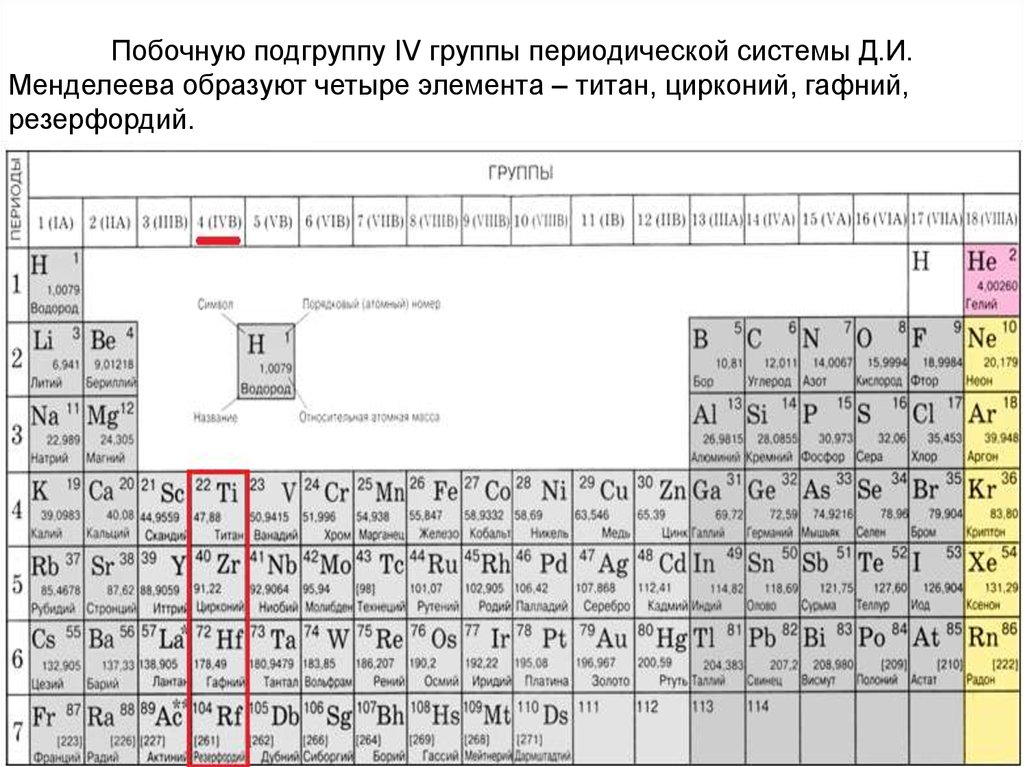
Тест по химии Характеристика химического элемента на основании положения в Периодической системе Д.И. Менделеева 9 класс
19.08.2018 Тесты по предметам Химия 9 класс
Тест по химии Характеристика химического элемента на основании положения в Периодической системе Д.И. Менделеева 9 класс с ответами. Тест содержит 2 части. В части 1 — 15 заданий базового уровня. В части 2 — 3 задания повышенного уровня.
Часть 1
1. В периодах слева направо заряд ядра атома
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала увеличивается, а затем уменьшается
2. В главных подгруппах снизу вверх заряд ядра атома
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала увеличивается, а затем уменьшается
3. В главных подгруппах сверху вниз число электронов на внешнем уровне
1) увеличивается
2) уменьшается
а) не изменяется
4) сначала увеличивается, а затем уменьшается
4. В периодах справа налево число энергетических уровней
В периодах справа налево число энергетических уровней
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала увеличивается, а затем уменьшается
5. В главных подгруппах снизу вверх восстановительные свойства элемента
1) усиливаются
2) ослабевают
3) не изменяются
4) сначала ослабевают, а затем усиливаются
6. В периодах слева направо восстановительные свойства элемента
1) усиливаются
2) ослабевают
3) не изменяются
4) сначала ослабевают, а затем усиливаются
7. В главных подгруппах сверху вниз окислительные свойства элемента
1) усиливаются
2) ослабевают
3) не изменяются
4) сна чала ослабевают, а за тем усиливаются
8.
1) усиливаются
2) ослабевают
3) не изменяются
4) сначала ослабевают, а затем усиливаются
9. В главных подгруппах сверху вниз высшая положительная степень окисления
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала увеличивается, а затем уменьшается
10. Оксид кальция СаО не реагирует с
Оксид кальция СаО не реагирует с
1) NaOH
2) HCl
3) СО2
4) H2O
11. Оксид cepы(IV) SO2не реагирует с
1) NaOH
4) H2O
3) СаО
4) HCl
12. Укажите вещество Х в генетическом ряду серы:
S → Х → H2SO3
1) Na2SO3
2) SO3
3) H2S
4) SO2
13. Укажите вещество Х в генетическом ряду кальция:
Са → Х → Са(ОН)2
1) СаО
2) CaCl2
3) СаСO3
4) Ca(NO3)2
14. Используя метод электронного баланса, определите сумму коэффициентов в уравнении реакции по схеме:
NH3 + O2 → N
1) 12
2) 13
3) 14
4) 15
15. Сожгли 335 г технической серы, содержащей 10% примесей. Определите объем (н.у.) образовавшегося оксида cepы(IV), если выход этого оксида составил 90% от теоретически возможного.
Определите объем (н.у.) образовавшегося оксида cepы(IV), если выход этого оксида составил 90% от теоретически возможного.
1) 170 л
2) 180 л
3) 190 л
4) 200 л
Часть 2
1. Расположите элементы в порядке возрастания их металлических свойств:
1) Са,
2) Ва,
3) Ве,
4) Sr.
Ответ дайте в виде последовательности цифр.
2. Расположите элементы в порядке возрастания их окислительной способности:
1) S,
2) Cl,
3) Р,
4) Sb.
Ответ дайте в виде последовательности цифр.
3. Ознакомьтесь в Интернете с тем, какие элементы Периодической системы элементов называют металлами, неметаллами, полуметаллами и инертными газами. Установите соответствие между элементом и его классификацией. Ответ дайте в виде последовательности цифр, соответствующей буквам по алфавиту.
Элемент
А) германий
Б) свинец
В) аргон
Г) селен
Классификация
1) металлы
2) неметаллы
3) полуметаллы
4) инертные газы
Ответы на тест по химии Характеристика химического элемента на основании положения в Периодической системе Д.
Часть 1
1-1
2-2
3-3
4-3
5-2
6-2
7-2
8-1
9-3
10-1
11-4
12-4
13-1
14-4
15-3
Часть 2
1-3142
2-4312
3-3142
Опубликовано: 19.08.2018 Обновлено: 19.08.2018
Поделиться
Найти:Периодический закон и периодическая система химических элементов Д. И. Менделеева
Химические элементы — законопослушные граждане! Они подчиняются Периодическому закону, о котором сейчас пойдет речь.
На этой странице вы узнаете:- Закономерности изменения химических свойств элементов и их соединений по периодам и группам в Периодической системе.
- Как связаны снеговик и радиус атома?
Формулировка периодического закона
В 1869 г. Д.И.Менделеев сформулировал периодический закон, современная формулировка которого звучит следующим образом:
Свойства химических элементов находятся в периодической зависимости от заряда ядра атомов химических элементов.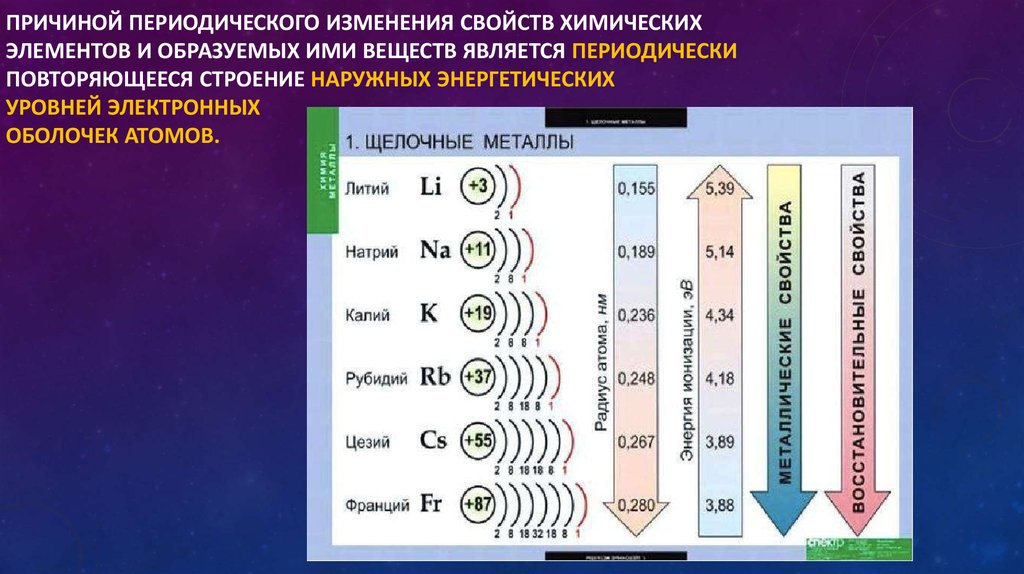
Давай разберем подробнее, как именно зависят свойства элемента от местонахождения в Периодической системе.
Закономерности изменения химических свойств элементов- Металлические/восстановительные свойства
Под металлическими свойствами подразумевают способность атомов отдавать электроны.
Можно провести воображаемую линию, которая начинается у атома бора и заканчивается у атома астата. Так вот, все элементы, которые попадут в левую область таблицы будут являться металлами, а элементы главных подгрупп, которые попадут в правую часть — неметаллами.
| Поэтому металлические/восстановительные свойства в периодах увеличиваются справа налево, а в группах — сверху вниз (т.е. при движении к францию). |
- Неметаллические/окислительные свойства
Здесь работает все с точностью наоборот: они будут увеличиваться слева направо в периодах, а в группах — снизу вверх (т. е. при движении к фтору).
е. при движении к фтору).
- Радиус атома
При движении по периоду увеличивается число электронов на соответствующем валентном уровне — электрончики начинают сильнее притягиваться к положительному ядру, тем самым «сжимая» размер радиуса. Т.е. радиус атома уменьшается слева направо при движении по периоду.
При движении по группе сверху вниз увеличивается число электронных оболочек, атом становится «толще», поэтому сверху вниз по группе радиус атома увеличивается.
| Как связаны снеговик и радиус атома? С увеличением номера периода количество электронных слоев растет, а значит, увеличивается и радиус атома; но так как к фтору увеличивается электроотрицательность, то электроны всё ближе и ближе «прижимаются» к ядру атома: атомный радиус уменьшается. Проще всего это представить в виде снеговика, у которого самая «маленькая» голова и самое «большое» туловище. Именно так увеличивается радиус ядра атома по группе. |
- Электроотрицательность
Это способность атомов оттягивать на себя электроны других атомов в химической связи. Электроотрицательность увеличивается при движении в периодической системе слева направо и снизу вверх. Самым электроотрицательным элементом является фтор, это нужно запомнить!
- Основные свойства высших оксидов/гидроксидов
Основные свойства зависят от металлических свойств и меняются точно так же — в периодах увеличиваются справа налево, а в группах — сверху вниз.
- Кислотные свойства высших оксидов/гидроксидов
Кислотные свойства зависят уже от неметаллических свойств и меняются соответствующим образом — увеличиваются слева направо в периодах, а в группах — снизу вверх.
- Высшая/низшая степень окисления
Чтобы определить высшую/низшую степень окисления элемента, необходимо смотреть на номер группы, в которой находится элемент: высшая степень окисления равна номеру группы со знаком «плюс» (+N).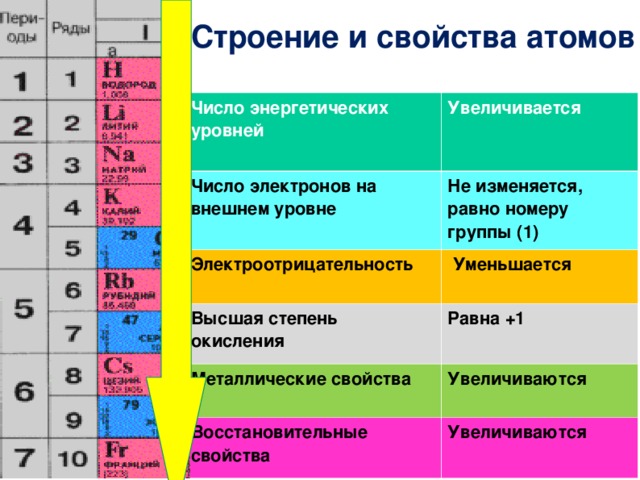 Низшая c.o. определяется, как разность номера группы и восьми:
Низшая c.o. определяется, как разность номера группы и восьми:
| Высшая с.o. = N Низшая с.o. = N – 8, где N — номер группы, в которой располагается элемент |
- Высшая/низшая валентность
Здесь используем следующие правила:
Высшая валентность = N
Низшая валентность = 8 — N
| Исключением является азот, у которого максимальная валентность равна IV |
Можно поинтересоваться, а почему так?
У азота есть только основное состояние атома, в котором три неспаренных электрона и неподеленная электронная пара. Возможность «рассорить» эту пару у азота попросту нет! Поэтому возможны следующие варианты:
- один неспаренный электрон = валентность I;
- два неспаренных электрона = валентность II;
- три неспаренных электрона = валентность III;
- три неспаренных электрона + неподеленная электронная пара = валентность IV.

Аналогичные исключения действует для кислорода и фтора, запоминаем их по аббревиатуре FON.
- Кислотные свойства водородных соединений
В группе кислотные свойства зависят от от радиуса атома — чем больше атом, с которым связан водород, тем легче последнему отщепляться от него, поэтому в группе кислотные свойства усиливаются сверху вниз.
В периоде кислотные свойства зависят от неметаллических свойств — они увеличиваются слева направо.
- Энергия ионизации
Это энергия, необходимая для отрыва одного электрона от нейтрального атома. В группах она увеличивается снизу вверх, в периодах — слева направо.
- Сродство к электрону
Это энергия, выделяющаяся при присоединении одного электрона к нейтральному атому. Она изменяется аналогично изменению энергии ионизации.
Фактчек- Таблица Менделеева состоит из «столбцов», т.
 е. групп и «строк», т.е. периодов;
е. групп и «строк», т.е. периодов; - Металлические свойства связаны со способностью отдавать электроны;
- Радиус атома увеличивается при увеличении числа электронных оболочек;
- Высшая валентность для большинства элементов равна номеру группы.
Задание 1.
Какова высшая валентность алюминия?
- I;
- II;
- III;
- IV.
Задание 2.
Водородное соединение какого элемента обладает наибольшими основными свойствами?
- Азот;
- Фосфор;
- Сурьма;
- Мышьяк.
Задание 3.
Из перечисленных элементов металлом является:
- Кремний;
- Франций;
- Радон;
- Астат.
Задание 4.
Гидроксид какого элемента проявляет основные свойства?
- Серы;
- Хлора;
- Рубидия;
- Фосфора.
Ответы: 1. — 3 ; 2. — 1; 3. — 2; 4. — 3.
— 1; 3. — 2; 4. — 3.
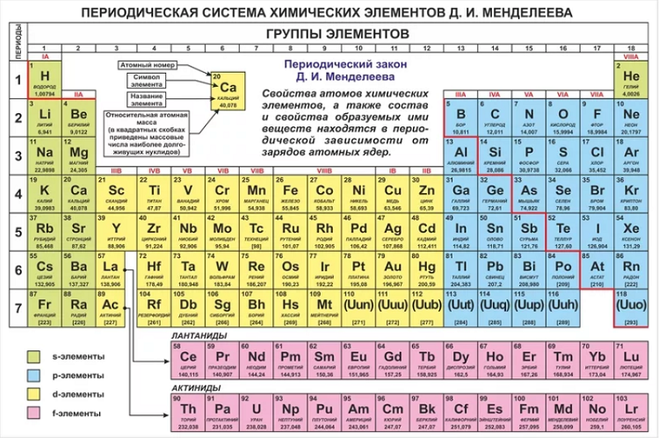
Как периодическая таблица группирует элементы
Когда вы совершаете покупку по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
В классической Периодической таблице химические элементы организованы в соответствии с количеством протонов, которые каждый из них имеет в своем атомном ядре. (Изображение предоставлено: Карл Тейт, автор Livescience.com) Сегодня, 150 лет спустя, химики официально признают 118 элементов (после добавления четырех новых элементов в 2016 году) и до сих пор используют периодическую таблицу элементов Менделеева для их организации.
В таблице семь строк и 18 столбцов. Каждая строка представляет один период; номер периода элемента указывает, на скольких его энергетических уровнях находятся электроны. Например, натрий находится в третьем периоде, что означает, что атом натрия обычно имеет электроны на первых трех энергетических уровнях. Двигаясь вниз по таблице, периоды длиннее, потому что для заполнения более крупных и сложных внешних уровней требуется больше электронов.
Столбцы таблицы представляют собой группы или семейства элементов. Элементы в группе часто выглядят и ведут себя одинаково, потому что у них одинаковое количество электронов в самой внешней оболочке — лице, которое они показывают миру. Например, элементы группы 18 в крайней правой части таблицы имеют полностью заполненные внешние оболочки и редко участвуют в химических реакциях.
Элементы обычно классифицируются как металлы или неметаллы, но граница между ними размыта. Металлические элементы обычно являются хорошими проводниками электричества и тепла. Подгруппы внутри металлов основаны на сходных характеристиках и химических свойствах этих коллекций. В нашем описании периодической таблицы используются общепринятые группы элементов, согласно данным Лос-Аламосской национальной лаборатории .
Периодическая таблица элементов разбита на несколько широких групп (Изображение предоставлено: Future)Группы Периодической таблицы
Щелочные металлы: Щелочные металлы составляют большую часть группы 1, первого столбца таблицы. Блестящие и достаточно мягкие, чтобы их можно было резать ножом, эти металлы начинаются с лития (Li) и заканчиваются францием (Fr). Они также чрезвычайно реактивны и могут загореться или даже взорваться при контакте с водой, поэтому химики хранят их в маслах или инертных газах. Водород с его единственным электроном тоже живет в группе 1, но газ считается неметаллом.
Щелочноземельные металлы: Щелочноземельные металлы составляют группу 2 периодической таблицы, от бериллия (Be) до радия (Ra). Каждый из этих элементов имеет два электрона на своем внешнем энергетическом уровне, что делает щелочные земли достаточно реактивными, поэтому они редко встречаются в природе поодиночке. Но они не такие реактивные, как щелочные металлы. Их химические реакции обычно протекают медленнее и выделяют меньше тепла по сравнению с щелочными металлами.
Лантаниды: Третья группа слишком длинная, чтобы поместиться в третий столбец, поэтому она разбивается и переворачивается, чтобы стать верхней строкой острова, плавающего в нижней части таблицы. Это лантаноиды, элементы с 57 по 71 — от лантана (La) до лютеция (Lu). Элементы этой группы имеют серебристо-белый цвет и тускнеют при контакте с воздухом.
Актиниды: Актиниды выстилают нижний ряд острова и включают элементы с 89, актиний (Ac), по 103, лоуренсий (Lr). Из этих элементов только торий (Th) и уран (U) встречаются в природе на Земле в значительных количествах. Все радиоактивны. Актиниды и лантаноиды вместе образуют группу, называемую внутренними переходными металлами.
Из этих элементов только торий (Th) и уран (U) встречаются в природе на Земле в значительных количествах. Все радиоактивны. Актиниды и лантаноиды вместе образуют группу, называемую внутренними переходными металлами.
Переходные металлы: Возвращаясь к основной части таблицы, оставшиеся группы с 3 по 12 представляют собой остальные переходные металлы. Твердые, но податливые, блестящие и обладающие хорошей проводимостью, эти элементы — это то, о чем вы обычно думаете, когда слышите слово «металл». Многие из величайших хитов мира металла, включая золото, серебро, железо и платину, живут здесь.
Постпереходные металлы: В преддверии прыжка в мир неметаллов общие характеристики не разделены четко по вертикальным групповым линиям. К постпереходным металлам относятся алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi), и они охватывают группы с 13 по 17. Эти элементы обладают некоторыми классическими характеристиками переходных металлов, но они, как правило, мягче и хуже проводят ток, чем другие переходные металлы.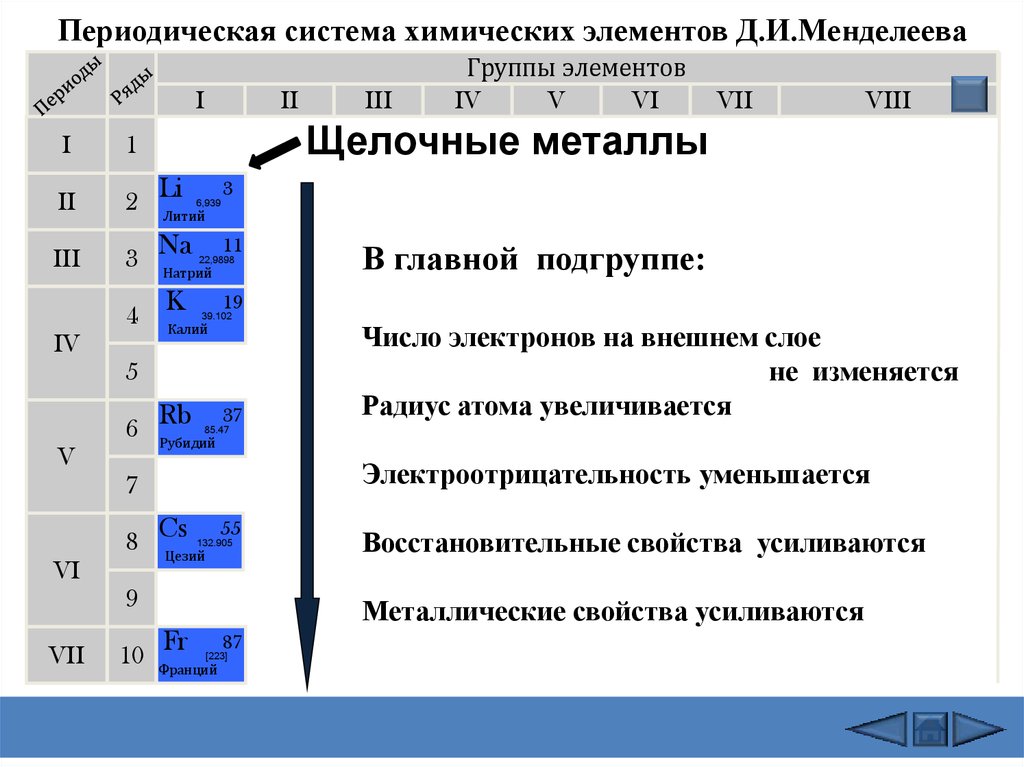 Во многих периодических таблицах есть жирная линия «лестницы» под диагональю, соединяющей бор с астатом. Постпереходные металлы сгруппированы в левом нижнем углу этой линии.
Во многих периодических таблицах есть жирная линия «лестницы» под диагональю, соединяющей бор с астатом. Постпереходные металлы сгруппированы в левом нижнем углу этой линии.
Металлоиды: К металлоидам относятся бор (B), кремний (Si), германий (Ge), мышьяк (As), сурьма (Sb), теллур (Te) и полоний (Po). Они образуют лестницу, которая представляет собой постепенный переход от металлов к неметаллам. Эти элементы иногда ведут себя как полупроводники (B, Si, Ge), а не как проводники. Металлоиды также называют «полуметаллами» или «бедными металлами».
Неметаллы: Все остальное вверху справа от лестницы — плюс водород (H), застрявший еще в Группе 1 — является неметаллом. К ним относятся углерод (C), азот (N), фосфор (P), кислород (O), сера (S) и селен (Se).
Галогены: Четыре верхних элемента группы 17, от фтора (F) до астата (At), представляют собой одно из двух подмножеств неметаллов. Галогены довольно химически активны и имеют тенденцию образовывать пары со щелочными металлами с образованием различных типов солей.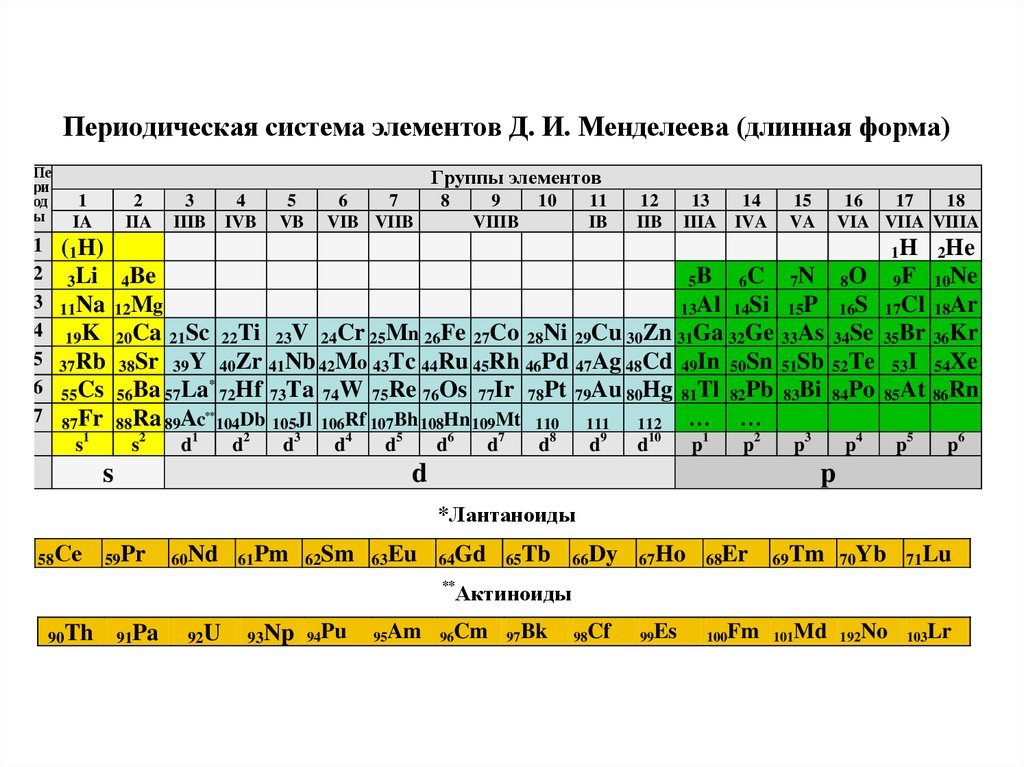 Поваренная соль на вашей кухне, например, представляет собой сочетание щелочного металла натрия и галогена хлора.
Поваренная соль на вашей кухне, например, представляет собой сочетание щелочного металла натрия и галогена хлора.
Благородные газы: Бесцветные, без запаха и почти полностью нереакционноспособные, инертные или благородные газы завершают таблицу в Группе 18. Многие химики ожидают, что оганесон (ранее обозначаемый как «унуноктий»), один из четырех недавно названных элементов, разделить эти характеристики; однако, поскольку период полураспада этого элемента измеряется миллисекундами, никто не смог проверить его напрямую. Оганесон завершает седьмой период таблицы Менделеева, так что если кому удастся синтезировать элемент 119(и гонка за это уже началась), он зациклится, чтобы начать восьмой ряд в столбце щелочных металлов.
Из-за циклического характера, создаваемого периодичностью, которая дала название таблице, некоторые химики предпочитают визуализировать таблицу Менделеева в виде круга.
Дополнительные ресурсы:
- Посмотрите это короткое видео о периодической таблице и группах элементов из Crash Course (откроется в новой вкладке).

- Пролистайте эту интерактивную периодическую таблицу элементов на ptable.com (откроется в новой вкладке).
- Ознакомьтесь с этим бесплатным образовательным онлайн-ресурсом для понимания групп элементов из CK-12 (откроется в новой вкладке).
Бен Биггс — увлеченный и опытный писатель в области науки и техники, автор опубликованных книг и редактор отмеченного наградами журнала How It Works. Он также много лет писал и редактировал материалы для изданий, посвященных технологиям и видеоиграм, позже стал редактором журнала All About Space, а затем журнала Real Crime.
Периодические тенденции — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 618
Периодические тренды — это определенные закономерности, присутствующие в периодической таблице, которые иллюстрируют различные аспекты определенного элемента, включая его размер и его электронные свойства.
Тенденции электроотрицательности
Электроотрицательность можно понимать как химическое свойство, описывающее способность атома притягивать и связывать электроны. Поскольку электроотрицательность является качественным свойством, стандартного метода расчета электроотрицательности не существует. Однако наиболее распространенной шкалой для количественной оценки электроотрицательности является шкала Полинга (таблица A2), названная в честь химика Линуса Полинга. Числа, присвоенные шкалой Полинга, безразмерны из-за качественного характера электроотрицательности. Значения электроотрицательности для каждого элемента можно найти в определенных периодических таблицах. Пример приведен ниже.
Числа, присвоенные шкалой Полинга, безразмерны из-за качественного характера электроотрицательности. Значения электроотрицательности для каждого элемента можно найти в определенных периодических таблицах. Пример приведен ниже.
Электроотрицательность измеряет тенденцию атома притягивать и образовывать связи с электронами. Это свойство существует благодаря электронной конфигурации атомов. Большинство атомов следуют правилу октета (имея валентную или внешнюю оболочку, состоящую из 8 электронов). Поскольку элементы в левой части периодической таблицы имеют менее чем наполовину заполненную валентную оболочку, энергия, необходимая для приобретения электронов, значительно выше по сравнению с энергией, необходимой для потери электронов. В результате элементы в левой части периодической таблицы обычно теряют электроны при образовании связей. И наоборот, элементы в правой части периодической таблицы более энергоэффективны в получении электронов для создания полной валентной оболочки из 8 электронов. Природа электроотрицательности эффективно описывается следующим образом: чем больше атом склонен приобретать электроны, тем больше вероятность того, что атом будет притягивать электроны к себе.
Природа электроотрицательности эффективно описывается следующим образом: чем больше атом склонен приобретать электроны, тем больше вероятность того, что атом будет притягивать электроны к себе.
- Слева направо по периоду элементов электроотрицательность увеличивается. Если валентная оболочка атома заполнена менее чем наполовину, для потери электрона требуется меньше энергии, чем для его приобретения. И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать его.
- Сверху вниз по группе электроотрицательность уменьшается. Это связано с тем, что атомный номер увеличивается вниз по группе, и, таким образом, увеличивается расстояние между валентными электронами и ядром или увеличивается атомный радиус.
- Важные исключения из вышеуказанных правил включают инертные газы, лантаноиды и актиноиды. Благородные газы обладают полной валентной оболочкой и обычно не притягивают электроны.
 Лантаниды и актиноиды обладают более сложным химическим составом, который обычно не следует каким-либо тенденциям. Следовательно, благородные газы, лантаноиды и актиноиды не имеют значений электроотрицательности.
Лантаниды и актиноиды обладают более сложным химическим составом, который обычно не следует каким-либо тенденциям. Следовательно, благородные газы, лантаноиды и актиноиды не имеют значений электроотрицательности. - Что касается переходных металлов, хотя они имеют значения электроотрицательности, между ними мало различий по периоду и вверх и вниз по группе. Это связано с тем, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.
В соответствии с этими двумя общими тенденциями наиболее электроотрицательным элементом является фтор с 3,98 единицами Полинга.
Рисунок \(\PageIndex{2}\): Периодическая таблица, показывающая тренд электроотрицательностиТенденции энергии ионизации
Энергия ионизации – это энергия, необходимая для отрыва электрона от нейтрального атома в его газовой фазе. Концептуально энергия ионизации противоположна электроотрицательности.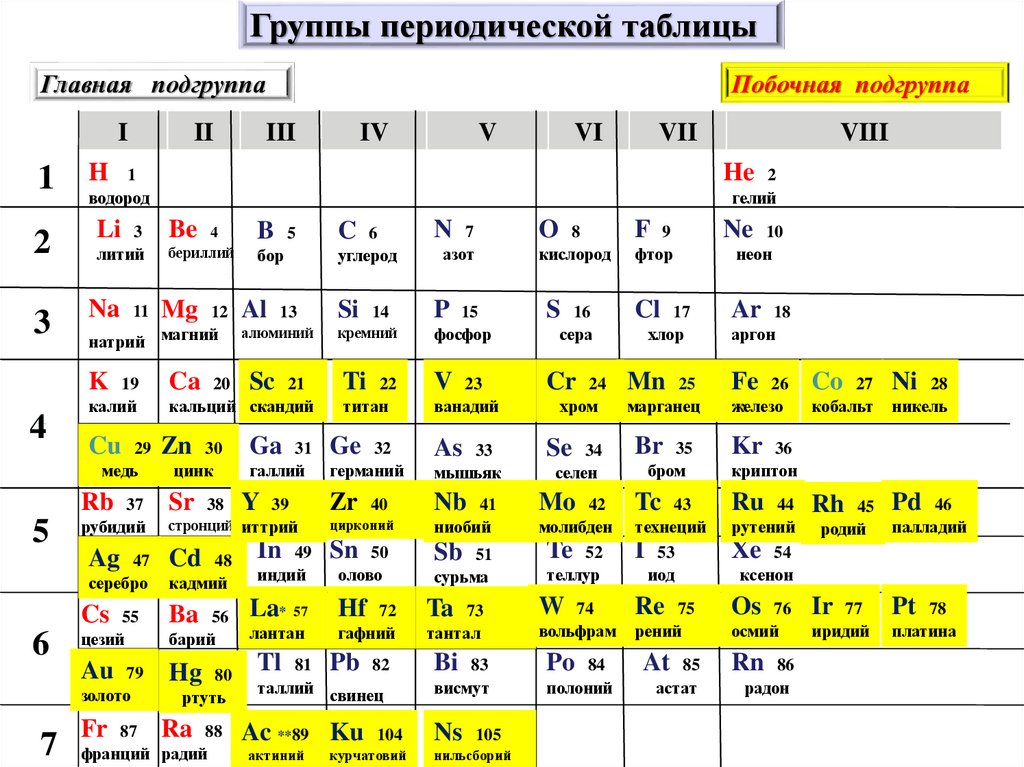 Чем ниже эта энергия, тем легче атом становится катионом. Следовательно, чем выше эта энергия, тем менее вероятно, что атом станет катионом. Как правило, элементы в правой части периодической таблицы имеют более высокую энергию ионизации, потому что их валентная оболочка почти заполнена. Элементы в левой части периодической таблицы имеют низкую энергию ионизации из-за их готовности терять электроны и становиться катионами. Таким образом, энергия ионизации увеличивается слева направо в таблице Менделеева.
Чем ниже эта энергия, тем легче атом становится катионом. Следовательно, чем выше эта энергия, тем менее вероятно, что атом станет катионом. Как правило, элементы в правой части периодической таблицы имеют более высокую энергию ионизации, потому что их валентная оболочка почти заполнена. Элементы в левой части периодической таблицы имеют низкую энергию ионизации из-за их готовности терять электроны и становиться катионами. Таким образом, энергия ионизации увеличивается слева направо в таблице Менделеева.
Другим фактором, влияющим на энергию ионизации, является экранирование электронов . Электронное экранирование описывает способность внутренних электронов атома экранировать его положительно заряженное ядро от его валентных электронов. При движении вправо от точки увеличивается число электронов и увеличивается сила экранирования. В результате электронам валентной оболочки легче ионизироваться, и, таким образом, энергия ионизации уменьшается вниз по группе.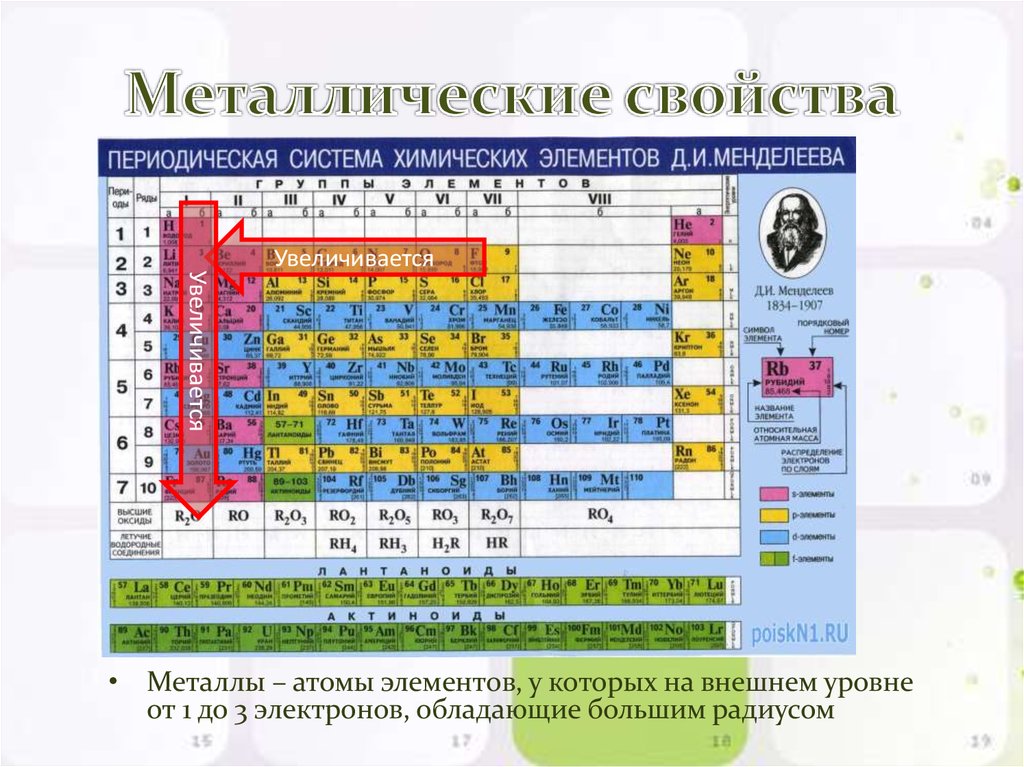 Электронное экранирование также известно как скрининг .
Электронное экранирование также известно как скрининг .
Тенденции
- Энергия ионизации элементов внутри периода обычно увеличивается слева направо. Это связано со стабильностью валентной оболочки.
- Энергия ионизации элементов внутри группы обычно уменьшается сверху вниз. Это происходит из-за электронного экранирования.
- Благородные газы обладают очень высокими энергиями ионизации из-за их полных валентных оболочек, как показано на графике. Обратите внимание, что у гелия самая высокая энергия ионизации среди всех элементов.
Некоторые элементы имеют несколько энергий ионизации; эти различные энергии называются первой энергией ионизации, второй энергией ионизации, третьей энергией ионизации и т. д. Первая энергия ионизации — это энергия, необходимая для удаления электрона с самой внешней или наивысшей энергией, вторая энергия ионизации — это энергия, необходимая для удалить любой последующий высокоэнергетический электрон из газообразного катиона и т. д. Ниже приведены химические уравнения, описывающие первую и вторую энергии ионизации: 9- \]
д. Ниже приведены химические уравнения, описывающие первую и вторую энергии ионизации: 9- \]
Как правило, любые последующие энергии ионизации (2-я, 3-я и т. д.) следуют той же периодической тенденции, что и первая энергия ионизации.
Рисунок \(\PageIndex{4}\): периодическая таблица, показывающая тренд энергии ионизацииЭнергия ионизации уменьшается по мере увеличения атомного радиуса. На это наблюдение влияют \(n\) (главное квантовое число) и \(Z_{eff}\) (основанное на атомном номере и показывающее, сколько протонов видно в атоме) на энергию ионизации (I). Связь задается следующим уравнением: 92} \]
- Через период \(Z_{eff}\) увеличивается на , а n (главное квантовое число) остается тем же самым , поэтому энергия ионизации увеличивается на .
- Вниз по группе \(n\) увеличивает и \(Z_{eff}\) немного увеличивает ; энергия ионизации уменьшается .
Тенденции сродства к электрону
Как следует из названия, сродство к электрону — это способность атома принимать электрон. В отличие от электроотрицательности, сродство к электрону является количественным измерением изменения энергии, которое происходит, когда электрон присоединяется к нейтральному атому газа. Чем отрицательнее значение сродства к электрону, тем выше сродство атома к электронам.
В отличие от электроотрицательности, сродство к электрону является количественным измерением изменения энергии, которое происходит, когда электрон присоединяется к нейтральному атому газа. Чем отрицательнее значение сродства к электрону, тем выше сродство атома к электронам.
Сродство к электрону обычно уменьшается вниз по группе элементов, потому что каждый атом больше, чем атом над ним (это тренд атомного радиуса, обсуждаемый ниже). Это означает, что добавленный электрон находится дальше от ядра атома по сравнению с его положением в меньшем атоме. При большем расстоянии между отрицательно заряженным электроном и положительно заряженным ядром сила притяжения относительно слабее. Следовательно, сродство к электрону уменьшается. Двигаясь слева направо по периоду, атомы становятся меньше по мере того, как силы притяжения становятся сильнее. Это заставляет электрон двигаться ближе к ядру, тем самым увеличивая сродство к электрону слева направо по периоду.
- Сродство к электрону увеличивается слева направо в пределах периода. Это связано с уменьшением атомного радиуса.
- Внутри группы сродство к электрону уменьшается сверху вниз. Это связано с увеличением атомного радиуса.
Тенденции атомного радиуса
Атомный радиус равен половине расстояния между ядрами двух атомов (точно так же, как радиус равен половине диаметра круга). Однако эта идея усложняется тем фактом, что не все атомы обычно связаны друг с другом одинаковым образом. Одни связаны ковалентными связями в молекулах, другие притягиваются друг к другу в ионных кристаллах, третьи удерживаются в металлических кристаллах. Тем не менее подавляющее большинство элементов могут образовывать ковалентные молекулы, в которых два одинаковых атома удерживаются вместе одной ковалентной связью. Ковалентные радиусы этих молекул часто называют атомными радиусами. Это расстояние измеряется в пикометрах. Модели атомного радиуса наблюдаются во всей периодической таблице.
Размер атома постепенно уменьшается слева направо по периоду элементов. Это связано с тем, что в пределах периода или семейства элементов все электроны добавляются к одной и той же оболочке. Однако в то же время к ядру добавляются протоны, что делает его более положительно заряженным. Эффект увеличения числа протонов больше, чем эффект увеличения числа электронов; следовательно, существует большее ядерное притяжение. Это означает, что ядро сильнее притягивает электроны, притягивая оболочку атома ближе к ядру. Валентные электроны удерживаются ближе к ядру атома. В результате атомный радиус уменьшается.
Рисунок \(\PageIndex{6}\): Периодическая таблица, показывающая тренд атомного радиуса D собственная группа, атомный радиус увеличивается. Валентные электроны занимают более высокие уровни из-за увеличения квантового числа (n). В результате валентные электроны удаляются от ядра по мере увеличения «n». Экранирование электронов предотвращает притяжение этих внешних электронов к ядру; таким образом, они удерживаются слабо, и результирующий атомный радиус велик.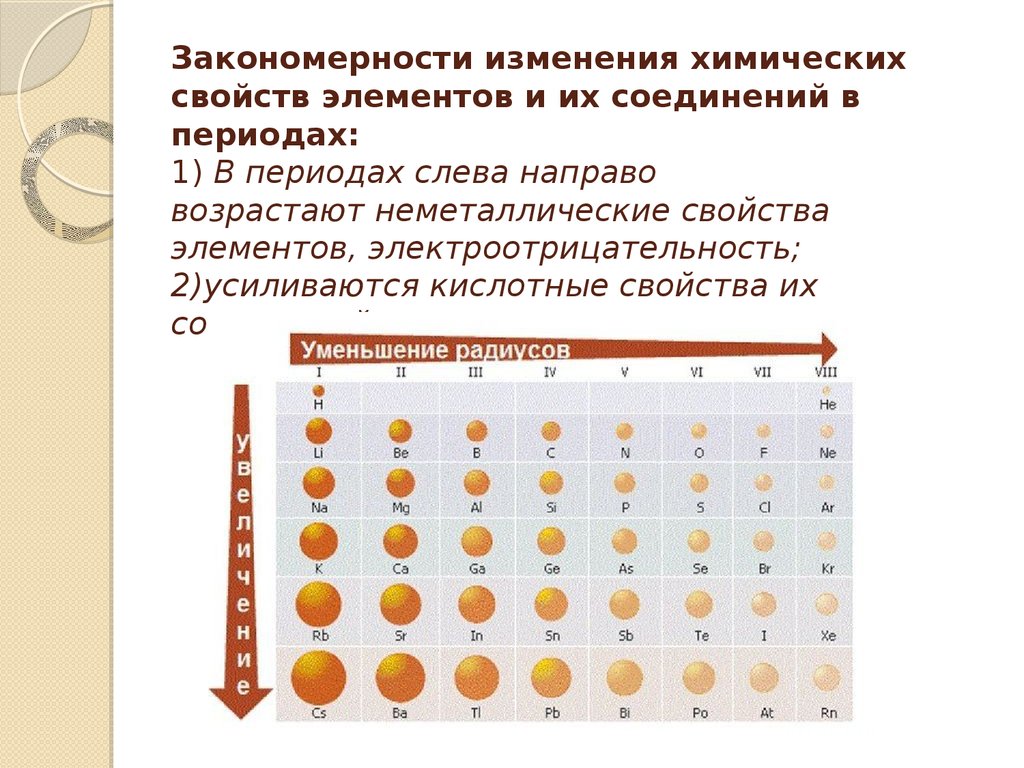
- Атомный радиус уменьшается на слева направо в течение периода. Это вызвано увеличением числа протонов и электронов за период. Один протон имеет больший эффект, чем один электрон; таким образом, электроны притягиваются к ядру, что приводит к меньшему радиусу.
- Атомный радиус увеличивается на сверху вниз внутри группы. Это происходит из-за электронного экранирования.
Тенденции изменения температуры плавления
Температура плавления — это количество энергии, необходимое для разрыва связи (связей) для превращения твердой фазы вещества в жидкость. Как правило, чем прочнее связь между атомами элемента, тем больше энергии требуется для разрыва этой связи. Поскольку температура прямо пропорциональна энергии, высокая энергия диссоциации связи коррелирует с высокой температурой. Точки плавления различны и обычно не образуют различимой тенденции в периодической таблице. Однако из рисунка \(\PageIndex{7}\) можно сделать определенные выводы.
- Металлы обычно имеют высокую температуру плавления .
- Большинство неметаллов имеют низкую температуру плавления .
- Неметалл углерод обладает самой высокой температурой плавления среди всех элементов . Полуметаллический бор также обладает высокой температурой плавления.
Тенденции металлического характера
Металлический характер элемента можно определить как легкость, с которой атом может потерять электрон. Справа налево по периоду металлический характер усиливается, потому что притяжение между валентным электроном и ядром слабее, что облегчает потерю электронов. Металлический характер усиливается по мере продвижения вниз по группе, потому что увеличивается размер атома. Когда размер атома увеличивается, внешние оболочки удаляются. Главное квантовое число увеличивается, а средняя электронная плотность перемещается дальше от ядра.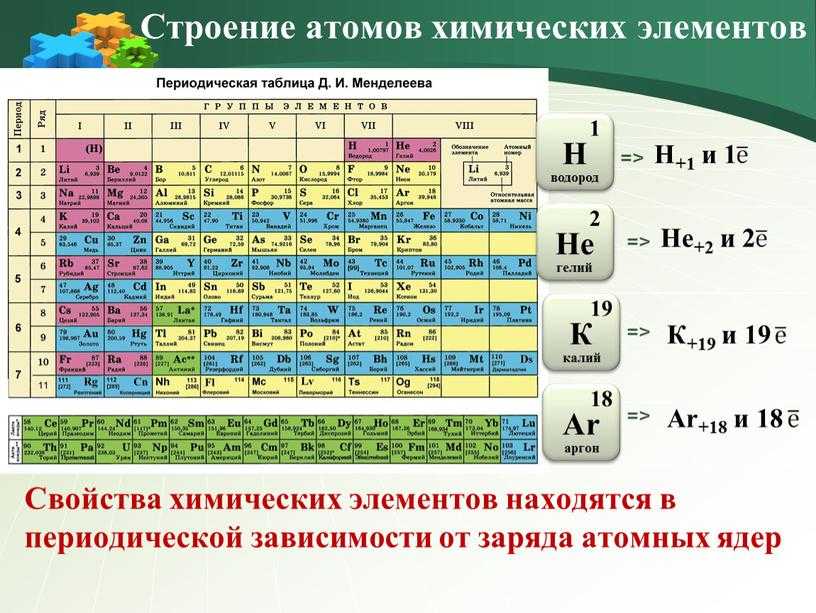 Электроны валентной оболочки имеют меньшее притяжение к ядру и, как следствие, могут легче терять электроны. Это вызывает усиление металлического характера.
Электроны валентной оболочки имеют меньшее притяжение к ядру и, как следствие, могут легче терять электроны. Это вызывает усиление металлического характера.
- Металлические характеристики уменьшаются слева направо по периоду. Это вызвано уменьшением радиуса (вызванным Z eff , как указано выше) атома, что позволяет внешним электронам легче ионизироваться.
- Металлические характеристики увеличиваются вниз по группе. Электронное экранирование вызывает увеличение атомного радиуса, поэтому внешние электроны ионизируются легче, чем электроны в более мелких атомах.
- Металлический характер относится к способности терять электроны, а неметаллический характер относится к способности приобретать электроны.
Еще один простой способ запомнить тенденцию металлического характера состоит в том, что при движении влево и вниз по направлению к нижнему левому углу периодической таблицы металлический характер увеличивается в направлении групп 1 и 2, или групп щелочных и щелочноземельных металлов . Точно так же, двигаясь вверх и вправо к правому верхнему углу таблицы Менделеева, металлический характер уменьшается, потому что вы проходите по правой стороне лестницы, которая указывает на неметаллов . К ним относятся Группа 8, благородные газы и другие распространенные газы, такие как кислород и азот.
Точно так же, двигаясь вверх и вправо к правому верхнему углу таблицы Менделеева, металлический характер уменьшается, потому что вы проходите по правой стороне лестницы, которая указывает на неметаллов . К ним относятся Группа 8, благородные газы и другие распространенные газы, такие как кислород и азот.
- Другими словами:
- Переместиться влево по периоду и вниз по группе: увеличить металлический характер (в сторону щелочных и щелочных металлов)
- Перемещение вправо по периоду и вверх по группе: уменьшение металлического характера (в направлении неметаллов, таких как благородные газы)
Задачи
Следующая серия задач проверяет общее понимание вышеупомянутого материала.
1. Основываясь на периодических трендах энергии ионизации, какой элемент имеет наибольшую энергию ионизации?
- Фтор (F)
- Азот (N)
- Гелий (Не)
2. ) Азот имеет больший атомный радиус, чем кислород.
) Азот имеет больший атомный радиус, чем кислород.
- А.) Правда
- Б.) Ложь
3.) Что имеет более металлический характер, свинец (Pb) или олово (Sn)?
4.) Какой элемент имеет более высокую температуру плавления: хлор (Cl) или бром (Br)?
5.) Какой элемент более электроотрицательный, сера (S) или селен (Se)?
6) Почему значение электроотрицательности большинства благородных газов равно нулю?
7) Расположите эти атомы в порядке убывания эффективного заряда ядра по валентным электронам: Si, Al, Mg, S
8) Перепишите следующий список в порядке убывания сродства к электрону: фтор (F), фосфор (P) , сера (S), бор (B).
9) Атом с атомным радиусом меньшим, чем у серы (S), это __________.
- А.) Кислород (О)
- Б.) Хлор (Cl)
- С.) Кальций (Ca)
- D.) Литий (Li)
- E.) Ничего из вышеперечисленного
10) Неметалл имеет меньший ионный радиус по сравнению с металлом того же периода.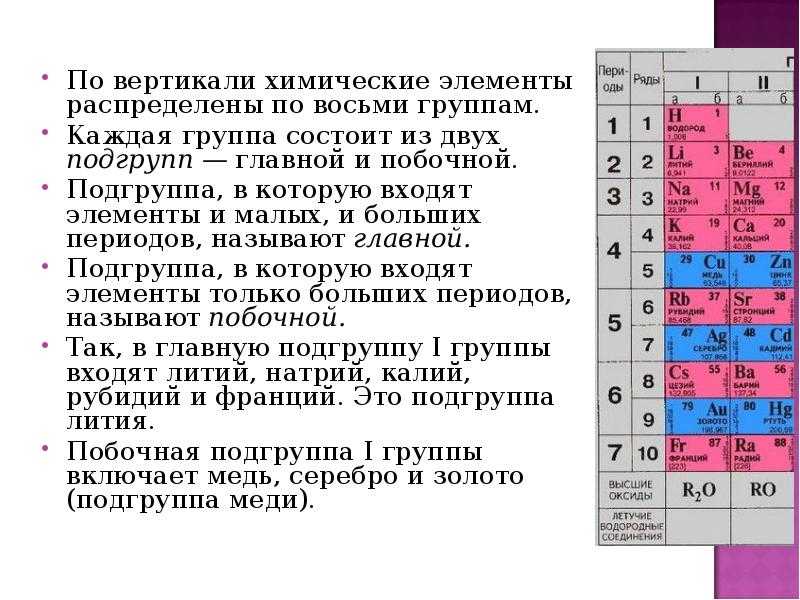
- А.) Верно Б.) Неверно
Решения
1. Ответ: C.) Гелий (He)
Пояснение: Гелий (He) имеет самую высокую энергию ионизации, потому что, как и другие благородные газы, валентная оболочка гелия заполнена. Следовательно, гелий стабилен и с трудом теряет или приобретает электроны.
2. Ответ: A.) Верно
Объяснение: Радиус атома увеличивается справа налево в периодической таблице. Следовательно, азот больше кислорода.
3. Ответ: Свинец (Pb)
Объяснение: Свинец и олово находятся в одном столбце. Металлический характер увеличивается вниз по столбцу. Свинец находится под оловом, поэтому свинец имеет более металлический характер.
4. Ответ: Бром (Br)
Пояснение: В неметаллах температура плавления увеличивается вниз по столбцу. Поскольку хлор и бром находятся в одной колонке, бром имеет более высокую температуру плавления.
5. Ответ: Сера (S)
Пояснение: Обратите внимание, что сера и селен находятся в одной колонке.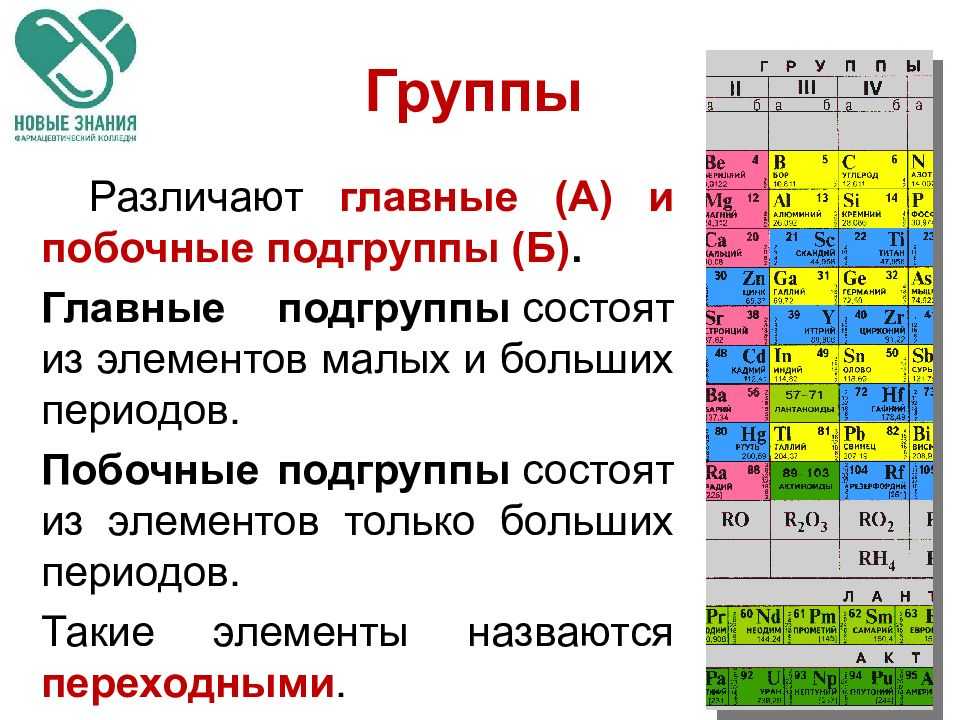 Электроотрицательность увеличивается вверх по столбцу. Это указывает на то, что сера более электроотрицательна, чем селен.
Электроотрицательность увеличивается вверх по столбцу. Это указывает на то, что сера более электроотрицательна, чем селен.
6. Ответ: Большинство благородных газов имеют полные валентные оболочки.
Пояснение: Из-за полной валентной электронной оболочки благородные газы чрезвычайно стабильны и не теряют и не приобретают электроны.
7. Ответ: S > Si > Al > Mg.
Пояснение: Электроны над закрытой оболочкой защищены закрытой оболочкой. S имеет 6 электронов над закрытой оболочкой, поэтому каждый чувствует притяжение 6 протонов в ядре.
8. Ответ: Фтор (F)>Сера (S)>Фосфор (P)>Бор (B)
Пояснение: Сродство к электрону обычно увеличивается слева направо и снизу вверх.
9. Ответ: C.) Кислород (O)
Объяснение: Периодические тренды показывают, что атомный радиус увеличивается вверх по группе и слева направо по периоду. Поэтому кислород имеет меньший атомный радиус серы.
10. Ответ: B.) Неверно
Объяснение: Причина этого заключается в том, что металл обычно теряет электрон, превращаясь в ион, а неметалл приобретает электрон.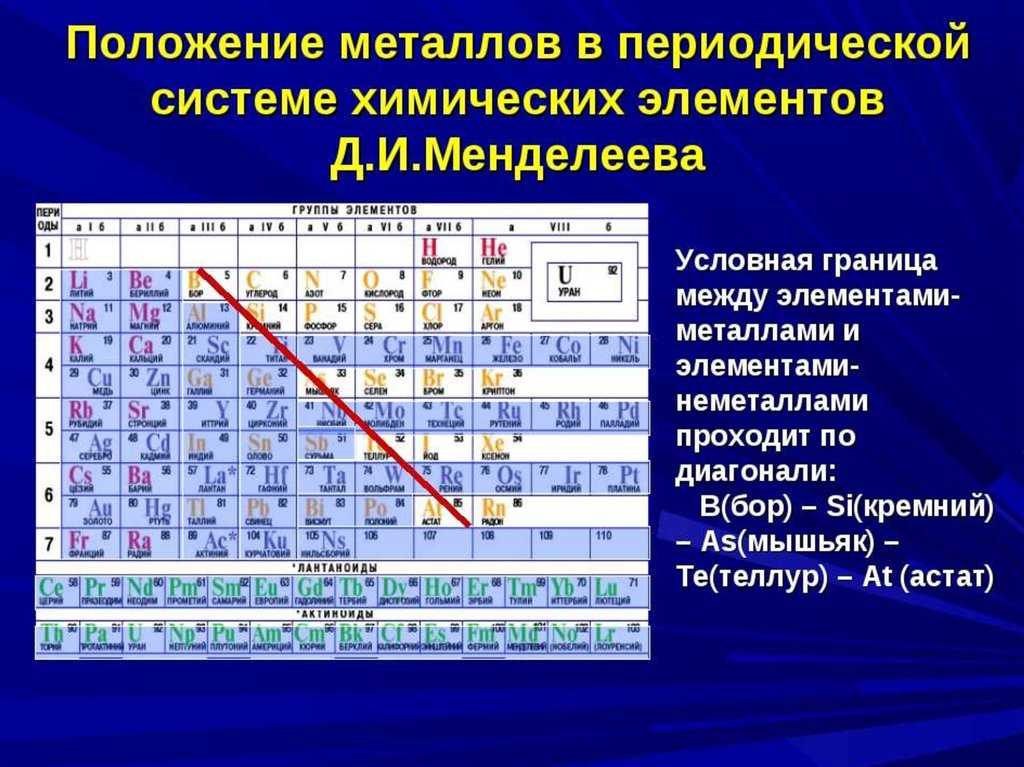 Это приводит к меньшему ионному радиусу для иона металла и большему ионному радиусу для иона неметалла.
Это приводит к меньшему ионному радиусу для иона металла и большему ионному радиусу для иона неметалла.
Ссылки
- Пинто, Габриэль. «Использование мячей различных видов спорта для моделирования изменения размеров атомов». J. Chem. Образовательный 1998 75 725.{cke_protected}{C}
- Куреши, Пушкин М.; Камунпури, С. Икбал М. «Сольватация ионов: проблема ионных радиусов». J. Chem. Образовательный 1991 , 68 , 109.
- Смит, Дерек В. «Энтальпии атомизации металлических элементарных веществ с использованием полуколичественной теории ионных твердых тел: простая модель для рационализации периодических тенденций». J. Chem. Образовательный 1993 , 70 , 368.
- Руссо, Стив и Майк Сильвер. Введение в химию. Сан-Франциско: Пирсон, 2007. .
- Петруччи, Ральф Х. и др. Общая химия: принципы и современные приложения. 9-е изд.


 е. групп и «строк», т.е. периодов;
е. групп и «строк», т.е. периодов;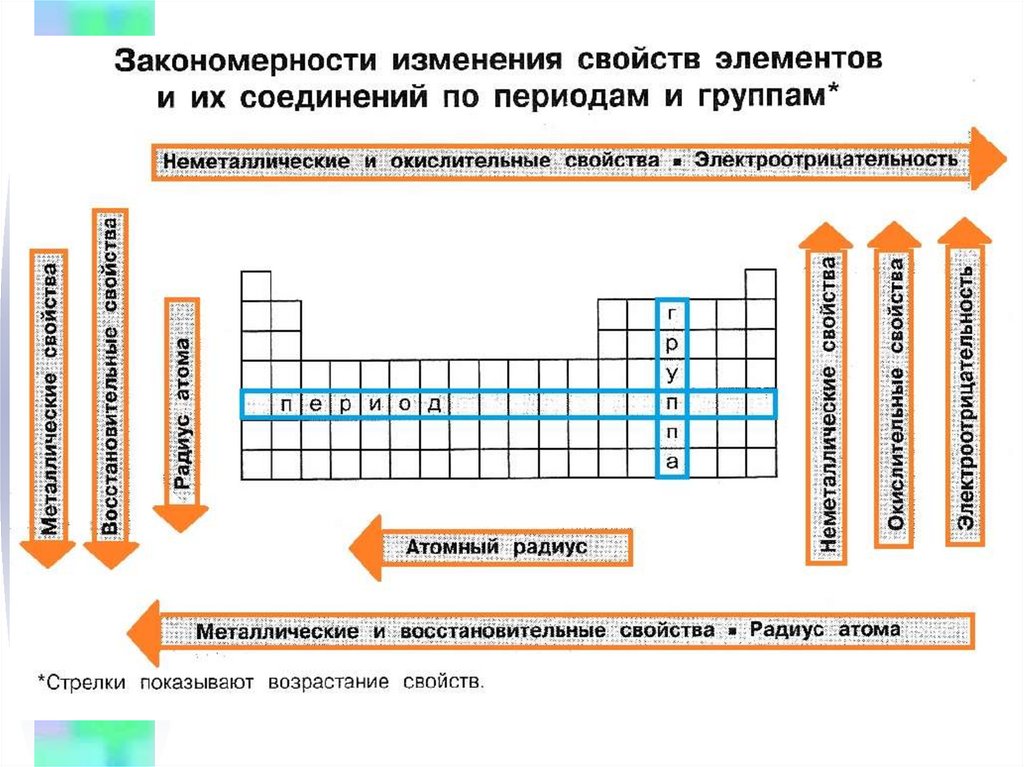
 Лантаниды и актиноиды обладают более сложным химическим составом, который обычно не следует каким-либо тенденциям. Следовательно, благородные газы, лантаноиды и актиноиды не имеют значений электроотрицательности.
Лантаниды и актиноиды обладают более сложным химическим составом, который обычно не следует каким-либо тенденциям. Следовательно, благородные газы, лантаноиды и актиноиды не имеют значений электроотрицательности.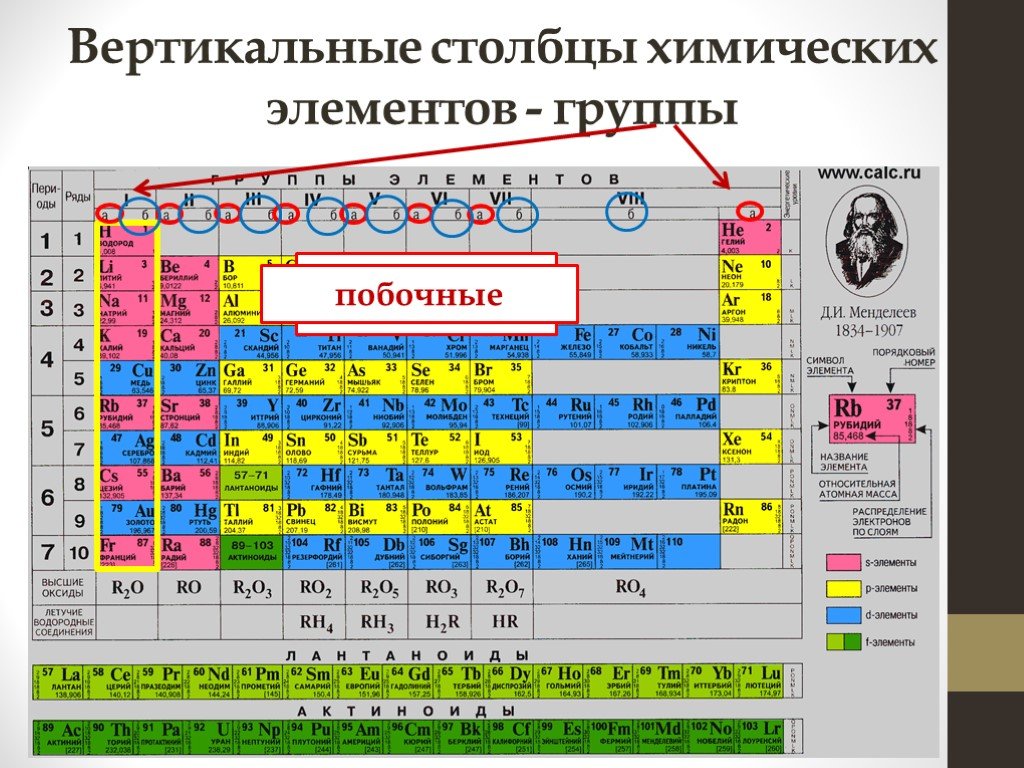
Leave A Comment