Химический состав
Химические свойства
Возможные степени окисления
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(Nh4)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11h21)23−, полученных в 1994 году.
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не
вступает в реакцию с водой и разбавленной соляной кислотой. Переводится враствор
кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
2Cu + h3O + CO2 + O2 à Cu2CO3(OH)2↓
Реагирует с концентрированной холодной серной кислотой:
Cu + h3SO1 àCuO + SO2 ↑ + h3O
С концентрированной горячей серной кислотой:
Cu + 2h3SO4 à CuSO4 + SO2 ↑ + 2h3O
- В электротехнике
- Теплообмен
- Для производства труб
- Сплавы
- Сплавы на основе меди
- Сплавы, в которых медь значима
- Ювелирные сплавы
- Соединения меди
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C:
0,01724-0,0180 мкОм·м), медь широко применяется в электротехнике для изготовления силовых и других
кабелей, проводов или других проводников, например, при печатном монтаже.
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известныерадиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные
трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во
внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и
холодильных агрегатах.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005, а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко
распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими
названиями для целого семейства материалов, в которые, помимо олова и цинка, могут входить никель,
висмут и другие металлы. Например, в состав пушечной бронзы, использовавшейся для изготовления
артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк;
рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на
изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой
пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др.
(а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически
чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют
механических свойств при термической обработке, и их механические свойства и износостойкость
определяются только химическим составом и его влиянием на структуру.
Например, в состав пушечной бронзы, использовавшейся для изготовления
артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк;
рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на
изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой
пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др.
(а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически
чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют
механических свойств при термической обработке, и их механические свойства и износостойкость
определяются только химическим составом и его влиянием на структуру.
Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой
для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных
гальванических элементов и батарей.
Медь. Серебро | ЕГЭ по химии
Все для самостоятельной подготовки к ЕГЭ
Зарегистрироваться
Русский язык Математика (профильная) Математика (базовая) Обществознание Физика История Биология Химия Английский язык Литература Информатика География
Задания Варианты Теория
Электронная конфигурация
Периодический закон
Степень окисления и валентность
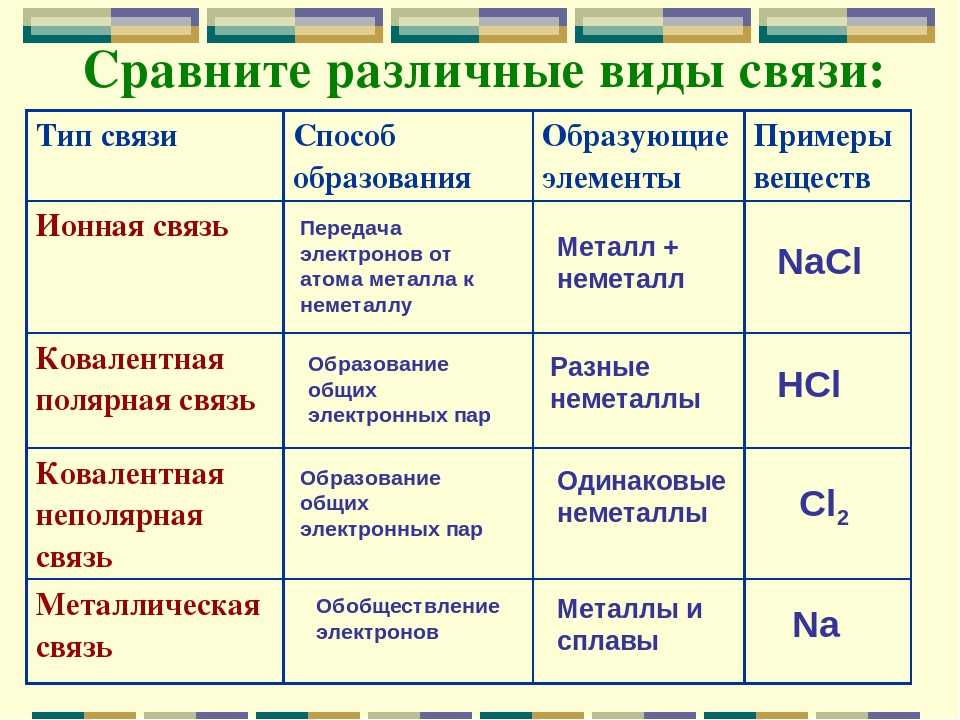
Химическая связь
Строение вещества
Классификация неорганических веществ
Типы химических реакций
Оксиды
Основания
Кислоты
Амфотерные гидроксиды
Электролитическая диссоциация.
 {–}=Cu(OH)_2↓; Cu(OH)_2 {→}↖{t°} CuO+H_2O$
{–}=Cu(OH)_2↓; Cu(OH)_2 {→}↖{t°} CuO+H_2O$Составим твой персональный план подготовки к ЕГЭ
Химия связи медь(I)–вода. Некоторые новые наблюдения
Джнан П. Наскар, и Шубхамой Чоудхури, и Майкл ГБ Дрю б и Дипанкар Датта* и
Принадлежности автора
* Соответствующие авторы
и Департамент неорганической химии, Индийская ассоциация развития науки, Калькутта, Индия
Электронная почта: icdd@mahendra.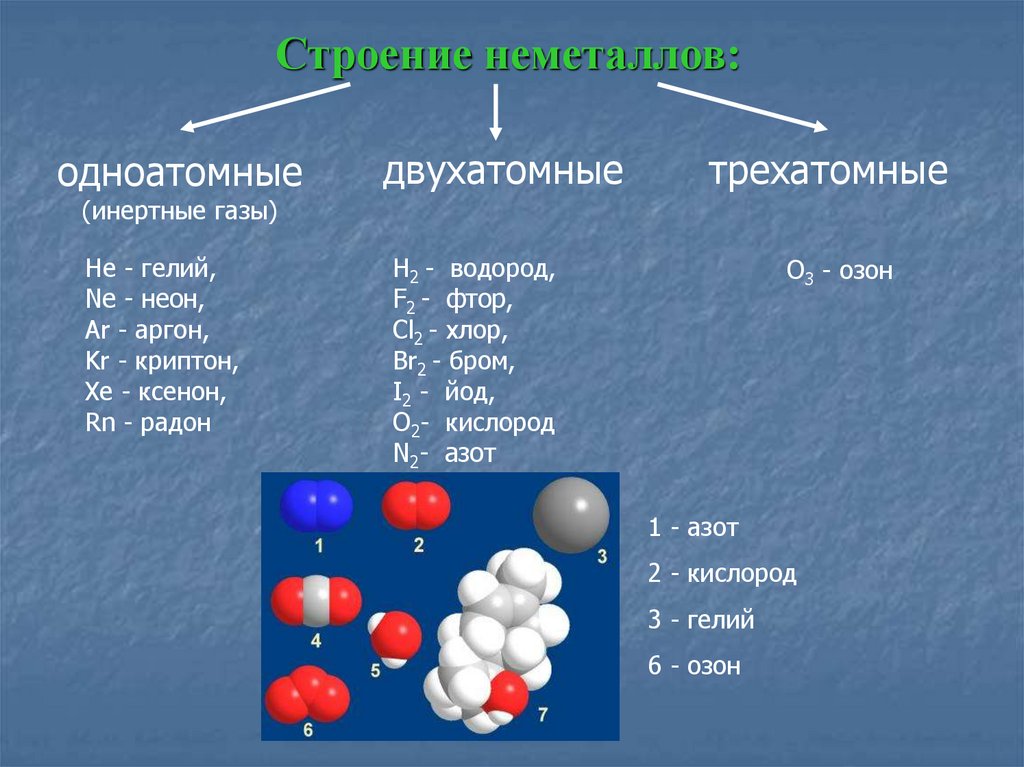 iacs.res.in
iacs.res.in
б Кафедра химии, Университет Рединга, Уайтнайтс, Рединг, Великобритания
Аннотация
One-dimensional polymeric copper( I ) complexes of the type {[CuL(H 2 O)]BF 4 ·H 2 O} n , где L = 2,3-дифенилхиноксалин, и {[CuL′(H 2 O)]X} n , где L′ = 2,3-диметилхиноксалин -6-9008 9003 X 9003 = CLO 4 — или BF 4 — , содержащий редкую медь ( I ) — водные связи были синтезированы. По рентгеноструктурным данным двух из них центры меди( I ) в этих комплексах имеют плоскую Т-образную координационную сферу N 2 O. Это следует из наблюдаемых длин связей Cu( I )–O(вода) [2,167(7)–2,307(14)
Å], что медь( I )–вода
связи в этих комплексах довольно слабые. С L также синтезирован мономерный комплекс типа CuL 2 ClO 4 . Но получить такой мономерный комплекс меди ( I ) с анионом BF 4 − или лигандом L’ не удалось. В CuL 2 ClO 4 металл также имеет, согласно рентгеновской кристаллической структуре, плоскую Т-образную форму N 2 Координационная сфера O с анионом перхлората, очень слабо связанным с металлом через атом кислорода [Cu( I )–O(перхлорат) = 2,442(8)
Å]. В то время как в электронных спектрах твердого тела CuL 2 ClO 4 показывает полосу при 346 нм, аквакомплексы показывают дополнительные полосы в диапазоне 400–480 нм.
По рентгеноструктурным данным двух из них центры меди( I ) в этих комплексах имеют плоскую Т-образную координационную сферу N 2 O. Это следует из наблюдаемых длин связей Cu( I )–O(вода) [2,167(7)–2,307(14)
Å], что медь( I )–вода
связи в этих комплексах довольно слабые. С L также синтезирован мономерный комплекс типа CuL 2 ClO 4 . Но получить такой мономерный комплекс меди ( I ) с анионом BF 4 − или лигандом L’ не удалось. В CuL 2 ClO 4 металл также имеет, согласно рентгеновской кристаллической структуре, плоскую Т-образную форму N 2 Координационная сфера O с анионом перхлората, очень слабо связанным с металлом через атом кислорода [Cu( I )–O(перхлорат) = 2,442(8)
Å]. В то время как в электронных спектрах твердого тела CuL 2 ClO 4 показывает полосу при 346 нм, аквакомплексы показывают дополнительные полосы в диапазоне 400–480 нм.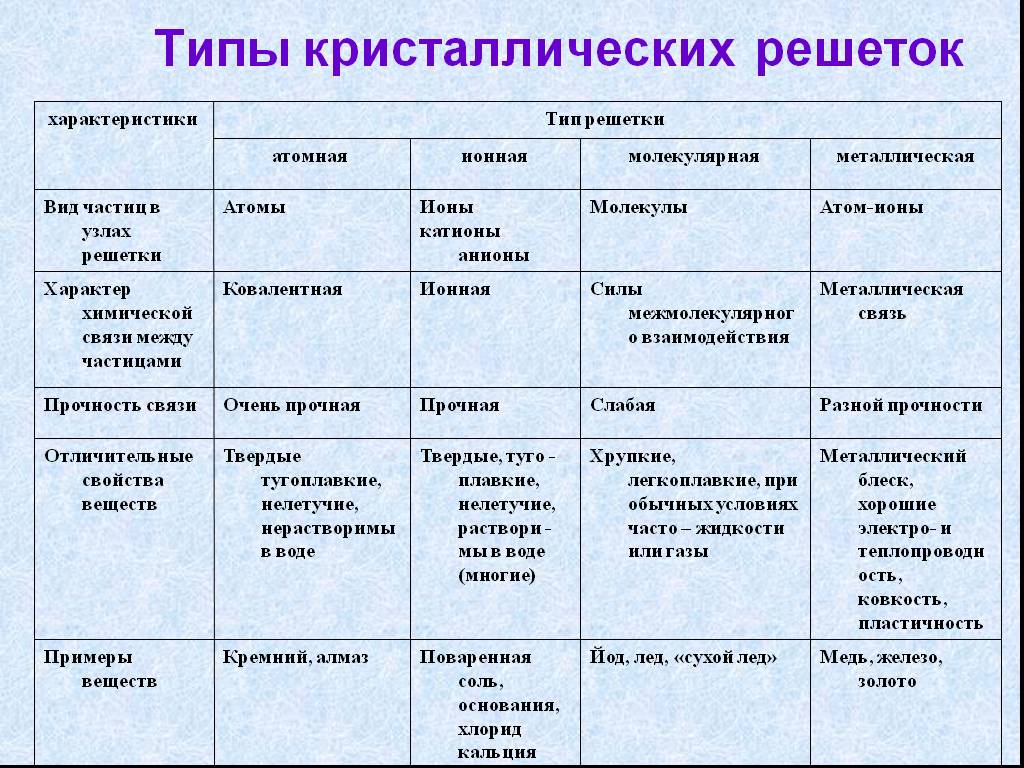 CuL 2 ClO 4 реагирует с водой в дихлорметане с образованием аквамеди( I ) комплекс: CuL 2 ClO 4 + H 2 O
→ [CuL 2 (H 2 O)]ClO 4 → 1/ n {[CuL(H 2 O)]ClO 4 } n + L В циклической вольтамперометрии на стеклоуглеродном электроде в безводном дихлорметане в атмосфере N 2 атмосфера, CuL 2 ClO 4 показывает квазиобратимую пару Cu II / I с очень высоким окислительно-восстановительным потенциалом 5 9004 0,91 В SCE, который снижен до 0,79 В против . SCE при добавлении воды.
CuL 2 ClO 4 реагирует с водой в дихлорметане с образованием аквамеди( I ) комплекс: CuL 2 ClO 4 + H 2 O
→ [CuL 2 (H 2 O)]ClO 4 → 1/ n {[CuL(H 2 O)]ClO 4 } n + L В циклической вольтамперометрии на стеклоуглеродном электроде в безводном дихлорметане в атмосфере N 2 атмосфера, CuL 2 ClO 4 показывает квазиобратимую пару Cu II / I с очень высоким окислительно-восстановительным потенциалом 5 9004 0,91 В SCE, который снижен до 0,79 В против . SCE при добавлении воды. Это указывает на то, что связывание воды дестабилизирует медь ( I ), результат, ожидаемый на основе принципа HSAB Пирсона.
Это указывает на то, что связывание воды дестабилизирует медь ( I ), результат, ожидаемый на основе принципа HSAB Пирсона.
WebElements Periodic Table » Медь » свойства соединений
29 Cu
Доступные свойства меди…
Энергия связи в газообразных двухатомных соединениях CuCu составляет 176,52 ± 2,38 кДж моль -1 .
Медь: энтальпии связи в газообразных двухатомных соединениях
Следующие значения относятся к нейтральным гетеродвухатомным молекулам в газовой фазе. Эти числа могут значительно отличаться, скажем, от энергий одинарной связи в твердом теле. Все значения даны в кДж моль -1 .
| CuH | CuHe | ||||||
| 277,8 | |||||||
| CuLi | куб | Куб | CuC | CuN | CuO | CuF | CuNe |
| 192,9 ±8,8 | 269,0 ±20,9 | 413,4 ±13 | |||||
| CuNa | CuMg | CuAl | CuSi | Медь | CuS | CuCl | CuAr |
| 176,1 ±16,7 | 227,1 ±9,8 | 221,3 ±6,3 | 276 | 382,8 ±4,6 | |||
| CuK | КуКа | CuGa | CuGe | CuAs | CuSe | CuBr | CuKr |
| 215,9±15,1 | 208,8 ±20,1 | 251 | 331 ±25 | ||||
| CuRb | CuSr | CuIn | CuSn | CuSb | CuTe | КуИ | CuXe |
| 187,4 ±7,9 | 169,5 ±6,7 | 278,7 | 197 ±21 | ||||
| CuCs | Куба | CuTl | CuPb | КуБи | МедьПолимер | CuAt | CuRn |
| CuFr | CuRa | ||||||

Примечания
Выражаю благодарность профессору Дж.А. Керру (Университет Бирмингема, Великобритания) за предоставление данных о силе связи двухатомных молекул.
Приведенные здесь значения даны при 298 К. Все значения указаны в кДж моль -1 . Как правило, эти данные были получены спектроскопическими или масс-спектрометрическими методами. Вы должны обратиться к ссылке 1 для получения дополнительной информации. Предупреждение: прочность, скажем, связи C-H в газообразных двухатомных соединениях CH (не изолируемых соединениях) не обязательно такая же, как прочность связи C-H, скажем, в метане.
Самой прочной связью для двухатомных соединений является окись углерода CO (1076,5 ± 0,4 кДж моль -1 ). Самая сильная связь для гомоядерных двухатомных соединений — это диазот, N 2 (945,33 ± 0,59 кДж моль -1 ).
Каталожные номера
- Дж.А. Керр в CRC Handbook of Chemistry and Physics 1999-2000: A Read-Reference Book of Chemical and Physical Data (CRC Handbook of Chemistry and Physics , DR Lide, (ed.
 ), CRC Press, Boca Raton, Florida, USA, 81-е издание, 2000 г.
), CRC Press, Boca Raton, Florida, USA, 81-е издание, 2000 г.
Медь: энергия решетки
Все значения энергии решетки указаны в кДж моль -1 .
| Соединение | Термохимический цикл / кДж моль -1 | Рассчитано / кДж моль -1 |
|---|---|---|
| CuF 2 | 3082 | 3046 |
| CuCl | 996 | 921 |
| CuCl 2 | 2811 | 2774 |
| CuBr | 979 | 879 |
| CuBr 2 | 2763 | 2711 |
| CuI | 966 | 835 |
| CuI 2 | (нет значения) | 2640 |
| CuH | 1254 | 828 |
| CuH 2 | (нет значения) | 2941 |
| Медь 2 О | (нет значения) | 3273 |
| CuO | 4050 | 4135 |
- Х.
 Д.Б. Дженкинс — личное общение. Я благодарен профессору Дону Дженкинсу (Университет Уорика, Великобритания), который предоставил данные об энергии решетки, адаптированные из его вклада, содержащегося в ссылке 2.
Д.Б. Дженкинс — личное общение. Я благодарен профессору Дону Дженкинсу (Университет Уорика, Великобритания), который предоставил данные об энергии решетки, адаптированные из его вклада, содержащегося в ссылке 2. - Х.Д.Б. Дженкинс в CRC Handbook of Chemistry and Physics 1999-2000: A Read-Reference Book of Chemical and Physical Data (CRC Handbook of Chemistry and Physics , DR Lide, (ed.), CRC Press, Boca Raton, Florida, USA, 79-е издание, 1998 г.
Стандартные редукционные потенциалы
Стандартные восстановительные потенциалы медиКаталожные номера
Приведенные здесь стандартные потенциалы восстановления для водных растворов адаптированы из публикации IUPAC, ссылка 1, с дополнительными данными и случайными поправками, включенными из многих других источников, в частности, ссылок 2-7.
- А.Дж. Бард, Р. Парсонс и Дж. Джордан, Стандартные потенциалы в водных растворах , ИЮПАК (Марсель Деккер), Нью-Йорк, США, 1985.
- Н.


 Выберите их, чтобы просмотреть визуальные представления периодичности энтальпий связи меди с выбранными вами элементами.
Выберите их, чтобы просмотреть визуальные представления периодичности энтальпий связи меди с выбранными вами элементами.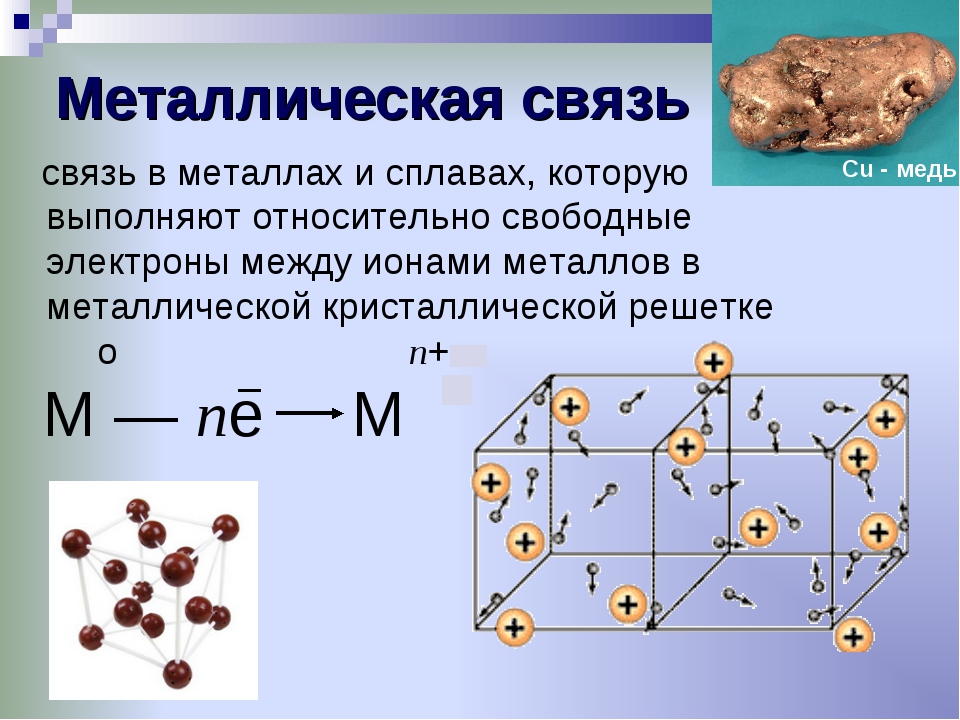 ), CRC Press, Boca Raton, Florida, USA, 81-е издание, 2000 г.
), CRC Press, Boca Raton, Florida, USA, 81-е издание, 2000 г. Д.Б. Дженкинс — личное общение. Я благодарен профессору Дону Дженкинсу (Университет Уорика, Великобритания), который предоставил данные об энергии решетки, адаптированные из его вклада, содержащегося в ссылке 2.
Д.Б. Дженкинс — личное общение. Я благодарен профессору Дону Дженкинсу (Университет Уорика, Великобритания), который предоставил данные об энергии решетки, адаптированные из его вклада, содержащегося в ссылке 2.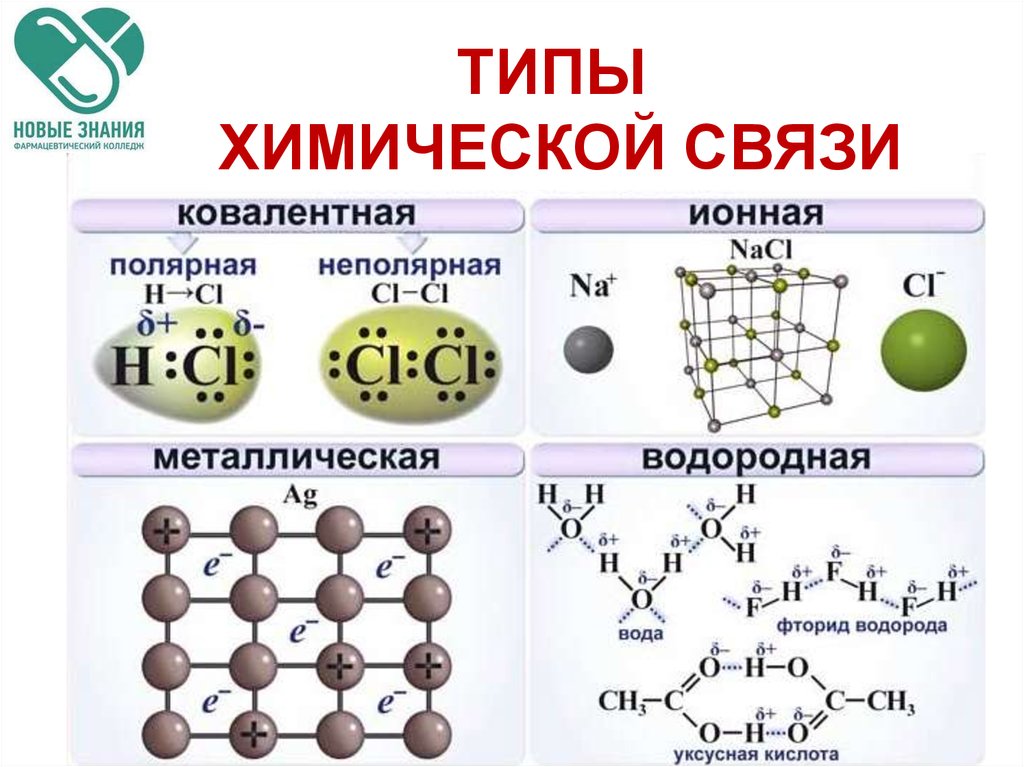
Leave A Comment