Составьте уравнения реакций пропилена и 3,3,3-трифтор-пропена-1 с бромоводородом. ГДЗ 11 класс химия Новошинский параграф № 36 задание 3
Составьте уравнения реакций пропилена и 3,3,3-трифтор-пропена-1 с бромоводородом. ГДЗ 11 класс химия Новошинский параграф № 36 задание 3 – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Всем привет! Подскажете:
Составьте уравнения реакций пропилена и 3,3,3-трифтор-пропена-1 с бромоводородом.
ответы
Могу ответить так:
По правилу Марковникова с пропиленом Br присоединится к среднему атому углерода, со вторым веществом — к конечному.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Юмор
Олимпиады
ЕГЭ
10 класс
похожие вопросы 5
Всем привет! Поделитесь ответом:
Для наркоза вместо применяемого ранее хлороформа СНС13, продукты разложения которого ядовиты, в (Подробнее…)
ГДЗНовошинский И.И.11 классХимия
Упр 1. Вариант 4.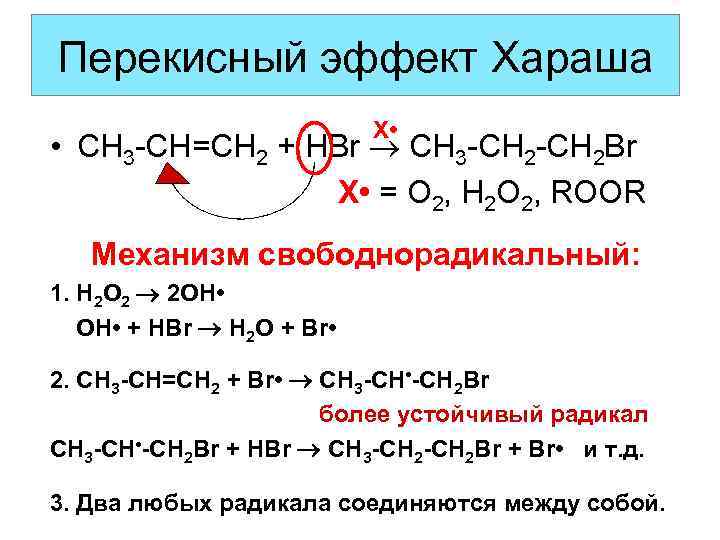 Работа 1. Тема 6 Спирты и фенолы. Химия. Дидактический материал. 10 класс. А.М. Радецкий ГДЗ
Работа 1. Тема 6 Спирты и фенолы. Химия. Дидактический материал. 10 класс. А.М. Радецкий ГДЗ
Помогите решить ребус и отгадать то это за вещества
Назовите вещества, формулы которых:
(Подробнее…)
ГДЗХимияРадецкий А.М.10 класс
ЕГЭ Математика 11 класс. Ященко И. В. Тренировочная работа 45 Вопрос 9 Решите уравнение.
Привет…Не могу справиться с ответом на такой вопрос…может кто поможет, а?
Решите уравнение В ответе запишите наибольший (Подробнее…)
ЕГЭМатематикаЯщенко И.В.Семенов А.В.11 класс
ЕГЭ Математика 11 класс. Ященко И. В. Тренировочная работа 45 Вопрос 10 Решите уравнение.
Привет пользователи! Окажите пожалуйста услугу…ответить помогите….
Решите уравнение В ответе запишите наибольший отрицательный (Подробнее…)
ЕГЭМатематикаЯщенко И.В.Семенов А.В.11 класс
Unit 1. № 78. ГДЗ Английский язык Enjoy English 7 класс Биболетова. Помогите ответить на вопросы по телефонным разговорам.
Помогите ответить на вопросы по телефонным разговорам.
Listen to two telephone conversations and answer the questions.
1. Who wanted to speak to Jim? (Подробнее…)
ГДЗАнглийский язык7 классБиболетова М. З.
Химия — 10
IV РАЗДЕЛ | ЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ |
Проверьте изученное
- Определите продукт реакции циклопропана с НВr.
A) 1-бромпропан
D) бромциклопропанB) 2-бромпропан
E) 1,3-дибромпропанC) 1,2-дибромпропан - Какие реакции не протекают?
A) 1,2 B) 3,4 C) 1,4 D) 2,3 E) 1,3 -
В данном направлении реакции присоединения циклоалканов с галогенами затрудняются, а реакции замещения протекают легче. Объясните причину этого.
Объясните причину этого. - Для бутена-1 и циклобутана являются различными:
- Агрегатное состояние при обычных условиях
- Обесцвечивание бромной воды
- Продукты гидрирования
- Число вторичных атомов углерода в молекуле
- Продукты горения
Определите число атомов углерода в молекуле циклоалкана.Вещество Масса воды, образованной
при полном сгорании 1 моля, гЦиклоалкан 108 - При постепенном пропускании 44,8 л (н.у.) смеси, состоящей из пропена и циклопропана, через бромную воду, взятую в избытке, масса раствора увеличивается на 8,4 г.
 Вычислите объёмную долю (%) циклопропана в первоначальной газовой смеси.
Вычислите объёмную долю (%) циклопропана в первоначальной газовой смеси.A) 50 B) 60 C) 80 D) 40 E) 90 Реакции присоединения Реакции замещения 1. циклопентан + водород
3. циклопропан + бромоводород2. циклогексан + бром
4. циклогексан + хлор
Бромоводород и аклены: эффект перекиси
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 25767
На этой странице вы найдете факты и простые лаконичные механизмы свободнорадикального присоединения бромистого водорода к алкенам, часто известного как «пероксидный эффект». Если вы хотите, чтобы механизмы были объяснены вам более подробно, внизу страницы есть ссылка.
Если вы хотите, чтобы механизмы были объяснены вам более подробно, внизу страницы есть ссылка.
Присоединение к симметричным алкенам
Симметричный алкен подобен этену, в котором группы на обоих концах двойной углерод-углеродной связи одинаковы. Реакция происходит при комнатной температуре в присутствии органических перекисей или некоторого количества кислорода воздуха. Алкены очень медленно реагируют с кислородом с образованием следов органических пероксидов, поэтому два возможных условия эквивалентны друг другу.
Реакция представляет собой простое добавление бромистого водорода. Например, с этеном:
С симметричным алкеном вы получаете точно такой же продукт в отсутствие органических перекисей или кислорода, но механизм другой.
Механизм
Галогеноводороды (хлороводород, бромоводород и остальные) обычно реагируют с алкенами по механизму электрофильного присоединения. Однако в присутствии органических пероксидов бромистый водород присоединяется по другому механизму.
| Примечание |
|---|
Если вам интересно, вы найдете механизм электрофильного присоединения бромистого водорода и других галогеноводородов к алкенам, если перейдете по этой ссылке. Возможно, вам придется изучить несколько страниц в этом разделе. |
При наличии органических пероксидов вы получаете
Инициирование цепи
Цепь инициируется свободными радикалами, образующимися при разрыве связи кислород-кислород в органических пероксидах.
Эти свободные радикалы извлекают атом водорода из молекулы бромистого водорода с образованием радикалов брома.
Распространение цепи
Бромный радикал присоединяется к этилену, используя один из электронов в пи-связи. Это создает новый радикал с одним электроном на другом атоме углерода.
Этот радикал реагирует с другой молекулой HBr с образованием бромэтана и другого радикала брома для продолжения процесса.
и т.д.
Обрыв цепи
В конце концов два свободных радикала сталкиваются друг с другом и производят какую-то молекулу. На этом процесс останавливается, потому что новые свободные радикалы не образуются.
Присоединение к несимметричным алкенам
Несимметричный алкен подобен пропилену, в котором группы на обоих концах двойной углерод-углеродной связи различны. водород и бром могут добавляться двумя разными способами. Способ добавления зависит от того, присутствуют ли органические перекиси (или кислород) или нет.
Обычно, когда молекула HX присоединяется к двойной связи углерод-углерод, водород присоединяется к углероду с уже имеющимся большим количеством атомов водорода. Это известно как правило Марковникова .
Поскольку присоединение HBr происходит «неправильным образом» в присутствии органических пероксидов, это часто называют пероксидным эффектом или антимарковниковым присоединением .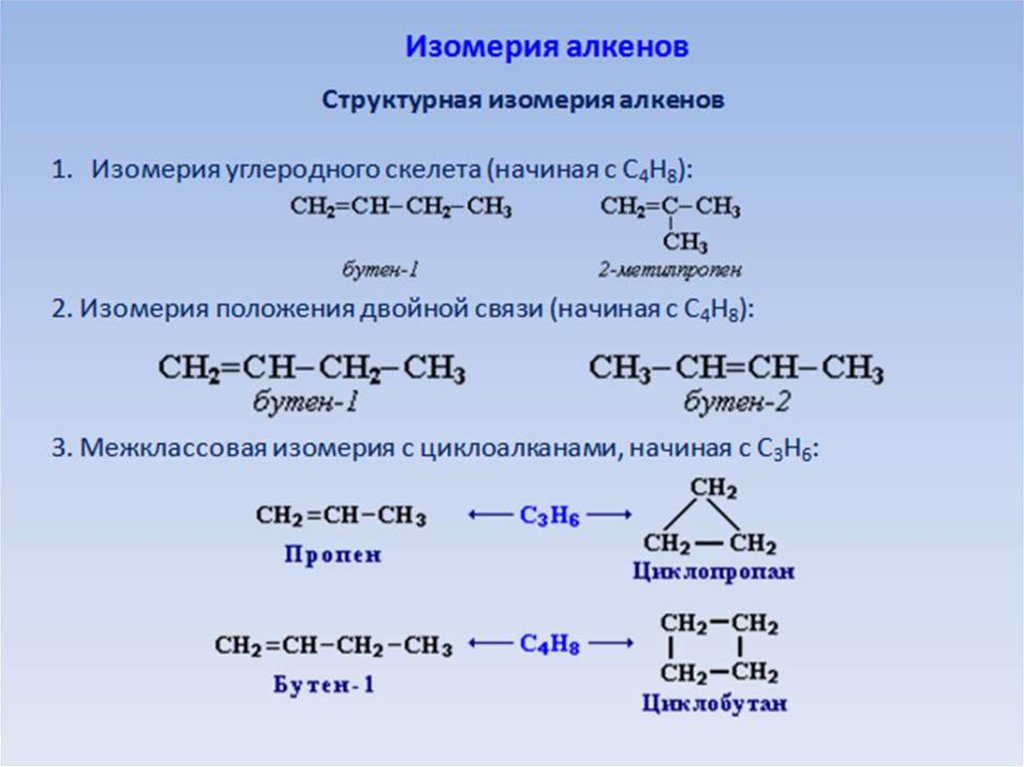
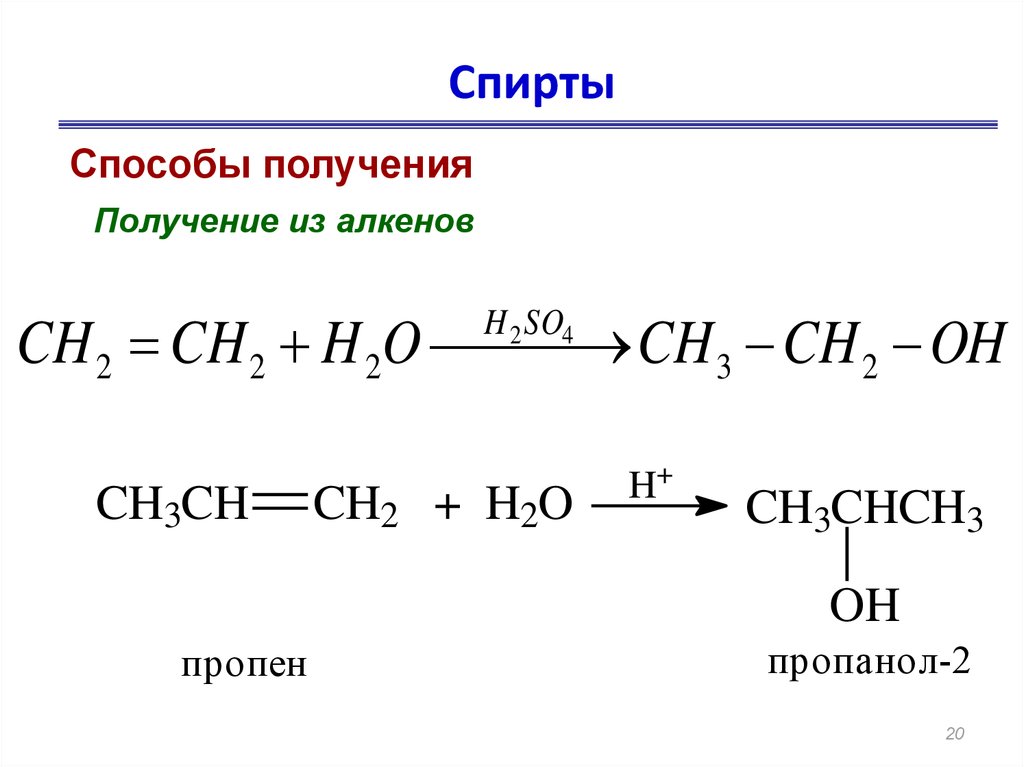
В отсутствие пероксидов бромистый водород присоединяется к пропилену по механизму электрофильного присоединения. Это дает произведение, предсказанное правилом Марковникова.
Свободнорадикальный механизм
Инициирование цепи
Точно такой же, как и в случае с этеном выше.
Распространение цепи
Когда радикал брома присоединяется к пропилену, он присоединяется, так что образуется вторичный радикал. Он более стабилен (и поэтому легче образуется), чем первичный радикал, который образовался бы, если бы он присоединился к другому атому углерода.
Этот радикал реагирует с другой молекулой HBr с образованием 1-бромпропана и другого радикала брома для продолжения процесса.
и т.д.
Обрыв цепи
В конце концов два свободных радикала сталкиваются друг с другом и производят какую-то молекулу. На этом процесс останавливается, потому что новые свободные радикалы не образуются.
Почему другие галогеноводороды не ведут себя так же
? Причина того, что бромистый водород присоединяется антимарковниковским образом в присутствии органических пероксидов, заключается просто в скорости реакции. Свободнорадикальный механизм намного быстрее, чем альтернативный механизм электрофильного присоединения. Оба механизма имеют место, но большая часть продукта относится к свободнорадикальному механизму, потому что он работает быстрее. С другими галогеноводородами все наоборот.
Свободнорадикальный механизм намного быстрее, чем альтернативный механизм электрофильного присоединения. Оба механизма имеют место, но большая часть продукта относится к свободнорадикальному механизму, потому что он работает быстрее. С другими галогеноводородами все наоборот.
- Фторид водорода : Связь водород-фтор настолько прочна, что радикалы фтора не образуются на стадии инициирования.
- Хлористый водород : С хлористым водородом вторая половина стадии распространения очень медленная. Если вы подсчитаете сумму энтальпии связи, вы обнаружите, что следующая реакция является эндотермической.
Это связано с относительно высокой прочностью связи водород-хлор.
- Йодоводород: В этом случае первая стадия стадии размножения оказывается эндотермической, что замедляет реакцию. При образовании слабой связи углерод-йод выделяется недостаточно энергии.
В случае бромистого водорода обе стадии стадии размножения являются экзотермическими.
Вопросы для проверки вашего понимания Вопросы по этому поводу вы найдете в Help! страницу (см. ниже). |
Авторы
Джим Кларк (Chemguide.co.uk)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Книга или блок
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Пропен с HBr
Пропен с HBr[email protected] Мы пытаемся помочь вам изучить химию онлайн.
Дом ВИДЕО Редакция ментальные карты
Электрофильное присоединение: пропен с Hbr (правило Марковникова)
Цели этого веб-сайта
Средняя химия Высшая химия
Периодическая таблица Элементы, соединения и смеси Атомы и связь Химические формулы и уравнения Относительные атомные и молекулярные массы Расчеты в химии Частота реакций Энергетика Неорганическая химия Органическая химия Кислоты, основания и соли Жесткая вода Электролиз Разное: вопросы и ответы
История Периодической таблицы Периодичность
Даты открытия элементов Доберейнер Ньюлендс Менделеев
Элементы Соединения Смеси
Имена Характеристики
Методы разделения смесей Магнит с Fe и S Фильтрация Центрифугирование Хроматография1 Простая перегонка Фракционная перегонка Фракция масла Делительная воронка Разделение сахара и соли
Хроматография2
Практическое видео
Атомная структура Ионная связь Ковалентная связь Металлическое соединение Вопросы и ответы
Электронная конфигурация
LiF NaF КФ MgF2 CaF2 AlF3
LiCl Li2O Li2S Li3N Li3P
NaCl Na2O Na2S Na3N Na3P
KCl К2О К2С К3Н К3П
MgCl2 MgO MgS Mg3N2 Mg3P2
CaCl2 СаО CaS Ca3N2 Ca3P2
AlCl3 Al2O3 Ал2С3 АлN АлП
Водород Фтор хлор Кислород Азот Хлористый водород Вода Сероводород Метан аммиак Углекислый газ Этен Простые ковалентные структуры Гигантские ковалентные структуры
метан йод СО2 Лед
графит Алмаз
Структура металла Податливый и пластичный Электрическая проводимость Нагрев металла
Балансировка химических формул Уравнения балансировки
Схема масс-спектрометра Относительная молекулярная масса Эмпирические формулы
Относительная атомная масса
RMM Excel Cruncher RMM: сульфат аммония РММ: карбонат кальция
Эмпирические формулы
Расчет реактивной массы Реагирование на решения Реагирующие газы Титрование Газовые законы и расчеты Вопросы и ответы
Синтез Реакция Реакция разложения Вода кристаллизации Термитная реакция Кислотно-карбонатная реакция Вулканическая реакция Прикладные вопросы Реагирующая масса и экономика атома Электронная таблица Преобразование молей в другие единицы измерения и из них
Вопросы и ответы
1 и 2 Введение 3 и 4 5 и 6 7 и 8 9 и 10 11 и 12 13 и 14 15 и 16
HCl и NaOH Ch4COOH и NaOH h3SO4 и Nh5OH Кривые титрования
Сильная кислота с сильной щелочью Сильная кислота со слабой щелочью Слабая кислота с сильной щелочью Слабая кислота со слабой щелочью
Экзаменационные вопросы Концентрация Температура Площадь поверхности Катализатор
Экзотермические реакции Эндотермические реакции
Металлы и их соединения Неметаллы и их соединения
Серия реактивности
Группа 1. Щелочные металлы
Группа 2. Щелочноземельные металлы
Алюминий
Цинк
Железо
Вести
Медь
Тесты для катионов
Вопросы и ответы
Щелочные металлы
Группа 2. Щелочноземельные металлы
Алюминий
Цинк
Железо
Вести
Медь
Тесты для катионов
Вопросы и ответы
Реакции металлов Реакция смещения Термическое разложение
Калий натрий Литий Кальций Магний с холодной водой Металлы с кислотой
Магний с паром
магний — медь цинк — медь железо-медь магний — медь Термит – Алюминий – Железо
Цикл карбоната кальция
С гидроксидом натрия С аммиаком
Получение водорода. Кислородная подготовка
Углекислый газ
Азот и аммиак
Сера, ее оксиды и серная кислота
Группа 7. Галогены и галогениды
Группа 8. Благородные газы
Вопросы и ответы
Кислородная подготовка
Углекислый газ
Азот и аммиак
Сера, ее оксиды и серная кислота
Группа 7. Галогены и галогениды
Группа 8. Благородные газы
Вопросы и ответы
Свойства сухого льда
Оксиды серы
С нитратом серебра С AgNO3 и Nh4 Реакции смещения Подготовка хлора Подготовка HCl
Введение Углеводороды. Спирт этиловый Этановая кислота Эфиры. Этилэтаноат Конденсационные полимеры Органические оценки Вопросы и ответы Вопросы и Ответы
Что такое гомологичный ряд Фракционная перегонка нефти Крекинг углеводородов
Алканы Алкены
Структуры формул имен Горение Расширенный – метан и хлор
Тест на бромную воду
Кислоты, основания и соли
Временная жесткость Постоянная твердость Удаление жесткости Преимущества недостатки Вопросы и ответы
Стиральная сода Ионный обмен Простая дистилляция
Расплавленные соли Растворы солей Промышленные приложения Материаловедение
Бромид свинца (II) хлорид лития
Бромид свинца (II): видео
Хлорид лития: видео
Вода (с серной кислотой) Рассол — концентрированный хлорид натрия Сульфат меди (II)
Вода (с серной кислотой): Видео
Рассол – концентрированный хлорид натрия – видео
Сульфат меди (II): видео
Камера Зала Эруля Рафинирование блистерной меди
Старое видео
Определение терминов Композитные материалы Керамика
Атомная теория Склеивание и структуры Формы молекул (теория ВСЕПР) Межмолекулярные силы Физическая химия Неорганическая химия Органическая химия Гомологическая серия Окислительно-восстановительная химия Аналитическая химия Электрохимия: цинк/медь Химия окружающей среды
Принцип наращивания (Aufbau) Спектр излучения водорода Спектры пламени Энергия в фотоне света Вопросы и ответы Энергия ионизации
Вопросы и ответы
Тенденции в 1-й энергии ионизации Последовательные энергии ионизации
Ионная связь Ковалентная связь Металлическое соединение
Ионные структуры
Ковалентные структуры
Простой ковалентный Гигантский ковалентный
силы Ван-дер-Ваальса Диполь – дипольные связи Водородные связи Простые ковалентные вещества Гигантские ковалентные вещества
Силы Ван-дер-Ваальса: молекулы воды
Диполь-дипольные связи в воде
Водородные связи: жидкая вода Водородные связи: лед Водородные связи: этанол Водородные связи: Этановая кислота Водородные связи: карбонилы и вода
Метан Углекислый газ Сера Йод Азот Жидкая вода Вода как лед Воздух
Сравнение структур CO2 и SiO2
графит Алмаз Кварц (кремнезем)
родинки Кинетика равновесия Термодинамика
Формулы и уравнения Расчет реактивной массы Титрование
Часть 1 Часть 2 Часть 3
Титрования 1 Титрования 2 Титрования 3 Титрования 4
Теория столкновений Распределение Максвелла-Больцмана Влияние температуры Влияние концентрации Влияние площади поверхности Влияние катализатора Расчеты
Выражение скорости Методы мониторинга ставок Нахождение начальной ставки Уравнение скорости Прикладные вопросы
Качественные эффекты Количественные эффекты
Равновесия разделов
Общие химические равновесия
Кислотно-основное равновесие
Буферы: качественные аспекты.
Поиск Kc. Ку. 1 из 3 Поиск Kc. Ку. 2 из 3 Поиск Kc. Ку. 3 из 3 Нахождение Кр. Ку. 1 из 2 Нахождение Кр. Ку. 2 из 2
рН сильной кислоты pH слабых кислот: использование Ka Кислотно-основные теории: основные принципы.
pH слабой кислоты: расчеты, продолжение
Кислотно-основные теории: вопросы и ответы
Буферы: стратегии для выполнения расчетов. Буферы: вопросы и ответы.
термины и определения Калориметрия Циклы Гесса Бонд Энергия Энергия решетки Энтропия Свободная энергия
MASH-реакция реакция НЕЙТРАЛИЗАЦИИ СМЕЩЕНИЕ реакция ГОРЕНИЕ реакция
Нахождение энтальпии образования Нахождение энтальпии сгорания Использование метода формулы Вопросы и ответы по энергетике
Bond Energy: видео
Циклы Рода Габера Энтальпия раствора
Хлорид натрия Хлорид рубидия Кальций фторид Оксид магния Оксид алюминия Гидрид натрия Вопросы и ответы: структурированный Вопросы и ответы: краткий ответ
Общие моменты термины и определения KCl NaCl Объяснение тенденций в группе 2
Группа 2.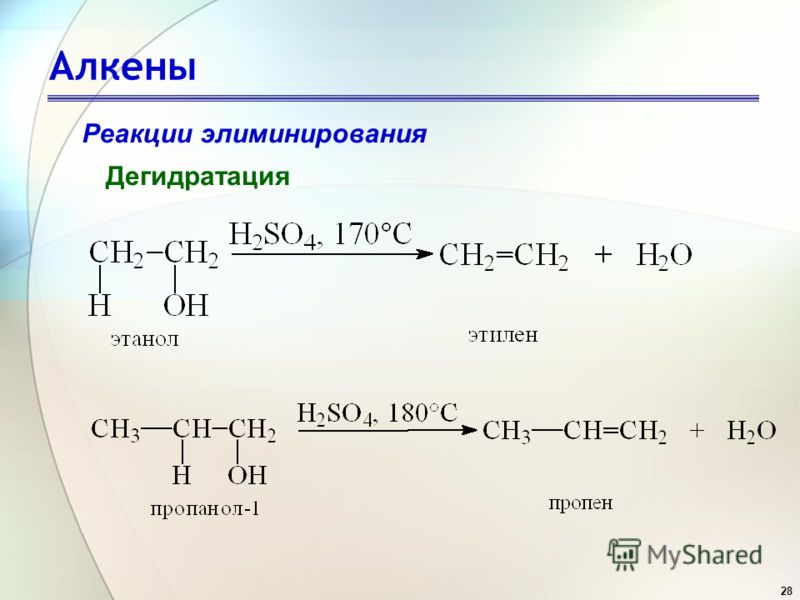 Щелочноземельные металлы
Группа 7. Галогены
Переходные металлы
Комплексы
Комплексы-Другое
Щелочноземельные металлы
Группа 7. Галогены
Переходные металлы
Комплексы
Комплексы-Другое
Галогены: вопросы и ответы
Вопросы и ответы, часть 1 Вопросы и ответы, часть 2 Вопросы и ответы, часть 3
конфигурация и мп тренд происхождение цвета Катализ
определения терминов номенклатура химические свойства окислительно-восстановительные принципы Окислительно-восстановительная химия ванадия Восстановление хрома (III) Равновесие хромат-дихромат Химия хрома (III) Железо (II) и (III) с сильными и слабыми основаниями Химия комплексов кобальта Сульфат меди (II) с NaOH и Nh4 Обратимая замена лиганда на CuCl2
Кристаллы хромовых квасцов, растущие под микроскопом Изготовление кристаллов хромовых квасцов Комплексные ионы: добавление Nh5OH к нитрату хрома (III) Добавление ионов хлорида к водному раствору хлорида кобальта Добавление ионов хлорида к водному сульфату меди (II) Комплексные ионы: добавление NaOH к нитрату хрома (III) Комплексные ионы: обратимая замена лиганда CuCl2 Комплексные ионы: осаждение и окисление гидроксида марганца (II) Комплексные ионы: комплексы хрома Комплексные ионы: комплексы кобальта
Алифатическая химия Ароматическая химия Конденсационные полимеры Органический синтез Органический анализ Практические методы Механизмы реакции
Органические вещества из нефти и угля Цепная изомерия Геометрическая изомерия Оптическая стереоизомерия Алканы Алкены Спирты Алкилгалогениды Альдегиды и кетоны Карбоновые кислоты и производные Сложные эфиры, жиры и масла Амины Нитрилы Пересмотр карбонилов и карбоновых кислот Органические вопросы и ответы
Фракционная перегонка Фракционирование нефти Крекинг парафин
Полное и неполное сгорание
Свободнорадикальное замещение
Органические: межмолекулярные силы
Сигма- и пи-облигации
Номенклатура. Горение
Метан + хлор
Горение
Метан + хлор
Номеклатура, трехмерные структуры и изомеры Тест с бромной водой Электрофильное присоединение — Этен + HBr Электрофильное присоединение — Этен + Бром Электрофильное присоединение — пропен + HBr Дополнительные полимеры HDPE Сигма- и пи-облигации Сигма- и пи-облигации
Реакция с бромом
Механизм: Этен + HBr
Номенклатура, изомерия и п.н. Первичный, вторичный и третичный Спирты от брожения Спирты от гидратации этена Сравнение реакций пропан-1-ола и -2-ола Реакция с PCl5 Реакция с натрием Реакция с SOCl2
Скорость гидролиза хлор-, бром- и йодалканов Подготовить и очистить (основной) Подготовка и очистка (третичный уровень)
Тест с 2,4-ДНП изомеры C6h22O Физические свойства Подготовка Нуклеофильная добавка Реагент Брейди (ДНП) Редукция с Lithal Различать карбонилы Йодоформный тест 2,4-ДНП Реагент Брейди 2,4-ДНП Реагент Брейди
эфиры Номенклатура Физические свойства Кислотность объяснила Подготовка Реакции
переэтерификация подготовка очистить сложные эфиры во фруктах Жиры и масла
Йодное число Значение омыления
Номенклатура и изомерия
Физические свойства
Структуры жиров и масел.

 Объясните причину этого.
Объясните причину этого.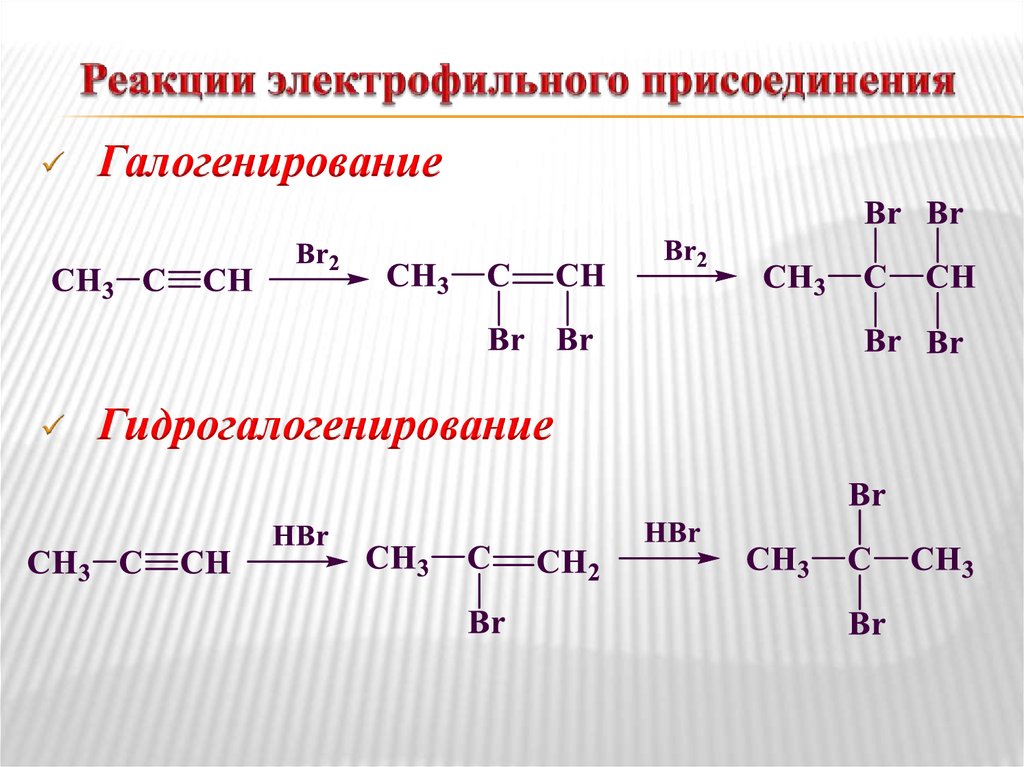 Вычислите объёмную долю (%) циклопропана в первоначальной газовой смеси.
Вычислите объёмную долю (%) циклопропана в первоначальной газовой смеси.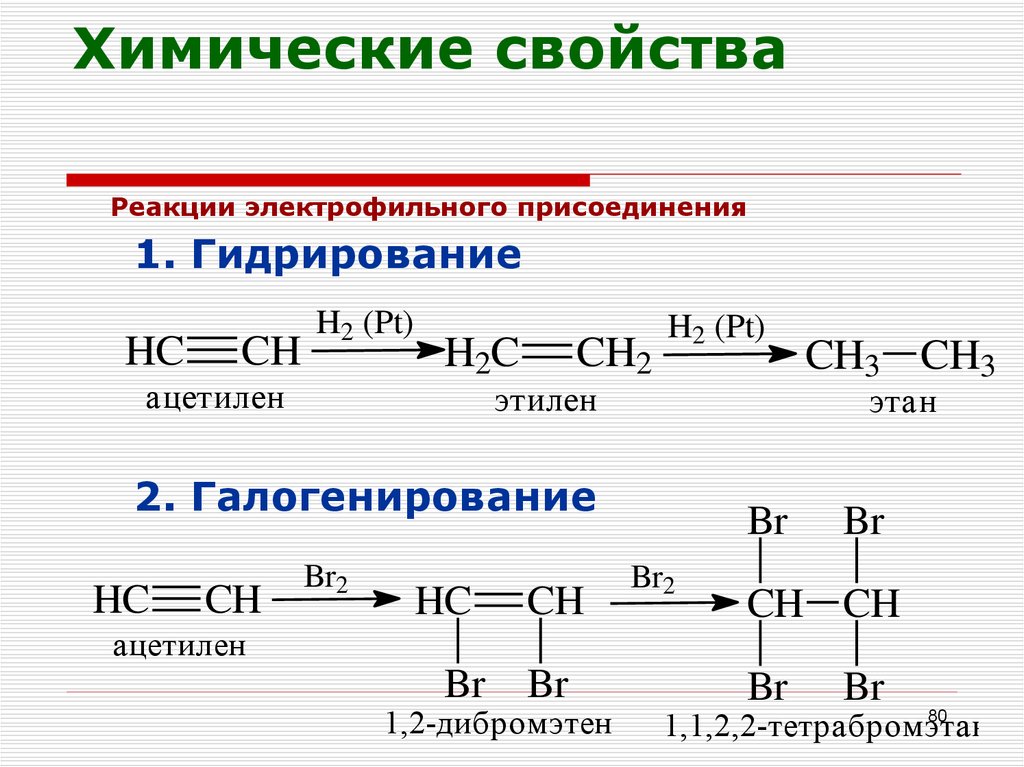
Leave A Comment