Таблица менделеева — Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 — K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Химия Вариант 81
Министерство сельского хозяйства Российской Федерации
ФГОУ ВПО «Ульяновская государственная сельскохозяйственная академия»
Задания для контрольных работ и экзаменационные вопросы по дисциплине
Химия
Ульяновск — 2010
УДК 54
А.Л. Игнатов. Задания для контрольных работ и экзаменационные вопросы по дисциплине «Химия» / Под ред. проф. В. И. Костина. – Ульяновская ГСХА , 2009, 58с.
И. Костина. – Ульяновская ГСХА , 2009, 58с.
Рецензент: Кафиятуллина А.Г., к.х.н., старший преподаватель кафедры химии ГОУ ВПО «Ульяновский государственный педагогический университет им. И.Н.Ульянова»
Данное методическое пособие содержит контрольные задания по основным разделам курса химии, примеры решения типовых задач и перечень экзаменационных вопросов.
Для студентов инженерного факультета заочной формы обучения по специальности: 110301 «Механизация сельского хозяйства», 110304 «Технология обслуживания и ремонта машин в АПК», 190601 «Автомобили и автомобильное хозяйство».
Рассмотрено и рекомендовано к печати методической комиссией инженерного факультета Ульяновской ГСХА. Протокол №2 от 12 ноября 2009 года.
©А.Л.Игнатов, 2010.
©ФГОУ ВПО «Ульяновская государственная сельскохозяйственная академия», 2010.
2
КОНТРОЛЬНЫЕ ЗАДАНИЯ
СТРОЕНИЕ ВЕЩЕСТВА
Примеры решения типовых задач
Задача 1. Какой энергетический подуровень атома заполняется электронами раньше: а) 4s или 3d; б) 5p или
4d; в) 6p или 4f?
Решение. Порядок заполнения энергетических подуровней электронами определяется правилом Клечковского, согласно которому подуровни заполняются электронами в порядке последовательного увеличения суммы главного и орбитального квантовых чисел (n+l), а при одинаковых значениях этой суммы – в порядке возрастания главного квантового числа n. Найдем сумму (n+l) для перечисленных в условии задачи энергетических подуровней.
Порядок заполнения энергетических подуровней электронами определяется правилом Клечковского, согласно которому подуровни заполняются электронами в порядке последовательного увеличения суммы главного и орбитального квантовых чисел (n+l), а при одинаковых значениях этой суммы – в порядке возрастания главного квантового числа n. Найдем сумму (n+l) для перечисленных в условии задачи энергетических подуровней.
Подуро- | 3d | 5p | 4d | 6p | 4f |
4s | |||||
вень |
|
|
|
|
|
Сумма n+l 4+0=4 | 3+2=5 | 5+1=6 | 4+2=6 | 6+1=7 | 4+3=7 |
Следовательно, в случае (а) сначала электронами заполняется подуровень 4s, а затем – 3d; в случае (б) – сначала 4d, затем – 5p; в случае (в) – сначала 4f, затем – 6p.
Задача 2. Распределите электроны по уровням, напишите электронную формулу атома Fe в основном и возбужденном состоянии, укажите квантовые состояния его валентных электронов и распределите их по квантовым ячейкам.
3
Решение. Решение этой задачи необходимо начать с определения числа уровней, которые будут заняты электронами в невозбужденном атоме железа. Их число определяется номером периода, в котором находится элемент. Для железа оно равно 4. На первых двух уровнях максимальное число электронов – 2 и 8 соответственно (определяется удвоенным квадратом главного квантового числа 2n2). Максимальное число валентных электронов определяется номером группы, в которой расположен элемент (VIII). Так как железо расположено в побочной подгруппе, то валентные электроны его распределяются между s – подуровнем внешнего энергетического уровня и d – подуровнем предвнешнего уровня. Так, в 4s состоянии находится 2 электрона, а в 3d-состоянии – 6 ( номер группы минус 2). Общее число электронов предпоследнего энергетического уровня атома железа равно 14.
Итак, электроны в невозбужденном атоме железа по уровням распределяются следующим образом:
Fe +26 )2 )8 )14 )2
Каждый n-й уровень расщепляется на n подуровней. При написании электронной формулы атома подуровни располагают в порядке возрастания суммы главного и орбитального квантового числа:
1s2 | 2s2 | 2p6 | 3s2 | 3p6 | 3d6 | 4s2 |
1+0=1 | 2+0=2 | 2+1=3 | 3+0=3 | 3+1=4 | 3+2=5 | 4+0=4 |
Валентные электроны – 3d 6 4s2.
Порядок заполнения квантовых ячеек подуровня электронами определяется правилом Гунда по принципу наибольшего абсолютного значения суммарного спина:
4
|
| 3d |
| 4s | ||
|
|
|
|
|
|
|
↑↓ | ↑ | ↑ | ↑ | ↑ |
| ↑↓ |
|
|
|
|
|
|
|
В возбужденном атоме железа один s – электрон переходит на 4р – подуровень.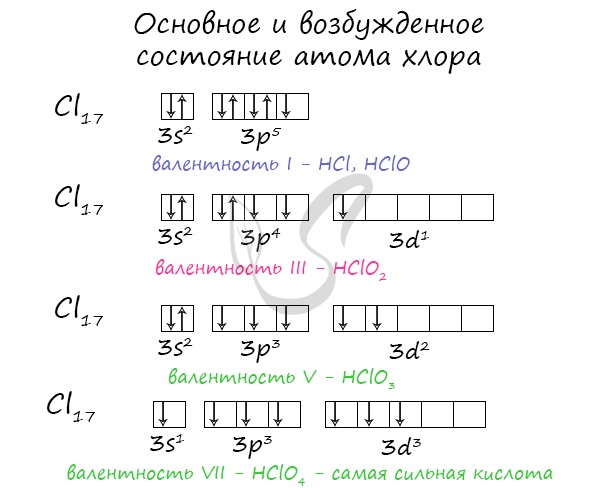
|
| 3d6 |
| 4s1 |
|
| 4p1 | |||
|
|
|
|
|
|
|
|
|
|
|
↑↓ | ↑ | ↑ | ↑ | ↑ |
| ↑ |
| ↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
Задача 3. Напишите электронные формулы ионов Mn2+, S2-, Br- .
Решение. У атома Mn (d-элемент) электроны распреде-
лены по энергетическим уровням следующим образом: 1s22s22p63s23p63d54s2
|
| 3d |
| 4s | ||
|
|
|
|
|
|
|
↑ | ↑ | ↑ | ↑ | ↑ |
| ↑↓ |
|
|
|
|
|
|
|
При образовании положительных ионов у d — элементов первыми всегда удаляются s-электроны внешнего слоя, то есть для Mn+2 справедлива электронная формула:
1s22s22p63s23p63d54s0
↑ ↑ ↑ ↑ ↑
5
При образовании отрицательных ионов происходит дальнейшее заполнение энергетических подуровней согласно правилу Клечковского, то есть если для атома серы справедливо:
S:1s22s22p63s23p4
3s 3p
↑↓ |
| ↑↓ | ↑ | ↑ |
|
|
|
|
|
то для иона S2– произойдет «достройка» 3р-подуровня
S2– :1s22s22p63s23p6
3s 3p
↑↓ |
| ↑↓ | ↑↓ | ↑↓ |
|
|
|
|
|
Аналогичная «достройка» подуровня происходит при образовании иона Br-:
Br:1s22s22p63s23p63d104s24p5
| 4s |
|
|
| 4p |
|
|
|
|
|
|
|
|
|
|
| ↑↓ |
|
| ↑↓ | ↑↓ | ↑ |
|
|
|
|
|
|
|
| |
Br– :1s22s22p63s23p63d104s24p6 | |||||||
| 4s |
|
|
| 4p |
|
|
|
|
|
|
|
|
| |
| ↑↓ |
|
| ↑↓ | ↑↓ | ↑↓ |
|
|
|
|
|
|
|
|
|
6
Задача 4. Укажите положение элемента в периодической системе (период, группу, подгруппу), если последний электрон в его атом попал в состояние: а) 3d6; б) 4p2.
Укажите положение элемента в периодической системе (период, группу, подгруппу), если последний электрон в его атом попал в состояние: а) 3d6; б) 4p2.
Ответ обоснуйте.
Решение. а) Если последний электрон попал в атом в d – состояние, то это элемент побочной подгруппы. В атомах элементов побочных подгрупп последний валентный электрон попадает на d – подуровень предпоследнего энергетического уровня. Из этого следует, что n-1=3, а n=4. Величина главного квантового числа – 4 – определяет номер периода – 4. Так как 4s-состояние заполняется электронами раньше, чем 3d, то общее число электронов, которые могут быть валентными, равно 4: 3d24s2. Значит, это элемент 4-го периода IV группы побочной подгруппы – титан (Ti).
б) Если последний электрон попал в атом в p – состояние, то это элемент главной подгруппы.
В атомах элементов главных подгрупп валентные электроны расположены на внешнем энергетическом уровне. Отсюда величина главного квантового числа – 4 – определяет номер периода. Так как p-состояние внешнего уровня заполняется электронами после s-состояния, то общее число валентных электронов, равное 4, и определяет номер группы. Следовательно, это элемент 4-го периода IV группы и главной подгруппы – германий .
Так как p-состояние внешнего уровня заполняется электронами после s-состояния, то общее число валентных электронов, равное 4, и определяет номер группы. Следовательно, это элемент 4-го периода IV группы и главной подгруппы – германий .
Задача 5. Определите, перекрыванием каких электронных облаков образованы связи в молекуле BCl3, какой валентный угол имеет молекула, полярна или нет молекула BCl3. Ответ обоснуйте, рассмотрите схему строения молекулы BCl3 с позиций метода ВС (валентных связей).
Решение. По положению элемента в периодической системе указать квантовые состояния валентных электронов в атомах, образующих связи, и распределить их по
7
квантовым ячейкам: В…2s 22p1, но так как атом бора образует три химические связи, то он находится в возбуждённом состоянии и происходит гибридизация sp2 электронных орбиталей; образуются три гибридных электронных облака.
B….2s | 22p1 |
|
|
| ||||
22 |
|
|
|
| 2 |
|
| |
|
|
|
|
|
|
|
|
|
| ↑↓ |
|
|
| ↑ |
|
|
|
|
|
|
|
|
|
| ||
B*…. |
|
|
| |||||
| 2s2 |
|
|
| 2p | |||
|
|
|
|
|
|
| ||
| ↑ |
|
|
| ↑ | ↑ |
|
|
|
|
|
|
|
|
|
| |
Cl…3s | 23p5 |
|
|
| ||||
| 3s2 |
|
|
| 3p5 | |||
|
|
|
|
|
| |||
| ↑↓ |
|
|
| ↑↓ | ↑↓ | ↑ | |
|
|
|
|
|
|
|
|
|
В образовании связи у хлора участвует p-электрон.
Связи B–Cl образованы перекрыванием гибридных электронных облаков атома В и p-электронного облака атома Cl.
Направленность гибридных электронных облаков трехвалентного атома В определяет направленность связей и форму молекулы BCl3. Связи B−Cl направлены под углом 1200, молекула BCl3 имеет форму плоского треугольника. Схема образования связей в молекуле показана на рис.1.
8
Cl
B
Рис. 1
Векторы дипольных моментов связей µсв>0 направлены в сторону атома с большей электроотрицательностью. Суммарный дипольный момент молекулы PM равен 0, т.е. молекула неполярна, хотя все связи B−Cl полярны .
Задача 6. Какая связь действует между частицами в кристаллах следующих веществ: Ch5, Ne, Rb, RbF, Si, ZnSe? Какой тип кристаллической решетки по характеру частиц и видам связи между ними имеют эти вещества в
конденсированном состоянии?
Решение. Для кристаллов метана и неона характерна молекулярная решетка. В узлах первой кристаллической решетки находятся неполярные молекулы Ch5, между которыми действуют дисперсионная составляющая сил Ван дер Ваальса. Дисперсионное взаимодействие проявляется и в кристаллах между одноатомными молекулами неона.
Дисперсионное взаимодействие проявляется и в кристаллах между одноатомными молекулами неона.
Рубидий – металл; для кристаллического рубидия характерна металлическая решетка; связь между катионами рубидия, находящимися в узлах решетки – металлическая.
В соединении RbF действует типичная ионная связь, так как разность электроотрицательностей атомов
9
более двух единиц: ΔХ RbF = ХF — Х Rb = 4,0 – 0,8 = 3,2 (Приложение I), для кристаллов RbF характерна ионная решетка, в узлах которой находятся положительные и отрицательные ионы Rb+ и F-, между которыми действует ионная связь.
Кристаллический кремний (кремний – неметалл) имеет ковалентную кристаллическую решетку типа алмаза, в которой каждый атом кремния связан с четырьмя соседними атомами неполярной ковалентной связью. Ковалентную решетку имеют кристаллы селенида цинка.
Между атомами цинка и селена, находящимися в узлах кристаллической решетки, действует полярная ковалентная связь, так как ∆XZnSe = 2,4 — 1,6 = 0,8
Задание 1
Задания даны в таблице 1. Номер варианта соответствует строке, номер задания соответствует столбцу.
Номер варианта соответствует строке, номер задания соответствует столбцу.
1.Распределите электроны по энергетическим уровням, напишите электронную формулу предложенного в задании атома, укажите квантовые состояния валентных электронов, распределите их по квантовым ячейкам в невозбужденном и возбужденном состояниях, укажите, к какому электронному семейству относится данный элемент?
2.Напишите электронные формулы предложенных ионов, укажите квантовые состояния валентных электронов и распределите их по квантовым ячейкам.
3.В какой последовательности заполнятся электронами предложенные в задании подуровни? Дайте объяснение.
4.По квантовому состоянию последнего электрона укажите положение элемента в периодической системе (период, группу, подгруппу).
5.Рассмотрите строение предложенных в задании молекул с позиции метода валентных связей, укажите
10
физическая химия. Электронная конфигурация возбужденных состояний железа
спросил
Изменено 6 лет, 7 месяцев назад
Просмотрено 9к раз
$\begingroup$
Электронная конфигурация основного состояния $\ce{Fe}$ $\mathrm{1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^6}$. 7}$, но разве угловой момент не сохраняется, потому что $l=0$ для $\mathrm{s}$ и $l= 2$ за $\mathrm{d}$?
7}$, но разве угловой момент не сохраняется, потому что $l=0$ для $\mathrm{s}$ и $l= 2$ за $\mathrm{d}$?
- физико-химия
- электронная конфигурация
- орбитали
$\endgroup$
1
$\begingroup$
Электронные конфигурации возбужденных состояний нейтрального железа перечислены на этой странице базы данных NIST:
- 3d 6 4s 2 — a 5 D — основное состояние
- 3д 7 ( 4 F)4s 1 — a 5 F — 6928,268 см –1
- 3d 7 ( 4 F)4s 1 — a 3 F — 11976,238 см –1
- 3d 7 ( 4 П)4с 1 — а 5 П — 17550,180 см –1
- 3d 6 4s 2 — a 3 P — 18378,185 см –1
- 3d 6 ( 5 D)4s 1 4p 1 ( 3 П) — z 7 D 0 — 19350,892 см –1
Ссылка на эти данные: G. Nave, S. Johansson, R. C. M. Learner, A. P. Thorne, and J. W. Brault, Astrophys. Дж. Доп. сер. 94, 221 (1994).
Nave, S. Johansson, R. C. M. Learner, A. P. Thorne, and J. W. Brault, Astrophys. Дж. Доп. сер. 94, 221 (1994).
Таким образом, хотя в целом предсказание электронных конфигураций для возбужденных состояний является сложной задачей, вы правы: первая возбужденная электронная конфигурация должна «продвигать» один 4s-электрон на 3d-орбитали. И вторая конфигурация возбужденного состояния (независимо от различных спектроскопических терминов и подуровней) должна продвигать 4s-электрон в 4p.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Какая электронная конфигурация представляет атом в возбужденном состоянии? 91)#
Это соответствует возбуждению в первое возбужденное состояние, которое менее стабильно; что затем приводит к релаксации обратно в основное состояние. Релаксация излучает желтый свет (#»589 нм»#).
В конце концов я просматриваю правила выбора (которые помогают предсказать, разрешен или запрещен электронный переход), символы терминов и предсказания переходов. Это в целом говорит вам, откуда я знаю, что переход #3s -> 3p# является реальным переходом для натрия.
(Если вы хотите, вы можете пропустить контекстную секцию символов терминов; это необязательно.)
Возможно, вы уже выучили правила выбора , а возможно, и нет, но их несложно запомнить. Они помогут вам определить, как записывать электронные конфигурации для возбужденных состояний.
ПРАВИЛА ВЫБОРА
Правила отбора управляют тем, как наблюдается переход электрона ( возбуждает вверх или расслабляет вниз) с одной орбитали на другую.
Формально они записываются так:
#цвет(синий)(DeltaS = 0)#
#цвет(синий)(DeltaL=0, pm1)##цвет(синий)(L + S = J)#
#:. цвет (синий) (DeltaJ = 0, pm1) #
, где #DeltaS# — изменение собственного углового момента электрона (кратность вращения равна #2S + 1#), #DeltaL# — изменение орбитального углового момента , а #DeltaJ# — изменение полный угловой момент .
Полезно знать правила выбора, если вы хотите предсказать, как конфигурация возбужденного состояния может быть записана только на основе (правильной) конфигурации основного состояния атома.
ПРИМЕРЫ ЭЛЕКТРОННЫХ ПЕРЕХОДОВ ВОЗБУЖДЕНИЯ
Разрешено:
#color(green)(2s -> 2p)# (#color(green)(DeltaS = 0#, #color(green)(DeltaL = +1)#, #color(green)(DeltaJ = 0, pm1) #) 9″старый» = 0#.
Запрещено:
Пример запрещено электронного перехода вверх одного неспаренного электрона на пустую орбиталь:
#color(green)(3s -> 3d)# (#color(green)(DeltaS = 0)#, #color(green)(DeltaL = color(red)(+2))#, #color(green) (DeltaJ = 0, pm1, цвет(красный)(pm2))#)
#DeltaL = +2#, так как для #s# #l = 0#, а для #d# #l = 2#. Таким образом, #DeltaL = +2#, что больше допустимого, поэтому это запрещено.
#DeltaS# по-прежнему #0#, потому что это тот же самый электрон, который переходит, как и прежде, только на другую орбиталь.
СИМВОЛЫ ТЕРМИНОВ / КОНТЕКСТ
«Я никогда раньше не видел #L#, #S# или #J#. А? Для чего они используются?»
Подробнее о них можно прочитать здесь:
http://socratic.org/scratchpad/3616fa1583309e7c0ed2
ОТКАЗ ОТ ОТВЕТСТВЕННОСТИ: В приведенной выше ссылке поясняются символы терминов для контекста. Это полезно знать, но вам не обязательно знать это как свои пять пальцев, если только вы не изучаете физическую химию.

 2s 12p2
2s 12p2
Leave A Comment