Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
| Похожие вопросы |
Решено
1. 2+4x+3 Найдите: а) наименьшее значение функции; б) значения х, при которых значение функции равно 8; в) значения х, при которых функция принимает положительные значения;
2+4x+3 Найдите: а) наименьшее значение функции; б) значения х, при которых значение функции равно 8; в) значения х, при которых функция принимает положительные значения;
Пользуйтесь нашим приложением
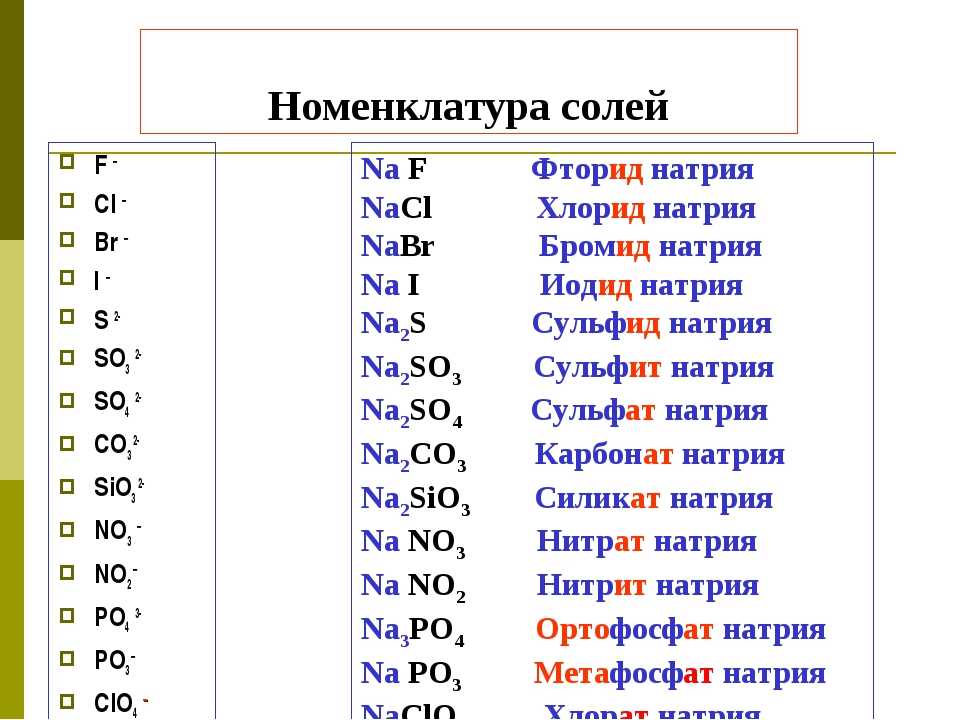
Сульфат натрия — хим. свойства и получение
Сульфат натрия — соль щелочного металла натрия и серной кислоты. Белый. Плавится и кипит без разложения. Хорошо растворяется в воде (гидролиз не идет).
Относительная молекулярная масса Mr = 142,04; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 884º C; tкип = 1430º C.
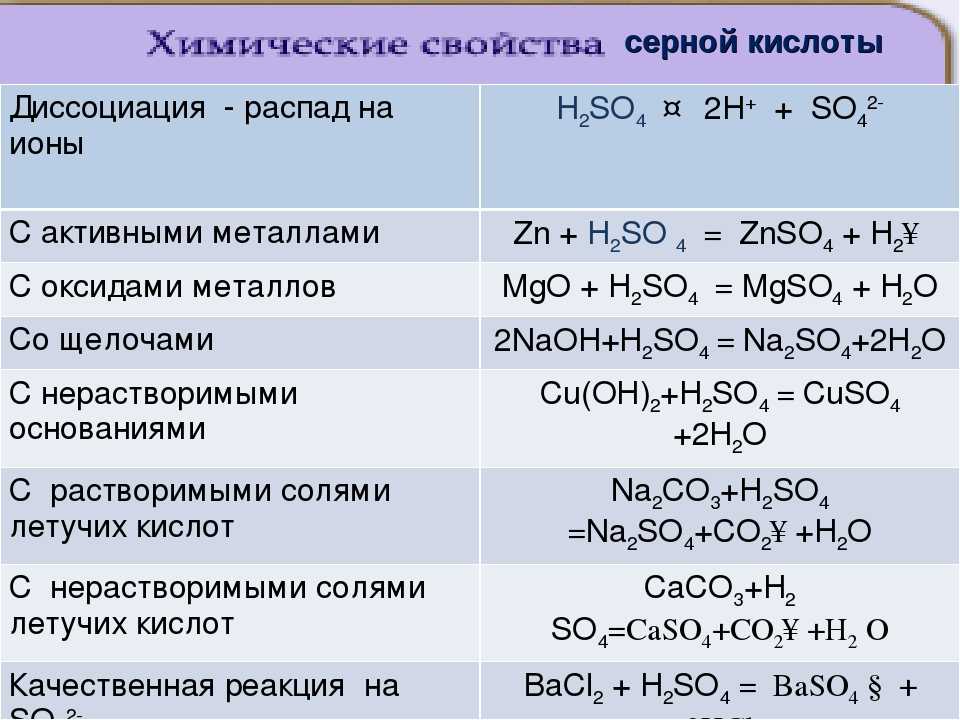
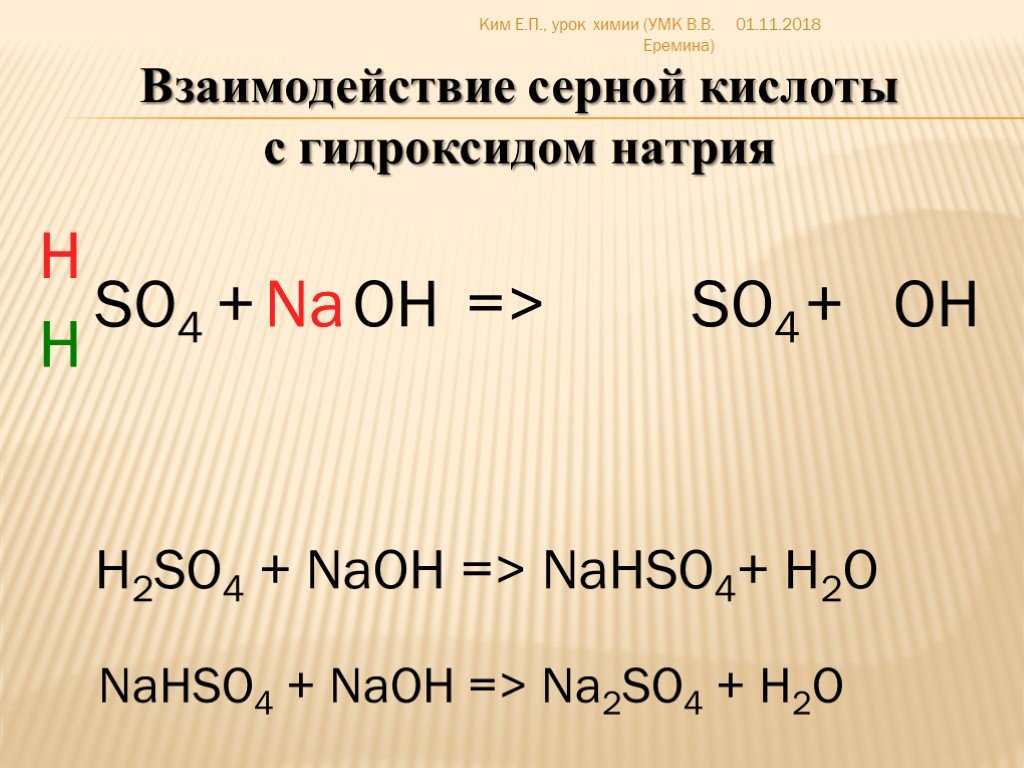
1. В результате взаимодействия разбавленной серной кислоты и гидроксида натрия образуется сульфат натрия и вода:
2NaOH + H2SO4 = Na2SO4 + H2O
2. При температуре 450–800º C гидросульфат натрия реагирует с хлоридом натрия. В результате реакции образуется сульфат натрия и хлороводородная кислота:
При температуре 450–800º C гидросульфат натрия реагирует с хлоридом натрия. В результате реакции образуется сульфат натрия и хлороводородная кислота:
NaHSO4+ NaCl = Na2SO4 + HCl
3. В состоянии кипения в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование сульфата натрия и газа хлороводорода:
2NaCl + H2SO4 = Na2SO4 + 2HCl↑
4. Твердый сульфид натрия и кислород взаимодействуют при температуре выше 400º C с образованием сульфата натрия:
Na2S + 2O2 = Na2SO4
5. При взаимодействии концентрированного раствора пероксида водорода и сульфида натрия образуется сульфат натрия и вода:
При взаимодействии концентрированного раствора пероксида водорода и сульфида натрия образуется сульфат натрия и вода:
Na2S + 4H2O2 = Na2SO4 + 4H2O
Качественная реакция на сульфат натрия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария, сульфат натрия образует сульфат бария и хлорид натрия:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
1. Сульфат натрия может реагировать с простыми веществами:
1.1. Сульфат натрия реагирует со фтором при температуре 100–150º C. При этом образуются фторид натрия, сульфурилфторид и кислород:
При этом образуются фторид натрия, сульфурилфторид и кислород:
Na2SO4 + 2F2 = 2NaF + SO2F2 + O2
1.2. С водородом сульфат натрия реагирует при температуре 550–600º C, в присутствии катализатора Fe2O3 с образованием сульфида натрия и воды:
Na2SO4 + 4H2 = Na2S + 4H2O
2. Сульфат натрия вступает в реакцию со многими сложными веществами:
2.1. Сульфат натрия реагирует с гидроксидом бария с образованием гидроксида натрия и сульфата бария:
Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
2. 2. При взаимодействии с концентрированной серной кислотой твердый сульфат натрия образует гидросульфат натрия:
2. При взаимодействии с концентрированной серной кислотой твердый сульфат натрия образует гидросульфат натрия:
Na2SO4 + H2SO4 = 2NaHSO4
2.3. Сульфат натрия реагирует с оксидом серы (VI). Взаимодействие сульфата натрия с оксидом серы (VI) приводит к образованию пиросульфата натрия:
Na2SO4 + SO3 = Na2S2O7
2.4. Сульфат натрия взаимодействует с хлоридом бария. При этом образуются хлорид натрия и сульфат бария:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Понравилось это:
Нравится Загрузка. ..
..
Что, Как сбалансировать и часто задаваемые вопросы —
Автор Deepak Poddar
Давайте узнаем о химической реакции с уникальными механизмами, захватывающей химией и свойствами. Ниже приведено объяснение реакции между серной кислотой и сульфидом натрия.
Серная кислота (H 2 SO 4 ) также известна как король кислот из-за ее широкого использования в производстве многих соединений. Сульфид натрия, или Na 2 S, представляет собой хорошо известное неорганическое химическое соединение с формулой Na 2 S и действует как база.
Теперь мы можем обсудить механизм реакции, такой как энтальпия, тип реакции, межмолекулярная сила, сопряженные пары, образование продукта и т. д., в следующей статье.
Каков продукт H 2 SO 4 и NA 2 S H 2 SO 4 и NA 2 S будет произведена реакцией между фоссором. кислоту и сульфид натрия, как указано в приведенной ниже реакции.
кислоту и сульфид натрия, как указано в приведенной ниже реакции.
- H 2 SO 4 (AQ)+ NA 2 S (S) = NA 2 SO 4 (S)+ H 2 S (AQ)
2020202
Какой тип реакции — H 2 SO 4 и NA 2 SH 2 SO 4 и NA 2 с. ) сульфида натрия и анион (сульфат) серной кислоты меняются местами, и происходит образование новых соединений.
Как сбалансировать H 2 SO 4 и NA 2 SH 2 SO 4 и NA 2 S Реакция баланса следующая :
H. 2 SO 4 + NA 2 S = NA 2 SO 4 + H 2 S
Далее, Реакция между H 2 SO 4 и NA . 2 S балансируется следующим образом:
2 S балансируется следующим образом:
- Во-первых, необходимо установить реакцию между вышеупомянутыми реагентами.
- H 2 SO 4 + Na 2 S = Na 2 SO 4 + H 2 S
- Coefficient of the individual chemical molecules are labeled as ,
- H 2 SO 4 (a), Na 2 S (b), Na 2 SO 4 (c) и H 2 S (d)
- Подсчитайте количество водорода (H), серы (S), кислорода (O) и натрия (Na) как со стороны реагента, так и со стороны продукта . That gives
·
| Coefficient at Reactant side | Element | Coefficient at the Product side |
| 2 | S | 2 |
| 4 | O | 4 |
| 2 | H | 2 |
| 2 | Na | 2 |
- Now equate the number of elements как со стороны реагента, так и со стороны продукта.

- Это дает уравнение баланса0009 SO 4 + H 2 S
H 2 SO 4 and Na 2 S дает кислотно-основное титрование, когда стандартный раствор Na 2 S титруется H 2 SO 4 в присутствии индикатора. Несколько аппаратов, условий и процедур титрования обсуждаются ниже:
Используемый аппаратБюретка, подставка для бюретки, мерная колба, коническая колба и химические стаканы.
ИндикаторБромофенол Блю служит индикатором
Процедура- Сначала, промыть все аппарат с чистой водой, и сухой его в пюре. раствор Na 2 S и H 2 SO 4 с использованием молярных уравнений
- Наполните бюретку кислотой до отметки 50 мл и отберите 10 мл Na 2 S в коническую колбу.

- Добавьте несколько (3) капель индикатора в коническую колбу.
- Титруйте основание кислотой, медленно добавляя в него кислоту по каплям.
- Отметьте показания бюретки, когда окраска раствора изменится с желтой на синюю.
- Показания расскажут о точке нейтрализации раствора.
- Повторите процесс трижды, чтобы записать согласованные показания.
H 2 SO 4 and Na 2 S чистое ионное уравнение is
2H + + S – = H 2 S +
- Разделите реагенты и продукты на ионы, чтобы определить, какие из них являются наблюдателями.
 Который составляет
Который составляет - NA 2 S (aq) + H 2 SO 4 (AQ) = NA 2 SO 4 (AQ) + H 2 S (G)
- + H 2 S (G)
- + H 2 S (G)
- (a). Здесь сначала разделите сильные электролиты на ионы (полное ионное уравнение), которое равно
- 2H + + SO 4 2- + 2Na + + S = H – 90 2 S + 2NA + + SO 4 2-
- Теперь вычеркните ионы зрителей с обеих сторон ионного уравнения
- 2H + 999999999999999999999999999999999999999999999999999999999999999999999999999999999 9999 + + + + + + + + + + + + + . 2 S +
- This yield the net ionic equation, which is
- 2H + + S – = H 2 S +
H 2 SO 4 и Na 2 S реакция имеет следующую сопряженную пару .
- Конъюгатное основание H 2 SO 3 IS HSO 3– (бисульфит -анион)
- Конъюгатная пара основания NA 2 SO AS 2+999999999999999999999999999999999999999999999999999999 (бисульфит -анион) .
H 2 SO 4 и NA 2 S Реакция имеет следующие межмолекулярные силы,
- H 2 SO 4 и NA 2 998 2 SO 4 и NA 2 7779779779779. , H 2 SO 4 связан посредством ван-дер-ваальсовых дисперсионных сил, диполь-дипольных взаимодействий и водородных связей.
- Na 2 S обладает положительными и отрицательными межмолекулярными силами благодаря своей ионной связи.

H 2 SO 4 and Na 2 Энтальпия реакции S составляет -296,83 кДж/моль, что является отрицательным значением, поскольку в результате реакции выделяется энергия.
Is H 2 SO 4 + Na 2 S A A A Buffer SolutionH 2 Таким образом, 4 и NA 2 S не может заработать буфер, так как H 2 , так что 4 — сильная кислота, а NA. 2 S является сильным основанием в нейтральных условиях.
IS H 2 SO 4 + NA 2 S Полная реакция H С. 0008 2 SO 4 и Na 2 S представляют собой полную реакцию, поскольку в них полностью используется один из реагентов.
0008 2 SO 4 и Na 2 S представляют собой полную реакцию, поскольку в них полностью используется один из реагентов.
H 2 SO 4 and Na 2 S реакция носит экзотермический характер.
- Реакция обоих элементов высвобождает тепло в виде энергии и может быть рассчитана.

 10.17
10.17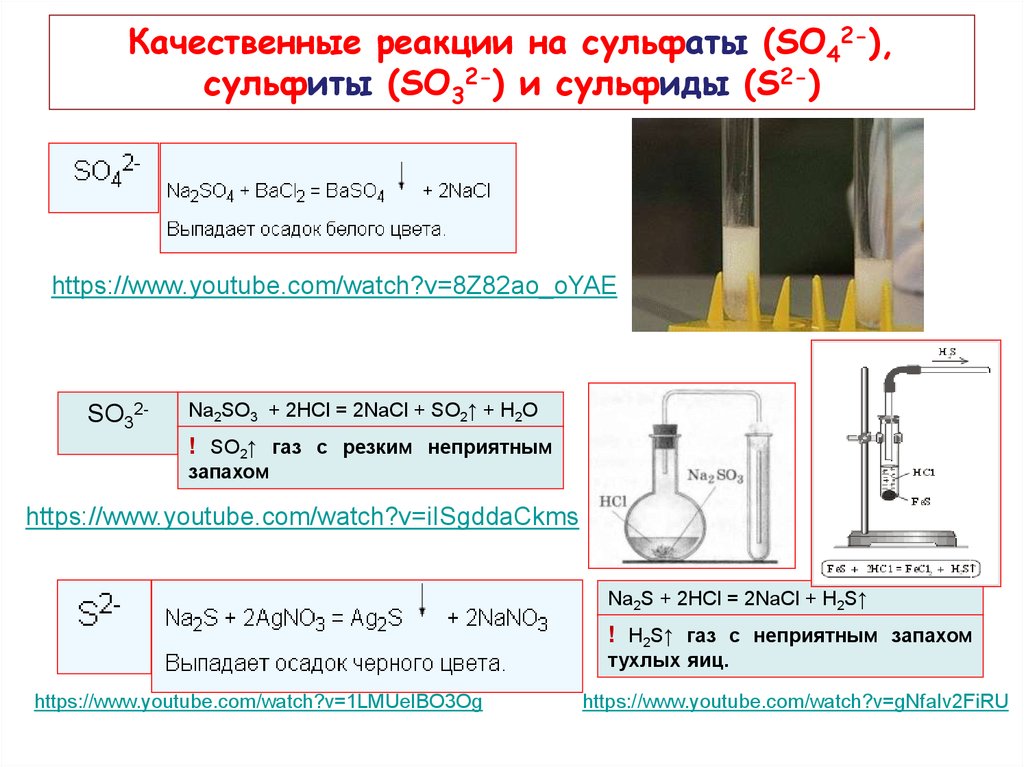

 Который составляет
Который составляет 
 0016
0016

Leave A Comment