Опровергнута самая популярная теория строения воды
Учёные СФУ совместно с коллегами из Королевского института технологий Швеции опровергли самую популярную ныне кластерную теорию строения воды. В ходе работы исследователи предложили новую теорию, согласующуюся с результатами их эксперимента. Работа опубликована в журнале Nature Communications. Исследования поддержаны грантом Российского научного фонда.
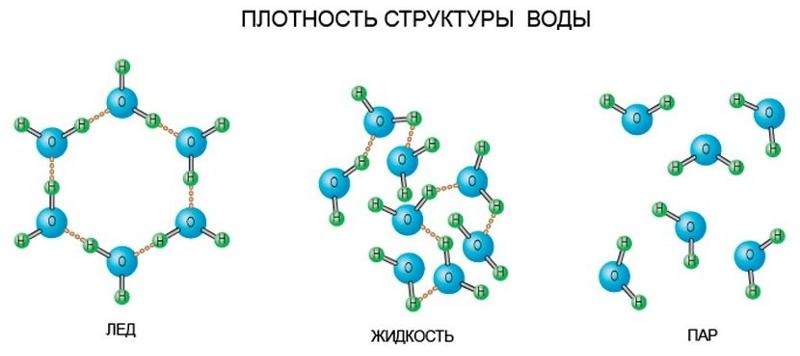
Вода — одно из самых распространённых, но в то же время необычных веществ на Земле. Она обладает рядом нетипичных свойств, объясняемых её особой структурой, например, высокой теплоёмкостью и низкой электропроводностью. Общепринято, что вода состоит из молекул Н2О, объединённых в группы так называемыми водородными связями. Их наличие обусловлено притяжением между положительно заряженными атомами водорода и отрицательно заряженными атомами кислорода. Свободные, не входящие в кластеры (группы молекул, связанных водородными связями) молекулы присутствуют лишь в небольшом количестве.
Чтобы пролить свет на эту фундаментальную проблему, авторы работы провели эксперимент с парами воды, где нет водородных связей. В ходе исследования они измерили спектр резонансного неупругого рассеяния изолированной молекулы. Эксперименты привели к неожиданному результату и показали, что точно такое же расщепление резонанса на два пика присутствует в рентгеновских спектрах рассеяний молекул воды в газовой фазе.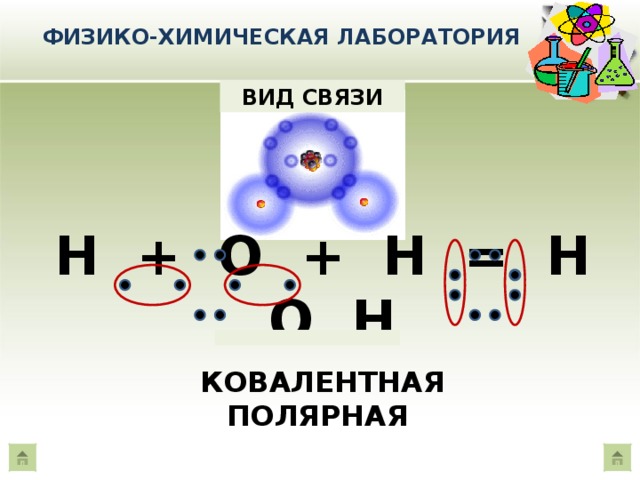
Второй не менее важный результат этой работы — получение детальной структурной информации о том, как влияют водородные связи на силу OH-связи. Колебательная инфракрасная (ИК) спектроскопия — общепринятый инструмент для исследования водородных связей в жидкостях. Но в них ИК-спектроскопия показывает лишь наиболее интенсивный переход в состояние с минимальной энергией колебаний, которое «слабо чувствует» межмолекулярное взаимодействие. Спектроскопия резонансного неупругого рассеяния воды качественно отличается от ИК-спектроскопии тем, что, получив энергию от рентгеновского фотона, электрон кислорода переходит с самой глубокой орбитали на первую незанятую.
«Важно отметить, что, в отличие от изолированной молекулы воды с одной энергией взаимодействия О и Н, в жидкости имеется набор (распределение) таких энергий в силу многообразия ближайшего окружения молекулы воды.— дополняет Фарис Гельмуханов, доктор физико-математических наук, профессор Королевского технологического института (Стокгольм, Швеция), старший научный сотрудник Сибирского федерального университета.Таким образом, второй результат работы — измерение распределения OH-потенциалов в сети постоянно изменяющихся водородных связей. На следующем этапе исследований необходимо выяснить, возможно ли из спектров резонансного неупругого рассеяния воды определить такой важный структурный параметр, как среднее число связей молекулы. Он определяет энергию взаимодействия последней с её окружением, а значит, и такие свойства, как скорость звука в воде и её теплоёмкость»,
В работе также приняли участие учёные из Университета Потсдама (Германия), Университета Цюриха (Швейцария) и Университета Турку (Финляндия).
Рисунки
- A) Молекула воды, поглотив фотон, возбуждается из основного состояния (0) в высоковозбуждённое диссоциативное состояние (с), где атом водорода быстро покидает точку равновесия.
 В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно.
В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно. - Б) рентгеновский спектр поглощения воды.
- B) Спектры испускания c→f и c→0 вблизи 526 эВ и 535 эВ, соответственно. Эмиссионный спектр c→f вблизи 525 эВ показывает динамическое формирование (в процессе диссоциации) дублета с расщеплением Δ (см. панель A). При возвращении молекулы в основное состояние c→0 в процессе диссоциации заселяются высокие колебательные уровни, что формирует протяжённую колебательную прогрессию в районе 535 эВ.
- Г) В работе решена обратная задача восстановления из колебательной прогрессии распределения OH-потенциалов воды в жидкой фазе.
Элементы жизни. Вода — Индикатор
Из чего состоят живые тела и при чем тут углерод? Что такое генетический код, кто такие вирусы, как устроено эволюционное древо и почему произошел кембрийский взрыв? Книга Сергея Ястребова «От атомов к древу: Введение в современную науку о жизни», вышедшая в издательстве «Альпина нон-фикшн», дает актуальные ответы на эти и многие другие вопросы.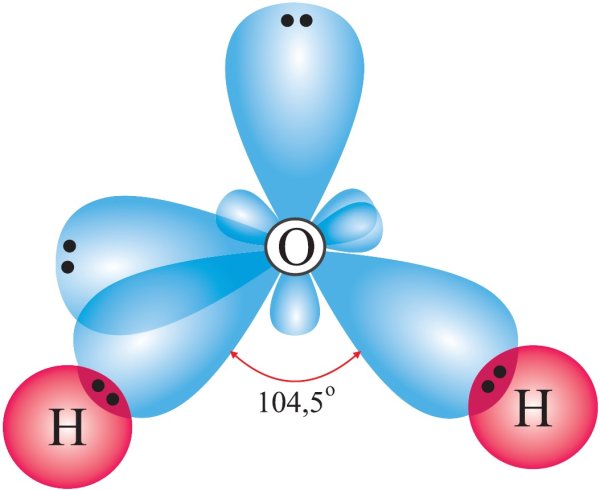
Что такое вода?
Вода — одно из самых распространенных веществ на планете Земля. Она покрывает две трети земной поверхности,и ее очень много в живых организмах — гораздо больше, чем любого другого вещества. Подавляющее большинство биохимических реакций, то есть превращений жизненно важных молекул друг в друга, идет в растворах, где вода является растворителем. Воды много и в космосе — например, в кометах, в недрах Урана и Нептуна или в межзвездных туманностях. В целом можно сказать, что вода — это одно из самых распространенных веществ не только на Земле, но и вообще во Вселенной. Иное дело, что далеко не на всех планетах она встречается в жидком виде (Земля — единственная планета Солнечной системы, на поверхности которой есть постоянно существующие водоемы). Так или иначе, неудивительно, что именно вода послужила средой для всем нам знакомой жизни.
Что же такое вода с точки зрения химии? Это весьма простая молекула, состоящая всего лишь из двух атомов водорода (H) и одного атома кислорода (O).
Многие свойства воды объясняются тем, что ее молекулы исключительно хорошо «слипаются» друг с другом. Например, на поверхности водоема они образуют пленку, по которой клопы-водомерки, отнюдь не микроскопические существа, бегают как посуху. Другие особенности воды как вещества — прекрасная теплопроводность и высокая температура кипения (на испарение литра воды надо потратить больше энергии, чем на испарение того же объема чуть ли не любой другой жидкости). Чтобы понять, почему вода именно такова, надо присмотреться к ее молекулам повнимательнее.
Водородная связь
Начнем вот с чего. В общей химии часто встречается понятие «электроотрицательность», введенное когда-то Лайнусом Полингом. Электроотрицательность — это сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Самый электроотрицательный элемент — фтор (F), а сразу за ним на
шкале электроотрицательности следует кислород (O). Иначе говоря, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора, который в живой природе встречается очень редко. Запомним этот факт, он нам пригодится.
Электроотрицательность — это сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Самый электроотрицательный элемент — фтор (F), а сразу за ним на
шкале электроотрицательности следует кислород (O). Иначе говоря, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора, который в живой природе встречается очень редко. Запомним этот факт, он нам пригодится.
Электроотрицательность одинаковых атомов по определению равна. Если между двумя одинаковыми атомами есть ковалентная связь, то образующая ее пара электронов никуда не смещается. Грубо говоря, эти электроны располагаются между атомами точно посредине. Такая ковалентная связь называется неполярной. Само собой разумеется, что любая ковалентная связь между одинаковыми атомами будет неполярна (например, связь в молекуле водорода H–H или углерод-углеродная связь C–C).
Если же ковалентную связь образуют два разных атома, то общие электроны смещаются к тому из них, у которого электроотрицательность выше. Такая связь называется полярной (см. рис. 1 и 2). При очень большой разнице в электроотрицательности связь может даже превратиться в ионную — это случится, если один атом полностью «отберет» общую пару электронов у другого. В молекулах, из которых состоят живые существа, ионные связи встречаются относительно редко, зато ковалентные полярные — очень часто. Например, это широко распространенные в органических веществах связи C–O и H–O.
Такая связь называется полярной (см. рис. 1 и 2). При очень большой разнице в электроотрицательности связь может даже превратиться в ионную — это случится, если один атом полностью «отберет» общую пару электронов у другого. В молекулах, из которых состоят живые существа, ионные связи встречаются относительно редко, зато ковалентные полярные — очень часто. Например, это широко распространенные в органических веществах связи C–O и H–O.
Связь между водородом и кислородом в молекуле воды — это типичная ковалентная полярная связь. Электроотрицательность кислорода намного выше, поэтому общие электроны смещены к нему. В результате на атоме кислорода образуется маленький отрицательный заряд, а на атомах водорода — маленькие положительные заряды. На графических формулах эти маленькие заряды, величина которых значительно меньше единицы, принято обозначать буквой «дельта» с добавлением соответствующего знака. Как мы теперь знаем, связи кислорода с водородом или углеродом вообще всегда полярные.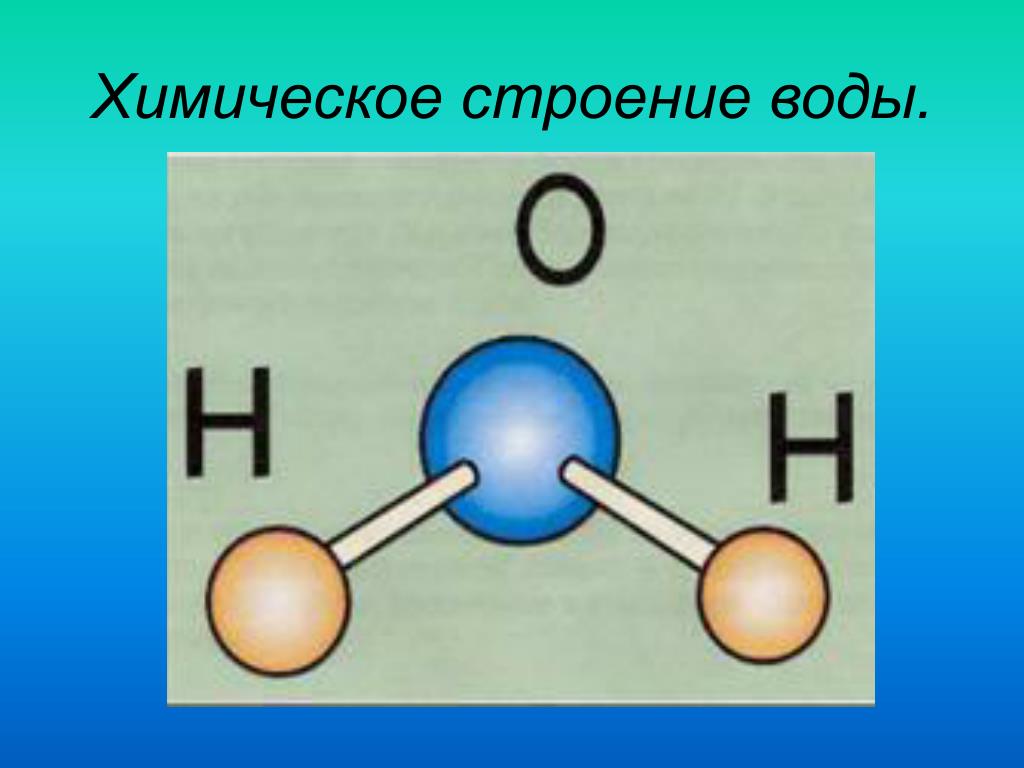 Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде.
Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде.
А вот связь между углеродом и водородом (C–H) считается неполярной, хоть атомы и разные. И это тоже очень важно. Между атомами углерода и водорода разница в электроотрицательности настолько мала, что смещение электронов там незаметно. Например, молекулы углеводородов, состоящие только из атомов C и H, в силу этого полностью неполярны, никаких частичных зарядов, которые хоть на что-то влияли бы, в них нет.
Теперь вспомним, что положительные и отрицательные электрические заряды, согласно закону Кулона, притягиваются друг к другу. Например, частично отрицательный атом кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул воды. В результате между водородом и кислородом возникают нековалентные связи, основанные на электростатическом притяжении, — они называются водородными.
Это очень слабые связи, в жидкой воде они легко образуются и так же легко рвутся при движениях молекул.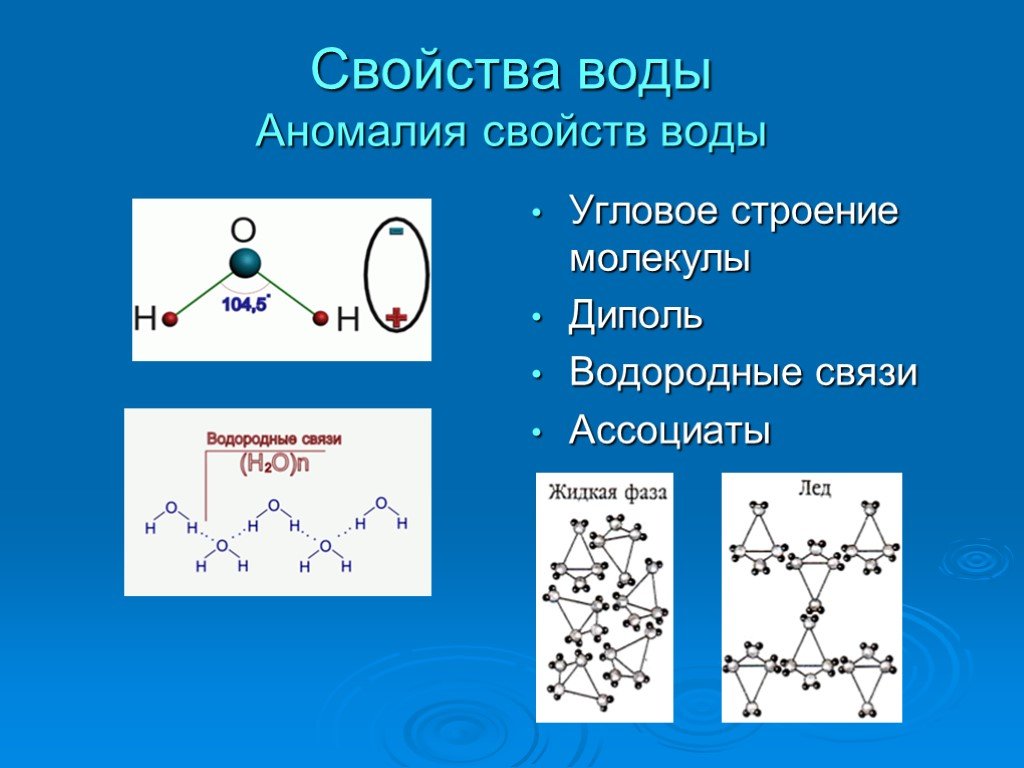 Но, несмотря на то, что водородные связи гораздо слабее ковалентных, они дают сильный эффект, если их много.
Но, несмотря на то, что водородные связи гораздо слабее ковалентных, они дают сильный эффект, если их много.
А в воде их очень много. Например, именно из-за колоссального количества водородных связей у воды исключительно высокая теплоемкость — ее трудно нагреть и трудно остудить. Большинство особенностей воды так или иначе связано с тем, что ее молекулы очень хорошо образуют водородные связи.
«Водородная связь чем-то напоминает любовь втроем», — писал в своем известном университетском учебнике американский биохимик Люберт Страйер. Он имел в виду, что в водородной связи атом водорода связан сразу с двумя атомами кислорода: с одним ковалентно (и прочно), а с другим электростатически (и слабо). Чтобы образовать водородную связь, атом водорода обязательно должен уже состоять в ковалентной связи с другим атомом, причем значительно отличающимся от него по электроотрицательности.
Водородные связи важны не только с точки зрения свойств воды. Они много где встречаются. Например, в главе 9 мы увидим, что без водородных связей невозможно представить себе структуру молекулы ДНК, от которой зависит хранение наследственной информации.
Любовь и ненависть воды
Любое вещество, растворенное в воде, так или иначе взаимодействует с ней, и способ этого взаимодействия зависит прежде всего от электрических свойств молекул. Например, если растворить в воде поваренную соль (NaCl), она распадется на положительно заряженные ионы натрия (Na+) и отрицательно заряженные ионы хлора (Cl–). При этом к ионам натрия молекулы воды «прилипнут» своими атомами кислорода (несущими маленький отрицательный заряд δ–), а к ионам хлора — атомами водорода (несущими маленький положительный заряд δ+). В результате и те и другие ионы получат оболочку, состоящую из молекул воды (см. рис. 3). Образование таких оболочек называется гидратацией. Ионы натрия и хлора находятся в воде в гидратированном состоянии. Гидратация — процесс, сопутствующий растворению в воде любого вещества (если оно вообще в ней растворимо, конечно).
Молекулы, в которых много ковалентных полярных связей, тоже прекрасно взаимодействуют с водой — в первую очередь потому, что образуют с ней водородные связи, «цепляясь» за молекулы воды своими частичными зарядами. Такие вещества хорошо растворяются в воде и называются гидрофильными («любящими воду»). К гидрофильным веществам относятся, например, спирты и углеводы. Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте — основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.
Такие вещества хорошо растворяются в воде и называются гидрофильными («любящими воду»). К гидрофильным веществам относятся, например, спирты и углеводы. Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте — основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.
Правда, рецепта водки Менделеев, вопреки распространенной легенде, не разрабатывал. Его интересовало происходящее при растворении взаимодействие молекул спирта и воды — тот самый процесс, который мы только что назвали гидратацией.
Менделеев убедительно показал, что растворение — это не физическое явление (простое смешивание), а химическое (включающее образование новых межмолекулярных связей). Тогда получается, что раствор — это, по сути, новое вещество.
Как правило, любое наугад взятое органическое соединение будет растворяться в воде тем лучше, чем больше в нем атомов кислорода. Это понятно: именно вокруг атомов кислорода обычно образуются водородные связи. Например, молекула глюкозы (C6H12O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Это понятно: именно вокруг атомов кислорода обычно образуются водородные связи. Например, молекула глюкозы (C6H12O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Молекулы, в которых все связи неполярные, взаимодействуют с водой гораздо слабее, чем друг с другом. Вещества, состоящие из таких молекул, плохо растворяются в воде и называются гидрофобными («боящимися воды»). Типичные гидрофобные соединения — углеводороды. Как мы знаем, они по определению состоят только из углерода и водорода, связи между которыми неполярны. Если бросить в воду парафин (смесь твердых углеводородов, из которой делают свечи), он и не подумает там растворяться — ни при каких условиях.
А если налить в воду бензин (смесь жидких углеводородов, которая служит моторным топливом), то он, скорее всего, отслоится от нее, образовав четкую поверхность раздела.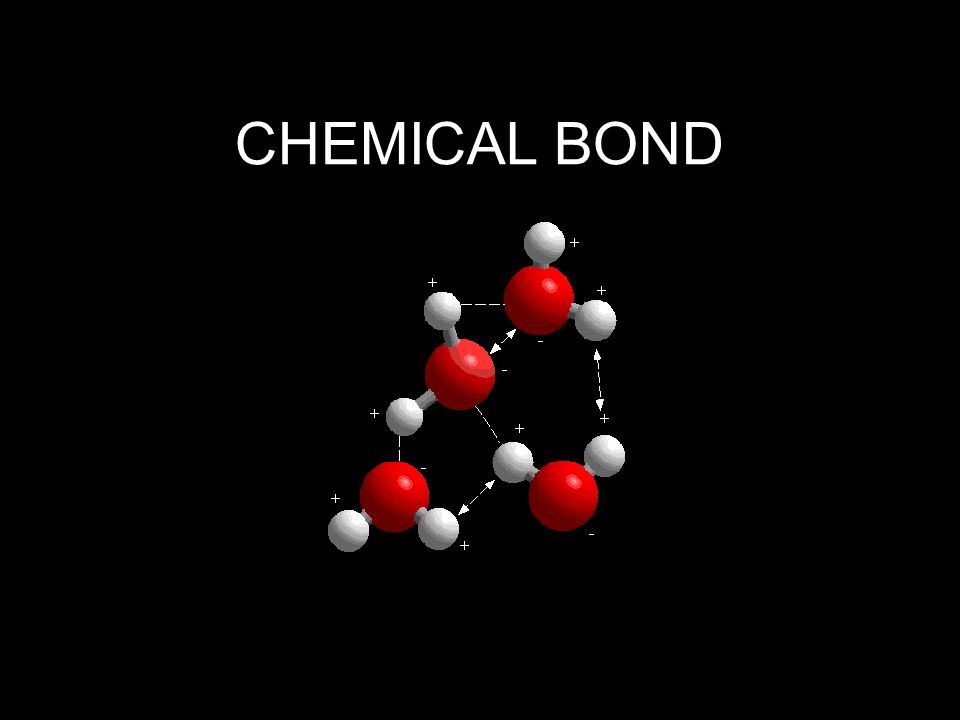 Вода как бы «выталкивает» эти вещества.
Вода как бы «выталкивает» эти вещества.
Если в формуле органического соединения есть кислород, то оно, скорее всего, гидрофильное, разве что там присутствует какая-нибудь совсем уж огромная углеводородная цепочка.
Гидрофильными бывают и некоторые бескислородные органические вещества — например, амины. В биохимии значение различий между гидрофильными и гидрофобными веществами без преувеличения грандиозно. Многие детали устройства клеток без учета этих различий просто невозможно понять. А все потому, что земная жизнь — водная.
Талассогены
А могут ли подойти для жизни какие-нибудь другие растворители, кроме воды? Ответ — да. Например, углекислота (ее формула O=C=O, или просто CO2) знакома людям прежде всего в виде углекислого газа, который мы выдыхаем, но она может и замерзать, образуя так называемый сухой лед. Проблема в том, что при нагревании в условиях, характерных для Земли, сухой лед сразу испаряется в газ, минуя жидкую фазу. Потому мы и не видим в быту жидкой углекислоты.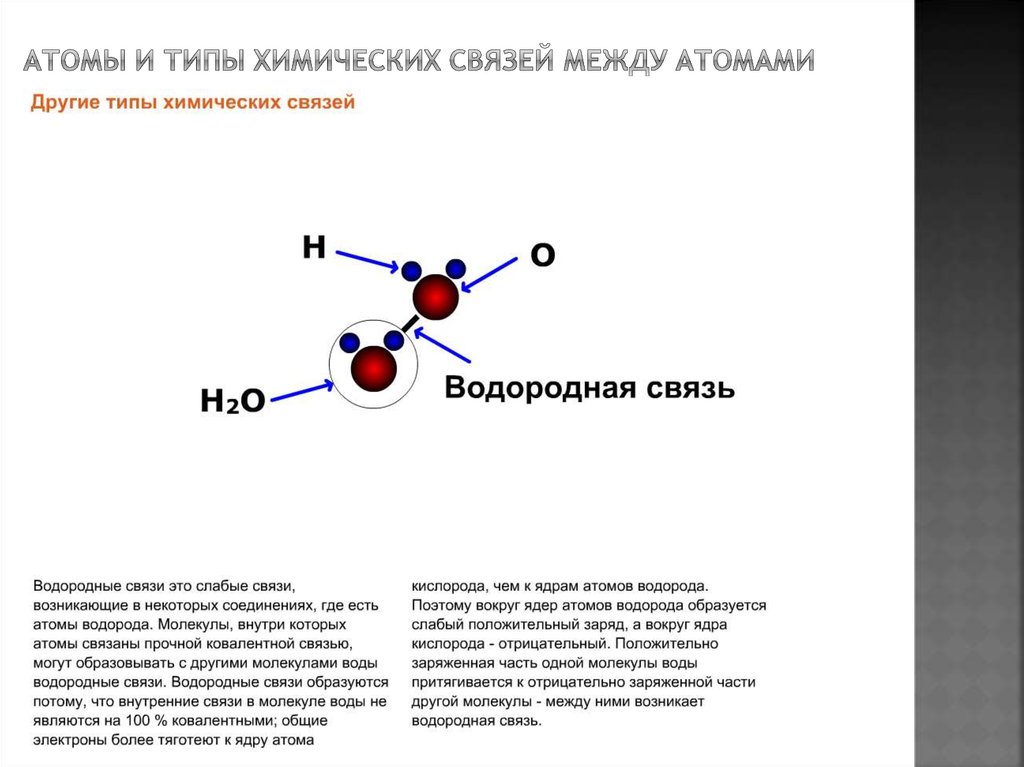 Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.
Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.
В этом растворителе могут жить даже земные микробы. Например, на дне Окинавского желоба в Восточно-Китайском море исследователи-океанологи нашли целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии.
Некоторые исследователи считают, что океаны жидкой углекислоты могут существовать на так называемых суперземлях — планетах с массой, в несколько раз превосходящей массу Земли. Суперземли — довольно многочисленная категория экзопланет, и возможность жизни на них сейчас активно обсуждается.
Другой перспективный кандидат на роль вмещающей среды для жизни — аммиак (NH3). Это гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом (их разница в электроотрицательности для этого вполне достаточна, см. рис. 2). Неудивительно, что по своим физико-химическим свойствам аммиак напоминает воду. На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
рис. 2). Неудивительно, что по своим физико-химическим свойствам аммиак напоминает воду. На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
Просто так уж сложилось, что на нашей планете из всех растворителей преобладает вода, ну а от добра добра не ищут, и земной жизни осталось лишь развиваться в этих относительно благоприятных условиях.
Еще один гидрофильный растворитель, в котором теоретически допускают возможность жизни, — метиловый спирт, или метанол (CH3OH). Для человека это страшный яд, но тут все зависит от настройки биохимических систем.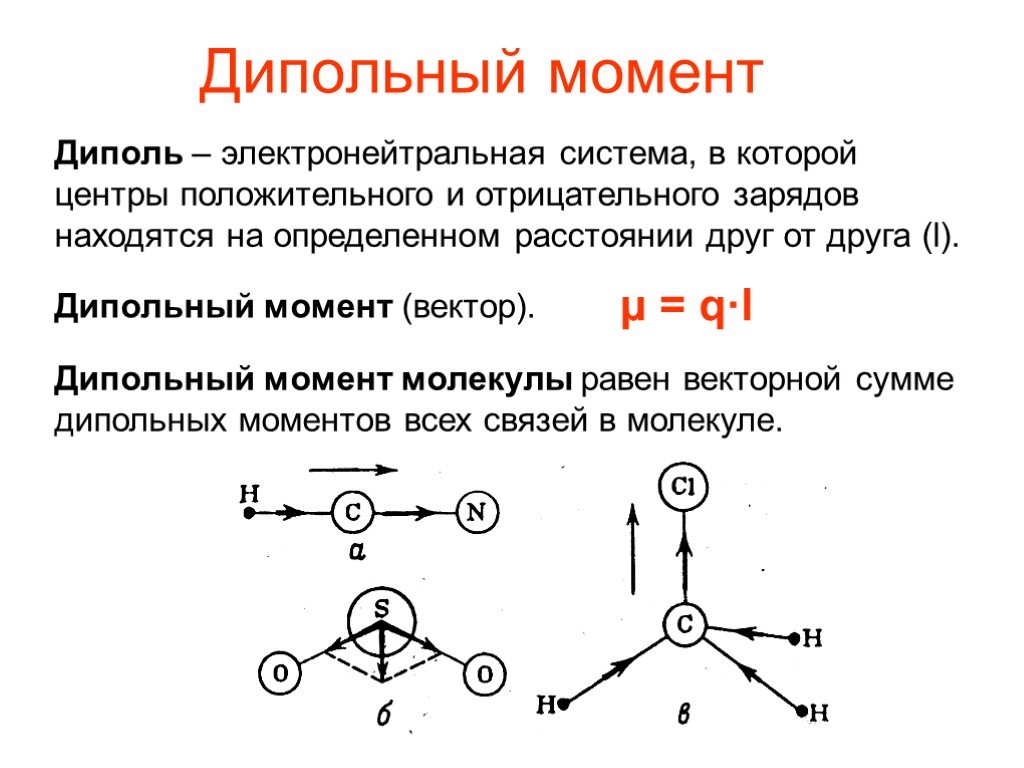 Вообще-то никакие законы природы не мешают «сконструировать» живой организм, для которого метанол будет совершенно безобиден, а то и полезен. Метанол — одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Земля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Вообще-то никакие законы природы не мешают «сконструировать» живой организм, для которого метанол будет совершенно безобиден, а то и полезен. Метанол — одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Земля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Наконец, еще один кандидат на роль подходящего для жизни гидрофильного растворителя — сероводород, соединение водорода и серы с формулой H2S (она же H–S–H).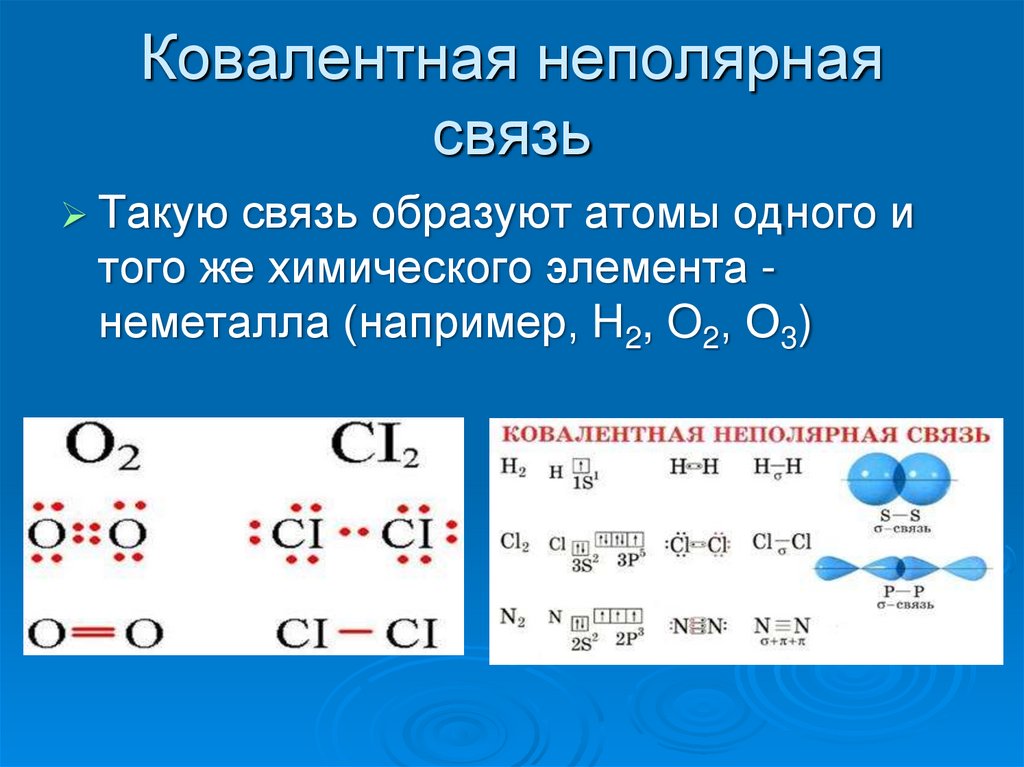 Молекула сероводорода очень похожа на молекулу воды. Правда, водородные связи она образует несколько хуже. В Солнечной системе сероводорода много на Ио — спутнике Юпитера, который отличается невероятной геологической активностью. Поверхность Ио покрыта вулканами, выбрасывающими фонтаны лавы, а состоит эта лава в основном из разнообразных соединений серы, которые текут и застывают, ибо в системе Юпитера очень холодно. Ио — это настоящий «мир льда и пламени».
Молекула сероводорода очень похожа на молекулу воды. Правда, водородные связи она образует несколько хуже. В Солнечной системе сероводорода много на Ио — спутнике Юпитера, который отличается невероятной геологической активностью. Поверхность Ио покрыта вулканами, выбрасывающими фонтаны лавы, а состоит эта лава в основном из разнообразных соединений серы, которые текут и застывают, ибо в системе Юпитера очень холодно. Ио — это настоящий «мир льда и пламени».
Если бы на Ио была жизнь, она вполне могла бы быть основана на сероводороде, точно так же, как земная жизнь — на воде.
А может ли среда для жизни оказаться не гидрофильной, а гидрофобной? Исключить такое в принципе нельзя. Например, на крупнейшем спутнике Сатурна — Титане — есть углеводородные озера и даже моря, состоящие из метана (CH4), этана (C2H6) и пропана (C3H8). Это настоящий гидрофобный растворитель, в котором некоторые ученые допускают существование жизни, хотя прямых подтверждений этому пока что нет. Жидкой воды на поверхности Титана не бывает, там слишком холодно.
Жидкой воды на поверхности Титана не бывает, там слишком холодно.
В целом, однако, сейчас кажется более вероятным, что главный растворитель для внеземной жизни окажется гидрофильным (но не обязательно водой). Во-первых, гидрофильных растворителей в природе просто больше. А во-вторых, все известные биохимические механизмы слишком уж сильно «заточены» под гидрофильную среду. Биохимию на гидрофобной основе вообразить гораздо труднее.
Из совсем уж экзотических альтернатив воде можно назвать, к примеру, фтороводород (HF, «аш-фтор»). Водный раствор фтороводорода — очень агрессивное вещество, которое называется плавиковой кислотой (в сериале «Во все тяжкие», главный герой которого — химик, ставший преступником, этой кислотой растворяют трупы). Однако многие органические молекулы, например углеводороды, в ней совершенно стабильны. К тому же фтороводород прекрасно образует водородные связи, а это, как мы уже знаем, очень важное для растворителя свойство. Возможность фтороводородной жизни допускали некоторые ученые, например астроном Карл Саган. А в фантастической повести Ивана Ефремова «Сердце
Змеи» описана планета с фтороводородным океаном и дышащими фтором разумными жителями, с которыми земляне вступают в контакт. «Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…»
А в фантастической повести Ивана Ефремова «Сердце
Змеи» описана планета с фтороводородным океаном и дышащими фтором разумными жителями, с которыми земляне вступают в контакт. «Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…»
Великий популяризатор науки Айзек Азимов — кстати говоря, биохимик по научной специальности — не раз задумывался над тем, из каких веществ могли бы образоваться океаны на других планетах. Он назвал такие вещества термином «талассогены», что буквально значит «производящие море». По определению Азимова, талассоген — это вещество, способное сформировать планетарный океан. В замечательной книге «Асимметрия жизни» Азимов подробно разбирает проблему океанов, приходя к выводу, что самые вероятные талассогены — это вода, аммиак и метан. При этом для планет, расположенных примерно на таком расстоянии от звезд, как Земля, вода имеет преимущество, потому что она остается жидкой при более высокой температуре.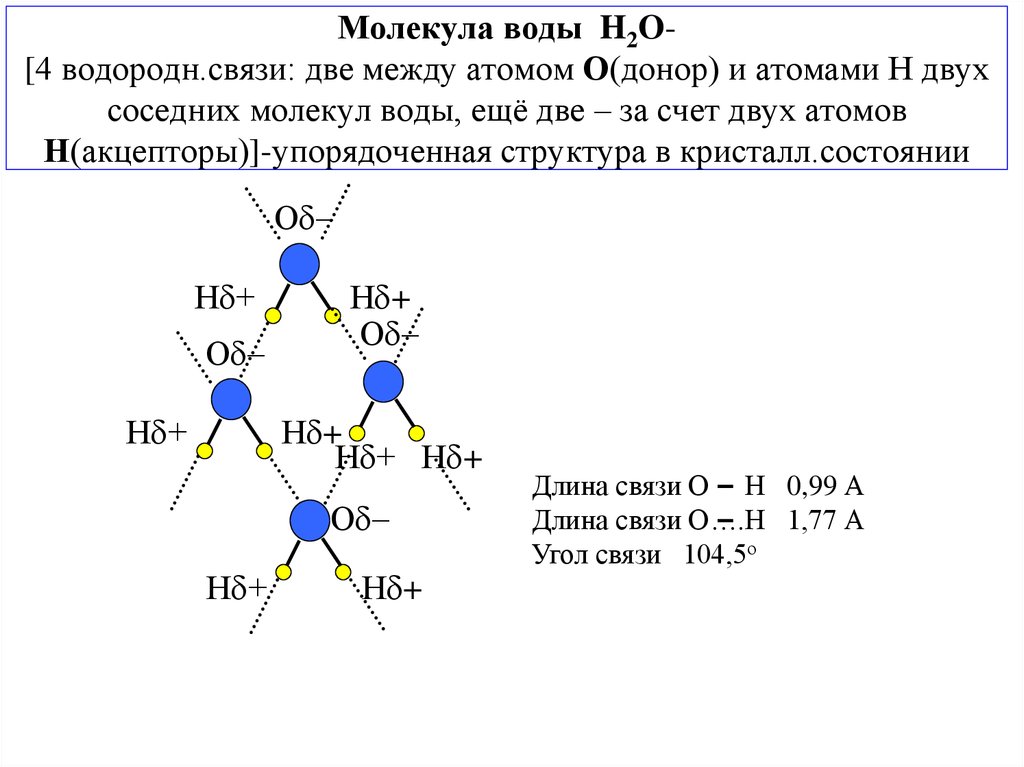 «Вы можете представить метановые океаны на такой планете, как Нептун, или аммиачные океаны на планете типа Юпитера, однако вода, и только вода может создать океан на внутренней планете вроде Земли». Это выглядит логичным, но тут есть по меньшей мере один важный нюанс. Азимов писал эту книгу больше 40 лет назад, когда о планетах других звездных систем не было известно совершенно ничего. Не было даже уверенности, что они вообще существуют. А сейчас астрономам известны тысячи экзопланет, и уже ясно, что, мягко говоря, далеко не все звездные системы похожи на Солнечную. Сочетания условий там могут быть совершенно другими. Поэтому от расширения списка возможных вариантов вреда, скорее всего, не будет.
«Вы можете представить метановые океаны на такой планете, как Нептун, или аммиачные океаны на планете типа Юпитера, однако вода, и только вода может создать океан на внутренней планете вроде Земли». Это выглядит логичным, но тут есть по меньшей мере один важный нюанс. Азимов писал эту книгу больше 40 лет назад, когда о планетах других звездных систем не было известно совершенно ничего. Не было даже уверенности, что они вообще существуют. А сейчас астрономам известны тысячи экзопланет, и уже ясно, что, мягко говоря, далеко не все звездные системы похожи на Солнечную. Сочетания условий там могут быть совершенно другими. Поэтому от расширения списка возможных вариантов вреда, скорее всего, не будет.
Возвращаясь к земной (а вернее, водной) биохимии, будем иметь в виду, что она не единственная теоретически возможная. Изучая природу, всегда полезно помнить любимую мысль Станислава Лема: «Среди звезд нас ждет Неизвестное».
Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс.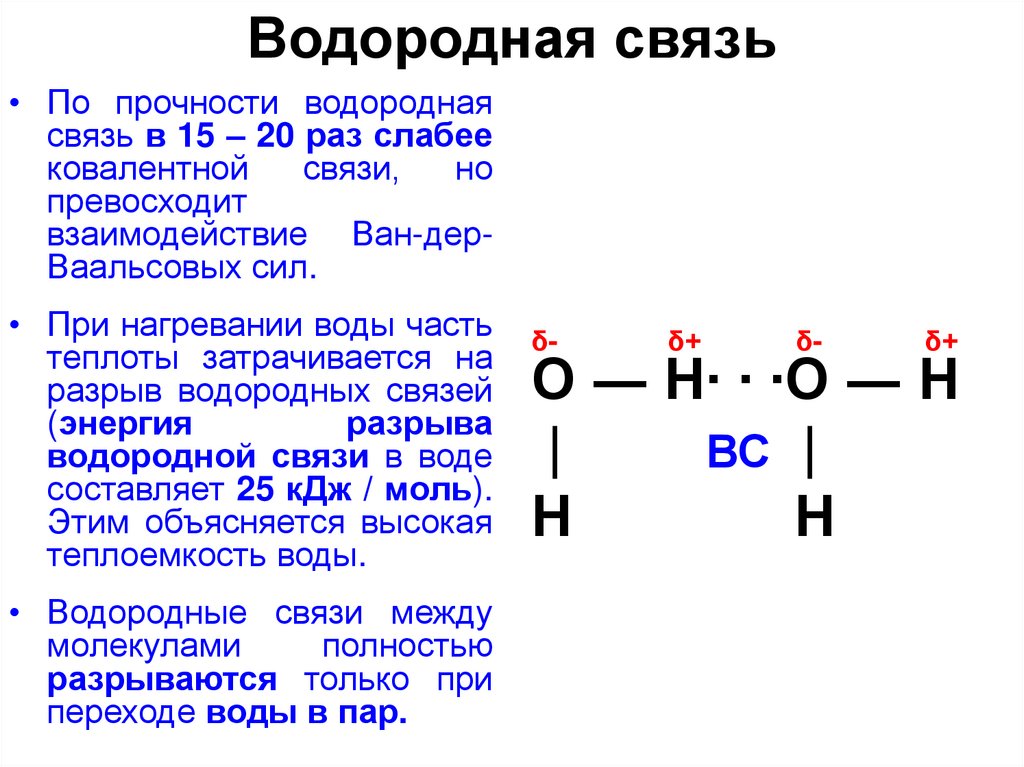 Новостей и читайте нас чаще.
Новостей и читайте нас чаще.
Подписывайтесь на Indicator.Ru в соцсетях: Facebook, ВКонтакте, Twitter, Telegram, Одноклассники.
15.1: Структура воды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53837
В своей известной поэме «Сказание о древнем мореплавателе» Сэмюэл Кольридж написал: «Вода, везде вода, ни капли для питья». Кольридж говорил о том, что он был в океане, но у него не было воды, потому что он убил альбатроса (очевидно, это принесло несчастье всем на корабле). Около \(75\%\) поверхности Земли покрыто водой. Основной составной частью человеческого тела (более \(60\%\)) является вода. Эта простая молекула играет важную роль во всех видах процессов.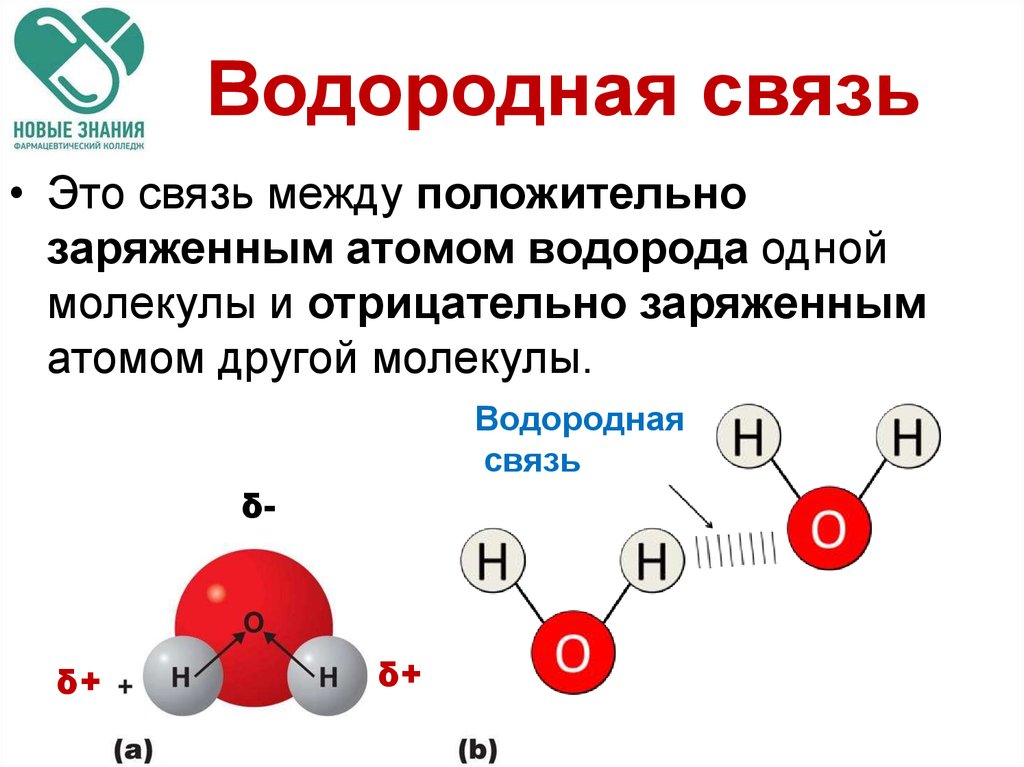 \text{o}\), что немного меньше идеального \(1093\) гибридная атомная орбиталь.
\text{o}\), что немного меньше идеального \(1093\) гибридная атомная орбиталь.
Изогнутая форма молекулы воды имеет решающее значение, поскольку полярные связи \(\ce{O-H}\) не компенсируют друг друга, а молекула в целом полярна. На рисунке ниже показана чистая полярность молекулы воды. Кислород — отрицательный конец молекулы, а область между атомами водорода — положительный конец молекулы.
Рисунок \(\PageIndex{2}\): Вода является полярной молекулой, так как большая электронная плотность находится вокруг более электроотрицательного атома кислорода. Полярные молекулы притягиваются друг к другу диполь-дипольными силами, так как положительный конец одной молекулы притягивается к отрицательному концу соседней молекулы. В случае воды высокополярные связи \(\ce{O-H}\) приводят к очень малой электронной плотности вокруг атомов водорода.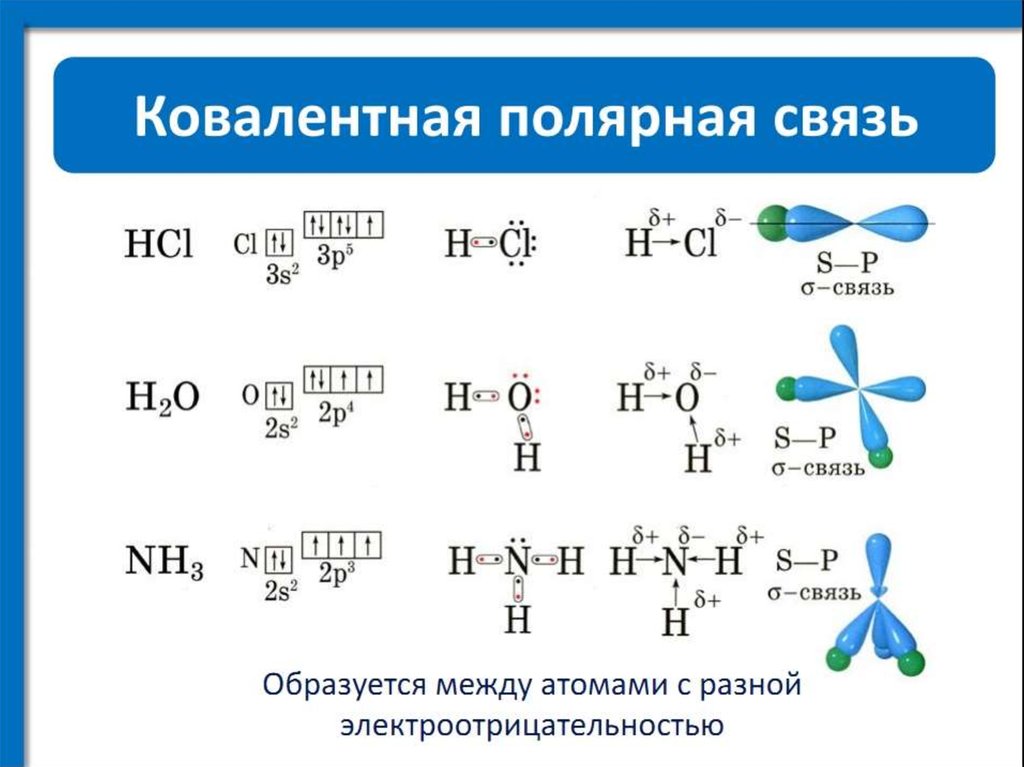 Каждый атом водорода сильно притягивается к неподеленной паре электронов соседнего атома кислорода. Они называются водородными связями и сильнее, чем обычные диполь-дипольные силы.
Каждый атом водорода сильно притягивается к неподеленной паре электронов соседнего атома кислорода. Они называются водородными связями и сильнее, чем обычные диполь-дипольные силы.
Поскольку каждый атом кислорода имеет две неподеленные пары, он может образовывать водородные связи с атомами водорода двух отдельных других молекул. На рисунке ниже показан результат — приблизительно тетраэдрическая геометрия вокруг каждого атома кислорода, состоящая из двух ковалентных связей и двух водородных связей.
Рисунок \(\PageIndex{4}\): В результате наличия двух ковалентных связей и двух водородных связей геометрия вокруг каждого атома кислорода приблизительно тетраэдрическая.Резюме
- Вода представляет собой молекулярное соединение, состоящее из полярных молекул изогнутой формы.
- Атом кислорода приобретает частичный отрицательный заряд, а атом водорода приобретает частичный положительный заряд.

Эта страница под названием 15.1: Структура воды распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд CK-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
Типы ковалентных связей: полярные и неполярные
Название
Типы ковалентных связей: полярные и неполярные
Тело
Электроны распределяются по-разному в ионных и ковалентных связях. Ковалентные связи могут быть неполярными или полярными и реагировать на электростатические заряды.
Ионные связи , как и в поваренной соли (NaCl), обусловлены электростатическими силами притяжения между их положительно (Na+) и отрицательно заряженными (Cl-) ионами. Во втором блоке мы сравнили атомы со щенками, а электроны с костями в нашей аналогии того, как работает связь. При ионной связи каждый щенок начинает с электронной кости, но один щенок действует как вор и крадет кость другого щенка (см. рис. 3-1а). Теперь у одного щенка две электронные кости, а у другого щенка нет ни одной. Поскольку электронные кости в нашей аналогии имеют отрицательный заряд, щенок-вор становится отрицательно заряженным из-за дополнительной кости. Щенок, потерявший свою электронную кость, становится положительно заряженным. Поскольку щенок, потерявший кость, имеет заряд, противоположный заряду щенка-вора, щенки удерживаются вместе электростатическими силами, точно так же, как ионы натрия и хлорида!
рис. 3-1а). Теперь у одного щенка две электронные кости, а у другого щенка нет ни одной. Поскольку электронные кости в нашей аналогии имеют отрицательный заряд, щенок-вор становится отрицательно заряженным из-за дополнительной кости. Щенок, потерявший свою электронную кость, становится положительно заряженным. Поскольку щенок, потерявший кость, имеет заряд, противоположный заряду щенка-вора, щенки удерживаются вместе электростатическими силами, точно так же, как ионы натрия и хлорида!
В ковалентных связях , таких как газообразный хлор (Cl2), оба атома разделяют и крепко удерживают электроны друг друга. В нашей аналогии каждый щенок снова начинает с электронной кости. Однако вместо того, чтобы один щенок воровал кость другого, оба щенка держатся за обе кости (см. рис. 3-1b).
Некоторые ковалентно связанные молекулы, такие как газообразный хлор (Cl2), поровну делят свои электроны (как два одинаково сильных щенка, каждый из которых держит обе кости). Другие ковалентно связанные молекулы, такие как газообразный фтористый водород (HF), не делят электроны поровну. Атом фтора действует как немного более сильный щенок, который немного сильнее притягивает общие электроны (см. рис. 3-1c). Несмотря на то, что электроны во фтористом водороде являются общими, фтористая сторона молекулы воды сильнее притягивает отрицательно заряженные общие электроны и становится отрицательно заряженной. Атом водорода имеет небольшой положительный заряд, потому что он не может так крепко держаться за отрицательные электронные кости. Ковалентные молекулы с таким типом неравномерного распределения заряда полярный . Молекулы с полярными ковалентными связями имеют положительную и отрицательную стороны.
Другие ковалентно связанные молекулы, такие как газообразный фтористый водород (HF), не делят электроны поровну. Атом фтора действует как немного более сильный щенок, который немного сильнее притягивает общие электроны (см. рис. 3-1c). Несмотря на то, что электроны во фтористом водороде являются общими, фтористая сторона молекулы воды сильнее притягивает отрицательно заряженные общие электроны и становится отрицательно заряженной. Атом водорода имеет небольшой положительный заряд, потому что он не может так крепко держаться за отрицательные электронные кости. Ковалентные молекулы с таким типом неравномерного распределения заряда полярный . Молекулы с полярными ковалентными связями имеют положительную и отрицательную стороны.
Изображение
Подпись к изображению
а. Аналогия с ионной связью. У щенка-вора есть обе кости (то есть оба электрона). Другой щенок потерял свою кость (электрон). Щенки удерживаются вместе из-за электростатической силы, вызванной разницей их зарядов.
Авторские права и источник изображения
ImageSource
Изображение
Подпись к изображению
б. Аналогия неполярной ковалентной связи. Оба щенка одинаково держат обе кости. Ни у одного из щенков нет заряда; они нейтральны.
Авторские права и источник изображения
ImageSource
Изображение
Подпись к изображению
c. Аналогия полярной ковалентной связи. Один щенок может больше тянуть кости, но оба щенка все еще держат обе кости.
Авторское право на изображение и источник
Источник изображения
Вода представляет собой полярную ковалентную молекулу
Вода (h3O), как и фтористый водород (HF), представляет собой полярную ковалентную молекулу. Когда вы посмотрите на диаграмму воды (см. рис. 3-2), вы увидите, что два атома водорода неравномерно распределены вокруг атома кислорода. Неравное распределение электронов между атомами и несимметричная форма молекулы означает, что молекула воды имеет два полюса — положительный заряд на полюсе водорода (сбоку) и отрицательный заряд на полюсе кислорода (сбоку). Мы говорим, что молекула воды электрически полярна.
Мы говорим, что молекула воды электрически полярна.
Изображение
а.
Изображение
б.
Изображение
с.
Изображение
д.
Рис.0029 Различные способы представления полярного распределения электронов в молекуле воды. На каждой диаграмме показана несимметричная форма молекулы воды. На (а) и (б) полярные ковалентные связи показаны линиями. В части (c) полярные ковалентные связи показаны в виде электронных точек, общих для атомов кислорода и водорода. В части (d) на диаграмме показаны относительные размеры атомов, а связи представлены касанием атомов.Активность
Полярная ковалентная связь водорода и кислорода в воде приводит к интересному поведению.
Ориентация молекулы
Рис. 3-4. Изгиб струи воды из-за электростатической силы, возникающей при трении пластмассовой расческой о сухие волосы.
3-4. Изгиб струи воды из-за электростатической силы, возникающей при трении пластмассовой расческой о сухие волосы.
Фото: Канеса Серафин
Вода притягивается положительными и отрицательными электростатическими силами, потому что жидкие полярные ковалентные молекулы воды способны перемещаться, поэтому они могут ориентироваться в присутствии электростатической силы. (см. рис. 3-4).
Эти силы можно наблюдать в следующем видео:
Рис. 3-5: Молекулы воды обычно ориентированы случайным образом (слева), если только они не ориентируются в присутствии электростатической силы (справа).
Хотя мы не можем видеть отдельные молекулы, из наших наблюдений мы можем сделать вывод, что в присутствии отрицательного заряда молекулы воды поворачиваются так, что их положительные водородные полюса обращены к отрицательно заряженному объекту. То же самое было бы верно в присутствии положительно заряженного объекта; молекулы воды поворачиваются так, что отрицательные полюса кислорода обращены к положительному объекту. См. рис. 3-5 для интерпретации художника.
То же самое было бы верно в присутствии положительно заряженного объекта; молекулы воды поворачиваются так, что отрицательные полюса кислорода обращены к положительному объекту. См. рис. 3-5 для интерпретации художника.
Симметрия и асимметрия
Помните, что в полярной молекуле притяжение одного атома сильнее, чем притяжение другого. Полярные ковалентные молекулы существуют всякий раз, когда существует асимметрия или неравномерное распределение электронов в молекуле. Один или несколько из этих асимметричных атомов притягивают электроны сильнее, чем другие атомы. Например, полярное соединение метиловый спирт имеет отрицательный полюс, состоящий из углерода и водорода, и положительный полюс, состоящий из кислорода и водорода (см. рис. 3-6).
Рис. 3-6: Полярные молекулы (вверху) и неполярные молекулы (внизу). Обратите внимание, что диоксид углерода имеет две ковалентные связи между каждым атомом кислорода и атомом углерода, которые показаны здесь двумя линиями и называются двойной связью.

 В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно.
В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно.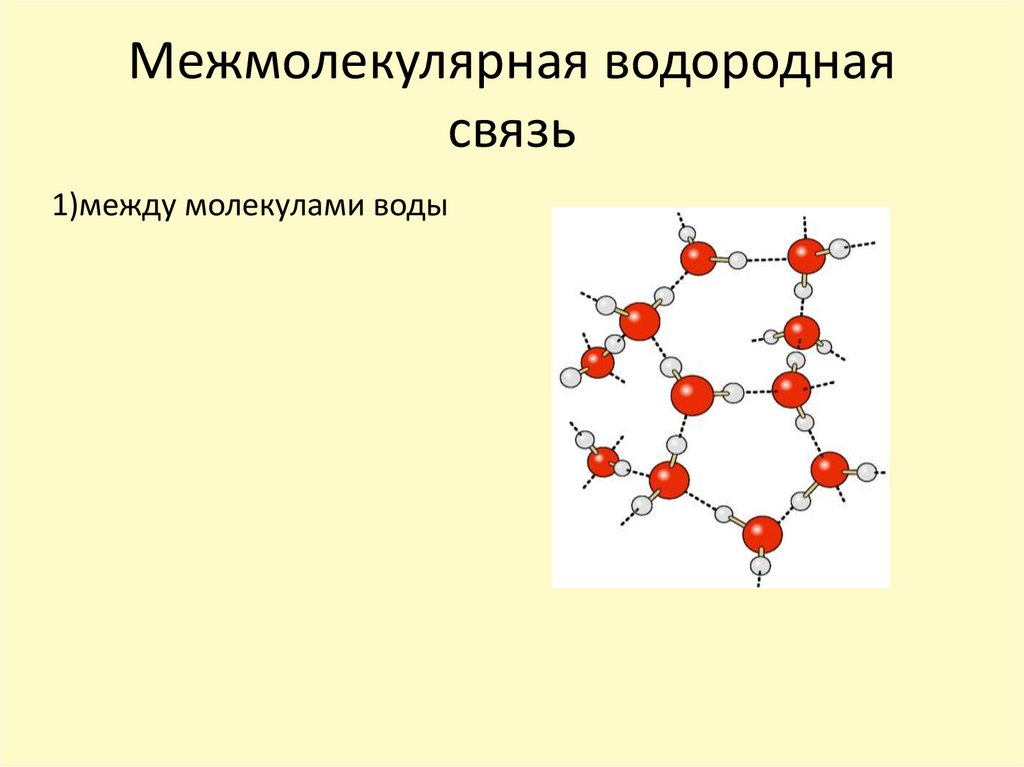
Leave A Comment