СУНЦ УрФУ
Расписание
Электронный журнал
Поступающим
Олимпиады, турниры, конкурсы
Планы работы
Подготовительные курсы
Новости:
26.03.2023
Рыбы, амфибии, рептилии…
В весенние каникулы в СУНЦ прошел практикум по зоологии позвоночных животных.
23.03.2023
Лицеисты-биологи в «Сириусе»
В образовательном центре «Сириус» проходит мартовская образовательная программа по биологии.
22.03.2023
«Февромарт» в общежитии
В общежитии традиционно «Битвой века» отметили День защитника Отечества и 8 Марта.
13.03.2023
Мы и гвозди забивать умеем!
Команда СУНЦ УрФУ победила в студенческих инженерных соревнованиях.
10.03.2023
Успех на региональном этапе
Учащиеся СУНЦ УрФУ получили 330 дипломов победителей и призеров регионального этапа Всероссийской олимпиады школьников.
08.03.2023
«Ты — женщина, и этим ты права…»
6 марта в СУНЦ состоялся концерт, посвящённый Международному женскому дню.
Больше новостей
Видеогалерея:
Мужчины СУНЦ о 8 Марта (2023)
Концерт к 8 Марта (2023)
Поздравление с Днем защитника Отечества (2023)
Больше видео
О нас:
Специализированный учебно-научный центр (СУНЦ) — структурное подразделение ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина», созданное в 1990 году как нетиповое структурное подразделение вуза, осуществляющее углубленное дифференцированное обучение по программам основного общего и среднего общего образования. Всего в России 10 СУНЦев. До мая 2011 года СУНЦ работал в составе Уральского государственного университета имени А. М. Горького (УрГУ).
В настоящее время СУНЦ имеет в своем составе 8 кафедр, укомплектованных профессорско-преподавательским составом УрФУ и учителями. Обучение производится по авторским программам, разработанным в соответствии с федеральными государственными образовательными стандартами; в составе СУНЦ — 8–11 классы различных профилей.
Иногородние обучающиеся проживают в уютном общежитии.
Прием производится в 8, 9, 10 и 11 классы. Работают подготовительные курсы.
Подробнее о правилах приема в СУНЦ можно узнать в отделе конкурсного отбора
по телефону +7 343 367-82-22 и в разделе нашего сайта «Поступающим».
Как нас найти:
Данилы Зверева ул., 30, Екатеринбург. N56°52´4˝ E60°39´16˝
Проезд:
- автобусами № 48, 52, 81 до остановки «Фирма Авангард»;
- автобусами № 28, 58 до остановки «Данилы Зверева», далее 7 минут пешком по улице Данилы Зверева;
- троллейбусом № 18 до остановки «Данилы Зверева», далее 14 минут пешком по улицам Сулимова, Данилы Зверева;
- троллейбусами № 4 до остановки «Сулимова», № 19, 32 до остановки «Боровая», далее 15 минут пешком по улицам Боровая, Вилонова, Данилы Зверева.
Химия. Для школьников старших классов и поступающих в вузы
Химия. Для школьников старших классов и поступающих в вузы
ОглавлениеВВЕДЕНИЕГлава I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ § 1. Предмет химии. Важнейшие понятия и законы химии Основные стехиометрические законы химии ЗАДАЧИ И УПРАЖНЕНИЯ § 2. Строение атома Электронные конфигурации атомов Ядро атома и радиоактивные превращения ЗАДАЧИ И УПРАЖНЕНИЯ § 3. 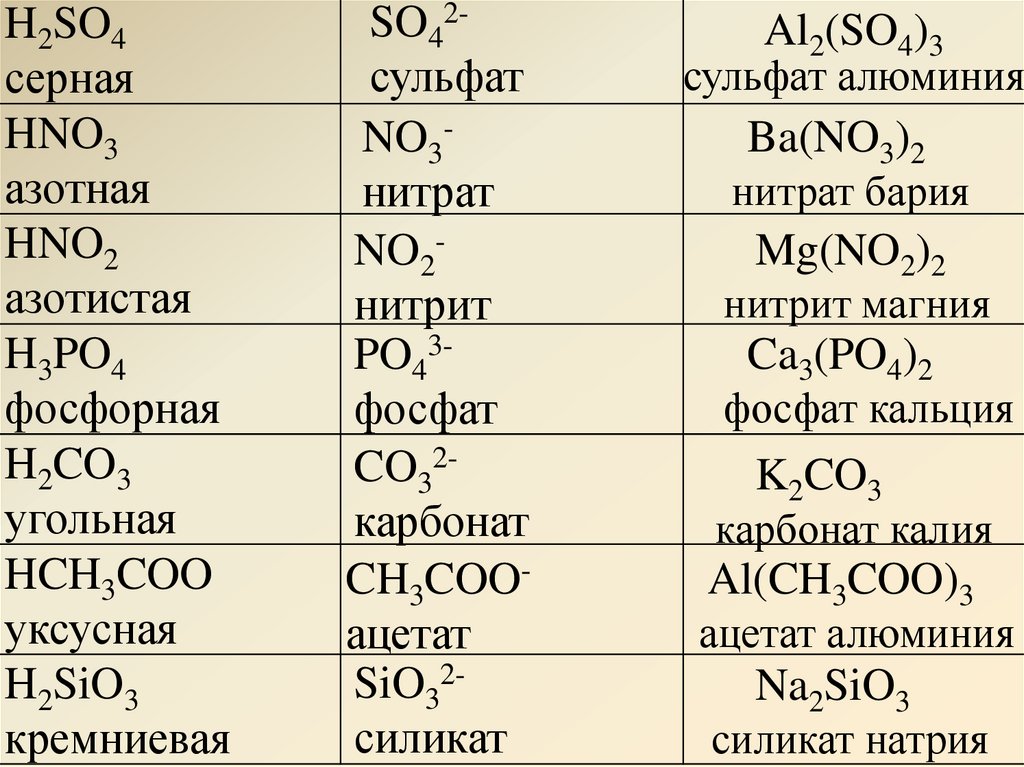 ЗАДАЧИ И УПРАЖНЕНИЯ § 4. Агрегатные состояния вещества Характерные свойства газов, жидкостей и твердых тел Газообразное состояние. Газовые законы ЗАДАЧИ И УПРАЖНЕНИЯ § 5. Закономерности протекания химических реакций Химическая кинетика Химическое равновесие ЗАДАЧИ И УПРАЖНЕНИЯ § 6. Растворы. Электролитическая диссоциация. Гидролиз солей Электролиты и электролитическая диссоциация Гидролиз солей ЗАДАЧИ И УПРАЖНЕНИЯ § 7. Классификация химических реакций. Окислительно-восстановительные процессы. Электролиз Окислительно-восстановительные реакции Электролиз ЗАДАЧИ И УПРАЖНЕНИЯ Глава II. НЕОРГАНИЧЕСКАЯ ХИМИЯ Оксиды Основания (гидроксиды металлов) Кислоты Соли § 9. Водород. Галогены и их соединения Галогены и их соединения ЗАДАЧИ И УПРАЖНЕНИЯ § 10. 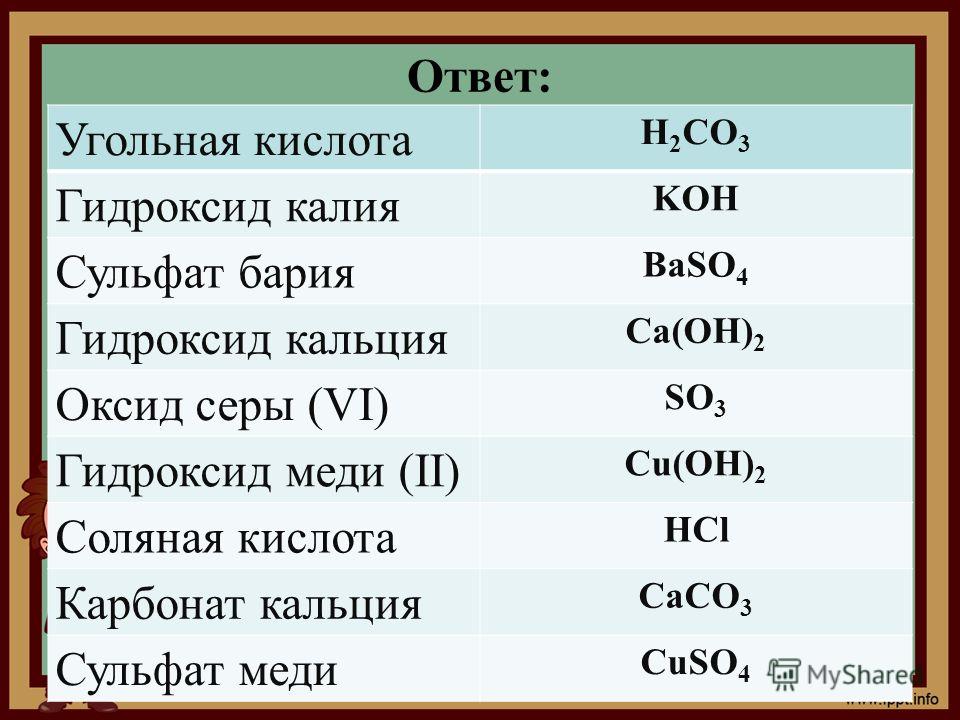 Подгруппа кислорода Подгруппа кислородаСера и ее соединения ЗАДАЧИ И УПРАЖНЕНИЯ § 11. Подгруппа азота Фосфор и его соединения ЗАДАЧИ И УПРАЖНЕНИЯ § 12. Подгруппа углерода Углерод и его соединения Кремний и его соединения ЗАДАЧИ И УПРАЖНЕНИЯ § 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений ЗАДАЧИ И УПРАЖНЕНИЯ § 14. Алюминий — типичный р-металл ЗАДАЧИ И УПРАЖНЕНИЯ § 15. Главные переходные металлы (d-элементы) и их соединения Химические свойства d-элементов ЗАДАЧИ И УПРАЖНЕНИЯ § 16. Задачи для повторения по неорганической химии Глава III. ОРГАНИЧЕСКАЯ ХИМИЯ § 17. Основные понятия и закономерности в органической химии. Предмет органической химии Классификация и номенклатура органических соединений Изомерия органических соединений Взаимное влияние атомов в молекуле и реакционная способность органических соединений Общая характеристика органических реакций ЗАДАЧИ И УПРАЖНЕНИЯ § 18.  Циклоалканы ЗАДАЧИ И УПРАЖНЕНИЯ § 19. Алкены. Диеновые углеводороды Диеновые углеводороды (алкадиены) ЗАДАЧИ И УПРАЖНЕНИЯ § 20. Алкины ЗАДАЧИ И УПРАЖНЕНИЯ § 21. Ароматические углеводороды (арены) ЗАДАЧИ И УПРАЖНЕНИЯ § 22. Спирты и фенолы Многоатомные спирты Фенолы ЗАДАЧИ И УПРАЖНЕНИЯ § 23. Карбонильные соединения — альдегиды и кетоны ЗАДАЧИ И УПРАЖНЕНИЯ § 24. Карбоновые кислоты. Сложные эфиры. Жиры Сложные эфиры. Жиры ЗАДАЧИ И УПРАЖНЕНИЯ Глава 4. ОСНОВНЫЕ ПРИЕМЫ РЕШЕНИЯ ЗАДАЧ Определение молекулярной формулы веществ Определение состава и разделение смесей Способы выражения концентрации растворов Ионные реакции в растворах Задачи на окислительно-восстановительные реакции Разные задачи ПРОГРАММА ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УНИВЕРСИТЕТЫ ОТВЕТЫ Рекомендуемая литература |
Видео с вопросами: расчет концентрации азотной кислоты путем титрования известным объемом гидроксида калия
30 мл раствора азотной кислоты титровали 0,1 М раствором гидроксида калия. Было обнаружено, что добавление 26,6 мл гидроксида калия нейтрализует азотную кислоту. Какая концентрация азотной кислоты? Дайте ответ с точностью до 2 знаков после запятой.
Было обнаружено, что добавление 26,6 мл гидроксида калия нейтрализует азотную кислоту. Какая концентрация азотной кислоты? Дайте ответ с точностью до 2 знаков после запятой.
Стенограмма видео
30-миллилитровый раствор азотной кислоту титровали 0,1-молярным раствором гидроксида калия. Добавление 26,6 миллилитров Было обнаружено, что гидроксид калия нейтрализует азотную кислоту. Какая концентрация у азотная кислота? Дайте ответ с точностью до двух знаков после запятой места.
Поскольку азотная кислота титровалась против
гидроксид калия, основание, происходит кислотно-основное титрование. Начнем с написания сбалансированного
уравнение реакции между азотной кислотой и гидроксидом калия. Азотная кислота HNO3 реагирует с
гидроксида калия, KOH, с образованием соли нитрата калия, KNO3 и воды. Уравнение уже
сбалансированный.
Мы пытаемся решить
концентрация кислоты. И нам дан его объем,
30 миллилитров. Для количества молей кислоты мы
можно использовать стехиометрический коэффициент из сбалансированного уравнения, который равен единице. Затем мы можем сделать то же самое для
другую часть уравнения и заполните концентрацию, объем и стехиометрический
коэффициент основания, гидроксид калия. Все, что делится на единицу,
сам. Следовательно, мы можем удалить
знаменатели. Затем мы можем сделать концентрацию
азотной кислоты на предмет, разделив обе части на 30 миллилитров.
Затем мы можем сделать концентрацию
азотной кислоты на предмет, разделив обе части на 30 миллилитров.
Если мы произведем расчет, единицы миллилитров отменяются, и мы остаемся с повторяющейся концентрацией 0,0886. молярный. Вопрос требует ответа на быть приведено к двум десятичным знакам. Следовательно, концентрация азотная кислота 0,09 мол.
Nagwa использует файлы cookie, чтобы обеспечить вам максимальное удобство на нашем веб-сайте. Узнайте больше о нашей Политике конфиденциальности.
Гидроксид калия + азотная кислота к нитрату калия + вода
Вопрос
Вопрос
PAPECIMEN PAPER 1-SECE II
21 видео. видео бина kisi ad ki rukaavat ke!
Обновлено на: 27-06-2022
लिखित उत्तर
Решение
KOH+HNO3 → KNO3+H3O
Шаг по шагам решения экспертов, чтобы помочь вам в вопросе сомнения и оценки.
Стенограмма
напишите следующие уравнения в равновесии их перед набором + азотная кислота вызывает давление селитры в воде для нее уравновешивает следующее уравнение гидроксид калия + азотная кислота давая начало нитрату калия в воде раньше было знать что такое неуравновешенное уравнение если равновесие уравнение эффективности, в котором объекты на стороне реагента равны, по крайней мере, они защищают из стороны в сторону это в символической форме первый гидроксид калия символ азотная кислота HNO3 дает нитрат калия и O3 плюс вода, которая представляет собой h3O
это уравнение символы количество реагентов и продуктов символы реагентов и продуктов символ первый это калий количество атомов калия слева внутри один и все продукты а также его 1 это справа один в тексте внутри снаружи но это количество атомов водорода это прямо здесь символ h буквы считать число один h3H есть два атома водорода чтобы Exide два атома водорода совершенный
нет прихода генетических элементов внутри 3 + 1 есть стороны и подходя к продуктам и трем водам в 74 Секторе 4, атомы азота внутри атомов азота, которые находятся вместе с их, и есть один атом на той стороне, что его пятая улица рядом с и вы можете заметить, что количество сущности на стороне реагента то есть торт был один это один человек они равны и даже атомы водорода равны
Любые другие предметы равны 4 и 4, а уравнение является балансом, потому что сущности на обеих сторонах уже лучше всего спасибо
संबंधित वीडियो
निम्न कथनों को 000
संबंधित वीडियो
निम्न कथनों र ासायनिक समीक समीक ुप ुप में प प निमшить क उन संतुलित संतुलित संतुलित संतुलित संतुलित संतुलित संतुलित संतुलित संतुलित संतुलित संतुलित संतुलित संतुलित संतुलित संतुलित पोटैशियम पोटैशियम पोटैशियम पोटैशियम पोटैशियम में में प o धातु जल स साथ अभिक्रिया करके पोटैशियम हाइड्रॉक्साइड एंव हाइड्रोजन गैस है।।।।।।।।।। है है है है है है है है है है है है
177256256
Переведите следующие утверждения в химические уравнения и сбалансируйте их.
Металлический калий реагирует с водой с образованием гидроксида калия и газообразного водорода.
380030031
Переведите следующие утверждения в химические уравнения и сбалансируйте их.
Металлический калий реагирует с водой с образованием гидроксида калия и газообразного водорода.
565379644
Переведите следующие утверждения в химические уравнения и сбалансируйте их:
Металлический калий реагирует с водой с образованием гидроксида калия и газообразного водорода.
571115838
Text Solution
Напишите сбалансированные молекулярные уравнения для следующего словесного уравнения: гидроксид меди + азотная кислота → нитрат меди + вода
643430625
Напишите сбалансированное уравнение для следующего: Получение азотной кислоты из нитрата калия.
643439710
निम्न कथनों को र समीक समीक000 के ूप अनुव अनुव क000
6435304441
निम्नांकित रास скон0003 643530520
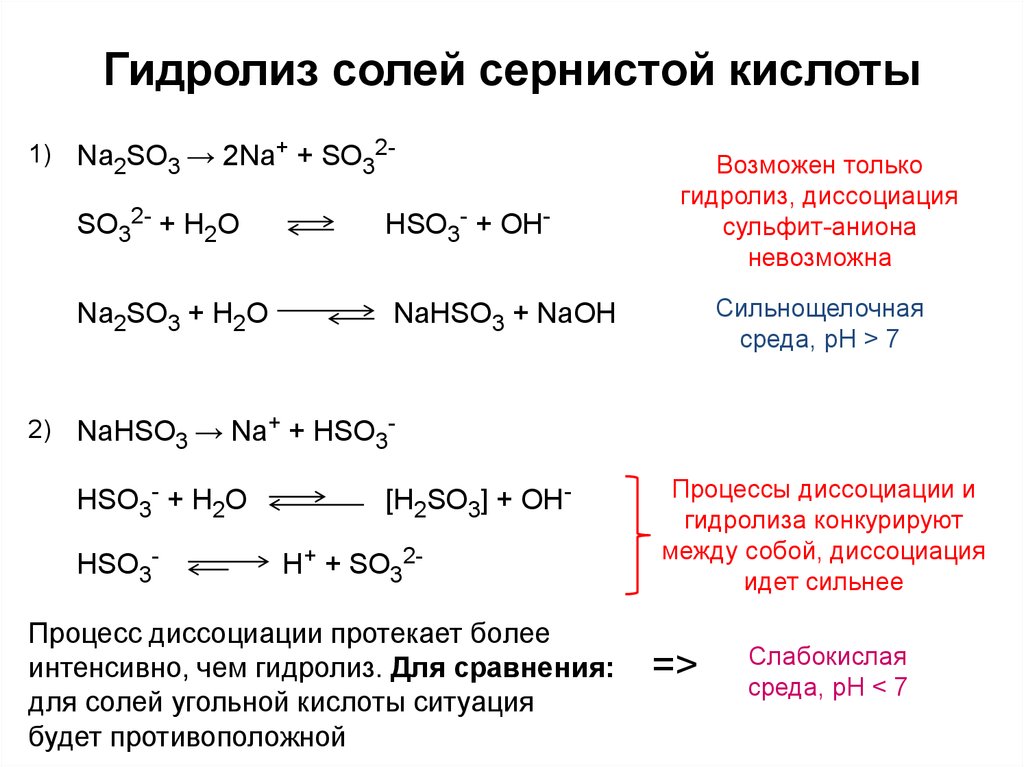
Напишите следующие уравнения и уравняйте их: бикарбонат калия + серная кислота в сульфат калия + диоксид углерода + вода.

 Е.Кузъменко, В.В.Еремин, В.А.Попков. Химия. Для школьников старших классов и поступающих в вузы. М.: Дрофа, 1995 — 527 с.
Е.Кузъменко, В.В.Еремин, В.А.Попков. Химия. Для школьников старших классов и поступающих в вузы. М.: Дрофа, 1995 — 527 с.
Leave A Comment