гомологический ряд, формулы и свойства
Поможем понять и полюбить химию
Начать учиться
Знакомство с органической химией всегда начинается с предельных (насыщенных) углеводородов — алканов. Из этой статьи вы узнаете, что такое алканы, познакомитесь с их физическими и химическими свойствами.
Алканы — это предельные углеводороды, в строении которых имеются только одинарные или σ-связи.
Этот класс относится к алифатическим соединениям, так как не имеет ароматических связей. К тому же алканы — предельные углеводороды, то есть они содержат максимально возможное число атомов водорода. Поэтому общая формула алканов — CnH2n+2.
Строение алканов
Основные химические связи у алканов — это ковалентная неполярная связь между атомами углерода (С—С) и ковалентная полярная связь между атомами углерода и водорода (С—Н).
Так как алканы — это предельный класс, делаем вывод, что все связи между атомами являются одинарными, то есть σ-связями.
Разберемся с типом гибридизации атомов углерода в алканах, но сначала вспомним, что такое гибридизация. Упрощенное определение гибридизации звучит так: это смешение различных орбиталей в многоатомной молекуле для выравнивания формы и энергии, которое приводит к изменению формы орбитали. Гибридизация атомов углерода в алканах — sp3. Рассмотрим, как она образуется.
При образовании связи между углеродами происходит смешение их орбиталей — вот так:
В то время как образование связи между углеродом и водородом происходит следующим образом:
Рассмотрим пространственное строение алканов на примере метана — первого представителя гомологического ряда алканов. При наличии четырех атомов водорода и одного атома углерода в молекуле образуются четыре гибридизованные орбитали, которые взаимно отталкиваются друг от друга, но не произвольно, а под определенным углом.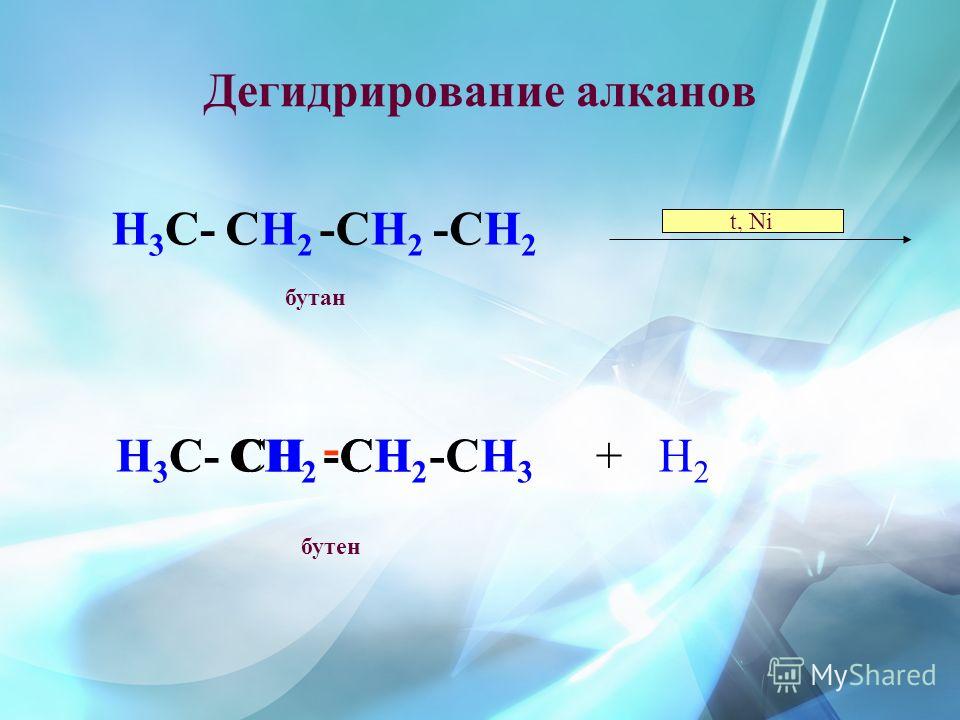 Максимальный угол взаимного отталкивания — это валентный угол, для алканов он равен 109°28′. Таким образом, молекула метана в пространстве выглядит как тетраэдр:
Максимальный угол взаимного отталкивания — это валентный угол, для алканов он равен 109°28′. Таким образом, молекула метана в пространстве выглядит как тетраэдр:
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Номенклатура алканов
Познакомьтесь с номенклатурой гомологического ряда алканов (ее необходимо выучить):
Название алкана | Формула алкана |
|---|---|
Метан | CH4 |
Этан | C2H6 |
Пропан | C3H8 |
Бутан | C4H10 |
C5H12 | |
Гексан | C6H14 |
Гептан | C7H16 |
Октан | C8H18 |
Нонан | C9 |
Декан | C10H22 |
Названия первых четырех представителей этого ряда сложились исторически. Названия остальных алканов образованы от греческих числительных, которые обозначают количество атомов углерода, с помощью суффикса -ан-.
Названия остальных алканов образованы от греческих числительных, которые обозначают количество атомов углерода, с помощью суффикса -ан-.
Важно помнить, что бутан и следующие за ним алканы могут иметь изомеры. Ниже в таблице указано количество изомеров у каждого представителя алканов:
Помимо структурной изомерии, для алканов характерна изомерия оптическая. Но для ее реализации нужно одно условие — наличие хирального атома углерода, то есть атома с четырьмя различными заместителями.
Молекулы таких соединений относятся друг к другу как предмет и его зеркальное отражение. Как бы мы ни вращали эти молекулы, нельзя получить из одной другую.
Физические свойства алканов
Свойства этих соединений меняются по мере продвижения по гомологическому ряду:
первые четыре представителя алканов являются газами;
алканы, в составе молекулы которых от 5 до 15 атомов углерода, являются жидкостями;
алканы, в составе молекулы которых от 16 атомов углерода, — твердые вещества.

С увеличением количества атомов углерода в структуре молекулы и с ее формой в пространстве связана одна особенность: у линейных молекул, в отличие от разветвленных, температура кипения и плавления выше. В таблице собрали справочные данные о температуре плавления и составе алканов.
Название вещества | Молекулярная формула | Структурная формула | Температура плавления, °С |
|---|---|---|---|
Метан | CH4 | CH4 | −182 |
Этан | С2Н6 | СН3—СН3 | −183 |
Пропан | С3Н8 | СН3—СН2—СН3 | −188 |
Бутан | С4Н10 | СН3—(СН2)2—СН3 | −138 |
Изобутан (2-метилпропан) | С4Н10 | (СН3)2—СН—СН3 | −160 |
Пентан | С5Н12 | СН3—(СН2)3—СН3 | −130 |
Изопентан (2-метилбутан) | С5Н12 | (СН3)2—СН—СН2—СН3 | −160 |
Неопентан (2,2-диметилпропан) | С5Н | −17 | |
Гексан | С6Н14 | СН3—(СН2)4—СН3 | −95 |
Гептан | С7Н16 | −91 | |
Октан | С8Н18 | СН3—(СН2)6—СН3 | −57 |
Нонан | С9Н20 | СН3—(СН2 | −51 |
Декан | С10Н22 | СН3—(СН2)8—СН3 | −30 |
Гексадекан | С16Н34 | СН3—(СН2)14—СН3 | 18 |
Эйкозан | С20Н42 | СН3—(СН2)18—СН3 | 36,7 |
Все алканы бесцветны, легче воды и нерастворимы в ней, однако хорошо растворяются в органических растворителях. Жидкие алканы, такие как пентан и гексан, сами широко используются как растворители.
Жидкие алканы, такие как пентан и гексан, сами широко используются как растворители.
Химические свойства алканов
Для алканов характерны реакции замещения. Для всех реакций замещения алканов нужно соблюдать правило: сначала замещается водород у третичного атома углерода, затем — у вторичного, в последнюю очередь — у первичного атома углерода.
Рассмотрим все возможные реакции, характерные для алканов.
Реакция нитрования (реакция Коновалова)
Галогенирование
.
Реакция может продолжаться до полного замещения атомов водорода на хлор.
Дегидрирование (отщепление водорода)
Катализаторы для дегидрирования: Ni, Pt, Pd, Cr2O3, Fe2O3, ZnO и другие.
Реакции разложения
Крекинг:
C8H18 → C4H10 + C4H8.

Пиролиз метана:
— при медленном и длительном нагревании;
— при очень быстром нагревании.
Реакция окисления (горение)
Все алканы, кроме метана, горят с образованием углекислого газа и воды. Метан горит с образованием угля и воды.
Алканы не окисляются сильными окислителями, такими как перманганаты, дихроматы и хроматы.
Вопросы для самопроверки
Выберите алкан с наибольшей молярной массой.
Пентан
Бутан
Октан
Гексан
Какая гибридизация у атомов углерода в предельных углеводородах?
sp3
sp2
sp
Гибридизации нет
Какие виды изомерии характерны для алканов?
Оптическая и пространственная
Цис-транс-изомерия
Углеродного скелета и геометрическая
Углеродного скелета и оптическая
Вспомните общую формулу алканов.

CnH2n
CnH2n−2
CnH2n+2
CnH2n−6
Какой тип реакций характерен для алканов?
Присоединение
Замещение
Присоединение и замещение
Любые типы реакций
Какая именная реакция удвоит углеродный скелет у алканов?
Реакция Коновалова
Реакция Вюрца — Фиттинга
Реакция Вюрца
Реакция Зинина
Подготовиться к ЕГЭ на онлайн-курсах по химии, пожалуй, лучший вариант. Можно заниматься дома и не тратить время на дорогу — нужен лишь компьютер и стабильный интернет. Преподаватели онлайн-школы Skysmart помогут не только упорядочить знания, но и подготовиться к экзамену психологически. Пройти вводное тестирование и получить рекомендации по самостоятельному обучению можно бесплатно!
Можно заниматься дома и не тратить время на дорогу — нужен лишь компьютер и стабильный интернет. Преподаватели онлайн-школы Skysmart помогут не только упорядочить знания, но и подготовиться к экзамену психологически. Пройти вводное тестирование и получить рекомендации по самостоятельному обучению можно бесплатно!
Ответы на вопросы
c
a
d
c
b
c
Ксения Боброва
К предыдущей статье
Теория Бутлерова
К следующей статье
Основные функции белков в организме
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
метилбутан — Большая Энциклопедия Нефти и Газа, статья, страница 2
Cтраница 2
Учитывая, что теплоемкость 2-метилбутана и 2-метилпентана экспериментально изучена [7], в настоящей работе с применением методов, описанных в [4] и [6], вычислена молярная теплоемкость 2-метилалканов и показано, что большие расхождения, которые дает метод Джонсона и Хуанга для некоторых жидких углеводородов, обусловлены структурой молекулы. [16]
[16]
В хлорировании 1-хлор — 2-метилбутана в качестве промежуточных продуктов участвуют свободные радикалы, тем самым механизм хлорирования напоминает схему А ( стр. [17]
Первичные атомы водорода в 2-метилбутане двух типов: в ме-тильных группах при третичном углероде и в метальной группе при вторичном атоме. Эти атомы Н неэквивалентны, но мы объединим продукты монозамещения всех первичных водородных атомов. [18]
В первой фракции был обнаружен 2-метилбутан, а во второй — 2 3-деметил-бутан. [19]
Предположим, что надо получить 2-метилбутан из неорганических исходных материалов. [20]
Выделено два его изомера: 2-метилбутан и к-пентан. Изопентанов в газах обычно больше, чем пентанов нормального строения. [21]
Используя экспериментальные данные по теплоемкости 2-метилбутана и 2-метилпентана, опубликованные в справочной литературе, рассчитана молярная теплоемкость гомологов 2-диметилалканов по предложенной нами формуле и методом Джонсона и Хуанга. [22]
[22]
Изопрен, полученный при дегидрировании 2-метилбутана, пропустили через избыток бромной воды, получив тетрабромпроизводное. Рассчитайте массу 2-метилбутана, который был взят для реакции. [23]
Бромирование оптически активного 1-бром — 2-метилбутана с помощью mjDem — бутилгипобромида дает некоторое количество 1 2-дибром — 2-метилбутана, который оптически активен, плюс другие продукты. [24]
При пропускании паров 4-хлор — 2-метилбутана или 4-бром — 2-метилбутана над такой же комбинацией катализаторов получается продукт, большая часть которого представляет собой 3-хлор — или 3-бромизомеры исходных продуктов. [25]
Вычислено по уравнению давления пара жидкого 2-метилбутана. [26]
Вычислено по уравнению давления пара жидкого 2-метилбутана оригинальной статьи. [27]
С — Cg и изопарафины; 2-метилбутан, 2 3-димети. [28]
Соединение С5Н10 при каталитическом гидрировании образует 2-метилбутан. Если же на исходное соединение подействовать бромистоводородной кислотой в присутствии перекиси и затем полученный продукт нагреть с металлическим натрием, то образуется 2 7-диметилоктан.
[29]
Если же на исходное соединение подействовать бромистоводородной кислотой в присутствии перекиси и затем полученный продукт нагреть с металлическим натрием, то образуется 2 7-диметилоктан.
[29]
Рассчитать равновесные выходы продуктов реакции дегидрирования 2-метилбутана в изопрен в области 7300 — 900 К. [30]
Страницы: 1 2 3 4
8.1 Реакции E2 – Органическая химия I
8.1.1 Механизм E2
Механизм E2 представляет собой механизм бимолекулярного отщепления , а скорость реакции зависит от концентрации как субстрата, так и основания. В качестве примера для обсуждения возьмем реакцию элиминирования 2-бром-2-метилпропана.
Рис. 8.1a. Реакция бимолекулярного элиминирования Ранее упоминалось, что HX является побочным продуктом дегидрогалогенирования, почему в уравнении реакции отсутствует HX (HBr для этой реакции)? Это можно понимать как наличие избытка основания (OH – ) в реакционной смеси HBr реагирует с OH – с образованием H 2 O и Br – . Следующее обсуждение механизма поможет вам лучше понять это.
Следующее обсуждение механизма поможет вам лучше понять это.
Механизм E2 также представляет собой одностадийную согласованную реакцию, аналогичную S N 2, с многократным переносом электронной пары, происходящим в одно и то же время.
Рисунок 8.1b. Механизм реакции E2
Основание OH– использует свою электронную пару для атаки β-водорода на β-углероде и начинает образовывать связь; в то же время сигма-связь β CH начинает приближаться, чтобы стать π-связью двойной связи, а тем временем Br начинает удаляться, унося с собой связывающие электроны. В процессе реакции образуется переходное состояние с частичным разрывом и частичным образованием связей. По окончании реакции двойная связь C=C и молекула h3O полностью образуются, а Br– полностью уходит.
Поскольку в одностадийном механизме участвуют и субстрат (галогенид), и основание, Е2 является реакцией второго порядка.
8.1.2 Региоселективность реакции Е2: правило Зайцева против правило Хофмана
Для реакции, о которой мы говорили в предыдущем разделе, в субстрате 2-бром-2-метилпропане имеется три β-углерода; однако все они идентичны , поэтому реакция дает только один единственный продукт отщепления: 2-метилпропен.
Для других алкилгалогенидов, если в субстрате имеется различных β-углеродов, то реакция отщепления может давать более одного продукта. Например, при дегидрогалогенировании 2-бром-2-метилбутана можно получить два продукта: 2-метил-2-бутен и 2-метил-1-бутен по двум различным путям.
Рисунок 8.1c Региоселективность реакции E2Из двух возможных продуктов 2-метил-2-бутен представляет собой тризамещенный алкен, тогда как 2-метил-1-бутен является монозамещенным. Для алкенов чем больше алкильных групп связано с атомами углерода двойной связи, тем стабильнее алкен. Как правило, относительная стабильность алкенов с разным числом заместителей составляет:
тетразамещенный > трехзамещенный > двузамещенный > монозамещенный > этен
Следовательно, 2-метил-2-бутен более стабилен, чем 2-метил-1-бутен. Когда для реакции элиминирования используется небольшое основание, такое как OH –, CH 3 O – или EtO –, относительная стабильность продукта является ключевым фактором для определения основного продукта.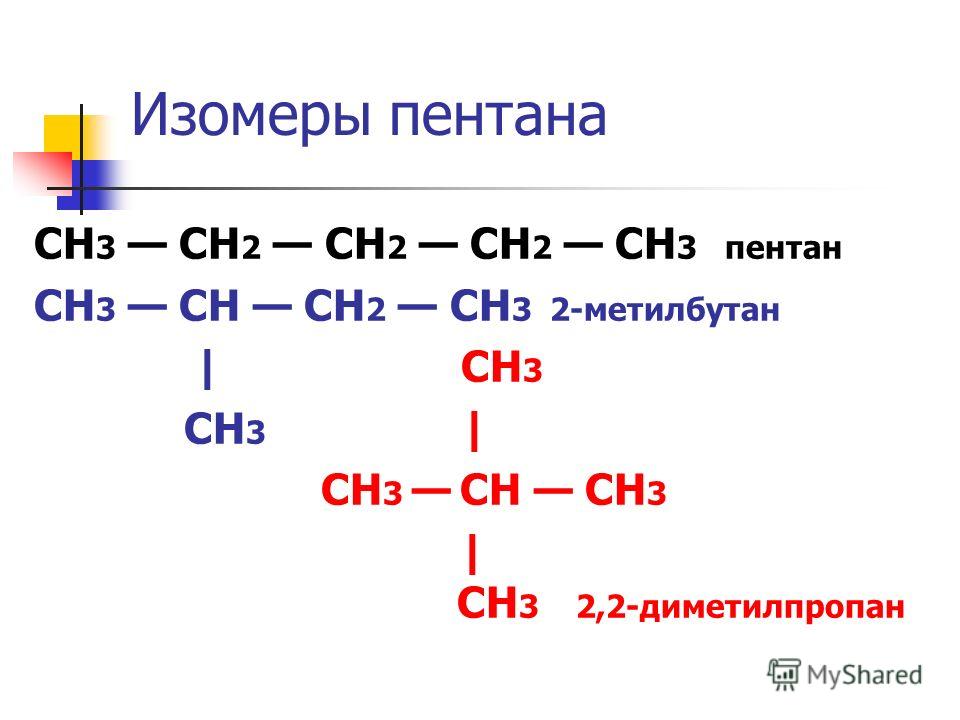 . В результате 2-метил-2-бутен является основным продуктом вышеуказанной реакции.
. В результате 2-метил-2-бутен является основным продуктом вышеуказанной реакции.
В качестве общей тенденции, когда применяется малое основание, продукты отщепления можно предсказать по правилу Зайцева , согласно которому предпочтительно получается более замещенный алкен . Таким образом, правило Зайцева по существу можно объяснить более высокой устойчивостью более замещенных алкенов.
Рисунок 8.1d Реакция элиминирования происходит по правилу Зайцева с применением небольшого основания
Однако, если при элиминировании применяется объемное основание, такое как t -BuOK реакция способствует образованию менее замещенных алкенов.
Рисунок 8.1e Реакция элиминации происходит по правилу Хофмана с нанесением объемного основания
Это происходит в основном из-за стерических затруднений. Поскольку t -BuO – атакует β-водород, этому большому массивному основанию трудно приблизиться к водороду из β-углерода, который связан с большим количеством заместителей (как показано на пути (а) ниже), в то время как водород метильной группы гораздо более доступен (вместо этого в пути (b)). Когда в результате отщепления образуется менее замещенный алкен, говорят, что это следует за Правило Гофмана .
Когда в результате отщепления образуется менее замещенный алкен, говорят, что это следует за Правило Гофмана .
Рисунок 8.1f Правило Хофмана: Объемное основание t-BuO- (путь а), Объемное основание t-BuO- менее затруднено
8.1.3 Стереохимия реакции E2
Механизм E2 имеет особые требования к стереохимии, чтобы обеспечить его работу. Во-первых, связь, связанная с уходящей группой, и связь, связанная с H, должны находиться в одной плоскости, чтобы обеспечить правильное перекрытие орбит двух атомов углерода при образовании π-связи алкенового продукта. Во-вторых, уходящая группа и H должны находиться в противоположном друг другу положении. Это связано с тем, что антиположение позволяет переходному состоянию реакции находиться в более стабильной шахматной конформации, что помогает снизить уровень энергии переходного состояния и ускорить реакцию. В целом реакция E2 протекает с уходящей группой, а H находится в антикомпланарная конформация.
Рисунок 8.1g Антикомпланарная конформация H и LG требуется в механизме E2
Из-за требования антикомпланарной конформации для реакции E2 один стереоизомер будет продуцироваться предпочтительно по сравнению с другим, и это называется стереоселективностью . В следующем примере при удалении (2 S ,3 S )-2-бром-3-фенилбутана образуется изомер E , а не Z изомер вообще. Это связано с тем, что когда H находится в положении, противоположном уходящей группе Br, все соединение находится в шахматной конформации, а другие группы сохраняют свое относительное положение при элиминировании, что приводит к изомеру E .
Показать продукт элиминирования следующих реакций
1.
2.
Ответы на практические вопросы главы 8
8.1.4 Основания в реакциях E2 (краткое изложение)
Наиболее часто применяемыми основаниями в реакции E2 являются гидроксид OH – и алкоксид RO –. В частности, широко используется комбинация основания с соответствующим спиртом, например, CH 3 ONa/CH 3 OH или C 2 H 5 ONa/C 2 H 5 OH.
В частности, широко используется комбинация основания с соответствующим спиртом, например, CH 3 ONa/CH 3 OH или C 2 H 5 ONa/C 2 H 5 OH.
Примеры малых оснований: OH –, CH 3 O –, C 2 H 5 O – и NH 2 –
Примеры больших громоздких оснований: т -BuO – и LDA (диизопропиламид лития)
Алкены из дегидратации спиртов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 905
Одним из способов синтеза алкенов является дегидратация спиртов, процесс, в котором спирты подвергаются механизмам E1 или E2 для потери воды и образования двойной связи.
Введение
Реакция дегидратации спиртов с образованием алкена протекает путем нагревания спиртов в присутствии сильной кислоты, такой как серная или фосфорная, при высоких температурах.
Необходимый диапазон температур реакции уменьшается с увеличением замещения гидроксисодержащего углерода:
- 1° спирты: 170° — 180°C
- 2° спирты: 100°– 140°C
- 3° спирты: 25°– 80°C
Если реакция недостаточно нагрета, спирты не дегидратируются с образованием алкенов, а реагируют друг с другом с образованием простых эфиров (например, синтез эфира Вильямсона).
Спирты амфотерные; они могут действовать как кислота или основание. Неподеленная пара электронов на атоме кислорода делает группу –ОН слабоосновной. Кислород может отдать два электрона электронодефицитному протону. Так, в присутствии сильной кислоты R—OH действует как основание и протонирует в очень кислый ион алкилоксония + OH 2 (Значение pKa третичного протонированного спирта может достигать -3,8). Эта основная характеристика спирта необходима для его реакции дегидратации с кислотой с образованием алкенов.
Эта основная характеристика спирта необходима для его реакции дегидратации с кислотой с образованием алкенов.
Механизм дегидратации спирта в алкен
Различные типы спиртов могут дегидратироваться по несколько иному механизму. Однако общая идея, стоящая за каждой реакцией дегидратации, заключается в том, что группа –ОН в спирте отдает два электрона H + из кислотного реагента, образуя ион алкилоксония. Этот ион действует как очень хорошая уходящая группа, которая уходит с образованием карбокатиона. Затем депротонированная кислота (нуклеофил) атакует водород, соседний с карбокатионом, и образует двойную связь.
Первичные спирты подвергаются бимолекулярному отщеплению (механизм E2), тогда как вторичные и третичные спирты подвергаются мономолекулярному отщеплению (механизм E1). Относительная реакционная способность спиртов в реакции дегидратации оценивается следующим образом:
Метанол < первичный < вторичный < третичный
Дегидратация первичного спирта по механизму Е2
Кислород отдает два электрона протону из серной кислоты H 2 SO 4 , образуя ион алкилоксония. Затем нуклеофил HSO 4 – с обратной стороны атакует один соседний водород, и ион алкилоксония уходит в согласованном процессе, образуя двойную связь.
Затем нуклеофил HSO 4 – с обратной стороны атакует один соседний водород, и ион алкилоксония уходит в согласованном процессе, образуя двойную связь.
Вторичные и третичные спирты дегидратируются по механизму Е1
Аналогично реакции, описанной выше, вторичный и третичный –ОН протонируют с образованием ионов алкилоксония. Однако в этом случае ион уходит первым и образует карбокатион в качестве промежуточного продукта реакции. Молекула воды (которая является более сильным основанием, чем ион HSO 4 — ) отрывает протон от соседнего атома углерода, образуя двойную связь. Обратите внимание, что в приведенном ниже механизме образование алека зависит от того, какой протон отщепляется: красные стрелки показывают образование более замещенного 2-бутена, а синие стрелки показывают образование менее замещенного 1-бутена. Напомним общее правило, что более замещенные алкены более стабильны, чем менее замещенные алкены, и транс алкены более стабильны, чем цис алкены. Следовательно, диастереомер транс продукта 2-бутена является наиболее распространенным.
Следовательно, диастереомер транс продукта 2-бутена является наиболее распространенным.
Реакция дегидратации вторичного спирта: Механизм дегидратации третичного спирта аналогичен показанному выше для вторичного спирта.
Когда возможны более одного алкенового продукта, предпочтительным продуктом обычно является термодинамически наиболее стабильный алкен. Более замещенные алкены предпочтительнее менее замещенных; и транс-замещенные алкены предпочтительнее цис-замещенных.
- Поскольку связь C=C не может свободно вращаться, цис-замещенные алкены менее стабильны, чем транс-замещенные алкены, из-за стерических затруднений (пространственной интерференции) между двумя объемными заместителями на одной стороне двойной связи (как показано в цис-продукте на рисунке выше). Транс-замещенные алкены уменьшают этот эффект пространственной интерференции путем разделения двух объемных заместителей с каждой стороны двойной связи (для дальнейшего объяснения жесткости связи C = C см.
 «Структура и связывание в этилене — пи-связь»).
«Структура и связывание в этилене — пи-связь»). - Теплоты гидрирования изомеров алкенов с различным замещением самые низкие для более замещенных алкенов, что позволяет предположить, что они более стабильны, чем менее замещенные алкены, и, таким образом, являются основными продуктами реакции элиминирования. Отчасти это связано с тем, что в более -замещенных алкенах p-орбитали пи-связи стабилизируются соседними алкильными заместителями, явление, подобное гиперконъюгации.
Гидридные и алкильные сдвиги
Поскольку в реакции дегидратации спирта присутствует промежуточный карбокатион, могут происходить гидридные или алкильные сдвиги, которые перемещают карбокатион в более стабильное положение. Таким образом, обезвоженные продукты представляют собой смесь алкенов с карбокатионной перегруппировкой и без нее. Третичный катион более стабилен, чем вторичный катион, который, в свою очередь, более стабилен, чем первичный катион из-за явления, известного как гиперконъюгация, когда взаимодействие между заполненными орбиталями соседних атомов углерода и однократно занятой p-орбиталью в карбокатионе стабилизирует положительный заряд в карбокатион.
- При гидридных сдвигах вторичный или третичный водород от атома углерода рядом с исходным карбокатионом переносит оба своих электрона в положение катиона, меняясь местами с карбокатионом и делая его более стабильным вторичным или третичным катионом.
Точно так же, когда нет гидрида, доступного для гидридного сдвига, алкильная группа может занять свои связывающие электроны и поменяться местами с соседним катионом, процесс, известный как алкильный сдвиг.
Практические задачи
Проверьте свои знания, предсказав, какой продукт(ы) образуется в каждой из следующих реакций:
1 .
2.
Растворы
1. Вы заметили температуру реакции? Она составляет всего 25°, что значительно ниже требуемой температуры 170°С для дегидратации первичного спирта. В результате этой реакции алкен не образуется, но образуется эфир.
2. . Обратите внимание, что реагент представляет собой вторичную группу -ОН, которая образует относительно нестабильный вторичный карбокатион в промежуточном продукте.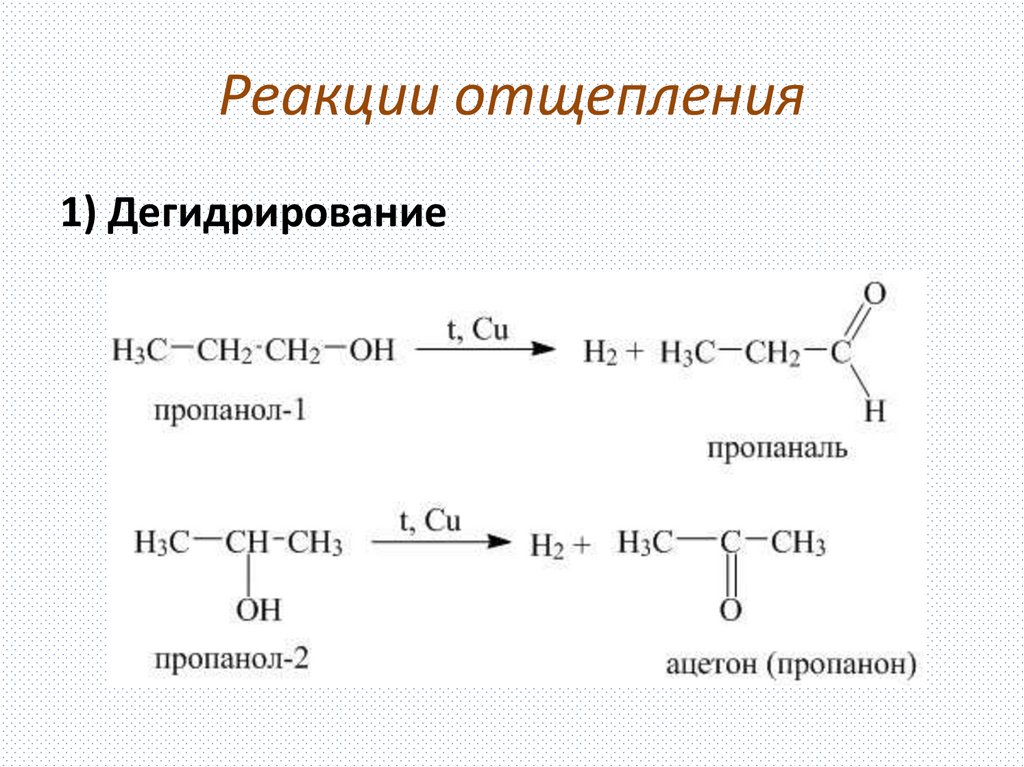 Таким образом, произойдет сдвиг гидрида от соседнего водорода, чтобы сделать карбокатион третичным, который намного более стабилен. Продукты представляют собой смесь алкенов, которые образуются с карбокатионной перегруппировкой или без нее (ряд продуктов образуется быстрее, чем может произойти гидридный сдвиг).
Таким образом, произойдет сдвиг гидрида от соседнего водорода, чтобы сделать карбокатион третичным, который намного более стабилен. Продукты представляют собой смесь алкенов, которые образуются с карбокатионной перегруппировкой или без нее (ряд продуктов образуется быстрее, чем может произойти гидридный сдвиг).
Ссылки
- Фоллхарт, К. Питер С. и Нил Шор. Органическая химия, структура и функции. 5-е изд. У. Х. Фриман и компания, 2007 г.
- Макмерри, Джон. Основы органической химии. 3-е изд. Cornell University. Пасифик-Гроув, Калифорния: Brooks/Cole Publishing Company, 1994. .
Авторы
- Туи Хоанг
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу Содержание
- № на стр.





 «Структура и связывание в этилене — пи-связь»).
«Структура и связывание в этилене — пи-связь»).
Leave A Comment