Кислоты — окислители | Дистанционные уроки
30-Авг-2018 | Нет комментариев | Лолита Окольнова
Давайте рассмотрим свойства
и продукты их реакций
Автор статьи — Саид Лутфуллин
Свойства концентрированной серной кислоты — окислителя
Концентрированная серная кислота – бесцветная тяжелая маслянистая нелетучая жидкость. Не имеет запаха и тянет сказать: «без вкуса», но вкус у нее все же есть, пробовать не советую.
Разбавленная серная кислота ничем особым непримечательна. Свойства как и у других кислот. За исключением того, что она не реагирует со свинцом, так как образующийся сульфат свинца нерастворим. Нерастворимое вещество покрывает кусочек металла и «защищает его от реакции»
Pb + H2SO4 ≠
А вот концентрированная серная кислота – сильный окислитель (за счет атома серы в высшей степени окисления).
Раз сера – окислитель, то она будет восстанавливаться:
Глубина восстановления серы зависит от активности восстановителя:
- сильные восстановители восстанавливают серную кислоту до h3S,
- слабые — до SO2,
- восстановители средней активности – до S.
На практике образуются несколько продуктов в разных пропорциях. Преобладание того или иного продукта зависит от множества факторов: от вышеупомянутой активности восстановителя, температуры, концентрации кислоты (95%, 90%. 85%, 80%, 75% – это все концентрированная кислота). Но в реалиях школьной программы все схематично и пишем один единственный продукт.
1. Взаимодействие металлов в концентрированной серной кислотой.
Концентрированная серная кислота реагирует с металлами, даже стоящими после водорода. Но кроме платины и золота – эти металлы слишком малоактивны.
Схема этих реакций:
- Активные металлы восстанавливают серную кислоту до h3S:
8Li + 5H2SO4 конц → 4Li2SO4 + h3S ↑ + H2O
4Mg + 5H2SO4 конц → 4MgSO4 + h3S ↑ + H2O
- Металлы средней активности восстанавливают серную кислоту до S:
3Mn + 4H2SO4 конц → 3MnSO
3Zn + 4H2SO4 конц → t→ 3ZnSO4 + S ↓ + 4H2O
- Малоактивные металлы восстанавливают серную кислоту до SO2:
Cu + 2H2SO4 конц → CuSO4 + SO2 ↑ + 2H2O
2Ag + 2H2SO4 конц → Ag2SO4 + SO2 ↑ + 2H2O
Некоторые металлы (конкретно нужно запомнить — Fe, Al, Cr) при контакте с концентрированной серной кислотой покрываются защитной пленкой – и реакция не идет
 Поэтому серную кислоту без всякой опасности перевозят в железных цистернах. Это явление называют пассивацией.
Поэтому серную кислоту без всякой опасности перевозят в железных цистернах. Это явление называют пассивацией.
То, что железо, алюминий и хром пассивируются не означает, что реакция невозможна. Просто нужно нагреть – при нагревании от защитной пленки не остаётся и следа:
2. Взаимодействие неметаллов с концентрированной серной кислотой.
Не все неметаллы реагируют с концентрированной серной кислотой: лишь те, что проявляют восстановительные свойства. Поэтому кислород, азот и галогены не вступают в эти реакции
Мы рассмотрим взаимодействие с фосфором, углеродом, бором, серой. Неметаллы – не такие активные восстановители как типичные металлы – поэтому серная кислота восстанавливается до SO2.
Неметалл окисляется до высшей степени окисления: образуется оксид. Поскольку оксид неметалла – кислотный, то он тут же в момент получения реагирует с водой и образуется кислота:
2P + 5H2SO4 конц → 2H3PO4 + 5SO2 ↑+ 2H2O
2B + 3H2SO4 конц → 2H3BO3 + 3SO2 ↑
Угольная кислота не образуется – получается углекислый газ:
C + 2H2SO4 конц → CO2 ↑ + 2SO2 ↑+ 2H2O
Концентрированная серная кислота окисляет серу:
3. Взаимодействие концентрированной серной кислоты с галогенидами.
Взаимодействие концентрированной серной кислоты с галогенидами.
Галогениды металлов – это соли галогеноводородов (HF, HCl, HBr, HI). Галогеноводороды – летучие кислоты, а HF еще к тому же и слабая.
Поэтому серная кислота их вытесняет из солей:
2KF тв + H2SO4 конц → K2SO4 + 2HF↑
2NaCl тв + H2SO4 конц → Na
Соли нужно брать твердые, не раствор. Тогда галогеноводороды будут вытесняться в виде газов.
А к фториду можно и в раствор прилить кислоты, так как фтороводородная кислота – слабая, она вытеснится. Только останется в растворе, вот и вся разница.
С хлоридами и фторидами происходит простая реакция обмена, без изменения степеней окисления.
Галоген окисляется до простого вещества. Сера восстанавливается:
А вот бромиды и иодиды – восстановители. После вытеснения галогеноводорода он тут же окисляется. Поэтому реакции концентрированной серной кислоты с бромидами и иодидами протекают с изменением степеней окисления.
После вытеснения галогеноводорода он тут же окисляется. Поэтому реакции концентрированной серной кислоты с бромидами и иодидами протекают с изменением степеней окисления.
Бромоводород и иодоводород окисляются так же, как и их соли:
2HBr + H2SO4 конц → Br2 + SO2 ↑ + 2H2O
8HI + H2SO4 конц → 4I2 ↓+ H2S ↑ + 4H2O
Азотная кислота — окислитель.
Производство.
Сырье для производства азотной кислоты – аммиак. Три последовательные реакции окисления:
1. Каталитическое окисление аммиака:
4NH3+5O2 → кат., t°→ 4NO+6H2
Реакция экзотермическая, необратимая.
2. Окисление NO до NO2:
2NO+O2→2NO2
Реакция экзотермическая, обратимая.
3. Поглощение NO2 водой и одновременно его окисление:
Реакция экзотермическая, обратимая – по этой же схеме азотная кислота разлагается при хранении. Поэтому с течением времени прозрачная изначально азотная кислота буреет. Бурый цвет кислоте придает, образующийся при разложении NO2.
Поэтому с течением времени прозрачная изначально азотная кислота буреет. Бурый цвет кислоте придает, образующийся при разложении NO2.
Если растворять NO2 в воде без доступа кислорода, то азот диспропорционирует:
Поэтому оксид азота (IV) NO2 мы относим к кислотным. Хоть у него и нет соответствующей кислоты, при растворении его в воде образуются HNO3 и HNO2.
Азотная кислота – жидкость с резким запахом. Свежая азотная кислота бесцветная. При хранении она разлагается и за счет бурого NO2 приобретает желтоватый цвет.
Важно знать, что азотная кислота летучая, легкокипящая, поэтому и имеет запах. А раз она летучая, то ее можно вытеснить из соли нелетучей кислотой, например, концентрированной серной:
NaNO3 тв + H2SO4 → t → NaHSO4
Важно, чтобы нитрат был твердым, а серная кислота концентрированная – меньше воды. Чтобы азотная кислота испарялась, испаряется – значит покидает реакционную смесь, значит реакция идет до конца.
Химические свойства.
Свойства азотной кислоты в целом повторяют свойства концентрированной серной. Но с одной поправкой, в отличие от серной, азотная кислота и концентрированная, и разбавленная проявляет сильные окислительные свойства.
1. Взаимодействие с металлами.
До чего может восстанавливаться азот? Вспомним
Получиться может любой из этих продуктов. А на практике – несколько сразу. Мы рассмотрим упрощенный вариант: берем только преобладающий продукт и только два фактора, влияющие на глубину восстановления:
- Активность металла – чем активнее, тем глубже идет восстановление.
- Концентрация кислоты – разбавленная кислота восстанавливается глубже.
Еще больше упрощая берем только четыре продукта: NH4NO3, N2O, NO, NO2.
4Ca + 10HNO3 разб → 4Ca(NO3)2 + NH4NO3 + 3H2O
Соответственно при взаимодействии концентрированной кислоты и малоактивного металла образуется NO2. Самое неглубокое восстановление.
Cu + 4HNO3 конц → Cu(NO3)2 + 2NO2 ↑+ 2H2O
Теперь нужно определить в каком случае будет N2O, а в каком NO. Фактор активности металла – решающий. С активным металлом и концентрированной кислотой будет N2O. А с малоактивным металлом и разбавленной кислотой образуется NO.
8Na + 10HNO3 конц → 8NaNO3 + N2O ↑ + 5H2O
3Cu + 8HNO3 разб → 3Cu(NO3)2 + 2NO ↑ + 4H2O
Концентрированная азотная кислота пассивирует Fe, Cr, Al, как и концентрированная серная.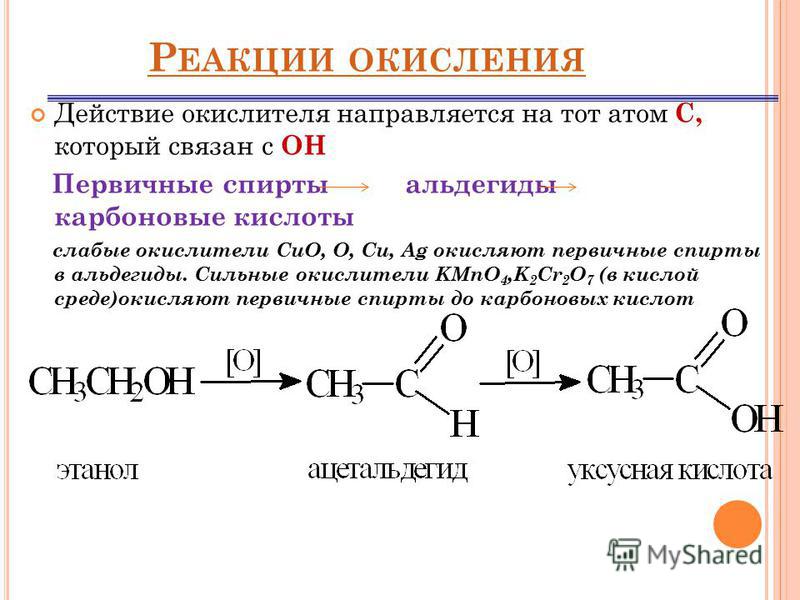
Чтобы провести реакцию нужно нагреть:
С разбавленной кислотой эти металлы реагируют и без нагревания:
2. Взаимодействие с неметаллами (C, P, B, S).
Неметаллы окисляются до высших кислот. Реагирует и концентрированная, и разбавленная азотная кислота. Неметаллы – не очень хорошие восстановители, поэтому кислота восстанавливается как в реакции с малоактивными металлами (образуются N2O и NO2).
В отличие от серной кислоты, очень концентрированная азотная кислота (безводная) окисляет при нагревании иод до иодноватой кислоты (HIO3):
I2 + 10HNO3 конц → t → 2HIO3 + 10NO2 ↑ + 4H2O
3. Взаимодействие с галогенидами.
Эти реакции могут запутать, хотя ничего сложного в них нет. Вам нужно просто понять логику каждой из них.
На что следует опираться:
- Реакции могут быть либо окислительно-восстановительными, либо обменными.

- Помним, что фториды (F–) и хлориды (Cl–) – восстановители плохие, если быть точнее, то никакие. А бромиды (Br–) и иодиды (I–) – хорошие восстановители.
- HF – слабая кислота, HCl, HBr, HI – сильные.
Фториды металлов – это соли слабых кислот, поэтому сильная азотная кислота вытесняет фтороводород. И не важно концентрированная или разбавленная – это простая реакция обмена/p>
KF + HNO3 → HF + KNO3
Фтороводород не реагирует с азотной кислотой. Реакция обмена невозможна и окислительно-восстановительная тоже: фторид – слабый восстановитель.
Хлориды металлов и хлороводород не реагируют с азотной кислотой. Хлорид ион – слабый восстановитель – не возможна ОВР. Хлориды металлов не реагируют, потому что соляная кислота – сильная (предыдущая плавиковая – слабая, если помните).
Бромиды и иодиды вступают с азотной кислотой в окислительно-восстановительное взаимодействие. Сами окисляются до простых веществ. Азотная кислота восстанавливается до NO2 если концентрированная, разбавленная – до NO, то есть так, как будто взаимодействует с малоактивным металлом.
Сами окисляются до простых веществ. Азотная кислота восстанавливается до NO2 если концентрированная, разбавленная – до NO, то есть так, как будто взаимодействует с малоактивным металлом.
- Подписка на рассылку
(Правила комментирования)
2.4. Химические свойства кислот
1. Рассмотрим характерные свойства кислот, не являющихся окислителями.
1.1. Реакции обмена
а) Взаимодействие с основаниями (как с растворимыми, так и с нерастворимыми) — реакция нейтрализации:
NaOH + HCl = NaCl + H2O
Cu(OH)2 + H2SO4 = CuSO4 раствор + 2 H2O.
б) Взаимодействие с солями
BaCl2 + H2SO4 = BaSO4
+ 2HCl
Na2SO3 + H2SO4 = Na2SO4 + SO2
+ H2O.
При составлении уравнений реакций обмена необходимо учитывать условия протекания этих реакций до конца:
а) образование хотя бы одного нерастворимого соединения
б) выделение газа
в) образование слабого электролита ( например, воды)
1.2. Реакции с основными и амфотерными оксидами:
а) FeO + H2SO4 = FeSO4 + H2O б) ZnO + 2 HNO3 = Zn(NO3)2 + H2O.
1.3. Металлы, стоящие в электрохимическом ряду напряжений до водорода, вытесняют водород из кислот, не являющихся сильными окислителями (HCl, H2SO4 (разб.)):
Zn + H2SO4 (разб.) = ZnSO4 +
H2
Mg + 2 HCl
= MgCl2 + H2.
Если в результате реакции образуется нерастворимая соль или оксид, то металл пассивируется и его растворение не происходит:
Pb + H2SO4 (PbSO4 — нерастворим в воде) Al + HNO3 (конц.) (поверхность металла покрывается оксидной пленкой).
1.4. Термически неустойчивые кислоты, например, угольная, сернистая, разлагаются при комнатной температуре или при легком нагревании:
H2CO3 = CO2 + H2O H2SO3 SO2 + H2O SiO2 x H2O SiO2 + x H2O .
1.5. Реакции с изменением степени окисления
кислотообразующего элемента.
4 + MnO2 = MnCl2 + + 2 H2O
+ H2O2 = + H2O
2 + Cu = CuSO4 + + 2 H2O 2 H2S + H2SO3 = 3 S + 3 H2O.
По этому принципу кислоты можно разделить на кислоты-восстановители и кислоты-окислители.
2.1. Реакции обмена. Кислоты-окислители реагируют с оксидами, гидроксидами и солями, в состав которых входят катионы металлов не проявляющих переменные степени окисления также как и кислоты, не являющиеся окислителями (см. 1.1 и 1.2 в п. 2.4).
2.2. Реакции с гидроксидами, оксидами и солями.
а) Если металл, образующий основание, может находиться в нескольких степенях окисления, а кислота проявляет окислительные свойства, то эти реакции могут протекать с изменением степеней окисления элементов, например:
Fe(OH)2 + 4 HNO3 (конц.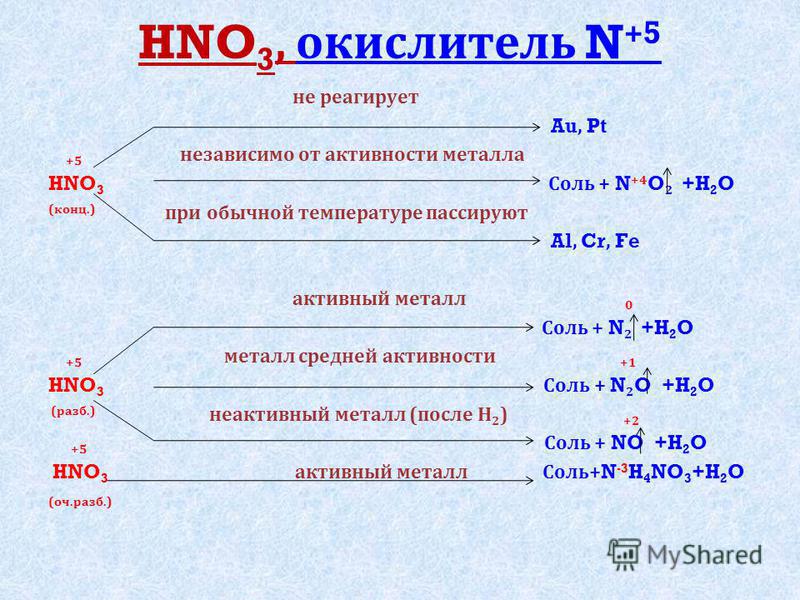 ) =
Fe(NO3)3 + NO2
+ 3 H2O.
) =
Fe(NO3)3 + NO2
+ 3 H2O.
б) Аналогично ведут себя в реакциях с кислотами-окислителями и оксиды металлов, проявляющих переменные степени окисления:
2 FeO + 4 H2SO4(конц.) = Fe2(SO4)3 + SO2 + 4 H2O.
в) При реакциях кислот-окислителей с солями, содержащими анион, проявляющий восстановительные свойства, происходит его окисление:
3 Na2S + 8 HNO3
(разб.) = 6 NaNO3 + 3 S
+ 2 NO
+ 4 H2O
8 NaI +
5 H2SO4 (конц.) = 4 I2+
H2S + 4 Na2SO4 + 4 H2O.
2.3. Взаимодействие с металлами.
Азотная и концентрированная серная кислоты являются сильными окислителями и могут взаимодействовать с металлами, стоящими в ряду напряжений как до, так и после водорода, но водород в этом случае не выделяется, а образуются продукты восстановления азота и серы, причем, состав продуктов зависит от активности металла, концентрации кислоты и температуры:
Cu + 4 HNO3 (конц.) = Cu(NO3)2 + 2 NO2
+ 2 H2O
3 Cu +
8 HNO3 (разб.) = 3 Сu(NO3)2 + 2 NO
+ 4 H2O
5 Co +
12 HNO3 (оч.разб.) = 5 Co(NO3)2 + N2 + 6 H2O
4 Zn
+ 10 HNO3 (оч. разб.) = 4 Zn(NO3)2 + NH4NO3 + 3 H2O.
разб.) = 4 Zn(NO3)2 + NH4NO3 + 3 H2O.
С разбавленной серной кислотой медь не взаимодействует, но реагирует с концентрированной серной кислотой, однако водород при этом не выделяется:
Cu + 2 H2SO4 (конц.) = CuSO4 + SO2 +2 H2O.
Некоторые металлы, стоящие в ряду напряжений до водорода, например, Fe, Al, Cr, эти кислоты пассивируют за счет образования на поверхности металла оксидной пленки нерастворимой в концентрированных кислотах при обычных условиях и поэтому указанные металлы не взаимодействуют с концентрированными серной и азотной кислотами.
2.4. Реакции с неметаллами. Концентрированные азотная и серная кислоты взаимодействуют с неметаллами: серой, фосфором, углеродом:
S + 2 HNO3 (конц. ) H2SO4 + 2 NO
S
+ 2 H2SO4 (конц.) 3 SO2
+ 2 H2O
3 P + 5 HNO3
(конц.) + 2 H2O
3 H3PO4 + 5 NO
C
+ 2 H2SO4 (конц.) CO2 + 2 SO2
+ 2 H2O.
) H2SO4 + 2 NO
S
+ 2 H2SO4 (конц.) 3 SO2
+ 2 H2O
3 P + 5 HNO3
(конц.) + 2 H2O
3 H3PO4 + 5 NO
C
+ 2 H2SO4 (конц.) CO2 + 2 SO2
+ 2 H2O.
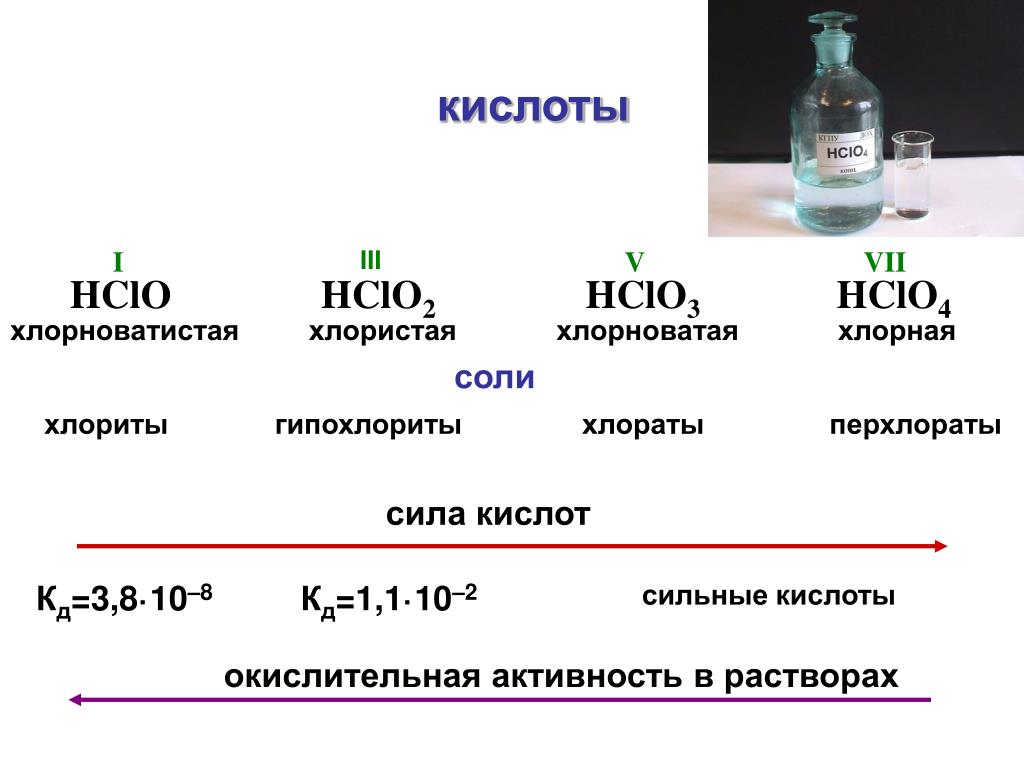
2.5. Кислоты, образованные переходными металлами в высших степенях окисления, например, хромовая [H2CrO4], марганцовая [HMnO4], являются сильными окислителями.
2 H2CrO4 + 3 SO2 = Cr2(SO4)3 + 2 H2O.
Кислоты, в которых кислотообразующий
элемент находится в промежуточной
степени окисления могут проявлять как
окислительные, так восстановительные
свойства.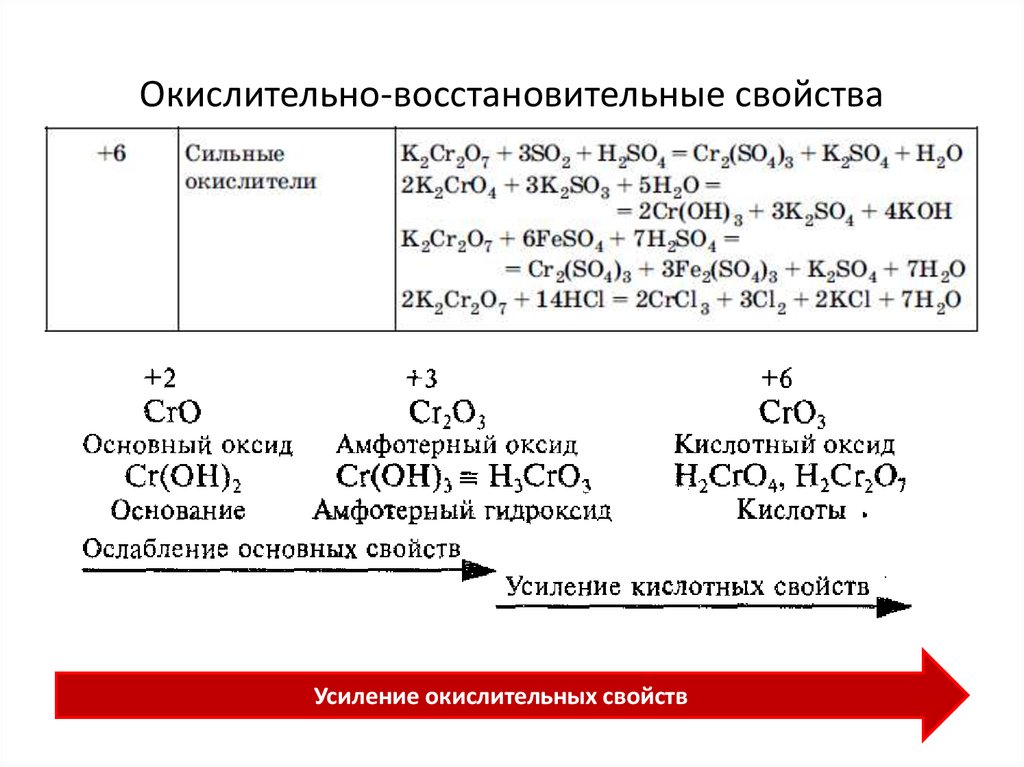
H2SO3 + 2 H2S = 3 S + 3 H2O (H2SO3 — окислитель) H2SO3 + NO2 = H2SO4 + NO (H2SO3 — восстановитель).
Кислоты сильные окислители | CAMEO Chemicals
Добавить в MyChemicals Страница для печати
Реактивная группа Лист данных
Что такое реактивные группы?
Реакционноспособные группы представляют собой категории химических веществ, которые обычно реагируют сходным образом.
способами, поскольку они сходны по своему химическому строению. Каждое вещество с
лист химических данных был назначен одной или нескольким реакционноспособным группам, и
CAMEO Chemicals использует присвоение реактивных групп, чтобы определить свою реакционную способность.
предсказания.
Подробнее о прогнозах реактивности. ..
..
Если вы не можете найти химическое вещество в базе данных, но знаете, какая реактивная группа он принадлежит — вместо этого вы можете добавить реактивную группу в MyChemicals, чтобы чтобы увидеть прогнозы реактивности.
Есть 51 химический паспорт относятся к этой реактивной группе.
Описание
Воспламеняемость
Материалы этой группы обычно негорючие. Они могут ускорять горение других материалов, снабжая место горения кислородом, т. е. выступая в качестве окислителей.
Реакционная способность
Материалы этой группы обычно растворимы в воде с выделением ионов водорода. Полученные растворы имеют pH 1 или около 1. Материалы этой группы реагируют с химическими основаниями (например, аминами и неорганическими гидроксидами) с образованием солей. Эти реакции нейтрализации происходят, когда основание принимает ионы водорода, которые отдает кислота. Нейтрализация может генерировать опасно большое количество тепла в небольших помещениях. Растворение кислот в воде или разбавление их концентрированных растворов водой может привести к значительному выделению тепла. При добавлении воды к кислотам в небольшой области смешения часто выделяется достаточно тепла, чтобы часть воды резко вскипела. В результате «удара» кислота широко разбрызгивается. Эти материалы обладают значительной способностью окислять, но эта способность варьируется (например, азотная кислота является более сильным окислителем, чем серная кислота и большинство сульфокислот). Они могут реагировать с активными металлами, включая железо и алюминий, а также со многими менее активными металлами, растворяя металл и выделяя водород и/или токсичные газы. Следует учитывать последующую стабильность продуктов коррозии (возможно, нитратов). Как и другие кислоты, материалы этой группы могут инициировать полимеризацию в определенных классах органических соединений. Их реакции с цианистыми солями и соединениями выделяют газообразный цианистый водород. Горючие и/или токсичные газы также часто образуются в результате их реакций с дитиокарбаматами, изоцианатами, меркаптанами, нитридами, нитрилами, сульфидами и слабыми или сильными восстановителями.
Растворение кислот в воде или разбавление их концентрированных растворов водой может привести к значительному выделению тепла. При добавлении воды к кислотам в небольшой области смешения часто выделяется достаточно тепла, чтобы часть воды резко вскипела. В результате «удара» кислота широко разбрызгивается. Эти материалы обладают значительной способностью окислять, но эта способность варьируется (например, азотная кислота является более сильным окислителем, чем серная кислота и большинство сульфокислот). Они могут реагировать с активными металлами, включая железо и алюминий, а также со многими менее активными металлами, растворяя металл и выделяя водород и/или токсичные газы. Следует учитывать последующую стабильность продуктов коррозии (возможно, нитратов). Как и другие кислоты, материалы этой группы могут инициировать полимеризацию в определенных классах органических соединений. Их реакции с цианистыми солями и соединениями выделяют газообразный цианистый водород. Горючие и/или токсичные газы также часто образуются в результате их реакций с дитиокарбаматами, изоцианатами, меркаптанами, нитридами, нитрилами, сульфидами и слабыми или сильными восстановителями. Дополнительные газообразующие реакции происходят с сульфитами, нитритами, тиосульфатами (с образованием h3S и SO3), дитионитами (SO2) и даже карбонатами: газообразный диоксид углерода от последних нетоксичен, но тепло и брызги от реакции могут быть хлопотный. Кислоты часто катализируют (увеличивают скорость) химических реакций.
Дополнительные газообразующие реакции происходят с сульфитами, нитритами, тиосульфатами (с образованием h3S и SO3), дитионитами (SO2) и даже карбонатами: газообразный диоксид углерода от последних нетоксичен, но тепло и брызги от реакции могут быть хлопотный. Кислоты часто катализируют (увеличивают скорость) химических реакций.
Токсичность
Разъедает ткани. Кислотные пары особенно сильно раздражают чувствительные ткани (например, глаза и дыхательную систему).
Прочие характеристики
Кислоты имеют кислый вкус; они окрашивают синий лакмус в красный цвет. Сильные кислоты полностью диссоциируют в воде на ионы Н+ и чрезвычайно слабые сопряженные анионы оснований. Окисляющие кислоты диссоциируют с образованием анионов, которые действуют как окислители. Они имеют значение рКа ниже -2 или значение рН менее 2.
Примеры
Кислота серная, кислота азотная, кислота хлорная, кислота хлорсульфоновая, кислота хлорная, кислота нитросерная, кислота селеновая.
Документация по реактивности
Воспользуйтесь ссылками ниже, чтобы узнать, как эта реактивная группа взаимодействует с любым реактивных групп в базе данных.
Прогнозируемые опасности и побочные продукты газа для каждой пары реактивных групп будут отображаться, а также документация и ссылки, которые использовались для делать прогнозы реактивности.
Смешать Кислоты сильные окислители с:
- Ацетали, кетали, полуацетали и полукетали
- Кислоты карбоновые
- Кислоты сильные неокисляющие
- Кислоты сильные окислители
- Кислоты, слабые
- Акрилаты и акриловые кислоты
- Ацилгалогениды, сульфонилгалогениды и хлорформиаты
- Спирты и полиолы
- Альдегиды
- Алкины с ацетиленовым водородом
- Алкины, не содержащие ацетиленового водорода
- Амиды и имиды
- Амины ароматические
- Амины, фосфины и пиридины
- Ангидриды
- Арилгалогениды
- Азо-, диазо-, азидо-, гидразиновые и азидные соединения
- Базы, Сильные
- Базы, слабые
- Карбаматы
- Карбонатные соли
- Хлорсиланы
- Конъюгированные диены
- Цианиды неорганические
- Соли диазония
- Эпоксиды
- Сложные эфиры, сульфатные эфиры, фосфатные эфиры, тиофосфатные эфиры и боратные эфиры
- Эфиры
- Соли фтора, растворимые
- Фторированные органические соединения
- Галогенированные органические соединения
- Галогенирующие агенты
- Углеводороды алифатические насыщенные
- Углеводороды, алифатические ненасыщенные
- Углеводороды, ароматические
- Недостаточно информации для классификации
- Изоцианаты и изотиоцианаты
- Кетоны
- Гидриды металлов, алкилы металлов, арилы металлов и силаны
- Металлы, щелочи, очень активные
- Металлы, элементальные и порошковые, активные
- Металлы менее химически активные
- Соединения нитратов и нитритов, неорганические
- Нитриды, фосфиды, карбиды и силициды
- Нитрилы
- Нитро, нитрозо, нитраты и нитритные соединения, органические
- Неокислительно-восстановительные неорганические соединения
- Не химически активный
- Металлоорганические соединения
- Окислители, сильные
- Окислители, слабые
- Оксимы
- Пероксиды органические
- Фенольные соли
- Фенолы и крезолы
- Полимеризуемые соединения
- Четвертичные аммониевые и фосфониевые соли
- Восстанавливающие агенты, сильные
- Восстанавливающие агенты, слабые
- Соли кислотные
- Соли основные
- Силоксаны
- Сульфиды неорганические
- Сульфиды органические
- Сульфитные и тиосульфатные соли
- Сульфонаты, фосфонаты и тиофосфонаты, органические
- Сложные эфиры и соли тиокарбамата/ Сложные эфиры и соли дитиокарбамата
- Вода и водные растворы
Кислоты сильные неокисляющие | CAMEO Chemicals
Добавить в MyChemicals Страница для печати
Реактивная группа Лист данных
Что такое реактивные группы?
Реакционноспособные группы представляют собой категории химических веществ, которые обычно реагируют сходным образом. способами, поскольку они сходны по своему химическому строению. Каждое вещество с
лист химических данных был назначен одной или нескольким реакционноспособным группам, и
CAMEO Chemicals использует присвоение реактивных групп, чтобы определить свою реакционную способность.
предсказания.
Подробнее о прогнозах реактивности…
способами, поскольку они сходны по своему химическому строению. Каждое вещество с
лист химических данных был назначен одной или нескольким реакционноспособным группам, и
CAMEO Chemicals использует присвоение реактивных групп, чтобы определить свою реакционную способность.
предсказания.
Подробнее о прогнозах реактивности…
Если вы не можете найти химическое вещество в базе данных, но знаете, какая реактивная группа он принадлежит — вместо этого вы можете добавить реактивную группу в MyChemicals, чтобы чтобы увидеть прогнозы реактивности.
Есть 50 химических паспортов относятся к этой реактивной группе.
Описание
Воспламеняемость
Соединения этой группы обычно негорючие.
Реакционная способность
Сильные неокисляющие кислоты обычно растворимы в воде с выделением ионов водорода. Полученные растворы имеют pH 1 или близкий к нему. Кислоты нейтрализуют химические основания (например, амины и неорганические гидроксиды) с образованием солей. Нейтрализация происходит, когда основание принимает ионы водорода, которые отдает кислота. Нейтрализация может генерировать опасно большое количество тепла в небольших помещениях. Растворение кислот в воде или разбавление их концентрированных растворов дополнительным количеством воды может привести к значительному выделению тепла; добавление воды часто вызывает достаточное количество тепла в небольшой области перемешивания, чтобы вызвать взрывное вскипание части воды. В результате «удара» кислота разбрызгивается. Эти материалы реагируют с активными металлами, включая такие конструкционные металлы, как алюминий и железо, с выделением водорода, горючего газа. Они могут инициировать полимеризацию некоторых классов органических соединений. Они реагируют с цианистыми соединениями с выделением газообразного цианистого водорода. Они часто выделяют легковоспламеняющиеся и/или токсичные газы при контакте с дитиокарбаматами, изоцианатами, меркаптанами, нитридами, нитрилами, сульфидами и сильными восстановителями.
Нейтрализация происходит, когда основание принимает ионы водорода, которые отдает кислота. Нейтрализация может генерировать опасно большое количество тепла в небольших помещениях. Растворение кислот в воде или разбавление их концентрированных растворов дополнительным количеством воды может привести к значительному выделению тепла; добавление воды часто вызывает достаточное количество тепла в небольшой области перемешивания, чтобы вызвать взрывное вскипание части воды. В результате «удара» кислота разбрызгивается. Эти материалы реагируют с активными металлами, включая такие конструкционные металлы, как алюминий и железо, с выделением водорода, горючего газа. Они могут инициировать полимеризацию некоторых классов органических соединений. Они реагируют с цианистыми соединениями с выделением газообразного цианистого водорода. Они часто выделяют легковоспламеняющиеся и/или токсичные газы при контакте с дитиокарбаматами, изоцианатами, меркаптанами, нитридами, нитрилами, сульфидами и сильными восстановителями. Дополнительные газообразующие реакции происходят с сульфитами, нитритами, тиосульфатами (с образованием h3S и SO3), дитионитами (SO2) и даже карбонатами: углекислый газ последних нетоксичен, но тепло и брызги от быстрой реакции могут быть хлопотным. Кислоты часто катализируют (увеличивают скорость) химических реакций.
Дополнительные газообразующие реакции происходят с сульфитами, нитритами, тиосульфатами (с образованием h3S и SO3), дитионитами (SO2) и даже карбонатами: углекислый газ последних нетоксичен, но тепло и брызги от быстрой реакции могут быть хлопотным. Кислоты часто катализируют (увеличивают скорость) химических реакций.
Токсичность
Разъедает ткани. Кислотные пары особенно сильно раздражают чувствительные ткани (например, глаза и дыхательную систему).
Прочие характеристики
Кислоты имеют кислый вкус; они окрашивают синий лакмус в красный цвет. Сильные кислоты полностью диссоциируют в воде на ионы Н+ и чрезвычайно слабые сопряженные анионы оснований. Неокисляющие кислоты дают анионы, которые не действуют как окислители. Они имеют значение pKa менее -2 или значение pH менее 2.
Примеры
Соляная кислота, йодистоводородная кислота, бромистоводородная кислота.
Документация по реактивности
Воспользуйтесь ссылками ниже, чтобы узнать, как эта реактивная группа взаимодействует с любым
реактивных групп в базе данных.

Leave A Comment