3.3. Примеры заданий по теме «Окислительно-восстановительные реакции» и комментарии к их решению
Задания по теме окислительно-восстановительные реакции представлены в контрольной работе ЕГЭ на всех уровнях сложности — базовом, повышенном и высоком.
Рассмотрим сначала задания по этой теме на базовом уровне сложности.
1. Процесс окисления отражен схемой
1) | SO3 → SO | 3) | S → SO |
2) | SO → SO2 | 4) | SO → S |
Для успешного
выполнения этого задания необходимо в
первую очередь определить степень
окисления серы в представленных молекулах
и ионах и на основании этого выделить
схему, в которой происходит повышение
степени окисления серы, т.
Руководствуясь правилами для вычисления степени окисления, делаем вывод, что в процессах 1 и 2 степень окисления серы не изменяется, т.е. эти процессы не являются окислительно-восстановительными. В процессе 3 степень окисления серы повышается с 0 до +4 (процесс окисления), в процессе 4 – понижается с +6 до 0 (процесс восстановления). Таким образом, правильный Ответ: 3.
2. В схеме превращений
NO2 NO N2 NH3 NO
азот проявляет восстановительные свойства на стадиях
1) | 1 и 2 | 2) | 1 и 3 | 3) | 2 и 3 | 4) | 1 и 4 |
Как и в предыдущем
задании, в этом задании сначала необходимо
определить степень окисления азота в
молекулах и ионах, а затем выделить
стадии, на которых азот повышает степень
окисления, т.
3. Только окислителем за счет атомов марганца может быть соединение, формула которого
1) | 2) | K2MnO4 | 3) | KMnO4 | 4) | Mn2O3 |
Только окислительные
свойства проявляют атомы, находящиеся
в высшей степени окисления. Высшая
степень окисления марганца равна +7.
Такую степень окисления марганец имеет
в KMnO
Высшая
степень окисления марганца равна +7.
Такую степень окисления марганец имеет
в KMnO
4. Окислительно-восстановительную двойственность за счет атомов азота может проявлять
1) | NH4Cl | 2) | KNO3 | 3) | N2O5 | 4) | NO2 |
Окислительно-восстановительную
двойственность способны проявлять
атомы, имеющие промежуточную степень
окисления. Высшая степень окисления
азота равна +5, низшая равна -3. Промежуточную
степень окисления, равную +4, азот имеет
в NO Ответ:
4.
Ответ:
4.
5. Оксид железа(II) проявляет восстановительные свойства при взаимодействии с
1) | бромоводородной кислотой |
2) | разбавленной серной кислотой |
3) | концентрированной серной кислотой |
4) | углеродом |
Проявляя
восстановительные свойства, оксид
железа(II)
при этом окисляется. Бромоводородная
и разбавленная серная кислота за счет
иона Н+,
не способны окислить железо(II).
Углерод, взаимодействуя с оксидом
железа(II),
восстанавливает железо.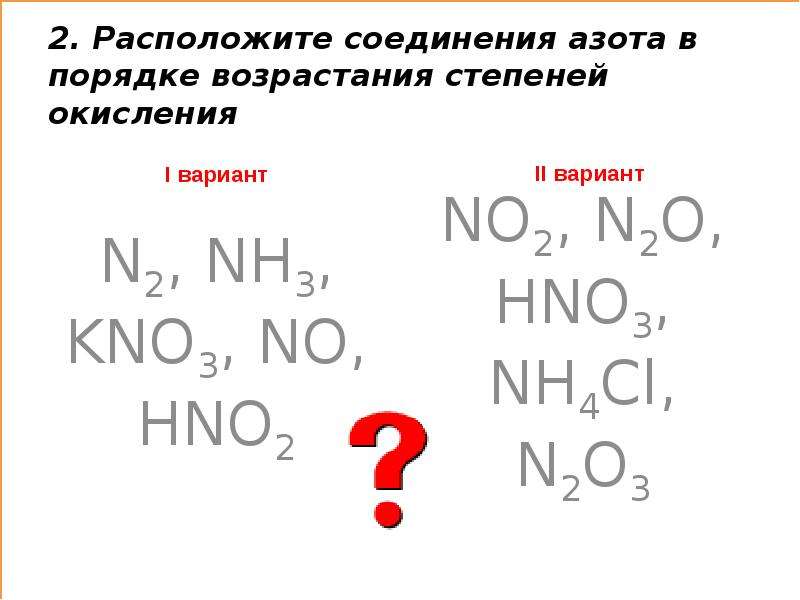
6. Исходя из теории окислительно-восстановительных процессов, укажите схему невозможной реакции
1) | H2SO3 + H2S
→ S + H |
2) | S + KOH → K2S + K2SO3 + H2O |
3) | SO2 + H2SO4 → S + H2O |
4) | Na2SO3 + O2 → Na2SO4 |
Анализируя и прогнозируя продукты окислительно-восстановительных реакций, следует помнить, что
 е. если есть
восстановитель, то обязательно должен
быть окислитель.
Никогда не происходит только один
процесс – окисление или восстановление.
Именно с таких позиций следует подходить
к выполнению этого задания. Определим,
как меняются степени окисления атомов
в представленных схемах реакций и
определим, какие вещества, участвующие
в них, являются окислителями и
восстановителями.
е. если есть
восстановитель, то обязательно должен
быть окислитель.
Никогда не происходит только один
процесс – окисление или восстановление.
Именно с таких позиций следует подходить
к выполнению этого задания. Определим,
как меняются степени окисления атомов
в представленных схемах реакций и
определим, какие вещества, участвующие
в них, являются окислителями и
восстановителями. В реакции 1
окислителем является H2SO3,
восстановителем — H2S;
в реакции 4 – окислитель О
Рассмотрим теперь
примеры заданий по теме
«Окислительно-восстановительные
реакции» на повышенном
уровне сложности.
7.
УРАВНЕНИЕ РЕАКЦИИ | ВОССТАНОВИТЕЛЬ | ||
А) | 4NO2 + O2 + 2H2O = 4HNO3 | 1) | NO2 |
Б) | SO2 + C
= S
+ CO | 2) | SO2 |
В) | SO2 + NO2 = SO3 + NO | 3) | O2 |
Г) | S + 2H2SО4 = 3SО2 + 2H2O | 4) | C |
5) | H2S | ||
6) | S | ||
Определим вещества,
в которых есть атомы, отдающие электроны
и повышающие вследствие этого степень
окисления, т. е. являющиеся восстановителями.
В уравнении А таким веществом является
NO2;
в уравнении Б – С; в уравнении В – SO2;
в уравнении Г – S.
Таким образом, правильный Ответ:
1426.
е. являющиеся восстановителями.
В уравнении А таким веществом является
NO2;
в уравнении Б – С; в уравнении В – SO2;
в уравнении Г – S.
Таким образом, правильный Ответ:
1426.
8. Установите соответствие между схемой реакции и изменением степени окисления окислителя в ней.
СХЕМА РЕАКЦИИ | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ | ||
А) | FeO + Н2 → Fe + Н2O | 1) Fe+2 → Fe0 2) S-2 → S+6 3) O → O2 4) H0 → H— 5) Cl+5 → Cl 6) O → O0 | |
Б) | Н2 + Na → NaH | ||
В) | H2O2 + KClO3 → KCl + H2O + O2 | ||
Г) | H2O2 + PbS → PbSO4 + H2O | ||
В реакции А
окислителем является FeO
за счет атомов железа, понижающих степень
окисления с +2 до 0. В реакции Б окислитель
— Н2,
при этом атомы водорода понижают степень
окисления с 0 до -1.
В реакции Б окислитель
— Н2,
при этом атомы водорода понижают степень
окисления с 0 до -1.
Пероксид водорода Н2О2 за счет атома кислорода в промежуточной степени окисления -1 может проявлять как окислительные, так и восстановительные свойства. В реакции В пероксид водорода является восстановителем, так как кислород повышает степень окисления с -1 до 0, а окислительные свойства проявляет KClO3 за счет атомов хлора, повышающих степень окисления с +5 до -1. А в реакции Г пероксид водорода является окислителем, так как кислород понижает степень окисления с -1 до -2. Ответ: 1453.
В заданиях С1 высокого
уровня сложности необходимо составить уравнение
окислительно-восстановительной реакции,
используя метод электронного баланса.
Окислительно-восстановительные реакции
требуется составить также при выполнении
заданий С2 (генетическая связь между
различными классами неорганических
веществ) и иногда – С3 (генетическая
связь между различными классами
органических веществ) и С4 (расчетная
задача).
Приведем пример задания С1 (задания С3 и С4, при выполнении которых также необходимо составить уравнения окислительно-восстановительных реакций, будут рассмотрены в соответствующих разделах курса).
9. Используя метод электронного баланса, составьте уравнение реакции:
H2SO4 + … → H2S + I2+ Na2SO4 + …
Определите окислитель и восстановитель.
Проанализируем,
атомы каких элементов изменяют степень
окисления. В этой реакции атомы серы в
молекуле серной кислоты меняют степень
окисления с +6 до -2, т.е. присоединяют
электроны, проявляя при этом окислительные
свойства. В левой части схемы реакции
не хватает восстановителя, однако в
правой части есть продукт его окисления
– I2,
в молекуле которого степень окисления
йода равна 0. С учетом того, что
восстановитель отдает электроны, а
низшая степень окисления йода равна
-1, делаем вывод, что восстановителем
должно быть соединение йода именно в
этой степени окисления. Так как среди
продуктов есть соединение натрия —
Na2SO4,
то, вероятно, восстановителем должен
быть йодид натрия NaI.
Составим электронный баланс:
Так как среди
продуктов есть соединение натрия —
Na2SO4,
то, вероятно, восстановителем должен
быть йодид натрия NaI.
Составим электронный баланс:
1 | S+6 + 8 e → S-2 |
4 | I — 2e → 2I‾ |
Перенесем найденные главные коэффициенты в уравнение реакции:
H2SO4 + 8NaI = H2S + 4I2 + Na2SO4 + …
Подсчет числа атомов натрия показывает, что в левой части их 8, а в правой – 3, поэтому перед формулой Na2SO4 следует поставить коэффициент 4:
H2SO4 + 8NaI = H2S + 4I2 + 4Na2SO4 + …
Подсчет числа
атомов серы показывает, что в левой
части их 5, а в правой — 1. Поэтому перед
формулой H2SO4 следует поставить коэффициент 5:
Поэтому перед
формулой H2SO4 следует поставить коэффициент 5:
5H2SO4 + 8NaI = H2S + 4I2 + 4Na2SO4 + …
Наконец, делаем вывод, что в левой части атомов водорода 10, а в правой – 2. Уравниваем число атомов водорода, добавив в правую часть вместо многоточия 4 молекулы воды:
5H2SO4 + 8NaI = H2S + 4I2 + 4Na2SO4 + 4Н2О
Для окончательной проверки правильности расстановки коэффициентов подсчитаем число атомов кислорода в правой и левой частях уравнения: и в правой, и в левой частях по 20 атомов кислорода. Это свидетельствует о том, что коэффициенты в уравнении реакции расставлены верно.
Правильный ответ должен выглядеть следующим образом:
H2SO4 + … → H2S + I2+ Na2SO4 + …
1 | S+6 + 8 e → S-2 |
4 | I — 2e → 2I‾ |
5H2SO4 + 8NaI = H2S + 4I2 + 4Na2SO4 + 4Н2О
Окислитель — H2SO4 за счет атомов серы в степени окисления
+6; восстановитель – NaI
за счет атомов йода в степени окисления
-1.
Урок 14. Азот и фосфор – HIMI4KA
Самоучитель по химии › Неорганическая химия
Содержание
- Строение атома и свойства азота
- Аммиак и соли аммония
- Азотная кислота и её соли
- Строение атома и свойства фосфора
- Свойства и значение соединений фосфора
- Выводы
Строение атома и свойства азота
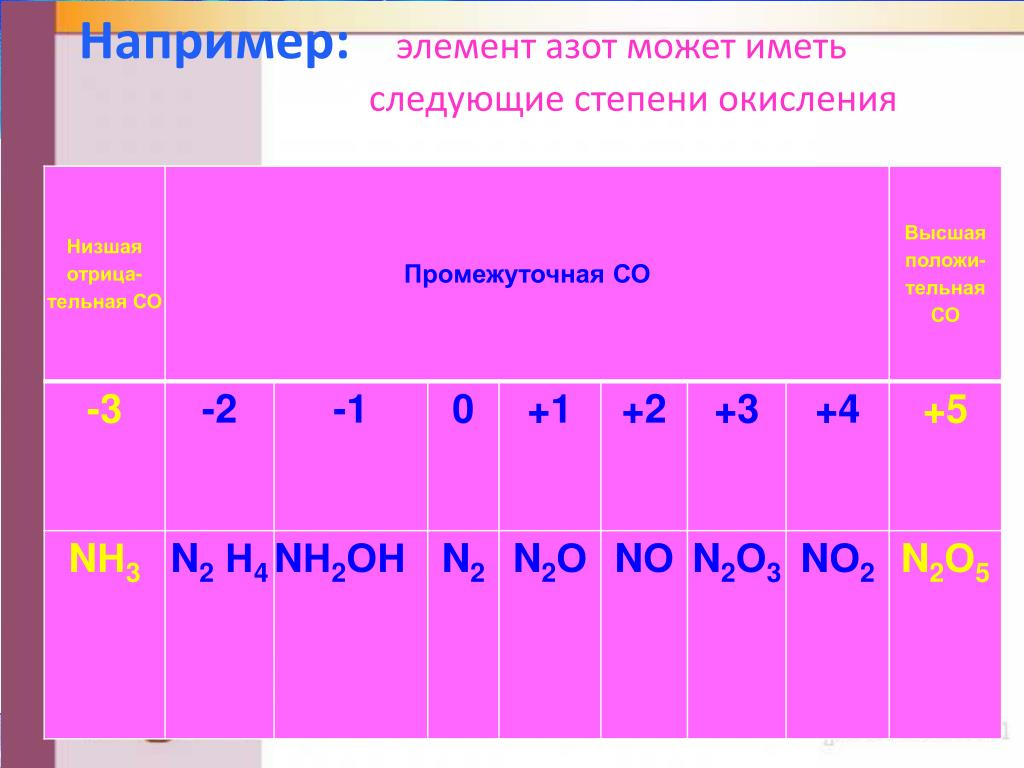
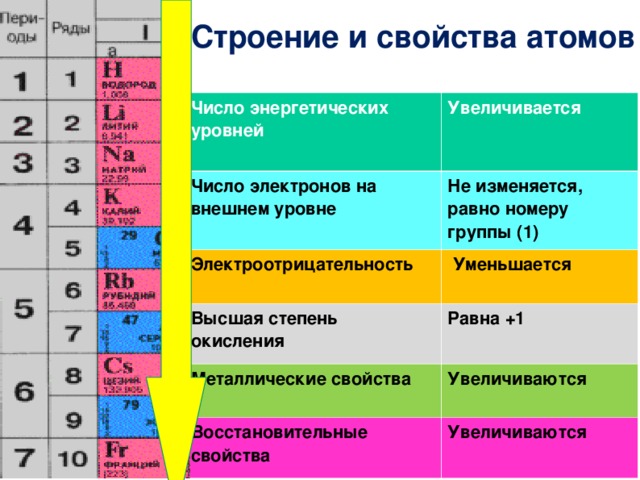
Азот — элемент пятой группы второго периода Периодической системы Менделеева.
Задание 14.1. Опишите строение атома этого элемента.
Имея на внешнем энергетическом уровне пять электронов, азот является типичным неметаллом, т. е. способен и принимать и отдавать электроны:
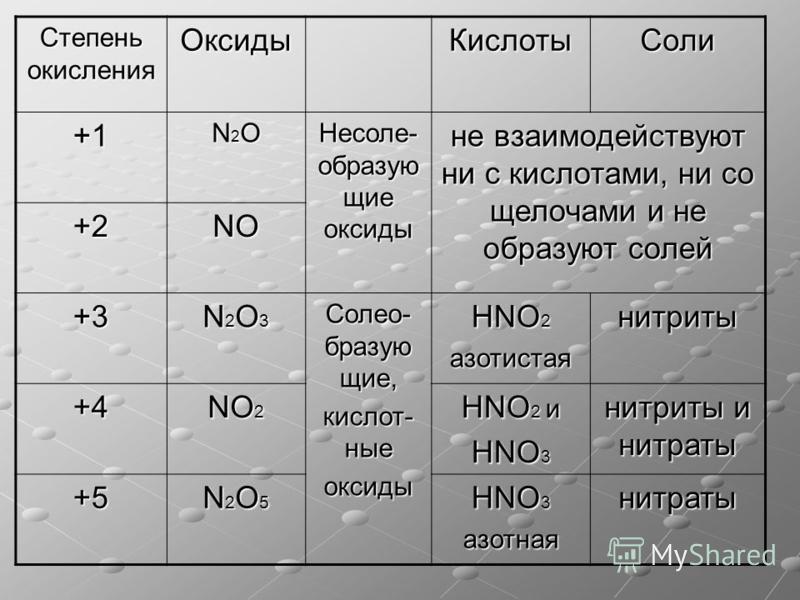
Задание 14.2. Составьте формулы простейших соединений азота с высшей (+5) и низшей (–3) степенями окисления (в случае затруднений см. урок 3).
Задание 14.3. Определите степени окисления азота в соединениях:
В своих соединениях атом азота может проявлять любые степени окисления от –3 до +5. Свойства некоторых из этих соединений будут рассмотрены ниже.
Свойства некоторых из этих соединений будут рассмотрены ниже.
Простое вещество — азот N2 — составляет 4/5 Земной атмосферы. Азот в виде соединений (белков) входит в состав всех живых существ. Неорганических соединений азота в земной коре очень мало: 0,002 % по массе.
Вопрос. Какой тип химической связи соединяет атомы азота в его молекуле N2?
Поскольку в этой молекуле объединяются одинаковые атомы — связь ковалентная неполярная:
Кроме того, это — тройная связь, на разрыв которой требуется затратить очень много энергии. Поэтому при нормальных условиях азот не реагирует ни с одним веществом, кроме лития. При определённых условиях (нагревание, присутствие катализатора) азот реагирует с некоторыми металлами и неметаллами:
Задание 14.4. Расставьте коэффициенты. Определите, какие свойства (окислителя или восстановителя) проявляет азот в этих реакциях.
Поскольку атом азота в молекуле азота N2 имеет промежуточную степень окисления 0, в химических реакциях он может быть и окислителем и восстановителем:
Так как азот с трудом вступает в химические реакции, он относится к инертным газам и используется там, где нужно изолировать что-либо от окислительного действия кислорода: внутри баллона лампочки накаливания, атмосфера нефтехранилища и т. д.
Очень низкая температура кипения жидкого азота (–195,8 °C) позволяет быстро замораживать пищевые продукты и сохранять их в таком виде длительное время.
Важнейшими органическими соединениями азота являются белки, которые входят в состав любого живого организма. Но большинство живых существ не могут получать белки из атмосферного азота (связывать азот). Для этого нужны его соединения. Важнейшими неорганическими соединениями азота являются аммиак, азотная кислота и их соли.
Аммиак и соли аммония
Аммиак NH3 — бесцветный газ с резким запахом, ядовит.
Задание 14.5. Составьте электронную и графическую формулы аммиака и определите тип химической связи в этой молекуле.
Поскольку связь N-Н сильно полярна, аммиак очень хорошо растворяется в полярном растворителе (воде) и реагирует с нею:
Вопрос. Какую реакцию среды имеет полученный раствор?
В результате этой реакции в растворе появляется избыток ионов ОН–, поэтому раствор аммиака в воде (аммиачная вода, нашатырный спирт) имеет щелочную среду и проявляет свойства слабого основания. Называется это основание «гидроксид аммония», и ему приписывают формулу NH4OH. Поскольку это щёлочь (растворимое основание), получаемая из летучего вещества (газа), её называют «летучей щёлочью».
Вопрос. Будет ли аммиак, а также его водный раствор реагировать с кислотами? щелочами?
Проявляя основные свойства, аммиак реагирует только с кислотами и не реагирует со щелочами:
В результате таких реакций образуются соли аммония, в которых вместо катиона металла имеется одновалентный катион аммония NH4+. Соли аммония имеют ряд особенностей:
Соли аммония имеют ряд особенностей:
1. Соли аммония, как соли слабого основания, реагируют со щелочами:
Задание 14.6. Составьте уравнение этой реакции в ионномолекулярном виде. Не забудьте, что гидроксид аммония — слабое основание.
Если такая реакция идёт при нагревании, то получается аммиак в виде газа. Это лабораторный способ получения аммиака:
Кроме того, появляется характерный запах — качественный признак присутствия солей аммония в смеси. Эту реакцию используют для получения аммиака в лаборатории.
Вопрос. Будут ли соли аммония подвергаться гидролизу?
2. Соли аммония, как соли слабого основания, подвергаются гидролизу:
Вопрос. Какая реакция среды получается в результате данного процесса?
Задание 14.7. Составьте уравнение реакции гидролиза нитрата аммония. Какой цвет имеет лакмус в этом растворе?
3. Соли аммония, как соли летучего основания, разлагаются при нагревании. При этом может выделяться аммиак:
Соли аммония, как соли летучего основания, разлагаются при нагревании. При этом может выделяться аммиак:
Но если соль образована кислотой, анион которой является сильным окислителем, аммиак не выделяется:
Почему в этом случае не выделяется аммиак? Возможно, что сначала процесс идёт как обычно:
Но поскольку азотная кислота — окислитель, а аммиак — восстановитель, они тут же реагируют друг с другом. При разложении нитрата аммония возможны и другие продукты реакции:
Задание 14.8. Составьте электронный баланс для реакций (1) и (2), укажите окислитель и восстановитель.
Вопрос. Почему атом азота в аммиаке проявляет восстановительные свойства? Может ли этот атом принимать электроны?
Атом азота в молекуле аммиака имеет низшую степень окисления –3 и поэтому способен только отдавать электроны и проявлять восстановительные свойства. Поэтому аммиак легко реагирует с окислителями, например с кислородом, и горит:
Реакция (3) практического смысла не имеет: зачем возвращать в атмосферу азот, который только что с таким трудом был превращён в аммиак? Зато реакция (4) каталитического окисления аммиака используется при получении азотной кислоты. Кроме того, аммиак и его соли применяются как азотные удобрения, а нитрат аммония входит в состав взрывчатых смесей.
Кроме того, аммиак и его соли применяются как азотные удобрения, а нитрат аммония входит в состав взрывчатых смесей.
Азотная кислота и её соли
Азотную кислоту получают в три стадии. Первая — каталитическое окисление аммиака. Полученный бесцветный газ NO окисляют в бурый газ NO2:
Эта реакция идёт даже при нормальных условиях. Полученный бурый газ NO2 очень ядовит, имеет резкий запах. Растворением его в воде в присутствии кислорода получают азотную кислоту:
Азотная кислота — очень сильный электролит, в растворе полностью диссоциирует на ионы:
Вопрос. Какие свойства проявляет атом азота азотной кислоты в окислительно-восстановительных реакциях?
Поскольку атом азота в азотной кислоте находится в высшей степени окисления +5, азотная кислота — сильный окислитель. Она окисляет и простые и сложные вещества:
Органические вещества, входящие в состав бумаги, хлопка, скипидара, могут загореться при соприкосновении с концентрированной азотной кислотой. Не удивительно поэтому, что при взаимодействии металлов с азотной кислотой не удаётся получить водород в качестве продукта реакции:
Не удивительно поэтому, что при взаимодействии металлов с азотной кислотой не удаётся получить водород в качестве продукта реакции:
Действительно, водород — восстановитель, а азотная кислота — окислитель, и они легко реагируют друг с другом в момент выделения водорода. В результате таких реакций образуются оксиды азота или аммиак, который образует с азотной кислотой соль аммония:
Обратите внимание.
- Концентрированная азотная кислота не реагирует с алюминием, хромом и железом, так как образует на их поверхности прочную оксидную плёнку, которая предохраняет металл от дальнейшего окисления (пассивирует его).
- Азотная кислота реагирует даже с теми металлами, которые стоят в ряду напряжений после водорода (водород и здесь НЕ выделяется!).
- Продукт реакции зависит и от активности металла и от разбавления кислоты: чем активнее металл и чем разбавленнее кислота, тем сильнее восстанавливается кислота, т.
 е. сильнее изменяется степень окисления атома азота (вплоть до –3).
е. сильнее изменяется степень окисления атома азота (вплоть до –3).
Задание 14.9. Расставьте коэффициенты в этих уравнениях реакций, пользуясь методом электронного баланса.
В любой из этих реакций образуется соль азотной кислоты — нитрат. Нитраты — это хорошо растворимые соли, применяемые часто в качестве удобрений (KNO3, NH4NO3). Соединения азота используются в качестве удобрений, поскольку растения, как и человек, не способны усваивать азот воздуха, т. е. не способны превращать N2 в органические соединения азота. А без этих соединений — аминокислот, белков, нуклеиновых кислот — жизнь в принципе невозможна.
При использовании таких удобрений следует помнить, что избыток нитратов в почве и растениях опасен для жизни, так как нитраты ядовиты!
Нитраты легко разлагаются при нагревании, причём продукты разложения зависят от активности металла. Так, нитраты очень активных металлов — селитры — разлагаются по схеме:
Задание 14. 10. Составьте уравнение реакции разложения нитрата натрия.
10. Составьте уравнение реакции разложения нитрата натрия.
Селитры входят в состав взрывчатых веществ. Так, нитрат калия входит в состав чёрного пороха. Действием на сухие нитраты концентрированной серной кислотой можно получить азотную кислоту.
Строение атома и свойства фосфора
Фосфор был получен и назван алхимиком Брандом*, который пытался найти философский камень.
* БРАНД Хённинг (ок. 1630–после 1710) — немецкий алхимик без специального образования, профессиональный военный.
Этот камень, по убеждению алхимиков, мог превращать металлы в золото, обладал магическими свойствами. В 1669 году Бранд из остатков прозаической мочи выделил вещество, которое светилось в темноте. Безусловно, такими свойствами мог обладать только философский камень! Увы, никакими чудодейственными свойствами это вещество не обладало, но способность свечения в темноте подарило веществу и химическому элементу имя: его назвали фосфор, что означает «несущий свет».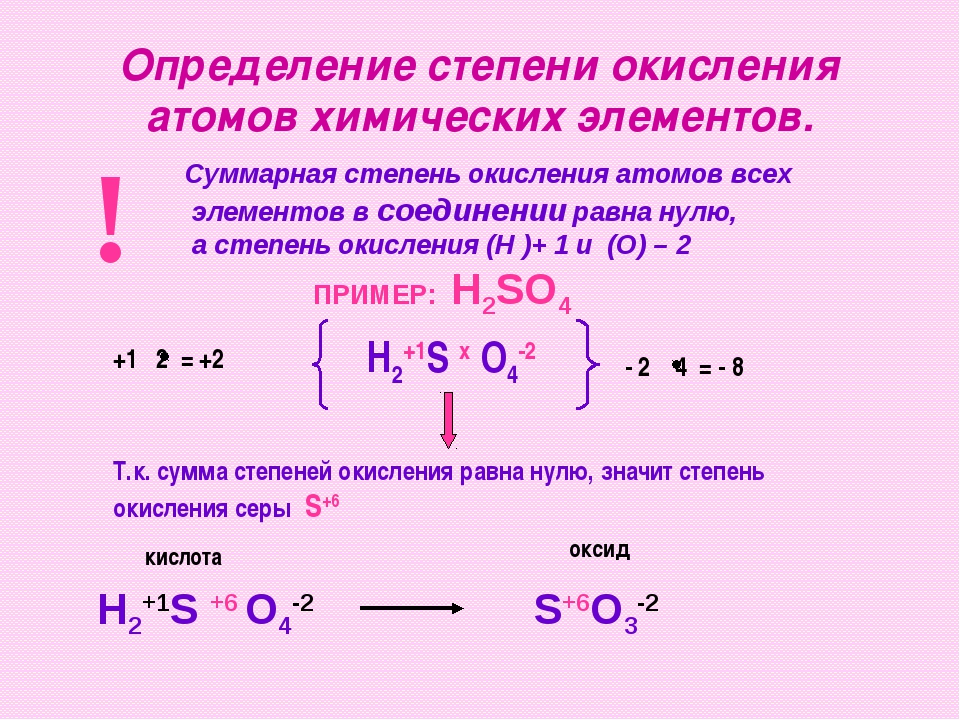
Задание 14.11. Составьте электронную схему строения атома фосфора, укажите распределение валентных электронов, возможные степени окисления.
Распределение валентных электронов атома фосфора:
Поэтому фосфор проявляет в соединениях степени окисления –3, +3 и +5.
Задание 14.12. Составьте формулы водородных соединений, оксидов и гидроксидов фосфора, которые соответствуют этим степеням окисления.
Ниже мы рассмотрим свойства этих соединений, но вначале следует описать свойства простого вещества.
Как и для углерода, для фосфора характерно несколько аллотропных модификаций. В природе они не встречаются ввиду высокой активности этого неметалла. Почему, собственно, светился фосфор, полученный алхимиком? Потому что это был белый фосфор. Он имеет состав Р4. Это неполярное вещество, легко испаряется (возгоняется), причём пары белого фосфора окисляются на воздухе. При этом энергия химической реакции переходит в световую:
Появляется свечение.
Полученный оксид проявляет ярко выраженный кислотные свойства, так как фосфор — активный неметалл, а степень окисления атома фосфора — высшая. Поэтому при попадании на кожу белого фосфора появляются глубокие, плохо заживающие ожоги. Кроме того, белый фосфор, его пары — токсичное вещество. Белый фосфор — желтоватое мягкое вещество, растворимое в неполярных растворителях.
В противоположность ему — красный фосфор достаточно инертное вещество, безвредное для человека, но при условии, что оно — абсолютно чистое. Примеси белого фосфора, которые довольно часто встречаются, делают его ядовитым. В чём причина такого разительного изменения свойств? В том, что красный фосфор и другие аллотропные модификации фосфора — являются неорганическими полимерами. И чем выше степень полимеризации, тем инертнее вещество, тем темнее цвет. В настоящее время кроме чёрного фосфора описаны свойства жёлтого, алого, фиолетового, коричневого и даже стеклообразного.
Чаще всего встречаются и используются белый, красный и чёрный фосфор. Рассмотрим свойства красного фосфора.
Рассмотрим свойства красного фосфора.
Красный фосфор — это красно-бурый аморфный порошок практически нерастворимый в воде и неполярных растворителях, поскольку это полимер. Степень полимеризации установить невозможно, поэтому химическая формула Р. В зависимости от того, происходит ли горение в избытке или недостатке кислорода, образуются разные оксиды:
Кроме того, фосфор реагирует с активными металлами и неметаллами:
Задание 14.13. Составить уравнение реакции фосфора с кальцием. Назвать полученное вещество.
Фосфиды, как и нитриды, силициды, разлагаются водой и кислотами. В результате образуется фосфин — ядовитый газ с неприятным чесночным запахом. Он способен самовоспламеняться на воздухе:
Именно огоньки-вспышки этого газа пугают прохожих на кладбищах, поскольку фосфин образуется при гниении белковых тел. А это означает, что фосфор, как и азот, — биогенный элемент. Биологические свойства соединений фосфора будут рассмотрены ниже.
Биологические свойства соединений фосфора будут рассмотрены ниже.
Вышеперечисленные реакции подтверждают ранее установленное правило: атомы с промежуточной степенью окисления проявляют свойства и окислителя, и восстановителя. Восстановительные свойства фосфора проявляются при взаимодействии с бертолетовой солью KClO3:
Эта реакция начинается при лёгком нагревании, трении, а иногда и без причин. В результате может произойти сильная вспышка. Мы её наблюдаем всякий раз, как только чиркаем спичкой о спичечный коробок. В состав спичечной головки входит бертолетова соль KClO3 и сера, а в состав намазки — красный фосфор и толчёное стекло.
Свойства и значение соединений фосфора
Как уже было показано выше, фосфор образует два вида оксидов Р2О3 и Р2О5. Это кислотные оксиды, образующие с водой фосфористую кислоту Н3РО3 и несколько фосфорных кислот. Состав фосфорных кислот отражает формула х Р2О5 · у Н2О:
Состав фосфорных кислот отражает формула х Р2О5 · у Н2О:
Метафосфорная кислота неустойчива и, присоединяя воду, превращается в более устойчивую кислоту:
Или в суммарном виде:
Ортофосфорная кислота диссоциирует в три стадии:
Поэтому она образует три вида солей: КН2РО4 — дигидрофосфат, К2НРО4 — гидрофосфат, К3РО4 — фосфат. Эти соли, их растворы имеют разные свойства. Так, если большинство фосфатов нерастворимы в воде, кислые фосфаты имеют бОльшую растворимость.
Поскольку фосфор химически активен, в природе встречаются только нерастворимые соединения фосфора, в основном фосфаты. Они составляют основу таких минералов как апатиты и фосфориты. Основу фосфоритов составляет фосфат кальция, а в состав апатитов кроме него входят хлориды и фториды кальция.
Аналогичный состав имеют наши кости (фосфориты) и зубы (фторапатиты). В теле взрослого человека до 1,5 кг этого химического элемента. Таким образом, фосфор — биогенный элемент. Атомы фосфора входят в состав ДНК и РНК (нуклеиновых кислот), которые хранят и воспроизводят генетическую информацию. Кроме того, атомы фосфора входят в состав АТФ (аденозинтрифосфорной кислоты), при гидролизе которой выделяется аккумулированная в этой молекуле энергия.
В теле взрослого человека до 1,5 кг этого химического элемента. Таким образом, фосфор — биогенный элемент. Атомы фосфора входят в состав ДНК и РНК (нуклеиновых кислот), которые хранят и воспроизводят генетическую информацию. Кроме того, атомы фосфора входят в состав АТФ (аденозинтрифосфорной кислоты), при гидролизе которой выделяется аккумулированная в этой молекуле энергия.
Фосфор в чистом виде получают при нагревании измельчённых фосфоритов с песком и коксом:
Полученный фосфор используется при изготовлении спичек и пиротехнических составов, ядохимикатов, СМС (синтетических моющих средств) и многого другого.
Выводы
Азот — это элемент жизни, поскольку он входит в состав любого живого организма в виде белков, нуклеиновых кислот. С другой стороны, газ азот обладает инертными свойствами, с трудом вступает в химические реакции, составляет основу атмосферы Земли. Фосфор совместно с азотом входит в состав ДНК, РНК, АТФ. Многочисленные соединения фосфора незаменимы в быту.
Урок 15. Сера →
← Урок 13. Углерод и кремний
Степени окисления переходных металлов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 650
Степень окисления элемента связана с количеством электронов, которые атом теряет, приобретает или, по-видимому, использует при соединении с другим атомом в соединениях. Он также определяет способность атома окислять (терять электроны) или восстанавливать (приобретать электроны) другие атомы или частицы. Почти все переходные металлы имеют несколько экспериментально наблюдаемых степеней окисления.
Введение
Для заполнения атомных орбиталей требуется определенное количество электронов.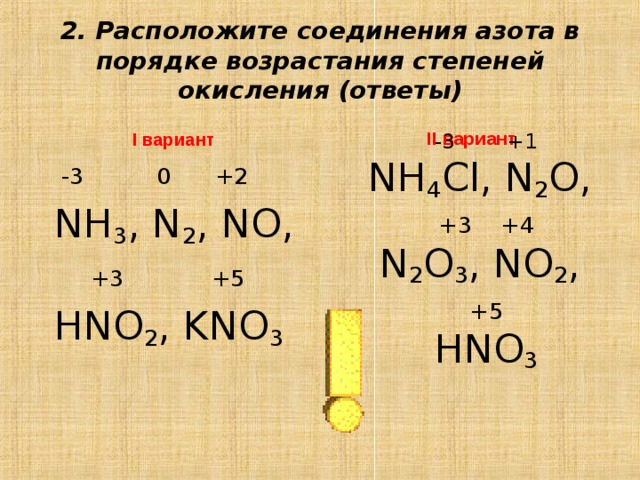 S-блок состоит из элементов I и II групп, щелочных и щелочноземельных металлов (к этому блоку относятся натрий и кальций). Группы с XIII по XVIII включают p-блок, который содержит неметаллы, галогены и инертные газы (обычными членами являются углерод, азот, кислород, фтор и хлор). Переходные металлы находятся в d-блоке между группами III и XII. Если следующая таблица покажется вам странной или ориентация неясна, просмотрите раздел, посвященный атомным орбиталям.
S-блок состоит из элементов I и II групп, щелочных и щелочноземельных металлов (к этому блоку относятся натрий и кальций). Группы с XIII по XVIII включают p-блок, который содержит неметаллы, галогены и инертные газы (обычными членами являются углерод, азот, кислород, фтор и хлор). Переходные металлы находятся в d-блоке между группами III и XII. Если следующая таблица покажется вам странной или ориентация неясна, просмотрите раздел, посвященный атомным орбиталям.
| с Орбитальный | p Орбиты | d Орбиты |
|---|---|---|
| 1 орбиталь, 2 электрона | 3 орбитали: p x , p y , p z ; 6 электронов | 5 орбиталей: d x 2 -y 2 , d z 2 , d xy , 7 y |
| Орбиталь с наивысшей энергией для данного квантового числа n | Вырожденный с s-орбиталью квантового числа n+1 |
Главное, что нужно помнить об электронной конфигурации, это то, что наиболее стабильная конфигурация благородного газа идеальна для любого атома. Формирование связей — это способ приблизиться к этой конфигурации. В частности, переходные металлы образуют более мягкие связи с анионами, катионами и нейтральными комплексами по сравнению с другими элементами. Это связано с тем, что d-орбиталь довольно размыта (в большей степени f-орбиталь серий лантанидов и актинидов).
Формирование связей — это способ приблизиться к этой конфигурации. В частности, переходные металлы образуют более мягкие связи с анионами, катионами и нейтральными комплексами по сравнению с другими элементами. Это связано с тем, что d-орбиталь довольно размыта (в большей степени f-орбиталь серий лантанидов и актинидов).
Электронные конфигурации нейтрального атома
Счет в периодической таблице — это простой способ определить, какие электроны находятся на каких орбиталях. Как упоминалось ранее, подсчитав протоны (атомный номер), вы можете определить количество электронов в нейтральном атоме. Организация по блокам ускоряет этот процесс. Например, если бы нас интересовало определение электронной организации ванадия (атомный номер 23), мы бы начали с водорода и продвигались вниз по периодической таблице).
1s (H, He), 2s (Li, Be), 2p (B, C, N, O, F, Ne), 3s (Na, Mg), 3p (Al, Si, P, S, Cl, Ar), 4s (K, Ca), 3d (Sc, Ti, V).
Если вы не уверены в этой системе счета и в том, как заполняются электронные орбитали, см. раздел о конфигурации электронов.
раздел о конфигурации электронов.
Ссылка на приведенную ниже периодическую таблицу подтверждает эту организацию. У нас есть три элемента на 3d-орбитали. Поэтому пишем в порядке заполнения орбиталей.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3
or
[Ar] 4s 2 3d 3 .
Конфигурации нейтральных атомов переходных металлов четвертого периода приведены в таблице \(\PageIndex{2}\).
| Sc | Ти | В | Кр | Мн | Фе | Со | Никель | Медь | Цинк |
|---|---|---|---|---|---|---|---|---|---|
| [Ar] 4s 2 3d 1 | [Ar] 4s 2 3d 2 | [Ar] 4s 2 3d 3 | [Ar] 4s 2 3d 4 | [Ar] 4s 2 3d 5 | [Ar] 4s 2 3d 6 | [Ar] 4s 2 3d 7 | [Ar] 4s 2 3d 8 | [Ar] 4s 2 3d 9 | [Ar] 4s 2 3d 10 |
| [Ar] 4s 1 3d 5 | [Ar] 4s 1 3d 10 |
Хром и медь выглядят аномально. Взгляните на место элемента Chromium (атомный номер 24) в периодической таблице (рисунок \(\PageIndex{1}\)). Электронная конфигурация хрома не [Ar] 4s 2 3d 4 , а [Ar] 4s 1 3д 5 . Это связано с тем, что наполовину заполненное 3d-многообразие (с одним 4s-электроном) более стабильно, чем частично заполненное d-многообразие (и заполненное 4s-многообразие). Из таблицы \(\PageIndex{2}\) вы заметите, что медь демонстрирует аналогичное явление, хотя с полностью заполненным d-коллектором.
Взгляните на место элемента Chromium (атомный номер 24) в периодической таблице (рисунок \(\PageIndex{1}\)). Электронная конфигурация хрома не [Ar] 4s 2 3d 4 , а [Ar] 4s 1 3д 5 . Это связано с тем, что наполовину заполненное 3d-многообразие (с одним 4s-электроном) более стабильно, чем частично заполненное d-многообразие (и заполненное 4s-многообразие). Из таблицы \(\PageIndex{2}\) вы заметите, что медь демонстрирует аналогичное явление, хотя с полностью заполненным d-коллектором.
Степени окисления ионов переходных металлов
При рассмотрении ионов мы добавляем или вычитаем отрицательные заряды из атома. Учет атомных орбиталей при присвоении степеней окисления помогает понять, что переходные металлы представляют собой особый случай, но не исключение из этого удобного метода. Атому, который принимает электрон для достижения более стабильной конфигурации, присваивается степень окисления -1. Пожертвование электрона тогда +1. Когда переходный металл теряет электроны, он имеет тенденцию терять свои s-орбитальные электроны раньше любого из своих d-орбитальных электронов. Для более подробного обсуждения формы этих соединений см. Образование координационных комплексов.
Когда переходный металл теряет электроны, он имеет тенденцию терять свои s-орбитальные электроны раньше любого из своих d-орбитальных электронов. Для более подробного обсуждения формы этих соединений см. Образование координационных комплексов.
Пример \(\PageIndex{1}\)
Запишите электронные конфигурации:
- нейтральное железо,
- ион железа (II) и
- ион железа(III).
- Ответить
Атомный номер железа равен 26, поэтому в этом веществе 26 протонов.
- Fe: [Ar] 4s 2 3d 6
- Fe 2 + : [Ar] 3d 6
- Fe 3 + : [Ar] 3d 5
Обратите внимание, что сначала теряются s-орбитальные электроны , затем d-орбитальные электроны.
Пример \(\PageIndex{2}\)
Определите более стабильную конфигурацию между следующей парой:
- [Kr] 5s 2 4d 6 по сравнению с [Kr] 5s 1 4
- Ag 1 + против Ag 2 +
- Ответить
- Здесь описывается рутений.
 Имеется только один 5s электрон.
Имеется только один 5s электрон. - Однократно окисленное серебро ([Kr] 4d 10 ) более стабильно, чем дважды- ([Kr] 4d 9 ).
- Здесь описывается рутений.
Несколько степеней окисления
Большинство переходных металлов имеют несколько степеней окисления, поскольку переходные металлы относительно легко теряют электроны по сравнению с щелочными металлами и щелочноземельными металлами. Щелочные металлы имеют один электрон на валентной s-орбитали, а их ионы почти всегда имеют степень окисления +1 (из-за потери одного электрона). Точно так же щелочноземельные металлы имеют два электрона на своих валентных s-орбиталях, что приводит к образованию ионов со степенью окисления +2 (из-за потери обоих). Однако переходные металлы более сложны и демонстрируют ряд наблюдаемых степеней окисления, в первую очередь из-за удаления d-орбитальных электронов. В следующей таблице описаны наиболее распространенные степени окисления элементов периода 3.
Скандий — один из двух элементов первого периода переходного металла, который имеет только одну степень окисления (другой — цинк со степенью окисления +2).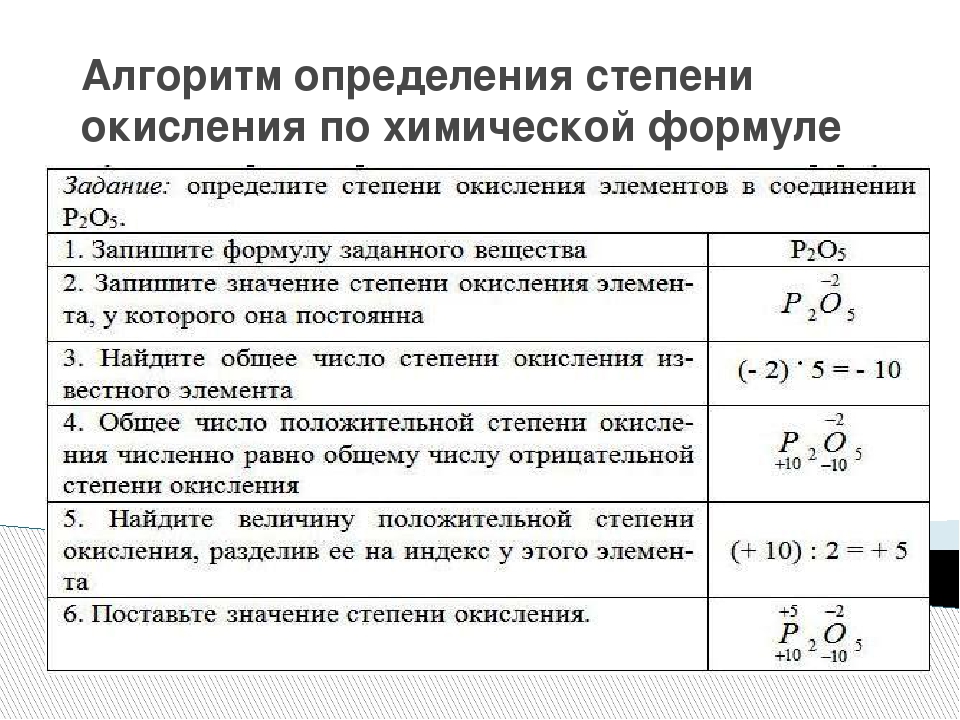 Все остальные элементы имеют как минимум две различные степени окисления. Марганец, находящийся в середине периода, имеет наибольшее количество степеней окисления и, действительно, самую высокую степень окисления за весь период, поскольку у него пять неспаренных электронов (см. таблицу ниже).
Все остальные элементы имеют как минимум две различные степени окисления. Марганец, находящийся в середине периода, имеет наибольшее количество степеней окисления и, действительно, самую высокую степень окисления за весь период, поскольку у него пять неспаренных электронов (см. таблицу ниже).
Чтобы помочь запомнить стабильность более высоких степеней окисления для переходных металлов, важно знать тенденцию: стабильность более высоких степеней окисления постепенно увеличивается вниз по группе. Например, в группе 6 (хром) Cr наиболее стабилен при степени окисления +3, а это означает, что вы не найдете много стабильных форм Cr в степени окисления +4 и +5. Напротив, существует много стабильных форм молибдена (Mo) и вольфрама (W) в степенях окисления +4 и +5.
Пример \(\PageIndex{3}\)
Что делает цинк стабильным в виде Zn 2 + ? Что делает скандий стабильным в виде Sc 3 + ?
- Ответить
Цинк имеет нейтральную конфигурацию [Ar]4s 2 3d 10 .
 Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 .
Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 .
Пример \(\PageIndex{4}\)
Почему железо почти всегда Fe 2 + или Fe 3 + ?
- Ответить
Железо записывается как [Ar]4s 2 3d 6 . Потеря 2 электронов с s-орбитали (3d 6 ) или 2 s- и 1 d-орбитали (3d 5 ) электрона являются довольно стабильными состояниями окисления.
Пример \(\PageIndex{5}\)
Запишите оксиды марганца в нескольких различных степенях окисления. Какие из них возможны и/или разумны?
- Ответить
Хотя Mn +2 является наиболее стабильным ионом марганца, d-орбиталь может удалять от 0 до 7 электронов.
 Таким образом, соединения марганца варьируются от Mn(0) в виде Mn (s) , Mn(II) в виде MnO, Mn(II, III) в виде Mn 3 O 4 , Mn(IV) в виде MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 — и так далее.
Таким образом, соединения марганца варьируются от Mn(0) в виде Mn (s) , Mn(II) в виде MnO, Mn(II, III) в виде Mn 3 O 4 , Mn(IV) в виде MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 — и так далее.
Степень окисления переходных металлов в соединениях
При наличии ионного соединения, такого как \(\ce{AgCl}\), можно легко определить степень окисления переходного металла. В этом случае вас попросят определить степень окисления серебра (Ag). Поскольку мы знаем, что хлор (Cl) находится в группе галогенов периодической таблицы, мы знаем, что он имеет заряд -1, или просто Cl — . Кроме того, видя, что для \(\ce{AgCl}\) нет общего заряда (что определяется, глядя на верхний правый угол соединения, т.е. AgCl # , где # представляет собой общий заряд соединения), мы можем заключить, что серебро (\(\ce{Ag}\)) имеет степень окисления +1. Это дает нам Ag + и Cl — , в которых положительный и отрицательный заряд компенсируют друг друга, в результате чего получается общий нейтральный заряд; поэтому +1 подтверждается как степень окисления серебра (Ag).
Пример \(\PageIndex{6}\)
Определите степень окисления кобальта в \(\ce{CoBr2}\).
- 9{-}}\)). Так как есть два брома, каждый с зарядом -1. Кроме того, мы знаем, что \(\ce{CoBr2}\) имеет общий нейтральный заряд, поэтому мы можем сделать вывод, что катион (кобальт), \(\ce{Co}\) должен иметь степень окисления от +2 до нейтрализовать заряд -2 от двух анионов брома.
Пример \(\PageIndex{7}\)
Какова степень окисления цинка в \(\ce{ZnCO3}\). (Примечание: анион \(\ce{CO3}\) имеет зарядовое состояние -2)
- Ответ 9{-}}\).
Этот пример также показывает, что атомы марганца могут иметь степень окисления +7, которая является максимально возможной степенью окисления для переходных металлов четвертого периода.
Марганец: тематическое исследование
Марганец широко изучается, поскольку он является важным восстановителем в химическом анализе, а также изучается в биохимии для катализа и в металлургии для обогащения сплавов.
Рисунок \(\PageIndex{2}\): (слева) Грубый фрагмент блестящего серебристого металла (CC BY-SA 3.0; Tomihahndorf через Википедию) (справа) В некоторых наскальных рисунках Ласко используются пигменты на основе марганца. (Общественное достояние; Prof saxx через Википедию) В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.
В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.Электронные конфигурации неспаренных электронов называются парамагнитными и реагируют на близость магнитов. Полностью спаренные электроны диамагнитны и не чувствуют этого влияния. Марганец, в частности, имеет парамагнитную и диамагнитную ориентацию в зависимости от его степени окисления. 9{0}\nonumber\]
Поскольку все 3p-орбитали спарены, этот комплекс является диамагнитным.

Резюме
Степени окисления переходных металлов подчиняются общим правилам для большинства других ионов, за исключением того факта, что d-орбиталь вырождается с s-орбиталью с более высоким квантовым числом. Переходные металлы достигают стабильности за счет соответствующего расположения своих электронов и окисляются или теряют электроны на другие атомы и ионы. Эти образующиеся катионы участвуют в образовании координационных комплексов или синтезе других соединений.
Вопросы
Определите степени окисления переходных металлов, обнаруженных в этих нейтральных соединениях. Примечание. В следующих соединениях переходный металл подчеркнут.
(A) Медь(I) Хлорид: Cu Cl (B) Медь(II) Нитрат: Cu (NO 3 ) 2 (C) Золото(V) Фтор: Au F 5 (D) Железо(II) Оксид: Fe O (E) Железо(III) Оксид: Fe 2 O 3 (F) Свинец(II) Хлор: Pb Cl 2 (G) Свинец(II) Нитрат: Pb (NO 3 ) 2 (H) Марганец(II) Хлорид: Mn Cl 2 (I) Молибден триоксид: Mo O 3 (J) Никель(II) Гидроксид: Ni (OH) 2 (K) Платина(IV) Хлорид: Pt Cl 4 (L) Серебро Сульфид: Ag 2 S (M) Вольфрам(VI) Фтор: W F 6 (N) Ванадий(III) Нитрид: V N (O) Цирконий Гидроксид: Zr (OH) 4 - Определите степень окисления переходного металла для общего ненейтрального соединения: Манганат ( Mn O 4 2 — 0 )
- Почему переходные металлы имеют большее число степеней окисления, чем металлы основной группы (т.
 е. щелочные металлы и щелочноземельные металлы)?
е. щелочные металлы и щелочноземельные металлы)? - Какой переходный металл имеет наибольшее количество степеней окисления?
- Почему число степеней окисления переходных металлов увеличивается в середине группы?
- Какие два переходных металла имеют только одну степень окисления?
Ссылки
- Окстоби Д., Гиллис Х.П., Кэмпион, А. Принципы современной химии, 6 -е, -е изд. Томсон Брукс/Коул, Белмонт. 2008 г.; 313-318.
- Audi A, Шервуд, стр. Рентгено-фотоэлектронные спектроскопические исследования валентной зоны марганца и его оксидов, интерпретированные расчетами кластерной и зонной структуры ; Серф. Интерфейс Анал.; 2002 г.; 33; 274-282.
- Reaney S, Kwik-Uribe C, Smith D. Состояние окисления марганца и его последствия для токсичности. Хим. Рез. Токсикол.; 2002 г.; 15; 1119-1126.
- CRC Handbook, 88 th ed. св. 1, пр. 1 Электронная конфигурация и энергия ионизации нейтральных атомов в основном состоянии ; 13-14.

- CRC Handbook, 88 th ed. св. 4, пр. 1 Температуры плавления, кипения, тройной и критической температуры элементов ; 133-134.
Авторы и ссылки
- Марго Крейтман (UCD), Джослин Вуд, Лиза Чу (UCD)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- атомные орбитали
- конфигурация
- делокализованный
- диамагнетик
- электронная конфигурация
- электронная конфигурация
- энергетические диаграммы
- ионов
- Конфигурация благородного газа
- степени окисления
- степень окисления
- степени окисления
- парамагнитный
- Физические свойства
- переходный металл
- Ион переходного металла
- Ионы переходных металлов
Число окисления – определение, правила, расчет, примеры
Окислительно-восстановительный потенциал – это химический процесс, связанный с изменением степени окисления атомов.
 Фактический или формальный перенос электронов между химическими веществами определяется окислительно-восстановительными реакциями, в которых обычно один вид (восстановитель) подвергается окислению (теряя электроны), а другой вид (окислитель) подвергается восстановлению (приобретает электроны). Химические соединения, потерявшие электрон, называются окисленными, а химические соединения, получившие электрон, — восстановленными. Другими словами:
Фактический или формальный перенос электронов между химическими веществами определяется окислительно-восстановительными реакциями, в которых обычно один вид (восстановитель) подвергается окислению (теряя электроны), а другой вид (окислитель) подвергается восстановлению (приобретает электроны). Химические соединения, потерявшие электрон, называются окисленными, а химические соединения, получившие электрон, — восстановленными. Другими словами: Потеря электронов или повышение степени окисления атома, иона или определенных атомов в молекуле называется окислением .
Прирост электронов или понижение степени окисления атома, иона или отдельных атомов в молекуле называется восстановлением (снижение степени окисления).
Номера окисления
Мы можем определить окисленный материал, восстановленное вещество, восстановитель и окислитель в химической реакции. Согласно понятию окислительно-восстановительной реакции, такую идентификацию можно провести, определив, какой материал передает электроны другим соединениям.
 С другой стороны, это объяснение с точки зрения потери и присоединения электронов применимо только к ионным соединениям с полным переносом электронов и исключает другие реакции, такие как:
С другой стороны, это объяснение с точки зрения потери и присоединения электронов применимо только к ионным соединениям с полным переносом электронов и исключает другие реакции, такие как:N 2 +O 2 → 2NO
H 2 +CL 2 → 2HCL
«Когда все другое атом в атмос. остаточный заряд, который есть у атома или кажется, что он есть».
Термины степень окисления и степень окисления обычно взаимозаменяемы. Это потому, что периодическое качество электроотрицательности основано на стандартных обозначениях степеней окисления. Оценивая свое окружение, атом в молекуле может присвоить отрицательную, положительную или нулевую степень окисления. В некоторых случаях степени окисления могут быть даже дробными.
Правила присвоения степеней окисления элементам:
Знание следующих критериев может быть использовано для расчета степени окисления элементов в соединениях.

Правило 1: Сумма всех атомов в степенях окисления молекулы равна нулю.
напр. В KMnO 4 степень окисления K равна +1, степень окисления Mn равна +7, а степень окисления кислорода равна -2.
Правило 2: Степень окисления атома всегда равна 0 в его основной форме.
напр. Степень окисления H ,O ,N ,P ,S ,Se ,Cu, Ag в их формах элементов равна H 2 ,O 2 ,N 2 ,P 4 ,S 8 , Se 8 ,Cu,Ag соответственно равен нулю.
Правило 3: Щелочные металлы (Li, Na, K, Rb, Cs) в своих соединениях имеют степень окисления +1.
напр. В NaCl степень окисления Na равна +1.
Правило 4: Щелочноземельные металлы (Be, Mg, Ca, Sr, Ba) в своих соединениях обычно имеют степень окисления +2.
напр. Степень окисления Mg в MgO равна +2.

Правило 5: За исключением гидридов металлов, степень окисления Н в его соединении всегда +1.
напр. В HCl степень окисления H равна +1, а в NaH (гидрид натрия) степень окисления H равна -1.
Правило 6: Степень окисления фтора равна 1 во всех его соединениях.
напр. В NaF степень окисления F равна -1.
Правило 7: За исключением перекиси, супероксидов, оксифторидов и озонидов, кислород имеет степень окисления -2 в большинстве своих оксидов.
напр. В Na 2 O степень окисления O равна -2.
Исключительные случаи:
- Пероксиды: Степень окисления кислорода в пероксидах равна 1. Примеры, H 2 O 2 , Na 2 O 2 .
Степень окисления кислорода в соединениях фтора равна +2. Примеры F 2 O или OF 2 и т.
 д.
д.- Супероксиды: Степень окисления кислорода в супероксидах составляет –1/2.
- Озониды: Каждый атом кислорода в озониде имеет степень окисления –1/3.
Правило 8: Заряд ионного соединения равен сумме степеней окисления всех атомов.
напр. В SO 2 –4 степень окисления серы равна +6. Степень окисления кислорода равна -2.
Правило 9: За исключением кислорода и фтора, максимальная степень окисления любого элемента равна номеру его группы.
напр. The oxidation number of sulphur in H 2 S 2 O 8 , K 2 S 2 O 8 , S 2 O –2 8 and H 2 SO 5 +6 из-за наличия перекисной связи.
Правило 10: Возможно, что не все атомы одного и того же элемента имеют одинаковую степень окисления в определенных соединениях.
 Мы получаем средний результат, когда вычисляем степень окисления этого элемента в таких компонентах.
Мы получаем средний результат, когда вычисляем степень окисления этого элемента в таких компонентах.напр. Один атом серы в Na 2 S 2 O 3 имеет степень окисления +6, тогда как другие атомы серы имеют степень окисления -2. В результате средняя степень окисления серы в Na 2 S 2 O 3 +2.
Правило 11: Углерод в органических молекулах может иметь любую степень окисления от -4 до +4.
напр. в HCHO степень окисления углерода равна нулю.
Правило 12: Общая степень окисления элемента эквивалентна его номеру группы от IA до IV A. Формула (номер группы –8) дает общую степень окисления любого элемента от VA до VIII-A.
напр.
- Степень окисления элементов I А группы =+1.
- Степень окисления элементов II А группы =+2.
- Степень окисления элементов III А группы =+3.

- Степень окисления элементов IV А группы =+4.
- Степень окисления элементов группы V A =–3.
- Степень окисления элементов VI А группы =–2.
- Степень окисления элементов VII А группы =–1.
- Степень окисления элементов VIII А группы =0.
Правило 13: C, N, P и S имеют степени окисления 4, –3, –3 и –2 во всех карбидах, нитридах, фосфидах и сульфидах соответственно.
напр. В Mg 3 N 2 степень окисления азота равна -3.
Правило 14: Во всех карбонилах металлов степень окисления металлов равна нулю.
напр. В Ni(CO) 4 степень окисления Ni равна нулю.
Расчет степеней окисления
- Степень окисления серы в H 2 SO 4
Пусть степень окисления серы в h3SO4 равна X
Степень окисления водорода =+1 9002 =–2
2(+1)+(X)+4×(–2)=0
2+X–8=0
X = 8–2=+6.

Степень окисления серы в H 2 SO 4 равна +6.
- Степень окисления хрома в Cr 2 O 2– 7 ион.
Степень окисления кислорода =–2
Степень окисления хрома =X
2X+7(–2)=–2
2X–14=–2
2X=–2+14 =12
Следовательно, X=+6.
Степень окисления хрома в Cr 2 O 2– 7 равна +6.
- Число окисления азота в нитрите аммония
Нитрит аммония представляет собой ионное соединение, содержащее ионы NH+4 и NO–2.
Степень окисления азота в NH + 4 ион =–3
Степень окисления азота в NO – 2 =+3.
Таким образом, один атом азота в нитрите аммония находится в степени окисления а–3 –, а другой атом азота – в степени окисления а+3.
Примеры вопросов
Вопрос 1: Какова общепринятая степень окисления инертных газов?
Ответ:
Инертные газы имеют нулевую степень окисления.

Вопрос 2: Каковы правила для степеней окисления?
Ответ:
Правила для степеней окисления:
- Сумма всех атомов в степенях окисления молекулы равна нулю.
- Степень окисления атома в его самой основной форме всегда равна нулю.
- В их соединениях степень окисления щелочных металлов (Li, Na, K, Rb, Cs) всегда +1.
- В их соединениях степень окисления щелочноземельных металлов (Be, Mg, Ca, Sr, Ba) всегда +2.
- За исключением гидридов металлов, степень окисления H в его соединении всегда +1.
- Фтор имеет степень окисления 1 во всех своих соединениях.
- За исключением перекиси, супероксидов, оксифторидов и озонидов, степень окисления кислорода в большинстве его оксидов равна -2.
- Углерод в органических молекулах может иметь любую степень окисления от -4 до +4.
Вопрос 3: Какова степень окисления ртути в амальгаме.

Ответ:
Амальгама ртути имеет нулевую степень окисления. Каждый элемент в сплаве или амальгаме имеет нулевую степень окисления.
Вопрос 4: Какова степень окисления кислорода в O 3 и в MgO?
Ответ:
Степень окисления O в O3=0
Степень окисления O в MgO=–2
?
Ответ:
Степень окисления кислорода =–2
Степень окисления хрома =X
2X+7(–2)=–2
2X–902=4 2X–902=4 –2+14=12
Следовательно, X=+6.
Степень окисления хрома в Cr 2 O 2– 7 равна +6.
Вопрос 6: Какова степень окисления серы в S8?
Ответ:
S8 представляет собой многоатомную молекулу в своей основной форме. В результате степень окисления серы в этой молекуле равна нулю.


 е. сильнее изменяется степень окисления атома азота (вплоть до –3).
е. сильнее изменяется степень окисления атома азота (вплоть до –3). Имеется только один 5s электрон.
Имеется только один 5s электрон. Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 .
Потеря 2 электронов не меняет полную d-орбиталь. Нейтральный скандий записывается как [Ar]4s 2 3d 1 . Потеря 3 электронов приводит конфигурацию в благородное состояние с валентностью 3p 6 . Таким образом, соединения марганца варьируются от Mn(0) в виде Mn (s) , Mn(II) в виде MnO, Mn(II, III) в виде Mn 3 O 4 , Mn(IV) в виде MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 — и так далее.
Таким образом, соединения марганца варьируются от Mn(0) в виде Mn (s) , Mn(II) в виде MnO, Mn(II, III) в виде Mn 3 O 4 , Mn(IV) в виде MnO 2 , или диоксид марганца, Mn(VII) в перманганат-ионе MnO 4 — и так далее. В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.
В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавляют некоторые клеточные функции. Из-за гибкости марганца в принятии многих степеней окисления он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.
 е. щелочные металлы и щелочноземельные металлы)?
е. щелочные металлы и щелочноземельные металлы)?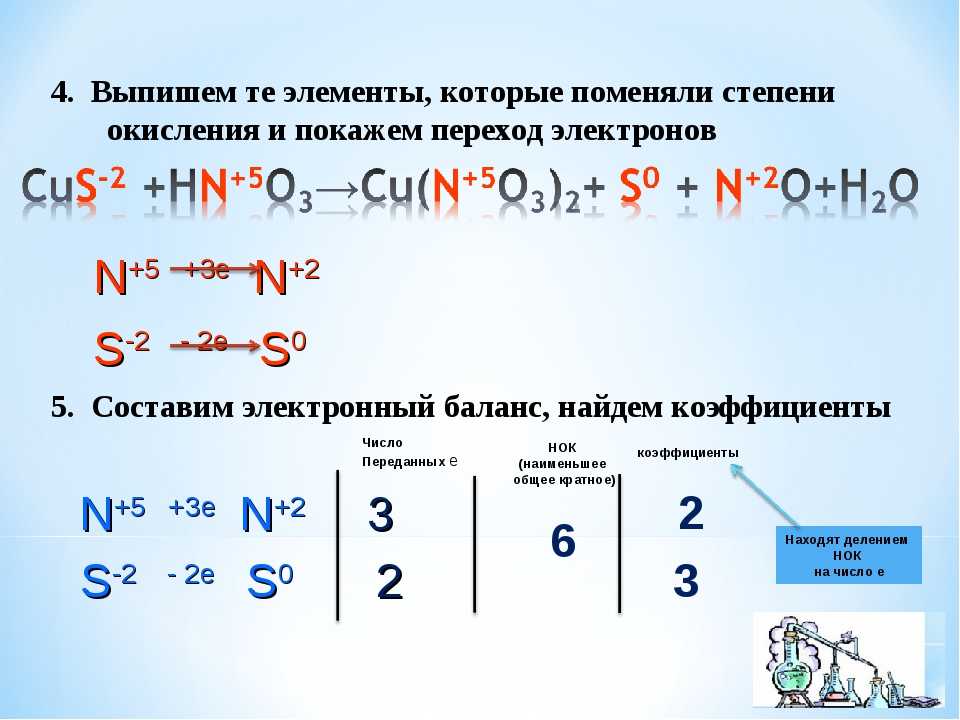
 Фактический или формальный перенос электронов между химическими веществами определяется окислительно-восстановительными реакциями, в которых обычно один вид (восстановитель) подвергается окислению (теряя электроны), а другой вид (окислитель) подвергается восстановлению (приобретает электроны). Химические соединения, потерявшие электрон, называются окисленными, а химические соединения, получившие электрон, — восстановленными. Другими словами:
Фактический или формальный перенос электронов между химическими веществами определяется окислительно-восстановительными реакциями, в которых обычно один вид (восстановитель) подвергается окислению (теряя электроны), а другой вид (окислитель) подвергается восстановлению (приобретает электроны). Химические соединения, потерявшие электрон, называются окисленными, а химические соединения, получившие электрон, — восстановленными. Другими словами:  С другой стороны, это объяснение с точки зрения потери и присоединения электронов применимо только к ионным соединениям с полным переносом электронов и исключает другие реакции, такие как:
С другой стороны, это объяснение с точки зрения потери и присоединения электронов применимо только к ионным соединениям с полным переносом электронов и исключает другие реакции, такие как:

 д.
д.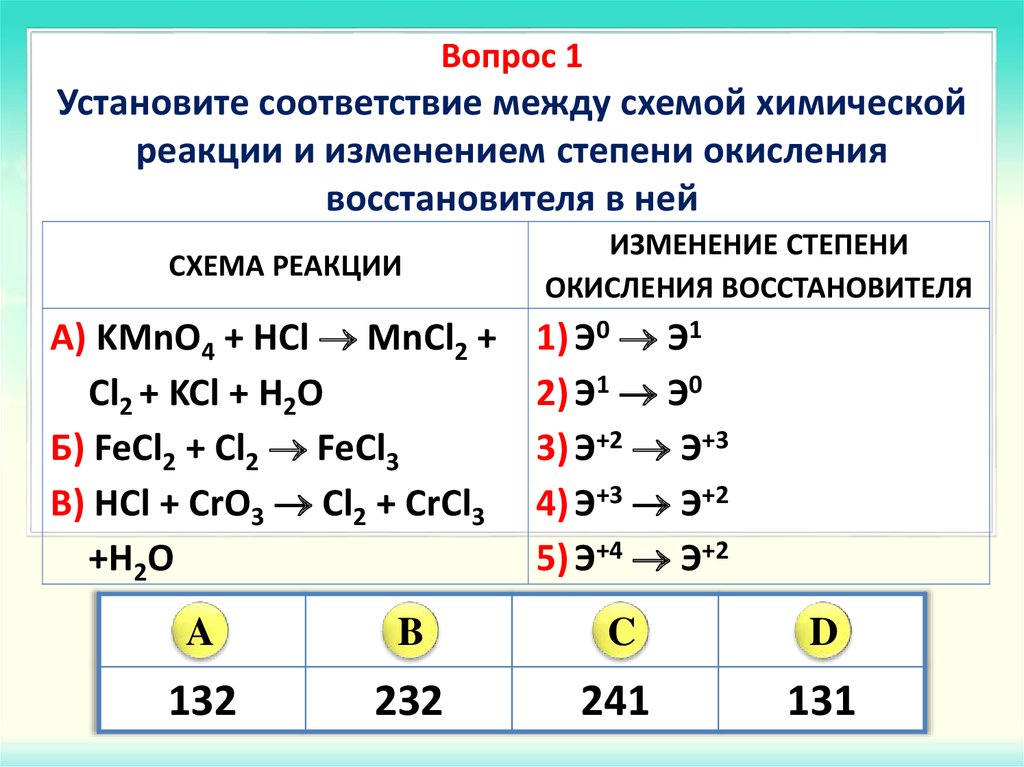 Мы получаем средний результат, когда вычисляем степень окисления этого элемента в таких компонентах.
Мы получаем средний результат, когда вычисляем степень окисления этого элемента в таких компонентах.

Leave A Comment