Газообразный кислород — компания Грасис
Запрос на оборудование
Кислород — бесцветный, не обладающий запахом газ. Он плохо растворим в воде и немного тяжелее воздуха. При охлаждении до −183 °С кислород становится прозрачной голубоватой жидкостью с плотностью, превышающей плотность воды. Кислород вступает в реакции со всеми элементами, за исключением инертных газов, и образует класс соединений, называемый оксидами.
Кислород — типичный окислитель, при повышении концентрации этого газа в воздухе до 30% и выше происходит очень интенсивное сгорание в такой атмосфере практически всех веществ. В кислороде горят различные металлы, неметаллы и сложные вещества, например, углерод, сера, магний, железо, сероводород. Эти свойства обуславливают широкое применение этого газа в различных отраслях промышленности.
| Внешний вид простого вещества | |
|---|---|
| газ без цвета, вкуса и запаха голубоватая жидкость | |
| Свойства атома | |
| Имя, символ, номер | Кислород / Oxygenium (Oxygen)(O), 8 |
| Атомная масса (молярная масса) | 15,9994 а. е. м. (г/моль) е. м. (г/моль) |
| Электронная конфигурация | [He] 2s2 2p4 |
| Радиус атома | 60 (48) пм |
| Химические свойства | |
| Ковалентный радиус | 73 пм |
| Радиус иона | 132 (-2e) пм |
| Электроотрицательность | 3,44 (шкала Полинга) |
| 0 | |
| Степени окисления | -2, -1, 0,+1, +2, -½ |
| Энергия ионизации (первый электрон) | 1313,1 (13,61) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,00142897 г./см3 |
| Температура плавления | 54,8 K |
| Температура кипения | 90,19 K |
| Теплота плавления | 0,444 кДж/моль |
| Теплота испарения | 3,4099 кДж/моль кДж/моль |
| Молярная теплоёмкость | 29,4 Дж/(K·моль) |
| Молярный объём | 14,0 см3/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | моноклинная |
| Параметры решётки | a=5,403 b=3,429 c=5,086 β=135,53 Å |
| Температура Дебая | 155 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 0,027 Вт/(м·К) |
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).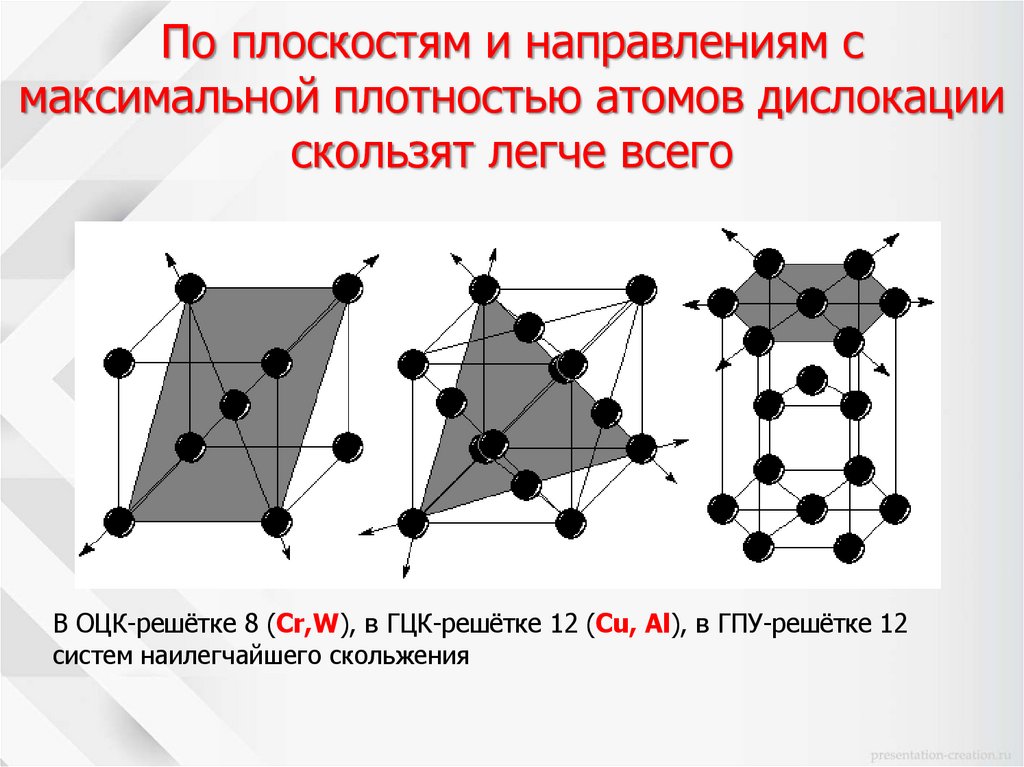
2HgO (t) → 2Hg + O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Основное применение
Газовая сварка, резка и пайка металлов
Проведение газопламенных работ, таких как сварка, резка и пайка металлов — одно из самых важных и востребованных применений кислорода.
Металлургическая промышленность
Увеличение температуры горения при производстве черных и цветных металлов, позволяющее существенно повысить эффективность производства. Связывание углерода с кислородом с образованием углекислого газа.
Связывание углерода с кислородом с образованием углекислого газа.
Химическая и нефтехимическая промышленность
Окисление исходных реагентов с целью получения азотной кислоты, этиленоксида, пропиленоксида, винилхлорида и других химических соединений.
Нефтегазовая промышленность
Увеличение вязкости и улучшение нефтегазового потока из колодцев. Увеличение производительности заводов по крекингу нефти, более эффективная переработка высокооктановых компонент, уменьшение серных отложений на НПЗ.
Выращивание рыбы, креветок, крабов, мидий
Обогащение воды растворенным кислородом способствует увеличению выживаемости и выхода молодых особей, а также существенно сокращает сроки инкубации.
Стекольная промышленность
Повышение температуры в печах и улучшение процессов горения, повышающие производительность производства.
Утилизация отходов
Увеличение температуры пламени в мусоросжигательных печах, обеспечивающее большую экономичность и производительность печей
Вас также может заинтересовать
- Кислород технический
- Газообразный кислород
- Жидкий кислород
- Промышленный способ получения кислорода
- Заправка баллонов кислородом
Новая страница 0
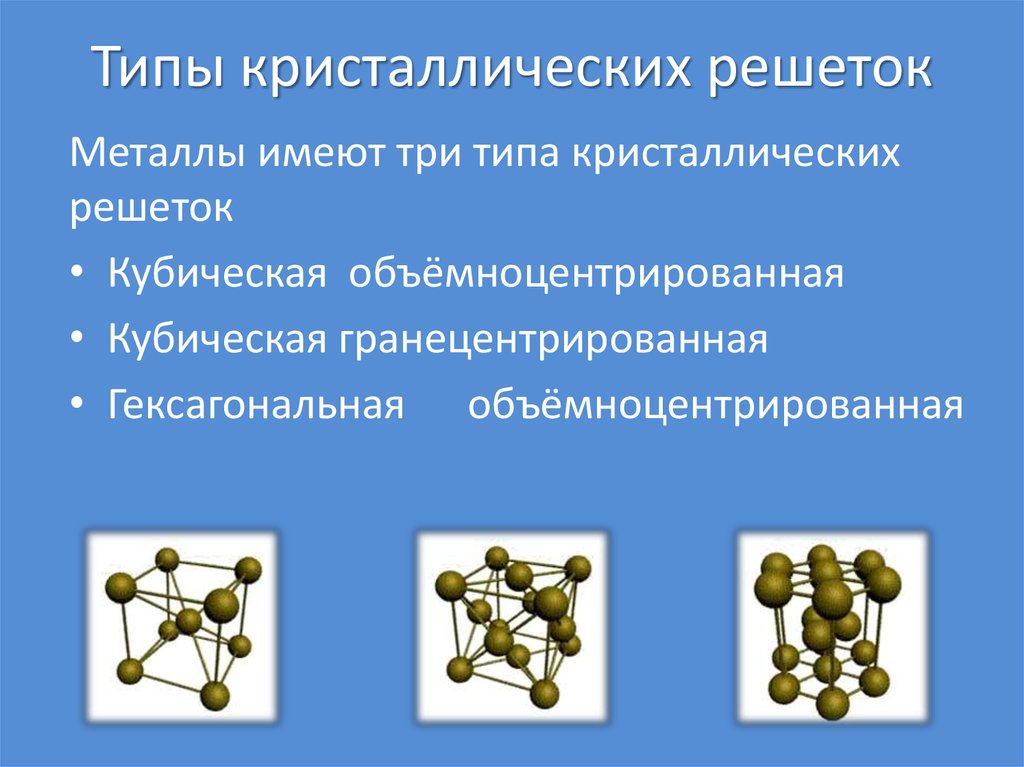
Новая страница 0ТЕМА: Кристаллические решетки.
(
химия 9 класс)ЦЕЛИ И ЗАДАЧИ:
Систематизировать знания учащихся о типах химической связи.
Изучить понятия: «Кристаллическая решетка», «типы кристаллических решеток» (ионная, атомная, молекулярная).
Рассмотреть зависимость физических свойств простых и сложных веществ от типа кристаллической решетки. Устанавливая связь со свойствами, предсказывать тип кристаллической решетки на основе свойств веществ и наоборот.
Развивать творческие способности ребят и умение самостоятельно работать с источниками знаний.
Воспитывать культуру работы в группе.
ФОРМА ОРГАНИЗАЦИИ РАБОТЫ:
групповая (в зависимости от знака зодиака четыре группы –
стихии: «Вода», «Земля», «Огонь», «Воздух»).
МЕТОДЫ И ПРИЕМЫ:
самостоятельная работа школьников с учебником и дополнительной литературой, демонстрация подготовленных творческих заданий, лабораторная работа, составление таблицы.
ОБОРУДОВАНИЕ:
магнитная доска; модели кристаллических решеток алмаза, графита, хлорида натрия; набор стекол; алмазное сверло; вода, хлорид натрия, хлорид калия, кислород, водород;
на столах учеников – инструкции-задания, справочный материал, дополнительная литература.
ХОД УРОКА.
Учитель сообщает учащимся, что работа на уроке будет проходить по группам:
1-
я группа – стихия «Земля»;2-
я группа – стихия «Вода»;3-
я группа – стихия «Воздух»;4-
я группа – стихия «Огонь».
Вводная часть
УЧИТЕЛЬ. Мы с вами изучили тему «Периодический закон и строение атома», имеем представление о химической связи, познакомились типами и видами химической связи. Вопросы к классу:Какие типы химической связи вы знаете?
Какие виды ковалентной связи вам известны?
Для того чтобы определить вид ковалентной связи мы пользуемся понятием «электроотрицательность». Дайте определение этого понятия.
Используя знания о строении атомов, типах и видах химической связи, попытаемся установить причинно-следстенные связи между ними .
(
Школьники отвечают, и учитель открывает часть таблицы №1)Таблица 1
| Строение атомов химических элементов | Типы химической связи между ними |
| Причина следствие | |
 Определить тип химической
связи и составить схему образования связи в соединениях:
Определить тип химической
связи и составить схему образования связи в соединениях:
1-
я группа – PCl3·· ··
: Cl : : Cl :
·· : ·· ·· : ··(: Cl ·· P ·· Cl : : Cl ·· P ·· Cl 🙂
·· ·· ·· ·· ·· ··
2-
я группа – O2·· ·· ·· ··
(: O · + · O : : O (: 🙂 O 🙂
ֹ ֹ
3-
я группа – CaCl2 ·· ··( Ca: + · Cl : Ca2+[: Cl : ]¯2).
·· ··
··
·Cl :··
4-
я группа – NH3, O2 (на магнитной доске схематично изобразить строение молекул). Представитель от каждой группы выполняет задание у доски, в это время остальные ученики выполняют лабораторную работу.
Лабораторная работа.
Составить шаро-стержневые модели молекул:1-
я группа – CH4.2-
я группа – H2O.3-
я группа – F2.4-
я группа – NaCl. Затем идёт проверка выполнения заданий №1 и лабораторной работы. УЧИТЕЛЬ. Вы все готовили к уроку творческие задания: сочиняли сказки, загадки, стихи, готовили пантомимы по теме «Химическая связь». Давайте послушаем и посмотрим некоторые отчёты по творческим заданиям и ответим на вопрос: о каком виде химической связи идёт речь? ПЕРВЫЙ УЧЕНИК. СКАЗКА О ЖАДНОМ ХЛОРЕ. В некотором царстве, химическом государстве, жил-был Хлор. И хотя принадлежал он к старинному роду Галогенов, да и наследство получил немалое, на внешнем энергетическом уровне было у него семь электронов, был он очень жадным и завистливым, а от злости стал даже жёлто-зелёным.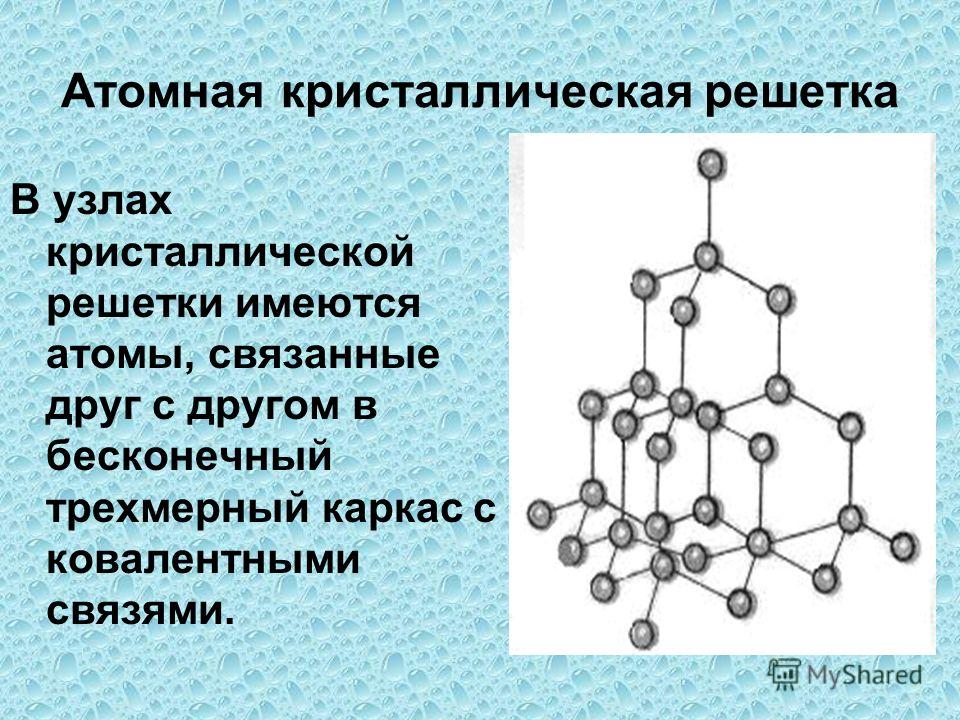 Днём и ночью мучило его одно
желание: сделаться похожим на Аргон. Он не раз слышал, как все хвалили его
соседа за благородство, независимый нрав, умение владеть собой, и ещё больше
зеленел от зависти. Стал он думать, как сделаться похожим на Аргон. Думал он,
думал, и, наконец, придумал. «У Аргона на внешнем уровне восемь электронов, а у
меня только семь, — рассуждал Хлор. – Значит, мне надо заполучить ещё один
электрон, тогда я тоже буду благородным».
На следующий
день собрался Хлор в дорогу за заветным электроном, но далеко идти ему не
пришлось: возле самого дома встретил он атом, похожий на него как две капли
воды.
Днём и ночью мучило его одно
желание: сделаться похожим на Аргон. Он не раз слышал, как все хвалили его
соседа за благородство, независимый нрав, умение владеть собой, и ещё больше
зеленел от зависти. Стал он думать, как сделаться похожим на Аргон. Думал он,
думал, и, наконец, придумал. «У Аргона на внешнем уровне восемь электронов, а у
меня только семь, — рассуждал Хлор. – Значит, мне надо заполучить ещё один
электрон, тогда я тоже буду благородным».
На следующий
день собрался Хлор в дорогу за заветным электроном, но далеко идти ему не
пришлось: возле самого дома встретил он атом, похожий на него как две капли
воды.
Слушай, брат, дай мне свой электрон, — заговорил Хлор.
Нет уж, лучше ты мне дай электрон, — ответил близнец.
Ладно, давай тогда объединим наши электроны, чтобы никому
не было обидно, — сказал жадный Хлор, надеясь, что потом он заберёт электрон
себе.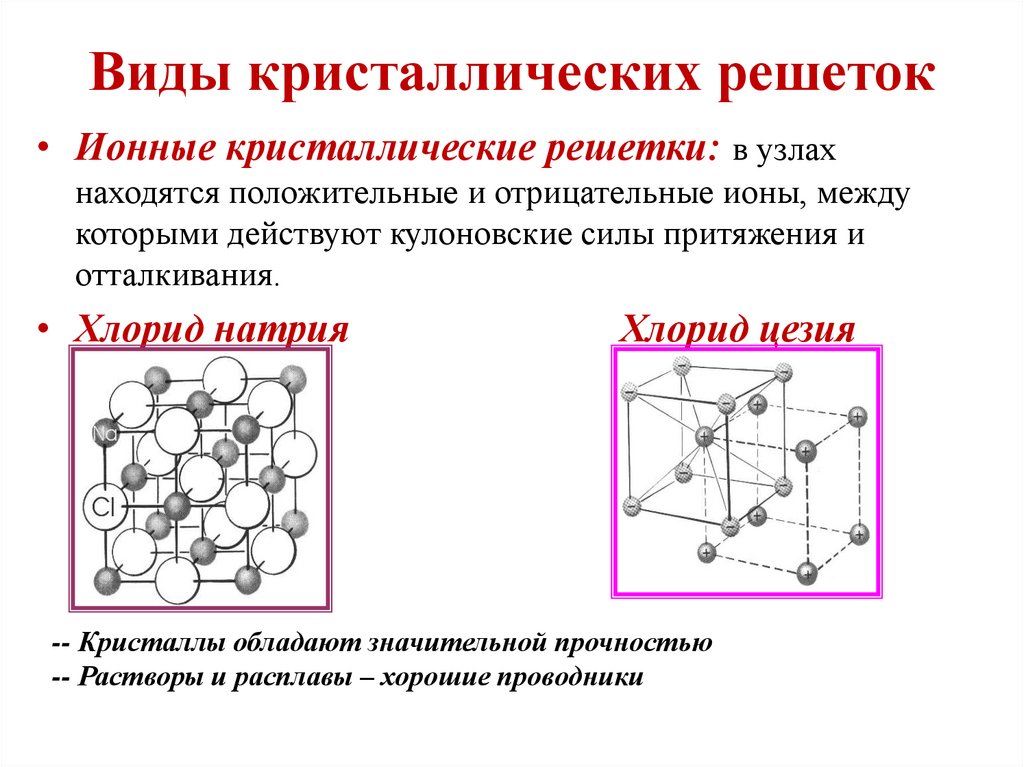
Не добившись своего, пошёл Хлор дальше искать кого-либо
послабее. Вскоре повстречался ему Водород, самый маленький, самый лёгкий из всех
жителей царства. Уж у этого я запросто отниму электрон! – обрадовался Хлор.
Доверчивый малыш не отказался образовать общую электронную пару, ведь он был
очень скромным (для полного счастья ему хватило бы и двух электронов). Хлор
сразу же бесцеремонно оттащил пару электронов к себе и лишь изредка отпускал их
побегать возле ядра Водорода. Непритязательный Водород был доволен и этим, но
Хлору этого было мало. И когда он окончательно убедился, что, несмотря на
тщедушность Водорода, полностью отобрать у него электрон не удастся, двинулся
дальше на поиски очередной жертвы.
Видит: у дороги сидит Калий из древнего, но разорившегося рода Щёлочных Металлов. «Ну, этого я точно обману! Ведь Калий и вся его родня, известные простофили», — подумал Хлор. Калий – добрая душа, не раздумывая, подарил свой единственный электрон с внешнего уровня Хлору. Недаром в народе говорят: тот, кто имеет меньше, отдаёт тем, кто имеет больше.
«
Наконец-то я стал благородным! Я свободен и независим!» – воскликнул Хлор. Но как он ошибался! В тот же миг, получив от Калия его электрон, он перестал быть прежним атомом: он превратился в отрицательный ион. Мало этого! Презираемый им Калий ни за что не хотел расстаться с ним. Так до конца своих дней и таскал за собой анион Хлора ненавистный ему катион Калия…Может, судьба Хлора сложилась бы иначе, если бы помнил он народную мудрость: чужое добро впрок не идёт.
ВТРОЙ УЧЕНИК. ИСТОРИЯ ХИМИЧЕСКОГО ГОСУДАРСТВА.
ИСТОРИЯ ХИМИЧЕСКОГО ГОСУДАРСТВА.
Много-много лет назад было создано химическое государство злым угнетателем Металлов королём Фтором.
При короле Фторе была шайка Неметаллов, паразитирующих и угнетающих Металлы. Доверчивые Металлы, имеющие за душой только один или два электрона, обирались Неметаллами до нитки и становились положительно заряженными ионами. Более богатые Неметаллы угнетали более бедных и брали с них высокие налоги.
Сохранилась старинная гравюра, изображающая Литий, порабощённый Фтором:
ТРЕТИЙ УЧЕНИК. ОКСИД КАЛЬЦИЯ (НЕГАШЁНАЯ ИЗВЕСТЬ)
Кальций был металлом щёлочно-земельным
И стоял в подгруппе главной
Со второй валентностью.
Кислород же там летал
И всех в таблице окислял.
Он и в группе был шестой,
Но с валентностью второй.
Как-то раз наш кислород
Предложил пойти в поход.
Тут наш Кальций согласился,
К Кислороду он сместился.
И они пошли в поход,
Через группы и ряды,
Через периоды прошли.
Кислород тут стал бурчать
И на Кальция ворчать.
Кальций сразу в позу встал.
Кислород его окислил,
Отобрав два электрона.
Кальций сразу стал ионом
Но каким он стал ионом?
Вам и надо тут сказать.
Получилась известь наша
Негашёная, но всё же!
ЧЕТВЁРТЫЙ УЧЕНИК.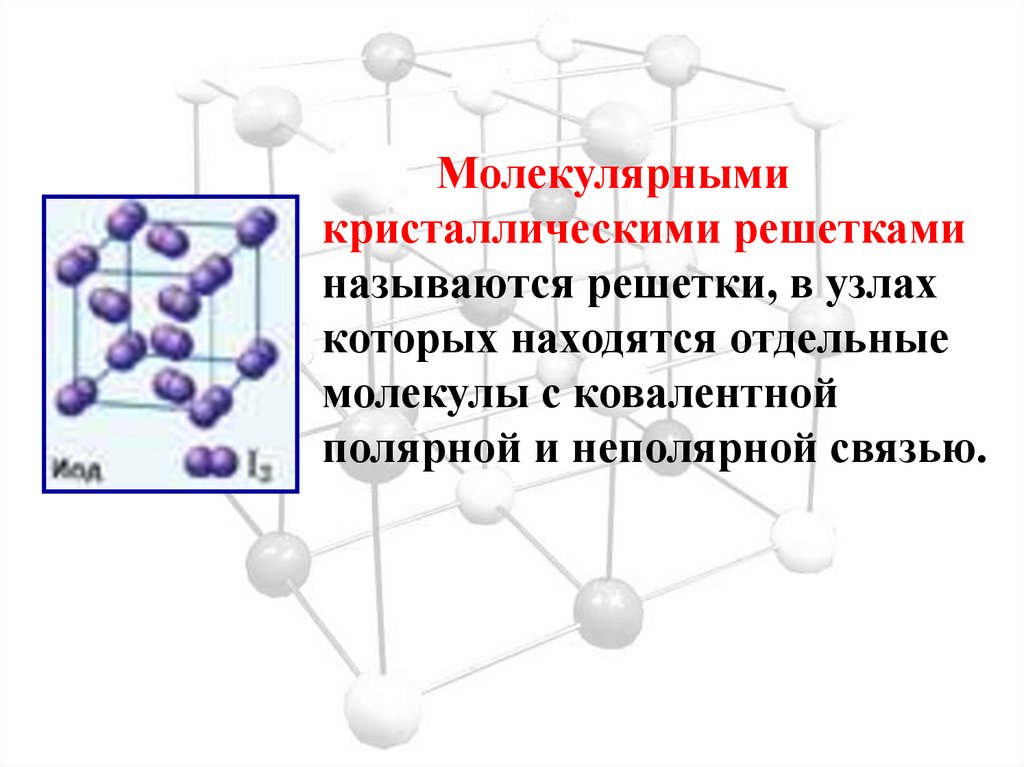 СКАЗКА.
СКАЗКА.
Жил-был Водород. Всё у него было: и машина, и гараж, и трёхкомнатная квартира в семиэтажном доме на первом этаже.
Жил бы Водород и сейчас, но взбрело ему в голову, чтобы стать весомее в химическом государстве, надо приобрести ему один электрон. И вспомнил Водород про своего приятеля Азота. Подумав, он пошёл к Азоту, взяв с собой двух своих братьев из семьи Водородовых.
Встреча прошла прекрасно, при этом образовалось соединение с валентным углов 107 градусов. Только вот забыл Водород, как называется его соединение с Азотом. Ребята, напомните ему, пожалуйста! Благодаря какой химической связи образовалось новое соединение?ПЯТЫЙ УЧЕНИК. ТРАГИЧЕСКАЯ СУДЬБА ХЛРОВОДОРОДОВЫХ.
Жили-были Хлорина и Водород. Однажды ночью Водород сделал
предложение Хлорине, она согласилась. Обвенчаться они хотели сейчас же, но было
темно, поэтому им пришлось ждать до утра.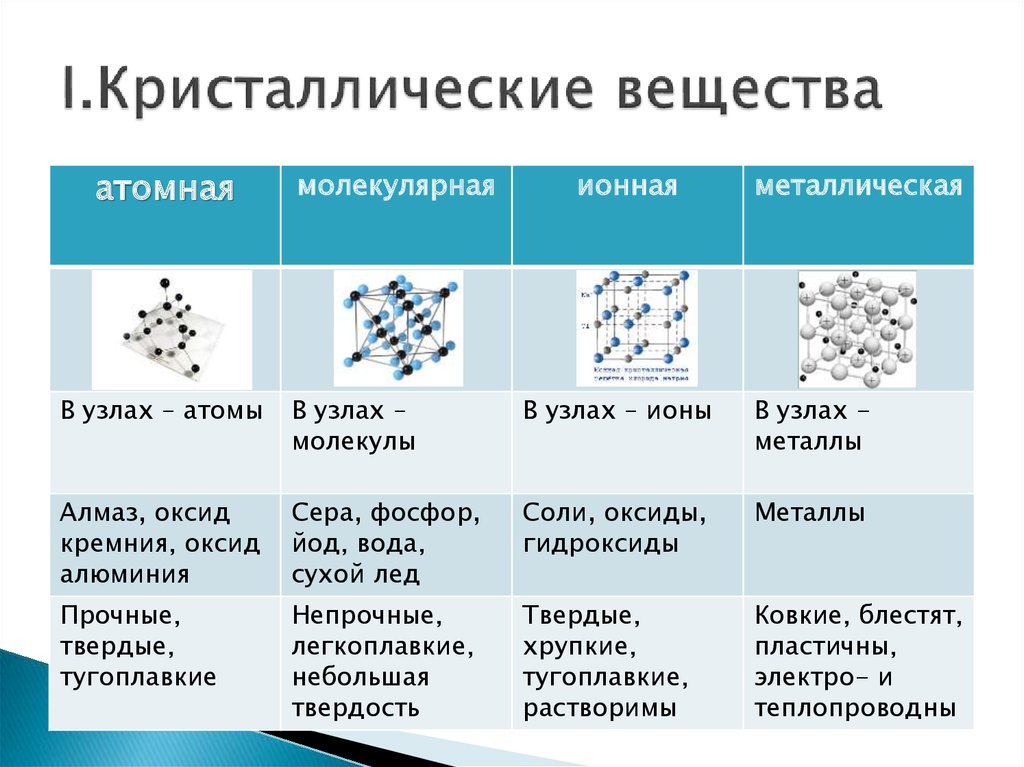 И вот при дневном свете в 1772 году
они обвенчались. Их священником был Джозеф Пристли. Хлорина, отличавшаяся
большей электроотрицательностью, стала оттягивать у Водорода его единственный
электрон. Водород захотел порвать всякую связь со своей новой женой, но не смог.
Венчание происходило на улице. Молодожёны Хлороводородовы вдруг
И вот при дневном свете в 1772 году
они обвенчались. Их священником был Джозеф Пристли. Хлорина, отличавшаяся
большей электроотрицательностью, стала оттягивать у Водорода его единственный
электрон. Водород захотел порвать всякую связь со своей новой женой, но не смог.
Венчание происходило на улице. Молодожёны Хлороводородовы вдруг
ШЕСТОЙ И СЕДЬМОЙ УЧЕНИКИ под музыку демонстрируют образование молекулы кислорода O2.
ВОСЬМОЙ И ДЕВЯТЫЙ УЧЕНИКИ — HCl
ДЕСЯТЫЙ И ОДИННАДЦАТЫЙ УЧЕНИКИ — NaCl.
У них на груди приколоты таблички, демонстрирующие число валентных электронов, а в руках – надувные шары, показывающие число неспаренных электронов. Взявшись за руки, они демонстрируют образование в случае ковалентной связи общих электронных пар.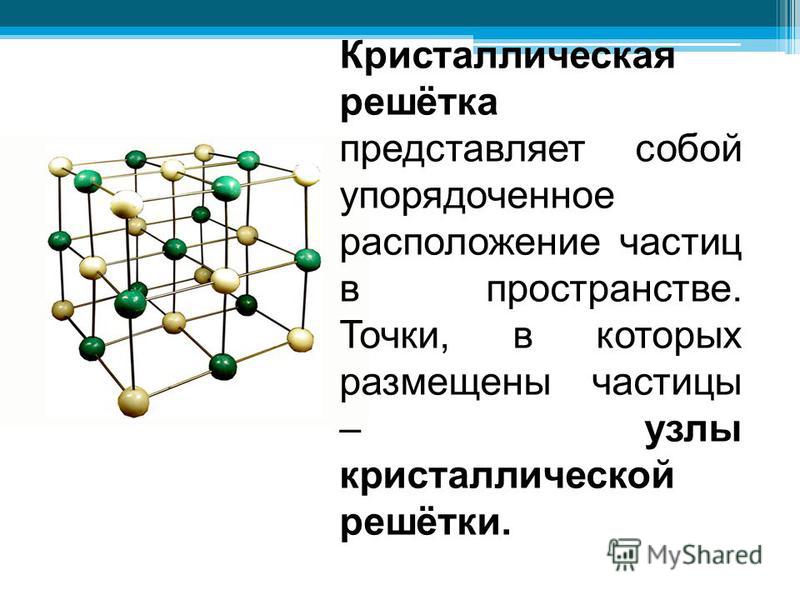 В случае ионной
связи один из учеников (Хлор) забирает шар (валентный электрон) у другого
(Натрия).
В случае ионной
связи один из учеников (Хлор) забирает шар (валентный электрон) у другого
(Натрия).
УЧИТЕЛЬ. Итак, я вижу, что вы хорошо разобрались в типах и видах химической связи. Эти знания пригодятся вам при изучении новой темы: «Кристаллические решётки».
Ученики записывают в тетради название темы урока.
Основная часть
УЧИТЕЛЬ. Мир веществ велик и разнообразен. Они обладают самыми разными свойствами. Мы с вами выделяли физические и химические свойства веществ. Какие свойства мы относим к физическим? Используя справочники и дополнительную литературу, выполните задание №2.
Задание №2.
опишите физические свойства данных веществ:1-
я группа — O2.2-
я группа — H2O.3-
я группа — NaCl.
4-
я группа — графит.Ученики заполняют таблицу №2
Физические свойства различных веществ Таблица №2
| Вещества Физичес кие свойства |
Кислород (О2) |
Вода (Н2О) |
Хлорид натрия (NaCl) |
Графит (C) |
| Агрегатное состояние |
Газообразное |
Жидкое |
Твёрдое |
Твёрдое |
| Цвет |
Бесцветный |
Бесцветный |
Белый |
Чёрный |
| Плотность (г/см3) |
1,429 |
1,000 |
2,165 |
2,265 |
| Температура плавления (0С) |
-218,8 |
0,0 |
+801,0 |
__ |
| Температура кипения (0С) |
-182,97 |
+100,0 |
+1465,0 |
+3700,0 (температура возгонки) |
| Растворимость в воде |
Малорастворим |
Не имеет смысла |
растворим |
Не растворим |
|
Электропроводность |
Не проводит электрического тока |
Слабо проводит электрический ток |
Раствор и рас- плав проводят электрический ток |
Проводит электрический ток |
После проверки выполнения задания №2 учениками делается вывод
о том, что у разных веществ – разные физические свойства.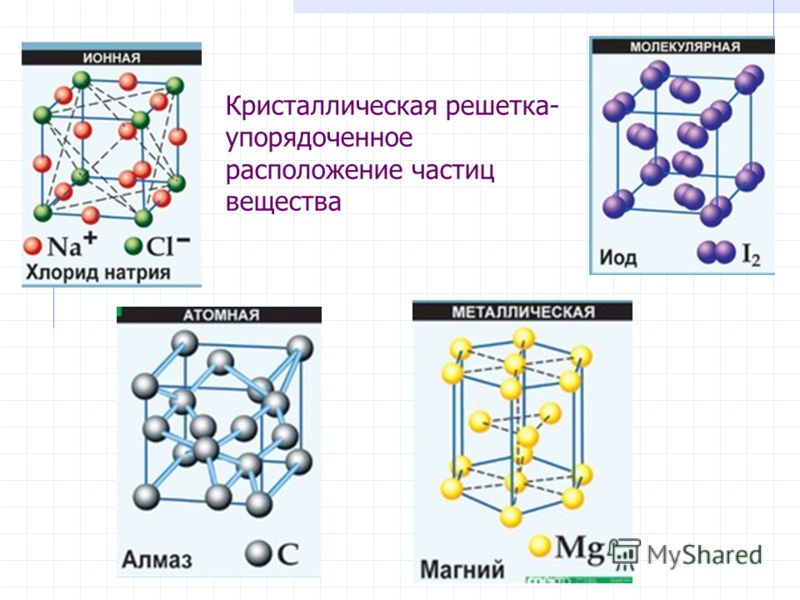
Далее учитель перечисляет все вещества, находящиеся на демонстрационном столе
.УЧИТЕЛЬ. А можно ли из веществ, представленных на демонстрационном столе, найти вещества с похожими физическими свойствами?
(
Школьники выделяют пары веществ: кислород – водород; хлорид натрия – хлорид калия.) Действительно, есть вещества, у которых можно выделить общие физические свойства. А можно ли предсказать общие физические свойства, зная строение вещества, и, наоборот: по физическим свойствам веществ определить их строение?В твёрдом агрегатном состоянии в зависимости от степени упорядоченности частиц различают аморфные и кристаллические вещества
А кристаллические вещества могут иметь различное строение,
что определяется типом кристаллической решётки. В чём отличие кристаллического
вещества от аморфного, нам поможет разобраться группа «Воздух».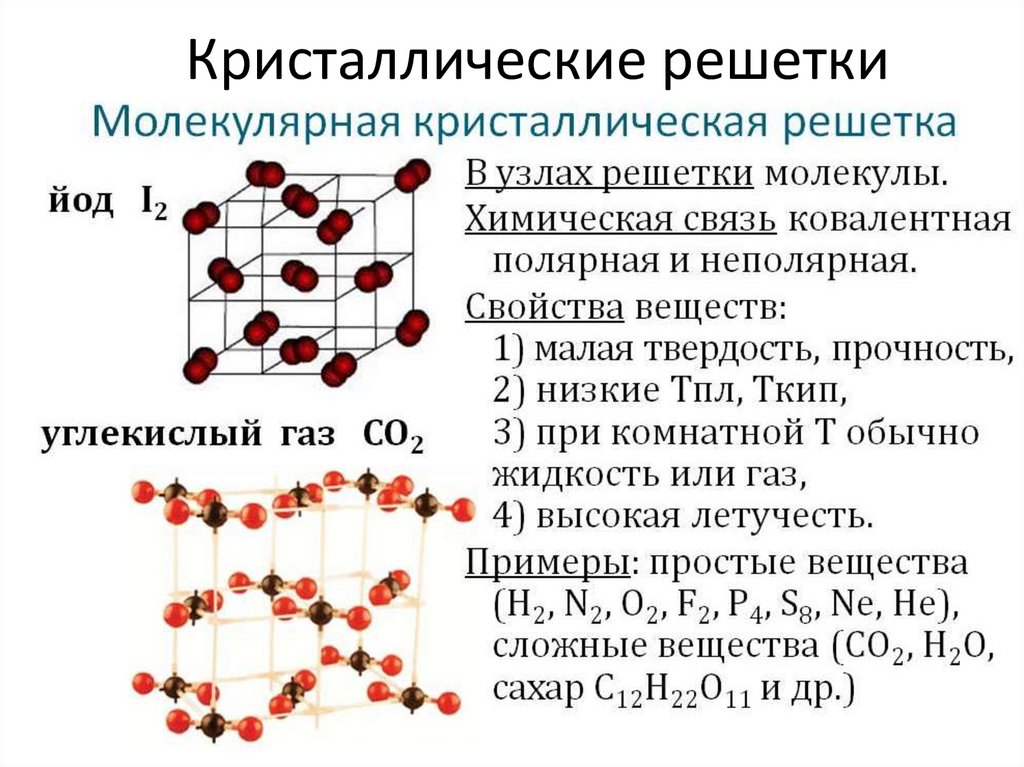
Задание №3.
Пользуясь материалом учебника и дополнительной литературой, ответьте на вопросы:Какое состояние вещества называется аморфным?
В чём отличие кристаллических и аморфных тел?
Как можно практически использовать полученные знания для предсказания физических свойств веществ?
УЧИТЕЛЬ. Что такое кристаллические решётки, каких типов они бывают и какими признаками характеризуются, нам помогут разобраться остальные группы.
Задание №4. Пользуясь материалом учебника и дополнительной литературой, заполните таблицу №3 и ответьте на вопросы:
Что такое кристаллическая решётка?
Какие типы кристаллических решёток различают?
3.
Как можно практически использовать полученные знания для предсказания физических свойств?(
Группа 1 заполняет в таблице 3 все графы, относящиеся к молекулярной кристаллической решётке; группа 2 – атомной кристаллической решётке; группа 4 – ионной кристаллической решётке.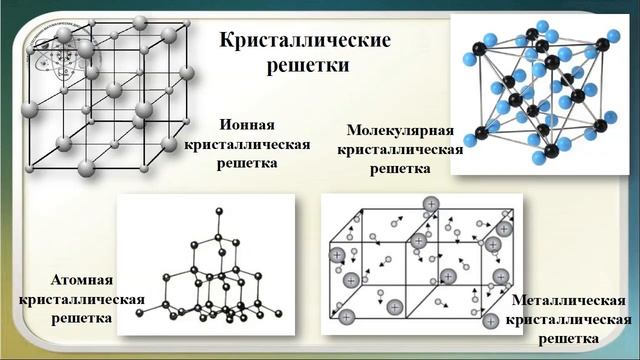 )
)
Спустя 7 – 10 минут проводится беседа по вопросам:
Какое строение вещества называется аморфным? В чём различие кристаллических и аморфных тел?
Что такое кристаллическая решётка?
Какие типы кристаллических решёток различают?
Затем идёт проверка заполнения учениками таблицы 3 (
выступают представители групп). Учитель по ходу ответов учеников заполняет таблицу 3 на доске или открывает готовую. Ребята сравнивают свои записи с той, что на доске, и отвечают на вопрос: как можно практически использовать полученные знания для предсказания физических свойств веществ?УЧИТЕЛЬ. Таким образом, зная тип кристаллической решётки вещества, можно предсказать основные физические свойства веществ и наоборот.
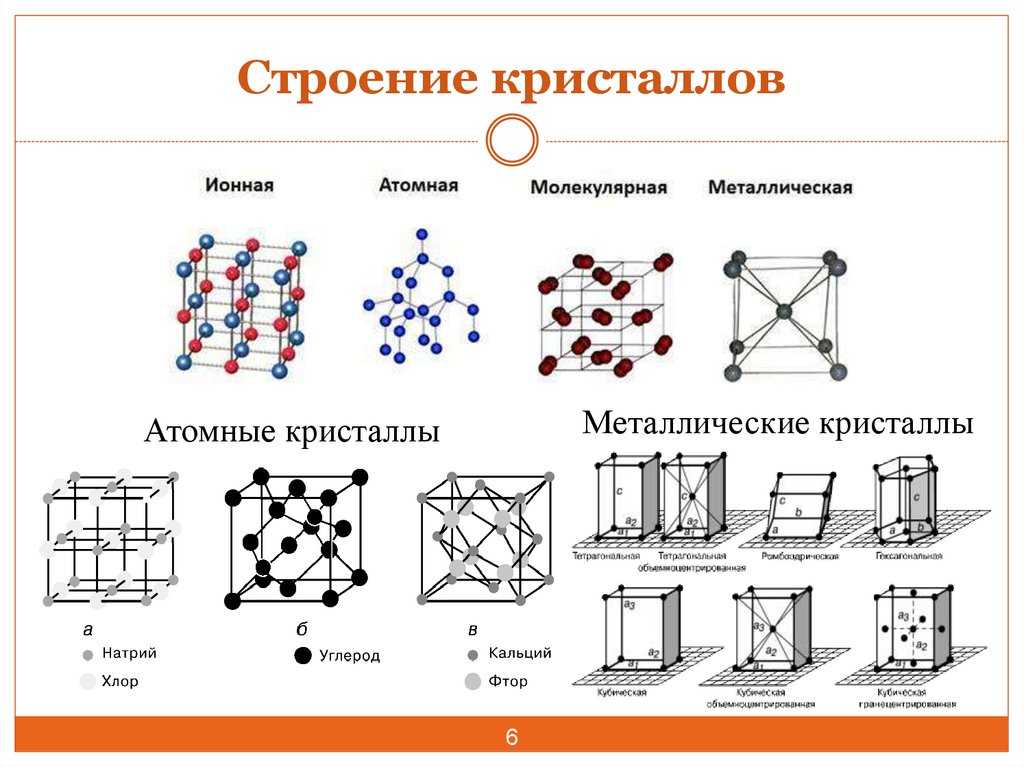
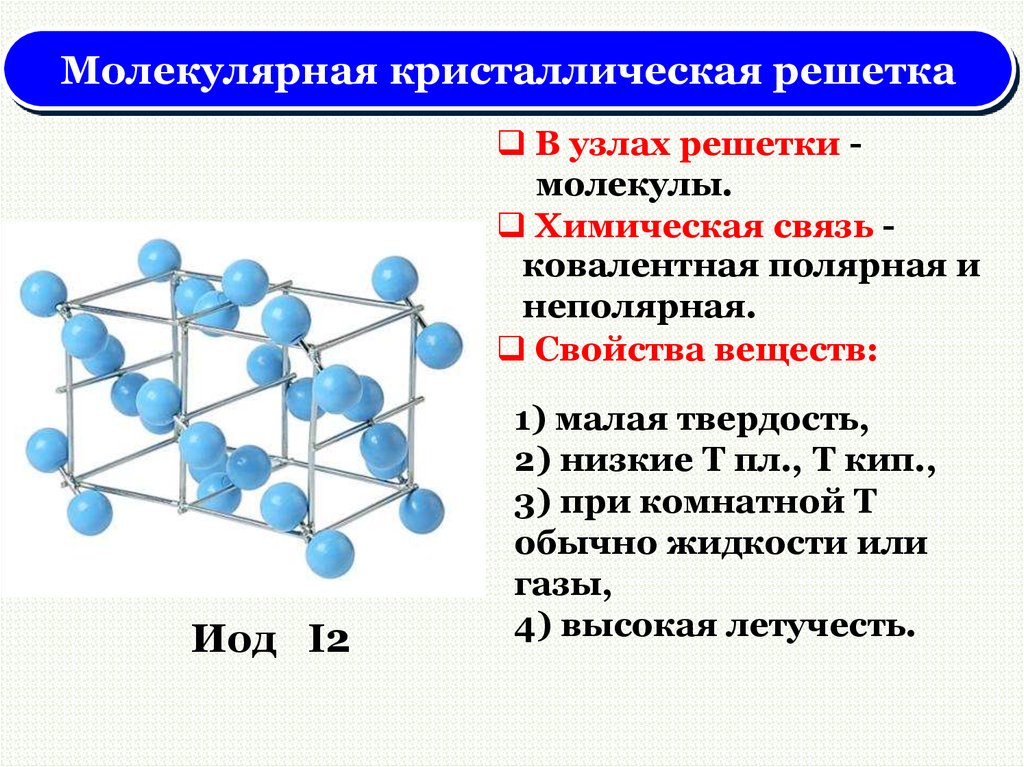
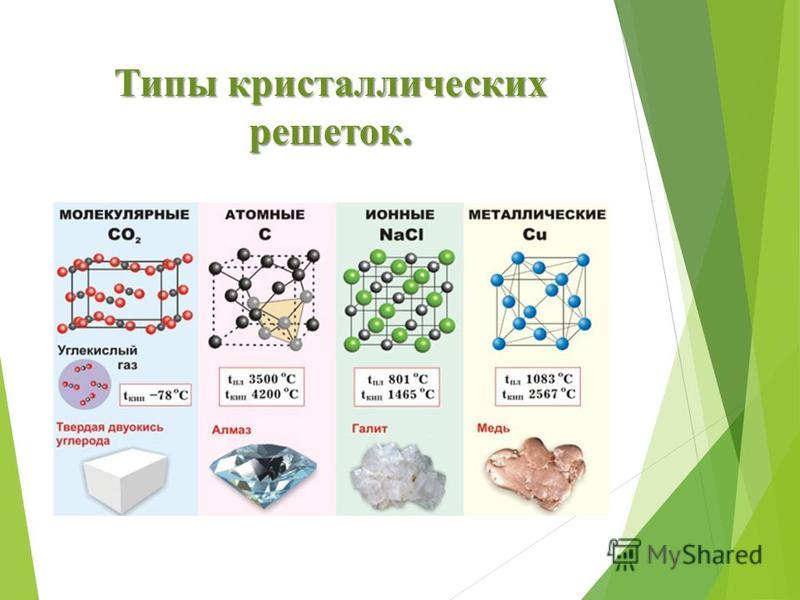
Кристаллические решётки
Таблица №3|
Тип кристаллической решётки |
|||
|
ионная |
молекулярная |
атомная |
|
|
Вид связи |
Ионная |
Ковалентная |
Ковалентная |
|
Частицы, образующие кристалл |
Ионы |
Молекулы |
Атомы |
|
Силы взаимодействия между частицами кристалла |
Электростатические |
Межмолекулярные |
Ковалентные |
|
Прочность связи |
Прочная |
Непрочная |
Очень прочная |
|
Отличительные физические свойства вещества |
Твёрдость сравнительно высокая; температура кипения высокая; тем-пература плавления вы-сокая; легко раство- ряются в воде; раствор и расплав проводят
электрический ток. |
Твёрдость неболь- шая; температура кипения низкая; температура плав- ления низкая; не- которые вещества могут растворять- ся в воде. |
Твёрдость очень высокая; тем-пература кипе-ния высокая; в воде не раство-ряются; расплав не проводит электрический ток. |
|
Примеры веществ |
Большинство солей, некоторые оксиды (име- ющие ионную связь), например: NaCl; KCl; Li2O; CaO; MgI2и
другие. |
Неметаллы (напри мер, водород, азот, кислород и другие, за исключением углерода и крем-ния), хлороводород оксид углерода (IV) |
Алмаз, кремний |
Вернёмся к таблице №1. Продолжим установление причинно-следственных связей.
Таблица №1|
Строение атомов химических элементов |
Тип химической связи между ними |
Тип кристаллической решётки |
Физические свойства вещества |
|
Причина следствие причина следствие причина следствие |
|||
Из таблицы 1 видно, что одна характеристика вещества, будучи
причиной другой, является следствием третьей.
Заключительная часть
Выполняются задания:
Задание №1.
Кремний имеет атомную кристаллическую решётку. Какие его характерные физические свойства можно предсказать?Задание№2. Какой тип кристаллической решётки характерен для сульфида натрия?
Задание №3. Оксид углерода (IV)
имеет очень низкую температуру плавления, а оксид кремния (IV) – очень высокую (кварц плавится при 17280С). Какую кристаллическую решётку они должны иметь?УЧИТЕЛЬ. Таким образом, на данном уроке мы с вами узнали о кристаллических решётках, их типах (ионной, молекулярной, атомной) и установили причинно-следственную связь между строением веществ и их физическими свойствами.
Затем выставляются оценки с комментариями.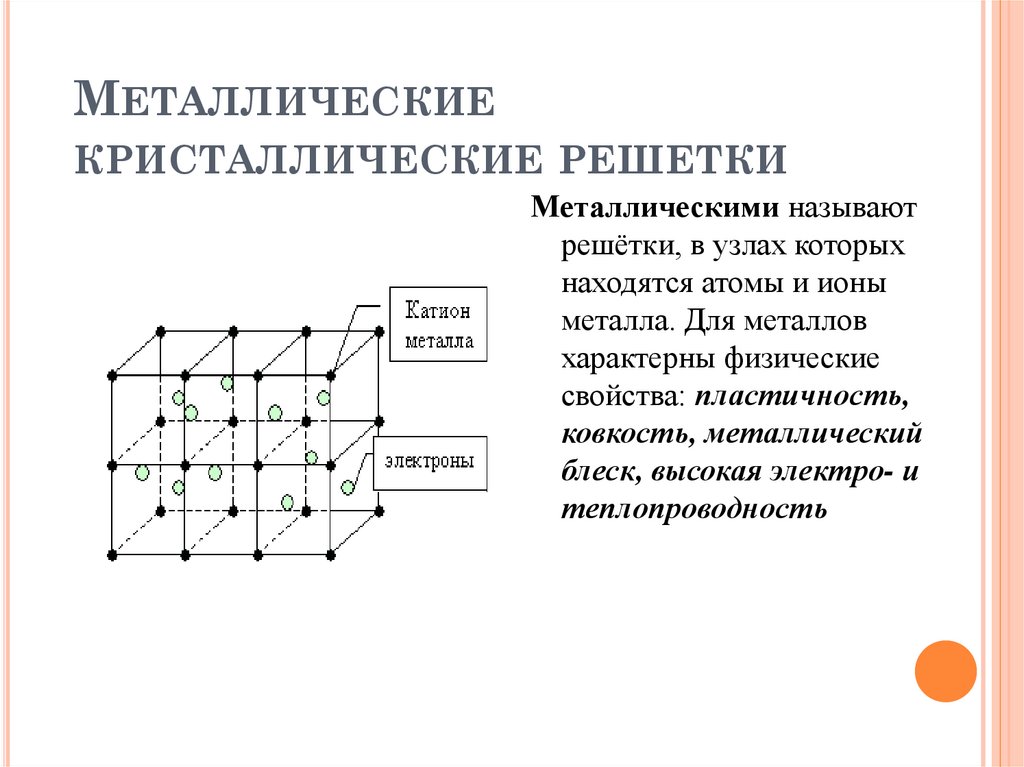
Предлагается следующее ДОМАШНЕЕ ЗАДАНИЕ:
Задание №1.
На конкретных примерах сравните физические свойства веществ с молекулярной и атомной кристаллическими решётками. Задание№2. На конкретных примерах покажите: как проявляется зависимость некоторых физических свойств веществ от типа их кристаллической решётки? Задание №3. Изобразите схемы строения следующих ионов:Mg2+, Cl¯, Na+, F¯.
Какой тип кристаллической решётки характерен для соединений, образованных этими частицами?
Влияние образования межузельного кислорода на деформацию кристаллической решетки в слоистых оксидах перовскита для электрохимических устройств
Влияние образования межузельного кислорода на деформацию кристаллической решетки в слоистых оксидах перовскита для электрохимических устройств
Такаши Накамура* a Ихан Лин и и Кодзи Амедзава и
Принадлежности автора
* Соответствующие авторы
и Институт междисциплинарных исследований перспективных материалов, Университет Тохоку, Япония
Электронная почта: t-naka@tagen.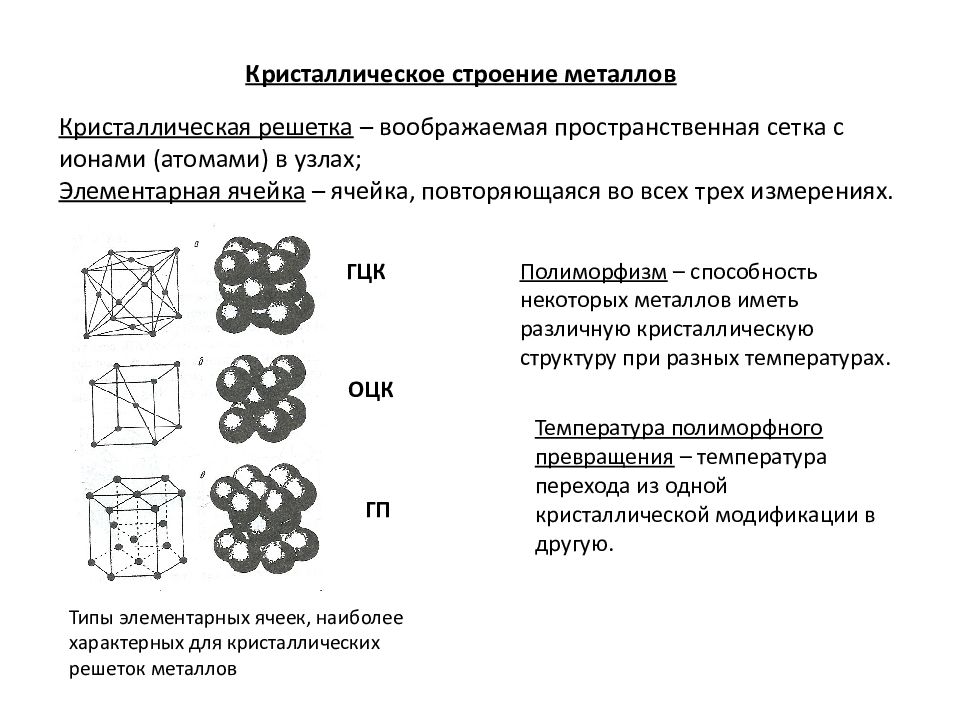 tohoku.ac.jp
tohoku.ac.jp
Аннотация
In order to understand the behaviour of the crystal lattice deformation induced by the interstitial oxygen formation in La 2 (Ni 0.9 M 0.1 )O 4+ δ ( M = Fe, Co, Cu), термогравиметрию, кулонометрическое титрование и высокотемпературную рентгенографию проводили в интервале температур от 873 до 1173 К и P (O 2 ) диапазон от 10 −24 до 1 бар. Compared with non-doped La 2 NiO 4+ δ , La 2 (Ni 0.9 Fe 0.1 )O 4+ δ и LA 2 (NI 0,9 CO 0,1 ) O 4+ Δ . 0032 2 (Ni 0,9 Cu 0,1 )O 4+ δ 4 900 меньше. Кристаллическую структуру при высоких температурах анализировали в предположении тетрагональной симметрии I 4/ ммм для всех составов. С увеличением концентрации межузельного кислорода параметр решетки, перпендикулярный слою перовскита, увеличивался, а параметр решетки, параллельный слою перовскита, уменьшался. Следовательно, изменение объема клетки за счет интерстициального образования кислорода было небольшим, а это означает, что макроскопическое химическое расширение было небольшим. Поведение химической и термической деформации можно объяснить, если принять линейную зависимость постоянных решетки от Т и δ . Были рассчитаны кажущиеся и истинные коэффициенты теплового расширения, а также коэффициент химического расширения и проведено их сравнение с оксидами типа перовскита и флюорита с дефицитом кислорода.
0032 2 (Ni 0,9 Cu 0,1 )O 4+ δ 4 900 меньше. Кристаллическую структуру при высоких температурах анализировали в предположении тетрагональной симметрии I 4/ ммм для всех составов. С увеличением концентрации межузельного кислорода параметр решетки, перпендикулярный слою перовскита, увеличивался, а параметр решетки, параллельный слою перовскита, уменьшался. Следовательно, изменение объема клетки за счет интерстициального образования кислорода было небольшим, а это означает, что макроскопическое химическое расширение было небольшим. Поведение химической и термической деформации можно объяснить, если принять линейную зависимость постоянных решетки от Т и δ . Были рассчитаны кажущиеся и истинные коэффициенты теплового расширения, а также коэффициент химического расширения и проведено их сравнение с оксидами типа перовскита и флюорита с дефицитом кислорода. Установлено, что коэффициенты химического расширения оксидов на основе La 2 NiO 4 , индуцированных образованием/аннигиляцией междоузельного кислорода, меньше, чем у оксидов типа перовскита и флюорита, индуцированных образованием/аннигиляцией кислородных вакансий.
Установлено, что коэффициенты химического расширения оксидов на основе La 2 NiO 4 , индуцированных образованием/аннигиляцией междоузельного кислорода, меньше, чем у оксидов типа перовскита и флюорита, индуцированных образованием/аннигиляцией кислородных вакансий.
Влияние концентрации остаточного кислорода на параметры решетки порошка нитрида алюминия, полученного по реакции карботермического восстановительного азотирования
. 2022 14 декабря; 15 (24): 8926.
дои: 10.3390/ma15248926.
Джэгём Ким 1 , Хевон Ан 1 , Сын Чжу Ким 2 3 , Джонг-Ён Ким 1 , Джэ-Хван Пи 1
Принадлежности
- 1 Ичхонский филиал Корейского института инженерии и технологии керамики (KICET), 3321, Gyeongchung Rd.
 , Sindun-Myeon, Icheon-si 17303, Республика Корея.
, Sindun-Myeon, Icheon-si 17303, Республика Корея. - 2 Химический факультет Университета Аджу, Сувон 16499, Республика Корея.
- 3 Департамент исследований энергетических систем, Университет Аджу, Сувон 16499, Республика Корея.
- PMID: 36556732
- PMCID: PMC9787569
- DOI: 10.3390/ma15248926
Бесплатная статья ЧВК
Джэгём Ким и др.
Материалы (Базель). .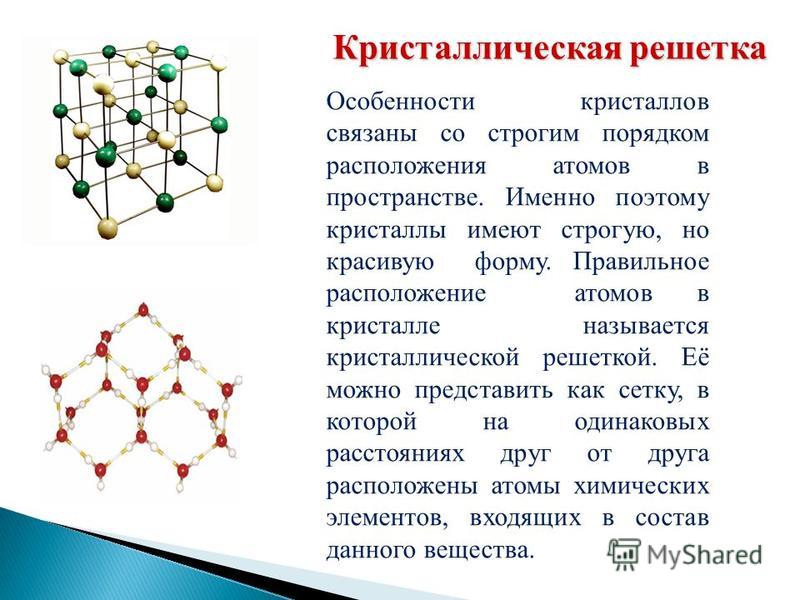
Бесплатная статья ЧВК
. 2022 14 декабря; 15 (24): 8926.
дои: 10.3390/ma15248926.
Авторы
Джэгём Ким 1 , Хевон Ан 1 , Сын Чжу Ким 2 3 , Джонг-Ён Ким 1 , Джэ-Хван Пи 1
Принадлежности
- 1 Ичхонский филиал Корейского института инженерии и технологии керамики (KICET), 3321, Gyeongchung Rd., Sindun-Myeon, Icheon-si 17303, Республика Корея.
- 2 Химический факультет Университета Аджу, Сувон 16499, Республика Корея.

- 3 Департамент исследований энергетических систем, Университет Аджу, Сувон 16499, Республика Корея.
- PMID: 36556732
- PMCID: PMC9787569
- DOI: 10.3390/ma15248926
Абстрактный
Остаточный кислород в кристалле нитрида алюминия (AlN) типа вюрцита, который существенно влияет на перенос фононов и рост кристаллов, имеет решающее значение для теплопроводности и качества кристаллов керамики AlN. В этом исследовании влияние остаточного кислорода на решетку AlN изучалось для образцов в состоянии после синтеза и после спекания. Контролируя время реакции в процедуре карботермического восстановительного азотирования (CRN), был успешно синтезирован порошок AlN, а количество остаточного кислорода систематически контролировалось. Эволюция параметров решетки AlN по отношению к кислороду, конц. был тщательно изучен с помощью рентгеноструктурного анализа. С увеличением количества остаточного кислорода в только что синтезированном AlN расширение решетки в 9Плоскость 0006 ab индуцировалась без существенного изменения параметра решетки c оси. Расширение решетки в плоскости ab за счет остаточного кислорода также было подтверждено с помощью просвечивающей электронной микроскопии высокого разрешения, в отличие от инвариантного параметра решетки спеченной фазы AlN. Значения микродеформации по уширению пиков XRD подтверждают, что напряжение, вызванное остаточным кислородом, расширяет решетку AlN. В этой работе расширение решетки AlN с увеличением остаточного кислорода было выявлено с помощью рентгеновской дифракции и HR-TEM, которые полезны для оценки и контроля содержания кислорода в решетке в керамике AlN.
Контролируя время реакции в процедуре карботермического восстановительного азотирования (CRN), был успешно синтезирован порошок AlN, а количество остаточного кислорода систематически контролировалось. Эволюция параметров решетки AlN по отношению к кислороду, конц. был тщательно изучен с помощью рентгеноструктурного анализа. С увеличением количества остаточного кислорода в только что синтезированном AlN расширение решетки в 9Плоскость 0006 ab индуцировалась без существенного изменения параметра решетки c оси. Расширение решетки в плоскости ab за счет остаточного кислорода также было подтверждено с помощью просвечивающей электронной микроскопии высокого разрешения, в отличие от инвариантного параметра решетки спеченной фазы AlN. Значения микродеформации по уширению пиков XRD подтверждают, что напряжение, вызванное остаточным кислородом, расширяет решетку AlN. В этой работе расширение решетки AlN с увеличением остаточного кислорода было выявлено с помощью рентгеновской дифракции и HR-TEM, которые полезны для оценки и контроля содержания кислорода в решетке в керамике AlN.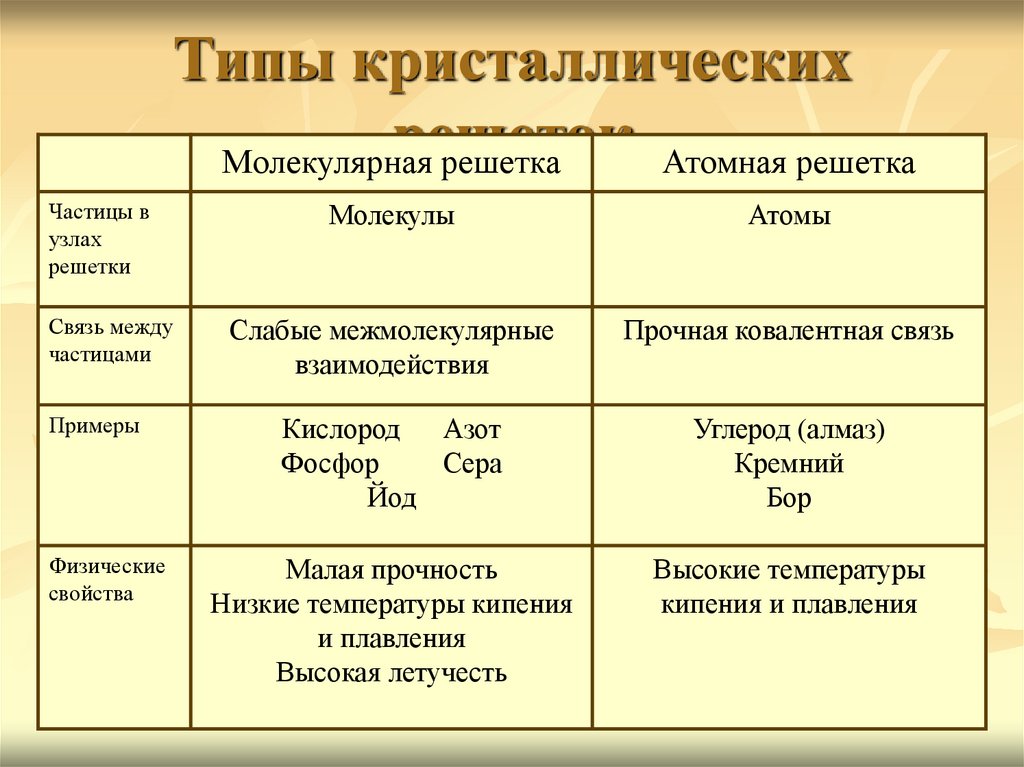
Ключевые слова: нитрид алюминия; параметр решетки; нитриды; остаточный кислород.
Заявление о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Цифры
Рисунок 1
Рентгенограммы продуктов…
Рисунок 1
Рентгенограммы продуктов, полученных при различном времени реакции при 1700 °C.
Рисунок 1рентгенограммы продуктов, полученные при различном времени реакции при 1700 °C.
Рисунок 2
Изменения параметров решетки (…
Рисунок 2
Изменение параметров решетки ( a , c ) и объема элементарной ячейки…
фигура 2 Изменение параметров решетки ( a , c ) и объема элементарной ячейки образцов AlN в зависимости от времени реакции.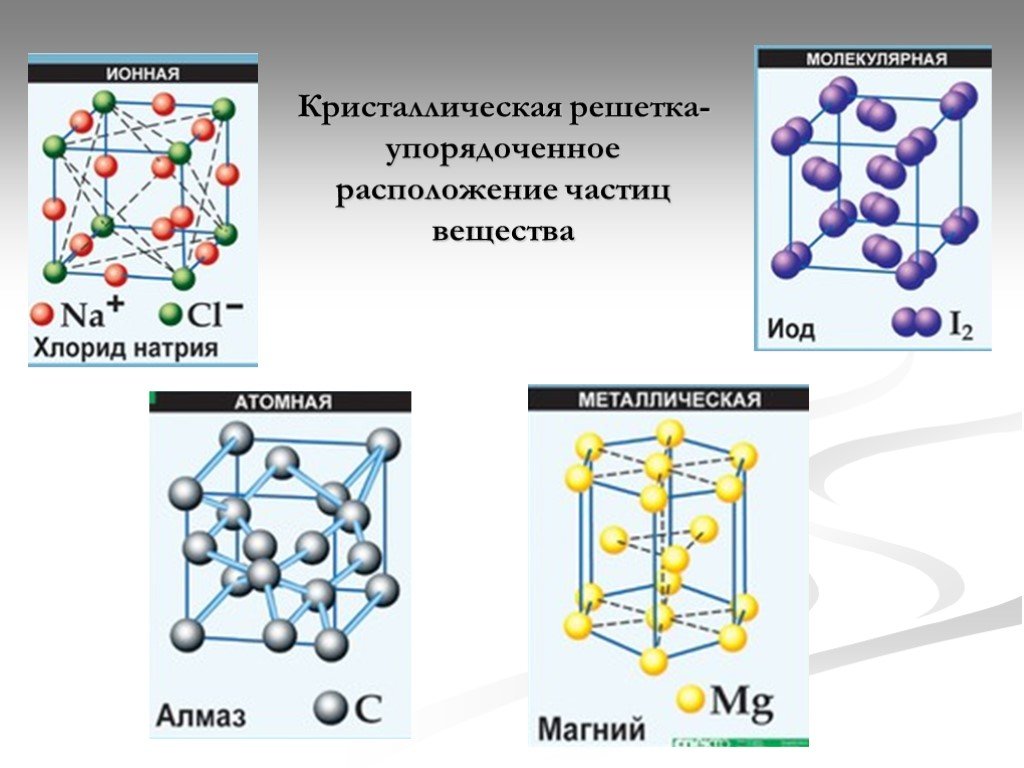 Постоянные решетки образцов AlN до и после спекания показаны черными и красными открытыми символами соответственно.
Постоянные решетки образцов AlN до и после спекания показаны черными и красными открытыми символами соответственно.
Рисунок 3
HRTEM-изображения за 1 ч…
Рисунок 3
HRTEM-изображения за 1 ч ( a , b ) и 5 ч…
Рисунок 3HRTEM-изображения 1-часового ( a , b ) и 5-часового ( c , d ) образцов, соответствующих электронограммам, показанным на вставках.
Рисунок 4
Изменения деформации и остаточные…
Рисунок 4
Изменения деформации и концентрации остаточного кислорода в решетке AlN в зависимости от времени реакции.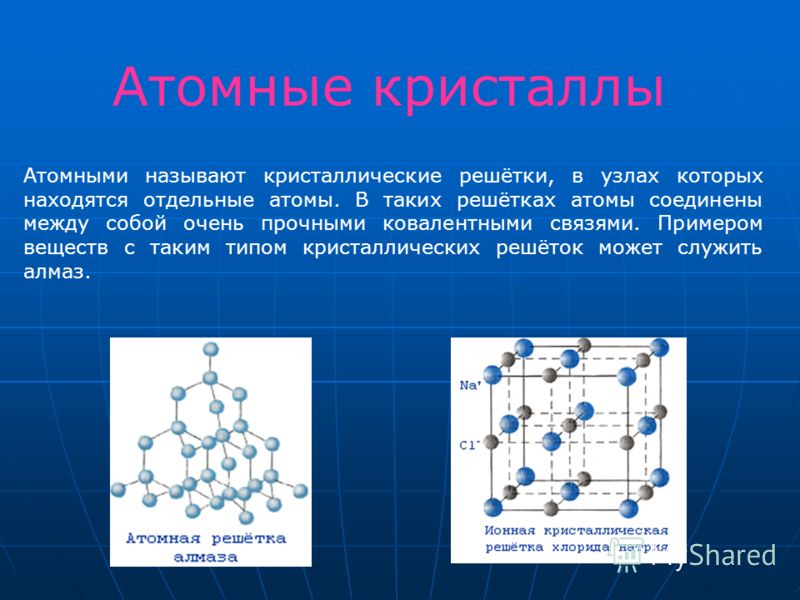
Изменения деформации и концентрации остаточного кислорода в решетке AlN в зависимости от времени реакции.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Прямые доказательства влияния растворения кислорода на тепло- и электропроводность керамики AlN с использованием твердотельного ЯМР-анализа Al.
Kim J, Kim JY, Ahn H, Jeong MH, Lee E, Cho K, Lee SM, Shim W, Pee JH. Ким Дж. и др. Материалы (Базель). 2022 16 ноября; 15 (22): 8125. дои: 10.3390/ma15228125. Материалы (Базель). 2022. PMID: 36431611 Бесплатная статья ЧВК.
Процессы двухстадийного плазменно-термического азотирования для получения порошков нитрида алюминия из порошков алюминия.

Sung MC, Wang YF, Chen SC, Tsai CH. Сун М.С. и др. Материалы (Базель). 2019 24 января; 12 (3): 359. дои: 10.3390/ma12030359. Материалы (Базель). 2019. PMID: 30678349Бесплатная статья ЧВК.
Структурные, поверхностные и оптические исследования m- и c-граней кристаллов AlN, выращенных методом физического паропереноса.
Чжан С., Ян Х., Ван Л., Ченг Х., Лу Х., Ян И., Ван Л., Сюй Г., Фэн З.К., Кляйн Б., Фергюсон И.Т., Сунь В. Чжан С. и др. Материалы (Базель). 2023 25 февраля; 16 (5): 1925. дои: 10.3390/ma16051925. Материалы (Базель). 2023. PMID: 360 Бесплатная статья ЧВК.
Влияние температуры и времени на прямое азотирование алюминиевых порошков для изготовления арматуры AlN.

Роджерс С., Даргуш М., Кент Д. Роджерс С. и соавт. Материалы (Базель). 2023 14 февраля; 16 (4): 1583. дои: 10.3390/ma16041583. Материалы (Базель). 2023. PMID: 36837213 Бесплатная статья ЧВК.
Рост полуполярной (101¯3) пленки AlN на сапфире M-плоскости с высокотемпературным азотированием методом HVPE.
Ли С, Чжао Дж, Лю Т, Лу И, Чжан Дж. Ли Х и др. Материалы (Базель). 2021 31 марта; 14 (7): 1722. дои: 10.3390/ma14071722. Материалы (Базель). 2021. PMID: 33807424 Бесплатная статья ЧВК.
Посмотреть все похожие статьи
Рекомендации
- Байк Ю., Дрю Р.А. Нитрид алюминия: обработка и применение. Ключ инж. Матер. 1996; 122:553.
 doi: 10.4028/www.scientific.net/KEM.122-124.553.
—
DOI
doi: 10.4028/www.scientific.net/KEM.122-124.553.
—
DOI
- Байк Ю., Дрю Р.А. Нитрид алюминия: обработка и применение. Ключ инж. Матер. 1996; 122:553.
- Курокава Ю., Утсуми К., Такамизава Х. Разработка и микроструктурная характеристика керамики из нитрида алюминия с высокой теплопроводностью. Варенье. Керам. соц. 1988;71:588–594. doi: 10.1111/j.1151-2916.1988.tb05924.x. — DOI
- Шанг К., Ван З., Ли Дж., Чжоу Г., Чжан Х., Ван С. Литье гель-ленты из керамики из нитрида алюминия. Дж. Адв. Керам. 2017; 6: 67–72. doi: 10.1007/s40145-016-0211-3. — DOI
- Иде Т.

- Иде Т.

 , Sindun-Myeon, Icheon-si 17303, Республика Корея.
, Sindun-Myeon, Icheon-si 17303, Республика Корея.

 doi: 10.4028/www.scientific.net/KEM.122-124.553.
—
DOI
doi: 10.4028/www.scientific.net/KEM.122-124.553.
—
DOI
Leave A Comment