Задачи на вычисление массовой доли раствора
Задания 22. Вычисление массовой доли растворенного вещества
К раствору силиката калия массой 20,53 г и массовой долей 15% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
Решение.
1) Составим уравнение реакции:
2) Рассчитаем массу и количество вещества силиката калия, содержащегося в растворе:
;
.
3) Определим массу осадка:
по уравнению реакции ;
.
Ответ: 2,32 г.
2. К раствору сульфата алюминия массой 68,4 г и массовой долей 8% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
3. Вычислите объём газа (н. у.), который выделится при действии избытка сульфида железа(II) на 490 г 10%-ного раствора серной кислоты.
4. Через 40 г раствора с массовой долей гидроксида натрия 8% пропустили сернистый газ. При этом образовался сульфит натрия. Вычислите объём (н. у.) вступившего в реакцию газа.
5. Раствор соляной кислоты массой 116,8 г и массовой долей 10% добавили к избытку сульфида магния. Вычислите объём (н. у.) выделившегося газа.
6. К раствору карбоната калия массой 110,4 г и массовой долей 5% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
7. После пропускания через раствор гидроксида калия 4,48 л сернистого газа (н. у.) получили 252,8 г раствора сульфита калия. Вычислите массовую долю соли в полученном растворе.
8. Вычислите объём углекислого газа (н. у. ), который выделится при действии на избыток карбоната кальция 730 г 20%-ного раствора соляной кислоты.
), который выделится при действии на избыток карбоната кальция 730 г 20%-ного раствора соляной кислоты.
9. К раствору карбоната калия массой 27,6 г и массовой долей 20% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
10. При взаимодействии 8,0 г оксида серы(VI) с избытком раствора гидроксида калия получили 174 г раствора средней соли. Вычислите массовую долю соли в полученном растворе.
11. Вычислите объём аммиака (н. у.), необходимого для полной нейтрализации соляной кислоты массой 146 г и массовой долей 10%.
12. В 73 г соляной кислоты с массовой долей 5% поместили избыток цинка. Вычислите объём выделившегося газа (н. у.).
13. К 80 г раствора хлорида бария с массовой долей растворённого вещества 6,5% добавили избыток раствора серной кислоты. Вычислите массу выпавшего осадка.
14. При взаимодействии 150 г раствора нитрата свинца с небольшим избытком раствора иодида калия выпало 10,45 г осадка. Рассчитайте массовую долю нитрата свинца в исходном растворе.
При взаимодействии 150 г раствора нитрата свинца с небольшим избытком раствора иодида калия выпало 10,45 г осадка. Рассчитайте массовую долю нитрата свинца в исходном растворе.
15. При растворении 10 г технического цинка в избытке разбавленной соляной кислоты выделилось 3,1 л (н. у.) водорода. Определите массовую долю примесей в этом образце цинка.
16. Рассчитайте массу осадка, который выпадет при взаимодействии избытка карбоната калия с 17,4 г раствора нитрата бария с массовой долей последнего 15%.
17. При взаимодействии 30,93 г руды, содержащей карбонат железа(II), с избытком соляной кислоты выделилось 4,48 л углекислого газа. Определите массовую долю карбоната железа в руде.
18. При растворении 180 г известняка в избытке азотной кислоты выделилось 34,27 л (н. у.) углекислого газа. Определите массовую долю карбоната кальция в данном образце известняка.
19. Определите объём (н. у.) углекислого газа, выделяющегося при растворении 110 г известняка, содержащего 92% карбоната кальция, в избытке азотной кислоты.
Определите объём (н. у.) углекислого газа, выделяющегося при растворении 110 г известняка, содержащего 92% карбоната кальция, в избытке азотной кислоты.
20. В избытке соляной кислоты растворили 1,506 г руды, содержащей 77% карбоната железа(II). Определите объём углекислого газа, выделившегося при этом.
21. При растворении в избытке разбавленной серной кислоты цинка, содержащего 4,5% нерастворимых примесей, выделилось 2,24 л (н. у.) водорода. Определить массу исходного образца металла, содержащего примеси.
22. Рассчитайте массу осадка, который выпадет при сливании 500 г 2%-ного раствора иодида калия с избытком раствора нитрата свинца.
23. При взаимодействии избытка раствора карбоната калия с 10%-ным раствором нитрата бария выпало 3,94 г осадка. Определить массу взятого для опыта раствора нитрата бария.
24. Через раствор нитрата меди(II) массой 37,6 г и массовой долей 5% пропустили избыток сероводорода. Вычислите массу осадка, образовавшегося в результате реакции.
Вычислите массу осадка, образовавшегося в результате реакции.
25. При обжиге 90 кг пирита (минерала, содержащего ) образовался сернистый газ объёмом 26,88 м3 (в пересчёте на н. у.). Рассчитайте массовую долю негорючих примесей в пирите.
26. При обжиге 50 кг сфалерита (минерала, содержащего ) образовался сернистый газ объёмом 8,96 м3 (в пересчёте на н. у.). Рассчитайте массовую долю негорючих примесей в сфалерите.
27. К 104 г раствора с массовой долей хлорида бария 9% добавили избыток раствора фосфорной кислоты. Вычислите массу образовавшегося осадка. Ответ округлите до целых.
28. К 296 г раствора с массовой долей нитрата магния 6% добавили избыток раствора фосфорной кислоты. Вычислите массу образовавшегося осадка.
29. К 250 г раствора карбоната натрия добавляли раствор хлорида бария до прекращения выделения осадка. Масса отфильтрованного и высушенного осадка составила 39,4 г. Рассчитайте массовую долю карбоната натрия в исходном растворе.
Масса отфильтрованного и высушенного осадка составила 39,4 г. Рассчитайте массовую долю карбоната натрия в исходном растворе.
30. К раствору сульфита натрия массой 252 г и массовой долей 5% добавили избыток раствора соляной кислоты. Вычислите объем (н. у.) выделившегося газа.
31. К 150 г раствора карбоната натрия добавили избыток разбавленной серной кислоты, и раствор нагрели до окончания выделения газа. Всего выделилось 3,36 л газа (н. у.). Рассчитайте массовую долю карбоната натрия в исходном растворе.
32. Через 5%-ный раствор сульфата меди(II) пропускали сероводород до прекращения выделения чёрного осадка. Масса осадка составила 14,4 г. Чему равна масса раствора сульфата меди(II)?
33. Через 10%-ный раствор серной кислоты пропускали аммиак до полного образования средней соли. Всего израсходовано 11,2 л (н. у.) аммиака. Определите массу исходного раствора серной кислоты.
34. 170 г раствора нитрата серебра смешали с избытком раствора хлорида натрия. Выпал осадок массой 8,61 г. Вычислите массовую долю соли в растворе нитрата серебра.
35. К 252 г раствора сульфита натрия с массовой долей соли 5,0 % добавили избыток соляной кислоты. Вычислите объём (н. у.) выделившегося газа.
36. После пропускания 11,2 л (н. у.) аммиака через 10-процентный раствор серной кислоты получили раствор средней соли. Определите массу исходного раствора серной кислоты.
37. К 360 г раствора сульфата аммония добавили избыток щёлочи, полученный раствор нагрели до прекращения выделения газа. Общий объём газа составил 13,44 л (н. у.). Определите массовую долю сульфата аммония в растворе.
38. К 125 г раствора серной кислоты добавили избыток гидрокарбоната натрия. Общий объём выделившегося газа составил 11,2 л (н. у.). Определите массовую долю серной кислоты в растворе.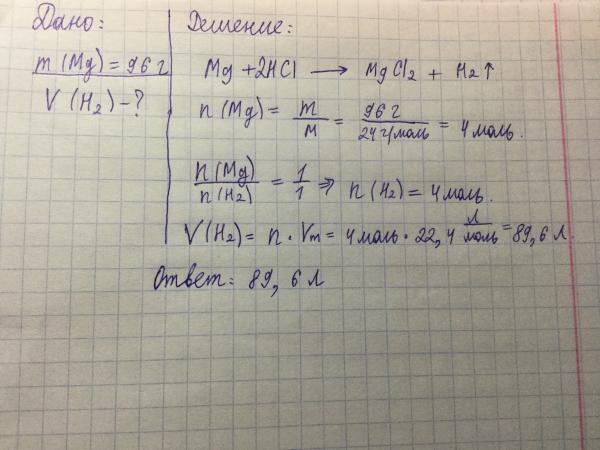
39. Для полной нейтрализации серной кислоты к 250 г её раствора потребовалось добавить 280 г 10-процентного раствора гидроксида натрия. Определите массовую долю серной кислоты в исходном растворе.
40. Для полной нейтрализации гидроксида бария к 250 г его раствора потребовалось добавить 50 г 7,3-процентной соляной кислоты. Определите массовую долю гидроксида бария в исходном растворе.
41. К 200 г соляной кислоты медленно добавляли карбонат натрия до прекращения выделения газа, которого было собрано 4,48 л (н.у.). Определите массовую долю хлороводорода в растворе соляной кислоты.
42. К 300 г баритовой воды добавили избыток раствора карбоната натрия, выпал осадок массой 11,82 г. Определите массовую долю гидроксида бария в исходном растворе.
43. Для определения концентрации серной кислоты к её раствору добавляли хлорид бария до прекращения выпадения осадка. Для взаимодействия с 20 г раствора кислоты потребовалось 52 г 10-процентного раствора хлорида бария. Определите массовую долю серной кислоты в исходном растворе.
Для взаимодействия с 20 г раствора кислоты потребовалось 52 г 10-процентного раствора хлорида бария. Определите массовую долю серной кислоты в исходном растворе.
44. Соляную кислоту добавляли к раствору нитрата серебра до окончания выпадения осадка. Для взаимодействия с 50 г раствора соли потребовалось 10 г 7,3-процентной соляной кислоты. Определите массовую долю нитрата серебра в исходном растворе.
45. 170 г раствора нитрата серебра смешали с избытком раствора хлорида натрия. Выпал осадок массой 8,61 г. Вычислите массовую долю соли в растворе нитрата серебра.
46. При сжигании сульфида железа(II) на воздухе образовалось 32 кг оксида железа(III). Какой объём воздуха (н.у.) для этого потребовался? Объёмная доля кислорода в воздухе составляет 21 %.
47. Какой объём воздуха (н. у.) потребуется для полного сжигания 48 кг дисульфида железа(II) до сернистого газа? Объёмная доля кислорода в воздухе составляет 21%.
48. Раствор соляной кислоты массой 116,8 г и массовой долей 10% добавили к избытку сульфида магния. Вычислите объём (н.у.) выделившегося газа.
49. Через раствор гидроксида натрия пропустили 4,48 л сернистого газа. Образовалось 126 г раствора сульфита натрия. Вычислите массовую долю соли в полученном растворе.
50. Вычислите массу осадка, который образуется при действии раствора избытка хлорида меди (II) на 80 г 10 %-ного раствора гидроксида натрия.
51. К 340 г раствора с массовой долей нитрата серебра 6 % добавили избыток раствора хлорида железа (III). Вычислите массу образовавшегося осадка.
52. После пропускания 5,6 л сернистого газа через 400 г раствора гидроксида натрия получили раствор средней соли. Вычислите массовую долю гидроксида натрия в растворе.
53. При взаимодействии 7,1 г оксида фосфора(V) с избытком раствора гидроксида натрия получили 164 г раствора средней соли. Вычислите массовую долю соли в полученном растворе.
Вычислите массовую долю соли в полученном растворе.
54. К раствору с массовой долей гидроксида натрия 5% добавили избыток раствора сульфата меди(II). При этом образовался осадок массой 4,9 г. Определите массу исходного раствора щелочи.
55. Рассчитайте массу гидроксида натрия, необходимую для полной нейтрализации 245 г раствора с массовой долей серной кислоты 20%.
56. После пропускания через раствор гидроксида калия 1,12 л углекислого газа (н.у.) получили 138 г раствора карбоната калия. Вычислите массовую долю соли в полученном растворе.
57. Оксид меди(II) массой 32 г может прореагировать с 146 г раствора соляной кислоты. Определите массовую долю кислоты в растворе.
58. К 150 г раствора карбоната натрия добавляли раствор хлорида кальция до прекращения выделения осадка. Масса осадка составила 12,0 г. Вычислите массовую долю карбоната натрия в исходном растворе.
59. К раствору серной кислоты с массовой долей 5% добавили избыток раствора нитрата бария. При этом выпал осадок массой 11,65 г. Определите массу исходного раствора серной кислоты.
60. К 85 г раствора с массовой долей нитрата серебра 2% добавили избыток раствора хлорида натрия. Определите массу выпавшего осадка.
61. Вычислите массу осадка, образовавшегося в результате добавления избытка гидроксида калия к 19 г раствора хлорида магния с массовой долей соли 5%.
62. К 134 г раствора с массовой долей хлорида меди (II) 2% добавили избыток раствора нитрата серебра. Определите массу выпавшего осадка.
63. Вычислите массу 5%-ного раствора нитрата серебра, с которым может прореагировать медь массой 3,2 г.
64. Через 350 г раствора серной кислоты с массовой долей 7% пропустили аммиак до образования сульфата аммония. Вычислите объём (н. у.) вступившего в реакцию газа.
у.) вступившего в реакцию газа.
65. К 200 г раствора серной кислоты с массовой долей 12,25% прилили избыток раствора нитрата бария. Определите массу выпавшего осадка.
66. Вычислите массу карбоната натрия, который потребуется для полной нейтрализации 49 г 20%-ного раствора серной кислоты.
67. К 89 г раствора хлорида алюминия с массовой долей 15,0% добавили избыток раствора нитрата свинца. Определите массу выпавшего осадка.
68. К 88,8 г раствора с массовой долей хлорида кальция 15% добавили избыток раствора фосфата натрия. Вычислите массу образовавшегося осадка.
69. К 150 г раствора карбоната натрия добавляли соляную кислоту до прекращения выделения газа. Всего выделилось 3.36 л газа (н.у.). Рассчитайте массовую долю карбоната натрия в исходном растворе.
70. Через 80 г раствора гидроксида натрия с массовой долей растворённого вещества 10% пропустили углекислый газ до образования карбоната натрия. Вычислите объём (н.у.), затраченного на реакцию газа.
Вычислите объём (н.у.), затраченного на реакцию газа.
71. К избытку раствора сульфата меди(II) добавили 10 г раствора с массовой долей гидроксида натрия 20%. Вычислите массу образовавшегося осадка.
72. К 27 г раствора с массовой долей хлорида меди (II) 10% добавили избыток раствора сульфида натрия. Определите массу выпавшего осадка.
73. К 57 г раствора сульфата железа (III) с массовой долей 7% добавили избыток раствора хлорида бария. Определите массу выпавшего осадка.
74. Раствор азотной кислоты массой 25,2 г и массовой долей 10% прилили к избытку карбоната магния. Вычислите объём выделившегося газа.
75. Вычислите массу осадка, который образуется при действии раствора хлорида кальция на 424 г 5%-ного раствора карбоната натрия.
76. При пропускании 2,24 л оксида углерода(IV) через раствор гидроксида калия получили 138 г раствора карбоната калия. Вычислите массовую долю соли в полученном растворе.
Вычислите массовую долю соли в полученном растворе.
77. Вычислите массу раствора азотной кислоты с массовой долей 7%, необходимого для реакции с 6,42 г гидроксида железа(III).
78. Раствор соляной кислоты массой 29,2 г и массовой долей 5% добавили к избытку сульфита магния. Вычислите объём (н.у.) выделившегося газа.
79. В результате реакции оксида натрия с водой было получено 80 г 10%-ного раствора щёлочи. Определите массу прореагировавшего оксида натрия.
80. Вычислите объём (н.у.) газа, выделившегося в результате взаимодействия избытка магния со 146 г соляной кислоты с массовой долей HCl 20%.
81. К 200 г раствора сульфата натрия добавляли раствор гидроксида бария до прекращения выделения осадка. Масса осадка составила 13.98 г. Рассчитайте массовую долю сульфата натрия в исходном растворе.
82. Вычислите массу алюминия, который может прореагировать с 480 г 10%-ного раствора сульфата меди(II).
83. Вычислите объём сероводорода (н.у.), который потребуется для полного осаждения ионов меди из 320 г 20%-ного раствора сульфата меди(II).
84. 284 г раствора сульфата натрия с массовой долей растворённого вещества 10% смешали с избытком раствора хлорида бария. Вычислите массу выпавшего осадка.
85. Через раствор гидроксида бария пропустили хлороводород. Образовалось 41,6 г раствора хлорида бария с массовой долей 15%. Вычислите объём прореагировавшего газа.
86. К раствору карбоната натрия массой 84,8 г и массовой долей соли 5% прилили избыток раствора нитрата бария. Вычислите массу образовавшегося осадка.
87. Вычислите массу раствора азотной кислоты с массовой долей 15%, необходимой для полной нейтрализации раствора, содержащего 3,7 г гидроксида кальция.
88. К раствору хлорида железа(II) с массовой долей 5% добавили избыток раствора гидроксида натрия. В результате реакции образовался осадок массой 4,5г. Определите массу исходного раствора соли.
В результате реакции образовался осадок массой 4,5г. Определите массу исходного раствора соли.
89. При взаимодействии металлического натрия с водой образовалось 100 г раствора гидроксида натрия и 1,12 л водорода. Вычислите массовую долю гидроксида натрия в растворе.
90. После полного растворения 2г оксида меди(II) в азотной кислоте масса раствора составила 94 г. Чему равна массовая доля получившейся соли в этом растворе?
91. Через 175 г раствора серной кислоты с массовой долей 14% пропустили аммиак до образования сульфата аммония. Вычислите объём (н. у.) вступившего в реакцию газа.
92. К 150 г раствора гидроксида бария добавляли серную кислоту до прекращения выпадения осадка. Масса осадка составила 4,66 г. Рассчитайте массовую долю гидроксида бария в исходном растворе.
93. При пропускании 4,48 л углекислого газа (н.у.) через раствор гидроксида бария с массовой долей 12% образовался карбонат бария. Вычислите массу исходного раствора гидроксида бария.
Вычислите массу исходного раствора гидроксида бария.
94. После пропускания 4,4 г углекислого газа через 320 г раствора гидроксида калия получили раствор средней соли. Вычислите массовую долю щёлочи в исходном растворе.
95. Через раствор серной кислоты пропустили 0,224 л аммиака. Образовалось 13,2 г раствора сульфата аммония. Вычислите массовую долю соли в полученном растворе.
96. К избытку раствора фосфата калия добавили 102 г раствора с массовой долей нитрата серебра 10%. Вычислите массу образовавшегося осадка.
97. При взаимодействии избытка карбоната магния со 146 г раствора хлороводорода было получено 2,24 л углекислого газа (н.у.). Вычислите массовую долю хлороводорода в исходном растворе.
98. После полного растворения 0,115 г натрия в воде образовался раствор щёлочи, массой 3,2 г. Чему равна массовая доля щёлочи в получившемся растворе?
99.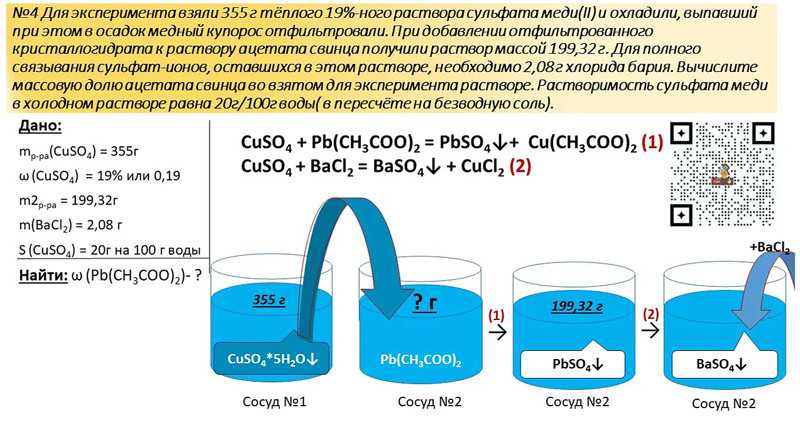 Вычислите массу осадка, образовавшегося в результате пропускания углекислого газа через 370 г раствора гидроксида кальция с массовой долей 0,2%.
Вычислите массу осадка, образовавшегося в результате пропускания углекислого газа через 370 г раствора гидроксида кальция с массовой долей 0,2%.
100. К 200 г раствора хлорида кальция добавляли раствор карбоната натрия до прекращения выпадения осадка. Масса осадка составила 12,0 г. Рассчитайте массовую долю хлорида кальция в исходном растворе. (Относительную атомную массу хлора примите равной 35,5)
101. При добавлении к раствору гидроксида калия с массовой долей щёлочи 10% избытка раствора нитрата меди(II) образовался осадок массой 9,8 г. Определите массу исходного раствора щёлочи.
102. Вычислите объём углекислого газа, который был поглощён 740 г 0,2%-ного раствора гидроксида кальция, если после окончания реакции был получен прозрачный раствор гидрокарбоната кальция
103. К 200 г раствора с массовой долей сульфата железа(III) 10% добавили избыток раствора нитрата бария. Вычислите массу образовавшегося осадка.
Вычислите массу образовавшегося осадка.
104. При взаимодействии 9,8 г гидроксида меди(II) с соляной кислотой получили 67 г раствора хлорида меди(II). Вычислите массовую долю соли в полученном растворе.
105. 73 г раствора соляной кислоты смешали с порцией карбоната кальция. При этом выделилось 0,896 л газа. Вычислите массовую долю исходного раствора соляной кислоты.
106. Вычислите массу оксида меди(II), который может прореагировать с 73 г 20%-ного раствора соляной кислоты.
107. Через 126 г раствора с массовой долей азотной кислоты 30% был пропущен аммиак, который полностью прореагировал. Определите объём (н.у.) аммиака, вступившего в реакцию.
108. При пропускании 5,6 л аммиака (н. у.) через раствор серной кислоты с массовой долей 7% образовался сульфат аммония. Вычислите массу исходного раствора серной кислоты.
109. К 284 г раствора сульфата натрия с массовой долей 10% добавили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
К 284 г раствора сульфата натрия с массовой долей 10% добавили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
110. Алюминий массой 5,4 г может прореагировать с 219 г раствора соляной кислоты. Определите процентную концентрацию кислоты в растворе.
111. Через раствор гидроксида кальция пропустили углекислый газ. Образовалось 324 г раствора гидрокарбоната кальция с массовой долей 1%. Вычислите объём прореагировавшего газа.
112. Вычислите массу раствора гидроксида натрия с массовой долей 10%, необходимого для полной нейтрализации раствора, содержащего 4,9 г серной кислоты.
113. Вычислите массу 10%-ного раствора соляной кислоты, который потребуется для полного растворения 21,4 г гидроксида железа(III).
114. Через 32 г раствора с массовой долей сульфата меди(II) 5% пропустили избыток газообразного сероводорода до полного выпадения черного осадка. Вычислите объём (н.у.) затраченного на реакцию газа.
Вычислите объём (н.у.) затраченного на реакцию газа.
115. Определите объём (н.у.) аммиака, который полностью прореагировал с раствором азотной кислоты массой 25,2 г и массовой долей кислоты 20%.
116. В результате взаимодействия растворов нитрата серебра и хлорида калия, взятого в избытке, выпал осадок массой 2,87 г. Вычислите массу исходного раствора нитрата серебра с массовой долей 17%, взятого для реакции.
117. К 80 г раствора с массовой долей гидроксида натрия 5% добавили избыток раствора сульфата меди(II). Определите массу выпавшего осадка.
118. Вычислите объём аммиака (н.у.), необходимого для полного взаимодействия со 196 г раствора серной кислоты с массовой долей 2,5%.
119. В результате взаимодействия раствора хлорида кальция с массовой долей растворённого вещества 12% и раствора карбоната натрия выпал осадок массой 8 г. Вычислите массу исходного раствора хлорида кальция, взятого для реакции.
120. К 376 г раствора с массовой долей нитрата меди (II) 7,5% добавили избыток раствора гидроксида калия. Определите массу выпавшего осадка.
121. Избыток оксида алюминия добавили к 29,4 г раствора с массовой долей серной кислоты 10%. Вычислите массу соли, образовавшейся в результате реакции.
122. В 98 г раствора серной кислоты с массовой долей 4% поместили избыток цинка. Вычислите объём выделившегося газа (н.у.).
123. К 200 г раствора нитрата серебра добавляли раствор хлорида кальция до прекращения выделения осадка. Масса полученного осадка составила 28,7 г. Рассчитайте массовую долю нитрата серебра в исходном растворе.
124. К 150 г раствора серной кислоты добавляли раствор хлорида бария до прекращения выделения осадка. Масса осадка составила 34,95 г. Вычислите массовую долю серной кислоты в исходном растворе.
125. При взаимодействии алюминия с соляной кислотой получили 6,72 л водорода и 178 г раствора соли. Вычислите массовую долю соли в полученном растворе.
При взаимодействии алюминия с соляной кислотой получили 6,72 л водорода и 178 г раствора соли. Вычислите массовую долю соли в полученном растворе.
126. В 36,5 г соляной кислоты поместили порцию карбоната кальция. При этом выделилось 0,448 л газа. Вычислите массовую долю HCl в исходном растворе соляной кислоты.
127. К раствору карбоната калия с массовой долей 6% добавили избыток раствора хлорида бария. В результате реакции образовался осадок массой 9,85 г. Определите массу исходного раствора карбоната калия.
128. После пропускания через раствор гидроксида натрия 2,24 л сернистого газа (н. у.) получили 252 г раствора сульфита натрия. Вычислите массовую долю соли в полученном растворе.
129. После пропускания через раствор гидроксида калия 0,448 л сероводорода (н. у.) получили 110 г раствора сульфида калия. Вычислите массовую долю соли в полученном растворе.
130. После пропускания через раствор гидроксида калия 6,72 л углекислого газа (н. у.) получили 414 г раствора карбоната калия. Вычислите массовую долю соли в полученном растворе.
После пропускания через раствор гидроксида калия 6,72 л углекислого газа (н. у.) получили 414 г раствора карбоната калия. Вычислите массовую долю соли в полученном растворе.
131. Рассчитайте массу гидроксида натрия, необходимую для полной нейтрализации 245 г раствора с массовой долей серной кислоты 20 %. В ответе запишите уравнение реакции, о которой идёт речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
132. При взаимодействии металлического натрия с водой образовалось 100 г раствора гидроксида натрия и 1,12 л водорода. Вычислите массовую долю гидроксида натрия в растворе.
133. К 171 г раствора с массовой долей сульфата алюминия 6 % добавили избыток раствора нитрата бария. Вычислите массу образовавшегося осадка. В ответе запишите уравнение реакции, о которой идёт речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
134. 73 г раствора соляной кислоты смешали с порцией карбоната кальция. При этом выделилось 0,896 л газа. Вычислите массовую долю исходного раствора соляной кислоты. В ответе запишите уравнение реакции, о которой идёт речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
135. К 170 г раствора с массовой долей нитрата серебра 3 % добавили избыток раствора хлорида алюминия. Вычислите массу образовавшегося осадка.
136. К раствору карбоната калия массой 110,4 г и массовой долей 5 % прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
137. Через раствор гидроксида натрия пропустили 4,48 л сернистого газа (н. у.). Образовалось 126 г раствора сульфита натрия. Вычислите массовую долю соли в полученном растворе. В ответе запишите уравнение реакции, о которой идёт речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
138. Вычислите объём углекислого газа (н. у.), который выделится при действии на избыток карбоната кальция 730 г 20 %-ного раствора соляной кислоты. В ответе запишите уравнение реакции, о которой идёт речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задачи на раствор — 9 класс
1. При пропускании 2,24 л оксида углерода(IV) через раствор гидроксида калия получили 138 г раствора карбоната калия. Вычислите массовую долю соли в полученном растворе.
2. Вычислите массу раствора азотной кислоты с массовой долей 7%, необходимого для реакции с 6,42 г гидроксида железа(III).
3. Раствор соляной кислоты массой 29,2 г и массовой долей 5% добавили к избытку сульфита магния. Вычислите объём (н.у.) выделившегося газа.
4.
В
результате реакции оксида натрия с водой было получено 80 г 10%-ного
раствора щёлочи. Определите массу прореагировавшего оксида натрия.
Определите массу прореагировавшего оксида натрия.
5. К раствору серной кислоты с массовой долей 5% добавили избыток раствора нитрата бария. При этом выпал осадок массой 11,65г. Определите массу исходного раствора серной кислоты.
6. К 85 г раствора с массовой долей нитрата серебра 2% добавили избыток раствора хлорида натрия. Определите массу выпавшего осадка.
7. После пропускания 5,6 л аммиака через раствор серной кислоты с массовой долей 10% получили раствор средней соли. Определите массу исходного раствора серной кислоты.
8. К раствору сульфита натрия массой 252 г с массовой долей 5% добавили избыток раствора соляной кислоты. Вычислите объём (н.у.) выделившегося газа.
9. В 73 г соляной кислоты с массовой долей HCl 5% поместили избыток цинка. Вычислите объём выделившегося газа (н.у.).
10.
К раствору карбоната натрия массой 84,8 г и
массовой долей соли 5% прилили избыток раствора нитрата бария.
11. После пропускания 5,6 л сернистого газа через 400 г раствора гидроксида натрия получили раствор средней соли. Вычислите массовую долю гидроксида натрия в растворе.
12. Вычислите объём (н.у.) газа, выделившегося в результате взаимодействия избытка магния со 146 г соляной кислоты с массовой долей HCl 20%.
13. К 200 г раствора сульфата натрия добавляли раствор гидроксида бария до прекращения выделения осадка. Масса осадка составила 13.98 г. Рассчитайте массовую долю сульфата натрия в исходном растворе.
14. К 32,8 г раствора с массовой долей нитрата кальция 15% добавили избыток раствора фосфата калия. Вычислите массу образовавшегося осадка.
15. Вычислите массу алюминия, который может прореагировать с 480 г 10%-ного раствора сульфата меди(II).
16. Вычислите массу осадка, образовавшегося в результате добавления избытка гидроксида калия к 19 г раствора хлорида магния с массовой долей соли 5%
17. Вычислите
объём углекислого газа (н.у.), который выделится при действии на избыток
карбоната кальция 730 г 20%-ного раствора соляной кислоты.
Вычислите
объём углекислого газа (н.у.), который выделится при действии на избыток
карбоната кальция 730 г 20%-ного раствора соляной кислоты.
18. К 134 г раствора с массовой долей хлорида меди (II) 2% добавили избыток раствора нитрата серебра. Определите массу выпавшего осадка.
19. Вычислите массу 5%-ного раствора нитрата серебра, с которым может прореагировать медь массой 3,2 г.
20. Вычислите объём сероводорода (н.у.), который потребуется для полного осаждения ионов меди из 320 г 20%-ного раствора сульфата меди(II).
21. 284 г раствора сульфата натрия с массовой долей растворённого вещества 10% смешали с избытком раствора нитрата бария. Вычислите массу выпавшего осадка.
22. Через раствор гидроксида бария пропустили хлороводород. Образовалось 41,6 г раствора хлорида бария с массовой долей 15%. Вычислите объём прореагировавшего газа.
23.
После пропускания через раствор гидроксида калия
4,48 л сернистого газа (н.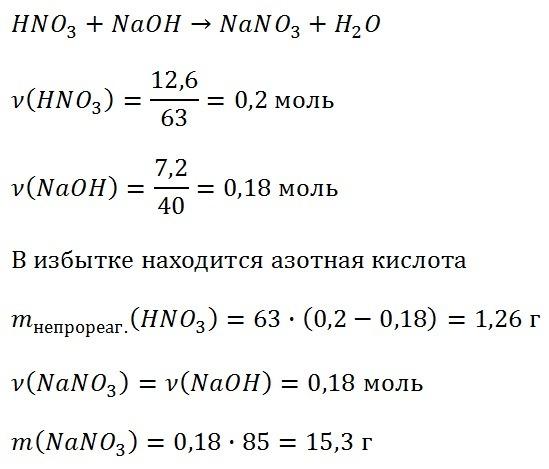 у.) получили 252,8 г раствора сульфита калия.
Вычислите массовую долю соли в полученном растворе.
у.) получили 252,8 г раствора сульфита калия.
Вычислите массовую долю соли в полученном растворе.
24. К раствору карбоната натрия массой 84,8 г и массовой долей соли 5% прилили избыток раствора нитрата бария. Вычислите массу образовавшегося осадка.
25. К 200 г соляной кислоты добавляли небольшими порциями карбонат кальция до прекращения выделения газа. Всего выделилось 4,48 л газа (н.у.). Рассчитайте массовую долю хлороводорода в соляной кислоте.
26. Через 10%-ный раствор серной кислоты пропускали аммиак до полного образования средней соли. Всего израсходовано 11,2 л (н.у.) аммиака. Определите массу исходного раствора серной кислоты.
27. Вычислите массу раствора азотной кислоты с массовой долей 15%, необходимой для полной нейтрализации раствора, содержащего 3,7 г гидроксида кальция.
28.
К 328 г раствора с массовой долей нитрата
кальция 5% добавили избыток раствора карбоната натрия. Определите массу
выпавшего осадка.
29. После пропускания через раствор гидроксида натрия 2,24 л сернистого газа (н.у.) получили 252 г раствора сульфита натрия. Вычислите массовую долю соли в полученном растворе.
30. При взаимодействии 7,1 г оксида фосфора(V) с избытком раствора гидроксида натрия получили 164 г раствора средней соли. Вычислите массовую долю соли в полученном растворе.
31. При пропускании 4,48 л углекислого газа (н.у.) через раствор гидроксида бария с массовой долей 12% образовался карбонат бария. Вычислите массу исходного раствора гидроксида бария.
32. После пропускания 4,4 г углекислого газа через 320 г раствора гидроксида калия получили раствор средней соли. Вычислите массовую долю щёлочи в растворе.
33. Через раствор серной кислоты пропустили 0,224 л аммиака. Образовалось 13,2 г раствора сульфата аммония. Вычислите массовую долю соли в полученном растворе.
34.
К
22,2 г раствора с массовой долей хлорида кальция 4% добавили
избыток раствора карбоната натрия. Определите массу выпавшего осадка.
Определите массу выпавшего осадка.
35. К 171 г раствора с массовой долей сульфата алюминия 6% добавили избыток раствора нитрата бария. Вычислите массу образовавшегося осадка.
36. К раствору карбоната калия массой 110,4 г и массовой долей 5% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
37. Через 126 г раствора с массовой долей азотной кислоты 30% был пропущен аммиак, который полностью прореагировал. Определите объём (н.у.) аммиака, вступившего в реакцию.
38.
Определите объём (н.у.) аммиака, который
полностью прореагировал
с раствором азотной кислоты массой
25,2 г и массовой долей кислоты 20%.
39. В результате взаимодействия растворов нитрата серебра и хлорида калия, взятого в избытке, выпал осадок массой 2,87 г. Вычислите массу исходного раствора нитрата серебра с массовой долей 17%, взятого для реакции.
40.
К 80 г раствора с массовой долей гидроксида
натрия 5% добавили избыток раствора сульфата меди(II).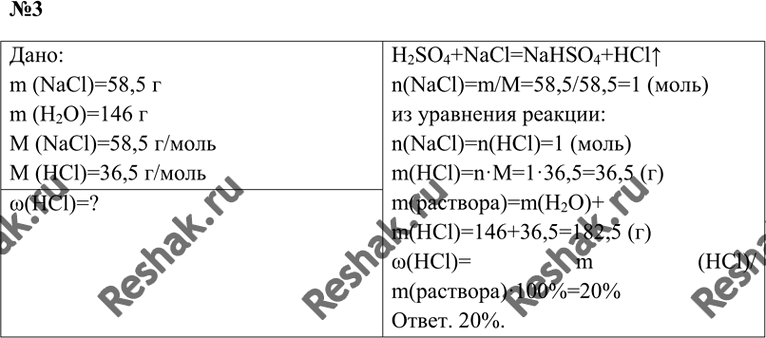 Определите
массу выпавшего осадка.
Определите
массу выпавшего осадка.
41. К избытку магния добавили 365 г раствора соляной кислоты с массовой долей 10%. Определите объём (н.у.) выделившегося газа.
42. Через28 г раствора с массовой долей гидроксида калия 8% пропустили углекислый газ до образования карбоната калия. Вычислите объём (н.у.) вступившего в реакцию газа.
43. 73 г раствора соляной кислоты смешали с порцией карбоната кальция. При этом выделилось 0,896 л газа. Вычислите массовую долю исходного раствора соляной кислоты.
44. При взаимодействии 9,8 г гидроксида меди(II) с соляной кислотой получили 67 г раствора хлорида меди(II). Вычислите массовую долю соли в полученном растворе.
45. Хлороводород объемом 6,72 л (н.у.) поглотили 10%-ным раствором гидроксида натрия. Вещества прореагировали полностью. Рассчитайте массовую долю соли в полученном растворе.
46.
К
150 г раствора гидроксида бария добавляли серную кислоту до прекращения
выпадения осадка. Масса осадка составила 4,66 г. Рассчитайте массовую долю
гидроксида бария в исходном растворе.
Масса осадка составила 4,66 г. Рассчитайте массовую долю
гидроксида бария в исходном растворе.
47. Через раствор нитрата меди (II) массой 75,2 г и массовой долей 5% пропустили избыток сероводорода. Вычислите массу осадка, образовавшегося в результате реакции.
48. Вычислите массу раствора гидроксида натрия с массовой долей 10%, необходимого для полной нейтрализации раствора, содержащего 4,9 г серной кислоты.
49. Вычислите массу 10%-ного раствора соляной кислоты, который потребуется для полного растворения 21,4 г гидроксида железа(III).
50. Через 32 г раствора с массовой долей сульфата меди(II) 5% пропустили избыток газообразного сероводорода до полного выпадения черного осадка. Вычислите объём (н.у.) затраченного на реакцию газа.
51. Вычислите массу осадка, который образуется при действии раствора избытка хлорида меди(II) на 80 г 10%-ного раствора гидроксида натрия.
52.
Через раствор гидроксида кальция пропустили
углекислый газ. Образовалось 324 г раствора гидрокарбоната кальция с массовой
долей 1%. Вычислите объём прореагировавшего газа.
Образовалось 324 г раствора гидрокарбоната кальция с массовой
долей 1%. Вычислите объём прореагировавшего газа.
53. К 200 г раствора с массовой долей сульфата железа(III) 10% добавили избыток раствора нитрата бария. Вычислите массу образовавшегося осадка.
54. К раствору карбоната натрия массой 42,4 г и массовой долей 5% прилили избыток раствора нитрата магния. Вычислите массу образовавшегося осадка.
55. При взаимодействии металлического натрия с водой образовалось 100 г раствора гидроксида натрия и 1,12 л водорода. Вычислите массовую долю гидроксида натрия в растворе
56. К раствору хлорида железа(II) с массовой долей 5% добавили избыток раствора гидроксида натрия. В результате реакции образовался осадок массой 4,5г. Определите массу исходного раствора соли.
57. К 265 г раствора с массовой долей фосфата калия 8% добавили избыток раствора хлорида магния. Определите массу выпавшего осадка.
58. Раствор соляной кислоты массой 14,6 г и с
массовой долей 10% добавили к избытку карбоната кальция. Вычислите объём (н.у.)
выделившегося газа.
Раствор соляной кислоты массой 14,6 г и с
массовой долей 10% добавили к избытку карбоната кальция. Вычислите объём (н.у.)
выделившегося газа.
59. К 424 г раствора с массовой долей фосфата калия 10% добавили избыток раствора хлорида бария. Определите массу выпавшего осадка.
60. К 300 г раствора с массовой долей сульфата меди (II) 8% добавили избыток раствора гидроксида натрия. Определите массу выпавшего осадка.
61. Рассчитайте массу гидроксида натрия, необходимую для полной нейтрализации 245 г раствора с массовой долей серной кислоты 20%.
62. После пропускания через раствор гидроксида калия 1,12 л углекислого газа (н.у.) получили 138 г раствора карбоната калия. Вычислите массовую долю соли в полученном растворе.
63. Оксид меди(II) массой 32 г может прореагировать с 146 г раствора соляной кислоты. Определите массовую долю кислоты в растворе.
64.
К
150 г раствора карбоната натрия добавляли раствор хлорида кальция до
прекращения выделения осадка. Масса осадка составила 12,0 г. Вычислите массовую
долю карбоната натрия в исходном растворе.
Масса осадка составила 12,0 г. Вычислите массовую
долю карбоната натрия в исходном растворе.
65. 170 г раствора нитрата серебра смешали с избытком раствора хлорида натрия. Выпал осадок массой 8,61 г. Вычислите массовую долю соли в растворе нитрата серебра.
66. После пропускания через раствор гидроксида калия 0,448 л сернистого газа (н.у.) получили 79 г раствора сульфита калия. Вычислите массовую долю соли в полученном растворе.
67. Вычислите массу осадка, образовавшегося в результате пропускания углекислого газа через 370 г раствора гидроксида кальция с массовой долей 0,2%.
68. Через 5,0%-ный раствор сульфата меди(II) пропускали сероводород до прекращения выделения чёрного осадка. Масса осадка составила 14,4 г. Чему равна масса раствора сульфата меди(II)?
69.
К
250 г раствора карбоната натрия добавляли раствор хлорида бария до прекращения
выделения осадка. Масса отфильтрованного и высушенного осадка составила 39,4 г. Рассчитайте массовую долю карбоната натрия в исходном растворе.
Рассчитайте массовую долю карбоната натрия в исходном растворе.
70. К 200 г раствора нитрата серебра добавляли раствор хлорида кальция до прекращения выделения осадка. Масса полученного осадка составила 28,7 г. Рассчитайте массовую долю нитрата серебра в исходном растворе.
71. К 150 г раствора серной кислоты добавляли раствор хлорида бария до прекращения выделения осадка. Масса осадка составила 34,95 г. Вычислите массовую долю серной кислоты в исходном растворе.
72. К раствору карбоната калия с массовой долей 6% добавили избыток раствора хлорида бария. В результате реакции образовался осадок массой 9,85г. Определите массу исходного раствора карбоната калия.
73. К 17 г раствора с массовой долей нитрата серебра 2% добавили избыток раствора хлорида магния. Определите массу выпавшего осадка.
74.
Через 171 г раствора гидроксида бария с массовой
долей 5% пропустили углекислый газ до образования карбоната бария. Вычислите
объём (н. у.) вступившего в реакцию газа.
Вычислите
объём (н. у.) вступившего в реакцию газа.
75. К 120 г раствора с массовой долей нитрата бария 10% добавили избыток раствора карбоната натрия. Определите массу выпавшего осадка.
76. Вычислите массу оксида меди(II), который может прореагировать с 73 г 20%-ного раствора соляной кислоты.
77. При пропускании 5,6 л аммиака (н. у.) через раствор серной кислоты с массовой долей 7% образовался сульфат аммония. Вычислите массу исходного раствора серной кислоты.
78. К 284 г раствора сульфата натрия с массовой долей 10% добавили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
79. Алюминий массой 5,4 г может прореагировать с 219 г раствора соляной кислоты. Определите процентную концентрацию кислоты в растворе.
80.
К
раствору с массовой долей гидроксида натрия 5% добавили избыток раствора
сульфата меди (II). При этом образовался осадок массой 4,9г. Определите
массу исходного раствора щелочи.
81. К раствору серной кислоты с массовой долей 5% добавили избыток раствора нитрата бария. При этом выпал осадок массой 11,65г. Определите массу исходного раствора серной кислоты.
82. К 85 г раствора с массовой долей нитрата серебра 2% добавили избыток раствора хлорида натрия. Определите массу выпавшего осадка.
83. После пропускания 5,6 л аммиака через раствор серной кислоты с массовой долей 10% получили раствор средней соли. Определите массу исходного раствора серной кислоты.
84. Через 175 г раствора серной кислоты с массовой долей 14% пропустили аммиак до образования сульфата аммония. Вычислите объём (н. у.) вступившего в реакцию газа.
85. К 56 г раствора с массовой долей гидроксида калия 6% добавили избыток раствора нитрата алюминия. Определите массу выпавшего осадка.
86.
После
пропускания через раствор гидроксида калия 0,896 л сероводорода (н.у.) получили
220 г раствора сульфида калия. Вычислите массовую долю соли в полученном
растворе.
Вычислите массовую долю соли в полученном
растворе.
87. К избытку раствора фосфата калия добавили 102 г раствора с массовой долей нитрата серебра 10%. Вычислите массу образовавшегося осадка.
88. При взаимодействии избытка карбоната магния со 146 г раствора хлороводорода было получено 2,24 л углекислого газа (н.у.). Вычислите массовую долю хлороводорода в исходном растворе.
89. К 252 г раствора сульфита натрия с массовой долей соли 5,0 % добавили избыток соляной кислоты. Вычислите объём (н. у.) выделившегося газа.
90. К 200 г раствора хлорида кальция добавляли раствор карбоната натрия до прекращения выпадения осадка. Масса осадка составила 12,0 г. Рассчитайте массовую долю хлорида кальция в исходном растворе. (Относительную атомную массу хлора примите равной 35,5)
91.
К
избытку карбоната кальция добавили 73 г раствора соляной кислоты с массовой
долей 10%. Вычислите объём (н.у.) выделившегося газа.
92. К 150 г раствора карбоната натрия добавили избыток разбавленной серной кислоты и раствор нагрели до окончания выделения газа. Всего выделилось 3,36 л газа (н.у.). Рассчитайте массовую долю карбоната натрия в исходном растворе.
93. К раствору хлорида алюминия массой 53,2 г и массовой долей 5% прилили избыток раствора нитрата серебра. Вычислите массу образовавшегося осадка.
94. К 104 г раствора с массовой долей хлорида бария 9% добавили избыток раствора фосфата натрия. Вычислите массу образовавшегося осадка.
95. Через раствор гидроксида натрия пропустили 8,96 л (н.у.) сернистого газа. Образовалось 400 г раствора сульфита натрия. Вычислите массовую долю соли в полученном растворе
96. После полного растворения 0,115 г натрия в воде образовался раствор щёлочи, массой 3,2 г. Чему равна массовая доля щёлочи в получившемся растворе?
97.
К
раствору силиката калия массой 20,53 г и массовой долей 15% прилили избыток
раствора нитрата кальция. Вычислите массу образовавшегося осадка.
Вычислите массу образовавшегося осадка.
98. После пропускания через раствор гидроксида натрия 0,896 л сернистого газа (н.у.) получили 63 г раствора сульфита натрия. Вычислите массовую долю соли в полученном растворе.
99. Вычислите массу осадка, образовавшегося в результате добавления избытка гидроксида калия к 19 г раствора хлорида магния с массовой долей соли 5%.
100. К 134 г раствора с массовой долей хлорида меди (II) 2% добавили избыток раствора нитрата серебра. Определите массу выпавшего осадка
101. Вычислите объём углекислого газа (н.у.), который выделится при действии на избыток карбоната кальция 730 г 20%-ного раствора соляной кислоты.
102. Вычислите массу 5%-ного раствора нитрата серебра, с которым может прореагировать медь массой 3,2 г.
103.
После
пропускания через раствор серной кислоты 0,448 л аммиака (н.у.) получили 66 г
раствора сульфата аммония. Вычислите массовую долю соли в полученном растворе.
104. Через 175 г раствора серной кислоты с массовой долей 14% пропустили аммиак до образования сульфата аммония. Вычислите объём (н. у.) вступившего в
105. После полного растворения 2г оксида меди(II) в азотной кислоте масса раствора составила 94 г. Чему равна массовая доля получившейся соли в этом растворе?
106. После пропускания 11,2 л (н. у.) аммиака через 10%-ный раствор серной кислоты получили раствор средней соли. Определите массу исходного раствора серной кислоты.
107. При добавлении к раствору гидроксида калия с массовой долей щёлочи 10% избытка раствора нитрата меди(II) образовался осадок массой 9,8 г. Определите массу исходного раствора щёлочи.
108. Через 40 г раствора с массовой долей гидроксида натрия 6% пропустили углекислый газ до образования карбоната натрия. Вычислите объём (н. у.) вступившего в реакцию газа.
109.
К
раствору карбоната калия массой 27,6 г и массовой долей 10% прилили избыток
раствора нитрата магния. Вычислите массу образовавшегося осадка.
Вычислите массу образовавшегося осадка.
110. Через 925 г известковой воды (раствора гидроксида кальция) с массовой долей растворённого вещества 1% пропустили углекислый газ до образования осадка карбоната кальция. Вычислите объём (н.у.) затраченного на реакцию газа.
111. К раствору карбоната калия массой 27,6 г и массовой долей 20% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
112. Через раствор гидроксида натрия пропустили 4,48 л сернистого газа. Образовалось 126 г раствора сульфита натрия. Вычислите массовую долю соли в полученном растворе.
113. К раствору сульфата алюминия массой 34,2 г и массовой долей 10% прилили избыток раствора нитрата бария. Вычислите массу образовавшегося осадка.
114. Через40 г раствора с массовой долей гидроксида натрия 8% пропустили сернистый газ. При этом образовался сульфит натрия. Вычислите объём (н.у.) вступившего в реакцию газа.
115. К
34,2 г раствора гидроксида бария с массовой долей щёлочи 5% прилили избыток
раствора карбоната калия. Вычислите массу выпавшего осадка. (1,97г)
К
34,2 г раствора гидроксида бария с массовой долей щёлочи 5% прилили избыток
раствора карбоната калия. Вычислите массу выпавшего осадка. (1,97г)
116. После полного растворения 2г оксида меди(II) в азотной кислоте масса раствора составила 94 г. Чему равна массовая доля получившейся соли в этом растворе?
117. После пропускания 11,2 л (н. у.) аммиака через 10%-ный раствор серной кислоты получили раствор средней соли. Определите массу исходного раствора серной кислоты.
118. К 296 г раствора с массовой долей нитрата магния 6% добавили избыток раствора фосфата натрия. Вычислите массу образовавшегося осадка.
119. Вычислите объём аммиака (н.у.), необходимого для полной нейтрализации соляной кислоты массой 146 г и массовой долей HCl 10%.
120.
После
пропускания через раствор гидроксида калия 1,12 л углекислого газа (н.у.)
получили 138 г раствора карбоната калия. Вычислите массовую долю соли в
полученном растворе.
121. Раствор азотной кислоты массой 25,2 г и массовой долей 10% прилили к избытку карбоната магния. Вычислите объём выделившегося газа.
122. Вычислите массу осадка, который образуется при действии раствора хлорида кальция на 424 г 5%-ного раствора карбоната натрия.
123. Через 80 г раствора гидроксида натрия с массовой долей растворённого вещества 10% пропустили углекислый газ до образования карбоната натрия. Вычислите объём (н.у.), затраченного на реакцию газа.
124. К избытку раствора сульфата меди(II) добавили 10 г раствора с массовой долей гидроксида натрия 20%. Вычислите массу образовавшегося осадка.
125. К 848 г раствора с массовой долей фосфата калия 5% добавили избыток раствора хлорида кальция. Определите массу выпавшего осадка.
126. К 57,1 г раствора сульфата железа(III) с массовой долей 7,0% добавили избыток раствора хлорида бария. Определите массу выпавшего осадка
127. К 27
г раствора с массовой долей хлорида меди (II) 10%
добавили избыток раствора сульфида натрия. Определите массу выпавшего осадка.
К 27
г раствора с массовой долей хлорида меди (II) 10%
добавили избыток раствора сульфида натрия. Определите массу выпавшего осадка.
128. Через раствор нитрата меди(II) массой 37,6 г с массовой долей 5% пропустили избыток сероводорода. Вычислите массу осадка, образовавшегося в результате реакции.
129. К 370 г раствора с массовой долей хлорида кальция 6% добавили избыток раствора карбоната калия. Определите массу выпавшего осадка.
130. К 57 г раствора сульфата железа (III) с массовой долей 7% добавили избыток раствора хлорида бария. Определите массу выпавшего осадка.
Видео с вопросами: Расчет массы на объем из молей на объем
Стенограмма видео
Какова массовая концентрация хлороводорода в 2,0-молярной соляной кислоте. Дайте ответ до ближайшего целого числа.
Молярная масса водорода составляет один грамм на моль, а молярная масса хлора составляет 35,5 грамм на моль. Соляная кислота представляет собой водный раствор хлористого водорода. Нам говорят, что концентрация соляной кислоты составляет 2,0 моля. Это эквивалентно 2,0 молям на литр. Это молярная концентрация, которая представляет собой количество молей растворенного вещества на литр раствора. Растворенное вещество является второстепенным компонентом раствора. Это вещество описывается как растворяющееся. В данном случае растворенным веществом является хлористый водород. Раствор представляет собой смесь, в которой одно или несколько растворенных веществ равномерно распределены в растворителе. Так что в данном случае раствор представляет собой соляную кислоту. А поскольку соляная кислота представляет собой водный раствор хлороводорода, растворителем будет вода.
Нам говорят, что концентрация соляной кислоты составляет 2,0 моля. Это эквивалентно 2,0 молям на литр. Это молярная концентрация, которая представляет собой количество молей растворенного вещества на литр раствора. Растворенное вещество является второстепенным компонентом раствора. Это вещество описывается как растворяющееся. В данном случае растворенным веществом является хлористый водород. Раствор представляет собой смесь, в которой одно или несколько растворенных веществ равномерно распределены в растворителе. Так что в данном случае раствор представляет собой соляную кислоту. А поскольку соляная кислота представляет собой водный раствор хлороводорода, растворителем будет вода.
Уравнение для молярной концентрации может быть выражено как 𝑐 равно 𝑛, деленному на 𝑣, где 𝑛 — количество молей растворенного вещества, 𝑣 — объем раствора в литрах, а 𝑐 — молярная концентрация в молях на литр. Нам дана молярная концентрация в вопросе. Это 2,0 моля на литр. Мы можем выразить это в виде 𝑐 равно 𝑛, деленному на 𝑣, поскольку 𝑐 равно двум молям, деленным на один литр. Но вопрос не в молярной концентрации. Он спрашивает о массовой концентрации.
Но вопрос не в молярной концентрации. Он спрашивает о массовой концентрации.
Массовая концентрация – это масса растворенного вещества на литр раствора. Нам еще нужно рассмотреть растворенный хлористый водород и раствор соляной кислоты, и уравнение почти такое же. Но вместо количества молей растворенного вещества мы используем массу растворенного вещества в граммах. 𝑣 по-прежнему представляет объем раствора в литрах, но 𝑐 теперь представляет массовую концентрацию в граммах на литр. Поскольку уравнения молярной концентрации и массовой концентрации очень похожи, мы можем использовать формат для молярной концентрации, чтобы помочь нам найти массовую концентрацию. Нам просто нужно заменить два моля хлористого водорода массой, эквивалентной двум молям хлористого водорода.
Чтобы помочь нам в этом, мы можем использовать это уравнение, которое говорит нам, что количество молей эквивалентно массе, деленной на молярную массу. Мы хотим найти массу. Итак, нам нужно сделать массу субъектом в этом уравнении. Если мы умножим обе части уравнения на молярную массу, молярная масса в правой части уравнения сократится, и мы получим массу, равную количеству молей, умноженному на молярную массу. Мы уже знаем, что вычисляем массу двух молей хлороводорода. Нам нужно умножить количество молей хлористого водорода на молярную массу хлористого водорода. Мы можем использовать молярные массы в вопросе, чтобы помочь нам сделать это.
Если мы умножим обе части уравнения на молярную массу, молярная масса в правой части уравнения сократится, и мы получим массу, равную количеству молей, умноженному на молярную массу. Мы уже знаем, что вычисляем массу двух молей хлороводорода. Нам нужно умножить количество молей хлористого водорода на молярную массу хлористого водорода. Мы можем использовать молярные массы в вопросе, чтобы помочь нам сделать это.
Хлористый водород имеет формулу HCl, поэтому нам нужно умножить молярную массу водорода, которая составляет один грамм на моль, на число эквивалентов водорода в хлористом водороде, которое равно единице. Затем нам нужно добавить молярную массу хлора, которая составляет 35,5 грамма на моль, и умножить ее на количество эквивалентов хлора в хлороводороде, которое также равно единице. Итак, нам нужно умножить два моля на 36,5 грамма на моль. Это дает массу 73 грамма. Теперь мы можем подставить это значение в уравнение массовой концентрации. Итак, массовая концентрация составляет 73 грамма на один литр. Мы можем переписать это как 73 грамма на литр.
Мы можем переписать это как 73 грамма на литр.
Итак, ответ на вопрос «Какова массовая концентрация хлористого водорода в 2,0-молярной соляной кислоте?» составляет 73 грамма на литр.
мольных долей
мольных долейМольная доля
Вернуться в меню решений
Мольная доля:
моль целевого вещества разделить на общее количество задействованных молей
Молярная доля обозначается строчной греческой буквой хи, χ. Вы часто будете видеть его с нижним индексом: χ растворенное вещество является примером.
Пример #1: 0,100 моль NaCl растворяют в 100,0 г чистого H 2 O. Какова молярная доля NaCl?
Решение:
100,0 г / 18,0 г моль¯ 1 = 5,56 моль H 2 OДобавьте это к 0,100 моль NaCl = 5,56 + 0,100 = 5,66 моль всего
Мольная доля NaCl = 0,100 моль / 5,66 моль = 0,018
Какова молярная доля H 2 О?
5,56 моль / 5,66 моль = 0,982
Кстати, еще один способ вычислить последнее вещество — 1,00 минус (сумма всех остальных молярных долей). В этом случае 1,00 — 0,018 = 0,982. Помните, что сумма всех молярных долей в растворе должна равняться единице.
В этом случае 1,00 — 0,018 = 0,982. Помните, что сумма всех молярных долей в растворе должна равняться единице.
Обратите внимание, что молярная доля не имеет единиц измерения и записывается в виде десятичного числа. Не меняйте его на проценты.
Предупреждение: вы можете увидеть термин «молярные проценты». Это просто молярная доля m, умноженная на 100. Например, в приведенной ниже задаче молярная доля коричной кислоты равна 0,2885. Его молярный процент составит 28,85%.
ChemTeam не рекомендует использовать термин «молярные проценты». Однако делайте то, что хочет от вас учитель.
Пример #2: Раствор готовят путем смешивания 25,0 г воды, H 2 O, и 25,0 г этанола, C 2 H 5 OH. Определить мольные доли каждого вещества.
Решение:
1) Определить количество молей каждого вещества:
H 2 O —> 25,0 г / 18,0 г/моль = 1,34 моль
C 2 H 5 OH —> 25,0 г / 46,07 г/моль = 0,543 моль
2) Определите мольные доли:
H 2 O —> 1,34 моль/(1,34 моль + 0,543 моль) = 0,71
C 2 H 5 OH —> 0,543 моль / (1,34 моль + 0,543 моль) = 0,29
Пример #3: Раствор содержит 10,0 г пентана, 10,0 г гексана и 10,0 г бензола. Какова молярная доля гексана?
Какова молярная доля гексана?
Решение:
1) Необходимо определить моль пентана, гексана и бензола. Для этого нужны молекулярные массы. Вот формулы:
пентан: C 5 H 12
гексан: C 6 H 14
бензол: C 6 H 6
2) Когда у вас есть родинки каждого, сложите их вместе.
3) Затем разделите количество молей гексана на общее количество.
Пример #4: Моляльность водного раствора сахара (C 12 H 22 O 11 ) составляет 1,62 мкм. Рассчитайте молярные доли сахара и воды.
Решение:
1) Моляльность – количество молей растворенного вещества на кг растворителя. Поэтому мы знаем, что наше решение:
1,62 моль C 12 H 22 O 11
1,00 кг = 1000 г воды
2) Рассчитайте количество молей присутствующей воды:
1000 г / 18,0152 г/моль = 55,50868 моль
3) Определите мольную долю сахара:
1,62 моль/(1,62 моль + 55,50868 моль) = 0,028357 = 0,0284 (до трех SF)
4) Рассчитайте мольную долю воды вычитанием:
1 − 0,0284 = 0,9716
Пример № 5: Сколько граммов воды необходимо использовать для растворения 100,0 граммов сахарозы (C 12 H 22 O 11 ) для получения 0,020 мольной доли сахарозы в растворе?
Решение:
1) Определить количество молей сахарозы:
100,0 г / 342,2948 г/моль = 0,292145835 моль
2) Определить количество молей воды, необходимое для приготовления раствора 0,020 мольной доли сахарозы:
0,020 = 0,292 / (0,292 + х)(0,020) (0,292 + х) = 0,292
0,00584 + 0,02х = 0,292
0,02х = 0,28616
х = 14,308 моль H 2 O
Комментарий: вы также можете сделать это:
0,292 до 0,02, как x до 0,98
3) Определить граммы воды:
14,308 моль x 18,015 г/моль = 258,0 г
Пример #6: Удивительно, но вода (в форме льда) слабо растворима в жидком азоте. В -196 °C, (точка кипения жидкого азота) мольная доля воды в насыщенном растворе составляет 1,00 x 10 -5 . Вычислите массу воды, которая может раствориться в 1,00 кг кипящего жидкого азота.
В -196 °C, (точка кипения жидкого азота) мольная доля воды в насыщенном растворе составляет 1,00 x 10 -5 . Вычислите массу воды, которая может раствориться в 1,00 кг кипящего жидкого азота.
Решение:
1) Используйте определение мольной доли, чтобы установить следующее:
χ воды = моль воды / (моль воды + моль азота)1,00 х 10 -5 = х / (х + 71,3944041)
Я собираюсь оставить несколько охранных цифр до конца расчета.
2) Немного алгебры:
(1,00 х 10 -5 ) (х) + 7,139440411 х 10 -4 = х0,99999x = 7,139440411 x 10 -4
x = 7,139511806 x 10 -4 моль H 2 O
3) Рассчитайте граммы воды из молей воды:
7,139511806 x 10 -4 моль x 18,0152 г/моль = 1,2862 x 10 -2 г1,29 x 10 -2 г (до трех SF)
Пример #7: Какова молярная доля коричной кислоты в смеси, состоящей из 50,0% мочевины в коричной кислоте (мочевина = 60,06 г/моль; коричная кислота = 148,16 г/моль)
Решение:
1) Предположим, имеется 100,0 г этой смеси. Поэтому:
Поэтому:
50,0 г – мочевина
50,0 г коричного
2) Перевести граммы в моли:
мочевина: 50,0 г / 60,06 г/моль = 0,8325 моль
коричная кислота: 50,0 г / 148,16 г/моль = 0,3375 моль
3) Определите мольную долю коричной кислоты:
0,3375 моль / 1,1700 моль = 0,2885
Пример #8: Раствор этиленгликоля, HOCH 2 CH 2 OH, в котором мольная доля растворенного вещества составляет 0,120. Какую массу этиленгликоля в граммах следует смешать с 955 г воды?
Решение:
1) Определите мольную долю воды:
1 − 0,120 = 0,880
2) Определить общее количество родинок:
[955 г / 18,015 г/моль] / 0,880 = 60,240 моль
3) Определить количество молей присутствующего растворенного вещества:
60,240 моль — [955 г / 18,015 г/моль] = 7,2286 моль
4) Определите массу растворенного вещества:
(7,2286 моль) (62,0678 г/моль) = 449 г (до трех цифр)
Пример бонуса: Вам предоставляется следующая информация о смеси KCl, NaCl и LiCl:
(а) масса KCl + NaCl 2,370 г
(б) масса NaCl + LiCl 1,290 г
(в) масса осажденного из смеси AgCl 6,435 г
Определите мольную долю LiCl в смеси.

Leave A Comment