Дистанционный репетитор — онлайн-репетиторы России и зарубежья
КАК ПРОХОДЯТ
ОНЛАЙН-ЗАНЯТИЯ?
Ученик и учитель видят и слышат
друг друга, совместно пишут на
виртуальной доске, не выходя из
дома!
КАК ВЫБРАТЬ репетитора
Выбрать репетитора самостоятельно
ИЛИ
Позвонить и Вам поможет специалист
8 (800) 333 58 91
* Звонок является бесплатным на территории РФ
** Время приема звонков с 10 до 22 по МСК
ПОДАТЬ ЗАЯВКУ
Россия +7Украина +380Австралия +61Белоруссия +375Великобритания +44Израиль +972Канада, США +1Китай +86Швейцария +41
Выбранные репетиторы
Заполните форму, и мы быстро и бесплатно подберем Вам дистанционного репетитора по Вашим пожеланиям.
Менеджер свяжется с Вами в течение 15 минут и порекомендует специалиста.
Отправляя форму, Вы принимаете Условия использования и даёте Согласие на обработку персональных данных
Вы также можете воспользоваться
расширенной формой подачи заявки
Как оплачивать и СКОЛЬКО ЭТО СТОИТ
от
800 до 5000 ₽
за 60 мин.
и зависит
ОТ ОПЫТА и
квалификации
репетитора
ОТ ПОСТАВЛЕННЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
(например, подготовка к олимпиадам, ДВИ стоит дороже, чем подготовка к ЕГЭ)
ОТ ПРЕДМЕТА (например, услуги репетиторовиностранных языков дороже)
Оплата непосредственно репетитору, удобным для Вас способом
Почему я выбираю DisTTutor
БЫСТРЫЙ ПОДБОР
РЕПЕТИТОРА И
ИНДИВИДУАЛЬНЫЙ ПОДХОД
ОПТИМАЛЬНОЕ
СООТНОШЕНИЕ ЦЕНЫ И
КАЧЕСТВА
ПРОВЕРЕНЫ ДОКУМЕНТЫ ОБ ОБРАЗОВАНИИ У ВСЕХ РЕПЕТИТОРОВ
НАДЕЖНОСТЬ И ОПЫТ.
DisTTutor на рынке с 2008 года.
ПРОВЕДЕНИЕ БЕСПЛАТНОГО, ПРОБНОГО УРОКА
ЗАМЕНА РЕПЕТИТОРА, ЕСЛИ ЭТО НЕОБХОДИМО
376553 УЧЕНИКОВ ИЗ РАЗНЫХ СТРАН МИРА
И вот, что УЧЕНИКИ ГОВОРЯТ
о наших репетиторах
Чулпан Равилевна Насырова
«
Я очень довольна репетитором по химии. Очень хороший подход к ученику,внятно объясняет. У меня появились сдвиги, стала получать хорошие оценки по химии. Очень хороший преподаватель. Всем , кто хочет изучать химию, советую только её !!!
«
Алина Крякина
Надежда Васильевна Токарева
«
Мы занимались с Надеждой Васильевной по математике 5 класса. Занятия проходили в удобное для обоих сторон время. Если необходимо было дополнительно позаниматься во внеурочное время, Надежда Васильевна всегда шла навстречу. Ей можно было позванить, чтобы просто задать вопрос по непонятной задачке из домашнего задания. Моя дочь существенно подняла свой уровень знаний по математике и начала демонстрировать хорошие оценки.
«
Эльмира Есеноманова
Ольга Александровна Мухаметзянова
«
Подготовку к ЕГЭ по русскому языку мой сын начал с 10 класса. Ольга Александровна грамотный педагог, пунктуальный, ответственный человек. Она всегда старается построить занятие так, чтобы оно прошло максимально плодотворно и интересно. Нас абсолютно все устраивает в работе педагога. Сотрудничество приносит отличные результаты, и мы его продолжаем. Спасибо.
«
Оксана Александровна
Наталья Борисовна Карасева
«
Мы восторге от репетитора. Наталья Борисовна грамотный педагог, она любит свою профессию, любит учеников. Занятия с сыном (2 класс), он находится на домашнем обучении, проходят по скайпу в комфортной обстановке. Репетитор умеет заинтересовать ребенка и выстраивает занятие с учетом его способностей, доступно объясняя предметы русский язык и математику.
«
Елена Васильевна
Клиентам
- Репетиторы по математике
- Репетиторы по русскому языку
- Репетиторы по химии
- Репетиторы по биологии
- Репетиторы английского языка
- Репетиторы немецкого языка
Репетиторам
- Регистрация
- Публичная оферта
- Библиотека
- Бан-лист репетиторов
Партнеры
- ChemSchool
-
PREPY.
 RU
RU
- Class
Внутренняя энергия. 1-й закон термодинамики.
Основные ссылки
CSS adjustments for Marinelli theme
Объединение учителей Санкт-Петербурга
Форма поиска
Поиск
Вы здесь
Главная » Внутренняя энергия. 1-й закон термодинамики.
Внутренняя энергия 1-й закон термодинамики. | |
Сумма кинетических энергий хаотического движения всех частиц тела относительно центра масс тела (молекул, атомов) и потенциальных энергий их взаимодействия друг с другом называется внутренней энергией. | |
Внимание!
| U=U(T,V) |
Для идеального газа: U=U — внутренняя энергия идеального одноатомного газа. Внутренняя энергия — однозначная функция состояния (с точностью до произвольной постоянной) и в замкнутой системе сохраняется. Обратное неверно(!) — одной и той же энергии могут соответствовать разные состояния. | Идеальный газ:
|
Опыты Джоуля доказали эквивалентность работы и количества теплоты, т. |
|
Р.Майер, Д.Джоуль, Г.Гельмгольц — закон сохранения энергии для тепловых процессов — 1-й закон термодинамики. |
|
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
| |
Изменений внутренней энергии не зависит от способа, которым осуществляется этот переход. Т.о. существует два способа изменения внутренней энергии: совершение механической работы и теплопередача (теплообмен). Работа и количество теплоты характеризуют |
|
Если А — работа внешних сил, а А’ — работа газа, то А = — А’ (в соответствии с 3-м законом Ньютона). Тогда: — другая форма записи первого закона термодинамики.Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами. | |
Невозможность создания вечного двигателя 1-го рода. Вечный двигатель первого рода — устройство, которое могло бы совершать неограниченное количество работы без затраты энергии. Тогда Q=0. Следовательно: A’= — ΔU. Т.е. такой двигатель должен совершать работу за счет убыли внутренней энергии. Но ее запасы конечны. После того, как запас энергии будет исчерпан, двигатель остановится. |
|
Теги:
конспект
Внутренняя энергия и тела различной массы и температуры
спросил
Изменено 2 месяца назад
Просмотрено 1к раз
$\begingroup$
Верно ли сказать, что тело с большей массой имеет больше внутренней энергии, чем тело с меньшей массой, или что тело с более высокой температурой имеет больше внутренней энергии, чем тело с более низкой температурой?
- энергия
$\endgroup$
$\begingroup$
Если предположить, что два тела сделаны из одного и того же вещества, а все другие применимые свойства идентичны, тогда да , полная внутренняя энергия тела зависит как от его массы, так и от его температуры — но масса применяется только в таким образом для тел .
Внутренняя энергия может быть определена как:
сумма различных видов энергии, которой обладают атомы или молекулы вещества
(как определено в пятом издании Катнелла и Джонсона по физике)
Обычно это сумма молекулярной кинетической энергии и молекулярной потенциальной энергии (вызванной взаимодействием между частицами).
Внутренняя энергия зависит от температуры , потому что температура исторически определяется как измерение средней кинетической энергии вещества. Квантовая физика меняет то, как выражается термодинамика, но это определение прекрасно работает. Поскольку внутренняя энергия напрямую зависит от кинетической энергии, более высокая средняя молекулярная кинетическая энергия в веществе приводит к более высокой внутренней энергии в этом веществе.
Внутренняя энергия тела зависит от массы по-другому. Масса – это количество всех частиц в теле. Следовательно, если х частиц имеют определенную полную внутреннюю энергию, 2х частиц имеют более высокую общую энергию, но не более высокую внутреннюю энергию на единицу массы. Внутренняя энергия объекта 2x может быть выше, но если прикоснуться к обоим объектам, они оба будут ощущаться одинаково; области (одинаковые на квадратную единицу вашей кожи), к которым вы прикасаетесь, имеют одинаковую внутреннюю энергию. 2x объекту просто потребуется больше времени, чтобы достичь равновесия с вашей рукой.
Следовательно, если х частиц имеют определенную полную внутреннюю энергию, 2х частиц имеют более высокую общую энергию, но не более высокую внутреннюю энергию на единицу массы. Внутренняя энергия объекта 2x может быть выше, но если прикоснуться к обоим объектам, они оба будут ощущаться одинаково; области (одинаковые на квадратную единицу вашей кожи), к которым вы прикасаетесь, имеют одинаковую внутреннюю энергию. 2x объекту просто потребуется больше времени, чтобы достичь равновесия с вашей рукой.
Если это сбивает с толку, просто подумайте о том, что полная внутренняя энергия тела зависит от массы, но только потому, что каждая единица массы имеет определенную дополнительную внутреннюю энергию.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
Внутренняя энергия: определение, формула и изменение
Сегодня суббота, и у вас есть билеты, чтобы пойти на футбольный стадион, чтобы посмотреть матч вашей любимой команды (вы можете заменить футбол на любой вид спорта, не волнуйтесь). Но вы читали много статей на StudySmarter и теперь работаете физиком на полную ставку. Итак, как только вы садитесь со своим напитком и закусками, вы смотрите на своего любимого игрока и представляете его просто как частицу. И когда вы отводите взгляд, все футбольное поле уже не поле, а пространство, заполненное физическими частицами. Конечно, вы хотите получить удовольствие от матча, но сначала у вас возникает вопрос, и вам нужно на него ответить. Обладает ли система реальных частиц полной кинетической энергией, подобно игрокам на поле?
Но вы читали много статей на StudySmarter и теперь работаете физиком на полную ставку. Итак, как только вы садитесь со своим напитком и закусками, вы смотрите на своего любимого игрока и представляете его просто как частицу. И когда вы отводите взгляд, все футбольное поле уже не поле, а пространство, заполненное физическими частицами. Конечно, вы хотите получить удовольствие от матча, но сначала у вас возникает вопрос, и вам нужно на него ответить. Обладает ли система реальных частиц полной кинетической энергией, подобно игрокам на поле?
Помните, что система в физике — это любая часть Вселенной, которую мы хотели бы изучить.
Ответ на этот вопрос — да. Точно так же, как игроки на футбольном поле, частицы в системе движутся. Частицы внутри этой системы обладают определенной кинетической энергией из-за температуры системы: частицы обычно движутся быстрее, когда температура системы выше. Кроме того, частицы могут иметь и потенциальную энергию, например, за счет взаимного притяжения между частицами (например, если они являются электрическими диполями).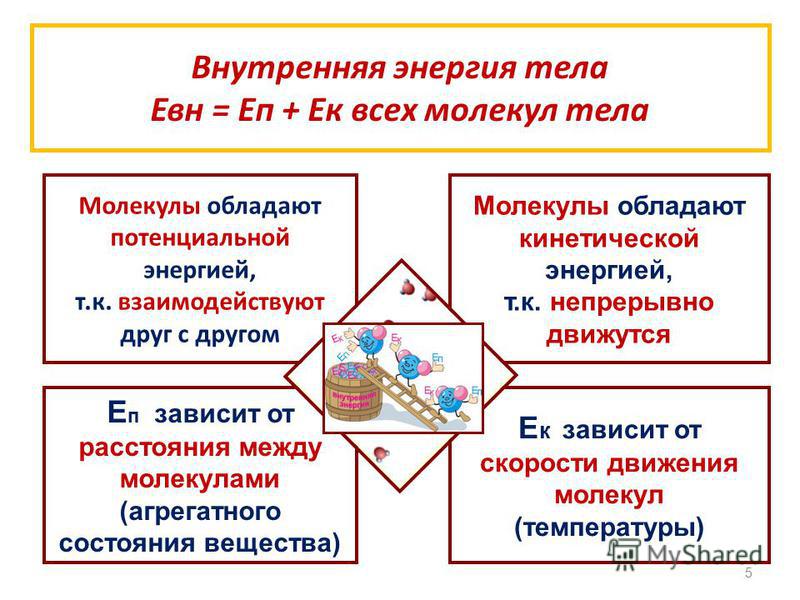
Определение внутренней энергии
Внутренняя энергия системы — это энергия, содержащаяся внутри. Это сумма всех микроскопических кинетических и потенциальных энергий частиц в системе, если бы система находилась в состоянии покоя, а не в макроскопическом энергетическом потенциале.
Важно понимать, что эта внутренняя энергия не имеет прямого отношения к внешней энергии системы. Это означает, что если система движется и обладает кинетической энергией, то внутренняя энергия системы не включает эту энергию, возникающую в результате общего движения системы. Точно так же, если мы поместим всю систему на высоте 1 км над землей, эта макроскопическая потенциальная энергия не повлияет на внутреннюю энергию системы. Система может быть совершенно неподвижной и не иметь кажущейся энергии, пока ее внутренняя энергия изменяется, но, с другой стороны, система может двигаться, в то время как ее внутренняя энергия постоянна.
Если мы нагреем воду, макроскопическая энергия системы не увеличится, поскольку вода не движется. Однако мы знаем, что что-то происходит, потому что температура воды повышается. По мере повышения температуры воды частицы воды начинают двигаться все быстрее и быстрее, что приводит к увеличению их общей кинетической энергии. Таким образом, внутренняя энергия воды увеличивается по мере нагревания воды. При этом внешняя кинетическая энергия остается равной нулю.
Однако мы знаем, что что-то происходит, потому что температура воды повышается. По мере повышения температуры воды частицы воды начинают двигаться все быстрее и быстрее, что приводит к увеличению их общей кинетической энергии. Таким образом, внутренняя энергия воды увеличивается по мере нагревания воды. При этом внешняя кинетическая энергия остается равной нулю.
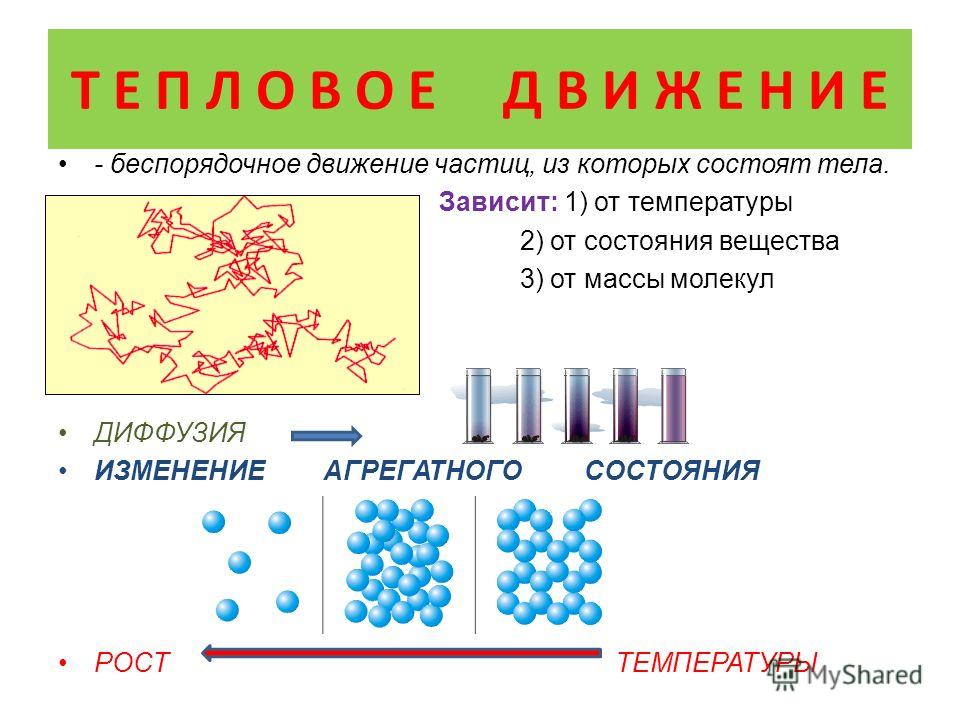
Обычно изменение внутренней энергии системы вызывает либо изменение температуры, либо изменение состояния.
Внутренняя энергия — экстенсивное свойство: свойство системы, которое зависит от того, как система оценивает свой размер или массу. Его значение можно описать как сумму значений более мелких подразделений системы.
Для реальных систем нас обычно интересует (и, следовательно, вычисляется) изменение внутренней энергии во время процесса, такого как повышение температуры.
Внутренняя энергия в термодинамике
В физике энергия передается в результате изменения температуры, приложения сил и т. д. Разделом, изучающим это, является термодинамика .
д. Разделом, изучающим это, является термодинамика .
Термодинамика — это раздел физики, изучающий взаимосвязь между теплотой, работой и другими видами передачи энергии.
Теперь представьте себе любую систему (и на этот раз это не обязательно должен быть футбольный стадион). Помните, что система в термодинамике — это любая часть Вселенной, которую мы хотим изучить, то есть это может быть человеческое тело, определенное количество жидкости, растение или что-то еще, что вы можете себе представить.
Рис. 1: Термодинамическая система с границей, адаптированная из изображения.
Частицы с микроскопическими энергиями находятся внутри системы, и сумма всех этих микроскопических энергий составляет то, что мы называем внутренней энергией.
Это приводит нас к изучению того, что происходит с внутренней энергией, когда часть энергии передается системе. В нашем случае мы сосредоточимся на том, что происходит, когда температура увеличивается. Для этого в систему , должна быть передана энергия, поэтому либо система должна быть нагрета, либо в системе должна быть совершена работа.
Для этого в систему , должна быть передана энергия, поэтому либо система должна быть нагрета, либо в системе должна быть совершена работа.
Тепло — это энергия, передаваемая в систему или из системы за счет разницы температур с окружающей средой.
Тепло, добавленное к системе или отведенное от нее, не следует путать с температурой системы.
Теплопередача вызывает изменение внутренней энергии системы. Точно так же приложение работы к системе увеличивает внутреннюю энергию системы.
Рис. 2: Теплопередача между двумя системами при разных температурах.
Изменение внутренней энергии системы может изменить либо потенциальную энергию частиц, либо кинетическую энергию частиц. Если потенциальная энергия изменяется, мы говорим об изменении состояния. Если кинетическая энергия изменяется, мы говорим об изменении температуры.
Температура системы является мерой полной кинетической энергии в системе. Когда тепло поступает в систему и не происходит изменения состояния, внутренняя энергия увеличивается, а, следовательно, увеличивается и общая кинетическая энергия.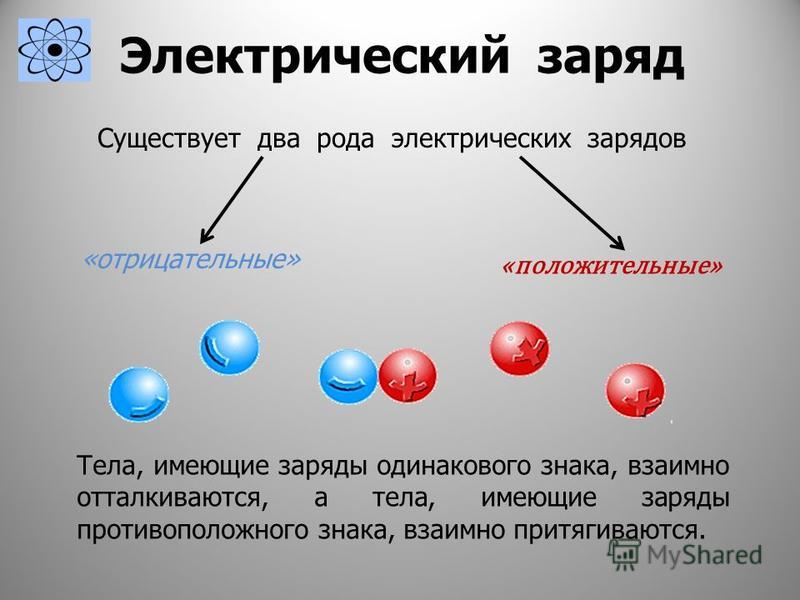 Это означает, что температура повышается.
Это означает, что температура повышается.
Изменения внутренней энергии
Как указывалось ранее, изменение внутренней энергии системы вызывает либо изменение температуры, либо изменение состояния. Мы рассмотрим изменения температуры в следующем разделе, а здесь сосредоточимся на изменениях состояния.
Как вы знаете, мы обычно различаем три состояния вещества: газ, жидкость и твердое тело . Если температура системы повышается или понижается до определенной точки, которая зависит от вещества, с которым мы работаем, может произойти переход из одного состояния в другое. При этом изменении состояния температура остается постоянной, но внутренняя энергия системы все же изменяется.
Во-первых, внутренняя энергия системы может увеличение, в результате приложения тепла или работы. Это три различных изменения состояния, связанные с увеличением внутренней энергии:
- Твердое тело будет плавиться , образуя жидкость.

- Жидкость будет испаряться, превращаясь в газ.
- Если у нас есть твердое тело и оно при увеличении внутренней энергии сразу превращается в газ, то мы говорим о сублимации .
Иначе можно уменьшить внутренняя энергия вещества, когда система начинает отдавать теплоту наружу или совершает работу в окружающей среде:
- Газ будет конденсироваться, получать жидкость.
- Жидкость замерзнет, превратится в твердое тело.
- Если вещество переходит из газообразного состояния в твердое, минуя свое жидкое состояние, говорят о отложении .
Рис. 3: Повышая и понижая температуру мы можем изменить состояние вещества.
Вы можете узнать больше об изменениях состояния здесь, в StudySmarter.
Уравнение изменения внутренней энергии
В большинстве случаев изменение внутренней энергии вызывает изменение температуры. При этом меняется только полная кинетическая энергия частиц, а полная потенциальная энергия остается неизменной.
При этом меняется только полная кинетическая энергия частиц, а полная потенциальная энергия остается неизменной.
Тепловая энергия системы представляет собой сумму всех микроскопических кинетических энергий частиц в системе, если бы система находилась в состоянии покоя.
Короче говоря, тепловую энергию можно рассматривать как кинетическую часть внутренней энергии. Когда во время процесса не происходит изменения состояния, изменение внутренней энергии совпадает с изменением тепловой энергии системы.
Уравнение, связывающее изменение тепловой энергии и изменение температуры системы, имеет вид
\[\text{изменение тепловой энергии}=\text{масса}\cdot \text{удельная теплоемкость}\cdot \ текст{изменение температуры}\].
В символах это уравнение принимает вид
\[\Delta E=mc\Delta \theta\],
где
- \(\Delta E\) — изменение тепловой энергии системы. Стандартной единицей измерения является джоуля \(\mathrm{J}\).

- \(m\) — масса системы. Стандартной единицей является килограмма (\(\mathrm{kg}\)}.
- \(c\) называется удельной теплоемкостью . Определяется как количество энергии, необходимое для увеличения температура единицы массы определенного вещества на одну единицу температуры.Каждое вещество имеет свою постоянную удельную теплоемкость: это характеристика, такая же как плотность и цвет.Стандартная единица j oule/(килограмм x кельвин) , (\(\mathrm{J}/(\mathrm{kg \cdot K})\)). Это всегда положительно.
- \(\Delta \theta\) — изменение температуры системы. Если конечная температура меньше начальной температуры, значение будет отрицательным. Стандартной единицей является кельвина , (\(K\))
Как видите, если масса вещества не меняется в процессе (поэтому имеет постоянное значение), температура системы будет увеличится, если мы увеличим его тепловую энергию. При определенном энерговкладе изменение температуры зависит от массы системы и удельной теплоемкости материала, из которого состоит система. Для двух систем с двумя разными веществами с одинаковой массой, одинаково изменяющими тепловую энергию обеих систем, изменение температуры будет различным. Это связано с тем, что два вещества будут иметь разные значения удельной теплоемкости.
Для двух систем с двумя разными веществами с одинаковой массой, одинаково изменяющими тепловую энергию обеих систем, изменение температуры будет различным. Это связано с тем, что два вещества будут иметь разные значения удельной теплоемкости.
Внутренняя энергия системы также может быть изменена с помощью работы .
В термодинамике обычно говорят о расширении и сжатии. Когда объем системы увеличивается, мы говорим о расширении, а когда он уменьшается, мы говорим о сжатии.
Рис. 4: Примеры а) расширения и б) сжатия системы.
Выполнение работы в системе приведет к сжатию системы. Какая работа необходима для сжатия системы на определенный объем, определяется давлением в системе по следующей формуле: 93\)).
Если мы работаем над системой, то из формулы видим, что разница в объеме отрицательна, значит, у нас действительно есть сжатие. Точно так же, если система работает в своей среде, она будет расширяться.
Примеры внутренней энергии
Теперь, когда мы поняли, что такое тепловая энергия и внутренняя энергия, давайте проведем некоторые расчеты, связывающие изменения тепловой энергии с изменениями температуры. {\circ}\)C. Какова удельная теплоемкость этого материала? Какой материал у нас есть?
{\circ}\)C. Какова удельная теплоемкость этого материала? Какой материал у нас есть?
Решение
Изменения состояния не было, поэтому изменение внутренней энергии равно изменению тепловой энергии. Снова нам нужно использовать уравнение изменения тепловой энергии, но на этот раз нам нужно выделить удельную теплоемкость следующим образом:
\[\Delta E=mc \Delta \theta \ \rightarrow \ c= \dfrac{\Delta E}{m \Delta \theta}\].
Теперь мы можем подставить значения в уравнение:
\[c=\dfrac{2250\,\,\mathrm{J}}{0,5\,\,\mathrm{kg}\cdot 10\ ,\,\mathrm{K}}=450\,\,\mathrm{\frac{J}{kg \cdot K}}\].
Удельная теплоемкость \(c=450\,\, \mathrm{Дж/кг \cdot K}\). Если мы посмотрим на таблицу удельной теплоемкости, то обнаружим, что у железа есть эта удельная теплоемкость, поэтому, скорее всего, у нас есть железо.
Внутренняя энергия — основные выводы
- Термодинамика — это раздел физики, изучающий взаимосвязь между теплотой, работой и другими видами передачи энергии.

- Термодинамическая система является ограниченной частью Вселенной.
- внутренняя энергия системы представляет собой сумму всех микроскопических кинетических и потенциальных энергий частиц в системе.
- Увеличение внутренней энергии системы приведет либо к повышению температуры, либо к изменению состояния.
- Тепловая энергия системы представляет собой сумму всех микроскопических кинетических энергий частиц в системе.
- Увеличение тепловой энергии системы заставит частицы системы двигаться быстрее (по мере увеличения их кинетической энергии), что вызывает повышение температуры.
- Изменение температуры системы в результате изменения тепловой энергии можно рассчитать по следующей формуле: \(\Delta E=mc \Delta \theta\).
- Удельная теплоемкость вещества определяется как количество энергии, которое необходимо для повышения температуры одной единицы массы вещества на одну единицу температуры.


 RU
RU

 е. и та и другая величины являются мерой изменения энергии, их можно измерять в одинаковых единицах: 1 кал = 4,1868 Дж ≈ 4,2 Дж. Эта величина наз. механическим эквивалентом теплоты.
е. и та и другая величины являются мерой изменения энергии, их можно измерять в одинаковых единицах: 1 кал = 4,1868 Дж ≈ 4,2 Дж. Эта величина наз. механическим эквивалентом теплоты.



Leave A Comment