Кристаллические решетки, подготовка к ЕГЭ по химии
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
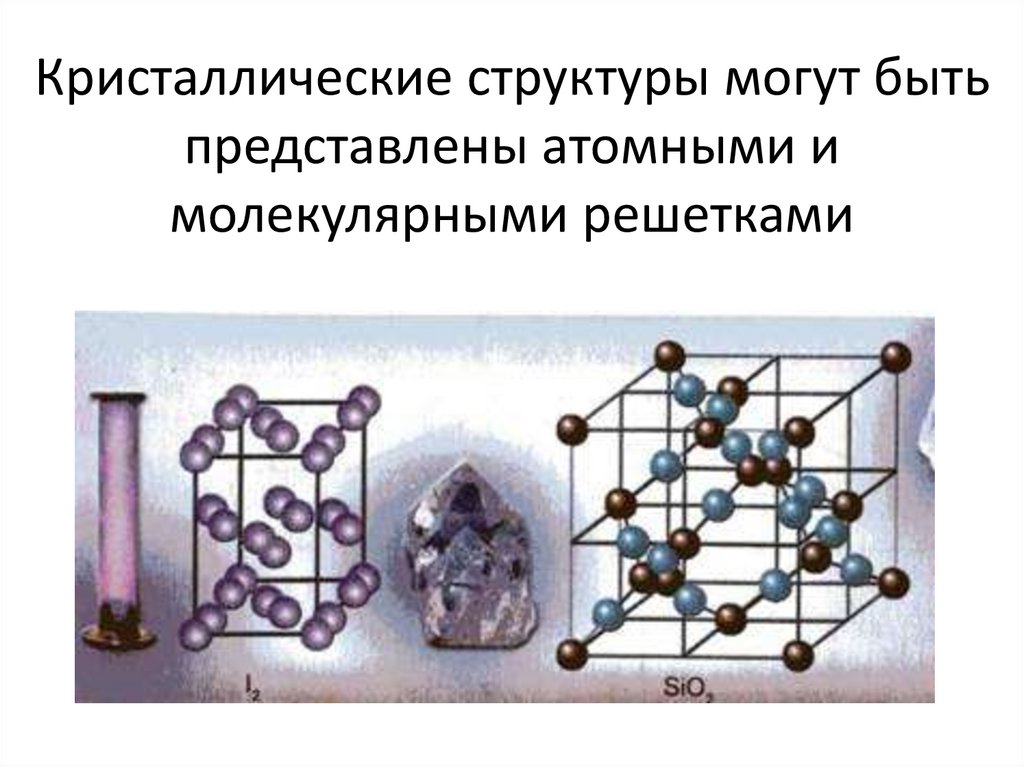
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
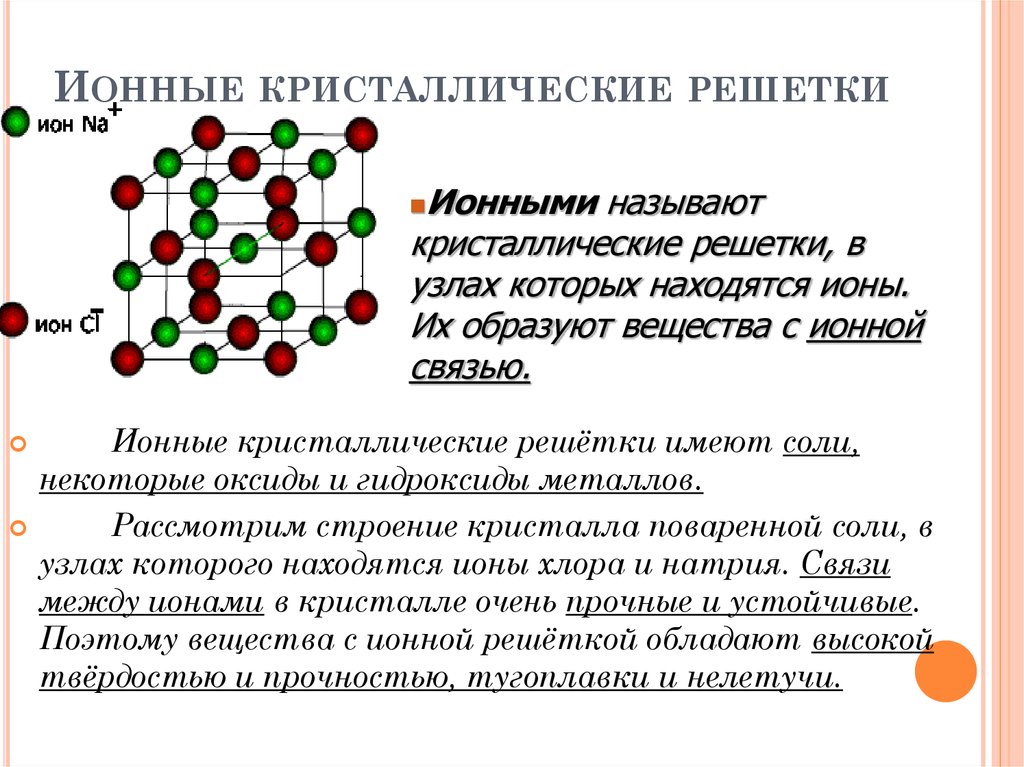
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью — NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко
растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.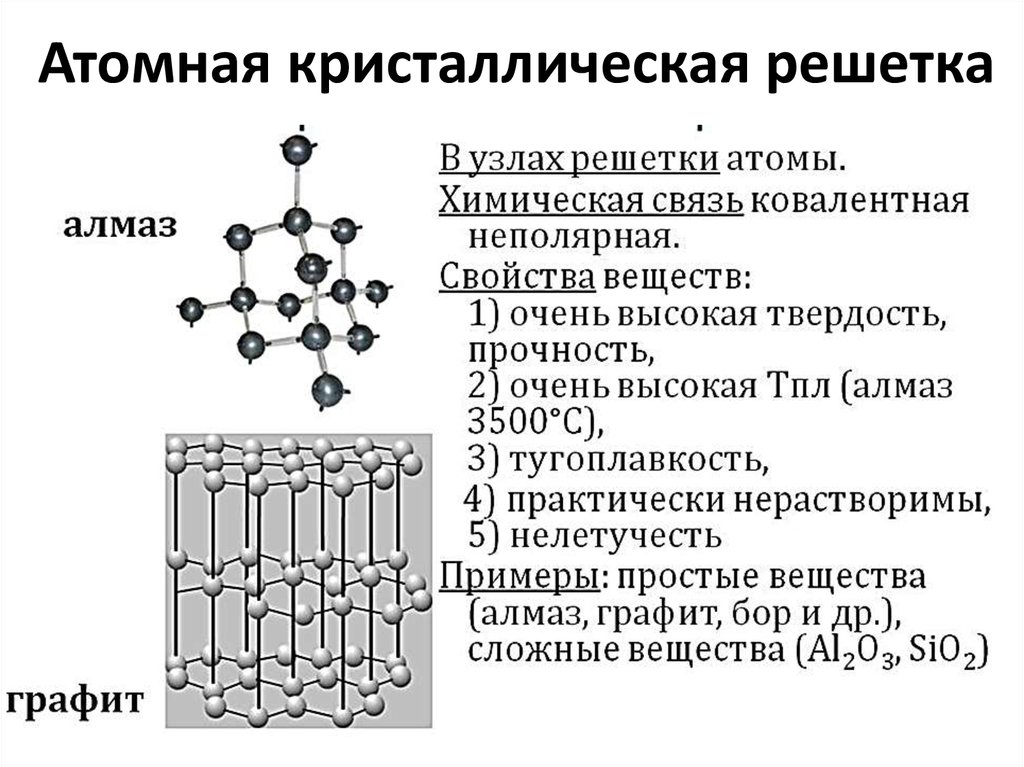
Примеры: NaCl, MgCl2, NH4Br, KNO3, Li2O, Na3PO4.
Металлическая кристаллическая решетка
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.

Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к
просто и понятно об их значении в химии
Содержание:
Определение
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном.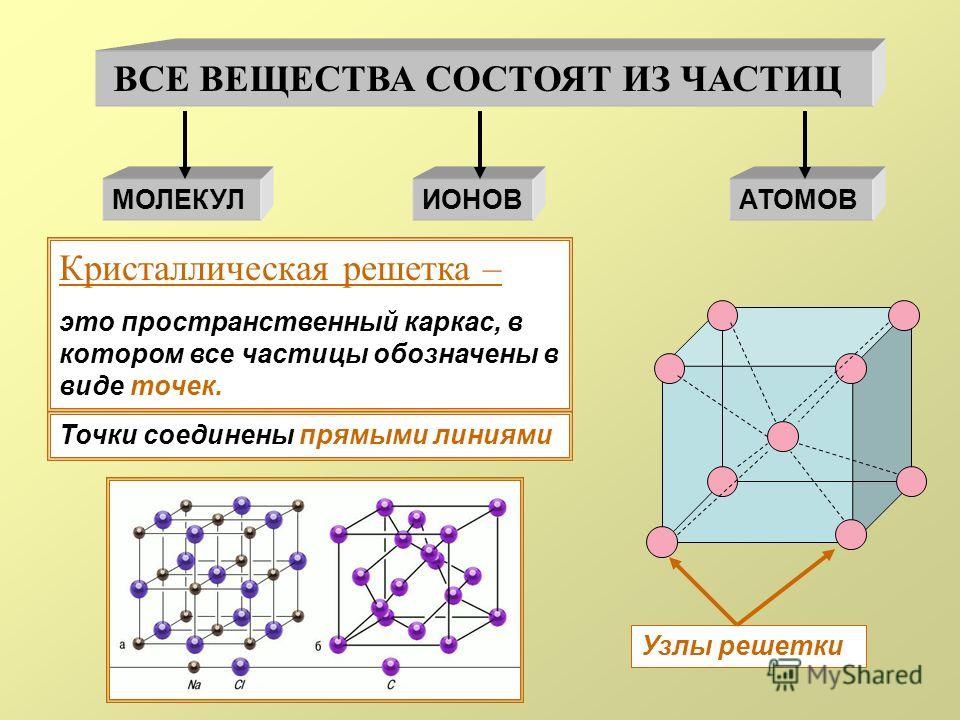
Виды решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- Металлическая кристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
Ионная решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку.
Атомная решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Молекулярная решетка
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул.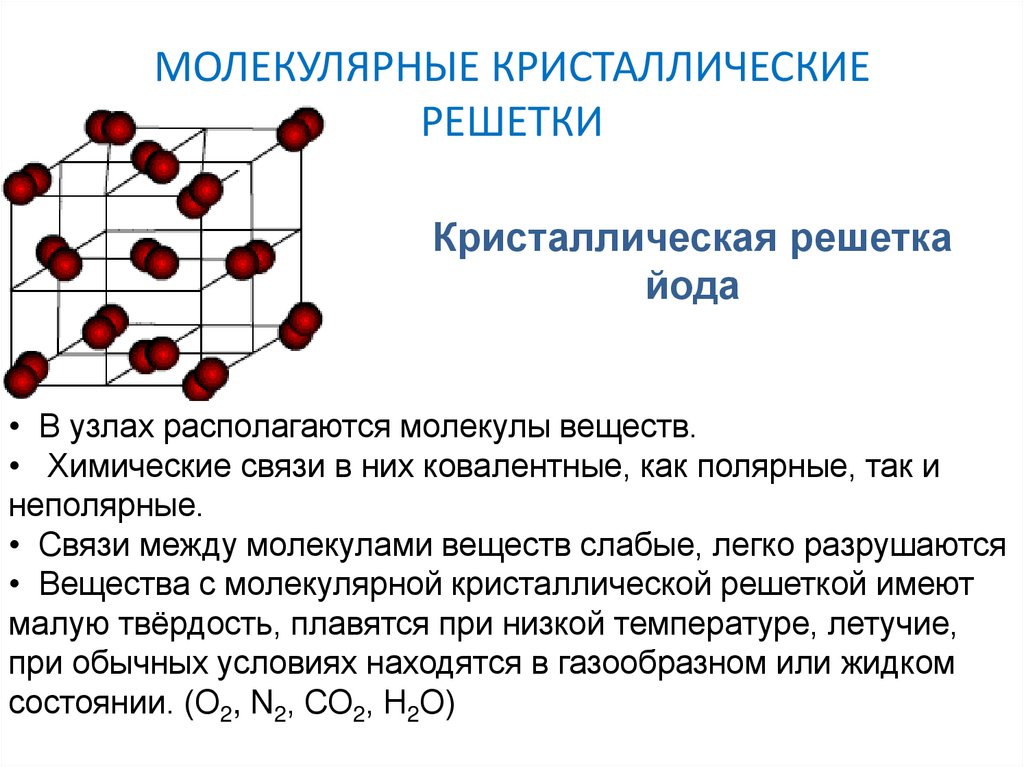 Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Металлическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Страница про автора
Эта статья доступна на английском – Crystal Lattice in Chemistry.
Схожі записи:
12.7: Типы кристаллических твердых тел — молекулярные, ионные и атомарные
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 98084
Цели обучения
- Определение различных типов твердых веществ.

Как общество, мы иногда принимаем вещи как должное. Например, часто предполагается, что мы получим электроэнергию, когда включим вилку в электрическую розетку. Провод, из которого состоит эта розетка, почти всегда медный, материал, который хорошо проводит электричество. Уникальные свойства твердой меди позволяют электронам свободно течь по проводу в любое устройство, к которому мы его подключаем. Тогда мы сможем наслаждаться музыкой, телевидением, работой на компьютере или любым другим занятием, которое захотим. Однако эти действия — и само чудо электричества — были бы невозможны без этого медного провода!
Классы кристаллических твердых тел
Кристаллические вещества можно описать по типам содержащихся в них частиц и по типам химической связи между частицами. Существует четыре типа кристаллов: (1) ионные , (2) металлические , (3) ковалентно-сетчатые и (4) молекулярные . Свойства и несколько примеров каждого типа перечислены в следующей таблице и описаны в таблице ниже.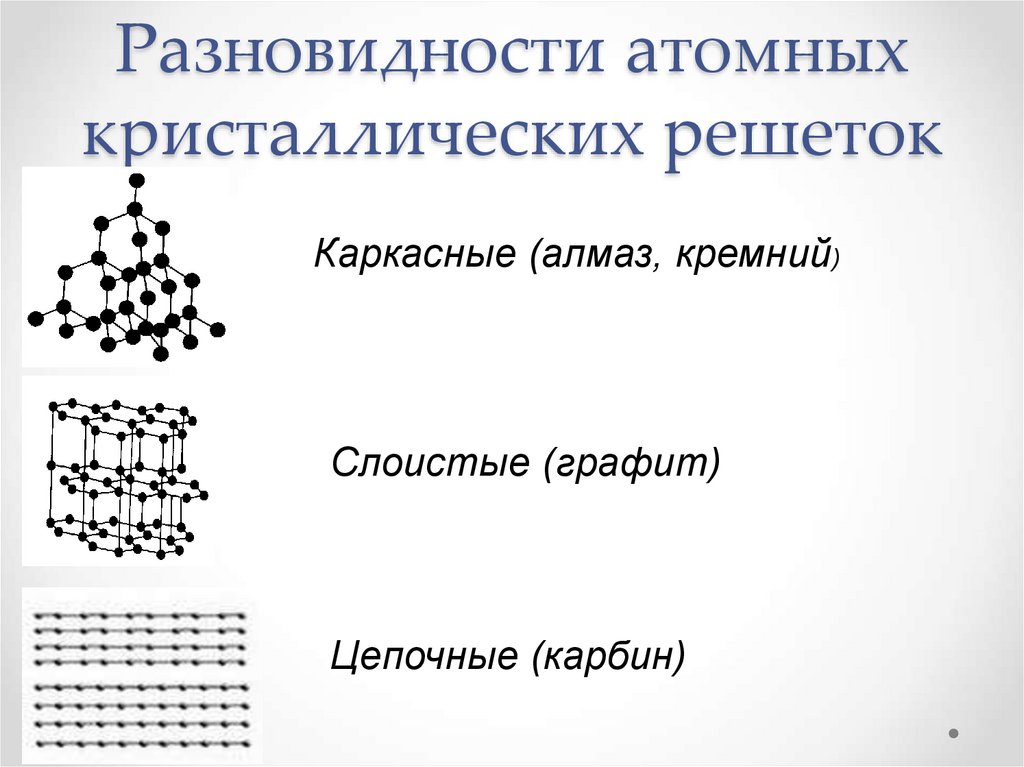
| Тип кристаллического твердого вещества | Примеры (формулы) | Температура плавления (°C) | Нормальная температура кипения (°C) |
|---|---|---|---|
| Ионный | \(\ce{NaCl}\) | 801 | 1413 |
| \(\ce{CaF_2}\) | 1418 | 1533 | |
| Металлик | \(\ce{Hg}\) | -39 | 630 |
| \(\ce{Na}\) | 371 | 883 | |
| \(\ce{Au}\) | 1064 | 2856 | |
| \(\ce{W}\) | 3410 | 5660 | |
| Ковалентная сеть | \(\ce{B}\) | 2076 | 3927 |
| \(\ce{C}\) (алмаз) | 3500 | 3930 | |
| \(\ce{SiO_2}\) | 1600 | 2230 | |
| Молекулярный | \(\ce{H_2}\) | -259 | -253 |
| \(\ce{I_2}\) | 114 | 184 | |
| \(\ce{NH_3}\) | -78 | -33 | |
| \(\ce{H_2O}\) | 0 | 100 |
Ионные кристаллы — Ионная кристаллическая структура состоит из чередующихся положительно заряженных катионов и отрицательно заряженных анионов (см.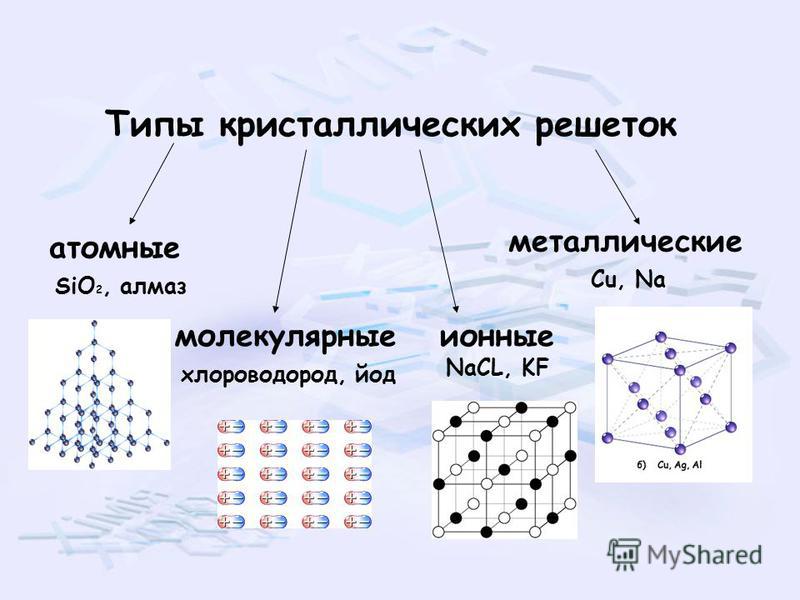 рисунок ниже). Ионы могут быть одноатомными или многоатомными. Как правило, ионные кристаллы образуются из комбинации металлов 1 или 2 группы и неметаллов 16 или 17 группы или неметаллических многоатомных ионов. Ионные кристаллы твердые и хрупкие и имеют высокие температуры плавления. Ионные соединения не проводят электричество в твердом состоянии, но проводят электричество в расплавленном состоянии или в водном растворе.
рисунок ниже). Ионы могут быть одноатомными или многоатомными. Как правило, ионные кристаллы образуются из комбинации металлов 1 или 2 группы и неметаллов 16 или 17 группы или неметаллических многоатомных ионов. Ионные кристаллы твердые и хрупкие и имеют высокие температуры плавления. Ионные соединения не проводят электричество в твердом состоянии, но проводят электричество в расплавленном состоянии или в водном растворе.
Металлический кристалл — Металлические кристаллы состоят из катионов металлов, окруженных «морем» подвижных валентных электронов (см. рисунок ниже). Эти электроны, называемые также делокализованными электронами, не принадлежат какому-то одному атому, а способны перемещаться по всему кристаллу. В результате металлы являются хорошими проводниками электричества. Как видно из приведенной выше таблицы, температуры плавления металлических кристаллов находятся в широком диапазоне.
Рисунок \(\PageIndex{2}\): Металлическая кристаллическая решетка со свободными электронами, способными перемещаться среди положительных атомов металла.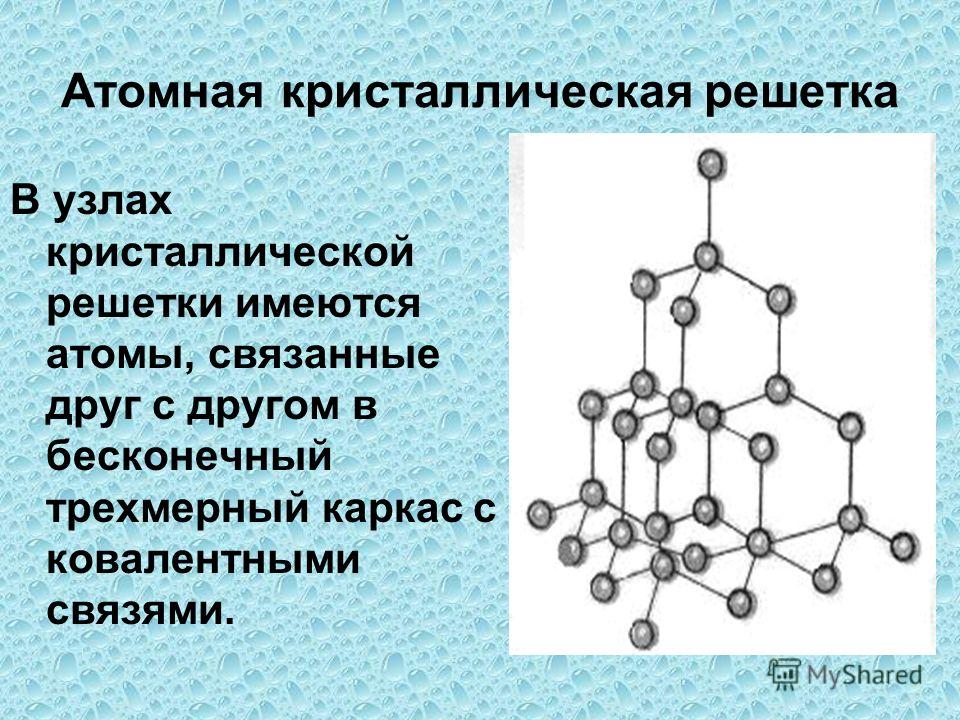
Кристаллы с ковалентной сеткой — Кристалл с ковалентной сеткой состоит из атомов в точках кристаллической решетки, причем каждый атом ковалентно связан со своим ближайшим соседним атомом (см. рисунок ниже). Ковалентно связанная сеть является трехмерной и содержит очень большое количество атомов. Сетчатые твердые вещества включают алмаз, кварц, многие металлоиды и оксиды переходных металлов и металлоиды. Сетчатые твердые вещества твердые и хрупкие, с чрезвычайно высокими температурами плавления и кипения. Состоя из атомов, а не ионов, они не проводят электричество ни в каком состоянии.
Рисунок \(\PageIndex{3}\): Алмаз представляет собой сетчатое твердое тело и состоит из атомов углерода, ковалентно связанных друг с другом в повторяющемся трехмерном узоре. Каждый атом углерода образует одиночные ковалентные связи в тетраэдрической геометрии. Молекулярные кристаллы — Молекулярные кристаллы обычно состоят из молекул в точках кристаллической решетки, удерживаемых вместе относительно слабыми межмолекулярными силами (см.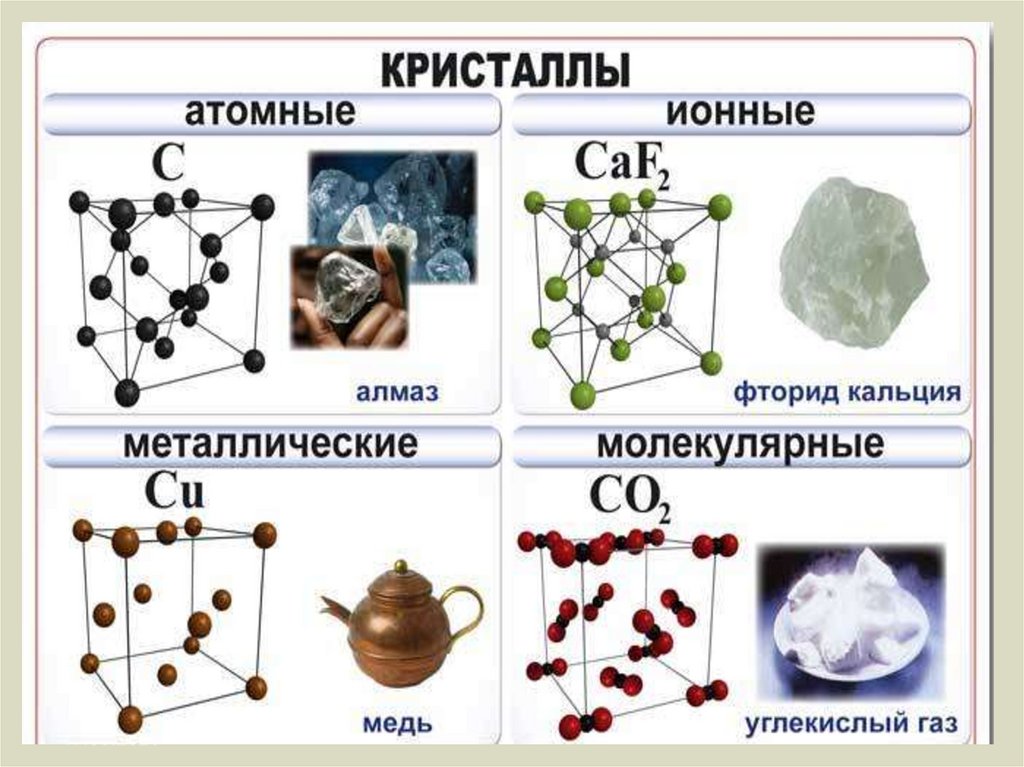 рисунок ниже). Межмолекулярные силы могут быть дисперсионными силами в случае неполярных кристаллов или диполь-дипольными силами в случае полярных кристаллов. В некоторых молекулярных кристаллах, таких как лед, молекулы удерживаются вместе водородными связями. Когда один из инертных газов охлаждается и затвердевает, точками решетки становятся отдельные атомы, а не молекулы. Во всех случаях межмолекулярные силы, удерживающие частицы вместе, намного слабее ионных или ковалентных связей. В результате температуры плавления и кипения молекулярных кристаллов намного ниже. Не имея ионов или свободных электронов, молекулярные кристаллы являются плохими проводниками электричества.
рисунок ниже). Межмолекулярные силы могут быть дисперсионными силами в случае неполярных кристаллов или диполь-дипольными силами в случае полярных кристаллов. В некоторых молекулярных кристаллах, таких как лед, молекулы удерживаются вместе водородными связями. Когда один из инертных газов охлаждается и затвердевает, точками решетки становятся отдельные атомы, а не молекулы. Во всех случаях межмолекулярные силы, удерживающие частицы вместе, намного слабее ионных или ковалентных связей. В результате температуры плавления и кипения молекулярных кристаллов намного ниже. Не имея ионов или свободных электронов, молекулярные кристаллы являются плохими проводниками электричества.
Некоторые общие свойства четырех основных классов твердых тел приведены в таблице \(\PageIndex{2}\).
| Ионные твердые вещества | Молекулярные твердые вещества | Ковалентные твердые вещества | Металлические твердые вещества |
|---|---|---|---|
*Существует множество исключений.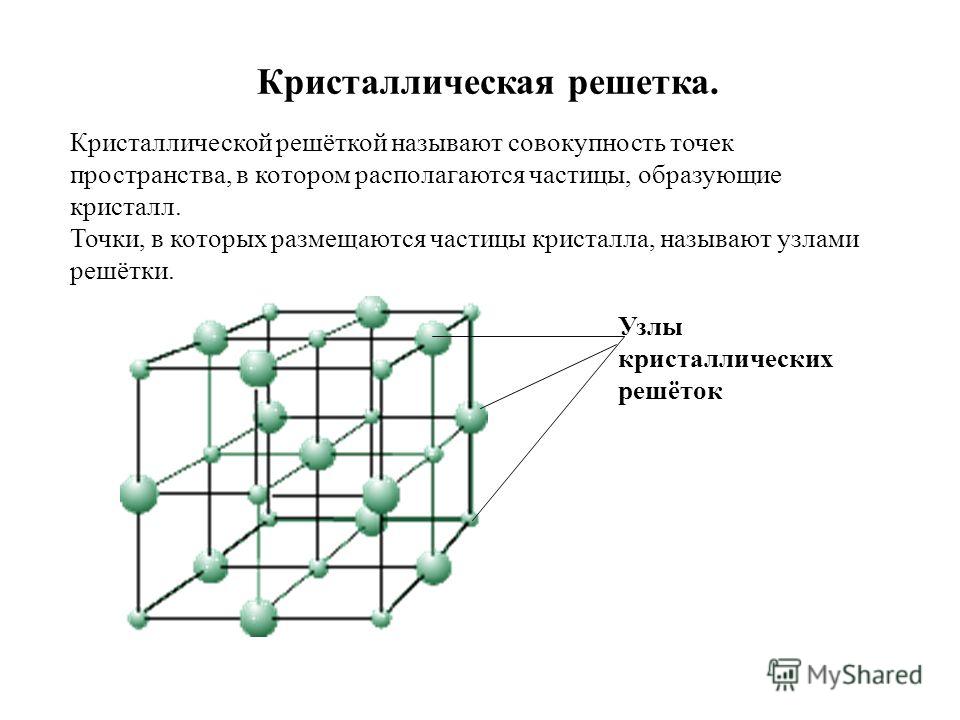 Например, графит имеет относительно высокую электропроводность в углеродных плоскостях, а алмаз обладает самой высокой теплопроводностью среди всех известных веществ. Например, графит имеет относительно высокую электропроводность в углеродных плоскостях, а алмаз обладает самой высокой теплопроводностью среди всех известных веществ. | |||
| плохие проводники тепла и электричества | плохие проводники тепла и электричества | плохие проводники тепла и электричества* | For example, graphite has a relatively high electrical conductivity within the carbon planes, and diamond has the highest thermal conductivity of any known substance.»> хорошие проводники тепла и электричества |
| относительно высокая температура плавления | низкая температура плавления | «> высокая температура плавления | температуры плавления сильно зависят от электронной конфигурации |
| твердый, но хрупкий; разбиться под стрессом | мягкий | «> очень твердый и хрупкий | легко деформируется под нагрузкой; пластичный и ковкий |
| относительно плотный | низкая плотность | «> низкая плотность | обычно высокой плотности |
| матовая поверхность | матовая поверхность | «> матовая поверхность | блестящий |
Пример \(\PageIndex{1}\)
Классифицировать \(\ce{Ge}\), \(\ce{RbI}\), \(\ce{C6(Ch4)6}\) , и \(\ce{Zn}\) как ионные, молекулярные, ковалентные или металлические твердые вещества и расположите их в порядке возрастания температуры плавления.
Дано : соединения
Запрошено : классификация и порядок точек плавления
Стратегия :
- Найдите компонент(ы) в периодической таблице. Основываясь на их положении, предскажите, является ли каждое твердое тело ионным, молекулярным, ковалентным или металлическим.
- Расположите твердые вещества в порядке возрастания температуры плавления в соответствии с вашей классификацией, начиная с молекулярных твердых веществ.

Решение :
A. Германий находится в p-блоке непосредственно под Si вдоль диагональной линии полуметаллических элементов, что предполагает, что элементарный Ge, вероятно, имеет ту же структуру, что и Si (структура алмаза). Таким образом, Ge, вероятно, представляет собой ковалентное твердое тело .
RbI содержит металл из группы 1 и неметалл из группы 17, поэтому это ионное твердое вещество , содержащее ионы Rb + и I — .
Соединение \(\ce{C6(Ch4)6}\) представляет собой углеводород (гексаметилбензол), который состоит из изолированных молекул, которые складываются в молекулярное твердое вещество без ковалентных связей между ними.
Zn представляет собой элемент d-блока, поэтому представляет собой твердое металлическое тело .
B. Расположить эти вещества в порядке возрастания температуры плавления несложно, за одним исключением. Мы ожидаем, что C 6 (CH 3 ) 6 будет иметь самую низкую температуру плавления, а Ge — самую высокую температуру плавления, а RbI где-то посередине. Тем не менее, точки плавления металлов трудно предсказать на основе моделей, представленных до сих пор. Поскольку Zn имеет заполненную валентную оболочку, он не должен иметь особенно высокую температуру плавления, поэтому разумным предположением будет 9.0030
Расположить эти вещества в порядке возрастания температуры плавления несложно, за одним исключением. Мы ожидаем, что C 6 (CH 3 ) 6 будет иметь самую низкую температуру плавления, а Ge — самую высокую температуру плавления, а RbI где-то посередине. Тем не менее, точки плавления металлов трудно предсказать на основе моделей, представленных до сих пор. Поскольку Zn имеет заполненную валентную оболочку, он не должен иметь особенно высокую температуру плавления, поэтому разумным предположением будет 9.0030
\[\ce{C6(Ch4)6 < Zn < RbI < Ge.} \номер\]
Фактические температуры плавления: C 6 (CH 3 ) 6 , 166°C; Zn, 419°С; RbI, 642°С; и Ge, 938°С. Это согласуется с нашим прогнозом.
Упражнение \(\PageIndex{1}\)
Классифицируйте CO 2 , BaBr 2 , GaAs и AgZn как ионные, ковалентные, молекулярные или металлические твердые вещества, а затем расположите их в порядке увеличения температуры плавления.
- Ответ
CO 2 (молекулярный) < AgZn (металлический) ~ BaBr 2 (ионный) < GaAs (ковалентный).
Фактические температуры плавления: CO 2 , около -15,6°C; AgZn, около 700°С; BaBr 2 , 856°С; и GaAs, 1238°C.
Резюме
- Ионные кристаллы состоят из чередующихся положительных и отрицательных ионов.
- Металлические кристаллы состоят из катионов металлов, окруженных «морем» подвижных валентных электронов.
- Ковалентные кристаллы состоят из атомов, ковалентно связанных друг с другом.
- Молекулярные кристаллы удерживаются вместе слабыми межмолекулярными силами.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- На этой странице нет тегов.
Свойства твердых тел
Свойства твердых телСвойства твердых тел
Как вы должны помнить из кинетической молекулярной теории, молекулы в твердых телах движутся не так, как в жидкостях или газах. Твердые молекулы просто вибрируют и вращаются на месте, а не перемещаются. Твердые тела обычно удерживаются вместе за счет ионной или сильной ковалентной связи, а силы притяжения между атомами, ионами или молекулами в твердых телах очень сильны. На самом деле эти силы настолько сильны, что частицы в твердом теле удерживаются в фиксированном положении и имеют очень небольшую свободу движения. Твердые тела имеют определенную форму и определенный объем и ни в какой степени не сжимаемы.
Существуют две основные категории твердых тел — кристаллические и аморфные. Кристаллические твердые тела — это такие тела, в которых атомы, ионы или молекулы, составляющие твердое тело, существуют в правильном, четко определенном порядке. Наименьшая повторяющаяся структура кристаллических тел известна как элементарная ячейка , а элементарные ячейки подобны кирпичам в стене — все они идентичны и повторяются. Другой основной тип твердых тел называется аморфными твердыми телами. Аморфные твердые вещества не имеют особого порядка в своих структурах. Хотя их молекулы расположены близко друг к другу и имеют мало свободы для движения, они не расположены в правильном порядке, как в кристаллических твердых телах. Типичными примерами этого типа твердых тел являются стекло и пластмассы.
Кристаллические твердые тела — это такие тела, в которых атомы, ионы или молекулы, составляющие твердое тело, существуют в правильном, четко определенном порядке. Наименьшая повторяющаяся структура кристаллических тел известна как элементарная ячейка , а элементарные ячейки подобны кирпичам в стене — все они идентичны и повторяются. Другой основной тип твердых тел называется аморфными твердыми телами. Аморфные твердые вещества не имеют особого порядка в своих структурах. Хотя их молекулы расположены близко друг к другу и имеют мало свободы для движения, они не расположены в правильном порядке, как в кристаллических твердых телах. Типичными примерами этого типа твердых тел являются стекло и пластмассы.
Существует четыре типа кристаллических твердых тел:
Ионные твердые вещества — Состоят из положительных и отрицательных ионов и удерживаются вместе за счет электростатического притяжения. Они характеризуются очень высокой температурой плавления и хрупкостью и являются плохими проводниками в твердом состоянии. Примером ионного твердого вещества является поваренная соль NaCl.
Они характеризуются очень высокой температурой плавления и хрупкостью и являются плохими проводниками в твердом состоянии. Примером ионного твердого вещества является поваренная соль NaCl.
Молекулярные твердые вещества — Состоят из атомов или молекул, удерживаемых вместе лондонскими дисперсионными силами, диполь-дипольными силами или водородными связями. Характеризуются низкой температурой плавления и гибкостью и являются плохими проводниками. Примером молекулярного твердого вещества является сахароза.
Твердые тела с ковалентной сеткой (также называемые атомарными) — Состоящие из атомов, соединенных ковалентными связями; межмолекулярные силы также являются ковалентными связями. Характеризуется как очень твердый материал с очень высокой температурой плавления и плохой проводимостью. Примерами этого типа твердых тел являются алмаз и графит, а также фуллерены. Как вы можете видеть ниже, графит имеет только двухмерную гексагональную структуру и поэтому не такой твердый, как алмаз.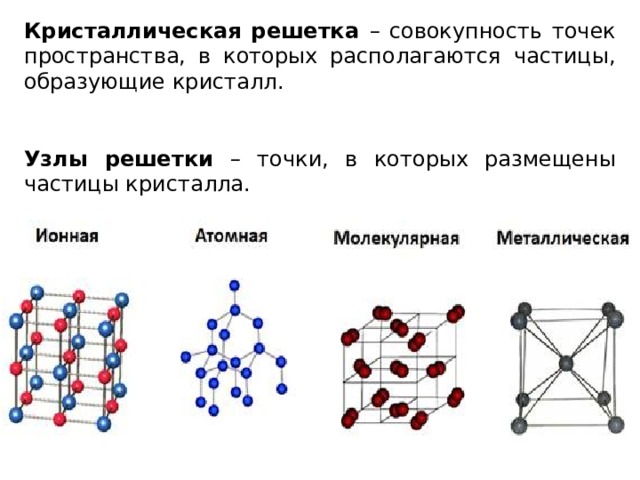 Листы графита удерживаются вместе только слабыми лондонскими силами!
Листы графита удерживаются вместе только слабыми лондонскими силами!
Металлические твердые вещества — Состоят из атомов металлов, удерживаемых вместе металлическими связями. Характеризуется высокой температурой плавления, может варьироваться от мягкого и податливого до очень твердого и является хорошим проводником электричества.
КРИСТАЛЛИЧЕСКИЕ СТРУКТУРЫ С КУБИЧЕСКИМИ ЕДИНИЧНЫМИ ЯЧЕТКАМИ (Из https://eee.uci.edu/programs/gchem/RDGcrystalstruct.pdf)
Кристаллические твердые тела представляют собой трехмерный набор отдельных атомов, ионов или целых молекул, организованных в повторяющиеся узоры. Эти атомы, ионы или молекулы называются точками решетки и обычно изображаются в виде круглых сфер. Двумерные слои твердого тела создаются путем упаковки «сфер» точек решетки в квадратные или замкнутые упакованные массивы. (См. ниже).
Рис. 1. Два возможных расположения идентичных атомов в двумерной структуре
Наложение двухмерных слоев друг на друга создает расположение точек трехмерной решетки, представленное элементарной ячейкой. Элементарная ячейка — это наименьшая совокупность точек решетки, которые могут быть повторены для создания кристаллического твердого тела. Твердое тело можно представить себе как результат объединения множества элементарных ячеек. Элементарная ячейка твердого тела определяется типом слоя (квадратным или плотно упакованным), способом размещения каждого последующего слоя на слое ниже и координационным числом для каждой точки решетки (количеством «сфер», касающихся « сфера» интересов.)
Элементарная ячейка — это наименьшая совокупность точек решетки, которые могут быть повторены для создания кристаллического твердого тела. Твердое тело можно представить себе как результат объединения множества элементарных ячеек. Элементарная ячейка твердого тела определяется типом слоя (квадратным или плотно упакованным), способом размещения каждого последующего слоя на слое ниже и координационным числом для каждой точки решетки (количеством «сфер», касающихся « сфера» интересов.)
Примитивная (простая) кубическая структура
Размещение второго слоя квадратного массива непосредственно над первым слоем квадратного массива формирует «простую кубическую» структуру. Простой «кубический» внешний вид полученной элементарной ячейки (рис. 3а) является основой для названия этой трехмерной структуры. Такая компоновка упаковки часто обозначается как «AA…», буквы обозначают повторяющийся порядок слоев, начиная с нижнего слоя. Координационное число каждой точки решетки равно шести.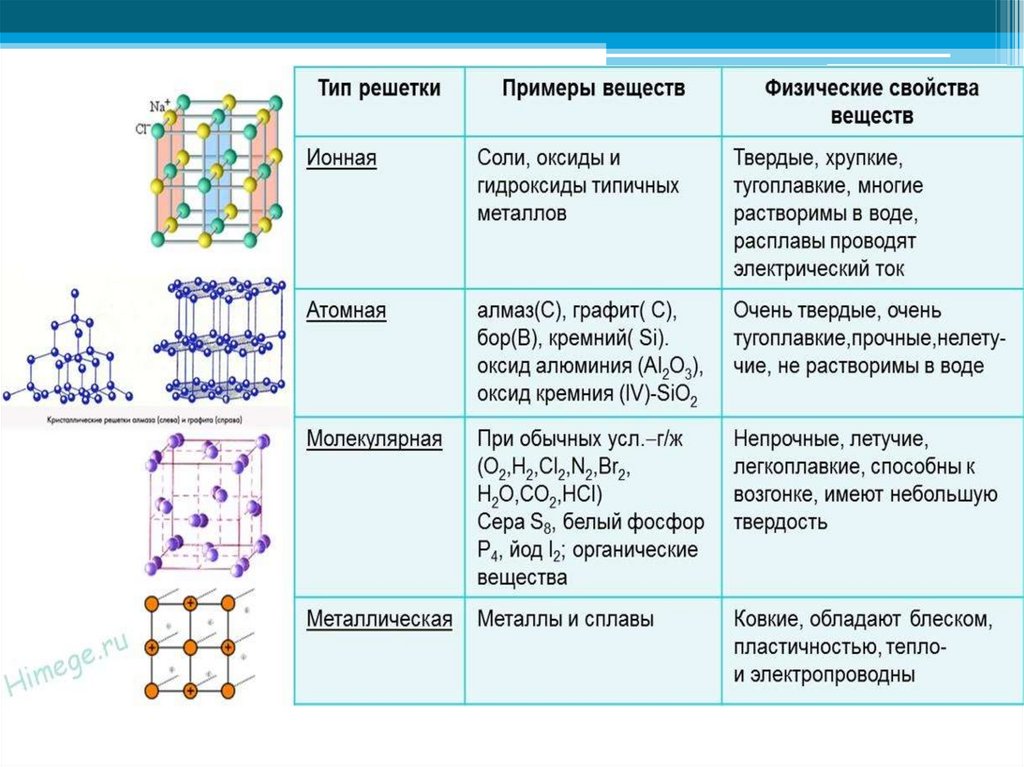 Это становится очевидным при осмотре части соседней элементарной ячейки (рис. 3б). Элементарная ячейка на рисунке 3а содержит восемь угловых сфер, однако общее количество сфер в элементарной ячейке равно 1 (только 1/8 каждой сферы фактически находится внутри элементарной ячейки). Остальные 7/8 каждой угловой сферы находятся в 7 соседних элементарных ячейках.
Это становится очевидным при осмотре части соседней элементарной ячейки (рис. 3б). Элементарная ячейка на рисунке 3а содержит восемь угловых сфер, однако общее количество сфер в элементарной ячейке равно 1 (только 1/8 каждой сферы фактически находится внутри элементарной ячейки). Остальные 7/8 каждой угловой сферы находятся в 7 соседних элементарных ячейках.
Значительное расстояние между сферами на рис. 3b вводит в заблуждение: точки решетки в твердых телах соприкасаются, как показано на рис. 3c. Например, расстояние между центрами двух соседних атомов металла равно сумме их радиусов. Снова вернитесь к рисунку 3b и представьте, что соседние атомы соприкасаются. Ребро элементарной ячейки тогда равно 2r (где r = радиус атома или иона), а значение диагонали грани как функцию r можно найти, применяя теорему Пифагора (a 2 + b 2 = c 2 ) к прямоугольному треугольнику, образованному двумя ребрами и диагональю грани (рис.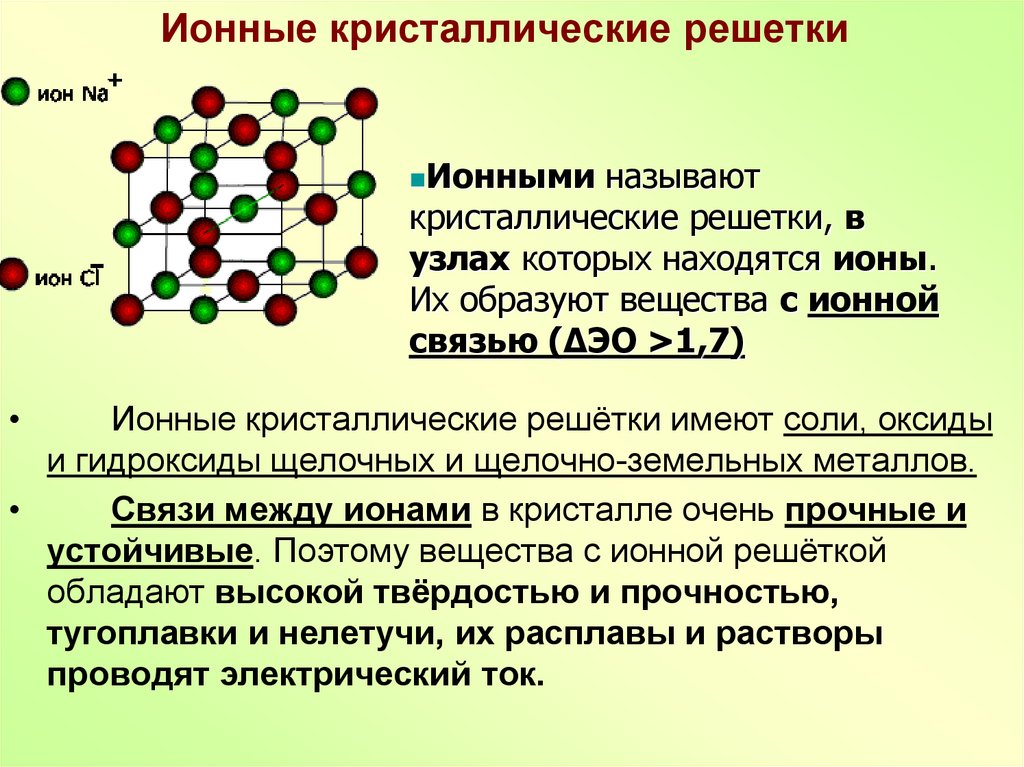 4а). Повторное применение теоремы к другому прямоугольному треугольнику, образованному ребром, диагональю грани и диагональю тела, позволяет определить диагональ тела как функцию r (рис. 4b).
4а). Повторное применение теоремы к другому прямоугольному треугольнику, образованному ребром, диагональю грани и диагональю тела, позволяет определить диагональ тела как функцию r (рис. 4b).
Немногие металлы имеют простую кубическую структуру из-за неэффективного использования пространства. Плотность кристаллического твердого вещества связана с его «процентной эффективностью упаковки». Эффективность упаковки простой кубической структуры составляет всего около 52%. (48% пустое место!)
Объемно-центрированная кубическая структура (ОЦК)
Более эффективно упакованная кубическая структура называется «объемно-центрированная кубическая» (ОЦК). Первый слой квадратного массива слегка расширен во все стороны. Затем второй слой смещается так, что его сферы прижимаются к пространствам первого слоя (рис. 5а, б). Этот повторяющийся порядок слоев часто обозначается как «ABA…».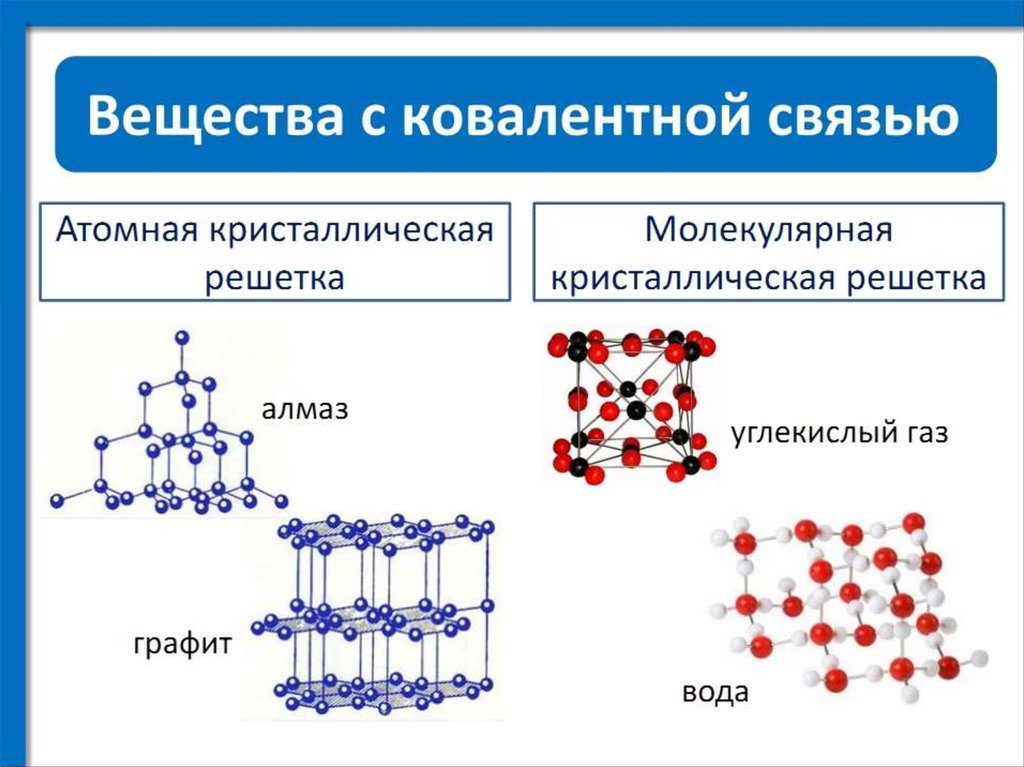 Как и на рис. 3b, значительное расстояние, показанное между сферами на рис. 5b, вводит в заблуждение: сферы плотно упакованы в ОЦК-тела и соприкасаются по диагонали тела. Эффективность упаковки ОЦК структуры составляет около 68%. Координационное число атома в ОЦК структуре равно восьми. Сколько всего атомов содержится в элементарной ячейке ОЦК-структуры? Нарисуйте диагональную линию, соединяющую три атома, отмеченные знаком «х» на рис. 5б. Предполагая, что атомы, отмеченные «x», имеют одинаковый размер, плотно упакованы и соприкасаются, какова величина диагонали этого тела в зависимости от r, радиуса? Найдите ребро и объем клетки в зависимости от r.
Как и на рис. 3b, значительное расстояние, показанное между сферами на рис. 5b, вводит в заблуждение: сферы плотно упакованы в ОЦК-тела и соприкасаются по диагонали тела. Эффективность упаковки ОЦК структуры составляет около 68%. Координационное число атома в ОЦК структуре равно восьми. Сколько всего атомов содержится в элементарной ячейке ОЦК-структуры? Нарисуйте диагональную линию, соединяющую три атома, отмеченные знаком «х» на рис. 5б. Предполагая, что атомы, отмеченные «x», имеют одинаковый размер, плотно упакованы и соприкасаются, какова величина диагонали этого тела в зависимости от r, радиуса? Найдите ребро и объем клетки в зависимости от r.
Кубическая плотнейшая упаковка (ccp)
Кубическая плотнейшая упаковка (ccp) создается путем наложения плотно упакованных массивов. Сферы второго слоя прижимаются к половине пространств первого слоя. Сферы третьего слоя непосредственно перекрывают другую половину пространств первого слоя, прижимаясь к половине пространств второго слоя. Слои повторяются в следующем порядке: «ABC…» (рис. 6 и 7). Координационное число атома в структуре ccp равно двенадцати (шесть ближайших соседей плюс по три атома в слоях выше и ниже), а эффективность упаковки составляет 74%.
Слои повторяются в следующем порядке: «ABC…» (рис. 6 и 7). Координационное число атома в структуре ccp равно двенадцати (шесть ближайших соседей плюс по три атома в слоях выше и ниже), а эффективность упаковки составляет 74%.
Рис. 6. Плотно упакованный массив. 1-й и 3-й слои представлены светом
сферы; 2-й слой, темные сферы. Сферы 2-го слоя приютились в пространствах 1-го
.
слой, отмеченный «х». Сферы 3-го слоя прижимаются к пространствам 2-го слоя, что
.
непосредственно перекрывают пробелы, отмеченные «·» в 1-м слое.
Рис. 7a и 7b: Два вида плотно упакованной кубической структуры
Если кубическую плотноупакованную структуру повернуть на 45°, можно увидеть элементарную ячейку гранецентрированного куба (ГЦК) (рис. 8). Элементарная ячейка ГЦК содержит 8 угловых атомов и атом на каждой грани. Атомы грани являются общими с соседней элементарной ячейкой, поэтому каждая элементарная ячейка содержит ½ атома грани. Атомы гранецентрированной кубической (ГЦК) элементарной ячейки соприкасаются по диагонали грани (рис. 9). Какова функция ребра, диагонали грани, диагонали тела и объема гранецентрированной кубической элементарной ячейки в зависимости от радиуса?
Атомы гранецентрированной кубической (ГЦК) элементарной ячейки соприкасаются по диагонали грани (рис. 9). Какова функция ребра, диагонали грани, диагонали тела и объема гранецентрированной кубической элементарной ячейки в зависимости от радиуса?
Рисунок 8: Гранецентрированная кубическая элементарная ячейка нарисована путем пересечения диагональной плоскости через
.
компоновка упаковки ABCA структуры ccp. Элементарная ячейка имеет 4 атома (1/8 от
каждого углового атома и ½ каждого атома грани).
Рисунок 9а: Модель заполнения пространства ГЦК. Рисунок 9b: Лицо ГЦК. Диагональ лица = 4р.
Ионные твердые вещества
В ионных соединениях более крупные ионы становятся точками решетки «сферами», которые являются каркасом элементарной ячейки. Меньшие ионы располагаются в углублениях («дырках») между большими ионами. Отверстия бывают трех типов: «кубические», «октаэдрические» и «тетраэдрические».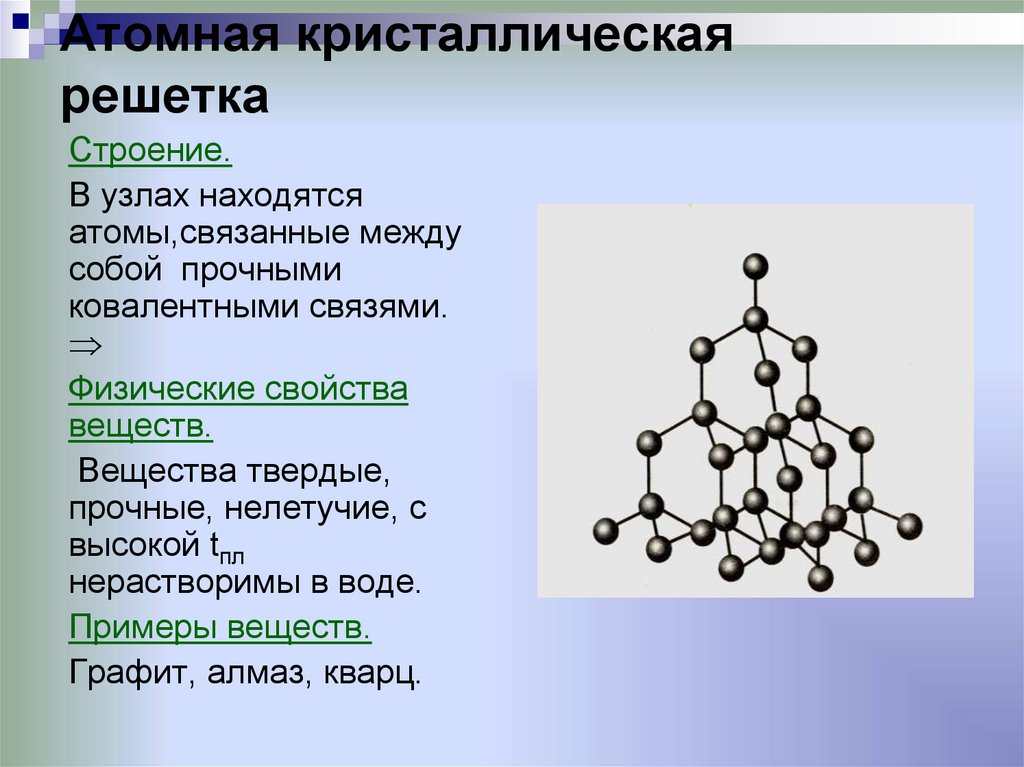 Кубические и восьмигранные отверстия встречаются в структурах с квадратной матрицей; тетраэдрические и октаэдрические отверстия появляются в плотноупакованных матричных структурах (рис. 10). Какой ион обычно больше – катион или анион? Как можно использовать периодическую таблицу для предсказания размера иона? Каково координационное число иона в тетраэдрической дырке? восьмигранное отверстие? кубическая дыра?
Кубические и восьмигранные отверстия встречаются в структурах с квадратной матрицей; тетраэдрические и октаэдрические отверстия появляются в плотноупакованных матричных структурах (рис. 10). Какой ион обычно больше – катион или анион? Как можно использовать периодическую таблицу для предсказания размера иона? Каково координационное число иона в тетраэдрической дырке? восьмигранное отверстие? кубическая дыра?
Рисунок 10. Отверстия в ионных кристаллах больше похожи на «ямки» или «впадины» между
плотноупакованные ионы. Маленькие ионы могут поместиться в эти отверстия и окружены более крупными ионами
противоположного заряда.
Тип дырки, образующейся в ионном твердом теле, во многом зависит от отношения меньшего радиуса иона к большему радиусу иона (r меньше /r больше ). (Таблица 1).
Эмпирическая формула ионного твердого тела
Два способа определения эмпирической формулы ионного твердого тела: 1) по количеству каждого иона, содержащегося в 1 элементарной ячейке 2) по соотношению координационных чисел катионов и анионы в твердом теле.
Пример: Найдите эмпирическую формулу для ионного соединения, показанного на рисунках 11 и 12.
Первый метод: При использовании первого метода помните, что большинство атомов в элементарной ячейке являются общими с другими ячейками. В табл. 2 перечислены типы атомов и доля, содержащаяся в элементарной ячейке. Определено количество каждого иона в элементарной ячейке: 1/8 каждого из 8 угловых ионов X и 1/4 каждого из 12 краевых ионов Y находятся в пределах одной элементарной ячейки. Следовательно, ячейка содержит 1 ион X (8/8 = 1) на каждые 3 иона Y (12/4 = 3), что дает эмпирическую формулу XY3. Какой катион? анион? При написании формулы ионных твердых тел что стоит первым?
Второй метод: Второй метод менее надежен и требует исследования кристаллической структуры для определения количества катионов, окружающих анион, и наоборот. Структура должна быть расширена, чтобы включить больше элементарных ячеек.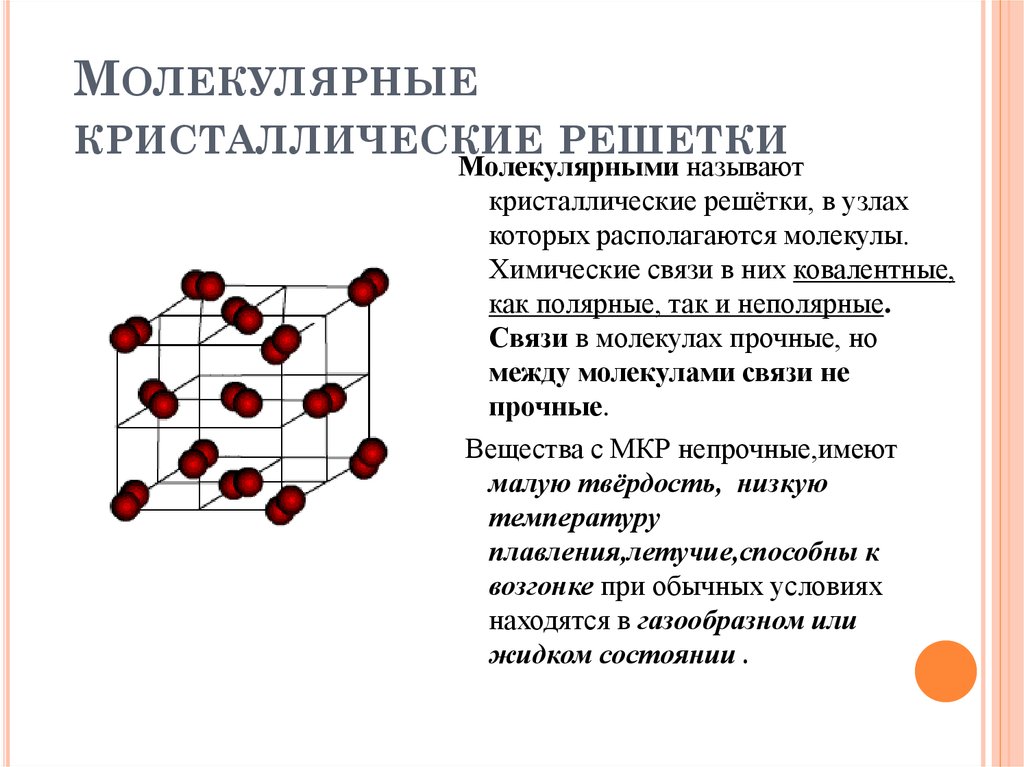


Leave A Comment