Особенности строения электронных оболочек атомов элементов
На этой странице вы узнаете:- Чем общежития электронов отличаются от студенческих?
- В атомах химических элементов есть свои уровни комфортности?
- Химические элементы делятся на семейства? Это что, биология какая-то?
Сейчас в обществе все больше набирает оборот модный тренд — минималистичный образ жизни. Как в фильме «Сто вещей и ничего лишнего». Главные герои — два закадычных друга — решили на спор отказаться от всех своих вещей (абсолютно всех, включая одежду и телефон). Спустя время и преодолев череду проблем, они поняли, что вещи — это не главное в жизни.
Видимо, по такому принципу «живет» хорошо нам знакомый товарищ — водород. У него всего один электрон, который всегда на своем месте. А как быть, например, с атомом хлора, у которого их аж 17, ведь их надо содержать в порядке? Сейчас мы с вами узнаем, как располагаются электроны в электронной оболочке атома и многое другое.
Представим, что электрон — это студент, а электронная оболочка атома — общежитие. Как будет жить наш студент в общежитии?
Разберемся сначала с «планом помещения».
- В нём есть отдельные комнаты, которые называются атомными орбиталями — в них могут проживать максимум 2 электрона.
- Несколько комнат объединяются в блок с общей кухней — их мы назовем энергетическими подуровнями.
- Этажи общежития — энергетические уровни. Определенный этаж содержит определенное количество блоков.
Таким образом, все электроны «живут» на энергетических уровнях-этажах, каждый из которых имеет энергетические подуровни-блоки со своими орбиталями-комнатами.
То, что мы видим с вами на рисунке — электронно-графическая формула для отдельных атомов химических элементов — это расположение всех его электронов на орбиталях.
| Чем общежития электронов отличаются от студенческих? 1. Энергетические уровни (этажи) имеют порядковую нумерацию. Причем на первом уровне располагается всего один подуровень (блок), на втором — два, на третьем — три, на четвертом и последующих — по 4. 2. Подуровни (блоки) обозначают в следующем порядке по мере отдаления от ядра: s (имеет одну орбиталь) → p (три орбитали) → d (пять орбиталей)→ f (семь орбиталей). 3. Орбиталь (комната) специального обозначения не имеет. Может содержать максимум 2 электрона (студента). |
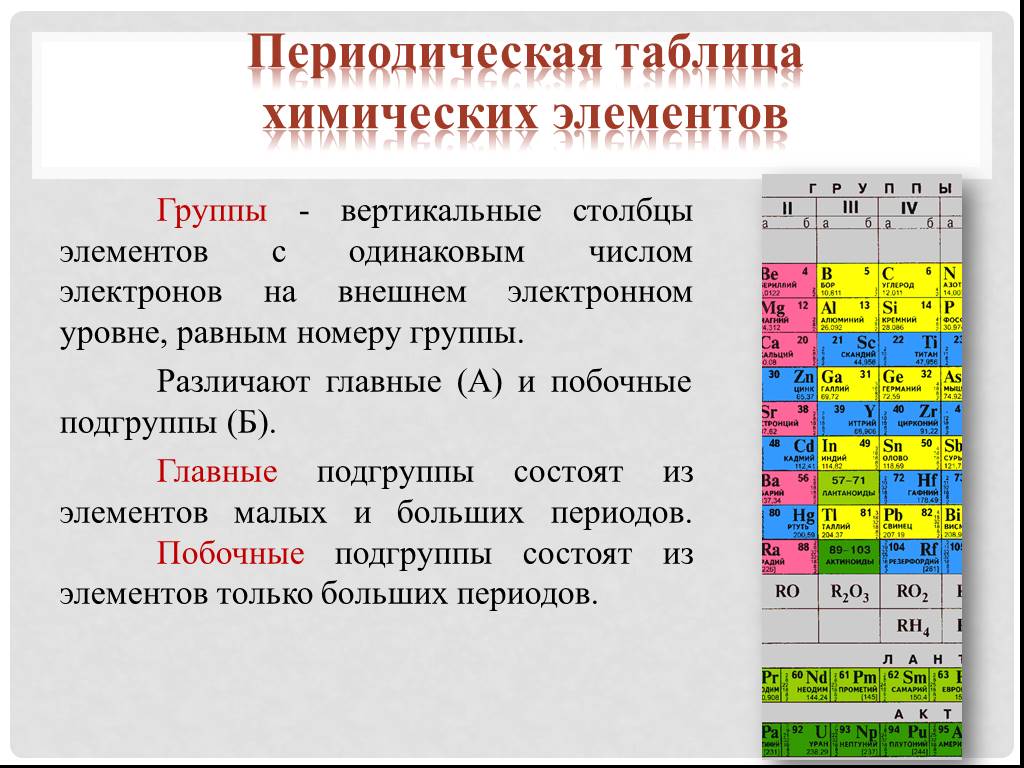
Как нам поможет Периодическая таблица химических элементов Д.И. Менделеева при заполнении схемы строения электронных оболочек атомов?
- Число электронов в атоме химического элемента равно его порядковому номеру в Периодической системе Д.
 И. Менделеева.
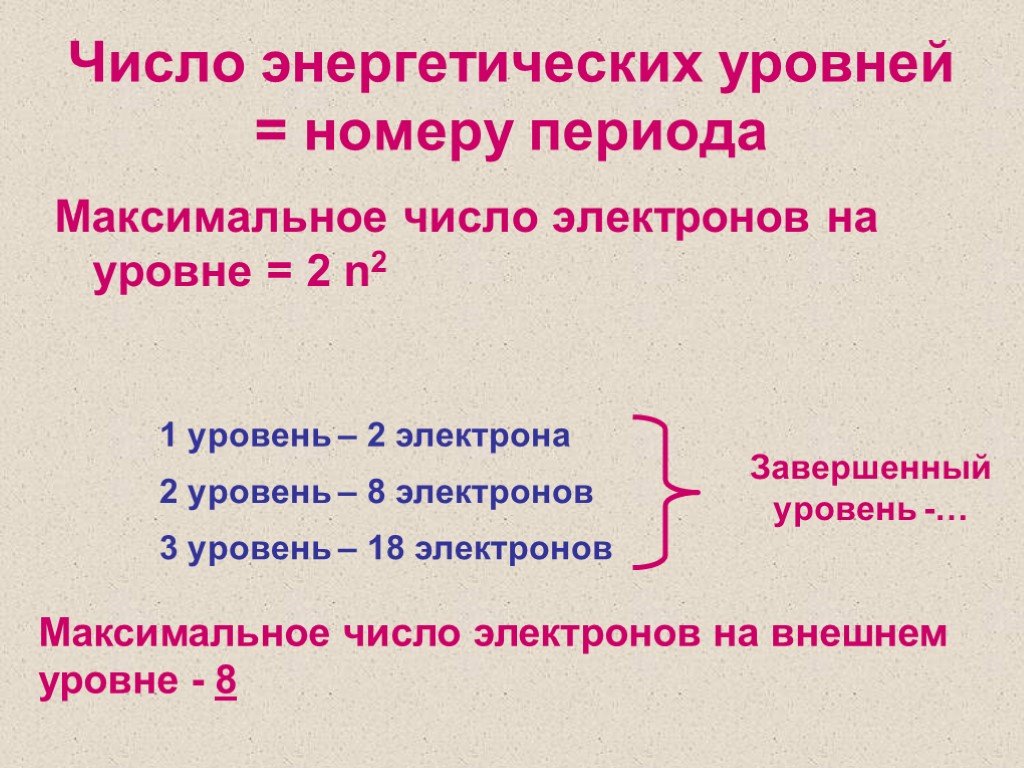
И. Менделеева. - Количество уровней совпадает с номером периода, в котором располагается элемент: 1, 2, 3…
- Количество электронов на внешнем энергетическом уровне для элементов главных (A) подгрупп можно также легко узнать — в какой группе по номеру расположен химический элемент, столько электронов и будет находиться на его внешнем уровне.
- Для элементов побочных подгрупп количество электронов на внешнем энергетическом уровне равно двум. Исключениями являются медь, серебро, хром, золото и некоторые другие элементы.
- Количество валентных электронов для элементов главных (A) подгрупп равно номеру группы, для элементов побочных подгрупп — числу электронов на внешнем энергетическом уровне и незаполненном предвнешнем подуровне.
Это можно использовать для проверки своих действий при распределении электронов по уровням.
Уже сейчас, используя полученную информацию, мы можем решить задание №2 ОГЭ по химии.
На приведенном рисунке изображена модель атома химического элемента.
Запишите в таблицу порядковый номер в Периодической системе (Х) химического элемента, модель атома которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе.
Решение:
1) Порядковый номер химического элемента в Периодической системе можно определить по числу электронов в атоме. Сосчитав все электроны, получаем, что их 14 штук, следовательно, X — 14.
2) Номер группы Периодической системы, в которой расположен химический, элемент можно узнать по числу электронов на его внешнем электронном уровне. Сосчитав их, получим, что их 4 штуки, следовательно, Y — 4.
Ответ: 144
Электронная конфигурация атомаДля изображения строения электронных слоев атома (электронной конфигурации) пользуются условной записью.
Удобно представлять атомные орбитали в виде ячеек, в которых располагаются два электрона, их обозначаем в виде двух стрелочек, первая направлена вверх, а вторая — вниз. Это называется принципом Паули.
Это называется принципом Паули.
Он гласит, что два электрона не могут иметь одинаковые спины. Спин — характеристика электрона, проще всего его можно представить как вращение электрона по часовой стрелке и против часовой, поэтому в ячейке они расположены в противоположном направлении (то есть +1/2 и -1/2).
При заполнении этих ячеек удобно пользоваться правилом Хунда (или правилом «трамвайного вагона»):
| При наличии свободных орбиталей на подуровне электроны занимают именно их, а не «подсаживаются» к другим электронам: Ты приглядись, решив присесть, |
В нашем с вами примере студентов заселяют по одному в комнату пока это возможно.
Важное замечание: в комнате не больше двух студентов — атомная орбиталь вмещает максимально два электрона. |
Например, на изображении представлена электронно-графическая формула атома углерода. Стрелочками обозначены электроны, которые занимают атомные орбитали. Несколько атомных орбиталей на одном энергетическом уровне образуют подуровни.
Можно составить общую табличку с информацией о том, как распределяются электроны по энергетическим уровням и подуровням электронно-графической формулы:
| В атомах химических элементов есть свои уровни комфортности? Да, проанализировав таблицу, мы увидим, что на s-подуровне (блоке) может находиться не больше двух электронов, на p-подуровне — не больше шести электронов, на d-подуровне — не больше десяти электронов, на f-подуровне — не больше четырнадцати электронов. Электроны, как и студенты, стремятся занять более комфортные места, так система стремится к минимуму энергии. Порядок заполнения подуровней в атомах химических элементов следующий: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … Согласитесь, если студентам заселиться в блок вдвоем, им будет проще найти друг с другом общий язык, чем если бы их было в блоке четырнадцать. |
Схематично порядок заполнения энергетических подуровней электронно-графической формулы представлен на картинке:
После того, как мы расположили все электроны по своим местам, мы можем составить электронную конфигурацию атома, которая будет отражать порядок заполнения электронов по подуровням в текстовом виде.
Потренируемся в написании электронной конфигурации на примере атомов хлора и титана.
Химический элемент титан располагается в IVB группе IV периода, имеет порядковый номер, равный 22. Исходя из этого, мы можем сказать, что в его атоме:
— четыре энергетических уровня (IV период), из которых первый и второй уровни полностью заполнены;
— четыре электрона на внешнем энергетическом уровне и предвнешнем подуровне;
— всего двадцать два электрона (порядковый номер).
В соответствии с порядком заполнения орбиталей распределим электроны:
22Ti 1s22s22p63s23p64s23d2 — как мы видим, сначала заполняется 4s-подуровень, а затем 3d-подуровень, это соответствует порядку заполнения орбиталей, описанному выше.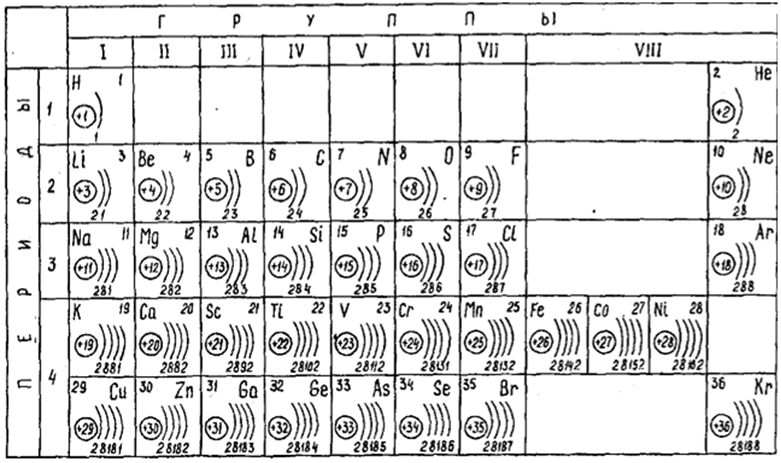
Проверим себя. В сумме все верхние цифры (обозначающие число электронов на подуровне), должны образовать ровно 22: 2 + 2 + 6 + 2 + 6 + 2 + 2 = 22, следовательно, электронная конфигурация атома хлора составлена верно.
| Химические элементы делятся на семейства? Это что, биология какая-то? К счастью, с биологией у атомов химических элементов мало общего, иначе, представьте, что в качестве домашнего питомца у вас был бы атом хлора, а в зоопарке бы показывали семью атомов золота. Что-то из области фантастики, не так ли? — s-элементы — это элементы IA и IIA групп, в их атомах последний электрон занимает место на s-подуровне внешнего энергетического уровня; |
Таким образом, мы с вами узнали, что электроны располагаются в атомах химических элементов в определенном порядке и выявили связь между положением химического элемента в Периодической системе химических элементов Д. И. Менделеева и строением его атома. Теперь для нас не составит труда описать строение атома любого химического элемента.
Фактчек- Электроны располагаются на электронных уровнях, причем их число определяется положением элемента в Периодической системе (по номеру периода).
- Энергетические уровни, в свою очередь, состоят из подуровней.
- Энергетические подуровни состоят из атомных орбиталей, которые для удобства обозначаются ячейками.
- По принципу Паули на каждой атомной орбитали могут располагаться максимально два электрона, причем их спины должны быть противонаправлены.
- Электроны располагаются по подуровням так, чтобы энергия системы была минимальна.

- Химические элементы делятся на s-, p-, d- и f-семейства по тому, на какой подуровень пишем последний электрон при составлении электронной конфигурации атома.
Задание 1.
Сколько электронов может максимально располагаться на орбитали?
- 1 электрон
- 2 электрона
- 3 электрона
- 4 электрона
Задание 2.
Как атомные подуровни заполняются электронами?
- в порядке увеличения их энергии
- в порядке уменьшения их энергии
- в периодическом порядке
Задание 3.
Сколько атомных орбиталей содержит d-подуровень?
- 1
- 3
- 5
- 7
Задание 4.
Какую форму имеет s-орбиталь?
- шара
- гантели
- эллипса
- нескольких гантелей
Ответы: 1. — 2; 2. — 1; 3. — 3; 4.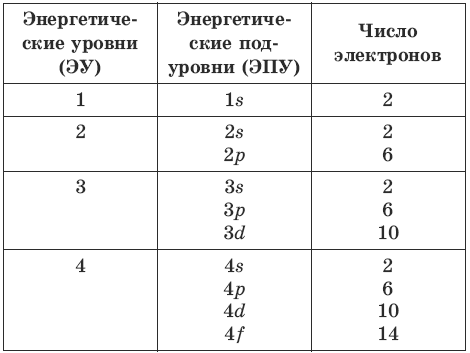 — 1.
— 1.
Для скачивания — Кафедра химии
- Главная
- Университет
- Для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609.98 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия». Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т. д. Координационные свойства проявляются всеми элементами периодической системы.
д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26. 12.2016 12:02
12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 23 с.
– 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01.04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З.В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701. 32 kB
32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З.В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Университет
Видео с вопросами: Определение количества электронов на внешней электронной оболочке атома
Стенограмма видео
Сколько электронов находится на внешней электронной оболочке фтора?
Электроны — это отрицательно заряженные частицы, окружающие ядро атома или иона. Иногда они обозначаются аббревиатурой e-. Электроны расположены слоями, называемыми оболочками или энергетическими уровнями. На картинке здесь мы можем видеть расположение электронов атома лития с двумя электронами во внутренней оболочке и еще одним во внешней оболочке. Каждая электронная оболочка имеет определенное количество электронов, которые она может удерживать до того, как заполнится.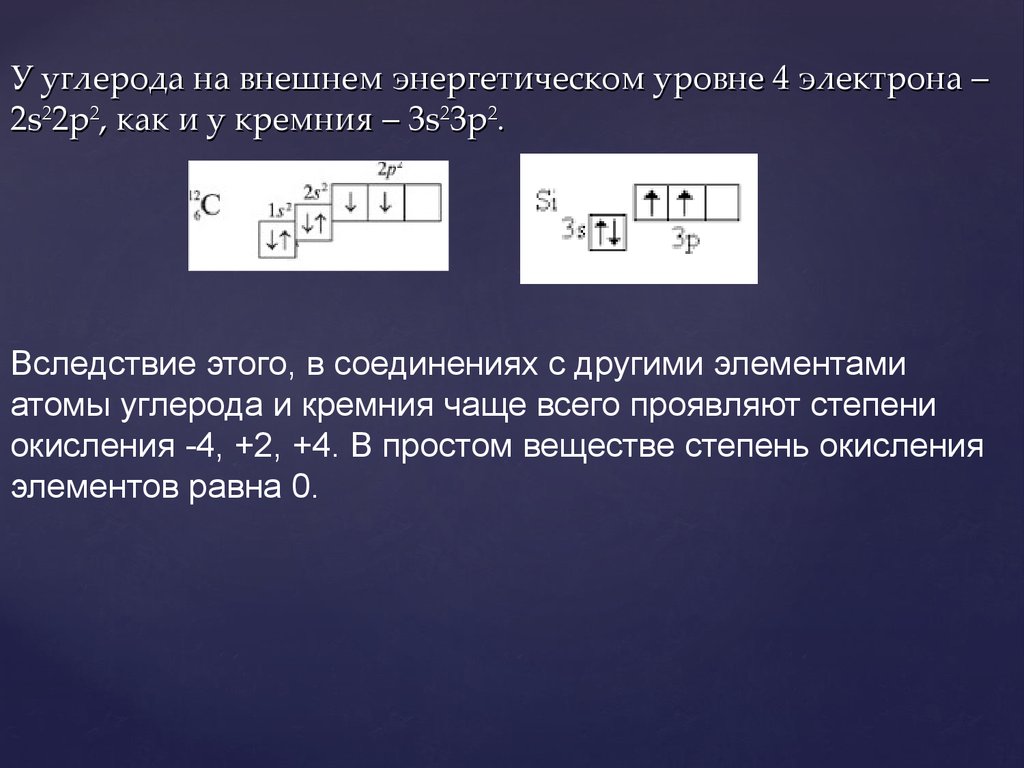 Любые дополнительные электроны будут добавлены к следующей оболочке. Например, самая внутренняя оболочка может содержать только два электрона. Итак, у лития третий электрон находится на второй оболочке.
Любые дополнительные электроны будут добавлены к следующей оболочке. Например, самая внутренняя оболочка может содержать только два электрона. Итак, у лития третий электрон находится на второй оболочке.
Так как электроны стремятся оседать в пространстве с наименьшей возможной энергией, оболочки будут заполняться изнутри наружу. Мы можем отобразить это расположение электронов на картинке, как показано, или, чтобы сэкономить время, мы также можем записать его в виде списка, называемого конфигурацией электронов. Электронная конфигурация атома лития записывается как 2,1, что указывает на наличие двух электронов на первой оболочке и еще одного электрона на второй. В качестве схемы решения этого вопроса мы можем сначала определить количество электронов в атоме фтора. Затем, ссылаясь на количество возможных электронов в каждой оболочке, мы можем определить, как электроны фтора распределены по разным оболочкам, и найти количество электронов в самой внешней оболочке.
Во-первых, сколько всего электронов содержится в атоме фтора? Мы можем ответить на этот вопрос, взглянув на периодическую таблицу. Если мы найдем фтор во втором справа столбце, мы увидим, что его атомный номер равен девяти. Это означает, что в ядре атома фтора девять протонов. Вопрос не относится к иону и не указывает на наличие заряда, поэтому мы можем предположить, что имеем дело с элементом фтором как с нейтральным атомом. Поскольку заряда нет, количество протонов и электронов будет одинаковым, по девять на каждого. Положительно заряженных протонов девять, потому что атомный номер фтора равен девяти. Таким образом, должно быть девять отрицательно заряженных электронов, чтобы уравновесить общий заряд атома.
Если мы найдем фтор во втором справа столбце, мы увидим, что его атомный номер равен девяти. Это означает, что в ядре атома фтора девять протонов. Вопрос не относится к иону и не указывает на наличие заряда, поэтому мы можем предположить, что имеем дело с элементом фтором как с нейтральным атомом. Поскольку заряда нет, количество протонов и электронов будет одинаковым, по девять на каждого. Положительно заряженных протонов девять, потому что атомный номер фтора равен девяти. Таким образом, должно быть девять отрицательно заряженных электронов, чтобы уравновесить общий заряд атома.
Для следующего шага задачи нам нужно спросить себя, как устроены эти девять электронов? Чтобы ответить на этот вопрос, нам нужно знать, сколько электронов может содержать каждая электронная оболочка. Первая электронная оболочка может содержать два электрона, вторая электронная оболочка может содержать восемь электронов, а третья электронная оболочка может содержать еще восемь электронов. За пределами третьей оболочки электроны располагаются немного иначе. Таким образом, в то время как оболочки увеличиваются в размерах, для наших целей мы можем сосредоточиться на первых трех оболочках. Зная, что электронные оболочки заполняются от низшего энергетического уровня к высшему или, другими словами, изнутри наружу, как устроятся девять электронов атома фтора?
Таким образом, в то время как оболочки увеличиваются в размерах, для наших целей мы можем сосредоточиться на первых трех оболочках. Зная, что электронные оболочки заполняются от низшего энергетического уровня к высшему или, другими словами, изнутри наружу, как устроятся девять электронов атома фтора?
Итак, первые два электрона входят в первую оболочку, полностью ее заполняя, еще семь электронов почти заполняют вторую оболочку, и после этого ни для одной оболочки больше не остается электронов. Мы можем записать электронную конфигурацию фтора как 2,7, что указывает на то, что на самой внутренней оболочке находятся два электрона, а на следующей внешней оболочке — семь электронов. Мы можем игнорировать любые оболочки с нулевыми электронами. Основываясь на таком расположении, мы можем ответить на вопрос и сказать, что на самой внешней электронной оболочке фтора имеется семь электронов. Мы также можем использовать закономерности периодической таблицы в свою пользу, чтобы ответить на этот вопрос по-другому.
Обратите внимание, что количество элементов в каждой строке периодической таблицы, также известное как период, соответствует количеству электронов в полной электронной оболочке. В первой строке два элемента, во второй строке восемь элементов и еще восемь элементов в третьей строке. Двигаясь вправо по таблице Менделеева, начиная с любого элемента, мы увидим, что атомный номер увеличивается на единицу. Это также означает, что количество протонов увеличивается на один и что количество электронов в нейтральном атоме этого элемента увеличивается на один, поскольку должен быть дополнительный отрицательный заряд, чтобы уравновесить положительный заряд добавленного протона.
Если мы начнем с элемента лития, который имеет один электрон на внешней оболочке, и перейдем через семь позиций к неону, каждый раз добавляя электрон, мы обнаружим, что заполнили электронную оболочку. Поскольку каждая строка периодической таблицы представляет электронную оболочку, элементы в левой части периодической таблицы, такие как литий, будут иметь один электрон в самой внешней электронной оболочке, в то время как элементы в правой части таблицы Менделеева Периодическая таблица, как и неон, будет иметь полные внешние электронные оболочки.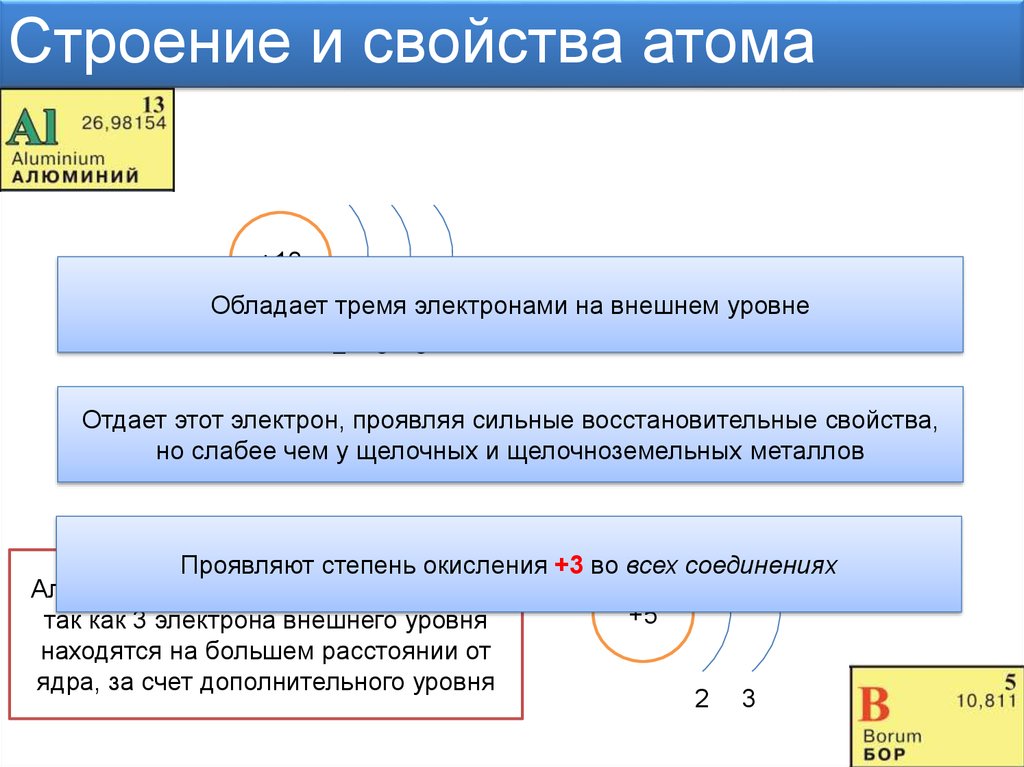 Таким образом, мы можем использовать столбец или группу элемента, чтобы определить количество электронов в его самой внешней оболочке, иногда называемой валентными электронами.
Таким образом, мы можем использовать столбец или группу элемента, чтобы определить количество электронов в его самой внешней оболочке, иногда называемой валентными электронами.
Элементы из четвертого столбца периодической таблицы, такие как углерод, имеют четыре электрона в самой внешней электронной оболочке или четыре валентных электрона. Фтор находится в седьмом столбце периодической таблицы, поэтому у него семь электронов на самой внешней оболочке, что соответствует нашему ответу, полученному ранее. Обратите внимание, что когда мы включаем 10 столбцов переходных металлов d-блока, которые появляются между бериллием и бором и ниже, это увеличивает количество столбцов в этих строках периодической таблицы на 10. Вот почему мы иногда будем видеть фтор столбец будет называться столбцом 17.
Однако это не означает, что на внешней электронной оболочке фтора 17 электронов. Если мы рассмотрим только элементы в этой строке периодической таблицы, мы увидим, что фтор является седьмым элементом, то есть у него семь электронов на внешней оболочке. Другие элементы того же столбца, такие как хлор, также имеют семь электронов на внешней оболочке.
Другие элементы того же столбца, такие как хлор, также имеют семь электронов на внешней оболочке.
Информация о самой внешней электронной оболочке может немного рассказать нам о том, как будет вести себя элемент. Поскольку фтор находится на расстоянии одного электрона от полной электронной оболочки, он будет стремиться образовать ион F-, добавляя электрон и заполняя свою внешнюю электронную оболочку. Литий, имеющий только один электрон в своей самой внешней электронной оболочке, часто отдает свой единственный электрон, также давая ему полную внешнюю оболочку. Получение или потеря электрона превратит атом в ион с отрицательным или положительным зарядом. Получение или потеря электронов также изменит электронную конфигурацию, поскольку теперь на самой внешней оболочке появилось новое количество электронов. Однако, как нейтральный атом, мы можем сказать, что у фтора есть семь электронов в самой внешней электронной оболочке.
Периодическая таблица и модели уровней энергии | Глава 4: Периодическая таблица и связь
Вам это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Спасибо!
Урок 4.3
Ключевые понятия
- Электроны, окружающие атом, расположены в областях вокруг ядра, называемых «энергетическими уровнями».
- Энергетический уровень представляет собой трехмерное пространство, окружающее ядро, где, скорее всего, находятся электроны.
- Первый энергетический уровень находится ближе всего к ядру. Второй энергетический уровень находится немного дальше первого. Третий чуть дальше второго, и так далее.
- Каждый энергетический уровень может вмещать или «удерживать» различное количество электронов, прежде чем дополнительные электроны начнут переходить на следующий уровень.
- Когда на первом энергетическом уровне есть 2 электрона, следующие электроны переходят на второй энергетический уровень, пока на втором уровне не будет 8 электронов.
- Когда на втором энергетическом уровне 8 электронов, следующие электроны переходят на третий энергетический уровень до тех пор, пока на третьем уровне не будет 8 электронов.

- Когда на третьем энергетическом уровне 8 электронов, следующие 2 электрона переходят на четвертый энергетический уровень.
- Электроны на энергетическом уровне, наиболее удаленном от ядра, называются валентными электронами.
- Атомы в одном столбце (группе) периодической таблицы имеют одинаковое количество валентных электронов.
Резюме
Учащиеся снова сосредоточатся на первых 20 элементах. Студенты сначала рассмотрят диаграмму и анимацию, чтобы понять основную схему расположения электронов на энергетических уровнях вокруг атома. Студентам будут выданы карточки с информацией об электронах и энергетических уровнях для каждого из первых 20 атомов. Они снова попытаются правильно сопоставить карточки с каждым элементом.
Задача
Учащиеся смогут интерпретировать информацию, приведенную в периодической таблице, для описания расположения электронов на энергетических уровнях вокруг атома.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Об этом уроке
Убедитесь, что по комнате развешены карточки с именами из 20 атомов. Вам понадобятся пять карточек с правой стороны каждого листа. Этот урок задуман как продолжение урока 2 главы 4.
На уроке 4.3 учащиеся могут сыграть в Периодическую таблицу, игра №2. Это онлайн-версия карточной игры с периодической таблицей из этого урока, которую вы можете назначить в качестве классной работы или домашнего задания после того, как учащиеся поиграют в игру в классе.
Познакомьте учащихся с идеей о том, что электроны окружают ядро атома в областях, называемых энергетическими уровнями.
Повторите вместе с учащимися, что на втором уроке они сосредоточились на количестве протонов, нейтронов и электронов в атомах каждого элемента. На этом уроке они сосредоточатся на расположении электронов в каждом элементе.
Спроецируйте изображение в разрезе уровня энергии.

Объясните учащимся, что электроны окружают ядро атома в трех измерениях, делая атомы сферическими. Они могут думать об электронах как о находящихся на разных энергетических уровнях, подобных концентрическим сферам вокруг ядра. Поскольку эти сферы очень трудно показать, энергетические уровни обычно изображают в двух измерениях.
Подробнее о моделях энергетических уровней читайте в разделе «Биография учителя».
Спроецируйте изображение Атом кислорода.
Скажите учащимся, что эта модель энергетического уровня представляет собой атом. Ядро представлено точкой в центре, которая содержит как протоны, так и нейтроны. Меньшие точки, окружающие ядро, представляют собой электроны на энергетических уровнях. Сообщите учащимся, что позже на этом уроке они узнают больше об электронах и энергетических уровнях.
Предложите учащимся просмотреть Периодическую таблицу элементов 1–20, которые они использовали на уроке 2, чтобы ответить на следующий вопрос:
- Можете ли вы определить, какой атом представляет эта модель?
- Если учащиеся не могут ответить на этот вопрос, укажите, что имеется 8 электронов.
 Поскольку нейтральные атомы в периодической таблице имеют такое же количество электронов, как и протоны, атом должен иметь 8 протонов. Число протонов такое же, как атомный номер, поэтому атом является кислородом.
Поскольку нейтральные атомы в периодической таблице имеют такое же количество электронов, как и протоны, атом должен иметь 8 протонов. Число протонов такое же, как атомный номер, поэтому атом является кислородом.
Попросите группы вместе разместить каждую карту с соответствующим атомом.
Покажите учащимся, что у вас есть 80 карточек (по 4 на каждый из первых 20 элементов). Перед раздачей карточек объясните, что каждая карточка содержит информацию об электронах и энергетических уровнях первых 20 элементов периодической таблицы. Задача учащихся — внимательно прочитать карточку, выяснить, какой элемент она описывает, и положить карточку на то место в комнате, где находится этот элемент. Напомните учащимся, что им нужно будет сосчитать электроны, чтобы идентифицировать каждый атом. Как только учащиеся поймут, в чем состоит их задание, раздайте карточки группам.
Обсудите расположение карт для двух или трех атомов.
После того, как все карты были размещены на 20 различных атомах, выберите два или три атома и проверьте, правильно ли были размещены карты.

Раздайте каждому учащемуся лист с заданиями по Периодической таблице уровней энергии. Эта таблица содержит модели уровней энергии для первых 20 элементов. Электроны включены только для атомов в начале и конце каждого периода.
Спроектируйте Периодическую таблицу энергетических уровней и обсудите расположение электронов, пока учащиеся заполняют лист с заданиями.
Проецировать изображение Периодическая таблица энергетических уровней.
Изображение, которое вы проецируете, содержит все электроны элементов 1–20. Однако периодическая таблица на листе активности содержит электроны только для элементов в начале и в конце каждого периода. Обсудите расположение электронов на энергетических уровнях этих атомов и предложите учащимся вписать электроны других атомов.
Примечание. На диаграммах энергетических уровней электроны распределены по уровню равномерно.
 В некоторых книгах они показаны разбросанными таким образом, а в некоторых — парами. Спаривание электронов предназначено для представления того, что электроны находятся на отдельных орбиталях в пределах каждого энергетического уровня. На уровне средней школы учащимся не обязательно изучать электронные орбитали. Эта информация предлагается для того, чтобы вам было понятнее, почему электроны часто изображаются парами на диаграммах энергетических уровней и на точечных диаграммах, используемых в качестве дополнения в конце этой главы. Орбиталь определяет область внутри энергетического уровня, где существует высокая вероятность обнаружения пары электронов. На каждой орбитали может находиться максимум два электрона. Вот почему электроны часто изображаются парами внутри энергетического уровня.
В некоторых книгах они показаны разбросанными таким образом, а в некоторых — парами. Спаривание электронов предназначено для представления того, что электроны находятся на отдельных орбиталях в пределах каждого энергетического уровня. На уровне средней школы учащимся не обязательно изучать электронные орбитали. Эта информация предлагается для того, чтобы вам было понятнее, почему электроны часто изображаются парами на диаграммах энергетических уровней и на точечных диаграммах, используемых в качестве дополнения в конце этой главы. Орбиталь определяет область внутри энергетического уровня, где существует высокая вероятность обнаружения пары электронов. На каждой орбитали может находиться максимум два электрона. Вот почему электроны часто изображаются парами внутри энергетического уровня.Скажите учащимся, что строки периодической таблицы называются периодами.
Период 1
- Водород
- Объясните, что водород имеет 1 протон и 1 электрон. 1 электрон находится на первом энергетическом уровне.

- Гелий
- Объясните, что у гелия 2 протона и 2 электрона. 2 электрона находятся на первом энергетическом уровне.
Период 2
- Литий
- Объясните, что у лития 3 протона и 3 электрона. На первом энергетическом уровне находятся 2 электрона, а на втором 1 электрон. Объясните, что на первом энергетическом уровне может быть только 2 электрона, поэтому следующий электрон в литии находится на следующем (втором) уровне.
- Неон
- Объясните, что у неона 10 протонов и 10 электронов. На первом энергетическом уровне находятся 2 электрона, а на втором 8 электронов.
- Бериллий-фтор
- Помогите учащимся указать правильное количество электронов на энергетических уровнях остальных атомов в периоде 2.
Период 3
- Натрий
- Объясните, что у натрия 11 протонов и 11 электронов. На первом энергетическом уровне находятся 2 электрона, на втором 8 электронов и 1 электрон на третьем энергетическом уровне.
 Объясните, что на втором энергетическом уровне может быть только 8 электронов, поэтому следующий электрон в натрии должен находиться на следующем (третьем) уровне.
Объясните, что на втором энергетическом уровне может быть только 8 электронов, поэтому следующий электрон в натрии должен находиться на следующем (третьем) уровне. - Аргон
- Объясните, что в аргоне 18 протонов и 18 электронов. На первом энергетическом уровне находятся 2 электрона, на втором 8 электронов и на третьем энергетическом уровне 8 электронов. Предложите учащимся заполнить модель энергетического уровня аргона в своей периодической таблице.
- Магний–хлор
- Помогите учащимся указать правильное количество электронов на энергетических уровнях остальных атомов в периоде 3.
Период 4
- Калий
- Объясните, что калий имеет 19 протонов и 19 электронов. На первом энергетическом уровне находятся 2 электрона, на втором 8 электронов, на третьем энергетическом уровне 8 электронов и на четвертом энергетическом уровне 1 электрон. Объясните, что после того, как на третьем энергетическом уровне будет 8 электронов, следующий электрон переходит на четвертый уровень.

- Кальций
- Помогите учащимся указать правильное количество электронов на энергетических уровнях кальция.
Примечание. Студенты могут задаться вопросом, почему энергетический уровень может содержать только определенное количество электронов. Ответ на этот вопрос выходит далеко за рамки изучения химии в средней школе. Это включает в себя представление об электронах как о трехмерных волнах и о том, как они будут взаимодействовать друг с другом и с ядром.
Предложите учащимся найти закономерности в строках и столбцах первых 20 элементов периодической таблицы.
Продолжайте проецировать изображение Периодической таблицы энергетических уровней для элементов 1–20 и предложите учащимся просмотреть свои рабочие листы, чтобы найти закономерности в количестве электронов на каждом энергетическом уровне.
Предложите учащимся посмотреть на точки (пересекающиеся строки).
Количество уровней энергии в каждом периоде
- Атомы первого периода имеют электроны на 1 энергетическом уровне.

- Атомы второго периода имеют электроны на 2 энергетических уровнях.
- Атомы третьего периода имеют электроны на 3 энергетических уровнях.
- Атомы четвертого периода имеют электроны на 4 энергетических уровнях.
Как электроны заполняют энергетические уровни
- Первый уровень энергии = 1, 2
- Второй уровень энергии = 1, 2, 3, …8
- Третий энергетический уровень = 1, 2, 3, …8
- Четвертый энергетический уровень = 1, 2
Узнайте больше о таблице Менделеева в разделе истории учителя.
Определенное количество электронов переходит на уровень, прежде чем на следующем уровне могут быть электроны. После того, как первый энергетический уровень содержит 2 электрона (гелий), следующие электроны переходят на второй энергетический уровень. После того, как на втором энергетическом уровне будет 8 электронов (неон), следующие электроны переходят на третий энергетический уровень. После того, как на третьем энергетическом уровне имеется 8 электронов (аргон), следующие 2 электрона переходят на четвертый энергетический уровень.

Примечание: Третий энергетический уровень может содержать до 18 электронов, поэтому он не заполнен, когда на нем 8 электронов. Но когда третий уровень содержит 8 электронов, следующие 2 электрона переходят на четвертый уровень. Затем, хотите верьте, хотите нет, еще 10 электронов продолжают заполнять оставшуюся часть третьего уровня. Студентам это знать не обязательно.
Предложите учащимся посмотреть на группы (столбцы идут вниз).
Скажите учащимся, что вертикальные столбцы периодической таблицы называются группами или семействами.
Попросите учащихся сравнить количество электронов на внешнем энергетическом уровне атомов в группе. Студенты должны понимать, что каждый атом в группе имеет одинаковое количество электронов на внешнем энергетическом уровне. Например, водород, литий, натрий и калий имеют по одному электрону на внешнем энергетическом уровне. Сообщите учащимся, что эти электроны на внешнем энергетическом уровне называются валентными электронами.
 Это электроны, ответственные за образование связи, которую учащиеся будут исследовать на следующем уроке.
Это электроны, ответственные за образование связи, которую учащиеся будут исследовать на следующем уроке.- Атомы первого периода имеют электроны на 1 энергетическом уровне.
Сравните химические реакции различных элементов и свяжите это с их положением в таблице Менделеева.
Скажите учащимся, что в таблице Менделеева атомы в одном и том же столбце, называемом группой, имеют определенные характеристики и могут реагировать сходным образом.
Спроектировать видео Натрий в воде и калий в воде.
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#sodium_in_water
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#potasium_in_waterУчащиеся увидят, что, хотя калий реагирует более энергично, чем натрий, реакции аналогичны. Предложите учащимся взглянуть на периодическую таблицу, чтобы увидеть, где находятся натрий и калий по отношению друг к другу.
Проект видео Кальций в воде.
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#calcium_in_water
Учащиеся увидят, что эта реакция отличается от реакции натрия и калия.
 Попросите их найти кальций в периодической таблице и указать, что он находится в другой группе, чем натрий и калий.
Попросите их найти кальций в периодической таблице и указать, что он находится в другой группе, чем натрий и калий.Спроецируйте видео Натрий в кислоте и калий в кислоте.
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#sodium_in_acid
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#potassium_in_acidПокажите натрий, реагирующий с кислотой, а затем калий, реагирующий с кислотой. HCl это соляная кислота. HNO3 это азотная кислота. Каждая кислота используется в двух различных концентрациях. Убедитесь, что учащиеся понимают, что натрий и калий реагируют одинаково, хотя калий реагирует более энергично.
Спроецировать видео Кальций в кислоте.
www.middleschoolchemistry.com//multimedia/chapter4/lesson3#calcium_in_acid
Укажите, что кальций реагирует иначе, чем натрий и калий.
Спросите студентов:
- Имеют ли элементы одной группы сходные свойства и сходную реакцию?
- Учащиеся должны понимать, что натрий и калий относятся к одной группе и реагируют одинаково.


 И. Менделеева.
И. Менделеева.




 Поскольку нейтральные атомы в периодической таблице имеют такое же количество электронов, как и протоны, атом должен иметь 8 протонов. Число протонов такое же, как атомный номер, поэтому атом является кислородом.
Поскольку нейтральные атомы в периодической таблице имеют такое же количество электронов, как и протоны, атом должен иметь 8 протонов. Число протонов такое же, как атомный номер, поэтому атом является кислородом.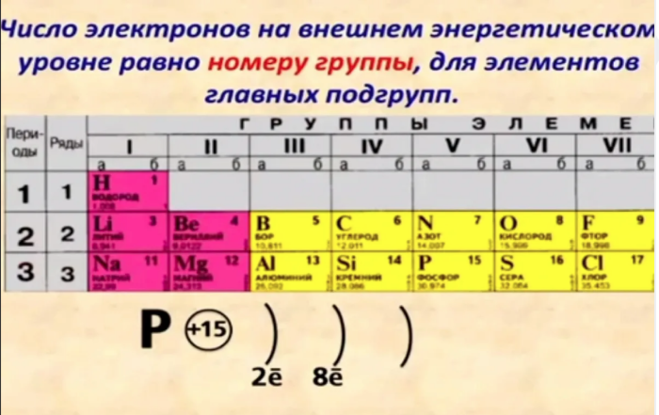
 В некоторых книгах они показаны разбросанными таким образом, а в некоторых — парами. Спаривание электронов предназначено для представления того, что электроны находятся на отдельных орбиталях в пределах каждого энергетического уровня. На уровне средней школы учащимся не обязательно изучать электронные орбитали. Эта информация предлагается для того, чтобы вам было понятнее, почему электроны часто изображаются парами на диаграммах энергетических уровней и на точечных диаграммах, используемых в качестве дополнения в конце этой главы. Орбиталь определяет область внутри энергетического уровня, где существует высокая вероятность обнаружения пары электронов. На каждой орбитали может находиться максимум два электрона. Вот почему электроны часто изображаются парами внутри энергетического уровня.
В некоторых книгах они показаны разбросанными таким образом, а в некоторых — парами. Спаривание электронов предназначено для представления того, что электроны находятся на отдельных орбиталях в пределах каждого энергетического уровня. На уровне средней школы учащимся не обязательно изучать электронные орбитали. Эта информация предлагается для того, чтобы вам было понятнее, почему электроны часто изображаются парами на диаграммах энергетических уровней и на точечных диаграммах, используемых в качестве дополнения в конце этой главы. Орбиталь определяет область внутри энергетического уровня, где существует высокая вероятность обнаружения пары электронов. На каждой орбитали может находиться максимум два электрона. Вот почему электроны часто изображаются парами внутри энергетического уровня.
 Объясните, что на втором энергетическом уровне может быть только 8 электронов, поэтому следующий электрон в натрии должен находиться на следующем (третьем) уровне.
Объясните, что на втором энергетическом уровне может быть только 8 электронов, поэтому следующий электрон в натрии должен находиться на следующем (третьем) уровне.
Leave A Comment