Ионная связь — определение, образование и примеры
Поможем понять и полюбить химию
Начать учиться
В этом материале речь пойдет о том, что такое ионная связь и чем она отличается от других видов, которые изучают на уроках химии в 8 классе.
Общие сведения о химических связях
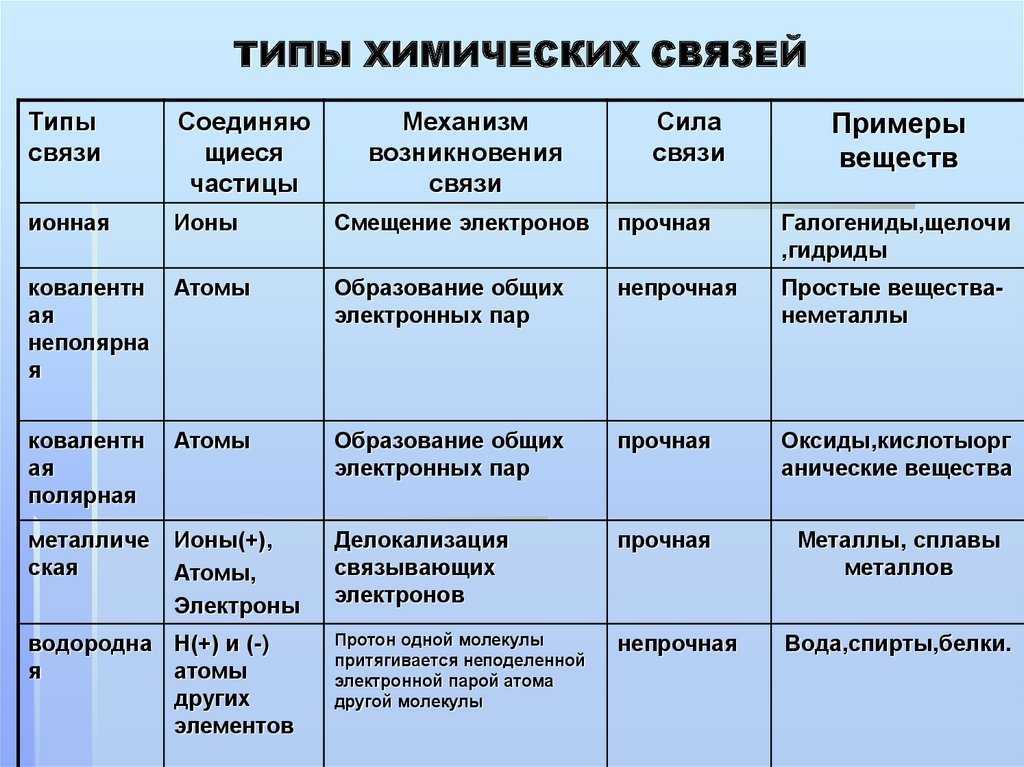
Давайте вспомним, как образуются химические связи. Для этого представим атом: он состоит из ядра с положительным зарядом и набора отрицательно заряженных электронов, которые располагаются на нескольких уровнях. Внешний уровень называется валентным, на нем располагаются валентные электроны. Они могут образовывать пары или быть свободными, т. е. неспаренными.
Во взаимодействии двух атомов участвуют свободные электроны внешней оболочки. Сколько таких электронов имеется у атома — столько химических связей он может образовать.
При этом каждый атом стремится приобрести устойчивую конфигурацию — двух- или восьмиэлектронную внешнюю оболочку, подобную той, что есть у инертного газа. Атом может достичь ее, отдавая или принимая часть электронов, а также образуя общую электронную пару с другим атомом. Если в результате получается два разноименно заряженных иона, говорят об ионном типе связи. Он характерен для взаимодействия атомов металла и неметалла.
Атом может достичь ее, отдавая или принимая часть электронов, а также образуя общую электронную пару с другим атомом. Если в результате получается два разноименно заряженных иона, говорят об ионном типе связи. Он характерен для взаимодействия атомов металла и неметалла.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
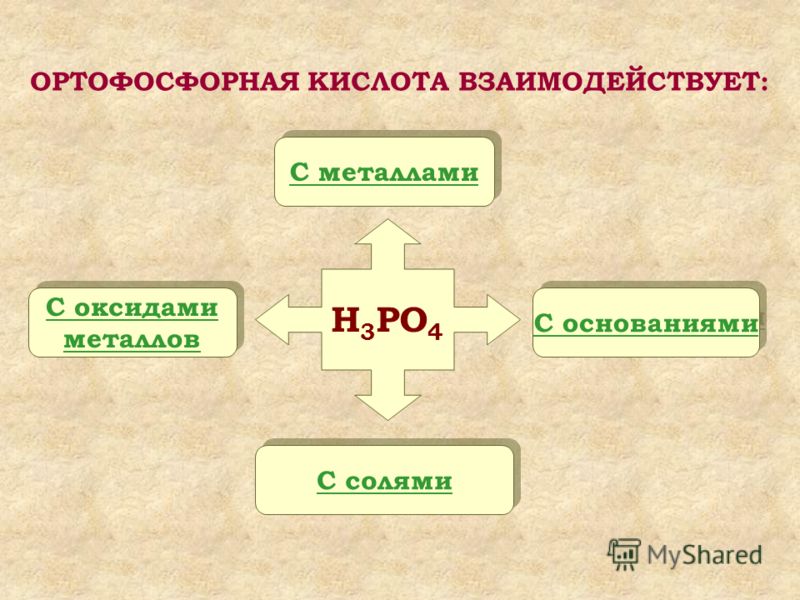
Определение ионной связи
Рассмотрим этот тип связи на примере реакции натрия и водорода, в результате которой получается гидрид натрия. У атома натрия Na есть один свободный электрон на внешнем уровне, в то время как атому водорода H не хватает одного электрона, чтобы завершить внешнюю оболочку и принять стабильную форму. Поскольку натрий имеет более низкую электроотрицательность, чем водород, он отдает свой валентный электрон и получает отрицательный заряд. Водород принимает этот электрон и получает положительный заряд.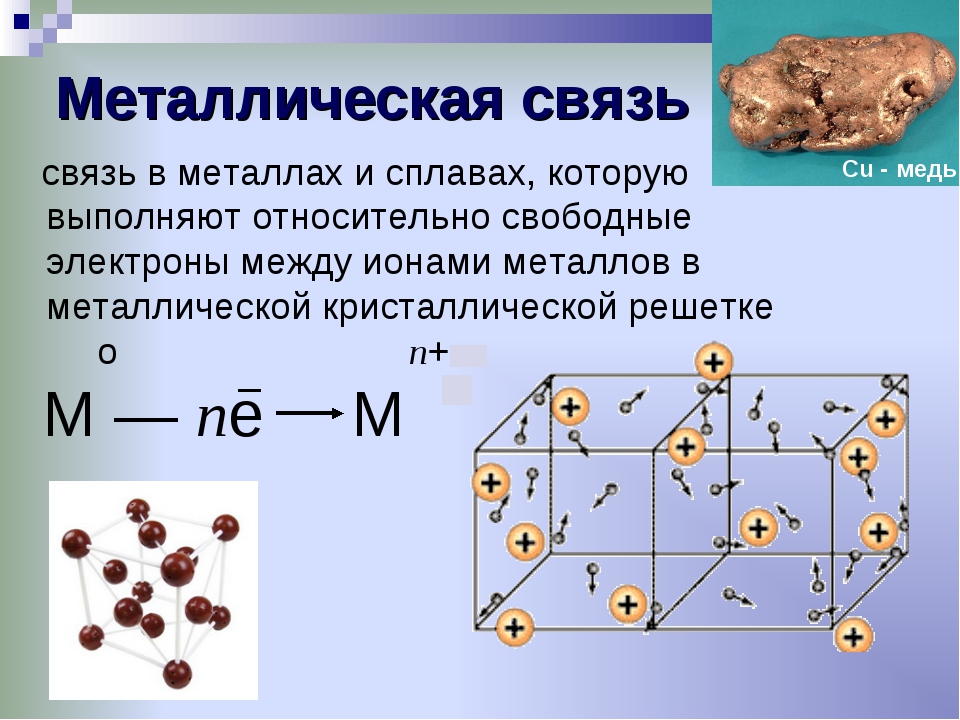 В итоге образуется два иона — катион Na+ и анион H—.
В итоге образуется два иона — катион Na+ и анион H—.
Между положительным ионом Na+ и отрицательным H— возникает электростатическое притяжение, которое и удерживает их вместе. Так образуется ионная связь в гидриде натрия.
Ионная связь — это тип химической связи, характерный для разноименно заряженных ионов, которые образовались в результате отдачи и присоединения электронов атомами. В нее вступают элементы с большой разностью электроотрицательности. Обычно так взаимодействуют атомы металла и неметалла.
Чаще всего именно так связаны в соединениях щелочные и щелочноземельные металлы с галогенами. Поскольку у щелочных металлов электроотрицательность ниже, их атомы становятся катионами, а атомы галогенов — анионами.
Механизм образования ионной связи похож на донорно-акцепторный механизм ковалентной связи. Первую даже называют крайним выражением второй.
Важно!
Соли аммония NH4NO3, NH4Cl, (NH4)2SO4 хоть и не являются соединениями металла и неметалла, но также образованы с помощью ионной связи.
Координационное число
Вернемся к нашему примеру с гидридом натрия и посмотрим на кристаллическую решетку, которую имеет это ионное соединение. Каждый ион Na+ контактирует с шестью ионами H—. Это максимально возможное для данного иона число химических связей, оно называется координационным.
Координационное число — это количество ближайших соседей иона в ионной кристаллической решетке. По сути это количество связей, которые образует каждый ион в составе сложного вещества.
Обратите внимание
При рассмотрении ковалентной химической связи говорят о валентности — она характеризует, сколько связей есть у конкретного атома с другими атомами. Но к ионным соединениям это понятие не применяют, потому что все ионы в кристаллической решетке взаимодействуют друг с другом. Вместо этого есть координационное число, и оно отражает количество таких взаимодействий.
Вместо этого есть координационное число, и оно отражает количество таких взаимодействий.
Примеры веществ с ионной связью
Таким же образом, как в гидриде натрия, ионы образуются и в других подобных ему соединениях. Например, в хлориде натрия NaCl атом натрия имеет один свободный электрон и отдает его атому хлора. В итоге оба завершают свой внешний уровень. Образуется ион натрия с положительным зарядом и отрицательно заряженный ион хлора.
Другой пример ионной химической связи — сульфид натрия Na2S. В данном случае у нас также есть натрий с одним свободным электроном и сера, у которой на внешнем уровне есть 2 свободных электрона из 6. Таким образом, чтобы завершить уровень и обрести стабильную форму, сере нужно 2 электрона. Поэтому в формуле сульфида серы присутствует два атома натрия.
Характеристики ионной связи
Мы узнали, как образуется ионная связь, а теперь поговорим о ее характеристиках.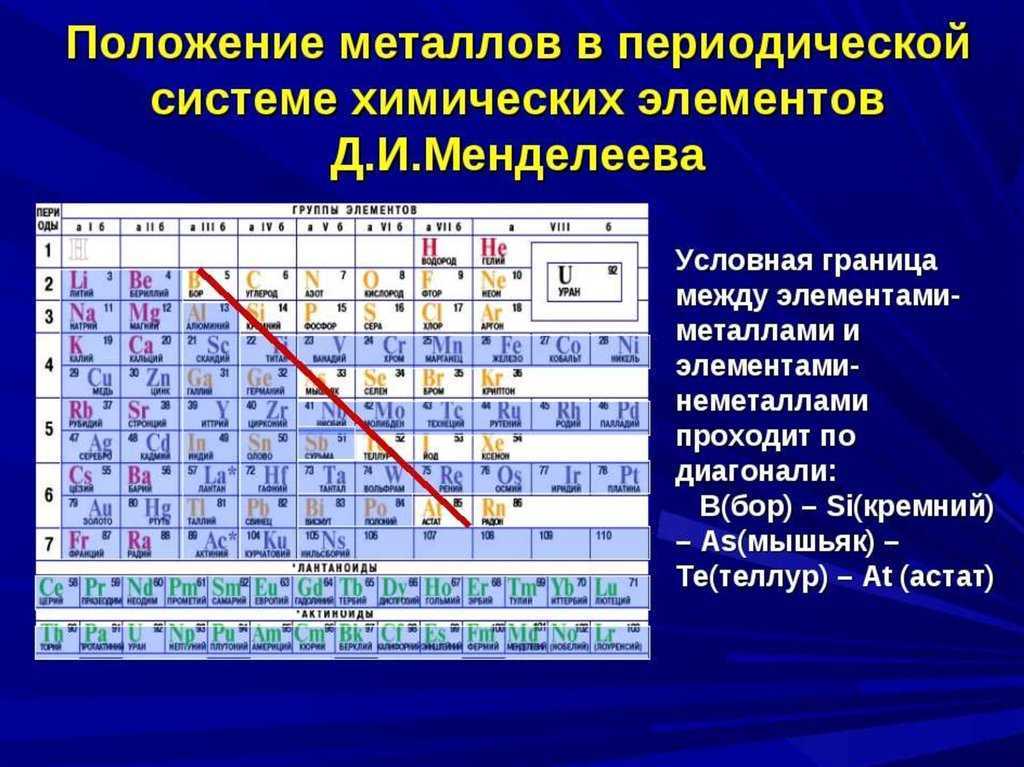 Она существенно отличается от других типов связи между атомами.
Она существенно отличается от других типов связи между атомами.
Ионная связь:
не направлена;
не насыщена;
не имеет кратности.
Разберемся в каждом пункте и начнем с направленности. Ковалентная полярная связь направлена, потому что она подразумевает смещение общей электронной пары к тому атому, который имеет большую электроотрицательность. В случае с ионами все иначе. Согласно закону Кулона притяжение между отрицательным и положительным ионом идет по прямой, соединяющей эти заряженные частицы. В кристаллической решетке все разноименно заряженные ионы взаимодействуют друг с другом и притяжение распределяется равномерно, поэтому говорят, что ионная связь не направлена.
А как насчет насыщаемости? Эта характеристика указывает на то, что атом может вступить в ограниченное количество химических связей, поскольку имеет ограниченное число неспаренных электронов.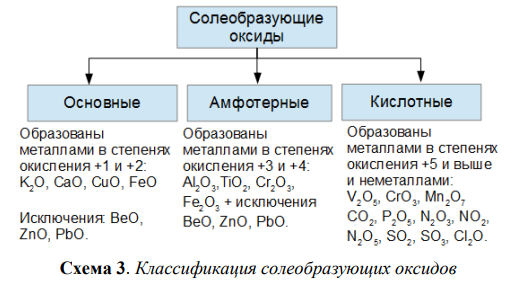 Но ионная связь — это не процесс соединения свободных электронов в пары, а взаимное притяжение ионов. Каждый ион может притягивать к себе неограниченное число ближайших соседей, поэтому нет смысла говорить о насыщаемости.
Но ионная связь — это не процесс соединения свободных электронов в пары, а взаимное притяжение ионов. Каждый ион может притягивать к себе неограниченное число ближайших соседей, поэтому нет смысла говорить о насыщаемости.
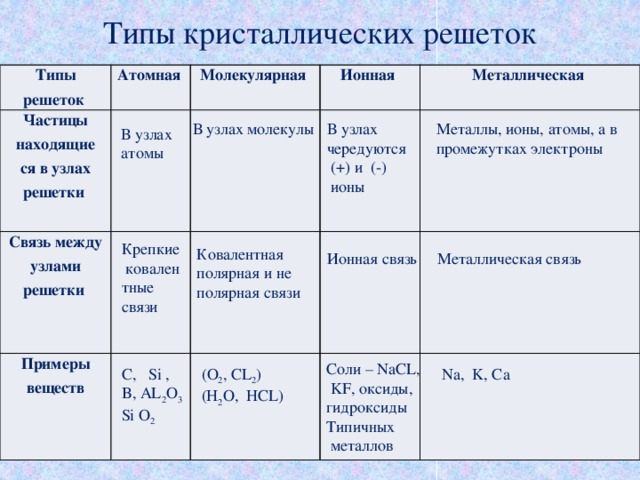
Физические свойства ионной связи
Между ионами в молекуле всегда образуется достаточно сильное притяжение, поэтому вещества с ионной связью в обычных условиях твердые и нелетучие. Такие соединения сложно разрушить при помощи тепловой энергии, что обуславливает высокую температуру кипения и плавления. При этом ионы имеют небольшой радиус взаимодействия — это придает веществам хрупкость.
Свойства ионных соединений:
твердость,
хрупкость,
нелетучесть,
тугоплавкость,
растворимость в воде,
электропроводность.

Типичным веществом с ионными связями можно считать хлорид натрия NaCl или поваренную соль. Ее кристаллы в точности соответствуют всем характеристикам.
Как определить ионную связь
Чтобы быстро понять, является ли нужное нам соединение ионным, выполните следующие действия:
Посмотрите, какие элементы входят в состав соединения. Формула вещества с ионной связью должна включать металл и неметалл. Если это щелочной металл (I группа таблицы Менделеева) и галоген (VII группа), то связь между ними точно ионная.
По шкале Полинга определите электроотрицательности обоих элементов соединения. Если разница между ними больше 1,7 — связь ионная. Это объясняется тем, что такой тип связи характерен для веществ, у которых сильно отличаются показатели электроотрицательности.
Дополнительным способом убедиться в правильности результата может стать оценка физических свойств вещества.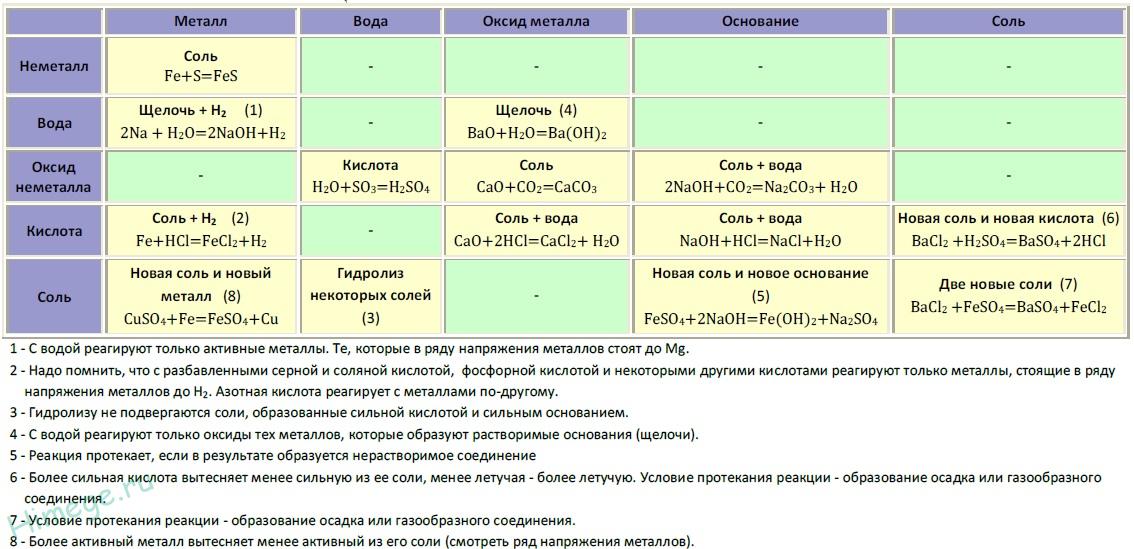 Если оно имеет высокую температуру кипения или плавления и проводит электроток — связь скорее всего ионная.
Если оно имеет высокую температуру кипения или плавления и проводит электроток — связь скорее всего ионная.
Вопросы для самопроверки:
Опишите, как образуется ионная связь. Какие условия для этого необходимы?
Что такое координационное число элемента в ионном соединении?
Каковы основные физические свойства ионных соединений?
В чем разница между характеристиками ионной и ковалентной связей?
Как можно определить ионную связь, зная электроотрицательность элементов в соединении?
Яна Кононенко
К предыдущей статье
125.8K
Окислительно-восстановительные реакции
К следующей статье
Теория электролитической диссоциации
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
2.
 2 Оксиды
2 Оксиды2.2.1 Определение. Состав и строение оксидов.
Оксиды – соединения, состоящие из двух элементов, одним из которых является кислород в степени окисления –2.
Например, СаО – оксид кальция, SО3 – оксид серы (VI).
Следует отличать оксиды от пероксидов, в составе которых кислород находится в степени окисления –1. В этих соединениях атомы кислорода связаны друг с другом. Примеры: Н2О2 – пероксид водорода, ВаО2 – пероксид бария. По своей природе пероксиды представляют собой соли очень слабой кислоты пероксида (перекиси) водорода Н2О2.
Ионными
можно считать практически лишь оксиды
щелочных и щелочноземельных металлов,
остальные оксиды – ковалентные соединения
(тип связи – ковалентная полярная).
В случае ковалентной связи кристаллическая
решетка оксида может быть атомной
(например, в SiО Примерами
последних могут быть: СО2,
SО2 и т. д.
Примерами
последних могут быть: СО2,
SО2 и т. д.
2.2.2 Классификация и номенклатура оксидов.
По функциональным признакам оксиды подразделяются на солеобразующие и несолеобразующие (безразличные). Солеобразующие оксиды, в свою очередь, делятся на основные, кислотные и амфотерные (таблица 2).
Таблица 2 – Классификация солеобразующих оксидов по их кислотно-основному характеру
Солеобразующие оксиды | ||
Основные | Амфотерные | Кислотные |
Гидраты* основных оксидов – основания | Гидраты амфотерных оксидов – амфотерные гидроксиды | Гидраты кислотных оксидов – кислоты |
Основные
оксиды образованы металлами, причем
степень окисления металла в
оксиде, как правило, равна +1 или +2. Na2О, MgO, MnO Существуют исключения, например: BeO, ZnO, SnO (относятся к амфотерным оксидам) | Амфотерные оксиды образованы металлами, причем степень окисления металла в оксиде равна +3 или +4. А12О3, Сг2О3, МnО2 Исключение: ВеО, ZnO, SnO – амфотерные оксиды | Кислотные оксиды образованы: – неметаллами Р2О5, СО2, SО3 – металлами, причем степень окисления металла в оксиде равна +5, +6, +7 V2О5, CrО3, Мn2О7 |
* Примечание: гидраты – продукты соединения с водой, получаемые присоединением воды к данному веществу прямо или косвенно | ||
Иногда
оксиды металлов, в которых степень
окисления металла равна +2, являются
амфотерными, например: ВеО, ZnO,
SnO,
PbO.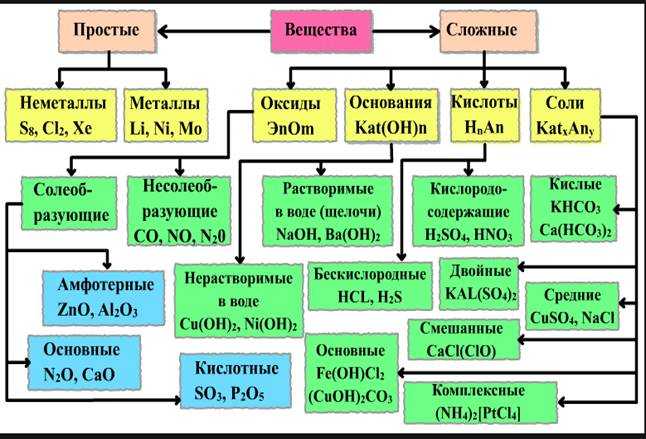
В то же время, некоторые оксиды, в которых степень окисления металла равна +3, являются основными, например: Y2О3, La2О3.
Несолеобразующие (безразличные) оксиды не имеют соответствующих гидратов, которые бы являлись кислотами или основаниями. Примеры: NO, N2О, CO, SiO.
Такие оксиды не проявляют ни кислотных, ни основных свойств.
Fe3О4 – оксид железа (II, III) – FeО∙Fe2О3;
Pb2O3 – оксид свинца (II, IV) – PbOPbO2.
Оксид | химическое соединение | Британика
оксид железа
Посмотреть все СМИ
- Ключевые люди:
- Джозеф Пристли
- Похожие темы:
- вода оксид серы глинозем диоксид титана оксидный минерал
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
оксид , любое из большого и важного класса химических соединений, в которых кислород связан с другим элементом.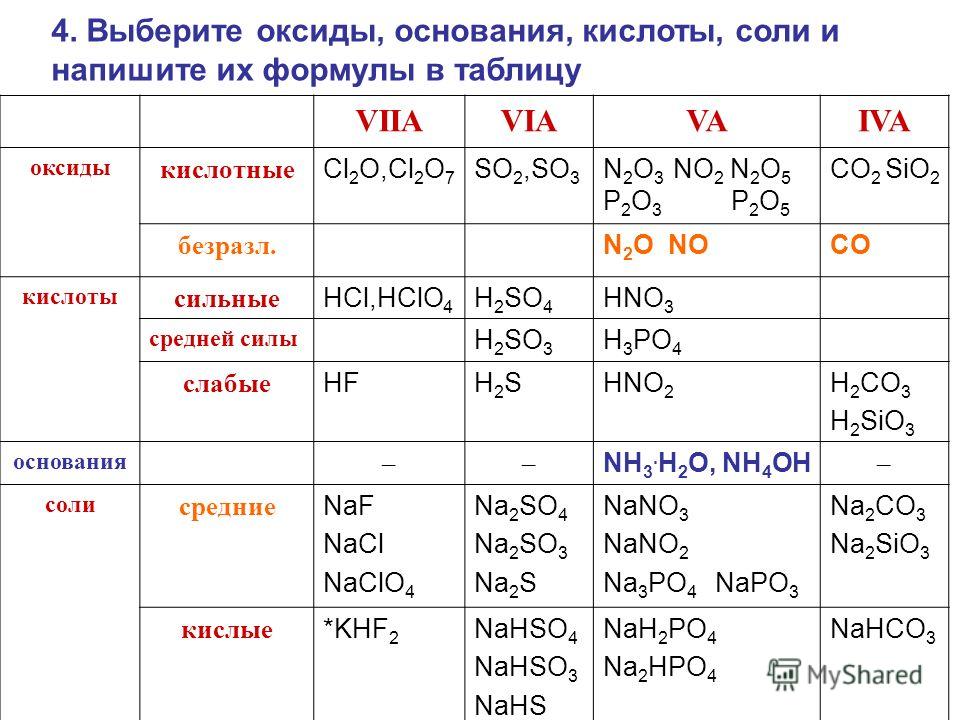 За исключением более легких инертных газов (гелия [He], неона [Ne], аргона [Ar] и криптона [Kr]), кислород (O) образует по крайней мере один бинарный оксид с каждым из элементов.
За исключением более легких инертных газов (гелия [He], неона [Ne], аргона [Ar] и криптона [Kr]), кислород (O) образует по крайней мере один бинарный оксид с каждым из элементов.
И металлы, и неметаллы могут достигать наивысших степеней окисления (т. е. отдавать максимальное количество доступных валентных электронов) в соединениях с кислородом. Щелочные и щелочноземельные металлы, а также переходные и постпереходные металлы (в их низших степенях окисления) образуют ионные оксиды, т. е. соединения, содержащие О 2- анион. Металлы с высокими степенями окисления образуют оксиды, связи которых имеют более ковалентный характер. Неметаллы также образуют ковалентные оксиды, которые обычно имеют молекулярный характер. Плавное изменение типа связи в оксидах от ионных к ковалентным наблюдается по мере того, как периодическая таблица перемещается от металлов слева к неметаллам справа. Такая же вариация наблюдается в реакции оксидов с водой и обусловленном этим кислотно-основном характере продуктов. Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих OH − ion) и образующиеся в результате основные растворы, в то время как большинство оксидов неметаллов реагируют с водой с образованием кислот и образующихся кислотных растворов ( см. в таблице).
Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих OH − ion) и образующиеся в результате основные растворы, в то время как большинство оксидов неметаллов реагируют с водой с образованием кислот и образующихся кислотных растворов ( см. в таблице).
| группа 1 | группа 2 | группа 13 | группа 14 | группа 15 | группа 16 | группа 17 | |
|---|---|---|---|---|---|---|---|
Источник: Из W. Robinson, J. Odom, and H. Holtzclaw, Jr., Chemistry: Concepts and Models, DC Heath and Co. , 1992. , 1992. | |||||||
| реакция оксидов с водой и кислотно-щелочной характер гидроксидов | Na 2 O дает NaOH (сильное основание) | MgO дает Mg(OH) 2 (слабое основание) | Al 2 O 3 нереагирующий | SiO 2 нереагирующий | P 4 O 10 дает H 3 PO 4 (слабая кислота) | SO 3 дает H 2 SO 4 (сильная кислота) | Кл 2 O 7 дает HClO 4 (сильная кислота) |
| связывание в оксидах | Na 2 O ионный | ионный MgO | Al 2 O 3 ионный | SiO 2 ковалентная | P 4 O 10 ковалентная | СО 3 ковалентный | Cl 2 O 7 ковалентная |
Некоторые органические соединения реагируют с кислородом или другими окислителями с образованием веществ, называемых оксидами. Так, амины, фосфины и сульфиды образуют аминооксиды, фосфиноксиды и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические эфиры.
Так, амины, фосфины и сульфиды образуют аминооксиды, фосфиноксиды и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические эфиры.
Оксиды металлов представляют собой твердые кристаллические вещества, содержащие катион металла и анион оксида. Обычно они реагируют с водой с образованием оснований или с кислотами с образованием солей.
Щелочные металлы и щелочноземельные металлы образуют три различных типа бинарных соединений кислорода: (1) оксиды, содержащие оксид-ионы, O 2– , (2) пероксиды, содержащие пероксид-ионы, O 2 2– , которые содержат ковалентные одинарные связи кислород-кислород, и (3) супероксиды, содержащие ионы супероксида, O 2 − , которые также имеют ковалентные связи кислород-кислород, но имеют на один отрицательный заряд меньше, чем ионы перекиси. Щелочные металлы (имеющие степень окисления +1) образуют оксиды M 2 O, пероксиды M 2 O 2 и супероксиды MO 2 .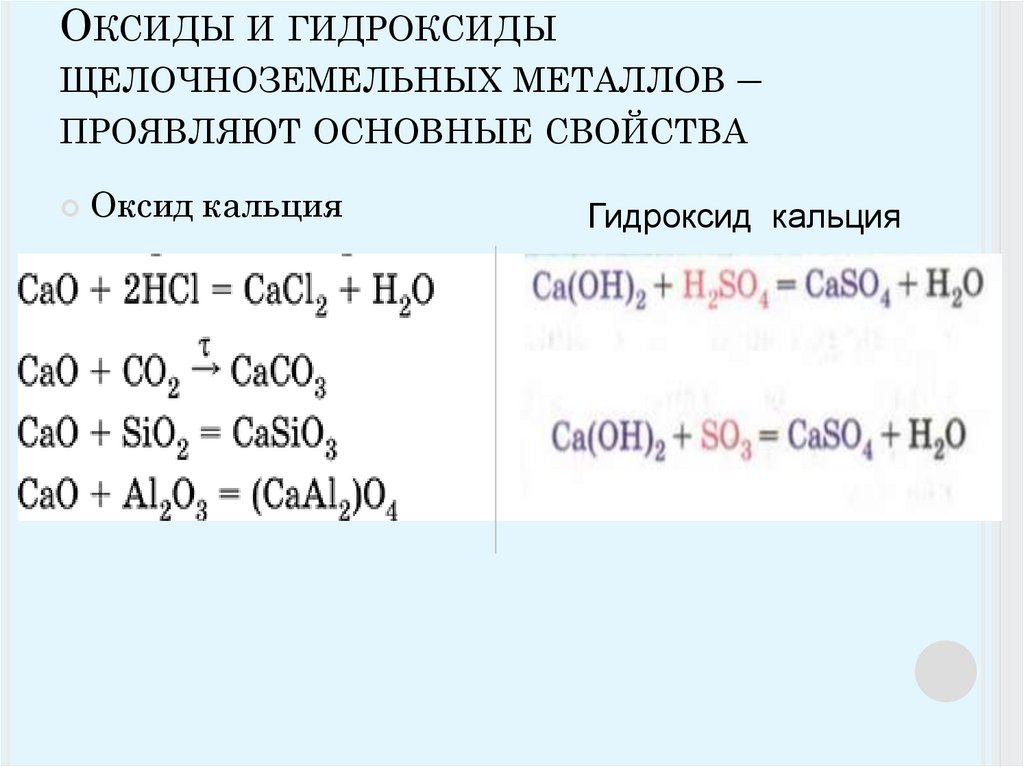 (M представляет собой атом металла.) Щелочноземельные металлы (со степенью окисления +2) образуют только оксиды, MO, и пероксиды, MO 2 . Все оксиды щелочных металлов могут быть получены нагреванием соответствующего нитрата металла с элементарным металлом.
2МНО 3 + 10M + тепло → 6M 2 O + N 2 Общее получение оксидов щелочноземельных металлов включает нагревание карбонатов металлов.
MCO 3 + тепло → MO + CO 2 Как оксиды щелочных металлов, так и оксиды щелочноземельных металлов являются ионными и реагируют с водой с образованием основных растворов гидроксида металла.
M 2 O + H 2 O → 2MOH (где M = металл группы 1)
(M представляет собой атом металла.) Щелочноземельные металлы (со степенью окисления +2) образуют только оксиды, MO, и пероксиды, MO 2 . Все оксиды щелочных металлов могут быть получены нагреванием соответствующего нитрата металла с элементарным металлом.
2МНО 3 + 10M + тепло → 6M 2 O + N 2 Общее получение оксидов щелочноземельных металлов включает нагревание карбонатов металлов.
MCO 3 + тепло → MO + CO 2 Как оксиды щелочных металлов, так и оксиды щелочноземельных металлов являются ионными и реагируют с водой с образованием основных растворов гидроксида металла.
M 2 O + H 2 O → 2MOH (где M = металл группы 1)
MO + H 2 O → M(OH) 2 (где M = металл группы 2)
Поэтому эти соединения часто называют основными оксидами. В соответствии со своим основным поведением они реагируют с кислотами в типичных кислотно-щелочных реакциях с образованием солей и воды; например,
М 2 O + 2HCl → 2MCl + H 2 O (где M = металл группы 1).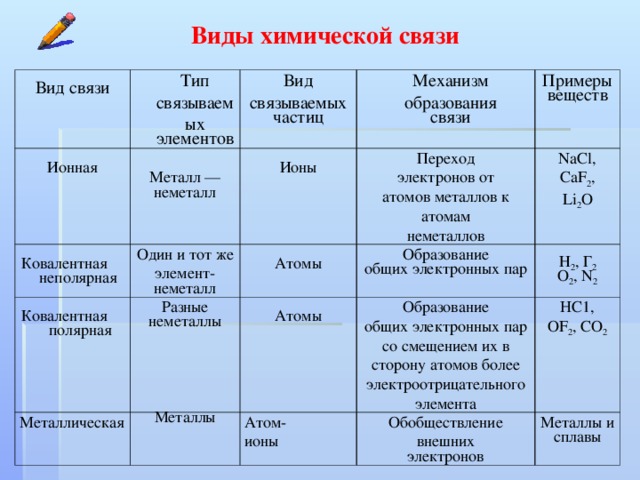 Эти реакции также часто называют реакциями нейтрализации. Наиболее важными основными оксидами являются оксид магния (MgO), хороший проводник тепла и электрический изолятор, который используется в огнеупорном кирпиче и теплоизоляции, и оксид кальция (CaO), также называемый негашеной известью или известью, широко используемый в сталелитейной промышленности и в воде. очищение.
Эти реакции также часто называют реакциями нейтрализации. Наиболее важными основными оксидами являются оксид магния (MgO), хороший проводник тепла и электрический изолятор, который используется в огнеупорном кирпиче и теплоизоляции, и оксид кальция (CaO), также называемый негашеной известью или известью, широко используемый в сталелитейной промышленности и в воде. очищение.
Тщательно изучены периодические тренды оксидов. В любой данный период связь в оксидах прогрессирует от ионной к ковалентной, а их кислотно-основной характер меняется от сильно основного к слабоосновному, амфотерному, слабокислому и, наконец, сильнокислому. Как правило, основность увеличивается вниз по группе (например, в оксидах щелочноземельных металлов BeO < MgO < CaO < SrO < BaO). Кислотность увеличивается с увеличением степени окисления элемента. Например, из пяти оксидов марганца MnO (в котором марганец имеет степень окисления +2) является наименее кислотным, а Mn 2 O 7 (содержащий Mn 7+ ) наиболее кислый.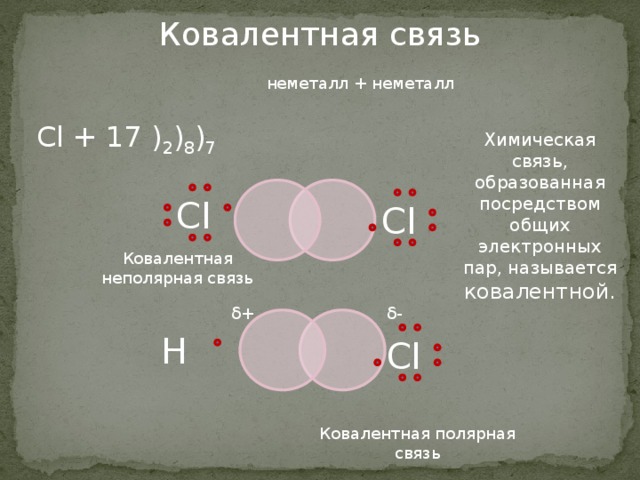 Оксиды переходных металлов со степенями окисления +1, +2 и +3 представляют собой ионные соединения, состоящие из ионов металлов и ионов оксидов. Эти оксиды переходных металлов со степенями окисления +4, +5, +6 и +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород. Как правило, ионные оксиды переходных металлов являются основными. То есть они будут реагировать с водными кислотами с образованием растворов солей и воды; например,
СоО + 2Н 3 О + → Co 2+ + 3H 2 О.
Оксиды со степенями окисления +5, +6 и +7 являются кислыми и реагируют с растворами гидроксида с образованием солей и воды; например,
CrO 3 + 2OH — → CrO 4 2− + H 2 O.
Оксиды со степенью окисления +4 обычно являются амфотерными (от греческого amphoteros, «в обоих направлениях»), что означает, что эти соединения могут вести себя либо как кислоты, либо как основания. Амфотерные оксиды растворяются не только в кислых, но и в основных растворах.
Оксиды переходных металлов со степенями окисления +1, +2 и +3 представляют собой ионные соединения, состоящие из ионов металлов и ионов оксидов. Эти оксиды переходных металлов со степенями окисления +4, +5, +6 и +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород. Как правило, ионные оксиды переходных металлов являются основными. То есть они будут реагировать с водными кислотами с образованием растворов солей и воды; например,
СоО + 2Н 3 О + → Co 2+ + 3H 2 О.
Оксиды со степенями окисления +5, +6 и +7 являются кислыми и реагируют с растворами гидроксида с образованием солей и воды; например,
CrO 3 + 2OH — → CrO 4 2− + H 2 O.
Оксиды со степенью окисления +4 обычно являются амфотерными (от греческого amphoteros, «в обоих направлениях»), что означает, что эти соединения могут вести себя либо как кислоты, либо как основания. Амфотерные оксиды растворяются не только в кислых, но и в основных растворах. Например, оксид ванадия (VO 2 ) представляет собой амфотерный оксид, растворяющийся в кислоте с образованием синего иона ванадила, [VO] 2+ , и в основании с образованием желто-коричневого гипованадат-иона, [V 4 O 9 ] 2− . Амфотеризм среди оксидов основной группы в первую очередь обнаруживается у металлоидных элементов или их близких соседей.
Например, оксид ванадия (VO 2 ) представляет собой амфотерный оксид, растворяющийся в кислоте с образованием синего иона ванадила, [VO] 2+ , и в основании с образованием желто-коричневого гипованадат-иона, [V 4 O 9 ] 2− . Амфотеризм среди оксидов основной группы в первую очередь обнаруживается у металлоидных элементов или их близких соседей.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Период 3 Оксиды: элементы и свойства
Промышленное стекло содержит около 70% диоксида кремния и 15% оксида натрия. Эти два оксида являются обычными примерами оксиды периода 3 , которые образуются в результате реакции между элементом периода 3 и кислородом.
- Эта статья посвящена оксидам периода 3 в неорганической химии.
- Начнем с рассмотрения соединения в оксидах периода 3.

- Затем мы увидим, как это влияет на некоторые их свойства, такие как температура плавления и электропроводность , а также степень окисления .
- После этого мы рассмотрим их реакции с водой, кислотами и основаниями . Это потребует рассмотрения их кислотно-щелочного поведения .
- Наконец, мы также исследуем некоторые другие соединения периода 3, а именно гидроксиды периода 3 и хлориды .
Связывание в оксидах периода 3
Для начала рассмотрим связывание оксидов периода 3. Это поможет нам понять, когда мы будем исследовать свойства и реакции оксидов периода 3 позже.
Существует множество различных оксидов 3-го периода, но в этой статье мы ограничим наше исследование только Na 2 O, MgO, Al 2 O 3 , SiO 2 , P 4 O 10 , SO 2 и SO 3 .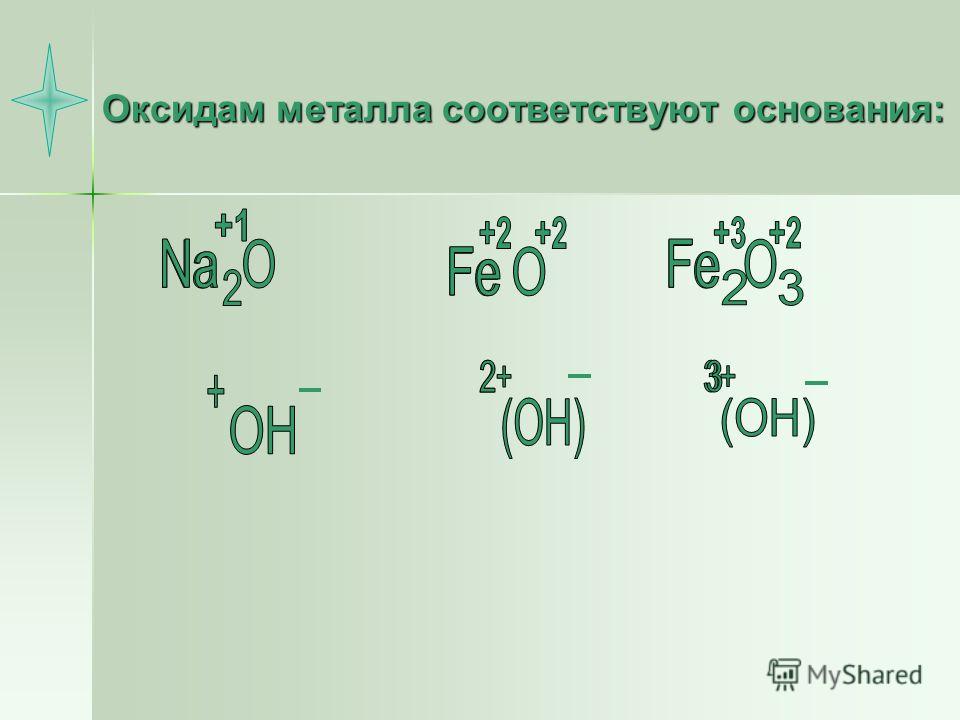 Чтобы упростить жизнь, мы разделили их на две группы: оксиды металлов (Na 2 O, MgO и Al 2 O 3 ) и оксиды неметаллов (SiO 2 , P 4). O 10 , SO 2 и SO 3 ).
Чтобы упростить жизнь, мы разделили их на две группы: оксиды металлов (Na 2 O, MgO и Al 2 O 3 ) и оксиды неметаллов (SiO 2 , P 4). O 10 , SO 2 и SO 3 ).
Если вы хотите узнать, как образуются эти оксиды, посмотрите «Элементы периода 3», чтобы узнать о различных реакциях.
В общем, при движении слева направо по периоду связь в оксидах периода 3 меняется с ионной на ковалентной . Это связано с разницей электроотрицательностей между элементом периода 3 и кислородом.
Оксиды металлов
Na 2 O и MgO являются ионными соединениями . Это происходит потому, что между металлом и кислородом существует большая разница электроотрицательностей . Они состоят из гигантских решеток чередующихся положительных ионов металлов и отрицательных ионов кислорода.
Al 2 O 3 также является ионным, но имеет ковалентный характер . Хотя разница электроотрицательностей между алюминием и кислородом достаточно велика для переноса электронов, образующих ионную связь, ион алюминия довольно мал и имеет высокая плотность заряда . Это означает, что он частично способен притягивать одну из пар электронов иона кислорода, искажая электронное облако иона кислорода. Электронная пара начинает действовать как общих пар электронов .
Оксиды неметаллов
SiO 2 представляет собой гигантскую ковалентную макромолекулу . Разница в электроотрицательности между кремнием и кислородом не так велика, поэтому SiO 2 связывает ковалентно . Он состоит из гигантская решетка атомов кремния и кислорода, соединенных ковалентными связями.
P 4 O 10 , SO 2 и SO 3 также связаны ковалентно.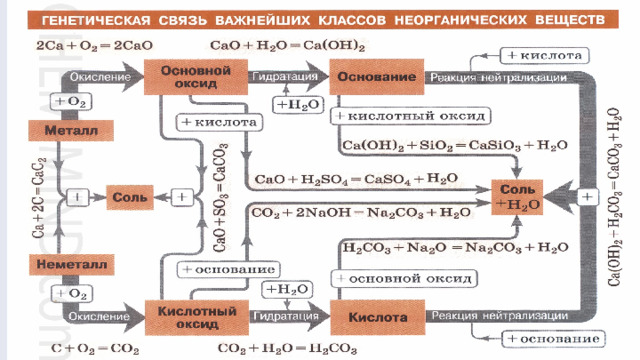 Однако они образуют простых ковалентных молекул вместо гигантской ковалентной макромолекулы.
Однако они образуют простых ковалентных молекул вместо гигантской ковалентной макромолекулы.
Рис. 1 – Электроотрицательность в периодической таблице
Свойства оксидов периода 3
Далее посмотрим, как структура и связи оксидов периода 3 влияют на их свойства. В частности, мы сосредоточимся на температура плавления и электропроводность . Мы также рассмотрим степень окисления .
Температура плавления оксидов периода 3
Оксиды металлов периода 3 имеют высоких температур плавления , а простые ковалентные оксиды имеют низких температур плавления . Однако гигантская макромолекула SiO 2 имеет очень высокую температуру плавления .
Оксиды металлов
Na 2 O, MgO и Al 2 O 3 имеют высокую температуру плавления . Это потому, что они представляют собой ионные соединения , удерживаемые вместе в виде твердого тела сильным электростатическим притяжением между их положительными ионами металлов и отрицательными ионами кислорода. MgO и Al 2 O 3 имеют более высокие температуры плавления, чем Na 2 O, потому что они содержат ионы металлов с более высоким зарядом .
MgO и Al 2 O 3 имеют более высокие температуры плавления, чем Na 2 O, потому что они содержат ионы металлов с более высоким зарядом .
Оксиды неметаллов
SiO 2 имеет очень высокую температуру плавления , потому что это гигантская ковалентная макромолекула . Он состоит из решетки атомов кремния и кислорода, вытянутых во всех направлениях, скрепленных сильными ковалентными связями . Плавление SiO 2 включает преодоление этих ковалентных связей, что требует много энергии.
P 4 O 10 , SO 2 и SO 3 имеют низкую температуру плавления . Это потому, что они представляют собой простых ковалентных молекул . Хотя существуют сильные ковалентные связи внутри молекул, единственными силами, удерживающими молекулы вместе как твердое тело, являются слабые межмолекулярные силы , для преодоления которых не требуется много энергии.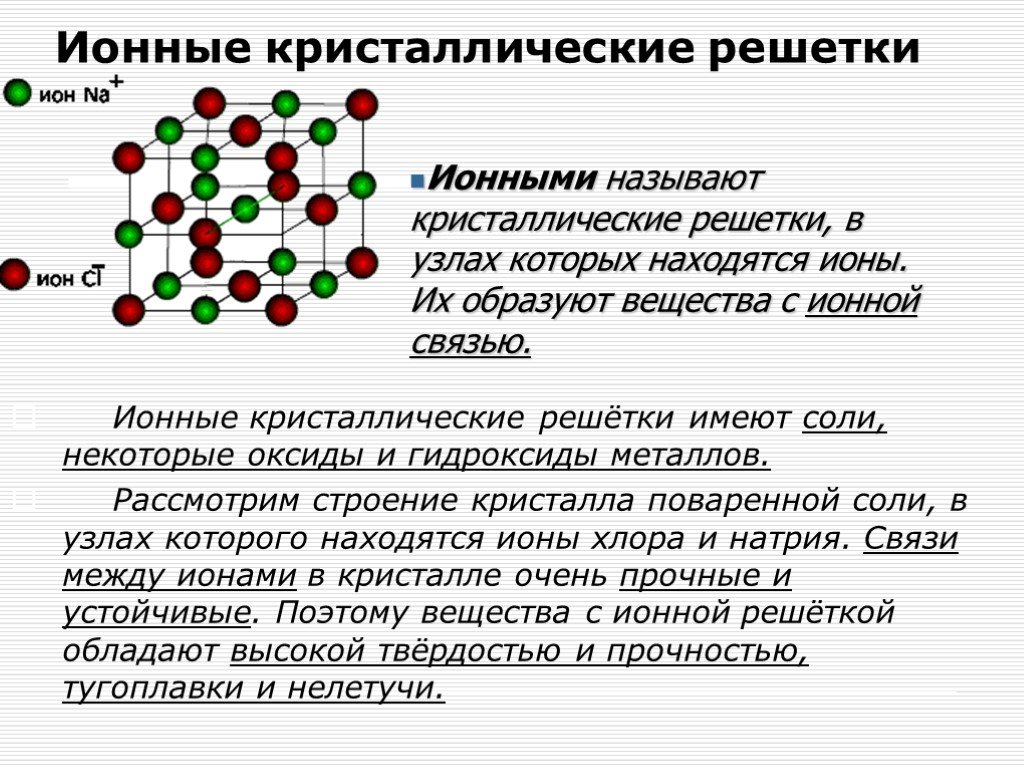 P 4 O 10 имеет более высокую температуру плавления, чем SO 3 , который, в свою очередь, имеет более высокую температуру плавления, чем SO 2 , из-за того, что это более крупная молекула .
P 4 O 10 имеет более высокую температуру плавления, чем SO 3 , который, в свою очередь, имеет более высокую температуру плавления, чем SO 2 , из-за того, что это более крупная молекула .
Ознакомьтесь с разделом «Физические свойства склеивания», чтобы узнать больше по этой теме.
Электропроводность
В твердом состоянии ни один из оксидов периода 3 не может проводить электричество . Однако это меняется в других состояниях.
Оксиды металлов
Оксиды металлов периода 3 (Na 2 O, MgO и Al 2 O 3 ) могут проводить электричество в расплавленном водном растворе или . Помните, что оксиды металлов состоят из ионной решетки положительных ионов металлов и отрицательных ионов кислорода. В твердом состоянии эти ионы прочно фиксируются на месте сильное электростатическое притяжение , поэтому нет свободных заряженных частиц. Однако в расплавленном или водном состоянии часть электростатического притяжения преодолевается, и ионы могут перемещаться и нести заряд .
Однако в расплавленном или водном состоянии часть электростатического притяжения преодолевается, и ионы могут перемещаться и нести заряд .
Оксиды неметаллов
Оксиды неметаллов периода 3 (SiO 2 , P 4 O 10 , SO 2 и SO 3 2 ) не проводят электричество в любом состоянии 6 ) Это потому, что они не содержат заряженных частиц, которые могут нести заряд.
Степень окисления
Теперь давайте попробуем вычислить степеней окисления оксидов периода 3.
Степени окисления , также известные как степени окисления , показывают количество электронов, которое элемент должен потерять или получить по сравнению с его несвязанным состоянием.
Ранее в этой статье мы рассмотрели относительную электроотрицательность кислорода и элементов периода 3. Кислород более электроотрицателен, чем все они. Это означает, что когда дело доходит до оксидов 3-го периода, кислород всегда занимает 9-е место.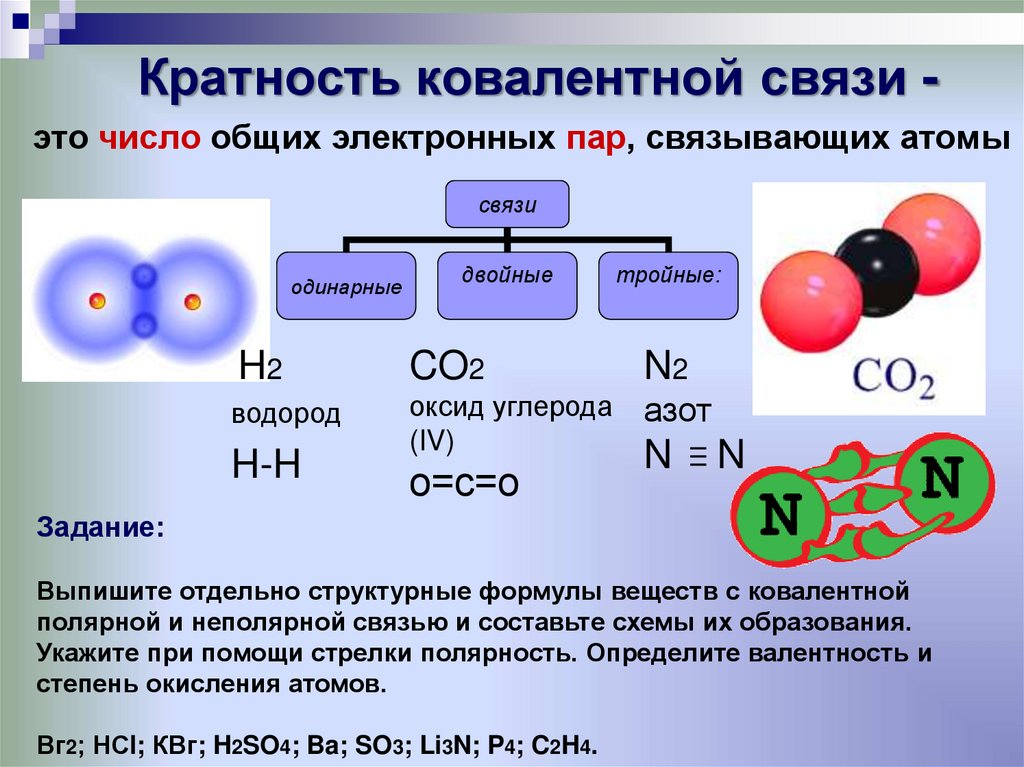 0025 низшая степень окисления . В частности, он всегда принимает степень окисления -2. Сумма степеней окисления в нейтральном соединении всегда равна нулю , поэтому, используя это знание, мы можем вычислить степени окисления соответствующего элемента периода 3. Эта таблица должна помочь:
0025 низшая степень окисления . В частности, он всегда принимает степень окисления -2. Сумма степеней окисления в нейтральном соединении всегда равна нулю , поэтому, используя это знание, мы можем вычислить степени окисления соответствующего элемента периода 3. Эта таблица должна помочь:
Рис. 2 — Степени окисления оксидов периода 3
Реакции оксидов периода 3
Оксиды периода 3 имеют одну общую черту: все они содержат кислород. Однако это не означает, что они реагируют одинаково. В следующем разделе мы рассмотрим, как оксиды периода 3 реагируют с 9.0025 кислород , кислоты, и основания . Это предполагает рассмотрение их кислотно-щелочной природы .
Кислота является донором протонов, , а основание является акцептором протонов .
Перейдите к разделу «Кислоты и щелочи», если вы впервые освещаете такого рода соединения.
Оксиды металлов в левой части периода 3 имеют тенденцию быть основными по своей природе, а оксиды неметаллов кислотными .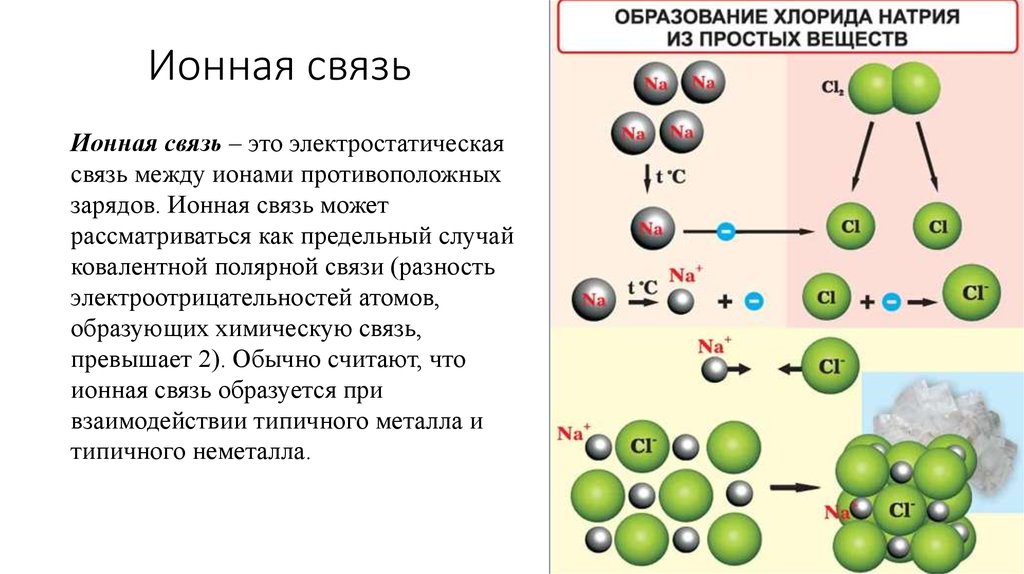 Ал 2 О 3 находится посередине и является амфотерным .
Ал 2 О 3 находится посередине и является амфотерным .
Реакции оксидов периода 3 с водой
Обычно оксиды металлов периода 3 являются основными по своей природе. Это означает, что они реагируют с водой с образованием гидроксида , образуя основной раствор. С другой стороны, оксиды неметаллов периода 3 являются кислыми по своей природе. Они реагируют с водой с образованием кислоты .
Оксиды металлов
Na 2 O и MgO реагируют с водой с образованием гидроксиды . Они делают это из-за их ионной связи. Они содержат сильноосновных оксидных ионов (O 2 — ) благодаря большой разнице электроотрицательностей между металлом и кислородом. Ион кислорода может принять ион водорода из раствора, действуя как основание.
- Na 2 O реагирует с водой с образованием NaOH, который диссоциирует на ионы Na + и OH — .

- MgO реагирует с водой с образованием Mg(OH) 2 , который мало растворим и частично диссоциирует на ионы Mg 2+ и ОН — .
Вот уравнения:
$$ Na_2O(т)+H_2O(ж)\rightarrow 2NaOH(вод) $$
$$ MgO(т)+H_2O(ж)\rightarrow Mg(OH)_2( aq) $$
С другой стороны, Al 2 O 3 является нерастворимым в воде и поэтому никак не реагирует.
Оксиды неметаллов
P 4 O 10 , SO 2 и SO 3 реагирует с водой с образованием кислот . Поскольку они связаны ковалентно, они не содержат ионов кислорода и поэтому не могут действовать как основания. Вместо этого они могут отдавать ион водорода в растворе, что означает, что они действуют как кислота.
- P 4 O 10 Реагирует с водой с образованием H 3 PO 4 , который частично диссоциирует на H + и H 2 PO 4 111919 —.
 3030.
3030. - SO 2 реагирует с водой с образованием H 2 SO 3 (сера ous кислота), которая частично диссоциирует на ионы H + и HSO 3 — .
- SO 3 реагирует с водой с образованием H 2 SO 4 (сера ic кислота), которая полностью диссоциирует на H + и HSO 4 — ионы.
Вам необходимо знать уравнения:
$$ P_4O_{10}(s)+6H_2O(l)\rightarrow 4H_3PO_4(aq) $$
$$ SO_2(g)+H_2O(l)\ rightarrow H_2SO_3(водн.) $$
$$ SO_3(г) + H_2O(ж)\rightarrow H_2SO_4(вод) $$
Как и Al 2 O 3 , SiO 2 нерастворим в воде. В воде никак не прореагирует.
Не путайте серосодержащие кислоты. Вот структуры серной кислоты H 2 SO 3 и серной кислоты H 2 SO 4 .
Рис. 3 – Сернистая и серная кислоты
Период 3 реакции оксидов с кислотами и основаниями
Теперь мы знаем, что два из трех оксидов металлов периода 3 являются основными по своей природе. Они, следовательно, реагируют с кислотами . Напротив, оксиды неметаллов периода 3 являются кислотными по своей природе и поэтому реагируют с основаниями. Al 2 O 3 находится между двумя группами и является амфотерным по своей природе.
Они, следовательно, реагируют с кислотами . Напротив, оксиды неметаллов периода 3 являются кислотными по своей природе и поэтому реагируют с основаниями. Al 2 O 3 находится между двумя группами и является амфотерным по своей природе.
Оксиды металлов
Na 2 O и MgO действуют как основания по , реагируя с кислотами с образованием соли и вода. Это потому, что они связывают ионно. Например:
- Реакция Na 2 O с HCl дает NaCl и H 2 O.
- Реакция MgO с HCl дает MgCl 2 и H 2 O. Уравнения показаны ниже:
$$ Na_2O(S+2HCl(водн.)\rightarrow 2NaCl(водн.)+H_2O(л) $$
$$ MgO(т)+2HCl(водн.)\rightarrow MgCl_2(водн.)+H_2O(ж) $ $
Al 2 O 3 немного другое – это амфотерный .
 Это означает, что он может вести себя как как кислота, так и как основание . Как и другие оксиды металлов периода 3, он действует как основание , реагируя с кислотой с образованием соли и воды благодаря своей ионной связи . Здесь ион алюминия имеет положительных заряда . Но он также может действовать как кислота на , реагируя с основаниями , благодаря своему ковалентному характеру . В этом случае мы формируем алюминат , соединение, в котором ион алюминия имеет отрицательный заряд . Например:
Это означает, что он может вести себя как как кислота, так и как основание . Как и другие оксиды металлов периода 3, он действует как основание , реагируя с кислотой с образованием соли и воды благодаря своей ионной связи . Здесь ион алюминия имеет положительных заряда . Но он также может действовать как кислота на , реагируя с основаниями , благодаря своему ковалентному характеру . В этом случае мы формируем алюминат , соединение, в котором ион алюминия имеет отрицательный заряд . Например:- Reacting AL 2 O 3 с HCL. условия, одним из которых может быть NaAl(OH) 4 .
Вот уравнения:
$$ Al_2O_3(s) + 6HCl(aq)\rightarrow 2AlCl_3(aq)+3H_2O(l) $$
$$ Al_2O_3(тв)+2NaOH(вод)+3H_2O(ж)+2NaAl(OH)_4(вод) $$
Оксиды неметаллов
SiO 2 , P 4 O 1 70 , SO 2 и SO 3 действуют как кислоты по , реагируя с основаниями с образованием соли и воды.
 Это потому, что они связывают ковалентно . Например:
Это потому, что они связывают ковалентно . Например:- Взаимодействие SiO 2 с NaOH дает NaSiO 3 и H 2 O.
- Реакция P 4 O 10 с NaOH аналогична реакции фосфорной кислоты с NaOH. Он производит смесь солей, включая Na 3 PO 4 , а также H 2 O.
- Реакция SO 2 с NaOH аналогична реакции сернистой кислоты с NaOH. В целом получается Na 2 SO 3 и H 2 O.
- Реакция SO 3 с NaOH аналогична реакции серной кислоты с NaOH. В целом, он производит Na 2 SO 4 и H 2 O.
Еще раз, мы предоставили вам уравнения:
$$ SiO_2(s)+2NaOH(aq)\rightarrow Na_2SiO_3(aq)+H_2O (л) $$
$$ P_4O_{10}(т)+12NaOH(водн.)\rightarrow 4Na_3PO_4(водн.)+6H_2O $$
$$ SO_2(г)+2NaOH(водн.)\rightarrow Na_2SO_3(водн.) +H_2O(ж) $$
$$ SO_3(г)+2NaOH(водн.
 )\rightarrow Na_2SO_4(водн.)+H_2O(л) $$
)\rightarrow Na_2SO_4(водн.)+H_2O(л) $$Сводка реакций оксидов периода 3
Чтобы завершить этот раздел, вот полезная таблица, обобщающая реакции оксидов периода 3 и их кислотно-основную природу.
Рис. 4 – Реакции оксидов периода 3
Гидроксиды периода 3
Другой тип соединения периода 3, о котором вам может понадобиться знать, это гидроксиды периода 3 . В этом разделе мы рассмотрим реакции трех гидроксидов периода 3 — NaOH, Mg(OH) 2 и Al(OH) 3 — с кислотами и основаниями .
Проверьте, подпадают ли гидроксиды периода 3 под действие вашей спецификации .
Реакции с кислотами и основаниями
Как NaOH, так и Mg(OH) 2 действуют как типичные основания . Они реагируют с кислотами с образованием соли и воды. Например:
- Реакция NaOH с HCl дает NaCl и H 2 O.

- Реакция Mg(OH) 2 с HCl дает MgCl 2 и H 2 6 O. 902 уравнения :
$$ NaOH(водн.)+HCl(водн.)\rightarrow NaCl(водн.)+H_2O(л) $$
$$ Mg(OH)_2(водн.)+2HCl(водн.)\rightarrow MgCl_2(водн.) +2H_2O(л) $$
Al(OH) 3 ведет себя немного иначе – это амфотерный . Он действует как основание , реагируя с кислотой с образованием соли и воды. Но он также действует как кислота , реагируя с основаниями с образованием алюмината . Например:
- Реакция Al(OH) 3 с HCl дает AlCl 3 и H 2 O.
- Реакция Al(OH) 3 с NaOH дает NaAl(OH) 4 .
Уравнения для этих реакций приведены ниже:
$$ Al(OH)_3(водн.)+2HCl(водн.)\rightarrow AlCl_3(водн.)+ 3H_2O(ж) $$
$$ Al(OH)_3 (водн.)+NaOH_(водн.)\rightarrow NaAl(OH)_4(водн.
 ) $$
) $$Хлориды периода 3
Последнее, что у нас сегодня на повестке дня, это хлориды периода 3. Мы рассмотрим их точек плавления , степень окисления и их реакцию с водой .
Температура плавления
Как правило, период 3 хлориды металлов имеют с высокой температурой плавления , в то время как хлориды неметаллов периода 3 имеют низкую температуру плавления . AlCl 3 является аномалией – несмотря на то, что он является хлоридом металла, он имеет низкую температуру плавления .
Хлориды металлов
Как NaCl, так и MgCl 2 имеют высокие температуры плавления . Это потому, что они представляют собой ионных соединений . Благодаря большой разнице в электроотрицательности между металлом и хлором они способны связывать ионно , а твердое тело удерживается вместе сильным электростатическим притяжением между противоположно заряженными ионами.

AlCl 3 немного отличается. При комнатной температуре и давлении он ионно связывает с , поэтому можно ожидать, что он будет иметь высокую температуру плавления. Но по мере повышения температуры он превращается из ионной решетки в простые молекулы Al 2 Cl 6 , которые со временем распадаются на более мелкие молекулы AlCl 3 . Это оба примера простые ковалентные молекулы . Они удерживаются вместе как твердое тело слабыми межмолекулярными силами , для преодоления которых не требуется много энергии, поэтому AlCl 3 на самом деле имеет низкую температуру плавления .
Хлориды неметаллов
SiCl 4 , PCl 5 , SCl 2 и S 2 Cl 2 имеют низкие температуры плавления . Это потому, что они представляют собой простых ковалентных молекул . Единственными силами, удерживающими их вместе как твердое тело, являются слабые межмолекулярные силы , для преодоления которых не требуется много энергии.

Степень окисления
Во всех хлоридах периода 3 хлор принимает отрицательную степень окисления -1. Это потому, что он на более электроотрицательный , чем элемент периода 3, с которым он связан. Сумма степеней окисления атомов в нейтральном соединении всегда равна нулю , и исходя из этого, вы можете вычислить степень окисления элемента периода 3. Запомнить довольно просто – за исключением SCl 2 и S 2 Cl 2 степень окисления соответствует номеру группы элемента. В следующей таблице собрана информация для вас.
Рис. 5. Степени окисления хлоридов периода 3
Реакция с водой
Наконец, мы исследуем реакций хлоридов периода 3 с водой , в том числе взглянем на pH образовался раствор. Обычно хлориды металлов просто растворяются в воде , тогда как хлориды неметаллов реагируют более энергично .
 И снова AlCl 3 противоречит тенденции, реагируя как хлорид неметалла.
И снова AlCl 3 противоречит тенденции, реагируя как хлорид неметалла.Хлориды металлов
NaCl и MgCl 2 оба растворяются в воде . Они делают это благодаря своей ионной связи . NaCl образует нейтральный раствор ионов Na + и Cl — с рН 7 , тогда как MgCl 2 образует слабокислый раствор ионов Mg 2+ и Cl — с рН около 6 .
AlCl 3 действует по-другому благодаря своему ковалентному характеру . Он реагирует с водой с образованием кислого раствора с pH около 3 , выделяя пары HCl .
Хлориды неметаллов
Другие хлориды неметаллов реагируют так же, как AlCl 3 , благодаря их ковалентным связям . Они реагируют с водой, образуя кислых растворов , каждый с рН около 2 .
 Все реакции выделяют паровые пары HCl .
Все реакции выделяют паровые пары HCl .Существуют четкие тенденции во всех различных свойствах и реакциях. Знание некоторых ключевых фактов, таких как тип связи, присутствующей в каждом соединении, должно помочь вам, когда речь идет об оксидах, гидроксидах и хлоридах периода 3.
Оксиды периода 3 – ключевые выводы
- Оксиды периода 3 представляют собой соединения, состоящие из период 3 элемент и кислород .
- Связь в оксидах периода 3 меняется с ионной на ковалентной по мере перемещения по периоду. Оксиды металлов имеют тенденцию быть ионными , в то время как оксиды неметаллов являются ковалентными . Оксид металла Al 2 O 3 является ионным, но имеет ковалентный характер .
- Оксиды металлов периода 3, как правило, имеют высоких температур плавления , в то время как оксиды неметаллов имеют низкая температура плавления .
 Оксид неметалла SiO 2 представляет собой гигантскую ковалентную макромолекулу и имеет очень высокую температуру плавления.
Оксид неметалла SiO 2 представляет собой гигантскую ковалентную макромолекулу и имеет очень высокую температуру плавления. - Оксиды металлов периода 3 имеют тенденцию быть основными по своей природе, в то время как оксиды неметаллов периода 3 являются кислотными . Оксид металла Al 2 O 3 находится в середине и является амфотерным .
- Гидроксиды металлов периода 3 имеют тенденцию быть основными по своей природе. Однако гидроксид металла Al(OH) 3 является амфотерным .
- Хлориды металлов периода 3 обычно имеют высоких температур плавления , в то время как хлориды неметаллов имеют низких температур плавления . Хлорид металла AlCl 3 является аномалией и имеет низкую температуру плавления .
- Хлориды металлов периода 3 склонны к растворению в воде , в то время как хлориды неметаллов реагируют более энергично .




 3030.
3030. Это означает, что он может вести себя как как кислота, так и как основание . Как и другие оксиды металлов периода 3, он действует как основание , реагируя с кислотой с образованием соли и воды благодаря своей ионной связи . Здесь ион алюминия имеет положительных заряда . Но он также может действовать как кислота на , реагируя с основаниями , благодаря своему ковалентному характеру . В этом случае мы формируем алюминат , соединение, в котором ион алюминия имеет отрицательный заряд . Например:
Это означает, что он может вести себя как как кислота, так и как основание . Как и другие оксиды металлов периода 3, он действует как основание , реагируя с кислотой с образованием соли и воды благодаря своей ионной связи . Здесь ион алюминия имеет положительных заряда . Но он также может действовать как кислота на , реагируя с основаниями , благодаря своему ковалентному характеру . В этом случае мы формируем алюминат , соединение, в котором ион алюминия имеет отрицательный заряд . Например: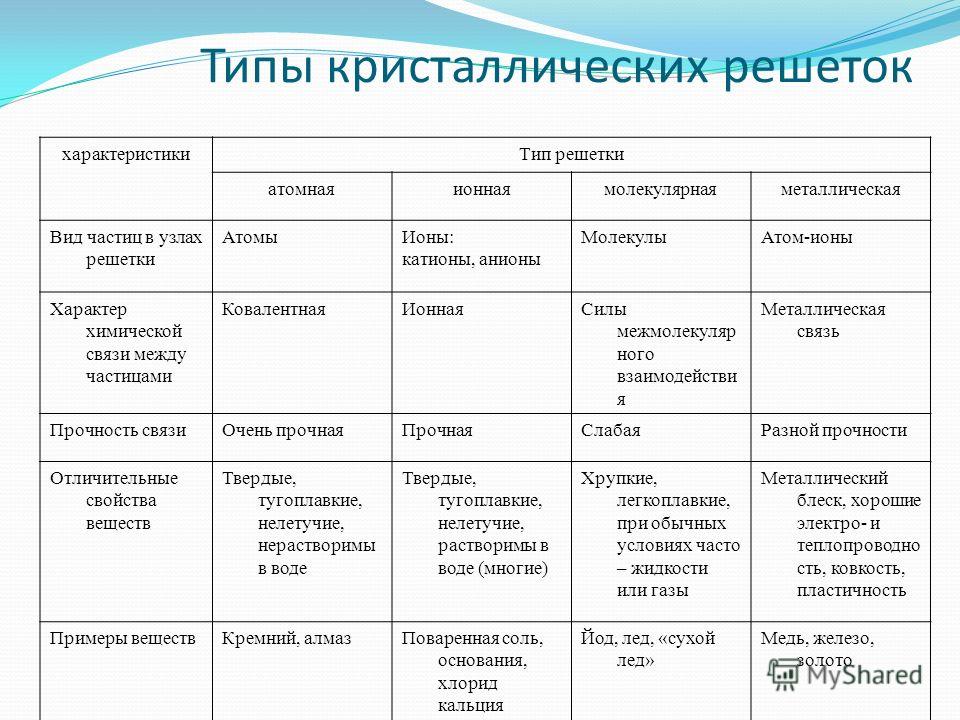 Это потому, что они связывают ковалентно . Например:
Это потому, что они связывают ковалентно . Например: )\rightarrow Na_2SO_4(водн.)+H_2O(л) $$
)\rightarrow Na_2SO_4(водн.)+H_2O(л) $$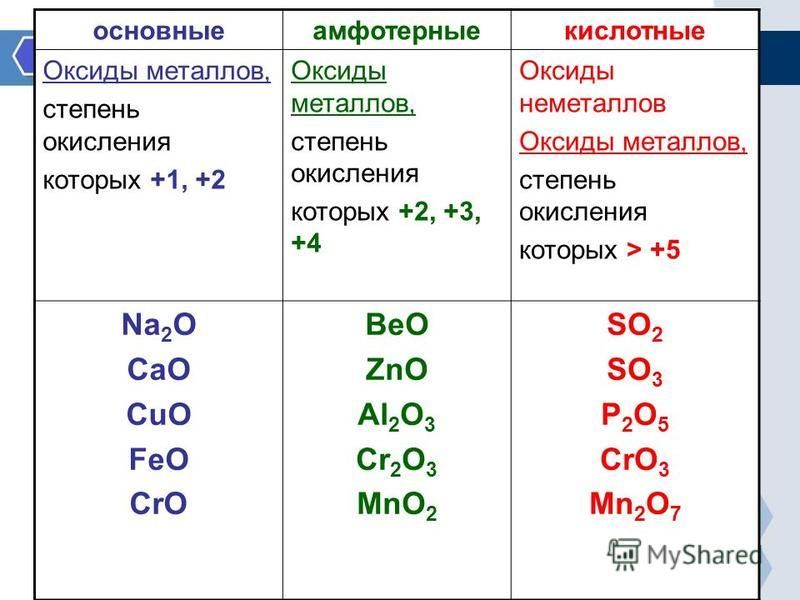
 ) $$
) $$

 И снова AlCl 3 противоречит тенденции, реагируя как хлорид неметалла.
И снова AlCl 3 противоречит тенденции, реагируя как хлорид неметалла. Все реакции выделяют паровые пары HCl .
Все реакции выделяют паровые пары HCl . Оксид неметалла SiO 2 представляет собой гигантскую ковалентную макромолекулу и имеет очень высокую температуру плавления.
Оксид неметалла SiO 2 представляет собой гигантскую ковалентную макромолекулу и имеет очень высокую температуру плавления. 
Leave A Comment