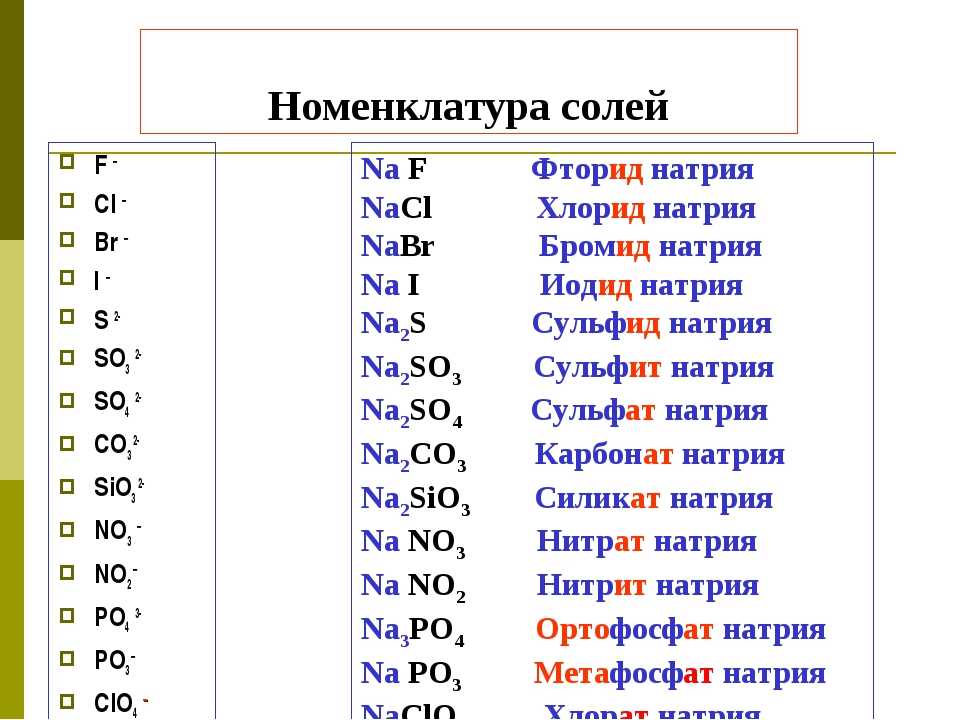
Задания для подготовки к ГИА, часть А. А7
Категория: Химия.
Задания для подготовки к ГИА, часть А. А7
А 7. Электролитическая диссоциация.
Тест 1
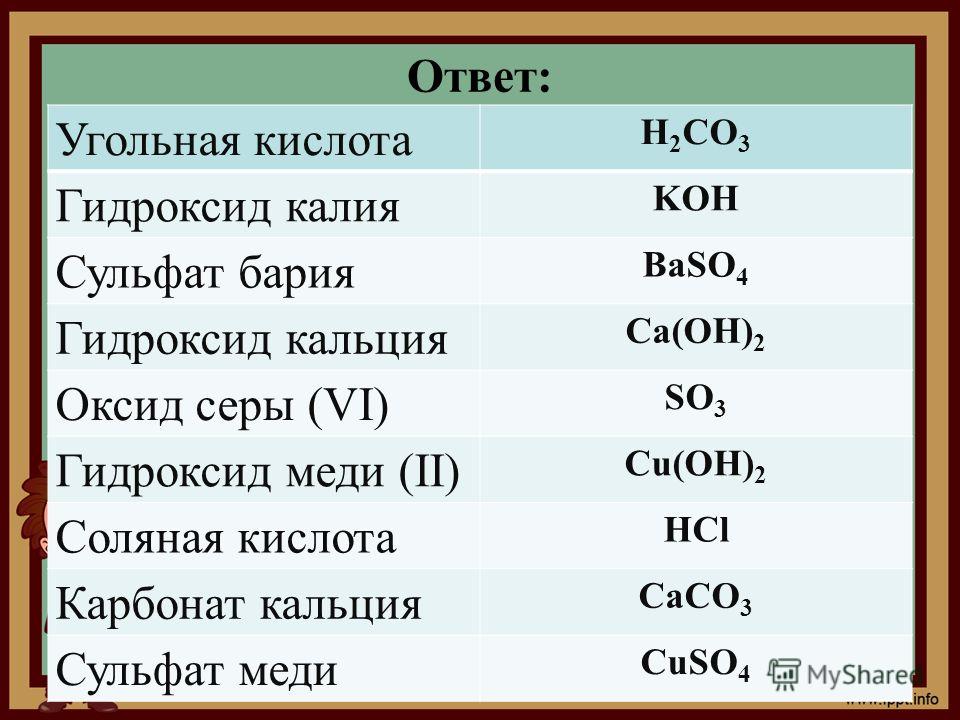
1. К хорошо растворимым электролитам относится
1) карбонат кальция 3) сульфид свинца
2) сульфат натрия 4) гидроксид хрома (III)
2. К неэлектролитам относится
1) карбонат аммония 3) бромоводород
2) этиловый спирт 4) нитрат цинка
3. Электрический ток не проводит
1) раствор хлороводорода
2) расплав сахара
3) раствор азотной кислоты
4) расплав сульфата натрия
4. Электрический ток проводит
1) расплав оксида кремния
2) расплав серы
3) водный раствор аммиака
4) водный раствор спирта
5. К хорошо растворимым электролитам относится
1) фосфат кальция 3) сульфид натрия
2) карбонат кальция 4) гидроксид железа (II)
6. К неэлектролитам относится
1) сульфат натрия 3) гидроксид бария
2) оксид серебра 4) нитрат лития
7. Неэлектролитом является
Неэлектролитом является
1) N2О 2) NaОН 3) К2СО3 4) NaHCO3
8. Электрическая лампочка не загорается при погружении электродов в
1) раствор бромоводорода
2) раствор азотистой кислоты
3) расплав оксида кремния
4) расплав нитрата натрия
Тест 2
1. Наибольшее количество ионов натрия образуется при диссоциации 1 моль
1) NаС1 2) Na2S 3) Nа3РО4 4) Nа2SО3
2. Наибольшее количество хлорид-ионов образуется в растворе при диссоциации 1 моль
1) хлорида меди (II) 3) хлорида кальция
2) хлорида хрома (III) 4) хлорида лития
3. С образованием катионов водорода в растворах диссоциируют
1) основные оксиды 3) основания
2) кислотные оксиды 4) кислоты
4. Укажите заряд катиона, образующегося на третьей стадии
диссоциации ортофосфорной кислоты.
1) +1 2) +2 3) +3 4) +4
5. Ионы ОН– образуются при диссоциации каждого из двух веществ:
1 ) НNO3 и СН3СООН 3) Са(ОН)2 и NаОН
2) Мg(ОН)С1 и Н2SО4 4) Са(НСО3)2 и Са(ОН)2
6. Выберите верную запись правой части
уравнения диссоциации фосфата натрия в водном растворе.
Выберите верную запись правой части
уравнения диссоциации фосфата натрия в водном растворе.
1) → Nа+ + Nа2РО4– 3) → 3Nа+ + РО43-
2) → 3Nа+ + 4РО3– 4) → Nа3+ + РО43-
7. Ионы Н+ образуются при диссоциации каждого из двух веществ:
1) Н2SО3 и С17Н35СООН 2) Н2S и Са(ОН)2
3) Си(ОН)С1 и Н2SО4 4) Са(НСО3)2 и Са(ОН)2
8. При полной диссоциации 1 моль нитрата хрома (III) в растворе образуется
1) 3 моль катионов хрома и 4 моль нитрат-ионов
2) 2 моль катионов хрома и 3 моль нитрат-ионов
3) 1 моль катионов хрома и 3 моль нитрат-ионов
4) 3 моль катионов хрома и 1 моль нитрат-ионов
9. С образованием катионов металла и анионов кислотного остатка диссоциирует
1) сахароза 3) бромид кальция
2) гидроксид натрия 4) азотная кислота
Ответы к части А
А1 | А2 | А4 | А5 | А6 | А7 | А8 | А9 | |
1. | 1. 3 | 1. 1 | 1. 2 | 1. 2 | 1. 2 | 1. 2 | 1. 2 | 1. 3 |
2. 1 | 2. 1 | 2. 1 | 2. 3 | 2. 1 | 2. 2 | 2. 2 | 2. 2 | |
3. 4 | 3. 2 | 3. 3 | 3. 1 | 3. 1 | 3. 3 | 3. 2 | 3. 1 | 3. 3 |
4. 3 | 4. 1 | 4. 3 | 4. 1 | 4. 1 | 4. 3 | 4. 3 | 4. 4 | 4. 1 |
5. 2 | 5. 1 | 5. 1 | 5. 4 | 5. 1 | 5. 1 | 5. | 5. 4 | 5. 1 |
6. 1 | 6. 2 | 6. 1 | 6. 1 | 6. 2 | 6. 2 | 6. 4 | ||
7. 1 | 7. 2 | 7. 2 | 1. 4 | 7. 2 | 7. 2 | 7. 1 | 1. 4 | 7. 2 |
8. 3 | 8. 4 | 8. 2 | 2. 4 | 8. 1 | 8. 3 | 8. 3 | 2. 2 | 8. 4 |
3. 1 | 3. 1 | |||||||
1. 1 | 1. 2 | 1. 4 | 4. 2 | 1. 2 | 1. 3 | 1. 3 | 4. 1 | 1. |
2. 4 | 2. 4 | 2. 3 | 5. 3 | 2. 1 | 2. 3 | 2. 2 | 5. 2 | 2. 1 |
3. 3 | 3. 1 | 3. 3 | 3. 2 | 3. 2 | 6. 1 | 3. 4 | ||
4. 2 | 4. 4 | 4. 2 | 1. 3 | 4. 1 | 4. 4 | 4. 1 | 4. 1 | |
5. 4 | 5. 2 | 5. 2 | 2. 4 | 5. 3 | 5. 2 | 5. 3 | 5. 3 | |
6. 3 | 6. 3 | 6. 3 | 3. 1 | 6. 1 | 6. 3 | 6. 3 | 6. | |
7. 2 | 7. 2 | 7. 4 | 4. 1 | 7. 3 | 7. 1 | 7. 2 | ||
8. 2 | 8. 3 | 8. 3 | 5. 1 | 8. 3 | 8. 3 | 8. 1 | ||
9. 3 | 9. 3 | |||||||
1. 1 | 1. 1 | |||||||
2. 4 | 2. 3 | |||||||
3. 2 | 3. 4 | |||||||
4. 1 | ||||||||
5. | ||||||||
6. 3 | ||||||||
7. 3 |
А10 | А11. 1 | А11. 2 | А12 | А13 | А14 | А15 |
1. 2 | 1. 4 | 1. 4 | 1. 1 | 1. 1 | 1. 2 | 1. 1 |
2. 2 | 2. 3 | 2. 1 | 2. 4 | 2. 1 | 2. 3 | 2. 4 |
3. 3 | 3. 1 | 3. 3 | 3. 1 | 3. 1 | 3. | 3. 2 |
4. 3 | 4. 3 | 4. 3 | 4. 4 | 4. 2 | 4. 1 | 4. 1 |
5. 1 | 5. 1 | 5. 2 | 5. 1 | 5. 4 | 5. 2 | |
6. 1 | 6. 2 | 6. 4 | 6. 4 | 6. 3 | 1. 4 | |
7. 4 | 7. 2 | 7. 4 | 1. 1 | 7. 2 | 2. 1 | |
8. 3 | 8. 2 | 8. 3 | 1. 4 | 2. 2 | 8. 3 | 3. 4 |
9. 3 | 9. 2 | 9. 4 | 2. 3 | 3. 2 | 9. 2 | 4. |
10. 4 | 10. 4 | 3. 1 | 4. 4 | |||
1. 2 | 11. 3 | 11. 1 | 4. 4 | 5. 2 | 1. 4 | 1. 4 |
2. 2 | 12. 2 | 12. 3 | 5. 1 | 2. 2 | 2. 2 | |
3. 2 | 13. 1 | 13. 2 | 6. 2 | 3. 4 | 3. 1 | |
4. 1 | 14. 1 | 14. 4 | 4. 2 | 4. 3 | ||
5. 1 | 15. 3 | 15. 2 | 1. 4 | 5. 4 | ||
6. 2 | 16. 2 | 16. | 2. 4 | 6. 2 | ||
7. 1 | 17. 4 | 3. 1 | 7. 3 | |||
8. 2 | 18. 1 | 4. 1 | 8. 4 | |||
9. 4 | 19. 2 | 5. 4 | 9. 4 | |||
10. 2 | 20. 4 | 6. 4 | ||||
Е. А. Кулабухова, МАОУ СОШ №12, ст. Михайловская, Курганинский район, Краснодарский край
Метки: Химия
Контрольная работа «Теория электролитической диссоциации»
- Подробности
- Автор: Ирина Смирнова
-
Категория: Физика
-
Опубликовано 30 Ноябрь -0001
-
Просмотров: 11750
Рейтинг: / 123
ПлохоОтлично
Тест 1
1. К хорошо растворимым электролитам относится
К хорошо растворимым электролитам относится
1) Бромид натрия
2) Карбонат меди
3) Сульфид железа (II)
4) Гидроксид магния
2. К неэлектролитам относится
1) Фосфат натрия
2) Оксид бария
3) Сульфат железа (III)
4) Нитрат хрома (III)
3. Неэлектролитом является
1) Cu(OH)2
2) AlPO4
3) CaCO3
4) CO
4. Электрический ток не проводит
1) Раствор соды
2) Раствор пирофосфорной кислоты
3) Расплав серы
4) Расплав сульфата магния
5. Электролитом является каждое из двух веществ:
1) Глюкоза и этиловый спирт
2) Уксусная кислота и сахароза
3) Масло и хлорид натрия
4) Серная кислота и нитрит натрия
6. В водном растворе наибольшее количество сульфат – анионов образуется при диссоциации 1 моль
1) Al2(SO4)3
2) FS2
3) BaSO4
4) Al2(SO3)3
7. Ионы Сl- образуются при диссоциации
1) HClO4
2) KClO3
3) NaClO3
4) Nh5Cl
8. Укажите верное уравнение диссоциации сульфата натрия в водном растворе.
1) Na2SO4↔Na+ + Na SO42-
2) Na2SO4↔Na+2 + SO42-
3) Na2SO4↔2Na+ + 4SO42-
4) Na2SO4↔2Na+ + SO42-
9. Ионы Н+ образуются при диссоциации каждого из двух веществ:
1) HNO3 и Ch4COOH
2) HCl и NaOH
3) Mg(OH)Cl и h3SO4
4) Ca(HCO3)2 и Ca(OH)2
10. Выберите верную запись правой части уравнения диссоциации сульфата натрия
1) = Na+ +HSO3-
2) = 2Na + + SO2-4
3) = Na+ + SO2-3
4) = 2Na + + SO2-3
Тест 2
1. К хорошо растворимым электролитам относится
1) Фосфат алюминия
2) Сульфид меди (II)
3) Гидроксид бария
4) Оксид железа (III)
2. К неэлектролитам относится
1) Этанол
2) Метафосфорная кислота
3) Хлорная кислота
4) Серная кислота
3. Неэлектролитом является
1) HF
2) BaCl2
3) C12h32O11
4) Ch4COOH
4. Электрический ток проводит
1) Расплав сахарозы
2) Расплав серы
3) Расплав кислорода в сере
4) Расплав хлорида кальция
5. К хорошо растворимым электролитам относится
1) Сульфид серебра
2) Сульфат калия
3) Гидроксид меди
4) Карбонат железа
6. Наибольшее количество хлорид- ионов образуется при диссоциации 1 моль
Наибольшее количество хлорид- ионов образуется при диссоциации 1 моль
1) CaCl2
2) AlCl3
3) KClO3
4) KCl
7. Наибольшее число ионов образуется при полной диссоциации 1 моль
1) K2SO4
2) Zn SO4
3) FeCl3
4) Cr2(SO4)3
8. Выберите верную запись правой части уравнения диссоциации фосфата натрия в водном растворе
1) = Na + +Na2PO4-
2) = 3 Na++ 4 PO43-
3) = 3Na++ PO43-
4) = Na +3+ PO43-
9. Ионы Н+ образуются при диссоциации каждого из двух веществ:
1) h3SO3 и С17Н35СООН
2) h3S и Сa(OH)2
3) Cu(OH)Cl и h3SO4
4) Ca(HCO3)2 и Ca(OH)2
10. Выберите правильную запись правой части уравнения диссоциации карбоната лития
1) = Li++ CO-3
2) = 2 Li ++ CO2-3
3) = Li++ CO2-3
4) = 2 Li ++ HCO-3
Тест 3
1. К хорошо растворимым электролитам относится
1) Оксид серебра
2) Сульфат свинца(II)
3) силикат кальция
4) Карбонат калия
2. К неэлектролитам относится
1) Карбонат натрия
2) Этиловый спирт
3) Хлороводород
4) Нитрат цинка
3. Электрический ток не проводит
Электрический ток не проводит
1) Расплав гидроксида бария
2) Расплав фосфата калия
3) Расплав хлорида калия
4) Расплав сахарозы
4. Электрический ток проводит
1) Раствор хлороводорода
2) Раствор глицерина
3) Расплав сахарозы
4) Расплав глюкозы
5. Электрический ток проводит
1) Расплав оксида кремния
2) Раствор нитрата аммония
3) Расплав серы
4) Раствор этанола
6. Наибольшее количество ионов натрия образуется при диссоциации 1 моль
1) NaCl
2) Na2S
3) Na3PO4
4) Na2SO3
7. Наибольшее количество ионов натрия образуется при диссоциации 1 моль
1) Хлорида меди (II)
2) Кислотные оксиды
3) Основания
4) Кислоты
8. С образованием катионов водорода в растворах диссоциируют
1) Основные кислоты
2) Кислотные оксиды
3) Основания
4) Кислоты
9. Укажите заряд катиона, образующегося на третьей стадии диссоциации ортофосфорной кислоты
1) + 1
2) +2
3) +3
4) +4
10. При полной диссоциации 1 моль нитрата хрома ( III) в растворе образуется
При полной диссоциации 1 моль нитрата хрома ( III) в растворе образуется
1) 3 моль катионов хрома и 4 моль нитрат – ионов
2) 2 моль катионов хрома и 3 моль нитрат – ионов
3) 1 моль катионов хрома и 3 моль нитрат – ионов
4) 3 моль катионов хрома и 1 моль нитрат — ионов
Литература:
Химия. 9 класс. Тематические тесты для подготовки к ГИА – 9. Базовый, повышенный, высокий уровни: учебно – методическое пособие/ Под. Ред. В. Н. Доронькина. – Изд. 3 – е, исправ. И дополн. – Ростов н/Д: Легион,2012._ 368 с.
- < Назад
- Вперёд >
У вас нет прав для создания комментариев.
Какие напитки содержат электролиты и как их приготовить дома
Электролиты — это минералы, такие как натрий, калий и магний. Они присутствуют в тканях, крови и других жидкостях организма и имеют решающее значение для функции нервов и мышц, регуляции артериального давления и гидратации. Некоторые напитки естественным образом богаты электролитами, в то время как другие проходят специальную подготовку для обеспечения электролитами.
Термин электролит относится к тому факту, что электролиты представляют собой вещества с электрическим зарядом. Многие функции организма зависят от слабого электрического тока, который обеспечивают электролиты.
Большинство людей могут поддерживать здоровый электролитный баланс, употребляя в пищу продукты и напитки, богатые электролитами. Другим людям, таким как высокоэффективные спортсмены и люди, которые больны и обезвожены, может потребоваться стимулирование. Многие напитки, в том числе напитки, которые люди могут приготовить дома, богаты электролитами.
В этой статье мы обсудим, что такое электролиты, перечислим напитки с высоким содержанием электролитов и предложим рецепты напитков с высоким содержанием электролитов, которые можно приготовить дома.
Термин электролиты относится к химическим веществам, которые несут электрический заряд при растворении в воде. С точки зрения питания это относится к минералам, которые играют важную роль в организме. Электролиты появляются в тканях, крови, моче и других жидкостях организма. К ним относятся:
К ним относятся:
- натрий
- кальций
- калий
- хлорид
- фосфат
- магний
кислотный и основной (pH) уровни организма.
Щелкните здесь, чтобы узнать больше об электролитах и их роли в организме человека.
Некоторые напитки являются естественными источниками электролитов, в то время как другие представляют собой напитки, насыщенные электролитами. Ниже приведены шесть распространенных напитков с высоким содержанием электролитов:
Коровье молоко
Коровье молоко естественно богато электролитами, включая кальций, натрий и калий.
База данных пищевых продуктов и питательных веществ для диетических исследований Министерства сельского хозяйства США (FNDDS) утверждает, что 1 чашка обычного цельного коровьего молока обеспечивает:
- 300 миллиграммов (мг) кальция
- 92,7 мг натрия
- 366 мг калия
Кроме того, коровье молоко является хорошим источником макроэлементов. Для людей, которые активно тренируются, эта комбинация электролитов и макроэлементов делает коровье молоко легким электролитным напитком после тренировки.
Для людей, которые активно тренируются, эта комбинация электролитов и макроэлементов делает коровье молоко легким электролитным напитком после тренировки.
Но коровье молоко не может быть подходящим напитком для всех людей. Например, обычное коровье молоко обычно не подходит для людей с непереносимостью лактозы. Безлактозная версия может быть лучшим вариантом.
Точно так же молоко животного происхождения (коровье или другое) не подходит для людей, придерживающихся веганской диеты. Существует множество доступных альтернатив молочным продуктам, таких как соевое молоко, миндальное молоко и овсяное молоко. Но некоторые исследования показывают, что не только растительное молоко не может обеспечить сопоставимые уровни витаминов и минералов, но и витамины и минералы усваиваются хуже, чем содержащиеся в коровьем молоке.
Любой, кто придерживается веганской диеты и ищет послетренировочный напиток или любой напиток, помогающий заменить электролиты, потерянные в результате чрезмерного и длительного потоотделения, может найти другие виды электролитных напитков более полезными, чем растительное молоко.
Фруктовый сок
Фруктовые соки, такие как апельсиновый сок, вишневый сок и арбузный сок, являются хорошими источниками магния, калия и фосфора. Согласно FNDDS, средний школьный контейнер (124 грамма) 100% апельсинового сока содержит:
- 13,6 мг магния
- 221 мг калия
- 34,7 мг фосфора
хороший источник антиоксидантов и витаминов. Но в большинстве фруктовых соков мало натрия и много сахара. В том же контейнере с апельсиновым соком всего 2,48 мг натрия, но 10,3 грамма (г) сахара. Таким образом, хотя фруктовые соки являются хорошим источником электролитов, они могут быть не самым подходящим напитком для замены натрия, теряемого с потом.
Кокосовая вода
Кокосовая вода является еще одним источником определенных электролитов, особенно калия, кальция, натрия и магния. В FNDDS указано, что 240 г неподслащенной кокосовой воды содержат:
- 396 мг калия
- 16,8 мг кальция
- 62,4 мг натрия
- 14,4 мг магния
- 244 мг натрия
- 184 мг калия
- 294 мг хлорида
- бананы
- авокадо
- шпинат
- капуста
- 1 литр воды
- 6 чайных ложек сахара
- ½ чайной ложки соли
- Хлорид : Примерно то же, что и натрий, поскольку большая часть пищевых хлоридов поступает из соли.
- Калий : Национальные институты здравоохранения (NIH) рекомендуют 2600 мг для взрослых женщин и 3400 мг для взрослых мужчин.
- Кальций : NIH рекомендует 1000 мг для людей в возрасте 19–50 лет и мужчин в возрасте 51–70 лет и 1200 мг для женщин в возрасте 51 года и старше и мужчин в возрасте 71 года и старше.
- Фосфат : Взрослым в возрасте 19 лет и старше требуется 700 мг.
- Магний : NIH рекомендует 310 мг для женщин и 400 мг для мужчин в возрасте 19–30 лет, а также 320 мг для женщин и 420 мг для мужчин в возрасте 31 года и старше.
5
вода с добавкамиПитательные вещества — Напитки с добавлением воды — это низкокалорийные напитки с низким содержанием сахара для электролитных напитков.
Водные напитки, содержащие электролиты, не содержат такого же количества сахара и калорий, как, например, фруктовые соки и спортивные напитки. В зависимости от марки они могут даже предоставлять более разнообразную смесь электролитов.
Если на упаковке напитка используется термин «вода», Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) заявляет, что продукт должен соответствовать всем требованиям безопасности и указывать все ингредиенты, включая минералы, на этикетке с информацией о пищевой ценности.
Спортивные напитки
Спортивные напитки — это общедоступные электролитные напитки. Несмотря на свою популярность, спортивные напитки имеют свои плюсы и минусы.
Например, употребление спортивных напитков — это удобный способ для спортсменов с высокой выносливостью избежать обезвоживания и пополнить электролиты, которые они теряют с потом. Есть варианты без сахара, а некоторые могут повысить энергию.
С другой стороны, спортивные напитки, как правило, содержат больше электролитов, чем нужно среднему человеку. В них часто содержится много сахара (порция спортивного напитка объемом 360 миллилитров может содержать 21 г сахара).
В них часто содержится много сахара (порция спортивного напитка объемом 360 миллилитров может содержать 21 г сахара).
В целом, коммерческие электролитные напитки, такие как спортивные напитки, могут быть хорошим выбором для спортсменов, но не самым подходящим вариантом для обычного человека.
Растворы электролитов для перорального применения
Растворы электролитов для перорального применения представляют собой еще один тип коммерческих напитков с электролитами. Производители обычно формулируют их с оптимальным балансом электролитов и сахара, чтобы помочь людям оправиться от обезвоживания. Например, порция коммерческого раствора электролитов для перорального приема на 8 унций может содержать:
Как ни странно, люди могут рекомендовать эти типы напитков для восполнения электролитов у детей с диареей или рвотой. Они также являются подходящим вариантом для взрослых, которые также могут подвергаться риску обезвоживания.
Существует множество способов самостоятельного приготовления электролитных напитков в домашних условиях.
Таблетки с электролитом
Приготовить напиток с электролитом дома можно так же просто, как добавить таблетку с электролитом в воду. Электролитные таблетки доступны в Интернете, а также во многих магазинах здоровья и хорошего самочувствия.
Смузи
Фруктовые или овощные смузи — это простой и популярный способ пополнения электролитов в домашних условиях. Люди могут выбирать фрукты и овощи с высоким содержанием электролитов, в том числе:
Рецепт пероральной регидратации
Люди могут приготовить свои собственные основные продукты для пероральной регидратации с помощью основных продуктов для пероральной регидратации. Например, люди могут приготовить раствор для пероральной регидратации, смешав следующие ингредиенты:
Большинству людей для поддержания здорового баланса требуется следующее рекомендуемое суточное количество электролитов: Максимум 2300 мг.
Людям, которые беременны или кормят грудью, может потребоваться большее или меньшее количество. Их врач порекомендует соответствующее количество.
Когда уровень электролитов в организме становится слишком высоким или слишком низким, это может вызвать электролитный дисбаланс.
Электролитный дисбаланс возникает при изменении количества воды в организме. Как правило, организму необходимо получать столько жидкости, сколько он теряет. Без этого баланса организм может стать обезвоженным (слишком мало воды) или гипергидратированным (слишком много воды).
Несколько факторов могут влиять на водный баланс организма, в том числе:
- чрезмерное потоотделение
- недостаточное количество еды или питья
- лекарства, включая мочегонные и слабительные
- рвота и диарея
- проблемы с почками или сердцем
Кроме того, некоторые другие медицинские состояния связаны с электролитным дисбалансом. Например, анализ 2020 года указывает на связь между COVID-19 итяжесть и значительно более низкие уровни натрия, калия и кальция.
При дисбалансе электролитов у человека может наблюдаться широкий спектр симптомов, которые могут включать одышку, спутанность сознания, учащенное сердцебиение или нерегулярное сердцебиение.

Человеку рекомендуется обратиться к врачу, если у него наблюдаются серьезные симптомы, такие как судороги, судороги или быстрые изменения артериального давления. Врач может определить, есть ли у человека дисбаланс электролитов или другое состояние, а также назначить соответствующее лечение.
Соблюдая сбалансированную диету, включающую питательные продукты и напитки, человек обычно может обеспечить организм необходимыми минералами для поддержания здорового баланса электролитов.
Это означает, что в рацион должны входить фрукты и овощи, богатые электролитами, а также другие полезные для здоровья источники необходимых минералов. Также важно поддерживать гидратацию в течение дня.
Людям, которые занимаются спортом, следует уделять особое внимание потреблению жидкости. Для легких и умеренных тренировок может потребоваться только вода, в то время как для более длительных и интенсивных тренировок могут потребоваться более крепкие электролитные напитки.
Люди, испытывающие такие симптомы, как диарея или рвота, также могут обратить внимание на потребление жидкости и рассмотреть возможность перорального приема раствора электролита, чтобы избежать обезвоживания.

Всем, у кого наблюдаются симптомы электролитного дисбаланса, следует обратиться к врачу.
Большинству людей, придерживающихся здоровой диеты и не допускающих обезвоживания, не требуются напитки с электролитами. Но они могут предоставить спортсменам быстрый и удобный способ пополнения электролитов, потерянных с потом, или помочь людям с тяжелой диареей или рвотой избежать обезвоживания и поддерживать электролитный баланс.
Но если человек регулярно употребляет электролитные напитки, он может потреблять больше, чем необходимо, что может иметь связанные с этим риски. Например, это может привести к гипернатриемии, гиперкалиемии или гиперкальциемии. Это когда у человека слишком много натрия, калия или кальция в крови.
Электролиты — это важные минералы, которые играют ключевую роль в ряде функций организма. Как правило, люди могут получать достаточное количество электролитов из своего рациона. Но богатый электролитами напиток может быть полезен спортсменам, занимающимся интенсивными физическими упражнениями, или людям, которые больны и подвержены риску обезвоживания.

Дома можно приготовить богатый электролитами напиток, смешав соль, сахар и воду. Но люди должны стараться поддерживать здоровый уровень электролитов, так как слишком много или слишком мало может привести к дисбалансу, что может иметь связанные с этим риски. Любой, кто беспокоится о своем уровне электролитов, должен обратиться к своему врачу.
7: Электропроводность водных растворов (эксперимент)
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 95541
- Колледж Санта-Моники
- Колледж Санта-Моники
- Для наблюдения электропроводности веществ в различных водных растворах
- Для определения раствор сильный или слабый электролит
- Чтобы интерпретировать химическую реакцию, наблюдая за проводимостью водного раствора.

- Измеритель имеет батарею 9 В и два параллельных медных электрода. Используйте промывочную бутыль с дистиллированной водой и большой химический стакан с надписью «отходы», чтобы промыть медные электроды. Высушите салфеткой Kimwipe. При включении фары не должны светиться каким-либо цветом. Если они есть, повторите полоскание и сушку.
- Поместите глюкометр печатной платой вверх (батарея будет внизу).
 Всегда устанавливайте счетчик таким образом, чтобы печатная плата не намокла. На этой стороне есть руководство по возможным измерениям электропроводности:
Всегда устанавливайте счетчик таким образом, чтобы печатная плата не намокла. На этой стороне есть руководство по возможным измерениям электропроводности: - Поместите 5 мл дистиллированной воды в небольшой чистый химический стакан. Протестируйте и запишите свои результаты.
- Поместите 5 мл водопроводной воды в небольшой чистый химический стакан. Протестируйте и запишите свои результаты.
- Поместите около 0,2 г твердого хлорида натрия (\(\ce{NaCl}\)) в небольшой чистый химический стакан и проверьте электропроводность. Добавьте 5 мл дистиллированной воды к хлориду натрия; проверить электропроводность раствора. Вылейте этот раствор в раковину и промойте стакан.
- Поместите около 0,2 г твердого карбоната кальция (\(\ce{CaCO3}\) в небольшой чистый химический стакан и проверьте электропроводность. Добавьте 5 мл дистиллированной воды к карбонату кальция; проверьте электропроводность раствора. Утилизируйте этот раствор. в раковину и ополосните стакан.

- Используйте по 5 мл каждого из следующих веществ в стакане на 100 мл для проверки электропроводности.
- уксусная кислота, 0,1 М \(\ce{HC2h4O2}\)
- нитрат алюминия, 0,1 М \(\ce{Al(NO3)3}\)
- гидроксид аммония, 0,1 М \(\ce{Nh5OH}\) ( aq )
- гидроксид кальция, насыщенный \(\ce{Ca(OH)2}\)
- лимонная кислота, 0,1 М \(\ce{C6H8O7}\)
- этанол, \(\ce{Ch4Ch3OH}\)
- соляная кислота, 0,1 М \(\ce{HCl}\)
- магния гидроксид, насыщенный \(\ce{Mg(OH)2}\)
- сульфат магния, 0,1 М \(\ce{MgSO4}\)
- азотная кислота, 0,1 М \(\ce{HNO3}\)
- калия йодид, 0,1 М \(\ce{KI}\)
- хлорид натрия, 0,1 М \(\ce{NaCl}\)
- гидроксид натрия, 0,1 М \(\ce{NaOH}\)
- сахароза, 0,1 М \(\ce{C12h32O11}\)
- Почему электроды кондуктометра, а также все химические стаканы необходимо промывать дистиллированной водой после каждого измерения электропроводности?
- Почему дистиллированная вода является более слабым проводником, чем водопроводная вода?
- Почему твердый хлорид натрия действует как неэлектролит, в то время как водный раствор \(\ce{NaCl}\) действует как сильный электролит?
- Классифицируйте каждое из следующего как неионизированное, частично ионизированное или ионизированное .

Объективы
Электропроводность основана на потоке электронов. Металлы являются хорошими проводниками электричества, потому что они позволяют электронам проходить через весь кусок материала. Таким образом, электроны текут как «море электронов» через металлы. Для сравнения, дистиллированная вода является очень плохим проводником электричества, поскольку через воду проходит очень мало электричества. Высокоионизированные вещества сильные электролиты . Сильные кислоты и соли являются сильными электролитами, так как полностью ионизируются (диссоциируют или расслаиваются) в растворе. Ионы переносят электрический заряд через раствор, создавая электрический ток. Ток, если он достаточен, зажжет один или оба светодиода на измерителе проводимости , показанном справа.
Слабоионизированные вещества слабые электролиты . Слабые кислоты и основания можно отнести к разряду слабых электролитов, поскольку они не полностью диссоциируют в растворе.
Вещества, не проводящие электрический ток, называются неэлектролитами . Неэлектролиты не ионизируются; они не содержат подвижных ионов. Светодиоды кондуктометра не загорятся, потому что нет ионов, переносящих электрический ток. В таблице ниже перечислены примеры сильных, слабых и неэлектролитов.
Неэлектролиты не ионизируются; они не содержат подвижных ионов. Светодиоды кондуктометра не загорятся, потому что нет ионов, переносящих электрический ток. В таблице ниже перечислены примеры сильных, слабых и неэлектролитов.
Сильные электролиты
Сильные кислоты| Наименование | Формула |
|---|---|
Кислота соляная | \(\ce{HCl}\) ( водный ) |
Кислота бромистоводородная | \(\ce{HBr}\) ( водный ) |
Кислота йодистоводородная | \(\ce{HI}\) ( aq ) |
Азотная кислота | \(\ce{HNO3}\) ( водный ) |
Серная кислота | \(\ce{h3SO4}\) ( водный раствор ) |
Хлорная кислота | \(\ce{HClO4}\) ( водный ) |
Кислота хлорная | \(\ce{HClO3}\) ( водный ) |
| Наименование | Формула |
|---|---|
Гидроксид натрия | \(\ce{NaOH}\) ( водный ) |
Гидроксид калия | \(\ce{KOH}\) ( aq ) |
Гидроксид кальция | \(\ce{Ca(OH)2}\) ( водный ) |
Бария гидроксид | \(\ce{Ba(OH)2}\) ( водный ) |
| Наименование | Формула |
|---|---|
Хлорид натрия | \(\ce{NaCl}\) ( водный раствор ) |
Карбонат калия | \(\ce{K2CO3}\) ( водный ) |
Сульфат меди(II) | \(\ce{CuSO4}\) ( водный раствор ) |
Слабые электролиты
Слабые кислоты| Наименование | Формула |
|---|---|
Уксусная кислота | \(\ce{HC2h4O2}\) ( ак ) |
Угольная кислота | \(\ce{h3CO3}\) ( водный раствор ) |
Лимонная кислота | \(\ce{C6H8O7}\) ( водный ) |
Фосфорная кислота | \(\ce{h4PO4}\) ( aq ) |
| Наименование | Формула |
|---|---|
Аммиак | \(\ce{Nh4}\) ( aq ) |
Гидроксид аммония | \(\ce{Nh5OH}\) ( водный ) |
Гидроксид магния | \(\ce{Mg(OH)2}\) ( водный ) |
| Большинство других оснований |
| Наименование | Формула |
|---|---|
Хлорид серебра | \(\ce{AgCl}\) ( с ) |
Карбонат кальция | \(\ce{CaCO3}\) ( с ) |
Сульфат бария | \(\ce{BaSO4}\) ( с ) |
Неэлектролиты
| Наименование | Формула |
|---|---|
Дистиллированная вода | \(\ce{h3O}\) ( л ) |
Метанол | \(\ce{Ch4OH}\) ( водный ) |
Процедура
Материалы и оборудованиеизмеритель проводимости, промывочная бутыль с дистиллированной водой, большой стакан для промывки/отходов, маленькие стаканы, салфетки Kimwipes, твердый хлорид натрия, твердый карбонат кальция
Растворы: уксусная кислота, нитрат алюминия, гидроксид аммония, гидроксид кальция, лимонная кислота, этанол, соляная кислота, гидроксид магния, сульфат магния, азотная кислота, йодид калия, хлорид натрия, гидроксид натрия, сахароза
Безопасность
Будьте осторожны с соляной кислотой, азотной кислотой, серной кислотой и концентрированной уксусной кислотой. Несмотря на низкую концентрацию, некоторые люди могут иметь повышенную чувствительность кожи. Если вы чувствуете покалывание или изменение цвета кожи, немедленно промойте большим количеством воды в течение 15 минут. Сообщите об этом своему инструктору как можно скорее.
Несмотря на низкую концентрацию, некоторые люди могут иметь повышенную чувствительность кожи. Если вы чувствуете покалывание или изменение цвета кожи, немедленно промойте большим количеством воды в течение 15 минут. Сообщите об этом своему инструктору как можно скорее.
Средства индивидуальной защиты (СИЗ): лабораторный халат, защитные очки, закрытая обувь
Тестирование электропроводности – доказательства присутствия ионов в водном растворе
Примечание
НЕ ПОДВЕРГАЙТЕ ПЕЧАТНУЮ ПЛАТУ ВОЗДЕЙСТВИЮ ВОДЫ. Только медные электроды следует промывать водой.
| Шкала | Красный светодиод | Зеленый светодиод | Проводимость |
|---|---|---|---|
| 0 | от | от | низкий или отсутствует |
| 1 | тусклый | от | низкий |
| 2 | средний | от | средний |
| 3 | яркий | тусклый | высокий |
| 4 | очень яркий | средний | очень высокий |
Примечание
Включите прибор и погрузите медные электроды для проверки электропроводности. Тщательно промывайте дистиллированной водой после каждого теста и сушите салфетками Kimwipes. Выключайте глюкометр между использованиями.
Тщательно промывайте дистиллированной водой после каждого теста и сушите салфетками Kimwipes. Выключайте глюкометр между использованиями.
Обязательно ополаскивайте и высушите электроды между тестами, используя промывочную бутыль с контейнером для отходов и салфетки Kimwipes.
Вылейте раствор и ополосните химический стакан в раковине между тестами. Утилизируйте раствор из стакана для отходов вместе с неопасными отходами в вытяжном шкафу.
Лабораторный отчет: Электропроводность водных растворов
Тестирование электропроводности – подтверждение присутствия ионов в водном растворе
Раствор
Наблюдения: красный светодиод | зеленый светодиод
Проводимость
Сильный, слабый или неэлектролитный
Ионизированный, частично ионизированный или неионизированный
примера: \(\ce{LiOH}\) ( водный раствор ),
\(\ce{HNO2}\) ( водный ),
метанол (л)
красный яркий, зеленый тусклый
красный тусклый, зеленый выключен
красный выключен, зеленый выключен
высокий
низкий
нет
сильный электролит
слабый электролит
неэлектролит
ионизированный
частично ионизированный
неионизированный
вода дистиллированная, \(\ce{h3O}\) ( л )
водопроводная вода \(\ce{h3O}\) ( л )
твердый хлорид натрия, \(\ce{NaCl}\) ( s )
раствор хлорида натрия, \(\ce{NaCl}\) ( aq )
твердый карбонат кальция, \(\ce{CaCO3}\) ( с )
раствор карбоната кальция, \(\ce{CaCO3}\) ( aq )
уксусная кислота, \(\ce{HC2h4O2}\) ( aq )
нитрат алюминия, \(\ce{Al(NO3)3}\) ( aq ) | ||||
гидроксид аммония, \(\ce{Nh5OH}\) ( aq ) | ||||
гидроксид кальция, \(\ce{Ca(OH)2}\) ( aq ) | ||||
угольная кислота, \(\ce{h3CO3}\) ( ак ) | ||||
этанол, \(\ce{Ch4Ch3OH}\) | ||||
кислота соляная, \(\ce{HCl}\) ( водный ) | ||||
гидроксид магния, \(\ce{Mg(OH)2}\) ( aq ) | ||||
сульфат магния, \(\ce{MgSO4}\) ( водный ) | ||||
азотная кислота, \(\ce{HNO3}\) ( водный ) | ||||
калия йодид, \(\ce{KI}\) ( aq ) | ||||
хлорид натрия, \(\ce{NaCl}\) ( водный ) | ||||
гидроксид натрия, \(\ce{NaOH}\) ( водный ) | ||||
сахароза, \(\ce{C12h32O11}\) ( водный раствор ) |

 1
1 3
3 4
4
 1
1 3
3 2
2 3
3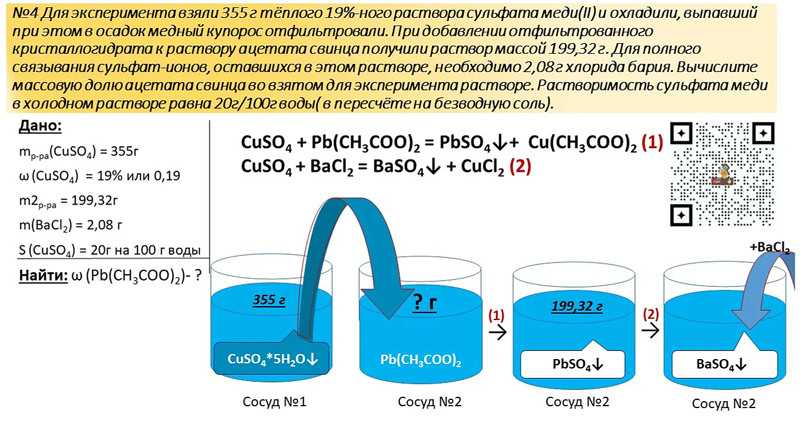



 Всегда устанавливайте счетчик таким образом, чтобы печатная плата не намокла. На этой стороне есть руководство по возможным измерениям электропроводности:
Всегда устанавливайте счетчик таким образом, чтобы печатная плата не намокла. На этой стороне есть руководство по возможным измерениям электропроводности:

Leave A Comment