Характеристика брома
Характеристика бромаБром (Br) располагается в 4 периоде, в VII группе, главной подгруппе, имеет порядковый номер 35.
Массовое число: A = 80
Число протонов: P = 35
Число электронов: ē = 35
Число нейтронов: N = A — Z = 80 — 35 = 45
| 35Br 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 |
Валентные электроны
| 35Br | ↑↓ | ↑↓ | ↑↓ | ↑ | ||||||||
| 4s | 4p | 4d | ||||||||||
| 35Br* | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | |||||||
| 4s | 4p | |||||||||||
| 35Br** | ↑↓ | ↑ | ↑ | ↑ | ↑ | ↑ | ||||||
| 4s | 4p | 4d | ||||||||||
| 35Br*** | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | |||||
| 4s | 4p | 4d | ||||||||||
Бром – p-элемент, неметалл.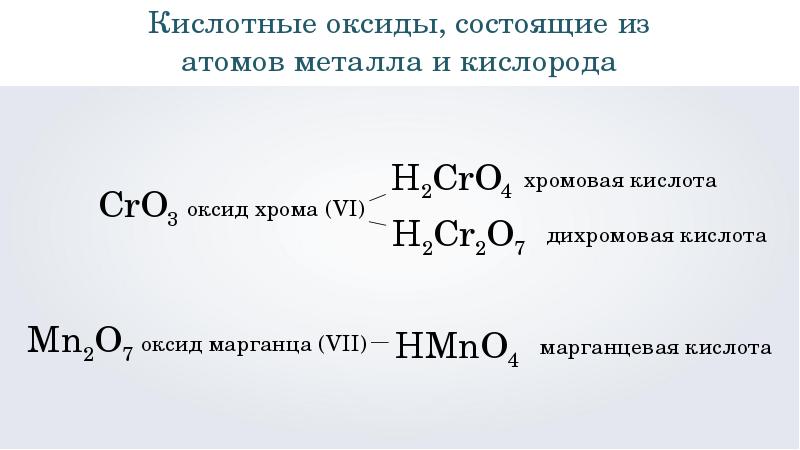
минимальная: -1
максимальная: +7
Высший оксид: Br2O7 – оксид брома (VII).
Проявляет кислотные свойства:
Br2O7 + 2NaOH ⟶ 2NaBrO4 + H2O
Высший гидроксид: HBrO4 – бромная кислота.
Проявляет кислотные свойства:
HBrO4 + NaOH ⟶ NaBrO4 + H2O
Водородное соединение в низшей степени окисления: HBr.
★ Оксид брома I — cтатьи о неорганических веществах .. Инфо
Пользователи также искали:
гидроксид брома, оксид брома 4, оксид брома 6, оксид брома кислотный, оксид брома основный или кислотный, оксид брома высший, оксид хлора, оксид селена 6, брома, оксидом, оксид, оксид брома, оксидов, кислотный, брома и, селена, оксида, бромом, оксидов брома, оксиды, высший, оксид селена, гидроксид, основный или кислотный, основный, бром, брома i, брома и оксида, оксида брома, оксиды брома, оксиды брома и, оксид хлора, оксид брома высший, оксид брома кислотный, гидроксид брома, оксид брома i, оксидов брома и, бром и,
Учебное пособие по общей и неорганической химии для. 1 сентября 2011 года произошла утечка брома в одном из вагонов грузового состава на станции Челябинск Главный Южно Уральской. .. брома IV оксид. брома VII 2 натрия 3 серы IV 4 оксид алюминия Сумма коэффициентов в уравнении реакции между оксидом. .. Персональный сайт Бром. тодиоды, хлора, оксид брома. doi: 10.21293 1818 0442 2017 20 4 33 38. Интерес к дистанционному контролю содержа ния оксидов галогенов в. .. Тест химии 11 класс по теме: Итоговая контрольная работа. Большинство оксидов галогенов неустойчивы получаются косвенным путем, Оксид брома I Br2O напоминает по свойствам и методу синтеза Cl 2O.. .. 8.Оксиды галогенов.. Окислением озоном при 50 С. Дополнительная информация: Медленное нагревание в вакууме дает смесь оксидов брома I и III. Источники. .. Брома IV оксид. Мини справочник по химическим google-wiki.info. Важнейшие. Соединения со степенью окисления 1. Оксид брома Br2O. Представляет собой газ коричневого цвета.. .. online расчет. Оксид неорганическое соединение брома и кислорода с формулой Br2O, неустойчивые тёмно коричневые кристаллы при температуре ниже. 1 сентября 2011 года произошла утечка брома в одном из вагонов грузового состава на станции Челябинск Главный Южно Уральской. .. брома IV оксид. брома VII 2 натрия 3 серы IV 4 оксид алюминия Сумма коэффициентов в уравнении реакции между оксидом. .. Персональный сайт Бром. тодиоды, хлора, оксид брома. doi: 10.21293 1818 0442 2017 20 4 33 38. Интерес к дистанционному контролю содержа ния оксидов галогенов в. .. Тест химии 11 класс по теме: Итоговая контрольная работа. Большинство оксидов галогенов неустойчивы получаются косвенным путем, Оксид брома I Br2O напоминает по свойствам и методу синтеза Cl 2O.. .. 8.Оксиды галогенов.. Окислением озоном при 50 С. Дополнительная информация: Медленное нагревание в вакууме дает смесь оксидов брома I и III. Источники. .. Брома IV оксид. Мини справочник по химическим google-wiki.info. Важнейшие. Соединения со степенью окисления 1. Оксид брома Br2O. Представляет собой газ коричневого цвета.. .. online расчет. Оксид неорганическое соединение брома и кислорода с формулой Br2O, неустойчивые тёмно коричневые кристаллы при температуре ниже. |
Оксиды хлора, брома и иода Справочник химика 21. Источники информации: Advances in Inorganic Radiochemistry. 1963. Vol. 5. С. 70 71 CRC Handbook of Chemistry and Physics. 90ed.. .. ХЛОРА ОКСИДЫ: с русского на все языки. Как показало исследование методом EXAFS имеет структуру пербромата брома с межатомными расстояними I.  |
«Электронное строение атомов и псхэ» (стр. 2 из 8)
Формула высшего оксида:
1. Э2О. 2. Э2О3. 3. ЭО. 4. ЭО3.
Формула высшего гидроксида:
а. ЭОН. б. Э(ОН)2. в. Э(ОН)3. г. Н2ЭО4.
ЧАСТЬ Б. Задания со свободным ответом
12 (3 балла). На основании положения в Периодической системе расположите элементы: германий, мышьяк, сера, фосфор — в порядке
убывания окислительных свойств. Объясните ответ.
Объясните ответ.
13 (6 баллов). Как и почему в Периодической системе изменяются металлические свойства?
А. В пределах периода. Б. В пределах главной подгруппы.
14 (7 баллов). Составьте электронную формулу элемента с порядковым номером 30 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
15 (5 баллов). Какие химические свойства характерны для высшего оксида элемента 3-го периода, главной подгруппы VI группы Периодической системы? Ответ подтвердите, написав уравнения реакций.
Вариант 3
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1 (2 балла). Нейтроны были открыты:
А. Н. Бором. В. Г. Мозли.
Б. Д. Менделеевым. Г. Д. Чедвигом.
2 (2 балла). Номер группы (для элементов главных подгрупп) в Периодической системе определяет:
A. Число протонов в атоме.
Число протонов в атоме.
Б. Число электронов в наружном слое атома.
B. Число электронных слоев в атоме.
Г. Число нейтронов в атоме.
3 (2 балла). Ориентацию электронных орбиталей в пространстве характеризует:
A. Главное квантовое число.
Б. Магнитное квантовое число.
B. Орбитальное квантовое число.
Г. Спиновое квантовое число.
4 (2 балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А. Ва и К. Б. Sb и Bi. В. Ti и Ge. Г. Кг и Fe.
5 (2 балла). d-Элементом является:
А. Калий. В. Аргон.
Б. Кремний. Г. Медь.
6 (2 балла). Электронная конфигурация …3d54s2 соответствует элементу:
А. Брому. В. Марганцу.
Б. Кальцию. Г. Хлору.
7 (2 балла). Амфотерным оксидом является вещество, формула которого:
А. СгО. Б. Сг2О3. В. СгО3. Г. FeO.
8 (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
А. А1—Ga—Ge. В. К—Na—Li.
Б. Са—Sr—Ва. Г. Mg—Ca—Zn.
9 (2 балла). Элемент Э с электронной формулой Is22s22p63s23p63d104s24p3 образует высший оксид, соответствующий формуле:
А. ЭО. Б. Э2О3. В. Э2О5. Г. ЭО3.
10 (2 балла). Изотоп железа, в ядре которого содержится 30 нейтронов, обозначают:
A. Fe. Б. Fe. В. Fe. Г. Fe.
11 (9 баллов). Установите соответствие.
Элемент:
I. Бор. II. Бром. III. Фосфор. IV. Литий.
Бор. II. Бром. III. Фосфор. IV. Литий.
Электронная формула:
A. 1s22s22p1. В. 1s22s22p63s23p3.
Б. 1s22s1. Г. 1s22s22p63s23p63d104s24p5.
Формула высшего оксида:
1. Э2О. 2. Э2О3. 3. Э2О5. 4. Э2О7.
Формула высшего гидроксида:
а. ЭОН. б. НЭО3. в. Н3ЭО3. г. НЭО4.
ЧАСТЬ Б. Задания со свободным ответом
12 (3 балла). На основании положения в Периодической системе расположите элементы: алюминий, калий, кальций, магний — в порядке возрастания восстановительных свойств. Объясните ответ.
Объясните ответ.
13 (6 баллов). Почему заряды ядер атомов элементов, расположенных в порядке возрастания порядковых номеров в Периодической системе, изменяются монотонно, а свойства элементов — периодически?
14 (7 баллов). Составьте электронную формулу элемента с порядковым номером 38 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
15 (5 баллов). Какие химические свойства характерны для гидроксидов металлов? Ответ подтвердите, написав уравнения реакций.
Вариант 4
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1 (2 балла). Протоны были открыты:
А. Г. Паули. В. Дж. Томсоном.
Б. Э. Резерфордом. Г. Д. Чедвигом.
2 (2 балла). Общее число электронов в атоме элемента определяют, используя Периодическую систему, по номеру:
А. Группы. В. Ряда.
Группы. В. Ряда.
Б. Периода. Г. Порядковому.
3 (2 балла). «Собственное вращение» электрона характеризует:
А. Главное квантовое число.
Б. Магнитное квантовое число.
В. Орбитальное квантовое число.
Г. Спиновое квантовое число.
4 (2 балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
A. Sn и Si. Б. As и Se. В. Zn и Са. Г. Мо и Те.
5 (2 балла). f-Элементом является:
А. Германий. Б. Калий. В. Селен. Г. Уран.
6 (2 балла). Электронная конфигурация …4s24p6 соответствует элементу:
А. Брому. Б. Железу. В. Неону. Г. Криптону.
7 (2 балла). Амфотерным гидроксидом является вещество, формула которого:
A. Ga(OH)3. Б. Mg(OH)2. В. LiOH. Г. Sc(OH)2.
Б. Mg(OH)2. В. LiOH. Г. Sc(OH)2.
8 (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
А. К—Rb—Sr. В. Be—Li—Cs.
Б. Al—Mg—Be. Г. Ge—Sn—Sb.
9 (2 балла). Элемент Э с электронной формулой 1s22s22p63s1 образует высший оксид, соответствующий формуле:
А. Э2О. Б. Э2О3. В. ЭО2. Г. ЭО3.
10 (2 балла). Изотоп кальция, в ядре которого содержится 24 нейтрона, обозначают:
А. Са. Б. Са В Са Г Са
11 (9 баллов). Установите соответствие.
Элемент:
I. Азот. II. Кальций. III. Кремний. IV. Сера.
Электронная формула:
A. 1s22s22p3. В. 1s22s22p63s23p2.
В. 1s22s22p63s23p2.
Б. 1s22s22p63s23p4. Г. 1s22s22p63s23p64s2.
Формула высшего оксида:
1. ЭО. 2. ЭО2. 3. Э2О5. 4. ЭО3.
Формула высшего гидроксида:
а. Н2ЭО4. б. Э(ОН)2. в. Н2ЭО3. г. НЭО3.
ЧАСТЬ Б. Задания со свободным ответом
12 (3 балла). На основании положения в Периодической системе расположите элементы: кислород, мышьяк, сера, фосфор — в порядке убывания окислительных свойств. Обоснуйте ответ.
13 (6 баллов). Перечислите основные правила (законы), в соответствии с которыми происходит заполнение электронами уровней, подуровней и орбиталей в электронной оболочке атомов элементов.
14 (7 баллов). Составьте электронную формулу элемента с порядковым номером 34 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
15 (5 баллов). Какие химические свойства характерны для гидроксидов неметаллов? Ответ подтвердите, написав уравнения реакций.
Тема «Виды химической связи»
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Формула вещества с ионной связью:
А. НС1 Б. КВг . В. Р4. Г. СН3ОН.
2 (2 балла). Вещество с металлической связью:
А. Оксид калия. В. Кремний. Б. Медь. Г. Гидроксид магния.
3 (2 балла). Число общих электронных пар в молекуле азота:
А. Одна.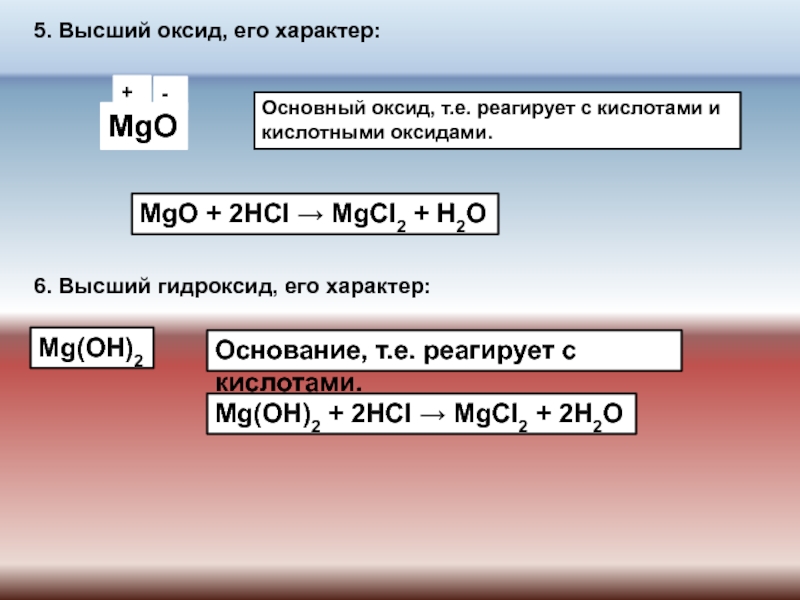 Б. Две. В. Три. Г. Четыре.
Б. Две. В. Три. Г. Четыре.
4 (2 балла). Полярность химической связи уменьшается в ряду соединений, формулы которых:
А. С12, H2S, CO2. Б. NH3, PH3, SO2. В. НС1, HBr, HI. Г. ВН3, NH3, HF.
5 (2 балла). Вид гибридизации электронных орбиталей атома серы в молекуле соединения, формула которого H2S:
A. sp3. Б. sp2. В. sp. Г. Не гибридизированы.
6 (2 балла). Кристаллическая решетка оксида кремния (IV):
А. Атомная Б. Металлическая В. Ионная. Г. Молекулярная.
7 (2 балла). Число σ- и π-связей в молекуле этена:
А. 6σ и π — нет. Б. 4σ и 2π В. Зσ и Зπ. Г. 5σ и 1π.
8 (2 балла). Вещества, формулы которых СН2=СН—СН2—СН3 и СН2=С—СН3, — это:
СН3
A. Гомологи. Б. Изомеры. B. Одно и то же вещество.
Гомологи. Б. Изомеры. B. Одно и то же вещество.
9 (2 балла). Гомологом вещества, формула которого СН3—СН2—СН2—ОН, является:
А. Бутаналь. Б. Этаналь. В Бутанол-2. Г. Этанол.
10 (2 балла). Вещество, формула которого CH3—C=СН2 называют:
│
СН3—СН2
А. 2-Метилбутен-1. Б. 2-Этилпропен-1. В. 2-Этилпропен-2 . Г. 2-Метилбутен-2.
ЧАСТЬ Б. Задания со свободным ответом
11 (8 баллов). Составьте схему образования соединений, состоящих из химических элементов: А. Кальция и фтора. Б. Мышьяка и водорода.
Контрольная работа «Периодический закон» 11 класс
Контрольная работа по химии (11 класс)
ПЕРИОДИЧЕСКИЙ ЗАКОН.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
СТРОЕНИЕ АТОМА
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
(2 балла). Электроны были открыты:
А. Н. Бором. Б. Э.Резерфордом. В. Дж. Томсоном. Г. Д. Чедвигом.
(2 балла).Порядковый номер элемента в Периодической системе определяется:
А. Зарядом ядра атома. Б. Числом электронов в наружном слое атома.
В. Числом электронных слоёв в атоме. Г. Числом нейтронов в атоме.
(2 балла). Общий запас энергии электронов в атоме характеризует: А. Главное квантовое число. Б. Магнитное квантовое число. В. Орбитальное квантовое число. Г. Спиновое квантовое число.
(2 балла). Пара элементов, имеющих сходное строение внешнего энергетического уровня: А. B и Si.
 Б. S и Se. В. K и Ca. Г. Cr и Fe.
Б. S и Se. В. K и Ca. Г. Cr и Fe.(2 балла). s – Элементом является: А. Барий. Б. Америций. В. Криптону. Г. Рутению.
(2 балла). Электронная конфигурация … 3d64s2 соответствует элементу: А. Аргону. Б. Железу. В. Криптону. Г. Рутению.
(2 балла). Амфотерным гидроксидом является вещество, формула которого: А. Be(OH)2. Б. Mg(OH)2. В. H2SiO3. Г. Ba(OH)2.
(2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств: А. Sr – Rb – K. Б. Be – Li – K. В. Na – K – Ca. Г. Al – Mg – Be.
(2 балла). Элемент Э с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле: А. Э2О. Б. Э2О3. В. ЭО2 Г. Э2О5.
(2 балла). Изотоп железа, в ядре которого содержится 28 нейтронов, обозначают: А.
 5426Fe. Б. 5626Fe. В. 5726Fe. Г. 5826Fe .
5426Fe. Б. 5626Fe. В. 5726Fe. Г. 5826Fe .(9 баллов). Установите соответствие.
Элемент: I. Бериллий. II. Натрий. III. Хлор. IV. Азот.
Электронная формула: А. 1s22s2. Б. 1s22s22p3. В. 1s22s22p63 s1. Г. 1s22s22p63 s23p5.
Формула высшего оксида: 1. Э2О. 2. ЭО. 3. Э2О5. 4. Э2О7.
Формула высшего гидроксида: а. ЭОН. Б. Э(ОН)2. в. НЭО3. г. НЭО4.
ЧАСТЬ Б. Задания со свободным ответом
(3 балла). На основании положения в Периодической системе расположите элементы: бериллий, бор, магний, натрий – в порядке возрастания восстановительных свойств. Объясните ответ.
(6 баллов).
 Как и почему в Периодической системе изменяются неметаллические свойства?
Как и почему в Периодической системе изменяются неметаллические свойства?
А. В пределах периода. Б. В пределах главной подгруппы.
(7 баллов).Составьте электронную формулу элемента с порядковым номером 31 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
(5 баллов). Какие химические свойства характерны для оксида элемента 2-го периода, главной подгруппы I группы Периодической системы? Ответ подтвердите, написав уравнения реакций.
Контрольная работа по химии (11 класс)
ПЕРИОДИЧЕСКИЙ ЗАКОН.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
СТРОЕНИЕ АТОМА
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
(2 балла).
 Атомные ядра были открыты:
Атомные ядра были открыты:
А. Д. Менделеевым. Б. Э.Резерфордом. В. Дж. Томсоном. Г. Д. Чедвигом.
(2 балла).Номер периода в Периодической системе определяется:
А. Зарядом ядра атома. Б. Числом электронов в наружном слое атома.
В. Числом электронных слоёв в атоме. Г. Числом электронов в атоме.
(2 балла). Форму электронных орбиталей характеризует: А. Главное квантовое число. Б. Магнитное квантовое число. В. Орбитальное квантовое число. Г. Спиновое квантовое число.
(2 балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней: А. S и Cl. Б. Be и B. В. Kr и Xe. Г. Mo и Se.
(2 балла). p – Элементом является: А. Скандий. Б. Барий. В. Мышьяк. Г. Гелий.
(2 балла). Электронная конфигурация … 3d104s2 соответствует элементу: А.
 Кальцию. Б. Криптону. В. Кадмию. Г. Цинку.
Кальцию. Б. Криптону. В. Кадмию. Г. Цинку.(2 балла). Амфотерным гидроксидом является вещество, формула которого: А. Zn(OH)2. Б. Mg(OH)2. В. Ca(OH)2. Г. Cr(OH)2.
(2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств: А. Mg – Ca – Zn. Б. Al – Mg – Ca. В. Sr – Rb – K. Г. Ge – Si – Sb.
(2 балла). Элемент Э с электронной формулой 1s22s22p63s23p63d104 s24p1 образует высший оксид, соответствующий формуле: А. Э2О. Б. Э2О3. В. ЭО2 Г. Э2О5.
(2 балла). Изотоп кальция, в ядре которого содержится 22 нейтрона, обозначают: А. 4020Ca. Б. 4220Ca. В. 4420Ca. Г.4820Ca.
(9 баллов). Установите соответствие.
Элемент: I. Алюминий. II. Калий. III. Селен. IV. Магний.
Алюминий. II. Калий. III. Селен. IV. Магний.
Электронная формула: А. 1s22s22p63s23p1. Б. 1s22s22p63s2. В. 1s22s22p63 s23p63d104 s24p4. Г. 1s22s22p63 s23p64 s1.
Формула высшего оксида: 1. Э2О. 2. Э2О3. 3. ЭО. 4. ЭО3.
Формула высшего гидроксида: а. ЭОН. Б. Э(ОН)2. в. Э(ОH)3. г. Н2ЭО4.
ЧАСТЬ Б. Задания со свободным ответом
(3 балла). На основании положения в Периодической системе расположите элементы: германий, мышьяк, сера, фосфор – в порядке убывания окислительных свойств. Объясните ответ.
(6 баллов). Как и почему в Периодической системе изменяются металлические свойства?
А. В пределах периода. Б. В пределах главной подгруппы.
В пределах периода. Б. В пределах главной подгруппы.
(7 баллов).Составьте электронную формулу элемента с порядковым номером 30 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
(5 баллов). Какие химические свойства характерны для высшего оксида элемента 3 -го периода, главной подгруппы VI группы Периодической системы? Ответ подтвердите, написав уравнения реакций.
Контрольная работа по химии (11 класс)
ПЕРИОДИЧЕСКИЙ ЗАКОН.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
СТРОЕНИЕ АТОМА
Вариант 3
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
(2 балла). Нейтроны были открыты:
А. Н. Бором. Б. Д. Менделеевым. В. Г. Мозли. Г. Д. Чедвигом.
Н. Бором. Б. Д. Менделеевым. В. Г. Мозли. Г. Д. Чедвигом.
(2 балла).Номер группы (для элементов главных подгрупп) в Периодической системе определяет:
А. Число протонов в атоме. Б. Число электронов в наружном слое атома.
В. Число электронных слоёв в атоме. Г. Число нейтронов в атоме.
(2 балла). Ориентацию электронных орбиталей в пространстве характеризует: А. Главное квантовое число. Б. Магнитное квантовое число. В. Орбитальное квантовое число. Г. Спиновое квантовое число.
(2 балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней: А. Ba и K. Б. Sb и Bi. В. Ti и Ce. Г. Kr и Fe.
(2 балла). d – Элементом является: А. Калий. Б. Кремний. В. Аргон. Г. Медь.
(2 балла). Электронная конфигурация … 3d54s2 соответствует элементу: А. Брому. Б. Кальцию.
 В. Марганцу. Г. Хлору.
В. Марганцу. Г. Хлору.(2 балла). Амфотерным оксидом является вещество, формула которого: А. CrO. Б. Cr2O3. В. CrO3. Г. FeO.
(2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств: А. Al – Ca – Ge. Б. Ca – Sr – Ba. В. K – Na – Li. Г. Mg – Ca – Zn.
(2 балла). Элемент Э с электронной формулой 1s22s22p63 s23p63d104s24p3 образует высший оксид, соответствующий формуле: А. ЭО. Б. Э2О3. В. Э2О5 Г. ЭО3.
(2 балла). Изотоп железа, в ядре которого содержится 30 нейтронов, обозначают: А. 5426Fe. Б. 5626Fe. В. 5726Fe. Г. 5826Fe .
(9 баллов). Установите соответствие.
Элемент: I. Бор. II. Бром. III. Фосфор. IV. Литий.
Электронная формула: А.1s22s22p1. Б.1s22s1. В.1s22s22p63 s23p3. Г.1s22s22p63 s23p63d104 s24p5.
Формула высшего оксида: 1. Э2О. 2. Э2О3. 3. Э2О5. 4. Э2О7.
Формула высшего гидроксида: а. ЭОН. б. НЭО3. в. Н3ЭО3. г. НЭО4.
ЧАСТЬ Б. Задания со свободным ответом
(3 балла). На основании положения в Периодической системе расположите элементы: алюминий, калий, кальций, магний – в порядке возрастания восстановительных свойств. Объясните ответ.
(6 баллов). Почему заряды ядер атомов элементов, расположенный в порядке возрастания порядковых номеров в Периодической системе, изменяются монотонно, а свойства элементов – периодически?
(7 баллов).Составьте электронную формулу элемента с порядковым номером 38 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
(5 баллов). Какие химические свойства характерны для гидроксидов ? Ответ подтвердите, написав уравнения реакций.
Контрольная работа по химии (11 класс)
ПЕРИОДИЧЕСКИЙ ЗАКОН.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
СТРОЕНИЕ АТОМА
Вариант 4
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
(2 балла). Протоны были открыты:
А. Г. Паули. Б. Э.Резерфордом. В. Дж. Томсоном. Г. Д. Чедвигом.
(2 балла).Общее число электронов в атоме элемента определяют, используя Периодическую систему, по номеру:
А. Группы. Б. Периода. В. Ряда. Г. Порядковому.
(2 балла). «Собственное вращение» электрона характеризует: А. Главное квантовое число. Б. Магнитное квантовое число. В. Орбитальное квантовое число. Г. Спиновое квантовое число.
(2 балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней: А. Sn и Si. Б. As и Se. В. Zn и Ca. Г. Mo и Te.
(2 балла). f – Элементом является: А. Германий. Б. Калий. В. Селен. Г. Уран.
(2 балла). Электронная конфигурация … 4s24 р6 соответствует элементу: А. Брому. Б. Железу. В. Неону. Г. Криптону.
(2 балла). Амфотерным гидроксидом является вещество, формула которого: А. Ca(OH)3. Б. Mg(OH)2. В. LiOH. Г. Sc(OH)2.
(2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств: А. K – Rb – Sr. Б. Al – Mg – Be. В. Be – Li – Cs. Г. Ge – Sn – Sb.
(2 балла). Элемент Э с электронной формулой 1s22s22p63 s1 образует высший оксид, соответствующий формуле: А. Э2О. Б. Э2О3. В. ЭО2 Г. ЭО3.
(2 балла). Изотоп кальция, в ядре которого содержится 24 нейтрона, обозначают: А. 4020Са. Б. 4220Са. В. 4420Са. Г. 4820Са .
(9 баллов). Установите соответствие.
Элемент: I. Азот. II. Кальций. III. Кремний. IV. Сера.
Электронная формула: А. 1s22s22p3. Б. 1s22s22p63s23p4. В. 1s22s22p63 s23p2. Г. 1s22s22p63 s23p64s2.
Формула высшего оксида: 1. ЭО. 2. ЭО2. 3. Э2О5. 4. ЭО3.
Формула высшего гидроксида: а. Н2ЭО. Б. Э(ОН)2. в. Н2ЭО3. г. НЭО3.
ЧАСТЬ Б. Задания со свободным ответом
(3 балла). На основании положения в Периодической системе расположите элементы: кислород, мышьяк, сера, фосфор – в порядке убывания окислительных свойств. Обоснуйте ответ.
(6 баллов). Перечислите основные правила (законы), в соответствии с которыми происходит заполнение электронами уровней, подуровней и орбиталей в электронной оболочке атомов элементов.
(7 баллов).Составьте электронную формулу элемента с порядковым номером 34 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
(5 баллов). Какие химические свойства характерны для гидроксидов неметаллов? Ответ подтвердите, написав уравнения реакций.
Строение атома брома (Br), схема и примеры
Общие сведения о строении атома брома
Относится к элементам p-семейства. Неметалл. Обозначение – Br. Порядковый номер – 35. Относительная атомная масса – 79,904 а.е.м.
Электронное строение атома брома
Атом брома состоит из положительно заряженного ядра (+35), внутри которого есть 35 протонов и 45 нейтронов, а вокруг, по четырем орбитам движутся 35 электронов.
Рис.1. Схематическое строение атома брома.
Распределение электронов по орбиталям выглядит следующим образом:
+35Br)2)8)18)7;
1s22s22p63s23p63d104s24p5.
Внешний энергетический уровень атома брома содержит 7 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Каждый валентный электрон атома брома можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
4 |
0 |
0 |
+1/2 |
|
s |
4 |
0 |
0 |
-1/2 |
|
p |
4 |
1 |
-1 |
+1/2 |
|
p |
4 |
1 |
-1 |
-1/2 |
|
p |
4 |
1 |
0 |
+1/2 |
|
p |
4 |
1 |
0 |
-1/2 |
|
p |
4 |
1 |
1 |
+1/2 |
Наличие одного неспаренного электрона свидетельствует о том, что степень окисления брома может быть равна -1 или +1. Так как на четвертом уровне есть вакантные орбитали 4d-подуровня, то для атома брома характерно наличие возбужденного состояния:
Именно поэтому для брома также характерна степень окисления +3. Известно, что в своих соединениях бром также способен проявлять степени окисления +5 и +7.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Химия 10 класс, школьный (первый) этап, г. Москва, 2016 год
Задание 1 «Десять порошков»
В десяти пронумерованных стаканах выданы порошки следующих веществ: медь, оксид меди(II), древесный уголь, красный фосфор, сера, железо, хлорид натрия, сахар, мел, малахит (оснóвный карбонат меди(II)). Ученики исследовали свойства выданных порошкообразных веществ, результаты своих наблюдений представили в таблице.
| Номер стакана | Цвет исследуемого вещества | «Поведение» порошка при помещении его в стакан с водой | Изменения, наблюдаемые при нагревании исследуемого порошкав ложечке с помощью спиртовки |
1 | белый | тонет в воде, постепенно растворяется | практически не изменяется |
2 | белый | тонет в воде, постепенно растворяется | плавится, темнеет, постепенно обугливается |
3 | белый | тонет в воде, не растворяется | практически не изменяется |
4 | жёлтый | частички плавают на поверхности воды, не растворяются | плавится, горит голубоватым пламенем |
5 | красный | тонет в воде, не растворяется | постепенно чернеет |
6 | тёмно-красный | тонет в воде, не растворяется | горит ярким белым пламенем |
7 | зелёный | тонет в воде, не растворяется | постепенно чернеет |
8 | тёмно-серый | тонет в воде, не растворяется | темнеет, частички в пламени раскаляются |
9 | чёрный | частички плавают на поверхности воды, не растворяются | начинает тлеть |
10 | чёрный | тонет в воде, не растворяется | практически не изменяется |
- Определите, в каком по номеру стакане находится каждое из веществ, выданных для исследования. Ответ обоснуйте.
- Какие из выданных веществ реагируют с соляной кислотой с выделением газа? Составьте соответствующие уравнения реакций.
- Известно, что плотность веществ, находящихся в стаканах № 4 и № 9, больше плотности воды, т. е. эти вещества должны тонуть в воде. Однако порошки этих веществ плавают на поверхности воды. Предложите возможное объяснение этому факту.
- Известно, что три выданных вещества проводят электрический ток. Какие это вещества? Раствор какого вещества проводит электрический ток?
Решение
1. В стакане № 1 находится хлорид натрия. Белый цвет, растворяется в воде,практически не изменяется на воздухе при нагревании.
№ 2 – сахар; белый цвет, растворяется в воде, плавится и постепенно
обугливается при нагревании.
№ 3 – мел; белый цвет, не растворяется в воде.
№ 4 – сера; жёлтый цвет, характерное горение.
№ 5 – медь; красный цвет; появление чёрной окраски при нагревании на воздухе за счёт образования оксида меди(II).
№ 6 – красный фосфор; тёмно-красный цвет; характерное горение.
№ 7 – малахит; зелёный цвет; появление чёрной окраски при термическом разложении за счёт образования оксида меди(II).
№ 8 – железо; тёмно-серый цвет; потемнение при нагревании.
№ 9 – древесный уголь; чёрный цвет; тлеет при нагревании на воздухе.
№ 10 – оксид меди(II); чёрный цвет; отсутствие изменений при нагревании.
По 0,5 балла за каждое верное определение и разумное обоснование.
Максимум – 5 баллов.
2. Газообразные вещества выделяются при взаимодействии соляной кислоты с мелом, малахитом и железом:
- CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
- (CuOH)2CO3 + 4HCl = 2CuCl2 + CO2↑ + 3H2O
- Fe + 2HCl = FeCl2 + H2↑
По 1 баллу за каждое уравнение
3. В стаканах № 4 и № 9 находятся соответственно порошки серы и древесного угля. Частички древесного угля пронизаны капиллярами, заполненными воздухом, таким образом, их средняя плотность оказывается меньше 1 г/мл. К тому же, поверхность угля, как и поверхность серы, не смачивается водой, т. е. является гидрофобной. Мелкие частички этих веществ удерживаются на поверхности воды силой поверхностного натяжения.
1 балл
4. Электрический ток проводят медь, железо и уголь.
Раствор хлорида натрия проводит электрический ток, т. к. NaCl – электролит.
1 балл
Всего 10 баллов.
Задание 2 «Вывод формулы органического вещества»
Органическое соединение А содержит 39,73 % углерода и 7,28 % водорода по массе. Определите молекулярную формулу вещества А и установите его структурную формулу, если известно, что в его состав входит четвертичный атом углерода, а плотность паров по воздуху равна 5,2. Назовите органическое соединение А по систематической номенклатуре. Предложите способ получения А.
Решение
1) Т.к. сумма массовых долей не равна 100 %, следовательно, в молекуле ещё есть какой-то остаток, содержание которого равно: 100 – 39,73 – 7,28 = 52,99 %.
Молярная масса вещества: M(A) = Dвозд∙Mвозд = 5,2 ∙ 29 = 151 г/моль.
Число атомов водорода в молекуле A: 151 ∙ 0,0728/1 = 11.
Число атомов углерода в молекуле A: 151 ∙ 0,3973/12 = 5.
Молярная масса остатка равна 151 × 0,5299 = 80 г/моль, что соответствует одному атому брома, следовательно, молекулярная формула вещества А – C5H11Br.
2) В состав А входит четвертичный атом углерода, поэтому А имеет следующую структуру:
1-бром-2,2-диметилпропан
3) Способ получения А:
Система оценивания:
| 1) Определение количества атомов углерода | 1 балл |
Определение количества атомов водорода | 1 балл |
Определение брома | 2 балла |
Молекулярная формула | 1 балл |
| 2) Структура | 2 балла |
Название | 1 балл |
| 3) Уравнение реакции получения | 2 балла |
Всего 10 баллов. |
Задание 3 «Три углеводорода»
Массовая доля углерода в трёх углеводородах составляет 85,7 %. Установите молекулярные формулы этих углеводородов, если плотность их по воздуху составляет 0,97; 1,43; 1,93. Приведите структурные формулы изомеров этих углеводородов и назовите их в соответствии с правилами международной номенклатуры.
Решение
а) Определение молярных масс углеводородов: М = Dвозд.(СxHy)∙29;
- M1 = 0,97∙29 = 28 г/моль;
- M2 =1,45∙29 = 42 г/моль;
- M3 = 1,93∙29 = 56 г/моль.
б) Определение простейшей формулы искомых углеводородов: 100 г вещества СxНy содержат 85,7 г углерода и 14,3 г водорода. Соотношение количества вещества углерода и водорода для искомых углеводородов составляет:
Следовательно, простейшая формула искомых углеводородов СН2;
М(СН2)= 14 г/моль.
в) Определение молекулярных формул искомых углеводородов и приведение структурных формул их изомеров:
1-й углеводород
28 : 14 = 2; n = 2 ⇒ С2Н4 — этилен. Изомеров не имеет.
2-й углеводород
42 : 14 = 3; n = 3 ⇒ С3Н6
Изомеры С3Н6:
CH2=СН–СН3 — пропен
— циклопропан
3-й углеводород
56 : 14 = 4; n = 4 ⇒ С4Н8
Изомеры: СН3 – СН2 – СН = СН2 — бутен-1
— цис-бутен-2
— транс-бутен-2
СН3 – С(CН3) = СН2 — метилпропен
— циклобутан
— метилциклопропан
Критерии оценивания
Определение простейшей формулы углеводородов. 1 балл
Определение молекулярных формул углеводородов и приведение структурных формул их изомеров:
- 1-й углеводород – 2 балла (1 балл за молекулярную формулу и 1 балл за структуру этилена)
- 2-й углеводород – 2 балла (1 балл за молекулярную формулу и по 0,5 балла за каждую структуру)
- 3-й углеводород – 5 баллов (1 балл за молекулярную формулу, по 0,5 балла за каждую структуру и 1 балл дополнительно, если учтена цис-трансизомерия).
(Если молекулярные формулы правильно определены без использования простейшей формулы, то 1 балл за простейшую формулу добавляется к результату.)
Всего 10 баллов.
Задание 4 «Превращения неметалла»
1) Выберите подходящий неметалл и осуществите для него превращения:
простое вещество → X → водородное соединение → высший оксид → простое вещество → соль
2) Напишите уравнения соответствующих реакций.
Решение
1) Подходят кремний и фосфор.
Цепочка для кремния.
Si → Mg2Si → SiH4 → SiO2 → Si → Na2SiO3
2) Уравнения реакций:
- Si + 2Mg = Mg2Si
- Mg2Si + 4HCl = SiH4↑ + 2MgCl2
- SiH4 + 2O2 = SiO2 + 2H2O
- SiO2 + C = Si + CO2
- Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
Каждое уравнение реакции – 2 балла.
Всего 10 баллов.
Задание 5 «Правые части с коэффициентами»
Восстановите левую часть уравнений:
- …. + …. + …. = Na2SO4 + 2Ag↓ + 2HNO3
- …. = Na2S + 3Na2SO4
- …. + …. + …. = 3Na2SO4 + 2MnO2↓ + 2KOH
- …. + …. = POCl3 + SOCl2
- …. +…. +…. 2H2SO4
Решение
- Na2SO3 + H2O + 2AgNO3 = Na2SO4 + 2Ag↓ + 2HNO3
- 4Na2SO3 = Na2S + 3Na2SO4
- 3Na2SO3+ H2O + 2KMnO4 = 3Na2SO4 + 2MnO2↓ + 2KOH
- SO2 + PCl5 = POCl3 + SOCl2
- 2SO2 + 2H2O + O2 2H2SO4
По 2 балла за уравнение.
Всего 10 баллов.
Задание 6 «Волшебный порошок»
Разбирая реактивы в лаборатории, юный химик нашёл неподписанную банку с белым порошком без запаха. Для исследования его свойств, юный химик аккуратно взвесил 10,00 граммов и разделил их ровно на 5 частей, с каждой из частей он провёл следующие опыты:
Номер опыта | Ход эксперимента | Наблюдения |
1 | Добавил в воду, а затем прилил несколько капель раствора лакмуса | Хорошо растворим в воде. Раствор окрасился в красный цвет |
2 | Растворил в воде. Затем добавил избыток карбоната калия | Бурное выделение газа |
3 | Аккуратно внёс часть навески в пламя горелки | Пламя горелки окрасилось в фиолетовый цвет |
4 | Растворил в воде. Затем добавил избыток хлорида бария | Выпало 3,43 г белого осадка, нерастворимого в кислотах и щелочах |
5 | Растворил в воде. После этого добавил избыток гидроксида калия | Пробирка нагрелась. Видимых признаков реакции не наблюдалось |
- Определите состав белого порошка. Ответ подтвердите расчётом.
- Для опытов 2, 4, 5 приведите соответствующее уравнение реакции.
- Что произойдёт при нагревании белого порошка? Приведите уравнение реакции.
Решение
1. Окрашивание пламени горелки в фиолетовый цвет говорит о том, что искомый порошок – соль калия. Выпадение белого осадка с избытком хлорида бария – качественная реакция на сульфат-ион. Но сульфат калия (K2SO4) имеет нейтральную среду (соль образована сильным основанием и сильной кислотой), а согласно опыту № 1 лакмус окрашивает раствор соли в красный цвет, что говорит о кислой реакции.
Следовательно, искомая соль – гидросульфат калия, KHSO4. Проверим это расчётом:
KHSO4 + BaCl2 → BaSO4↓ + HCl + KCl
т. к. исходную навеску в 10,00 г юный химик разделил на пять равных частей, значит в реакцию вступило 2,00 г соли:
m(BaSO4 ) = 0,0147 моль ∙ 233 г/моль = 3, 43 г.
Полученная масса сульфата бария совпадает с результатами эксперимента, следовательно белый порошок – действительно KHSO4.
Уравнения реакций:
- 2KHSO4 + K2CO3 → 2K2SO4 + CO2↑ + H2O
- KHSO4 + BaCl2 → BaSO4↓ + HCl + KCl
- KHSO4 + KOH → K2SO4 + H2O
Уравнение реакции разложения:
2KHSO4 K2S2O7 + H2O↑
Система оценивания:
| 1) Вывод о присутствии ионов калия | 1 балл |
| Вывод о присутствии сульфат-ионов | 1 балл |
| Расчёт | 2 балла |
| Формула соли | 1 балл |
| 2) 3 уравнения по 1 баллу | 3 балла |
| 3) Уравнение реакции разложения | 2 балла |
| Всего | 10 баллов |
В итоговую оценку из 6-и задач засчитываются 5 решений, за которые участник
набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не
учитывается.
Вариант 5
Задание №1.
На приведенном рисунке
изображена модель атома
1. Бериллия
2. Гелия
3. Натрия
4. Лития
Объяснение: у атома элемента, схема которого приведена на рисунке, два электронных слоя, на первом слое два электрона и на втором тоже 2. Значит это элемент с порядковым номером 4, а это — бериллий. Правильный ответ — 1.
Задание №2.
Основным является высший оксид каждого из химических элементов, имеющих в периодической системе Д.И. Менделеева порядковые номера:
1. 11, 7, 16
2. 19, 15, 17
3. 12, 3, 20
4. 6, 14, 16
Объяснение: основными оксидами являются оксиды щелочных и щелочноземельных металлов. Свойства основных оксидов можно посмотреть здесь. Из перечисленных выбираем магний, литий и кальций. Правильный ответ — 3.
Задание №3.
Ковалентной неполярной связью образовано каждое из веществ, формулы которых:
1. Br2, h3, O2
2. O2, S8, h3S
3. O2, h3, h3O
4. CO, Ch5, h3
Объяснение: ковалентная неполярная связь образуется между атомами одного и того же элемента, поэтому выбираем бром, водород и кислород. Правильный ответ — 1.
Задание №4.
Отрицательная степень окисления химических элементов численно равна:
1. Номеру группы в периодической системе
2. Числу электронов, недостающих до завершения внешнего электронного слоя
3. Числу электронных слоев в атоме
4. Номеру периода, в котором находится элемент в периодической системе
Объяснение: отрицательная степень окисления показывает сколько электронов не хватает атому до заполнения электронного слоя, так как отрицательная степень окисления — это наличие электронов (ситуация, при которой атом электроны забрал). Правильный ответ — 2.
Задание №5.
К сложным веществам относится:
1. Красный фосфор
2. Алмаз
3. Воздух
4. Угарный газ
Объяснение: сложные вещества состоят из атомов двух или более элементов. Красный фосфор и алмаз — простые вещества, воздух — смесь газов, угарный газ — сложное вещество — СО. Правильный ответ — 4.
Задание №6.
Реакции замещения соответствует уравнение:
1. 2NaOH + CO2 = Na2CO3 + h3O
2. NaCl + AgNO3 = NaNO3 + AgCl
3. CuO + h3SO4 = CuSO4 + h3O
4. Fe2O3 + 3C = 2Fe + 3CO
Объяснение: реакция замещения — реакция при которой одни атомы или функциональные группы меняются на другие. Из приведенных, реакцией замещения является последняя, в ней углерод замещает железо в оксиде. Правильный ответ — 4.
Задание №7.
Верны ли следующие суждения об электролитической диссоциации солей?
А. Все соли при диссоциации образуют катионы металлов, катионы водорода и анионы кислотных остатков.
Б. Соли в процессе диссоциации образуют катионы металлов и анионы кислотных остатков.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: первое утверждение неверно, так как катионы металлов, катионы водорода и анионы кислотных остатков при диссоциации дают только кислые соли. А второе утверждение верно. Правильный ответ — 2.
Задание №8.
Осадок белого цвета, нерастворимый в кислотах и щелочах, образуется в результате реакции, сокращенное ионное уравнение которой:
1. Zn²+ + 2OH‾ = Zn(OH)2
2. Fe²+ + 2OH‾ = Fe(OH)2
3. Ca²+ + CO3²‾ = CaCO3
4. Ba²+ + SO4²‾ = BaSO4
Объяснение: карбонат кальция растворяется в кислотах, гидроксиды образуют комплексы в щелочах. Сульфат бария нерастворим ни в кислотах ни в щелочах. Правильный ответ — 4.
Задание №9.
Цинк вытесняет металл из раствора:
1. Нитрата кальция
2. Нитрата калия
3. Нитрата меди (II)
4. Сульфата алюминия
Объяснение: цинк может вытеснить только менее активный металл. Среди кальция, калия, меди и алюминия слабее цинка только медь (см. ряд напряжений металлов). Правильный ответ — 3.
Задание №10.
Верны ли следующие суждения об оксидах?
А. При взаимодействии кислотных оксидов с основными образуются соли.
Б. Оксид серы (VI) реагирует как с гидроксидом натрия, так и с оксидом калия.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: оба суждения верны, такой вывод можно сделать, вспомнив химические свойства оксидов. Правильный ответ — 3.
Задание №11.
Раствор серной кислоты не взаимодействует с веществом, формула которого:
1. CuO
2. Cu
3. Ca(OH)2
4. Ba(NO3)2
Объяснение: раствор серной кислоты, как и все кислоты (кроме азотной) не реагирует с металлами, стоящими в ряду напряжений металлов после водорода. Таким металлом является медь. Правильный ответ — 2.
Задание №12.
Химическая реакция возможна между солями:
1. Na2CO3 и KCl
2. Al2(SO4)3 и NaNO3
3. AlCl3 и K2SO4
4. AgNO3 и Na3PO4
Объяснение: реакция обмена возможна только при образовании газа или осадка. Осадком является фосфат серебра, образующийся в последней реакции. Запишем ее.
3AgNO3 + Na3PO4 = 3NaNO3 + Ag3PO4↓
Правильный ответ — 4.
Задание №13.
Верны ли следующие суждения об обращении с газами в процессе лабораторных опытов?
А. Полученный из перекиси водорода кислород нельзя определять по запаху.
Б. Водород, полученный в аппарате Киппа, не надо проверять на чистоту.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: кислород (как и все остальные газы) в лаборатории нельзя проверить по запаху, так как кислород запаха не имеет. Водород всегда нужно проверять на чистоту вне зависимости от способа получения. Правильный ответ — 4.
Задание №14.
В химической реакции, уравнение которой
2KI + SO3 = K2SO3 + I2
окислителем является
1. I‾ в иодиде калия
2. О²‾ в оксиде серы (VI)
3. К+1 в иодиде калия
4. S+6 в оксиде серы (VI)
Объяснение: в данной окислительно-восстановительной реакции йод и сера меняют степень окисления. Запишем баланс.
S(+6) +2e → S(+4) — окислитель
2I(-1) -2e → I2(0) — восстановитель
То есть, окислителем является сера в оксиде серы (VI).
Правильный ответ — 4.
Задание №15.
Какое распределение массовых долей элементов соответствует количественному составу гидроксида калия?
1. 28,5,1,5, 70
2. 28,5, 3,5 67
3. 43, 3, 54
4. 42, 5, 53
Объяснение:
Ar(K) = 39 г/моль
Ar(H) = 1 г/моль
Ar(O) = 16 г/моль
Mr(KOH) = 56 г/моль
ω(К) = 39/56 х 100% = 70%
ω(Н) = 1/56 х 100% = 1,8%
ω(О) = 16/56 х 100% = 28,2%
Правильный ответ — 1.
Задание №16.
Общим для хлора и брома является
1. Наличие на внешнем электронном слое одинакового числа электронов
2. Наличие четырех электронных слоев в атомах
3. Одинаковое физическое состояние образованных ими простых веществ
4. Образование ими высших оксидов с общей формулой Э2О7
5. То, что они являются более сильными окислителями, чем фтор
Объяснение: и хлор и бром находятся в седьмой группе и называются галогенами, то есть на внешнем электронном слое оба элемента имеют одинаковое количество электронов — 7. В простом состоянии хлор является газом, бром — жидкостью. Оба образуют высшие оксиды с формулой Э2О7. Фтор является более сильным окислителем, чем оба эти галогена. Правильный ответ — 1.
Задание №17.
Для стеариновой кислоты характерны следующие утверждения
1. Хорошо растворяется в воде
2. Относится к кислородсодержащим органическим соединениям
3. Изменяет окраску лакмуса
4. Не содержит функциональных групп
5. Взаимодействует с кислородом
Объяснение: формула стеариновой кислоты — С8Н36О2, относится к карбоновым кислотам, то есть имеет функциональную группу — карбоксильную. Нерастворима в воде. Вступает в реакцию горения с кислородом (реакция идет до углекислого газа и воды). Правильный ответ — 25.
Задание №18.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти свойства.
Вещества
А. K2CO3(р-р) и Na2SiO3(р-р)
Б. Na2CO3(тв) и CaCO3(тв)
В. K2SO4(р-р) и KOH(р-р)
Реактив
1. CuCl2(р-р)
2. HNO3(р-р)
3. MgO
4. h3O
Объяснение: карбонат калия и силикат натрия можно различить при помощи азотной кислоты, в первой реакции выделяется углекислый газ. Твердые карбонат натрия и карбонат кальция различим водой, потому что карбонат натрия растворим в воде, а карбонат кальция — нерастворим (белый осадок). Сульфат калия и гидроксид калия отличить друг от друга можно при помощи раствора хлорида меди, так как образующийся во второй реакции гидроксид меди синего цвета и нерастворим в воде. Правильный ответ — 241.
Задание №19.
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
Название вещества
А. Оксид углерода (II)
Б. Оксид углерода (IV)
В. Карбонат натрия
Реагенты
1. Ba(OH)2(р-р), Mg
2. CO2(р-р), HCl(р-р)
3. Fe2O3, O2
4. h3O, SO2
Объяснение: оксид углерода (II) реагирует с оксидом железа и кислородом. Магний горит в углекислом газе: 2Мg + CO2 = C + 2MgO и еще диоксид углерода реагирует с гидроксидом бария. CO2 + Ba(OH)2 = BaCO3 + h3O
Карбонат натрия вступает в реакцию с углекислым газом и соляной кислотой.
Правильный ответ — 312.
Задание №20.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
h3S + HClO3 → S + HCl + h3O
Определите окислитель и восстановитель.
Объяснение: сера и хлор меняют степень окисления в данной окислительно-восстановительной реакции. Запишем баланс.
S(-2) -2e → S(0) | 3 — восстановитель
Cl(+5) +6e → Cl(-1) | 1 — окислитель
Расставляем коэффициенты.
3h3S + HClO3 → 3S + HCl + 3h3O
Задание №21.
Определите объем (н.у.) оксида углерода (IV), образующегося при растворении 110 г известняка, содержащего 92% карбоната кальция, в избытке соляной кислоты.
Объяснение: запишем уравнение реакции.
CaCO3 + 2HCl = CaCl2 + h3O + CO2↑
Найдем массу чистого известняка.
m(СaCO3) = 110 x 0,92 = 101,2 г
Находим количество вещества карбоната кальция.
n(CaCO3) = 101,2/100 = 1 моль
Количество вещества карбоната кальция равно количеству вещества углекислого газа.
n(CaCO3) = n(CO2) = 1 моль
Найдем объем углекислого газа.
V(CO2) = 1 x 22,4 = 22,4 л
Ответ: объем углекислого газа равен 22,4 л.
Задание №22.
Даны вещества: Al, I2, NaI, NaOH, HNO3. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид алюминия. Опишите признаки проведения реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Объяснение: алюминий реагирует с йодом: 2Al + 3I2 → 2AlI3
Затем йодид алюминия реагирует с гидроксидом натрия, при этом образуется нерастворимый гидроксид алюминия: AlI3 + 3NaOH → 3NaI + Al(OH)3↓
Запишем сокращенное ионное уравнение.
Al³+ + OH‾ → Al(OH)3↓
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Поверхностно-стабилизированный озонид вызывает окисление бромида на границе водный раствор-пар.
Оум, К.В., Лакин, М.Дж. и Финлейсон-Питтс, Б.Дж. Активация брома в тропосфере за счет темновой реакции О-3 со льдом морской воды . Geophys. Res. Lett. 25 , 3923–3926 (1998).
ADS CAS Статья Google ученый
Де Хаан, Д.O. et al. Гетерогенная химия в тропосфере: экспериментальные подходы и приложения к химии частиц морской соли. Внутр. Rev. Phys. Chem. 18 , 343–385 (1999).
ADS Статья Google ученый
Raso, A. R. W. et al. Фотохимия активного молекулярного йода в Арктике. Proc. Natl Acad. Sci. США , DOI: 10.1073 / pnas.1702803114.
Parrella, J. P. et al. Химия тропосферного брома: последствия для современного и доиндустриального озона и ртути. Атмос. Chem. Phys. 12 , 6723–6740 (2012).
ADS CAS Статья Google ученый
Schmidt, J. A. et al. Моделирование наблюдаемого тропосферного фона BrO: важность многофазной химии и последствия для озона, OH и ртути. J. Geophys. Res. 121 , 11819–11835 (2016).
CAS Google ученый
Heeb, M. B., Criquet, J., Zimmermann-Steffens, S. G. & von Gunten, U. Окислительная обработка бромидсодержащих вод: образование брома и его реакции с неорганическими и органическими соединениями — критический обзор. Water Res. 48 , 15–42 (2014).
CAS Статья PubMed Google ученый
Sander, R. et al. Неорганический бром в морском пограничном слое: критический обзор. Атмос. Chem. Phys. 3 , 1301–1336 (2003).
ADS CAS Статья Google ученый
Cao, L., Wang, CG, Mao, M., Grosshans, H. & Cao, NW Выведение механизмов сокращенной реакции на события истощения озонового слоя арктической весной с использованием анализа чувствительности к концентрации и главного компонента анализ. Атмос. Chem. Phys. 16 , 14853–14873 (2016).
ADS CAS Статья Google ученый
Haag, W. R. & Hoigne, J. Озонирование бромидсодержащих вод — кинетика образования бромистоводородной кислоты и бромата. Environ. Sci. Technol. 17, , 261–267 (1983).
ADS CAS Статья Google ученый
Gunten, U.v. Озонирование питьевой воды: Часть II. Дезинфекция и образование побочных продуктов в присутствии бромида, йодида или хлора. Water Res. 37 , 1469–1487 (2003).
Артикул Google ученый
Харута К. и Такеяма Т. Кинетика окисления водного бромид-иона озоном. J. Phys. Chem. 85 , 2383–2388 (1981).
CAS Статья Google ученый
Liu, Q. et al. Кинетика и механизмы реакций водного озона с бромидом, сульфитом, гидросульфитом, йодидом и нитрит-ионами. Inorg. Chem. 40 , 4436–4442 (2001).
CAS Статья PubMed Google ученый
Gladich, I. et al. Ab initio исследование реакции озона с бромид-ионом. J. Phys. Chem. A 119 , 4482–4488 (2015).
CAS Статья PubMed Google ученый
Хааг В. Р., Хойн Дж. И Бадер Х. Улучшенное окисление аммиака озоном в присутствии бромид-иона во время обработки воды. Water Res. 18 , 1125–1128 (1984).
CAS Статья Google ученый
Chameides, W. L. & Davis, D. D. Свободнорадикальная химия облачных капель и ее влияние на состав дождя. J. Geophys. Res. 87 , 4863–4877 (1982).
ADS CAS Статья Google ученый
Ниссенсон, П., Винген, Л. М., Хант, С. В., Финлейсон-Питтс, Б. Дж. И Дабдуб, Д. Быстрое образование молекулярного брома из разлитого аэрозоля NaBr в присутствии озона и УФ-излучения. Атмос. Environ. 89 , 491–506 (2014).
ADS CAS Статья Google ученый
Клиффорд Д. и Дональдсон Д. Дж. Прямые экспериментальные доказательства гетерогенной реакции озона с бромидом на границе раздела воздух-вода. J. Phys. Chem. A 111 , 9809–9814 (2007).
CAS Статья PubMed Google ученый
Abbatt, J. et al. Высвобождение газофазных галогенов путем фотолитической генерации ОН в замороженных растворах галогенидов-нитратов: активный механизм образования галогенов? J. Phys. Chem. A 114 , 6527–6533 (2010).
CAS Статья PubMed Google ученый
Олдридж, Н. В. и Аббатт, Дж. П. Д. Образование брома в газовой фазе при взаимодействии озона с замороженными и жидкими растворами NaCl / NaBr: количественное разделение поверхностной химии от реакции в объемной фазе. J. Phys. Chem. A 115 , 2590–2598 (2011).
CAS Статья PubMed Google ученый
Рен, С. Н., Кахан, Т. Ф., Джумаа, К. Б. и Дональдсон, Д. Дж. Спектроскопические исследования гетерогенной реакции между О-3 (г) и галогенидами на поверхности замороженных солевых растворов. J. Geophys. Res. 115 , Д16309 (2010).
ADS Статья Google ученый
Lee, M. T. et al. Конкуренция между органическими веществами и бромидом на границе раздела водный раствор-воздух, как видно из кинетики поглощения озона и рентгеновской фотоэлектронной спектроскопии. J. Phys. Chem. A 119 , 4600–4608 (2015).
CAS Статья PubMed Google ученый
Hunt, S. W. et al. Образование молекулярного брома в результате реакции озона с расплывчатым аэрозолем NaBr: данные о химии границ раздела фаз. J. Phys. Chem. A 108 , 11559–11572 (2004).
CAS Статья Google ученый
Shiraiwa, M. et al. Роль долгоживущих активных кислородных интермедиатов в реакции озона с аэрозольными частицами. Nat. Chem . 3 , 291–295 (2011).
CAS Статья PubMed Google ученый
Lampimaki, M. et al. Изгиб полос на металлооксидных поверхностях, вызванный озоном, изучен в условиях окружающей среды. Chem. Phys. Chem. 14 , 2419–2425 (2013).
Артикул PubMed Google ученый
Беркемайер, Т.и другие. Поглощение озона стеклообразными, полутвердыми и жидкими органическими веществами и роль реактивных промежуточных соединений кислорода в химии атмосферных аэрозолей. Phys. Chem. Chem. Phys. 18 , 12662–12674 (2016).
CAS Статья PubMed Google ученый
МакКейб, Дж. И Аббатт, Дж. П. Д. Гетерогенная потеря озона в газовой фазе на поверхностях сажи н-гексана: кинетика, аналогичная потере на других химически ненасыщенных твердых поверхностях. J. Phys. Chem. C 113 , 2120–2127 (2009).
CAS Статья Google ученый
Юнгвирт П. и Тобиас Д. Дж. Молекулярная структура солевых растворов: новый взгляд на границу раздела с последствиями для гетерогенной химии атмосферы. J. Phys. Chem. B 105 , 10468–10472 (2001).
CAS Статья Google ученый
Hofft, O. et al. Поверхностная сегрегация растворенных солевых ионов. J. Phys. Chem. B 110 , 11971–11976 (2006).
Артикул PubMed Google ученый
Ghosal, S., Shbeeb, A. & Hemminger, J. C. Поверхностная сегрегация брома в NaCl, легированном бромидом: последствия для сезонных колебаний арктического озона. Geophys. Res. Lett. 27 , 1879–1882 (2000).
ADS CAS Статья Google ученый
Оливиери, Г., Парри, К. М., Пауэлл, К. Дж., Тобиас, Д. Дж. И Браун, М. А. Количественная интерпретация моделирования молекулярной динамики для рентгеновской фотоэлектронной спектроскопии водных растворов. J. Chem. Phys. 144 , 154704 (2016).
ADS Статья PubMed PubMed Central Google ученый
Weber, R. et al. Фотоэмиссия из водных растворов солей иодида щелочного металла с использованием синхротронного излучения EUV. J. Phys. Chem. B 108 , 4729–4736 (2004).
CAS Статья Google ученый
Винтер Б. и Фаубель М. Фотоэмиссия из жидких водных растворов. Chem. Сборка 106 , 1176–1211 (2006).
CAS Статья PubMed Google ученый
Thurmer, S. et al. О природе и происхождении дикатионов с разделенными зарядами, образующихся в жидкой воде при облучении рентгеновскими лучами. Nat. Chem . 5 , 590–596 (2013).
Артикул PubMed Google ученый
Славичек П., Крыжевой Н. В., Азиз Э. Ф. и Винтер Б. Релаксационные процессы в водных системах при рентгеновской ионизации: переплетение электронной и ядерной динамики. J. Phys.Chem. Lett. 7 , 234–243 (2016).
CAS Статья PubMed Google ученый
Вайда В. Перспектива: химический состав атмосферы, опосредованный кластерами воды. J. Chem. Phys. 135 , 020901 (2011).
ADS Статья PubMed Google ученый
Li, L.и другие. Формирование почти безбарьерного бисульфата аммония посредством петлевой структуры способствовало механизму переноса протона на поверхности воды. J. Am. Chem. Soc. 138 , 1816–1819 (2016).
CAS Статья PubMed Google ученый
Zhu, C.Q. et al. Новые механистические пути для химии Криджи-вода на границе раздела воздух / вода. J. Am. Chem. Soc. 138 , 11164–11169 (2016).
CAS Статья PubMed Google ученый
Хаммерик, А. Д. и Бух, В. Альтернативное определение водородной связи в воде «ближним соседом». J. Chem. Phys. 128 , 111101 (2008).
ADS CAS Статья PubMed Google ученый
Ксантеас, С. С. и Вот, Г. А. Водные растворы и их границы раздела. J. Phys. Chem. B 113 , 3997–3999 (2009).
CAS Статья PubMed Google ученый
Miller, Y. et al. Структура крупных кластеров нитрат-вода при температуре окружающей среды: моделирование с эффективными потенциалами фрагментов и силовыми полями с последствиями для химии атмосферы. J. Phys. Chem. A 113 , 12805–12814 (2009).
CAS Статья PubMed Google ученый
Крепелова А., Ньюберг Дж. Т., Хутвелкер Т., Блум Х. и Амманн М. Природа нитратов на поверхности льда изучалась с помощью XPS и NEXAFS. Phys. Chem. Chem. Phys. 12 , 8870–8880 (2010).
CAS Статья PubMed Google ученый
Бертрам Т.H. et al. Прямые наблюдения реакционной способности N2O5 на окружающих аэрозольных частицах. Geophys. Res. Lett. 36 , L19803 (2009).
ADS Статья Google ученый
Инаба, С. Теоретическое исследование разложения муравьиной кислоты, катализируемого кластерами воды. J. Phys. Chem. A 118 , 3026–3038 (2014).
CAS Статья PubMed Google ученый
Инаба, С. и Самира, В. М. С. Дегидратация метандиола в водном растворе: исследование ONIOM (QM / MM). J. Phys. Chem. A 120 , 6670–6676 (2016).
CAS Статья PubMed Google ученый
Gerber, R. B. et al. Вычислительные исследования атмосферно значимых химических реакций в кластерах воды и на жидкой воде и на поверхности льда. В соотв. Chem.Res. 48 , 399–406 (2015).
CAS Статья PubMed Google ученый
Рамабхадран Р. О. и Рагхавачари К. Экстраполяция к золотому стандарту в квантовой химии: вычислительно эффективные и точные энергии CCSD (T) для больших молекул с использованием автоматизированной термохимической иерархии. J. Chem. Теория Comp 9 , 3986–3994 (2013).
CAS Статья Google ученый
Джордж, Г. Н. и др. Рентгеновская фотохимия и рентгеновская абсорбционная спектроскопия биологических образцов. J. Synchr. Радиат 19 , 875–886 (2012).
CAS Статья Google ученый
Маркс Д. и Хаттер Дж. Ab initio молекулярная динамика (Cambridge University Press, 2009).
Lakey, P. S. J. et al. Взаимосвязь между химическим воздействием и реакцией между загрязнителями воздуха и химически активными формами кислорода в дыхательных путях человека. Sci. Репутация . 6 , 32916 (2016).
ADS CAS Статья PubMed PubMed Central Google ученый
Моллер, К. и Плессет, М.С. Примечание об аппроксимационной трактовке для многоэлектронных систем. Phys. Ред. . 46 , 0618–0622 (1934).
ADS CAS Статья МАТЕМАТИКА Google ученый
Рагхавачари К., Тракс Г. В., Попл Дж. А. и Реплогл Е. Высококоррелированные системы: структура, энергия связи и частоты гармонических колебаний озона. Chem. Phys. Lett. 158 , 207–212 (1989).
ADS CAS Статья Google ученый
Frisch, M. J. et al. Gaussian 09, редакция E01 (Gaussian Inc., 2017).
Хаттер, Дж., Яннуцци, М., Шиффманн, Ф. и Ванде Вонделе, Дж. Междисциплинарные обзоры Wiley: Computational Molecular Science Vol. 4, 15–25 (John Wiley & Sons Ltd., 2014).
Ли К., Янг В. и Парр Р. Г. Преобразование формулы корреляционной энергии Колле-Сальветти в функционал электронной плотности. Phys. Ред.B 37 , 785–789 (1988).
ADS CAS Статья Google ученый
Беке, А. Д. Приближение функционала плотности обменной энергии с правильной асимптотикой. Phys. Ред. A 38 , 3098–3100 (1988).
ADS CAS Статья Google ученый
Гримме, С., Энтони, Дж., Эрлих, С. и Криг, Х. Последовательная и точная неэмпирическая параметризация поправки на функциональную дисперсию плотности (DFT-D) для 94 элементов H-Pu. J. Chem. Phys. 132 , 154104 (2010).
ADS Статья PubMed Google ученый
Годекер С., Тетер М. и Хаттер Дж. Сепарабельные гауссовские псевдопотенциалы в двойном пространстве. Phys.Ред. B 54 , 1703–1710 (1996).
ADS CAS Статья Google ученый
Schmidt, M. W. et al. Система общей атомной и молекулярной электронной структуры. J. Comput. Chem. 14 , 1347–1363 (1993).
CAS Статья Google ученый
Холм, А., Борве, К. Дж., Сотре, Л. Дж. И Томас, Т. Д. Точность вычисленных химических сдвигов в энергиях ионизации углерода 1s на основе одноэтапных методов ab initio и теории функционала плотности. J. Chem. Теория Comp . 7 , 4104–4114 (2011).
CAS Статья Google ученый
Шим, Дж., Клобуковский, М., Барыш, М., Лещинский, Дж. Калибровка и применение метода ΔMP2 для расчета энергии связи остовных электронов. Phys. Chem. Chem. Phys. 13 , 5703 (2011).
CAS Статья PubMed Google ученый
Brown, M. A. et al. Новая конечная станция швейцарского источника света для ультрафиолетовой фотоэлектронной спектроскопии, рентгеновской фотоэлектронной спектроскопии и рентгеновской абсорбционной спектроскопии для измерений жидких растворов. Rev. Sci. Instrum. 84 , 073904 (2013).
ADS Статья PubMed Google ученый
Kurahashi, N. et al. Фотоэлектронная спектроскопия водных растворов: потенциалы течения растворов NaX (X = Cl, Br и I) и энергии связи электронов жидкой воды и X-. J. Chem. Phys. 140 , 174506 (2014).
ADS Статья PubMed Google ученый
Винтер Б., Азиз Э. Ф., Хергенхан У., Фаубель М. и Хертель И. В. Водородные связи в жидкой воде изучались методом фотоэлектронной спектроскопии. J. Chem. Phys. 126 , 124504 (2007).
ADS Статья PubMed Google ученый
Фотоэлектронная спектроскопия высших анионов оксида брома и йода: сродство к электрону и электронная структура радикалов BrO2,3 и IO2-4
Аннотация
В этом отчете подробно описываются фотоэлектронная спектроскопия (PES) и теоретическое исследование сродства к электрону (EAs) и электронных структур нескольких атмосферно релевантных молекул высших брома и оксида йода в газовой фазе.Спектры ППЭ BrO 2 — и IO 2 — были зарегистрированы при 12 К и четырех энергиях фотонов — 355 нм / 3,496 эВ, 266 нм / 4,661 эВ, 193 нм / 6,424 эВ и 157 нм / 7,867 эВ — в то время как BrO 3 — , IO 3 — и IO 4 — изучались только при 193 и 157 нм из-за ожидаемых высоких энергий связи электронов. Спектральные особенности, соответствующие переходам из основного анионного состояния в основное и возбужденное состояния нейтрали, раскрыты и разрешены для каждого вида.ЭА этих оксидов брома и йода впервые экспериментально определены (кроме IO 2 ) и составляют 2,515 ± 0,010 (BrO 2 ), 2,575 ± 0,010 (IO 2 ), 4,60 ± 0,05 (BrO 3 ), 4,70 ± 0,05 (IO 3 ) и 6,05 ± 0,05 эВ (IO 4 ). Три низколежащих возбужденных состояния вместе с их соответствующими энергиями возбуждения получены для BrO 2 [1,69 (A 2 B 2 ), 1,79 (B 2 A 1 ), 1.99 эВ (C 2 A 2 )], BrO 3 [0,7 (A 2 A 2 ), 1,6 (B 2 E), 3,1 эВ (C 2 E)] , и IO 3 [0,60 (A 2 A 2 ), 1,20 (B 2 E), ∼3,0 эВ (C 2 E)], тогда как шесть возбужденных состояний IO 2 являются определены вместе с их соответствующими энергиями возбуждения 1,63 (A 2 B 2 ), 1,73 (B 2 A 1 ), 1,83 (C 2 A 2 ), 4.23 (D 2 A 1 ), 4,63 (E 2 B 2 ) и 5,23 эВ (F 2 B 1 ). Периодат (IO 4 — ) обладает очень высокой энергией связи электронов. Только одна особенность возбужденного состояния с энергией возбуждения 0,95 эВ показана в спектре 157 нм. Сопутствующие теоретические расчеты показывают структурные изменения от анионов к нейтральным, а рассчитанные ЭА хорошо согласуются с экспериментально определенными значениями. Моделирование факторов Франка-Кондона хорошо воспроизводит наблюдаемые колебательные прогрессии для BrO 2 и IO 2 .Информация о низколежащих возбужденных состояниях сравнивается с теоретическими расчетами и обсуждается с учетом их влияния на атмосферу.
Бром
Хотя некоторые соединения брома могут быть очень вредными для окружающей среды (например, бромметан приводит к истощению озона в стратосфере), они также чрезвычайно важны для производства многих незаменимых соединений.
Использование брома
Некоторые важные антипирены, такие как тетрабромбисфенол А, являются производными брома и бромных соединений, хотя эффективность некоторых из них вызывает опасения.Например, антипирены либо связаны (химически), либо физически включены в пластмассы. Это особенно важно при использовании пластмасс там, где существует опасность возгорания.
Бром также используется в производстве биоцидов, таких как биобром (2,2-дибром-3-нитрилопропионамид). Он широко используется при очистке воды
Концентрированные растворы бромида кальция и бромида магния (известные под общим названием «прозрачные рассолы») используются при бурении нефтяных скважин. Это очень плотные растворы ( около 1.8 кг м -3 ) и при заливке в буровую скважину тонет в воде на дно. Они помогают смазывать сверло, увеличивая его способность сверлить глубже. Они также помогают диспергировать выбуренные твердые частицы.
Рис. 1 Использование брома.
Хотя на Рисунке 1 показаны данные об использовании брома во всем мире, пропорция варьируется от страны к стране. Например, в США меньше (45%) используется для изготовления антипиренов и больше (21%) в качестве прозрачных рассолов для бурения.
Еще одно применение брома заключается в производстве бромметана, который используется в качестве фумиганта против вредителей и для очистки почвы перед посадкой. Однако важность этого вопроса снижается, поскольку существуют международные соглашения о сокращении его использования, поскольку, как и ХФУ, считается, что он приводит к истощению озона при его переносе в стратосферу. В настоящее время он используется в строго ограниченных условиях в развитых странах, но разрешен к использованию до 2015 года в развивающихся странах.
Годовое производство брома
| Весь мир | 390 000 тонн |
| Израиль | 150 000 тонн |
| Иордания | 100 000 тонн |
| Китай | 100 000 тонн |
| Япония | 30 000 тонн |
| Украина | 3 500 тонн |
Данные из:
U.S. Геологическая служба, Сводные данные по минерально-сырьевым товарам, 2016 г.
Цифра для Соединенных Штатов не указана. Самые последние доступные цифры показывают, что они были похожи на продукцию Израиля.
Производство брома
Бром получают окислением бромид-ионов:
Процесс состоит из двух идентифицируемых этапов:
а) окисление бромид-ионов до брома
б) очистка брома
(а) Окисление бромид-ионов до брома
Хлор и вода перекачиваются в колонну, по которой стекает горячий рассол, богатый ионами бромида.
Бром выделяется из раствора окислением бромид-ионов газообразным хлором:
(б) Очистка брома
Сырой бром, содержащий воду, хлор и органические вещества, очищают перегонкой. Бром из раствора «удаляется» паром. В одном процессе (используемом в США) пар пропускается через жидкость при пониженном давлении до тех пор, пока она не закипит. Бром собирается вместе с конденсированным паром и разделяется на два слоя, поскольку бром лишь слабо растворяется в воде.В Израиле паровая дистилляция проводится при атмосферном давлении. Бром дополнительно очищают перегонкой, а затем сушат концентрированной серной кислотой. Около 95% брома извлекается из рассола.
Морская вода содержит ионы бромида, но в гораздо меньшем количестве, чем ионы хлора, около 65 частей на миллион (частей на миллион). Действительно, для производства 1 тонны брома необходимо переработать 20 000 тонн морской воды.
Однако существуют источники с гораздо более высокими концентрациями бромид-ионов.Примерами являются солевые отложения в Арканзасе в США, где концентрация бромид-ионов колеблется от 4000-6000 ppm, и Мертвое море в Израиле, где концентрация еще больше, 6000-12 000 ppm.
Дата последнего изменения: 6 октября 2016 г.
Химия галогенов
Химия Галогены
The Галогены
В группе VIIA, предпоследний столбец, шесть элементов. таблицы Менделеева.Как и ожидалось, у этих элементов есть определенные общие свойства. Все они образуют двухатомные молекулы (H 2 , F 2 , Cl 2 , Br 2 , I 2 и На 2 ), например, и все они образуют отрицательно заряженные ионы (H — , F — , Cl — , Br — , I — и At — ).
Когда обсуждается химия этих элементов, водород отделены от других, а астатин игнорируется, потому что он радиоактивный.(Наиболее стабильные изотопы астата имеют период полураспада менее минуты. В результате наибольший образцов соединений астата, изученных на сегодняшний день, было меньше, чем 50 нг.) Обсуждения химии элементов в Группе Поэтому VIIA сосредотачивается на четырех элементах: фтор, хлор, бром и йод. Эти элементы называются галогенами (от греческого hals «соль» и gennan , «формировать или генерировать»), потому что они буквально солеобразователи.
Ни один из галогенов не встречается в природе в их элементарной форме. форма. Они неизменно находятся в виде солей галогенида ионы (F — , Cl — , Br — и I — ). Ионы фтора содержатся в минералах, таких как флюорит (CaF 2 ). и криолит (Na 3 AlF 6 ). Ионы хлорида содержится в каменной соли (NaCl) океанов, которая составляет примерно 2% Cl — иона по весу, а в озерах с высоким содержанием соли, например как Большое Соленое озеро в штате Юта, которое на 9% состоит из ионов Cl — . масса.И бромид, и иодид-ионы обнаруживаются при низких концентрации в океанах, а также в скважинах с рассолом в Луизиана, Калифорния и Мичиган.
Галогены в их элементальная форма
Фтор (F 2 ), высокотоксичный бесцветный газ, является самый реактивный элемент, известный настолько реактивный, что асбест, вода, и кремний загорелся в его присутствии. Это так реактивно он даже образует соединения с Kr, Xe и Rn, элементами, которые были когда-то считалось инертным.Фтор — такой мощный окислитель. агент, что он может уговорить другие элементы на необычно высокий степени окисления, как в AgF 2 , PtF 6 и IF 7 .
Фтор настолько реактивен, что трудно найти тара, в которой его можно хранить. F 2 атакует оба стекло и кварц, например, и вызывает взрыв большинства металлов в пламя. Фтор обрабатывается в оборудовании, изготовленном из определенных материалов. сплавы меди и никеля.Он все еще вступает в реакцию с этими сплавами, но он образует на поверхности слой фторида, который защищает металл от дальнейшей реакции.
Фтор используется в производстве тефлона или поли (тетрафторэтилен), (C 2 F 4 ) n , который используется для всего: от подкладок для кастрюль и сковородок до прокладок инертные к химическим реакциям. Большое количество фтора также потребляются каждый год для производства фреонов (например, CCl 2 F 2 ) используется в холодильниках.
Хлор (Cl 2 ) — высокотоксичный газ с бледным желто-зеленый цвет. Хлор — очень сильный окислитель, который используется в коммерческих целях как отбеливающий агент и как дезинфицирующее средство. Он достаточно силен, чтобы окислять красители, дающие древесная масса, например, желтого или коричневого цвета, тем самым отбеливающий этот цвет и достаточно сильный, чтобы уничтожить бактерии и тем самым действовать как бактерицид. Большое количество хлора используется каждый год для производства растворителей, таких как четыреххлористый углерод (CCl 4 ), хлороформ (CHCl 3 ), дихлорэтилен (C 2 H 2 Cl 2 ), и трихлорэтилен (C 2 HCl 3 ).
Бром (Br 2 ) — жидкость красновато-оранжевого цвета с неприятный запах удушья. Название элемента, по сути, идет от греческого слова bromos , «зловоние». Бром используется для приготовления антипиренов, средств пожаротушения, седативные средства, антидетонационные средства для бензина и инсектициды.
Йод — твердое вещество интенсивного цвета с почти металлическим блеск. Это твердое вещество относительно летучее и возгоняется, когда нагревается до образования фиолетового газа.Йод использовался для много лет как дезинфицирующее средство в «настойке йода». Соединения йода используются в качестве катализаторов, лекарств и красителей. Серебро йодид (AgI) играет важную роль в фотографическом процессе и в попытках вызвать дождь, засевая облака. Йодид также добавлен в соль для защиты от зоба, дефицита йода заболевание, характеризующееся отеком щитовидной железы.
Некоторые химические и физические свойства галогенов приведены в таблице ниже.Наблюдается регулярное увеличение многие свойства галогенов, когда мы спускаемся вниз по столбец от фтора до йода, включая температуру плавления, температура кипения, интенсивность окраски галогена, радиус соответствующего галогенид-иона и плотности элемента. С другой стороны, наблюдается закономерное снижение первых энергия ионизации при спуске по столбцу. В результате там регулярное снижение окислительной способности галогенов от фтора до йода.
| F 2 > Cl 2 > Br 2 > Я 2 |
| окислительная способность |
Эта тенденция отражается увеличением восстановительной силы соответствующих галогенидов.
| I —> Br —> Класс —> F — |
| понижающая прочность |
Некоторые свойства F 2 , Класс 2 , Br 2 , и я 2
| Плавка Путевая точка (С) | Кипячение Путевая точка (С) | Цвет | натуральный Изобилие (частей на миллион) | 1-й Ионизация Энергия (кДж / моль) | Электрон Родство (кДж / моль) | Ионный Радиус (нм) | Плотность (г / см 3 ) | |||||||||
| Ф. 2 | -218.6 | -188,1 | бесцветный | 544 | 1680,6 | 322,6 | 0,133 | 1,513 | ||||||||
| Класс 2 | -101.0 | -34,0 | бледно-зеленый | 126 | 1255,7 | 348,5 | 0,184 | 1.655 | ||||||||
| Br 2 | -7.3 | 59,5 | темно-красно-коричневый | 2,5 | 1142,7 | 324,7 | 0,196 | 3,187 | ||||||||
| Я 2 | 113.6 | 185,2 | очень темно-фиолетовый почти черный | 0,46 | 1008,7 | 295,5 | 0,220 | 3,960 |
Методы Получение галогенов из их галогенидов
Галогены могут быть получены реакцией раствора галогенида ион с любым веществом, которое является более сильным окислителем.Йод, например, можно получить путем реакции иодид-иона с либо бром, либо хлор.
| 2 I — ( водн. ) | + | Br 2 ( водн. ) | I 2 ( водн. ) | + | 2 Br — ( водн. ) |
Бром впервые был получен А.Ж. Балард в 1826 г. бромид-ионы с раствором Cl 2 , растворенного в воды.
| 2 Br — ( водн. ) | + | Класс 2 ( водн. ) | Br 2 ( водн. ) | + | 2 класса — ( водн. ) |
Для приготовления Cl 2 нам понадобится особо прочный окислитель, такой как диоксид марганца (MnO 2 ).
| 2 класса — ( водн. ) | + | MnO 2 ( водн. ) | + | 4 ч + ( водн. ) | Класс 2 ( водн. ) | + | Mn 2+ ( водн. ) | + | 2 H 2 O ( л ) |
Синтез фтора ускользнул от усилий химиков для почти 100 лет.Частично проблема заключалась в том, чтобы найти окислитель. агент, достаточно сильный, чтобы окислить ион F — до F 2 . Задача получения фтора осложнялась еще и тем, что необычайная токсичность как F 2 , так и водорода фторид (HF) использовался для его изготовления.
Лучший способ получения сильного восстановителя — это пропустить электрический ток через соль металла. Натрий, для Например, может быть получен электролиз расплавленного натрия хлористый.
| электролизный | ||||
| 2 NaCl ( л ) | 2 Na ( с ) | + | Класс 2 ( г ) |
Теоретически тот же процесс можно использовать для создания сильных окислители, такие как F 2 .
Попытки получить фтор электролизом, однако, были изначально неудачный. Хэмфри Дэви, приготовивший калий, натрий, барий, стронций, кальций и магний путем электролиза неоднократно пытались получить F 2 электролизом флюорит (CaF 2 ), и ему удалось только разрушить его здоровье. Жозеф Луи Гей-Люссак и Луи Жак Тенар, которые впервые приготовили элементарный бор, также пробовали приготовили фтор и пострадали от очень болезненного воздействия фтороводород.Джордж и Томас Нокс были сильно отравлены во время их попыток получить фтор, и Полин Луйе и Джером Никлз умер от отравления фтором.
Наконец, в 1886 году Анри Муассан успешно изолировал F 2 газ от электролиза смешанной соли KF и HF и отметил что кристаллы кремния вспыхивают при смешивании с этим газ. Электролиз KHF 2 все еще используется для приготовления фтор сегодня, как показано на рисунке ниже.
| электролизный | ||||||
| 2 KHF 2 ( s ) | H 2 ( г ) | + | F 2 ( г ) | + | 2 KF ( с ) |
Обычное окисление Номера галогенов
Фтор — самый электроотрицательный элемент в периодической стол.В результате он имеет степень окисления -1 во всех его соединения. Поскольку хлор, бром и йод меньше электроотрицательный, можно приготовить соединения, в которых эти элементы имеют степени окисления +1, +3, +5 и +7, так как показано в таблице ниже.
Общие числа окисления для галогенов
| Окисление Число | Примеры | |
| -1 | CaF 2 , HCl, NaBr, AgI | |
| 0 | F 2 , Cl 2 , Br 2 , I 2 | |
| +1 | HClO, ClF | |
| +3 | HClO 2 , ClF 3 | |
| +5 | HClO 3 , BrF 5 , BrF 6 —, IF 5 | |
| +7 | HClO 4 , BrF 6 + , IF 7 |
Общие тенденции в Галогенная химия
В химии галогенов есть несколько закономерностей.
1. Ни двойные, ни тройные связи не нужны для объяснения химия галогенов.
2. Химия фтора упрощена тем, что он самый электроотрицательный элемент в периодической таблице и тот факт, что в его валентной оболочке нет орбиталей d , поэтому он не может расширить свою валентную оболочку.
3. Хлор, бром и йод имеют валентную оболочку d орбитали и могут расширять свои валентные оболочки, чтобы удерживать до 14 валентных электронов.
4. В химии галогенов преобладают окислительно-восстановительные реакции.
Галогениды водорода (HX)
галогенидов водорода — это соединения, содержащие водород присоединен к одному из галогенов (HF, HCl, HBr и HI). Все эти соединения представляют собой бесцветные газы, растворимые в воды. До 512 мл газообразного HCl может раствориться в одном мл вода при температуре 0 o ° C и давлении 1 атм.Каждый из галогениды водорода ионизируются, по крайней мере, в некоторой степени, когда он растворяется в воде.
| H 2 O | ||||
| HCl ( г ) | H + ( водн. ) | + | Класс — ( водн. ) |
Некоторые галогениды водорода могут быть получены непосредственно из элементы.Смеси H 2 и Cl 2 , для Например, реагируйте взрывным насилием при наличии света с образованием HCl.
| H 2 ( г ) | + | Класс 2 ( г ) | 2 HCl ( г ) |
Поскольку химики обычно больше интересуются водными растворов этих соединений, чем чистые газы, эти соединения обычно синтезируются в воде.Водные растворы галогениды водорода часто называют минеральными кислотами , потому что это буквально кислоты, полученные из минералов. Соляной кислоту получают реакцией поваренной соли с серной кислотой, для Например, плавиковую кислоту получают из флюорита и серная кислота.
| 2 NaCl ( с ) | + | H 2 SO 4 ( водн. ) | 2 HCl ( водн. ) | + | Na 2 SO 4 ( водн. ) | |
| CaF 2 ( s ) | + | H 2 SO 4 ( водн. ) | 2 HF ( водн. ) | + | CaSO 4 ( водн. ) |
Эти кислоты очищают с использованием легкость, с которой газ HF и HCl выкипает из этих растворов.При нагревании одного из этих растворов выделяется газ. собираются, а затем повторно растворяются в воде, чтобы получить относительно чистый образцы минеральной кислоты.
Интергалоген Соединения
Межгалогенные соединения образуются в результате реакций между разные галогены. Все возможные межгалогенные соединения Тип XY известны. Бром реагирует с хлором, так как Например, чтобы получить BrCl, который является газом при комнатной температуре.
| Br 2 ( л ) | + | Класс 2 ( г ) | 2 BrCl ( г ) |
Межгалогенные соединения общей формулы XY 3 , XY 5 , и даже XY 7 являются образуется при реакции пар галогенов. Хлор реагирует с фтор, например, с образованием трифторида хлора.
| Класс 2 ( г ) | + | 3 F 2 ( г ) | 2 класса 3 ( г ) |
Эти соединения легче всего образовывать, когда Y фтор. Йод — единственный галоген, образующий XY 7 межгалогенное соединение, причем только с фтором.
ClF 3 и BrF 5 чрезвычайно реактивны соединения. ClF 3 настолько реактивен, что древесина, асбест, и даже вода самопроизвольно загорается в его присутствии. Эти соединения являются отличными фторирующими агентами, которые склонны вступать в реакцию друг с другом с образованием положительных ионов, таких как ClF 2 + и BrF 4 + и отрицательные ионы, такие как IF 2 — и BrF 6 — .
| 2 BrF 5 ( л ) | [BrF 4 + ] [BrF 6 — ] ( s ) |
Нейтральные оксиды Галогены
При определенных условиях можно изолировать нейтраль оксиды галогенов, такие как Cl 2 O, Cl 2 O 3 , ClO 2 , Cl 2 O 4 , Cl 2 O 6 , и Cl 2 O 7 .Cl 2 O 7 , для Например, может быть получена дегидратация хлорной кислоты, HClO 4 . Эти оксиды являются заведомо нестабильными соединениями, которые взрываются при подвергнуты термическому или физическому удару. Некоторые так нестабильные они взрываются при нагревании до температуры выше -40 o С.
Оксикислоты Галогены и их соли
Хлор реагирует с ионом OH — с образованием хлорида ионы и ионы гипохлорита (OCl — ).
| Класс 2 ( водн. ) | + | 2 OH — ( водн. ) | Класс — ( водн. ) | + | OCl — ( водн. ) | + | H 2 O ( л ) |
Это реакция диспропорционирования, в которой половина атомы хлора окисляются до ионов гипохлорита, а другие половина восстанавливается до ионов хлора.
Когда раствор горячий, эта реакция дает смесь хлорид и хлорат (ClO 3 —) ионы.
| 3 класса 2 ( водн. ) | + | 6 OH — ( водн. ) | 5-й класс — ( водн. ) | + | ClO 3 — ( водн. ) | + | 3 H 2 O ( л ) |
В тщательно контролируемых условиях возможно преобразовать смесь ионов хлората и гипохлорита в раствор, содержащий хлорит (ClO 2 —) ион.
| ClO 3 — ( водн. ) | + | ClO — ( водн. ) | 2 ClO 2 — ( водн. ) |
Последний представитель этого класса соединений, перхлорат. ион (ClO 4 — ), производится электролизом растворы хлорат-иона.
В названиях оксианионов галогенов используются окончания — ите и — ate для обозначения низкой и высокой степени окисления и префиксы hypo — и на — для обозначения очень низкие и очень высокие степени окисления, как показано на Таблица ниже. Каждый из этих ионов может быть преобразован в оксикислоту, который назван заменой — ite , заканчивающейся на — ous и — съел , заканчивая — ic .
Оксианионы и оксикислоты хлора
| Оксианионы | Оксикислоты | ||||||||
| Состояние окисления хлора | Соединение | Имя | Соединение | Имя | |||||
| +1 | ClO — | гипохлорит | HClO | хлорноватистая кислота | |||||
| +3 | ClO 2 — | хлорит | HOClO | хлорноватистая кислота | |||||
| +5 | ClO 3 — | хлорат | HOClO 2 | хлорная кислота | |||||
| +7 | ClO 4 — | перхлорат | HOClO 3 | хлорная кислота | |||||

 Б. S и Se. В. K и Ca. Г. Cr и Fe.
Б. S и Se. В. K и Ca. Г. Cr и Fe.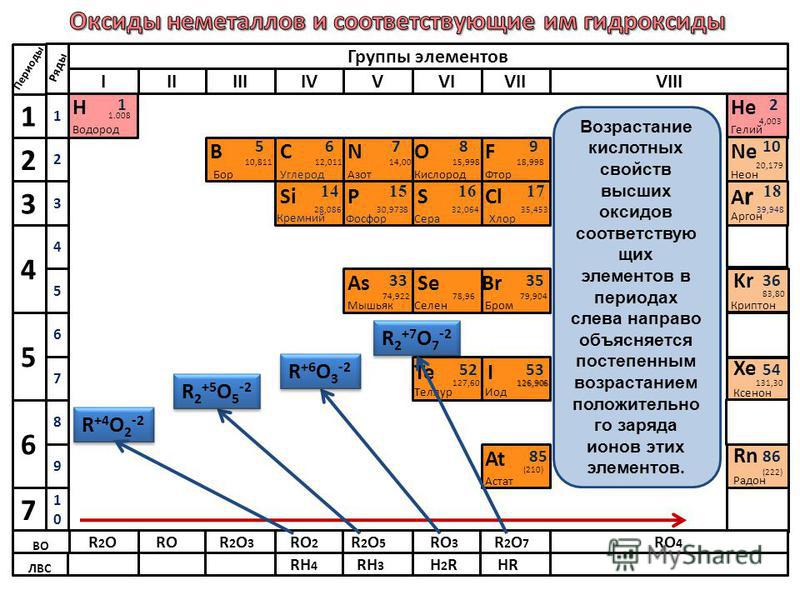 5426Fe. Б. 5626Fe. В. 5726Fe. Г. 5826Fe .
5426Fe. Б. 5626Fe. В. 5726Fe. Г. 5826Fe . Как и почему в Периодической системе изменяются неметаллические свойства?
Как и почему в Периодической системе изменяются неметаллические свойства?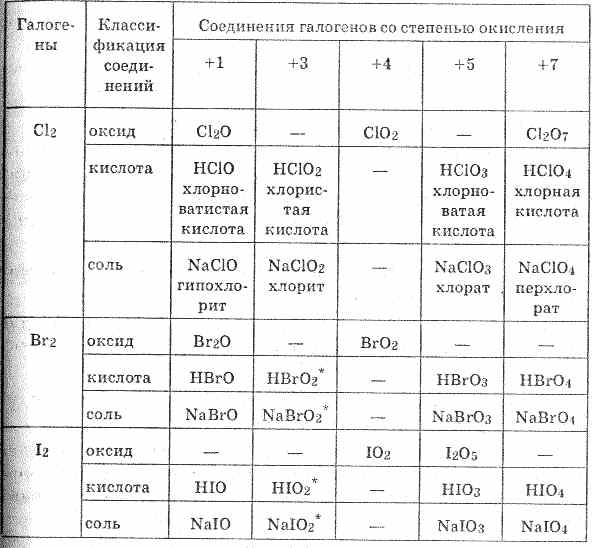 Атомные ядра были открыты:
Атомные ядра были открыты: Кальцию. Б. Криптону. В. Кадмию. Г. Цинку.
Кальцию. Б. Криптону. В. Кадмию. Г. Цинку. В. Марганцу. Г. Хлору.
В. Марганцу. Г. Хлору.
Leave A Comment