Функции и состояние эндотелиального гликокаликса в норме и патологии Текст научной статьи по специальности «Биотехнологии в медицине»
Функции и состояние эндотелиального гликокаликса в норме и патологии
Максименко А.В., Турашев А.Д.
ФГУ РКНПК МЗиСР РФ, Москва
Абстракт
В норме на поверхности сосудистого эндотелия присутствует сложная многокомпонентная система, называемая гликокаликсом. Его структура определяется группой протеогликанов, гликопротеинов и гликозаминогликанов, берущих начало из клеток эндотелия и кровотока. Благодаря своей комплексности и расположению на границе системы циркуляции крови, гликокаликс принимает участие в ряде функций, поддерживающих метаболизм кровотока. В условиях патологии происходит полная или частичная потеря этой структуры, что приводит к нарушению целостности сосудистой стенки и изменению ее функций.
Ключевые слова: эндотелий, гликокаликс, сосудистая проницаемость, напряжение сдвига кровотока, межклеточные взаимодействия, гипергликемия, ишемия/реперфузия, атеросклероз.
Functions and state of endothelial glycocalyx in the norm and pathology conditions
Maksimenko A. V, Turashev A.D.
Russian Cardiology Research Complex, Moscow
Abstract
In normal state, a complex multicomponent system called glycocalyx is present on the surface of endothelial vascular system. The structure of the glycocalyx is determined by a group of proteoglycans, glycoproteins and glycosaminoglycans, originating from endothelial cells and blood flow. Due to its complexity and location on the border of the system of blood circulation, glycocalyx participates in a number of functions supporting the metabolism of the vascular wall. Complete or partial loss of this structure in pathological conditions leads to inconsistencies in the vascular wall and changes itsfunctions. In this review we consideredfunctions of endothelial glycocalyx: its involvement in the regulation of vascular permeability, transduction and transformation by the shear stress of blood flow on endothelium, the molecular regulation of glycocalyx microenvironment and its interaction with circulating blood cells.
The structure of the glycocalyx is determined by a group of proteoglycans, glycoproteins and glycosaminoglycans, originating from endothelial cells and blood flow. Due to its complexity and location on the border of the system of blood circulation, glycocalyx participates in a number of functions supporting the metabolism of the vascular wall. Complete or partial loss of this structure in pathological conditions leads to inconsistencies in the vascular wall and changes itsfunctions. In this review we consideredfunctions of endothelial glycocalyx: its involvement in the regulation of vascular permeability, transduction and transformation by the shear stress of blood flow on endothelium, the molecular regulation of glycocalyx microenvironment and its interaction with circulating blood cells.
— Key words: endothelium, glycocalyx, vascular permeability, shear stress, cell-cell interactions, hyperglycemia, ischemia/ reperfusion, atherosclerosis.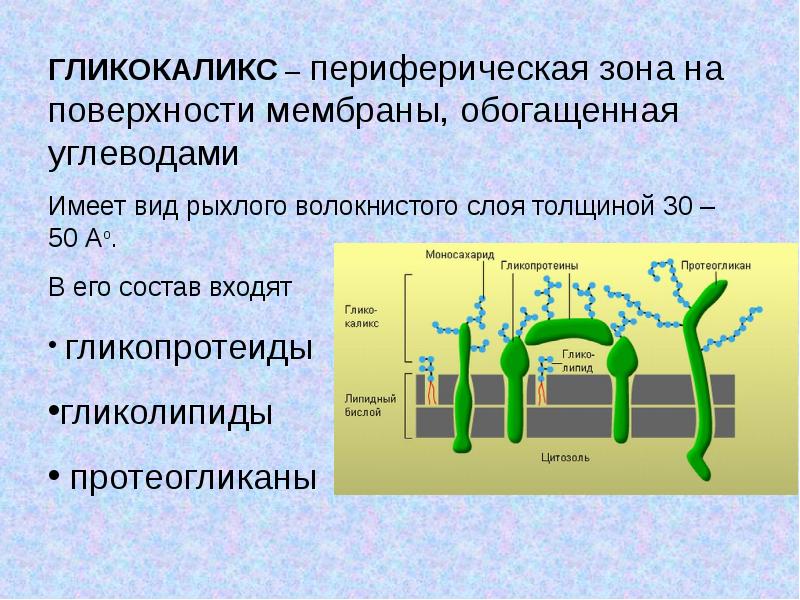
Эндотелий выполняет важную роль в регуляции сосудистого гомеостаза, представляя собой непосредственную зону контакта между циркулирующей в организме кровью и прилегающими к сосудистой стенке тканями. Помимо того, что через него происходит обмен нутриентами и продуктами жизнедеятельности тканей, клетки эндотелия находятся в динамическом взаимодействии с гормональными и клеточными медиаторами, берущими начало в кровотоке и сосудистой стенке [1]. Стратегическое расположение эндотелиального гликокаликса (ЭГК) на границе взаимодействия кровотока и эндотелия подразумевает участие этой структуры в широком спектре процессов функционирования сосудистой системы, как в условиях нормы, так и при патологии [2]. Основными функциями ЭГК в норме являются: регуляция сосудистого гомеостаза и тонуса, поддержание интерстициального жидкостного равновесия и контроль взаимодействия
4
клеток крови и сигнальных соединений с сосудистой стенкой.
Эндотелиальный гликокаликс как регулятор сосудистой проницаемости
Благодаря своей специфической ячеистой структуре и суммарному отрицательному заряду, ЭГК может выступать в роли селективного молекулярного сита, обеспечивающего избирательную фильтрацию компонентов плазмы крови и регулирующего сосудистую проницаемость [3, 4]. ЭГК является проницаемым для низкомолекулярных соединений (молекул воды, ионов и небольших гидрофильных веществ), тогда как в отношении высокомолекулярных соединений он демонстрирует избирательную проницаемость, в том числе зависящую от заряда макросоединения. Это свой-
ство ЭГК обнаружилось при изучении проницаемости артериол брыжейки крысы для флуоресцентно меченых декстранов с различным молекулярным весом [5]. Избирательная селективность ЭГК обеспечивает одинаковую проницаемость для белков плазмы в капиллярах с эндотелиальным слоем, как фенестрированного, так и непрерывного типа, несмотря на различия в коэффициентах фильтрации и ультраструктуры эндотелиального слоя разных типов [6].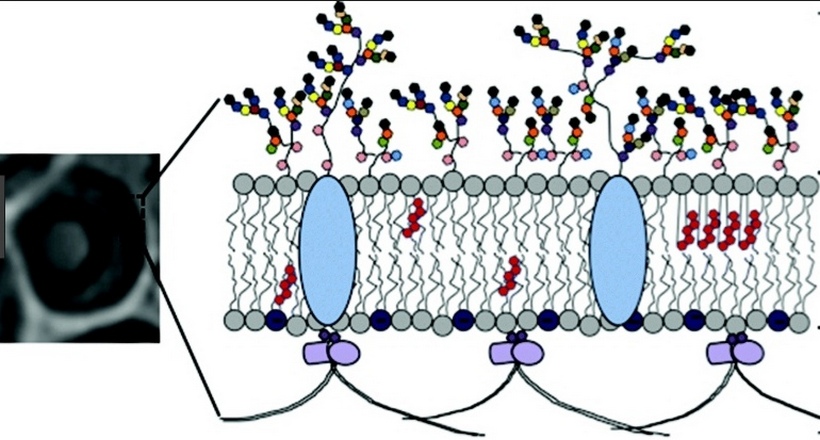 Ферментативное удаление ряда компонентов ЭГК приводит к увеличению сосудистой проницаемости для макромолекул кровотока (преимущественно белков плазмы, например, альбумина), результатом чего становится тканевый отек [7, 8].
Ферментативное удаление ряда компонентов ЭГК приводит к увеличению сосудистой проницаемости для макромолекул кровотока (преимущественно белков плазмы, например, альбумина), результатом чего становится тканевый отек [7, 8].
Благодаря селективной фильтрации макромолекул, ЭГК определяет происходящий на уровне капилляров обмен жидкостью между тканью и сосудистой сетью [9]. По классическим представлениям, общие барьерные свойства микрососудов при фильтрации жидкости определяются разницей между гидравлическими и коллоидноосмотическими давлениями в просвете сосуда и в прилежащей ткани, а также гидравлической проводимостью сосудистой стенки (уравнение Старлинга-Лэндиса) [10]. При этом постоянная фильтрация жидкости начинается на артериальном конце микрососудистого сегмента, а реабсорбция жидкости из ткани в просвет капилляра происходит ближе к венозному отделу микроцир-куляторного сегмента за счет разницы гидростатического давления на противоположных концах этого сегмента.
Обнаружение защитной функции ЭГК, нарушение которой приводит к развитию тканевого отека, позволило переосмыслить существующий принцип Старлинга. Была предложена концепция, согласно которой фильтрационные свойства капиллярной стенки определяются наличием на поверхности клеток эндотелия волокнистой пористой матрицы (ЭГК) [12, 13]. При этом локальный концентрационный градиент белка, создающий рабочее коллоидно-осмотическое (онкотическое) давление, следует применять не к общей толщине капиллярной стенки, а исключительно в отношении этой матрицы, самостоятельно регулирующей баланс между прямой и обратной фильтрацией жидкости с растворенными низкомолекулярными компонентами за счет конвекции и диффузии.
моделей (пространственной, а позже упрощенной одномерной) для расчета прохождения жидкости через капиллярную стенку с учетом существования ЭГК на поверхности эндотелиального слоя [14, 15]. Эксперименты для обоснования теоретического моделирования, выполненные на микрососудах брыжейки лягушки и крысы с тщательным контролем концентраций белка в тканевом пространстве и просвете сосуда методом конфокальной микроскопии, подтвердили предполагаемую роль ЭГК в сосудистой фильтрации за счет создаваемой разницы концентраций белка в областях на границах ЭГК [16, 17]. Таким образом, фильтрационные свойства капиллярных сетей в различных типах тканей могут быть сходны и зависят в первую очередь от наличия ЭГК и высокой концентрации в плазме отрицательно-заряженного альбумина, создающей требуемое для нормальной фильтрации онкотическое давление у поверхности сосудистой стенки.
В силу своей локализации монослой эндотелиальных клеток сосудистой стенки испытывает на себе действие механических сил, вызываемых постоянными изменениями нестационарных параметров кровотока [18]. Помимо того, что клетки эндотелия обладают группой рецепторных систем, реагирующих на действие циркулирующих биохимических медиаторов (гормонов, хемокинов, цитокинов и нейромедиаторов), они также располагают комплексом механизмов распознавания ге-модинамических воздействий и их преобразования в клеточные биохимические сигналы для регуляции сосудистого тонуса. Кровь может генерировать два типа механического воздействия на сосудистую стенку [18, 19]. Первое представляет кровяное давление, действующее перпендикулярно сосудистой стенке и оказывающее растягивающее воздействие на все ее компоненты (эндотелиальные и гладкомышечные клетки, перициты, базальный слой и внеклеточный матрикс), а второе действует параллельно сосудистой стенке и генерирует вязкостную силу — так называемое напряжение сдвига (fluid shear stress) — на люминальной поверхности сосуда. Таким образом, тангенциальное напряжение сдвига накладывается преимущественно на монослой эндотелиальных клеток и создает в нем внутреннее напряжение, которое реализуется в виде ответных физиологических реакций, поддерживающих гомеостаз сосудистой системы.
Помимо того, что клетки эндотелия обладают группой рецепторных систем, реагирующих на действие циркулирующих биохимических медиаторов (гормонов, хемокинов, цитокинов и нейромедиаторов), они также располагают комплексом механизмов распознавания ге-модинамических воздействий и их преобразования в клеточные биохимические сигналы для регуляции сосудистого тонуса. Кровь может генерировать два типа механического воздействия на сосудистую стенку [18, 19]. Первое представляет кровяное давление, действующее перпендикулярно сосудистой стенке и оказывающее растягивающее воздействие на все ее компоненты (эндотелиальные и гладкомышечные клетки, перициты, базальный слой и внеклеточный матрикс), а второе действует параллельно сосудистой стенке и генерирует вязкостную силу — так называемое напряжение сдвига (fluid shear stress) — на люминальной поверхности сосуда. Таким образом, тангенциальное напряжение сдвига накладывается преимущественно на монослой эндотелиальных клеток и создает в нем внутреннее напряжение, которое реализуется в виде ответных физиологических реакций, поддерживающих гомеостаз сосудистой системы. Напряжение сдвига оказывает влияние на ряд сосудистых процессов: регулирует морфологию эндотелиальных клеток, их проницаемость и продукцию вазоактивных соединений для регуляции сосудистого тонуса [18, 20]. Ответные реакции эндотелия на действие напряжения сдвига также участвуют в процессах репарации и развития сосудистых патологий, например, ангиогенеза, сосудистого ремоделирова-
Напряжение сдвига оказывает влияние на ряд сосудистых процессов: регулирует морфологию эндотелиальных клеток, их проницаемость и продукцию вазоактивных соединений для регуляции сосудистого тонуса [18, 20]. Ответные реакции эндотелия на действие напряжения сдвига также участвуют в процессах репарации и развития сосудистых патологий, например, ангиогенеза, сосудистого ремоделирова-
ния и очагового развития атеросклероза [21-23]. Во всех указанных процессах гемодинамические факторы регулируют функции эндотелия, как при непосредственном воздействии напряжения сдвига на апикальную клеточную поверхность, так и посредством растяжения эндотелиальных клеток, что меняет локальную концентрацию биологически активных соединений у поверхности эндотелия. Исследования механизмов преобразования напряжения сдвига в ответные реакции эндотелия показали, что при воздействии этого гемодинамического параметра в эндотелиальных клетках активируются разнообразные каскады передачи сигнала через мембранные компоненты и клеточные микродомены [20]. В этом процессе могут принимать участие ионные каналы клеточной мембраны, тирозинки-назные рецепторы, белки клеточной и базальной адгезии, цитоскелет, кавеолы, G-белки и первичные реснички. ЭГК также попал в число возможных кандидатов на роль сенсора и преобразователя действия напряжения сдвига [24].
В этом процессе могут принимать участие ионные каналы клеточной мембраны, тирозинки-назные рецепторы, белки клеточной и базальной адгезии, цитоскелет, кавеолы, G-белки и первичные реснички. ЭГК также попал в число возможных кандидатов на роль сенсора и преобразователя действия напряжения сдвига [24].
Плотный слой ЭГК на поверхности эндотелиальной клетки принимает на себя основную нагрузку при действии напряжения сдвига и полностью рассеивает его, в результате чего апикальная мембрана клетки не испытывает никакой нагрузки. Основанная нагрузка напряжения приходится на боковые цепи протеогликанов (ПГ) и их коровые белки, которые передают крутящий момент внутрь клетки [24, 25]. Нарушение структуры ЭГК при протекании патологических процессов или действии специфических протеолитических и гликолитиче-ских ферментов приводит к снижению его плотности и толщины, в результате чего основное напряжение приходится на мембрану клетки [26-28]. Эксперименты, призванные подтвердить эти предположения, были выполнены с использованием ферментов для селективного удаления компонентов ЭГК, главным образом гликозаминогликанов (ГАГ) клеточной поверхности. N05), и положительной регуляции экспрессии гена этого фермента за счет увеличения внутриклеточного содержания Са2+, тетрагидро-биоптерина (основного кофактора eN0S) и активации ряда протеинкиназ [31-34]. Обработка культивируемых клеток ферментом гепариназой, который расщепляет и удаляет гепаран-сульфат с ПГ клеточной поверхности, приводила к подавлению продукции N0 клетками под действием напряжения сдвига [35, 36]. При этом действие гепариназы не нарушало функции N0-производящего аппарата
N05), и положительной регуляции экспрессии гена этого фермента за счет увеличения внутриклеточного содержания Са2+, тетрагидро-биоптерина (основного кофактора eN0S) и активации ряда протеинкиназ [31-34]. Обработка культивируемых клеток ферментом гепариназой, который расщепляет и удаляет гепаран-сульфат с ПГ клеточной поверхности, приводила к подавлению продукции N0 клетками под действием напряжения сдвига [35, 36]. При этом действие гепариназы не нарушало функции N0-производящего аппарата
6
эндотелиальной клетки, так как механизмы синтеза вазодилататоров клеткой, индуцируемые брадики-нином через В2-рецепторы и гистамином, повреждены не были [35]. Полученные данные четко свидетельствуют об участии содержащих гепарансульфат компонентов ЭГК в формировании клеточных ответных реакций на кровоток. Помимо гепариназы для деструкции компонентов ЭГК были использованы также следующие ферменты: гиалуронидаза, специфически расщепляющая гиалуронан; хон-дроитиназа, оказывающая аналогичное действие на хондроитинсульфат; и нейраминидаза, удаляющая остатки сиаловых кислот с углеводных компонентов гликопротеинов ЭГК [37-39]. В условиях in vitro, как в среде культивируемых эндотелиальных клеток, так и на выделенных фрагментах артерий, обработка препаратов гиалуронидазой и нейрами-нидазой, но не хондроитиназой, с последующим их экспонированием к действию напряжения сдвига демонстрировала подавление продукции клетками NO. Отрицательное действие хондроитиназы может объясняться незначительным содержанием хондроитинсульфата в общей структуре ЭГК, а также его возможной локализацией в глубине структуры ЭГК около клеточной мембраны [2]. Напротив, действие всех этих ферментов не оказывает никакого влияния на продукцию эндотелиальными клетками другого вазодилататора, продукта метаболизма арахидоновой кислоты простациклина (PGI2), что подтверждает существование множества механизмов детекции и преобразования напряжения сдвига [37, 40]. Вероятно, продукция PGI2 может быть опосредована за счет восприимчивости к изменению динамики кровотока контактными областями базальной адгезии, сенсорные свойства которых не зависят от присутствия на апикальной поверхности клетки интактного ЭГК [20].
В условиях in vitro, как в среде культивируемых эндотелиальных клеток, так и на выделенных фрагментах артерий, обработка препаратов гиалуронидазой и нейрами-нидазой, но не хондроитиназой, с последующим их экспонированием к действию напряжения сдвига демонстрировала подавление продукции клетками NO. Отрицательное действие хондроитиназы может объясняться незначительным содержанием хондроитинсульфата в общей структуре ЭГК, а также его возможной локализацией в глубине структуры ЭГК около клеточной мембраны [2]. Напротив, действие всех этих ферментов не оказывает никакого влияния на продукцию эндотелиальными клетками другого вазодилататора, продукта метаболизма арахидоновой кислоты простациклина (PGI2), что подтверждает существование множества механизмов детекции и преобразования напряжения сдвига [37, 40]. Вероятно, продукция PGI2 может быть опосредована за счет восприимчивости к изменению динамики кровотока контактными областями базальной адгезии, сенсорные свойства которых не зависят от присутствия на апикальной поверхности клетки интактного ЭГК [20].
Полученные данные позволили сделать ряд предположений о возможном участии компонентов ЭГК в процессах улавливания и преобразования генерируемых напряжением сдвига сигналов эндотелиальными клетками. ПГ гликокаликса могут быть задействованы в децентрализованных механизмах передачи этого сигнала, когда восприятие происходит на эндотелиальной поверхности коро-выми белками и ГАГ с последующей передачей сигнала внутрь клетки через трансмембранные домены сенсорных молекул, преобразованием сигнала молекулярным аппаратом клетки и запуском внутриклеточных каскадов с генерированием ответных реакций. С другой стороны, мембранные компоненты ЭГК могут участвовать в прямых централизованных механизмах передачи, когда улавливание интенсивности напряжения сдвига и преобразование его в клеточный ответ происходит только на поверхности клетки [18]. При децентрализованном механизме коровые белки ПГ передают усвоенные сигналы напряжения сдвига на кортикальный ак-тиновый цитоскелет, который распределяет сигнал на многочисленные клеточные компоненты, такие
как клеточные органеллы, ядро, участки фокальной и базальной адгезии и межклеточные соединения [20]. Помимо ПГ в этом механизме может принимать участие гликопротеин PECAM-1 у межклеточных границ эндотелиального слоя, который связывается с цитоскелетом через катенины и участвует в активации eNOS при действии напряжения сдвига [41]. При централизованном механизме могут быть задействованы компоненты ЭГК, локализованные в кавеолах — мембранных микродоменах в виде клеточных инвагинаций, в которых наблюдается повышенное содержание сигнальных молекул (рецепторов, ионных каналов, связанной неактивной eNOS и протеинкиназ) [42]. К этим компонентам можно отнести мембранный про-теогликан глипикан (содержит гепарансульфаты) и гликопротеин CD44, связывающий гиалуронан и содержащий в своей структуре остатки сиаловых кислот. Глипикан-1 способен улавливать напряжение сдвига и передавать его через кавеолу, что активирует промежуточные посредники и приводит к фосфорилированию молекулы eNOS, ее активации и высвобождению в цитоплазму [42]. Использование гепариназы ингибирует процесс фосфо-рилирования eNOS и ее активацию.
Помимо ПГ в этом механизме может принимать участие гликопротеин PECAM-1 у межклеточных границ эндотелиального слоя, который связывается с цитоскелетом через катенины и участвует в активации eNOS при действии напряжения сдвига [41]. При централизованном механизме могут быть задействованы компоненты ЭГК, локализованные в кавеолах — мембранных микродоменах в виде клеточных инвагинаций, в которых наблюдается повышенное содержание сигнальных молекул (рецепторов, ионных каналов, связанной неактивной eNOS и протеинкиназ) [42]. К этим компонентам можно отнести мембранный про-теогликан глипикан (содержит гепарансульфаты) и гликопротеин CD44, связывающий гиалуронан и содержащий в своей структуре остатки сиаловых кислот. Глипикан-1 способен улавливать напряжение сдвига и передавать его через кавеолу, что активирует промежуточные посредники и приводит к фосфорилированию молекулы eNOS, ее активации и высвобождению в цитоплазму [42]. Использование гепариназы ингибирует процесс фосфо-рилирования eNOS и ее активацию.
Другим аспектом реагирования эндотелиальной клетки на действие напряжения сдвига является изменение ее морфологии через ремоделирование цитоскелета и межклеточных контактов. Влияние действия напряжения сдвига было продемонстрировано на модели культивируемых эндотелиальных клеток бедренной артерии кролика, которые в течение 5 часов подвергались воздействию напряжения сдвига в 11 дин/см2 в среде с нормальной концентрацией белков плазмы [43]. При отсутствии воздействия тока жидкости актиновые филаменты цитоскелета локализуются на границах клетки в районах межклеточных контактов, образуя плотные периферические полосы актина (DPAB, dense peripheral actin bands). Приложение нагрузки приводит к перераспределению актиновых фила-ментов цитоскелета с разрушением структур DPAB. Обработка клеток гепариназой не вызывает реорганизацию цитоскелета при воздействии на культуру напряжения сдвига. Подобный эффект проявляется также при культивировании эндотелиальных клеток в среде без белков плазмы, что демонстрирует зависимость свойств ЭГК от его окружения [44]. При наличии интактного ЭГК действие напряжения сдвига помимо реорганизации цитоскелета вызывает изменение межклеточных контактов через перераспределение или разрушение комплексов ряда белков этих контактов. Аналогичное действие было продемонстрировано для белка межклеточных контактов винкулина, белка щелевидных контактов (gap junction) Cx34 и белка плотных соединений (tight junction) ZO-1 [43]. Во всех случаях действие напряжения сдвига не приводило к реорганизации межклеточных соединений при обработке клеток гепариназой, т. е. при нарушении структуры ЭГК.
При наличии интактного ЭГК действие напряжения сдвига помимо реорганизации цитоскелета вызывает изменение межклеточных контактов через перераспределение или разрушение комплексов ряда белков этих контактов. Аналогичное действие было продемонстрировано для белка межклеточных контактов винкулина, белка щелевидных контактов (gap junction) Cx34 и белка плотных соединений (tight junction) ZO-1 [43]. Во всех случаях действие напряжения сдвига не приводило к реорганизации межклеточных соединений при обработке клеток гепариназой, т. е. при нарушении структуры ЭГК.
Полученные данные легли в основу создания модели «аттракционного электромобиля» «bumper car model»), призванной объяснить участие ЭГК в ремоделировании эндотелиальных клеток вызванных действием напряжения сдвига [43] (Рис. 1). Согласно этой модели, ЭГК передает напряжение сдвига клетке через прямой контакт с ак-тиновым цитоскелетом и косвенные соединения (через цитоскелет) с межклеточными контактами. Свыше определенных пороговых значений напряжения сдвига старые клеточные контакты могут разрушаться, что приводит к миграции и перегруппировке контактных белков для образования новых соединений, способных лучше стабилизировать эндотелиальный монослой в условиях измененного кровотока (функция адаптации). Когда целостность ЭГК нарушается, действие напряжения сдвига приходится на апикальную мембрану клетки и распространяется далее через участки межклеточных контактов, при этом реорганизации цитоскелета не происходит, а межклеточные контакты остаются неизменными.
Свыше определенных пороговых значений напряжения сдвига старые клеточные контакты могут разрушаться, что приводит к миграции и перегруппировке контактных белков для образования новых соединений, способных лучше стабилизировать эндотелиальный монослой в условиях измененного кровотока (функция адаптации). Когда целостность ЭГК нарушается, действие напряжения сдвига приходится на апикальную мембрану клетки и распространяется далее через участки межклеточных контактов, при этом реорганизации цитоскелета не происходит, а межклеточные контакты остаются неизменными.
При длительном действии напряжения сдвига на модельные системы культивируемых эндотелиальных клеток (24-48 часов, 15 дин/см2) эффекты ремоделирования в присутствии интактного ЭГК проявляются в виде изменения формы клеток, их выравнивая в направлении воздействия тока жидкости и значительного подавления пролиферации [45]. В условиях отсутствия кровотока эндотелиальные клетки имеют многогранную форму, тогда как напряжение сдвига заставляет их вытягиваться и ориентироваться в направлении действия нагрузки. Обработка клеток гепариназой III не вызывала подобных изменений в условиях экспериментального кровотока. Гепариназа оказывает действие и на клеточную пролиферацию: нарушение структуры ЭГК приводит к устранению ингибирующего эффекта напряжения сдвига на способность эндотелиальных клеток к делению [45]. В условиях отсутствия кровотока у клеток эндотелия скорость пролиферации и подвижность достаточно высокие, тогда как воздействие физиологического уровня напряжения сдвига значительно подавляют пролиферацию и подвижность. Считается, что удаление ЭГК устраняет ингибирующее эти процессы действие гемодинамических сил в результате реорганизации межклеточных контактов, что приводит к существенному изменению морфологии и поведения клеток в монослое эндотелия сосудистой стенки.
Обработка клеток гепариназой III не вызывала подобных изменений в условиях экспериментального кровотока. Гепариназа оказывает действие и на клеточную пролиферацию: нарушение структуры ЭГК приводит к устранению ингибирующего эффекта напряжения сдвига на способность эндотелиальных клеток к делению [45]. В условиях отсутствия кровотока у клеток эндотелия скорость пролиферации и подвижность достаточно высокие, тогда как воздействие физиологического уровня напряжения сдвига значительно подавляют пролиферацию и подвижность. Считается, что удаление ЭГК устраняет ингибирующее эти процессы действие гемодинамических сил в результате реорганизации межклеточных контактов, что приводит к существенному изменению морфологии и поведения клеток в монослое эндотелия сосудистой стенки.
Кроме того, напряжение сдвига может в определенной степени регулировать состав и толщину ЭГК. Было показано, что его воздействие в два раза увеличивает содержание гиалуронана в ЭГК культивируемых эндотелиальных клеток вены пуповины человека [46]. Другое исследование показало, что в областях ламинарного тока сонной артерии мыши толщина ЭГК (399±174 нм) значительно превышала толщину в синусной области бифуркации потока с деформированным профилем
Другое исследование показало, что в областях ламинарного тока сонной артерии мыши толщина ЭГК (399±174 нм) значительно превышала толщину в синусной области бифуркации потока с деформированным профилем
Рисунок 1. Структурная организация компонентов эндотелиальных клеток при действии напряжения сдвига кровотока.
ЪсР
V
*-й
о§
базальная мембрана
В
ш
Г.- о
¥ & Г
• V«*
• Ж
ш
ЪсГ
О
в
‘=
синдекан
ОРАВ
цш кисточкоподобные структуры ™ гликокаликса
• белок плотных контактов
комплекс интегрина с белками М межклеточных контактов (винкулин и паксиллин)
• 10А
Г\ нити актина
стрессорные волокна актина
белок нексусного контакта
1=1 белки адгезионных 1=1 контактов
A.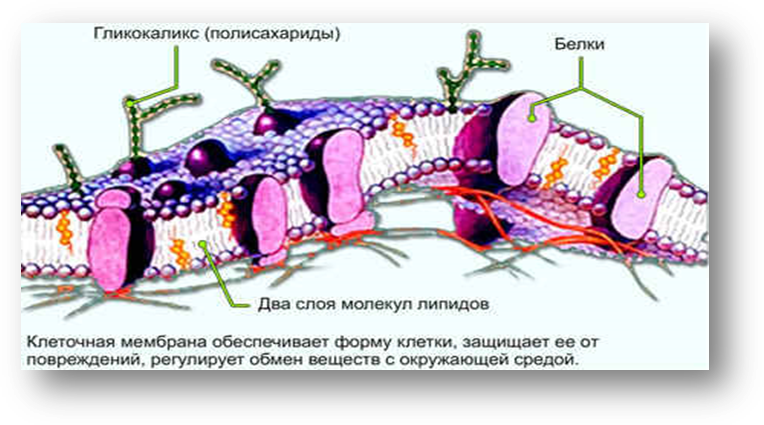 Воздействие напряжения сдвига кровотока на клетки отсутствует. Белки межклеточных контактов соседних клеток взаимодействуют друг с другом, организуя клеточный слой эндотелия.
Воздействие напряжения сдвига кровотока на клетки отсутствует. Белки межклеточных контактов соседних клеток взаимодействуют друг с другом, организуя клеточный слой эндотелия.
B. На клетки действует напряжение сдвига. Кисточкоподобные структуры ЭГК под действием локального крутящего момента деформируются и передают суммирующий крутящий момент на кортикальный актиновый скелет клетки, в результате чего происходит реорганизация формы клетки и межклеточных контактов для формирования клеточного ответа на действие напряжения сдвига определенной силы.
C. На клетки действует напряжение сдвига при удалении ЭГК с клеточной поверхности. Межклеточные контакты остаются неизменными, а изменение формы клеток происходит за счет локализованных у базальной мембраны интегринов и стрессорных актиновых волокон.
8
(73±36 нм) [27]. Тем не менее, в этой же синусной области на участках с ламинарным профилем течения крови толщина ЭГК незначительно отличалась от толщины линейных участков (308±185 нм).
Тем не менее, в этой же синусной области на участках с ламинарным профилем течения крови толщина ЭГК незначительно отличалась от толщины линейных участков (308±185 нм).
Все эти данные подчеркивают значимость ин-тактного ЭГК как одного из активных участников процесса механотрансдукции напряжения сдвига кровотока и ремоделирования эндотелия при поддержании сосудистого гомеостаза в меняющихся условиях циркуляции.
Гликокаликс как регулятор взаимодействий эндотелия и клеток крови
Экранируя люминальную поверхность сосудистой стенки, ЭГК может регулировать взаимодействия клеток эндотелия с циркулирующими клетками крови. В отношении эритроцитов он выполняет функцию «смазочного материала», способствующего продвижению этих клеток по сосудистому руслу, в особенности в капиллярах системы микроциркуляции [47]. Само по себе присутствие ЭГК in vivo в этих сегментах является основным параметром, регулирующим локальную вязкость крови и гема-токрит капилляров, и значительно увеличивает капиллярное сопротивление для циркулирующих компонентов [48, 49].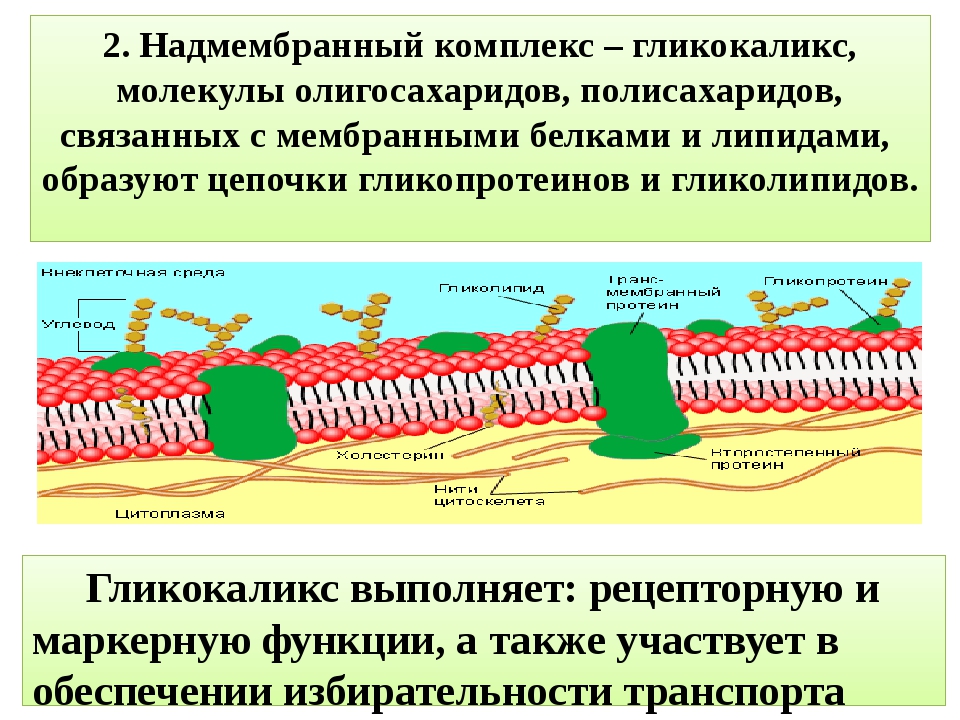 Увеличение микрососуди-стого сопротивления в областях с повышенной скоростью кровотока (>1000 мкм/с) может вызывать деформацию формы эритроцита и создавать зону исключения циркулирующих клеток у поверхности сосудистой стенки, заполняемую расширяющимся ЭГК, что выглядит так, будто ЭГК отталкивает эритроциты от поверхности стенки [47, 50] (Рис. 2).
Увеличение микрососуди-стого сопротивления в областях с повышенной скоростью кровотока (>1000 мкм/с) может вызывать деформацию формы эритроцита и создавать зону исключения циркулирующих клеток у поверхности сосудистой стенки, заполняемую расширяющимся ЭГК, что выглядит так, будто ЭГК отталкивает эритроциты от поверхности стенки [47, 50] (Рис. 2).
Этот эффект устраняется при обработке участка сосуда направленным действием ультрафиолетового излучения, вызывающим разрушение структуры ЭГК [47]. На участках микроциркуляции с пульсирующим кровотоком, где скорость крови не превышает 100-200 мкм/с и периодически падает до «нуля» (в капиллярах скелетных мышц), эритроциты изменяют свою форму, расширяясь и заполняя собой все люминальное пространство сосуда [51]. Проходя по капилляру и максимально сжимая ЭГК, они генерируют за собой подъемную силу, достаточную для быстрого восстановления эластичной структуры ЭГК до своего исходного размера [47, 52]. Вполне вероятно, что при тесном контакте ЭГК может взаимодействовать с рецепторами клеточной поверхности эритроцита для организации межклеточного обмена. Так, методом электронной микроскопии на границах эндотелиальной клетки и эритроцита в момент их контакта были обнаружены структуры в виде щетинок, образовывающие каналы между плазмолеммами клеток, которые обеспечивали межклеточный перенос ионов [53]. Кроме того, внеклеточное окружение самого эритроцита [54, 55] и ЭГК сосудистой стенки [56-58] создают диффузионный барьер, способный значительно снижать скорость связывания продуцируемого эндотелием N0 локализованным в эритроцитах гемоглобином.
Вполне вероятно, что при тесном контакте ЭГК может взаимодействовать с рецепторами клеточной поверхности эритроцита для организации межклеточного обмена. Так, методом электронной микроскопии на границах эндотелиальной клетки и эритроцита в момент их контакта были обнаружены структуры в виде щетинок, образовывающие каналы между плазмолеммами клеток, которые обеспечивали межклеточный перенос ионов [53]. Кроме того, внеклеточное окружение самого эритроцита [54, 55] и ЭГК сосудистой стенки [56-58] создают диффузионный барьер, способный значительно снижать скорость связывания продуцируемого эндотелием N0 локализованным в эритроцитах гемоглобином.
В условиях нормы сосудистый эндотелий не взаимодействует с тромбоцитами, адгезии которых препятствует целостность и антитромботиче-ские свойства сосудистой стенки [59]. Активация эндотелиальных клеток при гипертензии, сахарном диабете и в процессе ишемия-реперфузия
Рисунок 1. Разные типы нестабильных атеросклеротических бляшек [19].
Разные типы нестабильных атеросклеротических бляшек [19].
приводит к развитию эндотелиальной дисфункции и изменению поверхностной структуры монослоя с экспонированием на нем молекул адгезии (P- и E-селектины, ICAM-1, VCAM-1), инициирующих адгезию и роллинг циркулирующих тромбоцитов и лейкоцитов [59-62]. Подобные изменения представляет собой один из важнейших факторов развития атеросклеротического поражения. Процесс адгезии тромбоцитов к поврежденной сосудистой стенке является достаточно подробно изученным, в отличие от процессов роллинга и адгезии тромбоцитов к интактному активированному эндотелию, установленному in vivo, в том числе и при высоких значениях напряжения сдвига [63, 64]. Механизмы подобного поведения тромбоцитов схожи с взаимодействием и роллингом активированных лейкоцитов на активированном эндотелии, хотя последний этап подобного взаимодействия (трансмиграция тромбоцитов через неповрежденную сосудистую стенку в ткань) не происходит. Первичная адгезия тромбоцитов к эндотелиальным клеткам приводит к накоплению активированных тромбоцитов и образованию агрегатов на поверхности сосудистой стенки, что создает базу для последующего рекрутинга лейкоцитов [65]. Вероятно, что ЭГК может принимать участие в инициации процесса первичной адгезии тромбоцитов к сосудистой стенке. В нескольких работах было показано, что нарушение целостности ЭГК действием нейраминидазы [66] или окисленных ЛНП [67] приводило к адгезии на эндотелии тромбоцитов.
Первичная адгезия тромбоцитов к эндотелиальным клеткам приводит к накоплению активированных тромбоцитов и образованию агрегатов на поверхности сосудистой стенки, что создает базу для последующего рекрутинга лейкоцитов [65]. Вероятно, что ЭГК может принимать участие в инициации процесса первичной адгезии тромбоцитов к сосудистой стенке. В нескольких работах было показано, что нарушение целостности ЭГК действием нейраминидазы [66] или окисленных ЛНП [67] приводило к адгезии на эндотелии тромбоцитов.
Адгезия лейкоцитов на эндотелии также требует активации последнего и экспонировании на его поверхности молекул адгезии. Процесс присоединения рекрутированных лейкоцитов к эндотелию с последующим роллингом вдоль поверхности сосудистой стенки и экстравазацией (диапедезисом) в ткани является начальным этапом реализации механизмов системы врожденного иммунитета для борьбы с инфекционными стимулами и репарации поврежденных тканей. При этом избыточное накопление лейкоцитов в местах поражения может провоцировать развитие ряда патологий, таких как васкулит, аутоиммунные заболевания, менингит, атеросклероз и поражение тканей в процессе ишемии/реперфузии [68]. Роль ЭГК в инициировании лейкоцитарной адгезии выглядит двоякой. С одной стороны, молекулы клеточной адгезии входят в состав ЭГК и присутствуют в нем на постоянной основе (конститутивные Е-селектин, ICAM-2 и PECAM-1) или при активации эндотелия. С другой стороны, интактный ЭГК снижает адгезию лейкоцитов, экранируя своими поверхностными компонентами молекулы адгезии (Рис. 2) [69]. В ряде экспериментов по исследованию степени участия ЭГК в адгезии лейкоцитов к эндотелию было показано, что как прямое действие удаляющей из ЭГК гепарансуль-фаты гепариназы, так и опосредованное действие проатерогенных и воспалительных стимулов (окисленных ЛНП, TNF-a), снижающих синтез ПГ и уре-
Роль ЭГК в инициировании лейкоцитарной адгезии выглядит двоякой. С одной стороны, молекулы клеточной адгезии входят в состав ЭГК и присутствуют в нем на постоянной основе (конститутивные Е-селектин, ICAM-2 и PECAM-1) или при активации эндотелия. С другой стороны, интактный ЭГК снижает адгезию лейкоцитов, экранируя своими поверхностными компонентами молекулы адгезии (Рис. 2) [69]. В ряде экспериментов по исследованию степени участия ЭГК в адгезии лейкоцитов к эндотелию было показано, что как прямое действие удаляющей из ЭГК гепарансуль-фаты гепариназы, так и опосредованное действие проатерогенных и воспалительных стимулов (окисленных ЛНП, TNF-a), снижающих синтез ПГ и уре-
жающих сеть ЭГК, активизирует роллинг и усиливает адгезию иммунных клеток к сосудистой стенке [70, 71]. Следует учитывать, что процесс миграции лейкоцитов состоит из нескольких этапов, включающих в себя первичное связывание и обратимый роллинг, остановку лейкоцита с прочным связыванием и трансмиграцию в субэндотелиальную область [59]. Каждый этап вызывает изменение морфологии и биохимии взаимодействующих клеток, и разнообразные компоненты ЭГК принимают самое активное участие в этих процессах.
Каждый этап вызывает изменение морфологии и биохимии взаимодействующих клеток, и разнообразные компоненты ЭГК принимают самое активное участие в этих процессах.
Известно, что толщина ЭГК значительно превышает высоту внеклеточной части адгезионных молекул, что должно препятствовать первоначальной адгезии циркулирующих иммунных клеток. Так, высота внеклеточного домена P-селектина (одной из молекул, инициирующих адгезию лейкоцитов к эндотелию) не превышает 38 нм, что в 8 раз меньше толщины ЭГК в капилляре [72, 73]. Полученные методом генетической инженерии эндотелиальные клетки с более короткими молекулами P-селектина демонстрируют снижение адгезии нейтрофилов к эндотелиальному монослою. Клетки с дефектным гликозилированием и, как следствие, недостаточной толщиной ЭГК обладают повышенной степенью адгезии иммунных клеток [74]. Прижизненная микроскопия обычно фиксирует инициирование слабой адгезии и обратимого роллинга лейкоцитов на выходе из капилляров, где проходящий лейкоцит заполняет весь просвет микрососуда и максимально сжимает ЭГК, в посткапиллярных венулах [75] (Рис. 0,5 мкм толщины ЭГК), а микроскопия in vitro демонстрирует роллинг лейкоцита как процесс, при котором клетка перемещается в подвешенном состоянии на расстояние примерно 500 нм от поверхности эндотелия [79, 80]. На активированном эндотелии первичные временные контакты опосредуются связыванием: 1) P- и Е-селектинов эндотелия с рецептором PSGL-1 лейкоцита; 2) интегринов лейкоцита (в частности, a401) с молекулой VCAM-1 эндотелия и 3) фракталином эндотелия и его рецептором CX3CR1 на лейкоците [59]. Образующиеся контакты вызывают реорганизацию цитоскелета клеток, активацию сигнальных каскадов и изменение транскрипционного профиля эндотелия, а также активацию лейкоцитарных интегринов, которую вызывают продуцируемые активированным эндотелием хе-мокины. Для их презентации эндотелий увеличивает экспрессию гепарансульфата на своей поверх-
0,5 мкм толщины ЭГК), а микроскопия in vitro демонстрирует роллинг лейкоцита как процесс, при котором клетка перемещается в подвешенном состоянии на расстояние примерно 500 нм от поверхности эндотелия [79, 80]. На активированном эндотелии первичные временные контакты опосредуются связыванием: 1) P- и Е-селектинов эндотелия с рецептором PSGL-1 лейкоцита; 2) интегринов лейкоцита (в частности, a401) с молекулой VCAM-1 эндотелия и 3) фракталином эндотелия и его рецептором CX3CR1 на лейкоците [59]. Образующиеся контакты вызывают реорганизацию цитоскелета клеток, активацию сигнальных каскадов и изменение транскрипционного профиля эндотелия, а также активацию лейкоцитарных интегринов, которую вызывают продуцируемые активированным эндотелием хе-мокины. Для их презентации эндотелий увеличивает экспрессию гепарансульфата на своей поверх-
ности, увеличивая толщину сокращенного ранее ЭГК [81]. Дополнительная стимуляция лейкоцитов приводит к образованию прочных связей между р2 и а4р1 интегринами лейкоцита и молекулами эндотелия ^АМ-1, 1САМ-1, 1САМ-2 и остановке лейкоцита. М-1). Таким образом, ЭГК вносит значительный вклад в регуляцию адгезивных свойств сосудистой стенки, которые значительно возрастают после повреждения структуры ЭГК в результате действия воспалительных и проатерогенных стимулов с последующей активацией эндотелия. Возможным средством противодействия роллингу и адгезии лейкоцитов в этих условиях может быть подход, направленный на достижение восстановления ЭГК путем инфузии его компонентов, например, гепарансульфата [70]. Следует отметить, что роллинг и адгезия лейкоцитов постоянно наблюдаются в венулах кожи при отсутствии воспаления в условиях нормы, и природа этих локальных взаимодействий остается до сих пор не определенной [82].
М-1). Таким образом, ЭГК вносит значительный вклад в регуляцию адгезивных свойств сосудистой стенки, которые значительно возрастают после повреждения структуры ЭГК в результате действия воспалительных и проатерогенных стимулов с последующей активацией эндотелия. Возможным средством противодействия роллингу и адгезии лейкоцитов в этих условиях может быть подход, направленный на достижение восстановления ЭГК путем инфузии его компонентов, например, гепарансульфата [70]. Следует отметить, что роллинг и адгезия лейкоцитов постоянно наблюдаются в венулах кожи при отсутствии воспаления в условиях нормы, и природа этих локальных взаимодействий остается до сих пор не определенной [82].
Гликокаликс как регулятор микроокружения клеток эндотелия
Благодаря своей ячеистой периодической структуре, преимущественно зависящей от ПГ и их боковых цепей ГАГ, ЭГК создает на поверхности эндотелия гетерогенную структуру, которая может аккумулировать внутри себя разнообразные соединения, функциональность которых зависит от взаимодействия с ЭГК. Локализованные в ЭГК соединения могут быть как производными эндотелиальных клеток и клеток субэндотелиального пространства, так и сорбироваться на ЭГК из кровотока. Взаимодействие циркулирующих компонентов плазмы с локализованными в ЭГК активными соединениями может протекать по нескольким механизмам.
Локализованные в ЭГК соединения могут быть как производными эндотелиальных клеток и клеток субэндотелиального пространства, так и сорбироваться на ЭГК из кровотока. Взаимодействие циркулирующих компонентов плазмы с локализованными в ЭГК активными соединениями может протекать по нескольким механизмам.
Во-первых, ЭГК локализует процесс связывания рецептора со своим лигандом, создавая необходимую концентрацию взаимодействующих соединений и предоставляя возможность осуществления специфической сигнальной или ферментативной модификации. Так, структуры внеклеточных ПГ гепарансульфата регулируют образование активного комплекса FGF со своим рецептором, регулирующего пролиферацию клеток эндотелия и процесс ангиогенеза [83, 84]. Аналогичным образом проте-огликаны ЭГК могут регулировать взаимодействие выполняющих транспорт холестерина и триглицеридов ЛНП с липопротеинлипазой, тем самым участвуя в метаболизме липидов [85].
Во-вторых, связывание биомолекул крови с ЭГК может приводить к созданию концентрационного
градиента, необходимого для изменения транскрипционного профиля клетки в процессах ее созревания и дифференцировки. Примером подобного взаимодействия может быть локализация факторов роста, в частности TGFP1/2 (трансформирующие факторы роста) и VEGF (фактор роста эндотелия сосудов), регулирующих разнообразные процессы клеточной сигнализации, включая дифференци-ровку гладкомышечных клеток, тонус и реактивность сосудов [86, 87]. На модели острого легочного поражения у мышей, индуцированного интратрахе-альным введением липополисахарида (LPS), было отмечено разрушение эндотелиального клеточного барьера из-за увеличения экспрессии гиалуронан-связывающего белка-2 (HABP-2) [88]. Его действие развивалось через активацию PAR-1 и PAR-3 (активируемых протезами рецепторов 1 и 3) с последующим включением малой гуанозинтрифос-фатазы (RhoA) и серин/треонин киназы (ROCK). Гиалуронан-связывающий белок-2 предстает новым регулятором сосудистой целостности [88].
Примером подобного взаимодействия может быть локализация факторов роста, в частности TGFP1/2 (трансформирующие факторы роста) и VEGF (фактор роста эндотелия сосудов), регулирующих разнообразные процессы клеточной сигнализации, включая дифференци-ровку гладкомышечных клеток, тонус и реактивность сосудов [86, 87]. На модели острого легочного поражения у мышей, индуцированного интратрахе-альным введением липополисахарида (LPS), было отмечено разрушение эндотелиального клеточного барьера из-за увеличения экспрессии гиалуронан-связывающего белка-2 (HABP-2) [88]. Его действие развивалось через активацию PAR-1 и PAR-3 (активируемых протезами рецепторов 1 и 3) с последующим включением малой гуанозинтрифос-фатазы (RhoA) и серин/треонин киназы (ROCK). Гиалуронан-связывающий белок-2 предстает новым регулятором сосудистой целостности [88].
Наконец, ЭГК может содержать группу ферментов, их активаторов и ингибиторов, которые дополнительно придают структуре ЭГК специфические защитные функции. Так, ЭГК содержит целую группу соединений, обладающих антикоагулянтными свойствами, к которым относятся антитромбин III, тромбомодулин, эндотелиальный рецептор протеина С, кофактор II гепарина и белковый ингибитор тканевого фактора TFPI [89]. Эти соединения поддерживают в условиях физиологической нормы тромборезистентность сосудов, сохраняя кровоток при незначительных повреждениях сосудистой стенки, тогда как ее серьезные повреждения приводят к контакту богатой тканевым фактором субэндотелиальной зоны с кровью и запускают каскады свертываемости [90, 91]. Антитромбин III представляет собой сильный ингибитор прокоагу-лянтных ферментов, таких как тромбин и факторы свертывания (XIIa, XIa, Xa и IXa) [92]. Его активность усиливает связывание со специфическими участками гепарансульфата протеогликанов ЭГК [93]. Тромбомодулин является синтезируемым эндотелием гликопротеином, который содержит цепи хондроитинсульфата (опосредующие его включение в структуру ЭГК) и играет роль рецептора тромбина [94].
Так, ЭГК содержит целую группу соединений, обладающих антикоагулянтными свойствами, к которым относятся антитромбин III, тромбомодулин, эндотелиальный рецептор протеина С, кофактор II гепарина и белковый ингибитор тканевого фактора TFPI [89]. Эти соединения поддерживают в условиях физиологической нормы тромборезистентность сосудов, сохраняя кровоток при незначительных повреждениях сосудистой стенки, тогда как ее серьезные повреждения приводят к контакту богатой тканевым фактором субэндотелиальной зоны с кровью и запускают каскады свертываемости [90, 91]. Антитромбин III представляет собой сильный ингибитор прокоагу-лянтных ферментов, таких как тромбин и факторы свертывания (XIIa, XIa, Xa и IXa) [92]. Его активность усиливает связывание со специфическими участками гепарансульфата протеогликанов ЭГК [93]. Тромбомодулин является синтезируемым эндотелием гликопротеином, который содержит цепи хондроитинсульфата (опосредующие его включение в структуру ЭГК) и играет роль рецептора тромбина [94]. Связывая последний, тромбомодулин ингибирует превращение фибриногена в фибрин, способствует активности антитромбина III и активирует антикоагулянтный протеин С. Активированный протеин С приобретает протеазные свойства и совместно с протеином S (в качестве кофактора) ингибирует образование тромбина путем разрушения факторов свертывания крови Va и VIIIa и стимулирует фибринолиз [95]. Другим ингибитором тромбина является кофактор II гепарина, который образует с фактором свертывания II стабильный комплекс, при этом взаимодействие значительно ускоряется в присутствии дерматансульфата ЭГК [96, 97]. TFPI также является ингибитором факто-
Связывая последний, тромбомодулин ингибирует превращение фибриногена в фибрин, способствует активности антитромбина III и активирует антикоагулянтный протеин С. Активированный протеин С приобретает протеазные свойства и совместно с протеином S (в качестве кофактора) ингибирует образование тромбина путем разрушения факторов свертывания крови Va и VIIIa и стимулирует фибринолиз [95]. Другим ингибитором тромбина является кофактор II гепарина, который образует с фактором свертывания II стабильный комплекс, при этом взаимодействие значительно ускоряется в присутствии дерматансульфата ЭГК [96, 97]. TFPI также является ингибитором факто-
и
ров свертываемости крови Vila и Xa. В сосудистой стенке он присутствует в связанном с гепарансуль-фатами и гликопротеинами виде, при этом клиренс комплекса TFPI и связанного фактора осуществляется за счет ГАГ-компонентов ПГ [98, 99]. Приводящие к активации или дисфункции нативного эндотелия процессы вызывают снижение экспрессии его клетками антикоагулянтных факторов и нарушают гемостатический баланс. Кроме того, специфическое разрушение ЭГК (индуцируемое оксиленны-ми ЛНП) напрямую вызывает тромбообразова-ние и адгезию тромбоцитов в интервале 10 минут [100]. Помимо этого, ЭГК может аккумулировать активирующие эндотелий и лейкоциты агонисты (цитокины и хемокины), которые повышают адгезию циркулирующих клеток к эндотелию (при нарушении структуры ЭГК) и нарушают в нем синтез компонентов ЭГК (например, ПГ гепаран-сульфата и гиалуронана) [71, 101-103].
Кроме того, специфическое разрушение ЭГК (индуцируемое оксиленны-ми ЛНП) напрямую вызывает тромбообразова-ние и адгезию тромбоцитов в интервале 10 минут [100]. Помимо этого, ЭГК может аккумулировать активирующие эндотелий и лейкоциты агонисты (цитокины и хемокины), которые повышают адгезию циркулирующих клеток к эндотелию (при нарушении структуры ЭГК) и нарушают в нем синтез компонентов ЭГК (например, ПГ гепаран-сульфата и гиалуронана) [71, 101-103].
К защитной функции ЭГК может относиться его способность подавлять продукцию и накопление активных форм кислорода (АФК) благодаря аккумуляции антиоксидантов, в первую очередь внеклеточной супероксиддисмутазы (ес-SOD), преобразующей цитотоксический супероксид радикал в перекись водорода [104-106]. Этот фермент обладает как высокой степенью сродства к ге-парансульфатам ЭГК, обусловленной наличием специфического, положительно заряженного домена связывания гепариноподобных структур, так и высоким профилем экспрессии (70% общего содержания ферментов СОД в тканях сосуда) [107]. Помимо апикальной поверхности ес-SOD локализуется и в субэндотелиальном матриксе. Основная протекторная функция этого фермента заключается в поддержании паракринной функции эндотелиального NO в отношении гладкомышечных клеток сосудов, которая может подавляться путем конвертации NO супероксид анионом в высокоактивный окислитель пероксинитрит-анион (ONOO-), активный участник оксидативного стресса [108]. Благодаря своей функции, ec-SOD может участвовать в таких общих процессах, как регуляция кровяного давления и поддержании сосудистой функции.
Помимо апикальной поверхности ес-SOD локализуется и в субэндотелиальном матриксе. Основная протекторная функция этого фермента заключается в поддержании паракринной функции эндотелиального NO в отношении гладкомышечных клеток сосудов, которая может подавляться путем конвертации NO супероксид анионом в высокоактивный окислитель пероксинитрит-анион (ONOO-), активный участник оксидативного стресса [108]. Благодаря своей функции, ec-SOD может участвовать в таких общих процессах, как регуляция кровяного давления и поддержании сосудистой функции.
Развитие тканевого отека и набухания клеток эндотелия, оксидативного стресса и локального воспаления сосудистой ткани, активации и рекрутинга лейкоцитов в посткапиллярных венулах, опосредованное вышеописанными механизмами при разрушении ЭГК, обнаруживаются в микроцирку-ляторной сети при поражениях, вызываемых процессами тотальной и частичной ишемии с последующей реперфузией [109-112]. Экспериментально было показано, что кишечная ишемия/реперфузия значительно снижает размер ЭГК в венулах брыжейки крысы, вероятно, в результате удаления ГАГ с поверхности эндотелия [113]. Подобное воздействие может быть смягчено подавлением активности локализованной с гепарансульфатами ЭГК ксантин-оксидоредуктазы, генерирующей АФК,
Подобное воздействие может быть смягчено подавлением активности локализованной с гепарансульфатами ЭГК ксантин-оксидоредуктазы, генерирующей АФК,
а также располагающейся в гликокаликсе ec-SOD, напротив, подавляющей генерирование АФК [114, 115], что говорит о значительном вкладе оксида-тивного стресса в развитие ишемии/реперфузии. С другой стороны, введение эндогенных гиалуро-нана и пертуссин-токсина, ингибирующих индуцируемое G-белком удаление ГАГ-цепей ЭГК, снижает тяжесть поражения [113]. Клинически, удаление ЭГК при ишемии/реперфузии было показано по увеличению содержания синдекана-1 и гепаран-сульфата в плазме пациентов с периоперационной ишемией [116].
Участие ЭГК в развитии патологических процессов
Благодаря широкому набору присущих ЭГК функций, эта пограничная структура выступает в качестве важного регулятора сосудистого гомеостаза. Ее повреждение при воздействии разнообразных патологических стимулов приводит к нарушению функций ЭГК, что вносит вклад в ряд сосудистых патологий, основными из которых являются сахарный диабет, ИБС, воспалительные процессы сосудистой системы, а также гиперхолестеринемия и атеросклероз.
Ее повреждение при воздействии разнообразных патологических стимулов приводит к нарушению функций ЭГК, что вносит вклад в ряд сосудистых патологий, основными из которых являются сахарный диабет, ИБС, воспалительные процессы сосудистой системы, а также гиперхолестеринемия и атеросклероз.
Сахарный диабет и сопутствующая им гипергликемия является широко распространенным заболеванием, приводящим к тяжелым поражениям сердечно-сосудистой системы как на уровне ма-кро- и микроциркуляции [117]. Было показано, что острая гипергликемия вызывает значительное разрушение структуры ЭГК и увеличение сосудистой проницаемости в пораженных участках [118, 119]. Одним из возможных механизмов поражения ЭГК, вероятно, предстает отрицательная регуляция экспрессии ПГ гепарансульфата, воздействие гликиру-ющих агентов непосредственно на белки ЭГК и недостаточный отклик эндотелиального монослоя на действие напряжения сдвига [120]. Другим возможным фактором повреждения может выступать продукция АФК и увеличение активности ферментов, разрушающих ЭГК [118, 119]. Установлено, что системный объем ЭГК у пациентов с сахарным диабетом i типа был вполовину ниже, чем этот же показатель у здоровых добровольцев, тогда как наличие микроальбуминурии у этих больных еще больше снижало системный объем ЭГК [119]. У пациентов с сахарным диабетом при сокращенном объеме ЭГК в крови также увеличивается содержание циркулирующих гиалуронана и гиалуро-нидазы. Активация разлагающих ЭГК ферментов, воспалительных и коагулянтных каскадов может вызывать системное повреждение ЭГК, увеличивать проницаемость сосудистой стенки к альбумину (микроальбуминурия) и ЛНП и приводить к развитию ассоциированных с диабетом сердечнососудистых заболеваний.
Установлено, что системный объем ЭГК у пациентов с сахарным диабетом i типа был вполовину ниже, чем этот же показатель у здоровых добровольцев, тогда как наличие микроальбуминурии у этих больных еще больше снижало системный объем ЭГК [119]. У пациентов с сахарным диабетом при сокращенном объеме ЭГК в крови также увеличивается содержание циркулирующих гиалуронана и гиалуро-нидазы. Активация разлагающих ЭГК ферментов, воспалительных и коагулянтных каскадов может вызывать системное повреждение ЭГК, увеличивать проницаемость сосудистой стенки к альбумину (микроальбуминурия) и ЛНП и приводить к развитию ассоциированных с диабетом сердечнососудистых заболеваний.
Другим патологическим механизмом удаления ЭГК с поверхности сосудистой стенки является ги-
перхолестеринемия и развивающийся вследствие этого атеросклероз [121]. Хотя точные механизмы участия ЭГК в развитии атеросклероза при гипер-холистеринемии пока не установлены, накопилось значительное количество данных о том, что ЭГК может регулировать возможность образования атеросклеротических бляшек [122]. В модельных экспериментах острая гиперхолестеринемия, индуцируемая введением в кровоток значительных доз окисленных ЛНП, вызывала разрушение ЭГК в ми-кроциркуляторной сети кремастерной мышцы хомяка и последующую адгезию тромбоцитов [100]. Введение ec-SOD и каталазы в этом эксперименте подавляло разложение ЭГК, что демонстрировало вовлечение генерируемых АФК в развивающийся патологический процесс. Было показано, что диета с высоким содержанием холестерина снижает толщину ЭГК и увеличивает размер новообразованных комплексов «интима-медиа» на участках атерогенного риска в синусе сонной артерии мыши с нокаутированным геном аполипопротеина Е [27, 123]. Этот эксперимент подтверждают клинические данные, демонстрирующие, что повышенное содержание холестерина ЛНП у пациентов с семейной гиперхолестеринемией коррелирует со снижением системного объема ЭГК, тогда как направленная на снижение холестерина терапия приводит к частичному восстановлению этой характеристики [124]. Возможно, интактный ЭГК предотвращает миграцию липопротеинов в субэндотелиальное пространство, хотя в захвате этих соединений может принимать участие широко распространенный в ЭГК синдекан [125].
В модельных экспериментах острая гиперхолестеринемия, индуцируемая введением в кровоток значительных доз окисленных ЛНП, вызывала разрушение ЭГК в ми-кроциркуляторной сети кремастерной мышцы хомяка и последующую адгезию тромбоцитов [100]. Введение ec-SOD и каталазы в этом эксперименте подавляло разложение ЭГК, что демонстрировало вовлечение генерируемых АФК в развивающийся патологический процесс. Было показано, что диета с высоким содержанием холестерина снижает толщину ЭГК и увеличивает размер новообразованных комплексов «интима-медиа» на участках атерогенного риска в синусе сонной артерии мыши с нокаутированным геном аполипопротеина Е [27, 123]. Этот эксперимент подтверждают клинические данные, демонстрирующие, что повышенное содержание холестерина ЛНП у пациентов с семейной гиперхолестеринемией коррелирует со снижением системного объема ЭГК, тогда как направленная на снижение холестерина терапия приводит к частичному восстановлению этой характеристики [124]. Возможно, интактный ЭГК предотвращает миграцию липопротеинов в субэндотелиальное пространство, хотя в захвате этих соединений может принимать участие широко распространенный в ЭГК синдекан [125]. -а и эндотоксин, приводит к разрушению структуры ЭГК микроциркуляторного русла и дальнейшему развитию тканевого отека с повреждением сосудистой стенки и тромбозом [129, 130]. Эндогенное воздействие обладающего антикоагу-лянтными свойствами активированного протеина С устраняет влияние эндотоксина на ЭГК. Кроме того, в исследованиях участия эндотелия в адгезии лимфоцитов была продемонстрирована способность последнего вовлекать ПГ гепаран-сульфата в захват и презентацию воспалительных цитокинов [131]. Устранение из ЭГК гиалуронана и сиаловых кислот
-а и эндотоксин, приводит к разрушению структуры ЭГК микроциркуляторного русла и дальнейшему развитию тканевого отека с повреждением сосудистой стенки и тромбозом [129, 130]. Эндогенное воздействие обладающего антикоагу-лянтными свойствами активированного протеина С устраняет влияние эндотоксина на ЭГК. Кроме того, в исследованиях участия эндотелия в адгезии лимфоцитов была продемонстрирована способность последнего вовлекать ПГ гепаран-сульфата в захват и презентацию воспалительных цитокинов [131]. Устранение из ЭГК гиалуронана и сиаловых кислот
может усиливать эти свойства [132, 133]. Помимо этого цитокины могут активировать локализованные в ЭГК или секретируемые эндотелием протеа-зы и гликозидазы, что особенно значимо для локального разрушения ЭГК в микроциркуляторном русле, где обычно инициируется первичных захват активированных лейкоцитов [26, 1 27].
Терапевтические вмешательства, направленные на сохранение или восстановление ЭГК, могут предоставить эффективный инструмент для регуляции воспалительных процессов. -а (препарат е1апегсер1:) в вышеописанной модели устраняло все перечисленные воспалительные эффекты, демонстрируя защитное действие ЭГК против развития последствий воспалительных реакций.
-а (препарат е1апегсер1:) в вышеописанной модели устраняло все перечисленные воспалительные эффекты, демонстрируя защитное действие ЭГК против развития последствий воспалительных реакций.
Заключение
Эндотелиальный гликокаликс способен принимать участие в ряде патологических процессов сердечнососудистой системы и в норме выполняет функцию протекторного барьера и регулятора сосудистого гомеостаза, тогда как при активации эндотелия и нарушении его поверхностной структуры эта функция теряется. Основываясь на этом заключении, гликокаликс может быть использован в дальнейшем для более подробного исследования механизмов развития патологических чсостояний, а также в качестве терапевтической мишени и возможного маркера развития сердечнососудистых заболеваний.
Гранты
Настоящая работа выполнена при финансовой поддержке грантами РФФИ 07-04-12057-офи, 09-04-00023 и Минздравсоцразвития России.
Списоклитературы
1. Galley HF, Webster NR Physiology of the endothelium. Br J Anaesth 2004; 93(1): 105-113.
2. Weinbaum S, Tarbell JM, Damiano ER The structure andfunction of the endothelial glycocalyx layer. Annu Rev Biomed Eng 2007; 9:121-167.
3. Vink H., Duling BR Capillary endothelial surface layer selectively reduces plasma solute distribution volume. Am J Physiol Heart Circ Physiol2000; 278(1): h385-h389.
4. Firth JA Endothelial barriers: from hypothetical pores to membrane proteins. J Anat 2002; 200(6): 541-548.
5. van Haaren PM, VanBavel E, Vink H., Spaan JA Localization of the permeability barrier to solutes in isolated arteries by con-focal microscopy. Am J Physiol Heart Circ Physiol2003; 285(6): h3848-h3856.
Am J Physiol Heart Circ Physiol2003; 285(6): h3848-h3856.
6. Renkin EM. Multiple pathways of capillary permeability. Circ Res 1977; 41(6): 735-743.
7. Ueda A, Shimomura M., Ikeda M. et al. Effect of glycocalyx on shear-dependent albumin uptake in endothelial cells. Am J Physiol Heart Circ Physiol2004; 287(5): h3287-h3294.
8. van Haaren PM., VanBavel E, Vink H., Spaan JA Charge modification of the endothelial surface layer modulates the permeability barrier of isolated rat mesenteric small arteries. Am J Physiol Heart Circ Physiol2005; 289(6): h3503-h3507.
9. Dvorak HF. Vascular permeability to plasma, plasma proteins, and cells: an update. Curr Opin Hematol 2010; 17(3): 225- 2910. Starling EH. On the Absorption of Fluids from the Connective Tissue Spaces. J Physiol 1896; 19(4): 312-326.
11. Aird W.C. Phenotypic heterogeneity of the endothelium: I. Structure, function, and mechanisms. Circ Res 2007; 100(2): 158-173.
12. Weinbaum S. 1997 Whitaker Distinguished Lecture: Models to solve mysteries in biomechanics at the cellular level; a new view offiber matrix layers. Ann Biomed Eng 1998; 26(4): 627-643.
13. Michel C.C. Starling: the formulation of his hypothesis of microvascular fluid exchange and its significance after 100years. Exp Physiol 1997; 82(1): 1-30.
14. Hu X., Weinbaum S. A new view of Starling’s hypothesis at the microstructural level. Microvasc Res 1999; 58(3): 281-304.
15. Zhang X., Adamson RH, Curry FR, Weinbaum S. A 1-D model to explore the effects of tissue loading and tissue concentration gradients in the revised Starling principle. Am J Physiol Heart Circ Physiol 2006; 291(6): h3950-h3964.
Am J Physiol Heart Circ Physiol 2006; 291(6): h3950-h3964.
16. Hu X., Adamson RH., Liu B. et al. Starlingforces that oppose filtration after tissue oncotic pressure is increased. Am J Physiol Heart Circ Physiol2000; 279(4): h2724-h2736.
17. Adamson RH, Lenz JF, Zhang X. et al. Oncotic pressures opposing filtration across non-fenestrated rat microvessels.J Physiol 2004;557(Pt3): 889-907.
18. Davies PF. Flow-mediated endothelial mechanotransduction. Physiol Rev 1995; 75(3): 519-560.
19. Chien S. Mechanotransduction and endothelial cell homeostasis: the wisdom of the cell. Am J Physiol Heart Circ Physiol2007; 292(3): h2209-h2224.
20. МелькумянцAM., Балашов СА. Механочувствительность артериального эндотелия. — Тверь: Издательство “Триада”. 2005;208 с.: 41-58; 70-7421. Jones EA., le Noble F, Eichmann A. What determines blood vessel structure? Genetic prespecification vs. hemodynamics. Physiology (Bethesda) 2006; 21:388-395.
2005;208 с.: 41-58; 70-7421. Jones EA., le Noble F, Eichmann A. What determines blood vessel structure? Genetic prespecification vs. hemodynamics. Physiology (Bethesda) 2006; 21:388-395.
22. Kamiya A., Togawa T. Adaptive regulation of wall shear stress to flow change in the canine carotid artery. Am J Physiol 1980; 239(1): h24-h31.
23. Caro C.G. Discovery of the role of wall shear in atherosclerosis. Arterioscler Thromb Vasc Biol2009; 29(2): 158-161.
24. Weinbaum S, Zhang X., Han Y. et al. Mechanotransduction and flow across the endothelial glycocalyx. Proc Natl Acad Sci USA 2003; 100(13): 7988-7995.
25. Secomb T.W., Hsu R, Pries AR Effect of the endothelial surface layer on transmission offluid shear stress to endothelial cells. Biorheology 2001; 38(2-3): 143-150.
26. MulivorA.W., Lipowsky HH. Inflammation- and ischemia-induced shedding of venular glycocalyx. Am J Physiol Heart Circ Physiol 2004; 286(5): h2672-h2680.
MulivorA.W., Lipowsky HH. Inflammation- and ischemia-induced shedding of venular glycocalyx. Am J Physiol Heart Circ Physiol 2004; 286(5): h2672-h2680.
27. van den Berg BM, Spaan JA, RolfTM, Vink H. Atherogenic region and diet diminish glycocalyx dimension and increase intima-to-media ratios at murine carotid artery bifurcation. AmJ Physiol Heart Circ Physiol 2006; 290(2): H915-H920.
28. Zuurbier CJ, Demirci C., Koeman A et al. Short-term hyperglycemia increases endothelial glycocalyx permeability and acutely decreases lineal density of capillaries with flowing red blood cells. JApplPhysiol2005;99(4): 1471-1476.
29. Rubanyi GM, Romero J.C., Vanhoutte PM. Flow-induced release of endothelium-derived relaxingfactor. Am J Physiol 1986; 250(6Pt 2): h2145-h2149.
30. Michel T. NO way to relax: the complexities of coupling nitric oxide synthase pathways in the heart. Circulation 2010; 121(4):
Circulation 2010; 121(4):
484-486.
31. Boo Y.C., Jo H. Flow-dependent regulation of endothelial nitric oxide synthase: role of protein kinases. Am J Physiol Cell Physiol 2003; 285(3): C499-C508.
32. Corson MA, James NL., Latta SF. et al. Phosphorylation of endothelial nitric oxide synthase in response to fluid shear stress.
Circ Res 1996; 79:984-991.
33. Fleming I, Bauersachs J, Fisslthaler B, Busse R. Ca2+-independent activation of the endothelial nitric oxide synthase in response to tyrosine phosphatase inhibitors and fluid shear stress. Circ Res 1998; 82(6): 686-695.
34. Widder JD., Chen W, LiL., Dikalov S. et al. Regulation of tetrahydrobiopterin biosynthesis by shear stress. Circ Res 2007;
Circ Res 2007;
101(8): 830-838.
35. Florian JA, Kosky JR, Ainslie K. et al. Heparan sulfate proteoglycan is a mechanosensor on endothelial cells. Circ Res 2003; 93(10): e136-e142.
36. Chappell D., Jacob M., Rehm M. et al. Heparinase selectively sheds heparan sulphate from the endothelial glycocalyx. Biol Chem 2008; 389(1): 79-82.
37. Pahakis M.Y., Kosky JR, Dull R.O., Tarbell JM. The role of endothelial glycocalyx components in mechanotransduction offluid shear stress. Biochem Biophys Res Commun 2007; 355(1): 228-233.
38. Hecker M., Mülsch A, Bassenge E, Busse R. Vasoconstriction and increasedflow: two principal mechanisms of shear stress-dependent endothelial autacoid release. Am J Physiol 1993; 265(3 Pt 2): H828-H833.
39. Mochizuki S, Vink H., Hiramatsu O. et al. Role of hyaluronic acidglycosaminoglycans in shear-induced endothelium-derived nitric oxide release. Am J Physiol Heart Circ Physiol2003; 285(2): H722-H726.
Mochizuki S, Vink H., Hiramatsu O. et al. Role of hyaluronic acidglycosaminoglycans in shear-induced endothelium-derived nitric oxide release. Am J Physiol Heart Circ Physiol2003; 285(2): H722-H726.
40. Frangos JA, Eskin S.G., Mclntire L.V., Ives CL. Flow effects on prostacyclin production by cultured human endothelial cells. Science 1985; 227(4693): 1477-147941. Osawa M., Masuda M., Kusano K., Fujiwara K. Evidence for a role of platelet endothelial cell adhesion molecule-1 in endothelial cell mechanosignal transduction: is it a mechanoresponsive molecule? J Cell Biol 2002; 158(4): 773-785.
42. BalligandJL, Feron O, Dessy C. eNOS activation by physical forces: from short-term regulation of contraction to chronic remodeling of cardiovascular tissues. Physiol Rev 2009; 89(2): 481-534.
43- Thi MM, Tarbell JM, Weinbaum S., Spray D. C. The role of the glycocalyx in reorganization of the actin cytoskeleton under fluid shear stress: a “bumper-car” model. Proc NatlAcad Sci USA 2004; 101(47): 16483-16488.
C. The role of the glycocalyx in reorganization of the actin cytoskeleton under fluid shear stress: a “bumper-car” model. Proc NatlAcad Sci USA 2004; 101(47): 16483-16488.
44. Adamson RH, Clough G. Plasma proteins modify the endothelial cell glycocalyx offrog mesenteric microvessels.J Physiol 1992; 445:473-486.
45. Yao Y., RabodzeyA, Dewey CF.Jr. Glycocalyx modulates the motility and proliferative response of vascular endothelium to fluid shear stress. Am J Physiol Heart Circ Physiol 2007; 293(2): h2023-h2030.
46. Gouverneur M, Spaan JA, Pannekoek H. et al. Fluid shear stress stimulates incorporation of hyaluronan into endothelial cell glycocalyx. Am J Physiol Heart Circ Physiol 2006; 290(1): h558-h562.
47. Secomb T.W., Hsu R, Pries AR.Motion of red blood cells in a capillary with an endothelial surface layer: effect offlow velocity. AmJ Physiol Heart Circ Physiol 2001; 281(2): H629-H636.
AmJ Physiol Heart Circ Physiol 2001; 281(2): H629-H636.
48. Lipowsky HH. Microvascular rheology and hemodynamics. Microcirculation 2005; 12(1): 5-15.
49. Pries AR, Secomb T.W. Rheology of the microcirculation. Clin Hemorheol Microcirc 2003; 29(3-4): 143-148.
50. Secomb T.W., Skalak R, Oozkaya N, Gross, JF. Flow of axisymmetric red blood cells in narrow capillaries.J Fluid Mech 1986; 163:405-42351. Vink H., DulingBR Identification of distinct luminal domains for macromolecules, erythrocytes, and leukocytes within mammalian capillaries. Circ Res 1996; 79(3): 581-589.
52. FengJ., Weinbaum S. Lubrication theory in highly compressible porous media: the mechanics of skiing, from red cells to humans. J Fluid Mech 2000; 422:281-317.
53. Шахламов ВА Капилляры/под общ.ред. Савельева СВ. — М.: ВЕДИ. 2007; 288 с.: 30-31.
Шахламов ВА Капилляры/под общ.ред. Савельева СВ. — М.: ВЕДИ. 2007; 288 с.: 30-31.
54. CoinJ.T., OlsonJ.S. The rate of oxygen uptake by human red blood cells.JBiol Chem 1979; 254(4): 1178-1190.
55. Liu X., MillerMJ., JoshiMS. et al. Diffusion-limited reaction of free nitric oxide with erythrocytes.JBiol Chem 1998; 273(30): 18709-18713.
56. Butler AR, Megson IL., Wright P.G. Diffusion of nitric oxide and scavenging by blood in vasculature. Biochim Biophys Acta 1998; 1425(1): 168-176.
57. Liao J.C, Hein T.W., VaughnM.W. et al. Intravascular flow decreases erythrocyte consumption of nitric oxide. Proc NatlAcad Sci USA 1999;96(15): 8757-8761.
58. Vaughn M.W., Kuo L, Kiao J.C. Effective diffusion distance of nitric oxide in the microcirculation. AmJ Physiol 1998; 274(5 Pt 2): h2705-h2714.
AmJ Physiol 1998; 274(5 Pt 2): h2705-h2714.
59. Wagner DD., Frenette PS. The vessel wall and its interactions. Blood 2008; 111(11): 5271-5281.
60. Levi M, van der Poll T, Buller HR Biderectional relation between inflammation and coagulation. Circulation 2004; 109: 2698-270461. Hadi HA, Suwaidi JA. Endothelial dysfunction in diabetes mellitus. Vasc Health Risk Manag 2007; 3(6): 853-876.
62. Sakao S., TatsumiK., Voelkel NF. Endothelial cells and pulmonary arterial hypertension: apoptosis,proliferation, interaction and transdifferentiation. Respir Res 2009; 10:95-104.
63. Kottke-Marchant K. Importance of platelets and platelet response in acute coronary syndromes. Cleve Clin J Med2009; 76 Suppl 1: S2-S7.
64. Frenette PS,Johnson R. C., Hynes R.O., Wagner DD. Platelets roll on stimulated endothelium in vivo: an interaction mediated by endothelialP-selectin. Proc NatlAcad. Sci USA 1995;92(16): 7450-745465. May AE., Seizer P, GawazM. Platelets: inflammatoryfirebugs of vascular walls. Arterioscler Thromb Vasc Biol 2008; 28(3): S5-S10.
C., Hynes R.O., Wagner DD. Platelets roll on stimulated endothelium in vivo: an interaction mediated by endothelialP-selectin. Proc NatlAcad. Sci USA 1995;92(16): 7450-745465. May AE., Seizer P, GawazM. Platelets: inflammatoryfirebugs of vascular walls. Arterioscler Thromb Vasc Biol 2008; 28(3): S5-S10.
66. Pries AR, Secomb TW,Jacobs H. et al. Microvascular bloodflow resistance: role of endothelial surface layer. AmJ Physiol 1997; 273 (5,Pt2):h3272-h3279.
67. Vink H., Constantinescu AA., Spaan JAF. Oxidized lipoproteins degrade the endothelial surface layer. Implications for platelet-endothelial cell adhesion. Circulation 2000; 101:1500-1502.
68. Zarbock A, Ley K. Mechanisms and consequences of neutrophil interaction with the endothelium. AmJ Pathol2008; 172(1): 1-7.
69. Nieuwdorp M, Meuwese M. C., Vink H. et al. The endothelial glycocalyx: a potential barrier between health and vascular disease. Curr Opin Lipidol 2005; 16(5): 507-511.
C., Vink H. et al. The endothelial glycocalyx: a potential barrier between health and vascular disease. Curr Opin Lipidol 2005; 16(5): 507-511.
70. Constantinescu AA, Vink H., Spaan JA Endothelial cell glycocalyx modulates immobilization of leukocytes at the endothelial surface. Arterioscler Thromb Vasc Biol 2003; 23(9): 1541-1547.
71. Henry CB, Duling BR. TNF-alpha increases entry of macromolecules into luminal endothelial cellglycocalyx. Am JPhysiol Heart Circ Physiol2000; 279(6): h3815-h3823.
72. van den Berg BM, Vink H., Spaan JA. The endothelial glycocalyx protects against myocardial edema. Circ Res 2003; 92(6): 592-59473. Springer TA. Adhesion receptors of the immune system. Nature 1990;346(6283): 425-434.
74- Patel KD, Nollert MU, McEver RP. P-selectin must extend a sufficient length from the plasma membrane to mediate rolling of neutrophils. J Cell Biol 1995; 131(6 Pt2): 1893-1902.
J Cell Biol 1995; 131(6 Pt2): 1893-1902.
75- Ley K. Molecular mechanisms of leukocyte recruitment in the inflammatory process. Cardiovasc Res 1996; 32(4): 733-742. 76. Butler LM, Rainger GE, Nash GB. A role for the endothelialglycosaminoglycan hyaluronan in neutrophil recruitment by endothelial cells cultured for prolonged periods. Exp Cell Res 2009; 315(19): 3433-3441.
77- Zhao Y, Chien S., Weinbaum S. Dynamic contact forces on leukocyte microvilli and their penetration of the endothelial glycocalyx. Biophys J2001; 80(3): 1124-1140.
78. BruehlRE, Springer TA, Bainton DF. Quantitation of L-selectin distribution on human leukocyte microvilli by immunogold labeling and electron microscopy.JHistochem Cytochem 1996; 44(8): 835-844.
79. Tissot O., Pierres A, Foa C. et al. Motion of cells sedimenting on a solid surface in a laminar shear flow. Biophys J1992; 61(1): 204-21580. Tempelman LA, Hammer DA Receptor-mediated binding of IgE-sensitized rat basophilic leukemia cells to antigen-coated
Biophys J1992; 61(1): 204-21580. Tempelman LA, Hammer DA Receptor-mediated binding of IgE-sensitized rat basophilic leukemia cells to antigen-coated
substrates under hydrodynamic flow. Biophys J1994; 66(4): 1231-124381. Middleton J., Patterson AM., Gardner L. et al. Leukocyte extravasation: chemokine transport and presentation by the endothelium. Blood 2002; 100(12): 3853-3860.
82. Janssen GH, Tangelder GJ., Oude Egbrink M.G., Reneman RS. Spontaneous leukocyte rolling in venules in untraumatized skin of conscious and anesthetized animals. Am J Physiol 1994; 267(3 Pt 2): h2199-h2204-
83- Allen BL, Filla M.S., Rapraeger A.C. Role of heparan sulfate as a tissue-specific regulator of FGF-4 andFGF receptor recognition. J Cell Biol2001; 155(5): 845-858.
84- Harmer NJ. Insights into the role of heparan sulphate infibroblast growth factor signalling. Biochem Soc Trans 2006; 34(Pt 3): 442-44585- Wilsie L.C., Orlando RA The low density lipoprotein receptor-related protein complexes with cell surface heparan sulfate proteoglycans to regulate proteoglycan-mediated lipoprotein catabolism.J Biol Chem 2003; 278(18): 15758-1576486. Lopez-Casillasu, Wrana JL., Massague J. Betaglycanpresents ligand to the TGF beta signaling receptor. Cell 1993; 73(7):
Biochem Soc Trans 2006; 34(Pt 3): 442-44585- Wilsie L.C., Orlando RA The low density lipoprotein receptor-related protein complexes with cell surface heparan sulfate proteoglycans to regulate proteoglycan-mediated lipoprotein catabolism.J Biol Chem 2003; 278(18): 15758-1576486. Lopez-Casillasu, Wrana JL., Massague J. Betaglycanpresents ligand to the TGF beta signaling receptor. Cell 1993; 73(7):
1435-144487- Robinson CJ, Stringer SE. The splice variants of vascular endothelial growth factor (VEGF) and their receptors.J Cell Sci 2001;
114(Pt5): 853-86588. Mambetsariev N., Mirzapoiazova T., Mambetsariev B. et al. Hyaluronic acid binding protein 2 is a novel regulator of vascular integrity.Arterioscler Thromb Vasc Biol2010; 30(3): 483-490.
89- Egbrink M.G., Van GestelMA, BroedersMA et al. Regulation of microvascular thromboembolism in vivo. Microcirculation 2005; 12(3): 287-300.
Microcirculation 2005; 12(3): 287-300.
90. TanakaKA, Key N.S., Levy JH. Blood coagulation: hemostasis and thrombin regulation. AnesthAnalg 2009; 108(5): 14331446.
91. LeviM., van der Poll T., Buller HR. Bidirectional relation between inflammation and coagulation. Circulation 2004; 109(22): 2698-2704.
92. Quinsey NS, Greedy AL, Bottomley SP. et al. Antithrombin: in control of coagulation. IntJ Biochem Cell Biol2004; 36(3): 386-38993- Nader HB, PinhalMA., Bau E.C. et al. Development of new heparin-like compounds and other antithrombotic drugs and their
interaction with vascular endothelial cells. Braz J Med Biol Res 2001;34(6): 699-70994- Di Cera E. Thrombin. MolAspectsMed 2008; 29(4): 203-25495- Esmon C.T. The protein C pathway. Chest2003; 124(3 Suppl): 26S-32S.
96. Parker KA, Tollefsen DM. The protease specificity of heparin cofactor II. Inhibition of thrombin generated during coagulation.J Biol Chem 1985; 260(6): 3501-350597- Tovar AM, de Mattos DA, Stelling MP. et al. Dermatan sulfate is the predominant antithrombotic glycosaminoglycan in vessel walls: implications for a possible physiological function of heparin cofactor II. Biochim Biophys Acta 2005; 1740(1): 45-5398. Kato H. Regulation of functions of vascular wall cells by tissue factor pathway inhibitor: basic and clinical aspects. Arterioscler Thromb Vasc Biol2002; 22(4): 539-548.
Parker KA, Tollefsen DM. The protease specificity of heparin cofactor II. Inhibition of thrombin generated during coagulation.J Biol Chem 1985; 260(6): 3501-350597- Tovar AM, de Mattos DA, Stelling MP. et al. Dermatan sulfate is the predominant antithrombotic glycosaminoglycan in vessel walls: implications for a possible physiological function of heparin cofactor II. Biochim Biophys Acta 2005; 1740(1): 45-5398. Kato H. Regulation of functions of vascular wall cells by tissue factor pathway inhibitor: basic and clinical aspects. Arterioscler Thromb Vasc Biol2002; 22(4): 539-548.
99- Ho G, Broze GJ.Jr, Schwartz AL. Role of heparan sulfate proteoglycans in the uptake and degradation of tissue factor pathway inhibitor-coagulation factor Xa complexes.J Biol Chem 1997; 272(27): 16838-16844-100Vink H, Constantinescu AA, Spaan JAE. Oxidized lipoproteins degrade the endothelial surface layer. Implications for platelet-endothelial cell adhesion. Circulation 2000; 101:1500-1502.
Circulation 2000; 101:1500-1502.
101-Bode L, Eklund EA, Murch S, Freeze HH. Heparan sulfate depletion amplifies TNF-alpha-induced protein leakage in an in vitro model of protein-losing enteropathy. AmJ Physiol Gastrointest Liver Physiol 2005; 288(5): G1015-G1023-
102-Bode L, Murch S., Freeze HH. Heparan sulfate plays a central role in a dynamic in vitro model of protein-losing enteropathy.J Biol Chem 2006; 281(12): 7809-7815-
103-Rosenberg RD, Shworak N.W., Liu J. et al. Heparan sulfate proteoglycans of the cardiovascular system. Specific structures emerge but how is synthesis regulated? J Clin Invest 1997; 99(9): 2062-2070.
104-Faraci FM, Didion SP. Vascular protection: superoxide dismutase isoforms in the vessel wall. Arterioscler Thromb Vasc Biol 2004; 24(8): 1367-1373-
105. Fukai T., GalisZ.S., MengXP. et al. Vascular expression of extracellular superoxide dismutase in atherosclerosis. J Clin Invest 1998; 101(10): 2101-2111.
Fukai T., GalisZ.S., MengXP. et al. Vascular expression of extracellular superoxide dismutase in atherosclerosis. J Clin Invest 1998; 101(10): 2101-2111.
106.Fukai T., FolzRJ, Landmesser U., Harrison D.G. Extracellular superoxide dismutase and cardiovascular disease. Cardiovasc Res 2002;55(2): 239-249-
107.МаксименкоАВ.Внеклеточное оксидативное поражение сосудистой стенки и ее ферментативная антиоксидантная защита.Хим-фарм журн 2007; 41:2-12.
108.Kumagai R., Lu X., Kassab G.S. Role of glycocalyx inflow-induced production of nitric oxide and reactive oxygen species. Free Radical Biol Med 2009; 47:600-607.
109-Granger DN. Ischemia-reperfusion: mechanisms of microvascular dysfunction and the influence of risk factors for cardiovascular disease. Microcirculation 1999; 6:167-178.
110.0liver M.G, Specian RD, Perry MA, Granger DN. Morphologic assessment of leukocyte-endothelial cell interactions in mesenteric venules subjected to ischemia and reperfusion Inflammation 1991; 15:331-346.
111.Kurose I, Argenbright L.W., Wolf R et al. Ischemia/reperfusion-induced microvascular dysfunction: role of oxidants and lipid mediators. AmJ Physiol 1997; 272: h3976-h3982.
112.Kupinski AM, Shah DM, Bell DR. Transvascular albuminflux in rabbit hindlimb after tourniquet ischemia. AmJ Physiol 1993;
264: H901-H908.
113.Mulivor AW., Lipowsky HH. Inflammation- and ischemiainduced shedding of venular glycocalyx. Am J Physiol Heart Circ Physiol 2004; 286: h2672-h2680.
114-Rubio-Gayosso I, Platts SH, Duling BR. Reactive oxygen species mediate modification of glycocalyx during ischemia-reperfu-sion injury. AmJ Physiol Heart Circ Physiol 2006; 290: h3247-h3256.
Reactive oxygen species mediate modification of glycocalyx during ischemia-reperfu-sion injury. AmJ Physiol Heart Circ Physiol 2006; 290: h3247-h3256.
115Beresewicz A, Czarnowska E., Maczewski M. Ischemic preconditioning and superoxide dismutase protect against endothelial dysfunction and endothelium glycocalyx disruption in thepostischemic guinea-pig hearts. Mol Cell Biochem 1998; 186:
87-97.
116.Rehm M, Bruegger D., Christ F. et al. Shedding of the endothelial glycocalyx in patients undergoing major vascular surgery with global and regional ischemia. Circulation 2007; 116(17): 1896-1906.
117.HadiHA, Suwaidi JA Endothelial dysfunction in diabetes mellitus. Vasc Health Risk Manag 2007; 3(6): 853-876.
118.Nieuwdorp M, van Haeften T. W., Gouverneur M.C. et al. Loss of endothelial glycocalyx during acute hyperglycemia coincides with endothelial dysfunction and coagulation activation in vivo. Diabetes 2006;55:480-486.
W., Gouverneur M.C. et al. Loss of endothelial glycocalyx during acute hyperglycemia coincides with endothelial dysfunction and coagulation activation in vivo. Diabetes 2006;55:480-486.
119.Nieuwdorp M, Mooij HL., Kroon J. et al. Endothelial glycocalyx damage coincides with microalbuminuria in type 1 diabetes.
Diabetes 2006; 55:1127-1132.
120.Brower JB, Targovnik JH., Caplan MR., Massia SP. High glucose-mediated loss of cell surface heparan sulfate proteoglycan impairs the endothelial shear stress responce. Cytoskeletion 2010; 67:135-141.
121.Stoll G., Bendszus M. Inflammation and atherosclerosis: novel insights into plaque formation and destabilization. Stroke 2006;
37(7): 1923-1932.
122. Noble ML, Drake-Holland AJ, Vink H. Hypothesis: arterial glycocalyx dysfunction is the first step in the atherothrombotic process. QJM2008; 101(7): 513-518.
Noble ML, Drake-Holland AJ, Vink H. Hypothesis: arterial glycocalyx dysfunction is the first step in the atherothrombotic process. QJM2008; 101(7): 513-518.
123. van den Berg BM, Spaan JA, Vink H. Impaired glycocalyx barrier properties contribute to enhanced intimal low-density lipoprotein accumulation at the carotid artery bifurcation in mice. PflugersArch 2009; 457(6): 1199-1206.
124Meuwese M.C, Mooij HL., Nieuwdorp M. et al. Partial recovery of the endothelial glycocalyx upon rosuvastatin therapy in patients with heterozygous familial hypercholesterolemia. J Lipid Res 2009; 50(1): 148-153-
125Fuki I.V., Kuhn KM, Lomazov IR et al. The syndecan family of proteoglycans. Novel receptors mediating internalization of atherogenic lipoproteins in vitro.J Clin Invest 1997; 100(6): 1611-1622.
126Meuwese M. C, Stroes E.S.G., Vink H., van den Berg B. Continuous infusion of hyaluronidase reduces systemic glycocalyx volume and associates with increased molecular clearance [meeting abstract]. FASEB J2008; 22:924.20.
C, Stroes E.S.G., Vink H., van den Berg B. Continuous infusion of hyaluronidase reduces systemic glycocalyx volume and associates with increased molecular clearance [meeting abstract]. FASEB J2008; 22:924.20.
127.Hartvigsen K, Chou M.Y., Hansen LF. et al. The role of innate immunity in atherogenesis. Lipid Res 2009; 50 Suppl: S388-S393.
128.ChiZ, Melendez AJ. Role of cell adhesion molecules and immune-cell migration in the initiation, onset and development of atherosclerosis. Cell AdhMigr 2007; 1(4): 171-175.
129.Henry CB, Duling BR TNF-alpha increases entry of macromolecules into luminal endothelial cell glycocalyx. AmJ Physiol Heart Circ Physiol2000; 279: h3815-h3823.
130. Marechal X., Favory R., Joulin O. et al. Endothelial glycocalyx damage during endotoxemia coincides with microcirculatory dysfunction and vascular oxidative stress. Shock 2008; 29(5): 572-576.
Shock 2008; 29(5): 572-576.
131. Lortat-Jacob H., Grosdidier A, Imberty A. Structural diversity of heparan sulfate binding domains in chemokines. Proc Natl Acad Sci USA 2002; 99(3): 1229-1234-
132.Mulivor AW., Lipowsky HH. Role of glycocalyx in leukocyte-endothelial cell adhesion. AmJ Physiol Heart Circ Physiol2002;
283(4): h2282-h2291.
133. Varki A Sialic acids in human health and disease. Trends Mol Med 2008; 14(8): 351-360.
134. Gonzalez-Gay MA, Gonzalez-Juanatey C., Miranda-Filloy JA. et al. Cardiovascular disease in rheumatoid arthritis. Biomed Pharmacother2006; 60(10): 673-677.
135. Gonzalez-Juanatey C, Llorca J, Garcia-Porrua C. et al. Effect of anti-tumor necrosis factor alpha therapy on the progression of subclinical atherosclerosis in severe rheumatoid arthritis. Arthritis Rheum 2006; 55(1): 150-153.
Arthritis Rheum 2006; 55(1): 150-153.
136. Nieuwdorp M, Meuwese M.C, Mooij HL. et al. Tumor necrosis factor-alpha inhibition protects against endotoxin-induced endothelial glycocalyx perturbation. Atherosclerosis 2009; 202(1): 296-303.
17
Визуализация, состав и структура эндотелиального гликокаликса Текст научной статьи по специальности «Биотехнологии в медицине»
Визуализация, состав и структура эндотелиального гликокаликса
А.В. Максименко, А.Д. Турашев
Институт экспериментальной кардиологии, Федеральное Государственное Учреждение «Российский кардиологический научнопроизводственный комплекс» Министерства здравоохранения и социального развития Российской Федерации. Москва
Абстракт
В норме на поверхности эндотелия кровеносных сосудов присутствует сложная многокомпонентная система, называемая гликокаликсом.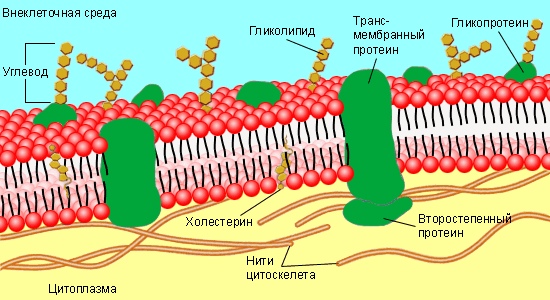 Структура гликокаликса определяется группой проте-огликанов, гликопротеинов и гликозаминогликанов, берущих начало из клеток эндотелия и кровотока. Благодаря своей комплексности и расположению на границе системы циркуляции крови, гликокаликс принимает участие в ряде функций, поддерживающих стенки сосуда. В условиях патологии происходит полная или частичная потеря этой структуры, что приводит к нарушению целостности сосудистой стенки и изменению ее функций. В первой части настоящего обзора рассматриваются история обнаружения и определения структуры гликокаликса эндотелия, используемые при этом методы и подходы. Подробно описан молекулярный состав гликокаликса, свойства компонентов и его общая структура.
Структура гликокаликса определяется группой проте-огликанов, гликопротеинов и гликозаминогликанов, берущих начало из клеток эндотелия и кровотока. Благодаря своей комплексности и расположению на границе системы циркуляции крови, гликокаликс принимает участие в ряде функций, поддерживающих стенки сосуда. В условиях патологии происходит полная или частичная потеря этой структуры, что приводит к нарушению целостности сосудистой стенки и изменению ее функций. В первой части настоящего обзора рассматриваются история обнаружения и определения структуры гликокаликса эндотелия, используемые при этом методы и подходы. Подробно описан молекулярный состав гликокаликса, свойства компонентов и его общая структура.
Ключевые слова: эндотелий, гликокаликс, протеогликаны, гликопротеины, гликозаминогликаны, прижизненная микроскопия.
Visualization, composition and structure of endothelial glycocalyx
A.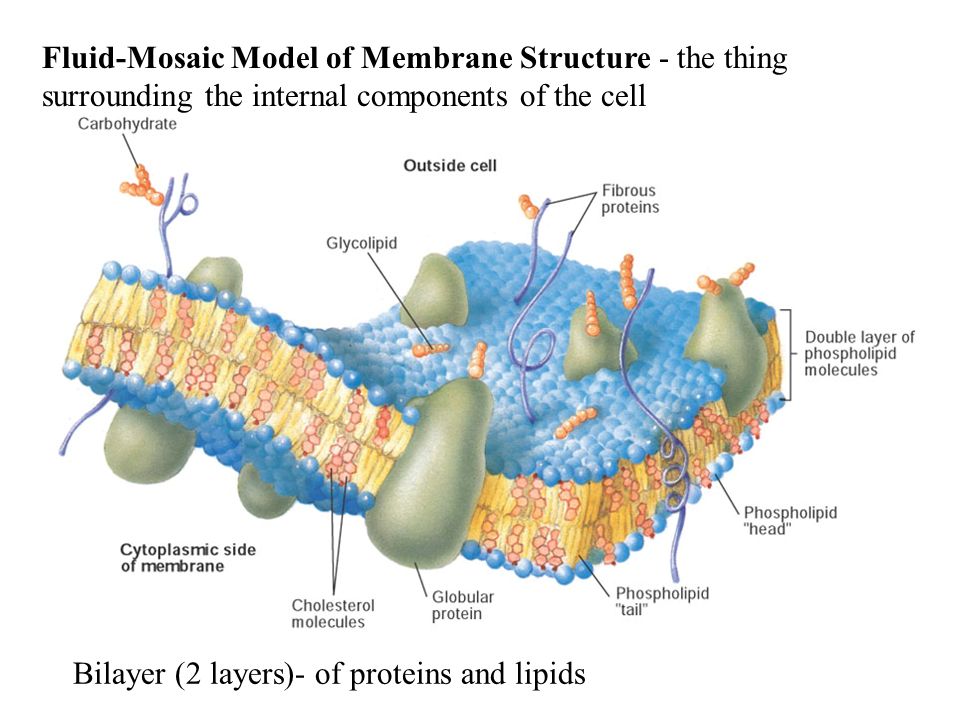 V Maksimenko & A.D. Turashev Abstract
V Maksimenko & A.D. Turashev Abstract
In normal state, a complex multicomponent system called glycocalyx is present on the surface of endothelial vascular system. The structure of the glycocalyx is determined by a group of proteoglycans, glycoproteins and glycosaminoglycans, originating from endothelial cells and blood flow. Due to its complexity and location on the border of the system of blood circulation, glycocalyx participates in a number of functions supporting the metabolism of the vascular wall. In pathological conditions undergo complete or partial loss of this structure, which leads to inconsistencies in the vascular wall and change its functions. In the first part of this review considers the history of detection and determination of endothelial glycocalyx structure, utilized methods and approaches. Described in detail the molecular composition of the glycocalyx, properties of its components and overall glycocalyx structure.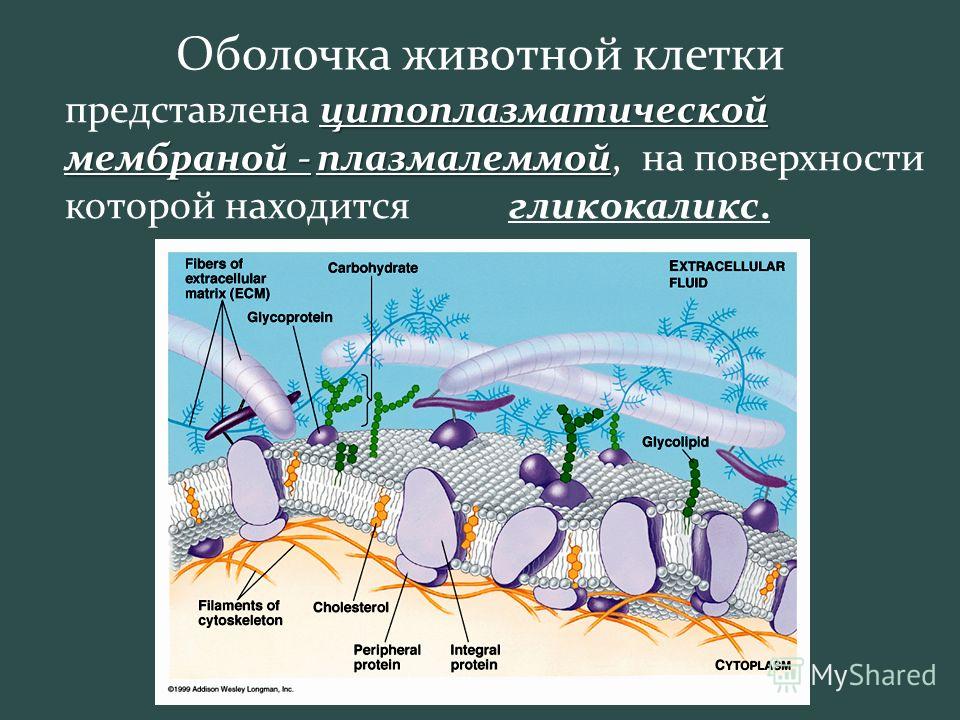 .
.
Key words: endothelium, glycocalyx, proteoglycans, glycoproteins, glycosaminoglycans, spatial structure, in — vivo microscopy.
Практически все эндотелиальные клетки тканей и органов в физиологических условиях покрыты с лю-минальной стороны сосудистой стенки слоем разнообразных связанных с эндотелиальной мембраной макромолекул, совокупность которых представляет эндотелиальный гликокаликс (ЭГК) [1]. В его состав входят белково-углеводные и углеводно-липидные комплексы, а также расположенные на его поверхности белки плазмы крови, формирующие выстилку эндотелия со специфичной структурой и широким набором функций. Аналогичные структуры также присутствуют на апикальной поверхности эпителиальных клеток, выстилающей множество органов человека, а входящие в состав гликокаликса соединения присутствуют в межклеточном матриксе всех тканей [2, 3].
Визуализация эндотелиального гликокаликса
Впервые концепция наличия на сосудистой стенке подобной структуры была предложена группой исследователей в 1940 году [4] и несколько раз впо-
следствии пересматривалась [5, 6].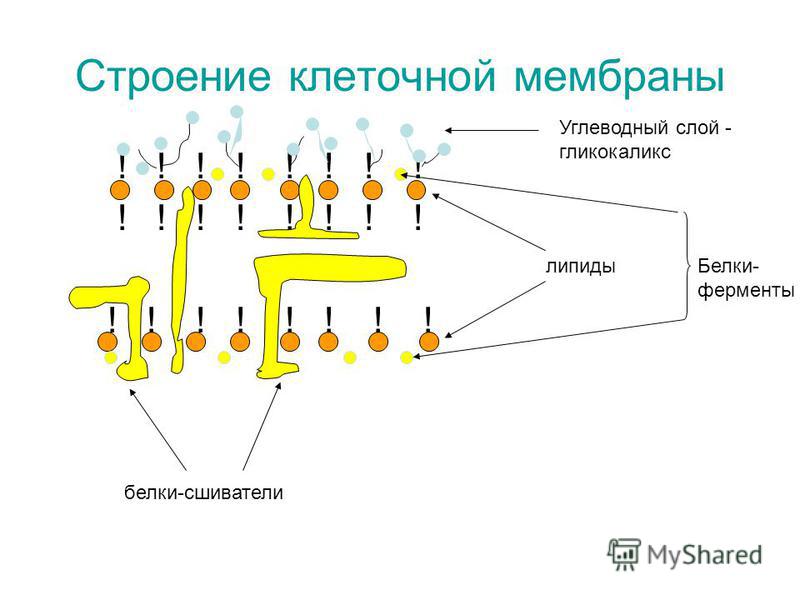 Однако первая визуализация гликокаликса была выполнена лишь в 1966 году с помощью метода трансмиссионной электронной микроскопии с использованием катионного красителя рутения красного в микрососуди-стой сети слизистой оболочки кишечника крысы [7]. Использованный в этом исследовании краситель может связываться с кислыми мукополисахарида-ми и генерировать области электронной плотности в присутствии четырехокиси осмия. Этот подход позволил визуализировать на поверхности капиллярной стенки волокнистую, кисточковидную структуру, толщина которой составляла примерно 20 нм. Косвенные данные существования подобной структуры были также получены при оценке капиллярного гематокрита скелетной мышцы [8], сетевого моделирования и измерения сосудистого сопротивления в сосудах диаметром до 30 мкм в сравнении с кварцевыми трубками аналогичного диаметра [9]. Расчетные значения толщины гликокаликса в этих экспериментах составляли около 1 мкм. Более того, использование разрушающего гликокаликс фер-
Однако первая визуализация гликокаликса была выполнена лишь в 1966 году с помощью метода трансмиссионной электронной микроскопии с использованием катионного красителя рутения красного в микрососуди-стой сети слизистой оболочки кишечника крысы [7]. Использованный в этом исследовании краситель может связываться с кислыми мукополисахарида-ми и генерировать области электронной плотности в присутствии четырехокиси осмия. Этот подход позволил визуализировать на поверхности капиллярной стенки волокнистую, кисточковидную структуру, толщина которой составляла примерно 20 нм. Косвенные данные существования подобной структуры были также получены при оценке капиллярного гематокрита скелетной мышцы [8], сетевого моделирования и измерения сосудистого сопротивления в сосудах диаметром до 30 мкм в сравнении с кварцевыми трубками аналогичного диаметра [9]. Расчетные значения толщины гликокаликса в этих экспериментах составляли около 1 мкм. Более того, использование разрушающего гликокаликс фер-
мента гепариназы приводило к двукратному увеличению гематокрита капилляров [10] и снижению сосудистого сопротивления [11], что подтверждало первоначальные предположения и указывало на то, что гликокаликс снижает скорость кровотока в пристеночном сегменте сосуда.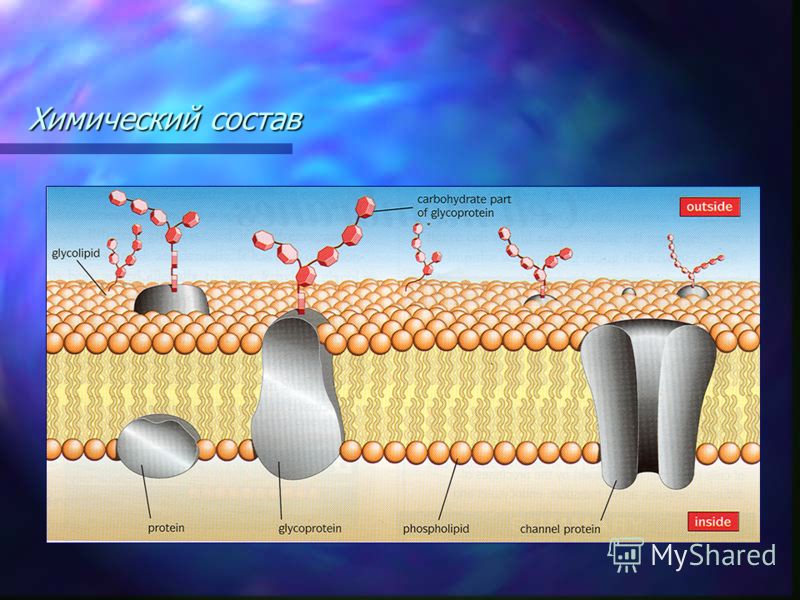
Эти работы вызвали повышенный интерес к визуализации гликокаликса с помощью трансмиссионной электронной микроскопии и различных специфичных маркеров, способных связываться с компонентами ЭГК и позволяющими определять их наличие и расположение. Для этого были использованы такие маркеры, как коллоидное золото [12], иммунопероксидазное маркирование [13] и высоко заряженные белки, например, катионизированный ферритин [14]. Аналогичный подход использовался и для изучения влияния напряжения сдвига кровотока на толщину гликокаликса и его способность в подобных условиях индуцировать поглощение белков плазмы клетками эндотелия [15]. Толщина ЭГК в этих исследованиях ненамного превышала первоначально установленную толщину (в 1,5-2 раза), но противоречила рассчитанным величинам математических моделей [16-19]. Использование катионизированного ферритина также продемонстрировало, что для поддержания целостности ЭГК должен существовать контакт этой структуры с белками плазмы крови, и что в действительности толщина ЭГК может значительно превышать ранее установленные значения 20-40 нм.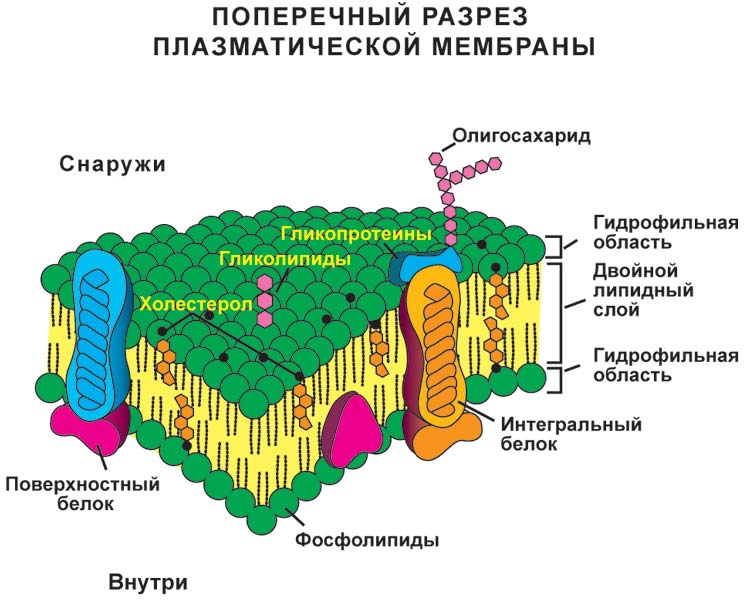 Предложенные методики приготовления препаратов для микроскопии, как оказалось, не отражали реальную структуру ЭГК из-за использования фиксаторов на основе водных носителей, которые, по-видимому, растворяли и удаляли большинство компонентов за исключением основных каркасных структур ЭГК. Для предотвращения разрушения структуры ЭГК были разработаны новые протоколы окрашивания и фиксации препаратов. Так, использование в качестве красителя алциана голубого 8GX позволило визуализировать методом трансмиссионной электронной микроскопии в капиллярах миокарда крысы ЭГК толщиной 200-500 нм, которая после обработки ферментом гиалуронидазой сокращалась до 100-200 нм [20]. Замена водных фиксаторов на фторуглеродные [21, 22] и использование глутарового альдегида [23, 24] показали, что толщина ЭГК достигает 60-200 нм в гломерулярных капиллярах и 50-100 нм в фене-стрированных капиллярах кишечника. Тем не менее, основным минусом методов визуализации ЭГК на основе микроскопии, помимо возникающих артефактов фиксации при изготовлении препаратов, состоит в том, что они не способны визуализировать интактный ЭГК в условиях in vivo.
Предложенные методики приготовления препаратов для микроскопии, как оказалось, не отражали реальную структуру ЭГК из-за использования фиксаторов на основе водных носителей, которые, по-видимому, растворяли и удаляли большинство компонентов за исключением основных каркасных структур ЭГК. Для предотвращения разрушения структуры ЭГК были разработаны новые протоколы окрашивания и фиксации препаратов. Так, использование в качестве красителя алциана голубого 8GX позволило визуализировать методом трансмиссионной электронной микроскопии в капиллярах миокарда крысы ЭГК толщиной 200-500 нм, которая после обработки ферментом гиалуронидазой сокращалась до 100-200 нм [20]. Замена водных фиксаторов на фторуглеродные [21, 22] и использование глутарового альдегида [23, 24] показали, что толщина ЭГК достигает 60-200 нм в гломерулярных капиллярах и 50-100 нм в фене-стрированных капиллярах кишечника. Тем не менее, основным минусом методов визуализации ЭГК на основе микроскопии, помимо возникающих артефактов фиксации при изготовлении препаратов, состоит в том, что они не способны визуализировать интактный ЭГК в условиях in vivo.
Несмотря на ряд недостатков, вышеуказанные методики визуализации с использованием электронной микроскопии помогли установить его ультраструктуру и связь основных каркасных структур ЭГК с кортикальным актиновым скелетом эндотелиальных клеток. Для этого полученные с помощью
ТЭМ данные визуализации капилляров брыжейки лягушки в приготовленных различными способами (замораживанием и химической фиксацией) препаратах [25, 26] подвергали компьютерной обработке с использованием автокорреляционных функций и Фурье-преобразования. Полученная уль-траструктурная модель (Рис. 1) была использована для дальнейшего математического моделирования поведения ЭГК в различных условиях его окружения [27, 28].
Рисунок 1. Вид идеализированной математической модели структуры эндотелиального гликокаликса, демонстрирующей гексагональное распределение каркасных белков (А-А) и связи их с цитоскелетом (А).
А-А
Кавеола
на поверхности (в ~ 70 мм)
кортикальным
актиновый
цитоскелет
кисточкоподобные
структуры
гликокаликса
(периодическая
структура)
центр связи поверхностных структур гликокаликса с актиновым цитоскелетом
коровые белки (расстояние между соседними 20 нм)
100 нм
каркасные структуры гликокаликса
J актиновые
— ——
t интегрины
базальная мембрана
Другим косвенным подходом визуализации ЭГК в сегментах микрососудистого русла является прижизненная микроскопия. Разработанный в середине девяностых годов прошлого века подход, получивший название «методика высвобождения красителя» (dye-exclusion technique) [29], определял ЭГК как пустую зону (пробел — gap) между стенкой капилляра и движущимися последовательно друг за другом в кровотоке эритроцитами. Кроме того, в кровоток вводили флуоресцентное высокомолекулярное соединение, FITC-декстран (меченный
Разработанный в середине девяностых годов прошлого века подход, получивший название «методика высвобождения красителя» (dye-exclusion technique) [29], определял ЭГК как пустую зону (пробел — gap) между стенкой капилляра и движущимися последовательно друг за другом в кровотоке эритроцитами. Кроме того, в кровоток вводили флуоресцентное высокомолекулярное соединение, FITC-декстран (меченный
флуоресцеин изоционатом декаран, 70 кДа), который практически не проникал в ЭГК. Использование этой методики позволило определить толщину ЭГК in vivo в капиллярах поддерживающей тестикулы (кремастерной) мышцы хомяка, который составил 0,4-0,5 мкм. Указанная ткань идеально подходит для микроскопии in vivo из-за своей низкой толщины и полупрозрачности, четкой визуализации клеток эндотелия и кровотока, возможности измерения локальных скоростей кровотока. Полученный результат подтвердил разрушение поверхностных структур ЭГК при его визуализации микроскопией ex vivo, что способствовало появлению множества работ на основе этой методики. -метода заключается в том, что исследуемая ткань (рассматривались венулы в кремастерной мышце хомяка), перфузи-руемая флуоресцентными микрочастицами (мечеными FITC), облучается астигматическим лазерным пучком, создающим плоскость, сканирующую кровоток в выбранном сечении ткани. Лазер прибора при этом работает в двухимпульсном режиме, а интервал между импульсами можно варьировать в определенном диапазоне. Рассеиваемое микросферами излучение регистрируется фотоприемником, после чего подвергается компьютерной обработке с использованием корреляционных алгоритмов для определения скоростей микрочастиц в кровотоке. Использование этого метода продемонстрировало экспоненциальный характер изменения профиля скоростей в ЭГК. Пилотное исследование, рассматривающее только насыщенную плазмой область около сосудистой стенки, определило эффективную гидродинамическую толщину ЭГК порядка 0,3-0,35 мкм [32]. Полный анализ профиля скоростей по всей плоскости микрососуда с использованием действительного градиента скоростей на границе ЭГК откорректировал первоначальные данные: эффективная
-метода заключается в том, что исследуемая ткань (рассматривались венулы в кремастерной мышце хомяка), перфузи-руемая флуоресцентными микрочастицами (мечеными FITC), облучается астигматическим лазерным пучком, создающим плоскость, сканирующую кровоток в выбранном сечении ткани. Лазер прибора при этом работает в двухимпульсном режиме, а интервал между импульсами можно варьировать в определенном диапазоне. Рассеиваемое микросферами излучение регистрируется фотоприемником, после чего подвергается компьютерной обработке с использованием корреляционных алгоритмов для определения скоростей микрочастиц в кровотоке. Использование этого метода продемонстрировало экспоненциальный характер изменения профиля скоростей в ЭГК. Пилотное исследование, рассматривающее только насыщенную плазмой область около сосудистой стенки, определило эффективную гидродинамическую толщину ЭГК порядка 0,3-0,35 мкм [32]. Полный анализ профиля скоростей по всей плоскости микрососуда с использованием действительного градиента скоростей на границе ЭГК откорректировал первоначальные данные: эффективная
толщина ЭГК в венулах составляла ~0,5 мкм, а при его деградации излучением 0,2 мкм [33].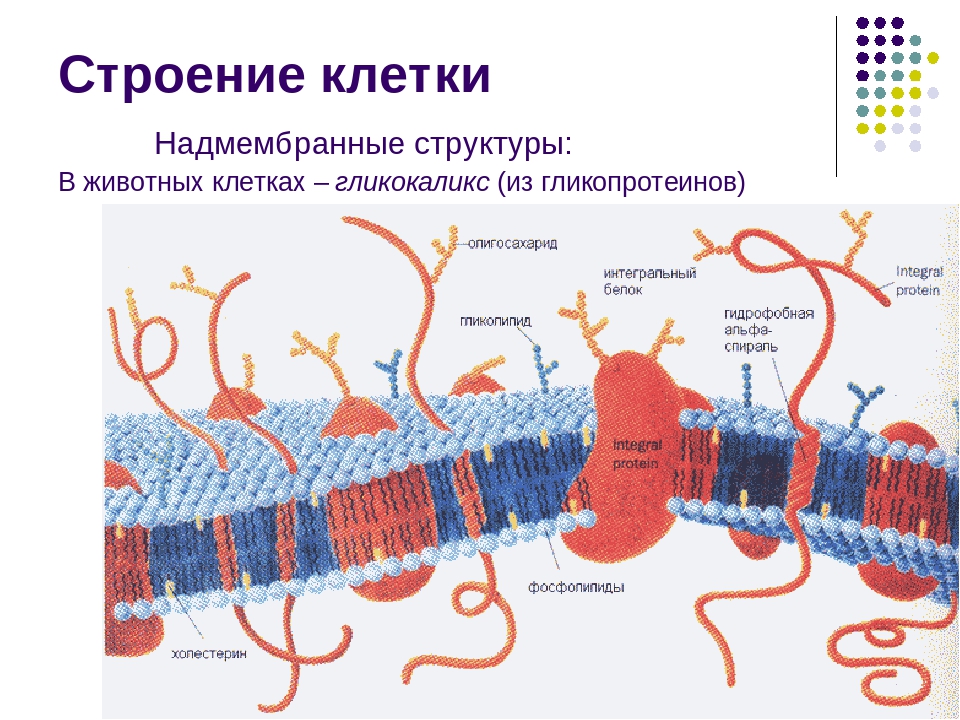
Перспективным подходом прямой визуализации ЭГК, в том числе и in vivo, является использование способных взаимодействовать с фрагментами ЭГК специфичных соединений с последующей лазерной микроскопией тканевых образцов, используя конфокальную лазерную сканирующую (CLSM) и двухфотонную лазерную сканирующую микроскопию (TPLSM). В качестве маркерных флуоресцентных соединений могут выступать связывающиеся со специфичными сахаридами сосудистой стенки лектины или антитела к белкам и сахаридам ЭГК [34, 35]. Указанные методики микроскопии позволяют создавать пространственную реконструкцию визуализируемых объектов, что способствует последующей обработке полученных данных. Метод CLSM был использован для визуализации ЭГК на поверхности культивируемых эндотелиальных клеток [36]. Толщина ЭГК в этом исследовании составляла 2-3 мкм. Этот тип микроскопии использовался также при исследовании воздействия на структуру ЭГК ишемии/ реперфузии и воспаления по изменению концентраций флуоресцентных лектинов в посткапиляр-ных венулах брыжейки крысы [35]. Использование метода CLSM ограничивается глубиной проникновения световых лучей в ткани (не глубже 40 мкм), что не позволяет исследовать крупные сосуды с толстой стенкой, а также использовать его на изолированных органах и клеточных культурах. Напротив, TPLSM позволяет in vivo изучать ткани на глубине более 1 мм, и имеет в сравнении с CLSM целый ряд дополнительных преимуществ (высокое разрешение, низкая фототоксичность), что способствует изучению ЭГК в крупных артериях. Возможности этого метода помогли визуализировать ЭГК в интактной сонной артерии мыши, толщина которого составила 3,5-5,5 мкм [37]. В настоящее время TPLSM является самой перспективной методикой для исследования функций ЭГК in vivo в микро- и макроциркуляторной системе мелких лабораторных животных.
Использование метода CLSM ограничивается глубиной проникновения световых лучей в ткани (не глубже 40 мкм), что не позволяет исследовать крупные сосуды с толстой стенкой, а также использовать его на изолированных органах и клеточных культурах. Напротив, TPLSM позволяет in vivo изучать ткани на глубине более 1 мм, и имеет в сравнении с CLSM целый ряд дополнительных преимуществ (высокое разрешение, низкая фототоксичность), что способствует изучению ЭГК в крупных артериях. Возможности этого метода помогли визуализировать ЭГК в интактной сонной артерии мыши, толщина которого составила 3,5-5,5 мкм [37]. В настоящее время TPLSM является самой перспективной методикой для исследования функций ЭГК in vivo в микро- и макроциркуляторной системе мелких лабораторных животных.
В настоящее время проводятся эксперименты по разработке экспериментальных подходов неинвазивной и воспроизводимой оценки состояния ЭГК у человека. Один из разрабатываемых подходов базируется на оценке состояния гликокаликса ми-кроциркуляторной сети в сублингвальной области человека по данным изменения размеров толщины колонки эритроцитов в капилляре после единичного прохождения лейкоцита (методике, апробированной на животных моделях) с помощью ортогональной поляризационной спектроскопии (orthogonal polarization spectroscopy, OPS) [38]. Полученные результаты оценивались совместно с измерениями системного объема ЭГК и показали обратную связь между наличием факторов риска ССЗ и толщиной ЭГК микроциркуляторной сети. Перспективной в этом плане является использование методики темнопольной микроскопии (side-stream dark field imaging, SDF) [39].
Полученные результаты оценивались совместно с измерениями системного объема ЭГК и показали обратную связь между наличием факторов риска ССЗ и толщиной ЭГК микроциркуляторной сети. Перспективной в этом плане является использование методики темнопольной микроскопии (side-stream dark field imaging, SDF) [39].
Биохимический состав и структура гликокаликса
Современные методы структурной и аналитической биохимии помогли идентифицировать входящие в ЭГК компоненты, а его общий вид был установлен различными способами визуализации (преимущественно микроскопии) и флуоресцентного маркирования [2]. Оказалось, ЭГК представляет собой высоко организованный полианионный комплекс с суммарным отрицательным зарядом, среди компонентов которого преобладают полимерные углеводы — гликозаминогликаны (ГАГ). Эти комплексные сахара связываются с поверхностью эндотелиальной клетки через ковалентное присоединение к белковым каркасным молекулам, образуя протеогликаны — синдеканы (связывают 5 цепей гепаран/хондроитинсульфата) и глипиканы (связывают 3 цепи гепаран/хондроитинсульфата) [2, 40]. ГАГ могут нековалентно связываться с другими белковыми компонентами ЭГК, гликопротеинами [41]. Эти мембранные белки содержат в своей структуре разнообразные олигосахаридные компоненты с терминальными сиаловыми кислотами, что создает на их поверхности специфические участки связывания разнообразных сигнальных молекул. Экспонированный к просвету сосуда поверхностный слой ЭГК состоит преимущественно из многочисленных растворимых компонентов, связывающихся с отрицательно заряженными компонентами через катионные участки своей структуры — растворимых протеогликанов (таких как бигликан, перлекан, де-корин, версикан, мимекан), плазматических белков, ферментов и их ингибиторов, цитокинов и факторов роста, катионных аминокислот, низкомолекулярных катионов и молекул воды [1, 42, 43]. ЭГК является весьма динамичным образованием, в котором постоянно происходит замещение структурных компонентов (в первую очередь растворимых) [44-46]. Следует также учитывать, что ЭГК подвергается воздействию специфических протеаз и гликозидаз, регулирующих его плотность и функции [47].
ГАГ могут нековалентно связываться с другими белковыми компонентами ЭГК, гликопротеинами [41]. Эти мембранные белки содержат в своей структуре разнообразные олигосахаридные компоненты с терминальными сиаловыми кислотами, что создает на их поверхности специфические участки связывания разнообразных сигнальных молекул. Экспонированный к просвету сосуда поверхностный слой ЭГК состоит преимущественно из многочисленных растворимых компонентов, связывающихся с отрицательно заряженными компонентами через катионные участки своей структуры — растворимых протеогликанов (таких как бигликан, перлекан, де-корин, версикан, мимекан), плазматических белков, ферментов и их ингибиторов, цитокинов и факторов роста, катионных аминокислот, низкомолекулярных катионов и молекул воды [1, 42, 43]. ЭГК является весьма динамичным образованием, в котором постоянно происходит замещение структурных компонентов (в первую очередь растворимых) [44-46]. Следует также учитывать, что ЭГК подвергается воздействию специфических протеаз и гликозидаз, регулирующих его плотность и функции [47]. Более того, динамические изменения параметров кровотока (например, напряжение сдвига) и действие сигнальных молекул вызывают постоянное изменение профиля экспрессии и катаболизма мембранных молекул апикальной поверхности эндотелиальных клеток, модулируя тем самым толщину ЭГК [48, 49]. Прямые методики визуализации показывают, что ЭГК преимущественно представляет самоорганизующуюся пространственную сеть различных полисахаридов [50]. Направленное ферментативное удаление любого из входящих в состав компонентов оказывает значительно воздействие на функции ЭГК, что демонстрирует значимость всех его компонентов для правильного функционирования этой структуры как целого.
Более того, динамические изменения параметров кровотока (например, напряжение сдвига) и действие сигнальных молекул вызывают постоянное изменение профиля экспрессии и катаболизма мембранных молекул апикальной поверхности эндотелиальных клеток, модулируя тем самым толщину ЭГК [48, 49]. Прямые методики визуализации показывают, что ЭГК преимущественно представляет самоорганизующуюся пространственную сеть различных полисахаридов [50]. Направленное ферментативное удаление любого из входящих в состав компонентов оказывает значительно воздействие на функции ЭГК, что демонстрирует значимость всех его компонентов для правильного функционирования этой структуры как целого.
Протеогликаны и гликозаминогликаны
В качестве основных опорных структур для остальных компонентов ЭГК выступают протеогликаны [2]. Они представляют собой вытянутые белковые молекулы (коровые белки), которые имеют в своей структуре несколько участков для ковалент-
Рисунок 2.
(2-503) (4-БОз, 6-Б03 ) ХОНДРОИТИН СУЛЬФАТ
СОПОЛИМЕРЫ
Г-4)С1сАф1 -4)С1сМАс(<х1- 1
[ 1с1оА (а1 С1сМБ03- -1 ‘
(2-Б03-) (З-БОз , 6-503 )
ГЕПАРИ Н/ГЕ ПАРАН СУЛ ЬФАТ
-4)<31сА ф1 -3)Са1сЫАсф1-ИоА(а1
(2-503) (4-503-, б-503 ) ДЕРМАТАНСУЛ ЬФАТ
ного присоединения цепей ГАГ Последние являются полимерными, отрицательно заряженными сахарами, обладающими линейной структурой, составленной из простой последовательности соединенных гликозидной связью дисахаридов [51, 52] (Рис. 2). Эти дисахариды представлены уроновой кислотой Ш-глюкуроновой или L-идуроновой кислотой), соединенной с гексозамином Ш-галактозамином или D-глюкозамином).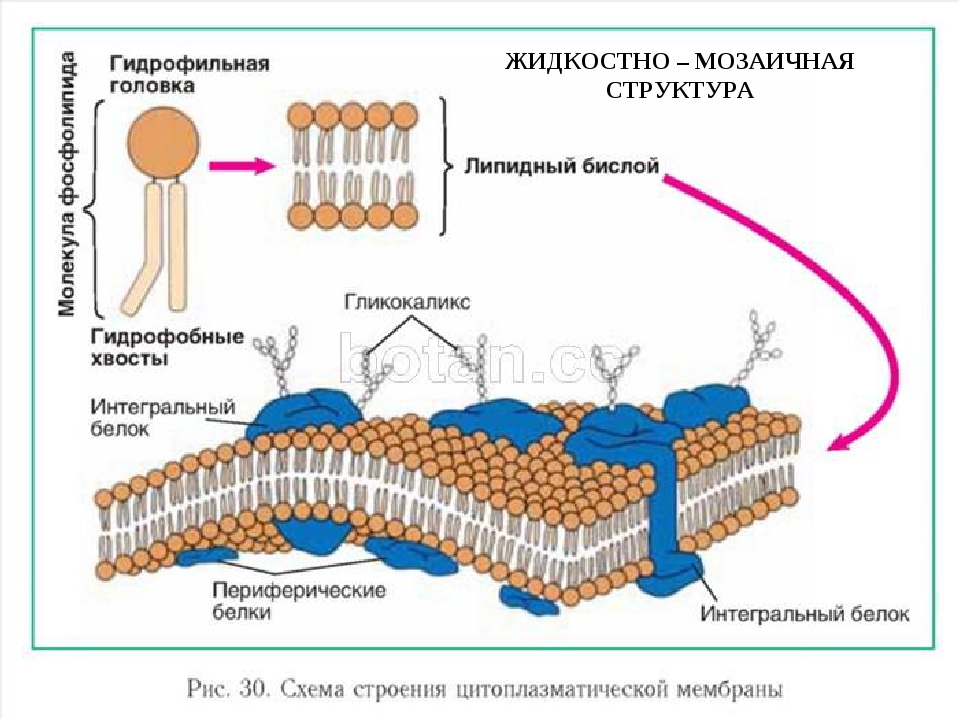 Почти все ГАГ (за исключением гиалуронана) имеют в своей структуре модифицированные группы [53, 54].
Почти все ГАГ (за исключением гиалуронана) имеют в своей структуре модифицированные группы [53, 54].
Существует множество ферментов, которые после посттрансляционной сборки полисахаридных цепей на коровом белке протеогликана проводят сульфатирование и ацетилирование функциональных группировок ГАГ, при этом в каждом случае степень модификации может варьировать в широких пределах [55-57]. Как правило, на одну дисахарид-ную единицу может приходиться от 16 до 48 различных типов сульфатирования [58]. Принимая во внимание тот факт, что функциональные домены ГАГ обычно состоят из 5-10 дисахаридных единиц, максимальное теоретическое число участков сульфатирования на гексасахаридном фрагменте может достигать 4000 Б04-групп, что создает громадную совокупность функционально гетерогенных соединений [50]. Сульфатированные ГАГ образуют вытянутые спирали, конформация которых зависит от локального характера сульфатирования, эластичности связанных моносахаридов и силы внутримолекулярных электростатических взаимодействий [59]. Локальные параметры среды (ионная сила и pH) оказывают сильное влияние на характер растяжимости спирали ГАГ [60]. Наибольшая растяжимость (80% от линейной длины) может достигаться при физиологических параметрах среды, в результате чего цепь ГАГ, состоящая из 100 дисахаридных единиц, может растягиваться на 80 нм.
Локальные параметры среды (ионная сила и pH) оказывают сильное влияние на характер растяжимости спирали ГАГ [60]. Наибольшая растяжимость (80% от линейной длины) может достигаться при физиологических параметрах среды, в результате чего цепь ГАГ, состоящая из 100 дисахаридных единиц, может растягиваться на 80 нм.
Наличие в структурной дисахаридной единице ГАГ того или иного компонента, а также геометрия гликозидной связи (а или р) между этими компонентами и степень модификации, определяет классификацию ГАГ Существует пять типов подобных полимеров: гепарин/гепарансульфат, хондроитин-сульфат, дерматансульфат, кератан-сульфат и гиа-луронан (гиалуроновая кислота) [55]. При этом они могут подразделяться по тому или иному параметру на соответствующие подгруппы. К примеру, различие может основываться на природе входящего в структуру ГАГ аминосахара: содержащие галак-тозамин хондроитинсульфат и дерматансульфат поэтому называются галактозаминогликанами, а содержащие глюкозамин гепарин/гепарансульфат и гиалуронан — глюкозаминогликаны (Рис. 2). Стоит также отметить, что дерматансульфат часто рассматривается как обособленный тип ГАГ, тогда как в действительности он является модифицированной молекулой хондроитинсульфата (класс Б). Различие между двумя классами состоит в эпиме-ризации глюкуроновой кислоты в идуроновую, что изменяет свойства дерматансульфата [52].
2). Стоит также отметить, что дерматансульфат часто рассматривается как обособленный тип ГАГ, тогда как в действительности он является модифицированной молекулой хондроитинсульфата (класс Б). Различие между двумя классами состоит в эпиме-ризации глюкуроновой кислоты в идуроновую, что изменяет свойства дерматансульфата [52].
Каждый тип ГАГ достаточно хорошо охарактеризован как структурно, так и функционально. Эти полимерные сахара в изобилии представлены во внеклеточном матриксе тканей позвоночных и принимают участие во множестве физиологических и патофизиологических процессов. Все ГАГ могут участвовать в передаче клеточных сигналов, эмбриогенезе, ангиогенезе, развитии и метаста-зирование опухолей, аксональном росте [61-66]. Важным свойством гепарина и некоторых типов гепаран-сульфата является регуляция свертываемости крови [67]. Некоторые гепарансульфаты с определенным типом сульфатирования полностью лишаются антикоагулянтных свойств, но приобретают способность подавлять рост опухолей [68, 69]. Так как сульфатированные ГАГ входят в состав разнообразных внеклеточных белковых скоплений, амилоидов, они участвуют в таких заболеваниях, как амилоидные дистрофии, болезнь Альцгеймера, сахарный диабет 2 типа, болезнь Паркинсона и при-онные инфекции [70, 71]. Воспалительные процессы также не обходятся без этих полимеров, выполняющих функцию вспомогательных соединений для реализации иммунного ответа организма [72]. Благодаря способности взаимодействовать с клеточной поверхностью некоторых патогенных микроорганизмов, ГАГ могут способствовать микробному патогенезу и инвазии [73].
Так как сульфатированные ГАГ входят в состав разнообразных внеклеточных белковых скоплений, амилоидов, они участвуют в таких заболеваниях, как амилоидные дистрофии, болезнь Альцгеймера, сахарный диабет 2 типа, болезнь Паркинсона и при-онные инфекции [70, 71]. Воспалительные процессы также не обходятся без этих полимеров, выполняющих функцию вспомогательных соединений для реализации иммунного ответа организма [72]. Благодаря способности взаимодействовать с клеточной поверхностью некоторых патогенных микроорганизмов, ГАГ могут способствовать микробному патогенезу и инвазии [73].
Все ГАГ за исключением гиалуронана связаны с коровыми белками протеогликанов ковалентной связью [51]. Эта связь представляет собой специфичную трисахаридную структуру, состоящую из двух остатков галактозы (Gal) и остатка ксилозы (Xyl), которая присоединена к сериновому остатку корового белка через О-гликозидную связь. Некоторые формы кератансульфата связываются с ко-ровым белком через N-аспарагин [52]. Связывание
Связывание
32
ГАГ с протеогликанами стабилизирует структуру полимерных сахаров.
Мембранные протеогликаны
Практически все типы клеток продуцируют разнообразные протеогликаны (ПГ), а затем переносят их во внеклеточный матрикс, экспонируют на своей поверхности или накапливуют в секреторных гранулах [74]. Эти белковые молекулы могут различаться по ряду параметров, таких как размер полипептид-ной цепи, характер связывания с мембраной эндотелиальной клетки, количество участков присоединения ГАГ На основании этих характеристик молекулы ПГ объединяются в несколько групп. ПГ, входящие в группы синдеканов (белки с трансмембранным доменом, 4 подтипа) и глипиканов (мембранные белки, связанные с гликозилфосфатидилинозитолом, 6 подтипов), присоединены к клеточной мембране, тогда как другие ПГ (бигликан, мимикан, перлекан, версикан и декорин) являются растворимыми белками и связаны с ЭГК благодаря своим ионогенным структурным группам [75]. ПГ не обладают способностью связывать какой-то определенный тип ГАГ, обычно те или иные группы ПГ содержат несколько типов углеводных полимеров. На соотношение содержания разных типов ГАГ могут влиять различные факторы в процессе синтеза структуры ПГ
ПГ не обладают способностью связывать какой-то определенный тип ГАГ, обычно те или иные группы ПГ содержат несколько типов углеводных полимеров. На соотношение содержания разных типов ГАГ могут влиять различные факторы в процессе синтеза структуры ПГ
Наиболее распространенными ПГ сосудистой стенки являются содержащие гепаран-сульфат ПГ, составляющие 50-90% от общего количества ПГ [1, 76]. Это значение существенно варьирует в указанном интервале из-за действия разнообразных стимулов, оказывающих влияние на эндотелиальную клетку. Менее распространенным на поверхности ЭГК является хондроитинсульфат различных видов, при этом традиционно указывается, что соотношение между гепарансульфатом и хондроитинсульфа-том в ЭГК составляет 4:1 [77, 78]. Распространение и функции в сосудистой сети ПГ кератан-сульфата до их пор не выяснены.
ПГ клеточной поверхности представлены в первую очередь тремя подтипами синдекана: синдекан-1 (33 кДа), -2 (22 кДа) и -4 (22 кДа) [79]. рз дерматансульфат
рз дерматансульфат
2Б 2Б
Л
э
протеиновая цепь олигосахарид белки кровотока
сию синдекана-1, а фактор роста фибробластов (FGF) инициирует только синтез синдекана-4 гладкомышечными клетками аорты [79]. Регулировать экспрессию синдеканов также могут как изменения
профиля скоростей кровотока, так и сами представители семейства синдеканов [48, 83]. Основным свойством этих трансмембранных молекул является способность передавать сигналы из внеклеточно-
го окружения в клетку. Связывание специфических лигандов с гепарансульфатами на клеточной поверхности приводит к активации внутриклеточных факторов, например, киназных доменов (с-Бгс), PDZ-домена или связанных с этими участками структурных клеточных белков (тубулин, динамин или а-актинин) [79]. терминальная часть этого ПГ содержит множество цистеиновых остатков и из-за этого принимает глобулярную форму, что отличает эти домены от внеклеточных доменов синдеканов с вытянутой формой. Глипиканы не является трансмембранными белками: их молекулы связаны с мембраной через гликозилфосфатидилинозитол и локализуются преимущественно в местах скопления холестерина и сфинголипидов [84, 85]. Подобные участки мембраны принимают участие в процессах везикулярного транспорта и передачи клеточных сигналов благодаря интеграции этих участков с белком кавеолином-1, образующим в участках мембраны, связанных с цитоскелетом, углубления (Рис. 3), и присутствию в них разнообразных сигнальных молекул, например, эндотелиальной NO-синтазы [86].
терминальная часть этого ПГ содержит множество цистеиновых остатков и из-за этого принимает глобулярную форму, что отличает эти домены от внеклеточных доменов синдеканов с вытянутой формой. Глипиканы не является трансмембранными белками: их молекулы связаны с мембраной через гликозилфосфатидилинозитол и локализуются преимущественно в местах скопления холестерина и сфинголипидов [84, 85]. Подобные участки мембраны принимают участие в процессах везикулярного транспорта и передачи клеточных сигналов благодаря интеграции этих участков с белком кавеолином-1, образующим в участках мембраны, связанных с цитоскелетом, углубления (Рис. 3), и присутствию в них разнообразных сигнальных молекул, например, эндотелиальной NO-синтазы [86].
Растворимые протеогликаны
Как с апикальной, так и с дорзальной стороны эндотелиальных клеток и на гладкомышечных клетках крупных сосудов также секретируется крупный растворимый ПГ перлекан (450 кДа), состоящий из пяти доменов, один из которых имеет несколько участков присоединения гепаран- и хондроитин-сульфата [87]. 1/2, TSG-6, CD38, CDC37, 1Т1, SPACR, объединяемых в группу так называемых белков гиаладгери-нов) обладают способными связывать гиалуронан
1/2, TSG-6, CD38, CDC37, 1Т1, SPACR, объединяемых в группу так называемых белков гиаладгери-нов) обладают способными связывать гиалуронан
структурными мотивами, что обусловливает участие этого полимера во многих процессах передачи клеточных сигналов [74].
Биосинтез протеогликанов и гликозаминогликанов
Содержащие гепарансульфат и хондроитинсуль-фат ПГ синтезируются в эндоплазматическом рети-кулуме и аппарате Гольджи клеток эндотелия [55, 56, 74]. Напротив, гиалуронан синтезируется на внутренней поверхности цитоплазматической мембраны клетки группой ферментов под названием гиалуронан синтазы, существенно отличающихся от остальных гликозилтрансфераз [91]. У млекопитающих существует три типа подобных ферментов, структура которых представляет собой комплекс трансмембранных доменов, связанных друг с другом крупными цитоплазматическими петлями. ацетилглюкозамина и глюкуроновую кислоту с необходимых субстратов (нуклеотидных сахаров) [92]. Растущая полимерная цепь гиалуронана продавливается через мембрану во внеклеточное пространство, где фиксируется специфическими рецепторами клеточной поверхности [93].
ацетилглюкозамина и глюкуроновую кислоту с необходимых субстратов (нуклеотидных сахаров) [92]. Растущая полимерная цепь гиалуронана продавливается через мембрану во внеклеточное пространство, где фиксируется специфическими рецепторами клеточной поверхности [93].
Гликопротеины
Некоторые гликопротеины могут наравне с ПГ участвовать в организации структуры ЭГК и обеспечивать его связь с клеточной мембраной эндотелия [41, 50]. Они представляют собой закрепленные в мембране белки, к внеклеточной части которых присоединены короткие разветвленные олигосахариды (2-15 сахаридных остатков). Сахаридная цепь этих остатков завершается сиаловыми кислотами, девятиуглеродными моносахаридами, вносящими вклад в отрицательный заряд ЭГК при их ионизации в области физиологических значений pH. Основными классами гликопротеинов являются молекулы клеточной адгезии и рецепторы межклеточной сигнализации, а также компоненты систем фибриноли-за и коагуляции [94, 95]. терминальный, является связывающей сахаридные компоненты лек-тиновой структурой [99, 100]. Также в структуре
терминальный, является связывающей сахаридные компоненты лек-тиновой структурой [99, 100]. Также в структуре
внеклеточной части селектинов могут содержаться модули, сходные по структуре с фрагментами белков комплемента. Существует 3 типа селектинов: E, P и L [101]. E-селектины экспонируются на эндотелиальных клетках, а L-селектины — на лейкоцитах. P-селектины могут быть представлены как на эндотелиальных клетках, так и на тромбоцитах. E-селектины эндотелиальных клеток сразу же после рибосомальной трансляции и посттрансляционных модификаций в эндоплазматическом ретикулу-ме и компартментах аппарата Гольджи непосредственно экспонируются на мембране клетки, тогда как P-селектины после синтеза хранятся в тельцах Вейбеля-Палладе. При воспалительном отклике на тканевое повреждение действие ряда медиаторов (таких как гистамин, тромбин, активные формы кислорода, ЛНП) вызывают мобилизацию и транслокацию P-селектина на клеточную поверхность, где он присутствуюе короткое время, после чего переводится в лизосомальные гранулы и аппарат Гольджи, а оттуда вновь поступает на хранение в тельца Вейбеля-Палладе [102, 103]. Стимуляция эндотелия эндотоксинами и цитокинами (IL-1 р, TNF-а) стимулирует экспрессию E-селектина и дополнительное экспонирование P-селектина на поверхности эндотелиальных клеток [104]. Основной функцией селектинов эндотелия является адгезия лейкоцитов к поверхности сосудистой стенки.
Стимуляция эндотелия эндотоксинами и цитокинами (IL-1 р, TNF-а) стимулирует экспрессию E-селектина и дополнительное экспонирование P-селектина на поверхности эндотелиальных клеток [104]. Основной функцией селектинов эндотелия является адгезия лейкоцитов к поверхности сосудистой стенки.
Упоминавшиеся выше интегрины представляют собой рецепторы клеточной поверхности, способствующие как межклеточной адгезии, так и связи клетки с компонентами внеклеточного матрикса и базальными мембранами. Эти гетеродимерные молекулы состоят из двух нековалентно связанных друг с другом трансмембранных субъединиц (а и р). Существует 18 типов а-субъединиц и 8 типов р-субъединиц, комбинация которых приводит к появлению различных типов этих белков [105]. В настоящее время охарактеризовано 24 типа инте-гринов. Эти гликопротеины экспрессируются множеством типов клеток, таких как фибробласты, клетки эпителия и эндотелия, лейкоциты и тромбоциты. На апикальной стороне эндотелиальных клеток экспонируется интегрин avp3, обеспечивающий контакт этих клеток с тромбоцитами, тогда как с дорсальной стороны интегрины а2р1, а5р1, и а6р1 взаимодействуют с лигандами внеклеточного матрикса (коллагенами, ламинином, фибронектином и ви-тронектином), при этом интегрины группируются в определенных участках, называемых фокальными контактами [96, 106]. Внутриклеточные домены ин-тегринов через группу молекул цитоплазмы (таких как талин, винкулин, паксиллин и а-актинин) связываются с актиновым цитоскелетом. Благодаря подобным контактам, а также связи внутриклеточных доменов с группой протеинкиназ, интегрины играют важную роль в передаче клеточных сигналов и участвуют в таких ключевых процессах как клеточная дифференциация, рост, пролиферация, миграция и апоптоз [96].
Внутриклеточные домены ин-тегринов через группу молекул цитоплазмы (таких как талин, винкулин, паксиллин и а-актинин) связываются с актиновым цитоскелетом. Благодаря подобным контактам, а также связи внутриклеточных доменов с группой протеинкиназ, интегрины играют важную роль в передаче клеточных сигналов и участвуют в таких ключевых процессах как клеточная дифференциация, рост, пролиферация, миграция и апоптоз [96].
Гликопротеины суперсемейства иммуноглобулинов являются трансмембранными белками, внеклеточные домены которых содержат различное количество иммуно-глобулиновых фрагментов. На эндотелии сосудистой стенки соединения этого типа представлены молекулами клеточной адгезии ICAM-1 и -2, молекулой адгезии клеток сосуда VCAM-1 и молекулой адгезии тромбоцитов к эндотелию PECAM-1. Молекулы ICAM-1 (CD54), -2 (CD102) и VCAM-1 обеспечивают адгезию нейтро-филов, моноцитов, эозинофилов и лимфоцитов к активированному эндотелию через связывание с лейкоцитарными интегринами LFA-1, Mac-1, 4 1 для экстравазации клеток иммунной системы в воспаленные ткани [101]. Эти гликопротеины секрети-руются клетками эндотелия, моноцитами и лимфоцитами, при этом ICAM-2 является конститутивным рецептором, тогда как ICAM-1 экспрессируется клетками после их активации цитокинами (IL-1, TNF- , IFN-). Экспрессия VCAM-1 и ICAM-1 активируется действием цитокинов [107]. Постоянно присутствующий на эндотелии гликопротеин PECAM-1 (CD31) наряду с адгезией иммунных и опухолевых клеток также обеспечивает связывание тромбоцитов с сосудистой стенкой [108].
Эти гликопротеины секрети-руются клетками эндотелия, моноцитами и лимфоцитами, при этом ICAM-2 является конститутивным рецептором, тогда как ICAM-1 экспрессируется клетками после их активации цитокинами (IL-1, TNF- , IFN-). Экспрессия VCAM-1 и ICAM-1 активируется действием цитокинов [107]. Постоянно присутствующий на эндотелии гликопротеин PECAM-1 (CD31) наряду с адгезией иммунных и опухолевых клеток также обеспечивает связывание тромбоцитов с сосудистой стенкой [108].
Помимо описанных выше соединений в составе гликокаликса могут присутствовать другие типы гликопротеинов, принимающих участие в процессах поддержания сосудистого гомеостаза, фибринолиза и коагуляция крови. В качестве примера подобных белков можно привести входящий в мембрану эндотелия гликопротеин тромбомодулин [109]. Этот белок, связывая тромбин и удаляя его из системы свертывания крови, ускоряет процесс активации протеина С, разрушающего ряд факторов коагуляции (Villa и Va) и ингибирующего образование тромбина, что определяет важную антикоагулянтную функцию тромбомодулина. Другим примером является экспрессирующийся на эндотелиальных клетках и тромбоцитах гликопротеиновый макрокомплекс Ib-IX-V, состоящий из четырех трансмембранных компонентов [110]. Этот комплекс связывает фактор Виллебранда и Р-селектин, способствуя активации тромбоцитов и их адгезии к субэндотелию при повреждении сосудистой стенки [111, 112].
Другим примером является экспрессирующийся на эндотелиальных клетках и тромбоцитах гликопротеиновый макрокомплекс Ib-IX-V, состоящий из четырех трансмембранных компонентов [110]. Этот комплекс связывает фактор Виллебранда и Р-селектин, способствуя активации тромбоцитов и их адгезии к субэндотелию при повреждении сосудистой стенки [111, 112].
Общая структура эндотелиального гликокаликса
Описанные мембранные ПГ и гликопротеины образуют квазипериодическую трехмерную сеть, организующую специфическую ультраструктуру на апикальной поверхности эндотелия. Волокна этой сети, представляющие собой коровые белки ПГ, имеют диаметр порядка 10-12 нм и расположены друг от друга на расстоянии ~20 нм [113]. Полученные при изучении изготовленных методом криоскалывания поперечных сосудистых срезов данные и общие результаты микроскопии ЭГК продемонстрировали существование центров фиксации коровых белков
на мембране и соединения этих центров со структурами цитоскелета. Исходящие из этих центров коро-вые белки образуют квазигексагональную ячеистую структуру (Рис. 1) с шагом решетки между центрами фиксации порядка 100 нм [23, 25, 1 13]. Подобная структура согласуется с концепцией того, что ЭГК представляет собой волоконную матрицу, выполняющую функцию внеклеточного молекулярного фильтра. На основании данных о существовании подобной ультраструктуры была созданная математическая модель, с помощью которой прогнозировались механизмы процесса фильтрации через ЭГК, расчет сопротивления ЭГК к различным скоростям кровотока и его передачи к кортикальному цитоскелету [114].
Исходящие из этих центров коро-вые белки образуют квазигексагональную ячеистую структуру (Рис. 1) с шагом решетки между центрами фиксации порядка 100 нм [23, 25, 1 13]. Подобная структура согласуется с концепцией того, что ЭГК представляет собой волоконную матрицу, выполняющую функцию внеклеточного молекулярного фильтра. На основании данных о существовании подобной ультраструктуры была созданная математическая модель, с помощью которой прогнозировались механизмы процесса фильтрации через ЭГК, расчет сопротивления ЭГК к различным скоростям кровотока и его передачи к кортикальному цитоскелету [114].
С помощью электронной микроскопии было показано, что ЭГК может быть организован в два слоя: внутренний слой толщиной в несколько десятков нанометров у поверхности мембраны клеток эндотелия и внешний слой, состоящий из коровых белков и простирающийся на 500 нм и выше [23] (Рис. 3). В этот слой входят растворимые компоненты, такие как белки кровотока и соединения, экспрессируемые эндотелиальными клетками./nauka/nauk_1_4.jpg) Помимо структурной роли они реализуют некоторые важные функции гликокаликса. Так, белки плазмы a-1-гликопротеид (орозомукоид) и альбумин, абсорбируясь на внешней поверхности ЭГК, участвуют в создании селективного заряженного барьера для избирательной тканевой фильтрации [14, 115]. На границе раздела этих слоев присутствует гиалуро-нан, связанный своими рецепторами с клеточной поверхностью и цепями хондроитинсульфата ПГ Возможность расположения гиалуронана в глубине ЭГК была показана в нескольких экспериментах с использованием различных гликолитических ферментов. Длительная обработка (в течение 2 часов) гиалуронидазой, разлагающим гиалуронан ферментом, вызывает незначительное сокращение структуры ЭГК, тогда как кратковременное использование фермента гепариназы, срезающего гепарансульфат с его ПГ, приводит к существенному изменению структуры ЭГК [34, 116]. Эти данные косвенно указывают на расположение гиалуронана внутри ЭГК около мембраны эндотелиальных клеток и экранирование его ПГ (Рис.
Помимо структурной роли они реализуют некоторые важные функции гликокаликса. Так, белки плазмы a-1-гликопротеид (орозомукоид) и альбумин, абсорбируясь на внешней поверхности ЭГК, участвуют в создании селективного заряженного барьера для избирательной тканевой фильтрации [14, 115]. На границе раздела этих слоев присутствует гиалуро-нан, связанный своими рецепторами с клеточной поверхностью и цепями хондроитинсульфата ПГ Возможность расположения гиалуронана в глубине ЭГК была показана в нескольких экспериментах с использованием различных гликолитических ферментов. Длительная обработка (в течение 2 часов) гиалуронидазой, разлагающим гиалуронан ферментом, вызывает незначительное сокращение структуры ЭГК, тогда как кратковременное использование фермента гепариназы, срезающего гепарансульфат с его ПГ, приводит к существенному изменению структуры ЭГК [34, 116]. Эти данные косвенно указывают на расположение гиалуронана внутри ЭГК около мембраны эндотелиальных клеток и экранирование его ПГ (Рис.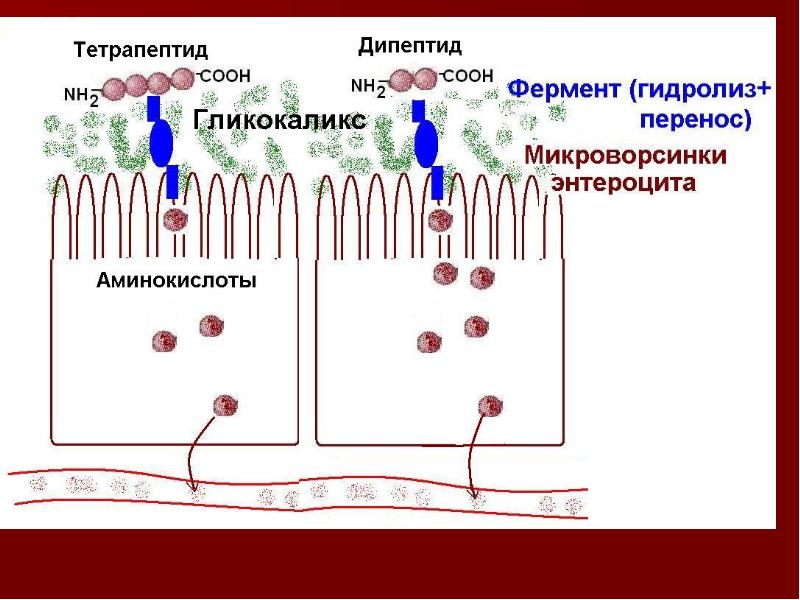 3). Благодаря своим вязкоэластичным свойствам и способностью к аг-грегации с образованием стабильных комплексов,
3). Благодаря своим вязкоэластичным свойствам и способностью к аг-грегации с образованием стабильных комплексов,
гиалуронан создает гелеподобную подложку и стабилизирует вытянутые структуры ПГ и остальные ГАГ [90]. ПГ и гликопротеины за счет своих сахаридных компонентов, вероятно, также поддерживают целостность структуры ЭГК, взаимодействуя с соседними коровыми белками через ГАГ-цепи [117]. Эти взаимодействия скорее всего носят электростатический характер, однако возможно и существование белковых структур, ковалентно связанных ГАГ друг с другом, например, в интер-альфа-трипсиновом ингибиторе [118]. Полагают, что проницаемость ЭГК определяется гиалуронаном, а его объем регулируется ПГ [119, 120].
Заключение
Несмотря на то, что концепция поверхностного слоя эндотелия была сформулирована в 60-х годах прошлого века, доказательной методологической базы того времени было не достаточно для определения общей структуры и точного молекулярного состава ЭГК.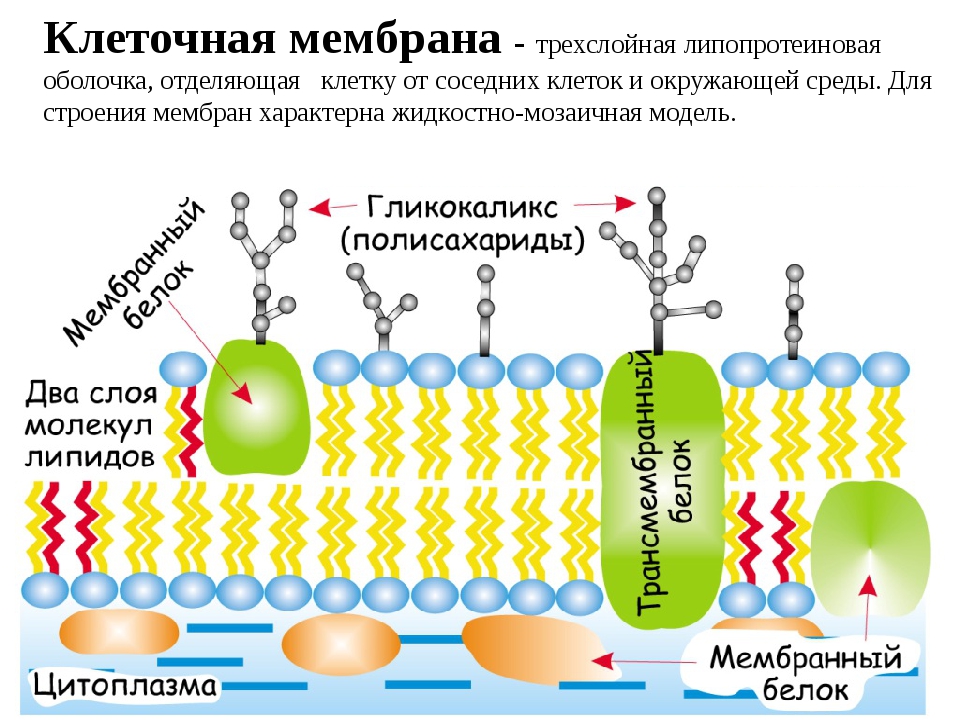 Эти задачи были в значительной мере разрешены благодаря усовершенствованию предшествующих микроскопии процедур фиксации и окрашивания тканевых препаратов, а также разработке изящных методик прижизненной визуализации ЭГК в системе микроциркуляции животных. Используемые методы показали, что ЭГК представляет собой достаточно крупную и организованную молекулярную структуру, покрывающую люминальную поверхность эндотелиальных клеток всей сердечно-сосудистой системы. Эта структура представляет собой организованный комплекс мембрано-связанных молекул с уникальным набором биологических функций, в состав которых входят связанные с ПГ сульфатированные ГАГ, гиа-луронан, гликопротеины и белки плазмы. Существование подобной структуры на стратегическом участке взаимодействия циркулирующей крови с тканью подразумевает наличие у ЭГК ряда специфических функций, регулирующих процессы сосудистого метаболизма.
Эти задачи были в значительной мере разрешены благодаря усовершенствованию предшествующих микроскопии процедур фиксации и окрашивания тканевых препаратов, а также разработке изящных методик прижизненной визуализации ЭГК в системе микроциркуляции животных. Используемые методы показали, что ЭГК представляет собой достаточно крупную и организованную молекулярную структуру, покрывающую люминальную поверхность эндотелиальных клеток всей сердечно-сосудистой системы. Эта структура представляет собой организованный комплекс мембрано-связанных молекул с уникальным набором биологических функций, в состав которых входят связанные с ПГ сульфатированные ГАГ, гиа-луронан, гликопротеины и белки плазмы. Существование подобной структуры на стратегическом участке взаимодействия циркулирующей крови с тканью подразумевает наличие у ЭГК ряда специфических функций, регулирующих процессы сосудистого метаболизма.
Гранты
Настоящая работа выполнена при финансовой поддержке грантами РФФИ 07-04-12057-офи, 0904-00023 и Минздравсоцразвития России.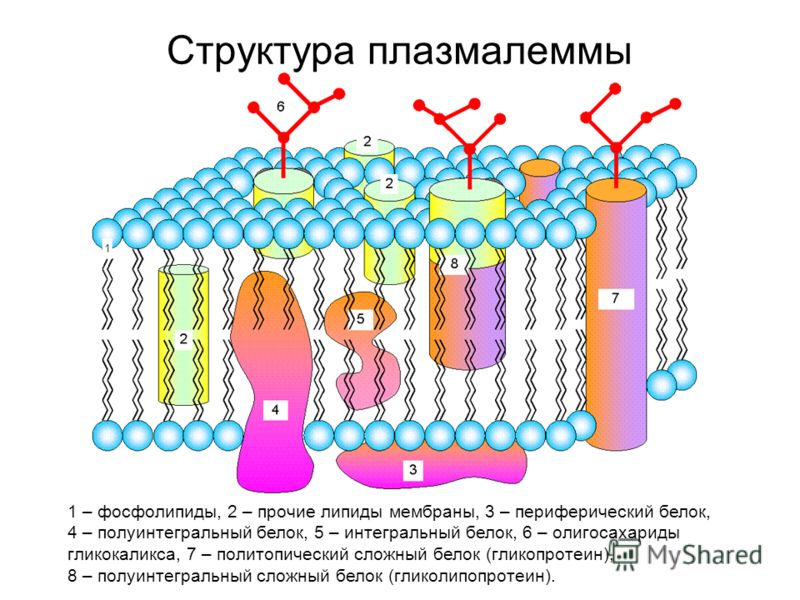
CnucoKnumepamypbi
1. PriesA.R., Secomb T.W., Gaehtgens P. The endothelial surface layer. PflugersArch Eur JPhysiol2000; 440:653-666.
2. Weinbaum S, TarbellJM., Damiano ER. The structure andfunction of the endothelial glycocalyx layer. Annu Rev Biomed Eng 2007; 9:121-167.
3. ScottJE. Extracellular matrix, supramolecular organisation and shape.JAnat 1995; 187:259-269.
4. DanielliJF. Capillary permeability and oedema in the perfusedfrog.J Physiol 1940; 98(1): 109-129.
5. Chambers R., Zweifach B.W. Intercellular Cement and Capillary Permeability. Physiol Rev 1947; 27:436-463.
6. CopleyA.L.Hemorheological aspects of the endothelium-plasma interface.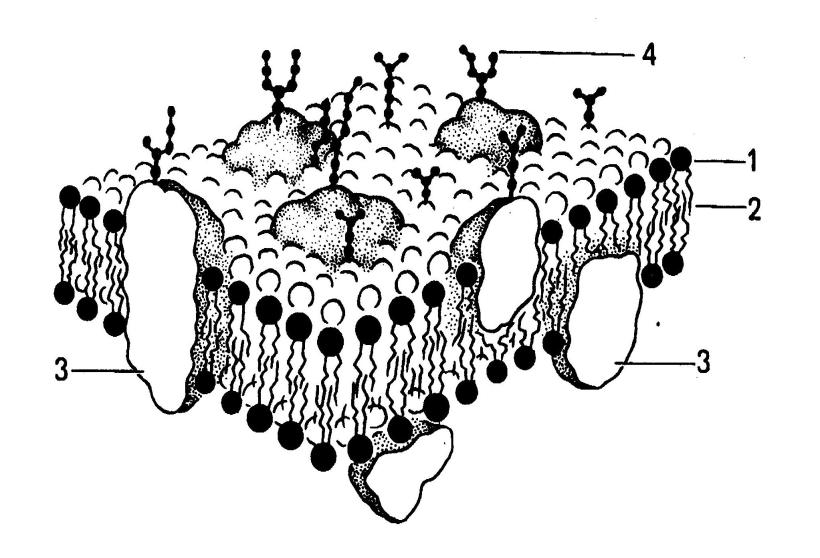 MicrovascRes 1974; 8:192-212.
MicrovascRes 1974; 8:192-212.
7. Luft JH. Fine structures of capillary and endocapillary layer as revealed by ruthenium red. FedProc 1966; 25:1773-1783.
8. Klitzman B., Duling BR. Microvascular hematocrit and red cell flow in resting and contracting striated muscle. Am J Physiol 1979; 237: h581-h590.
9. Pries AR, Secomb T.W., Gessner T. et al. Resistance to blood flow in microvessels in vivo. Circ Res 1994; 75:904-915.
10. Desjardins C, Duling BR Heparinase treatment suggests a rolefor the endothelial cell glycocalyx in regulation of capillary hematocrit. AmJ Physiol 1990; 258(3, Pt 2): H647-H654-
11. Pries AR, Secomb TW,,Jacobs H. et al. Microvascular bloodflow resistance: role of endothelial surface layer. Am J Physiol 1997;273 (5,Pt2):h3272-h3279-
12.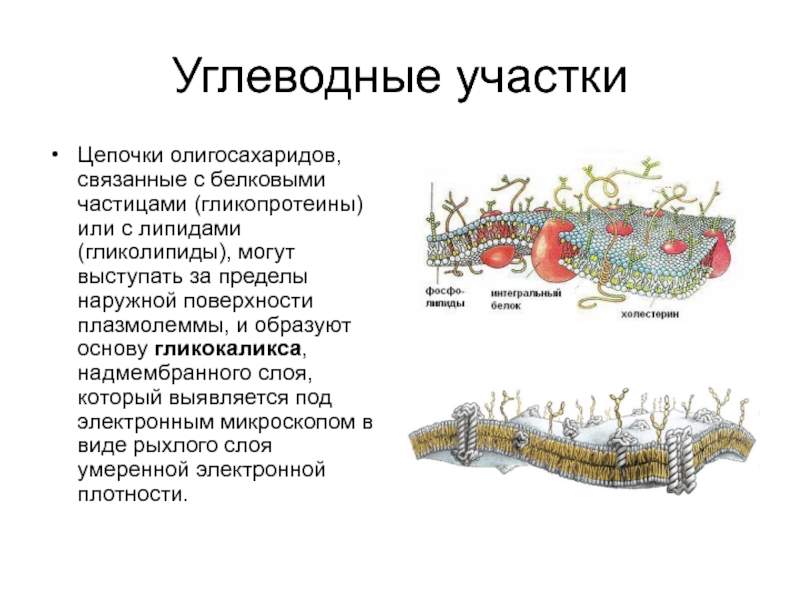 Baldwin AL, Winlove CP. Effects of perfusate composition on binding of ruthenium red and gold colloid to glycocalyx of rabbit aortic endothelium.JHistochem Cytochem 1984; 32:259-266.
Baldwin AL, Winlove CP. Effects of perfusate composition on binding of ruthenium red and gold colloid to glycocalyx of rabbit aortic endothelium.JHistochem Cytochem 1984; 32:259-266.
13. Clough G., Moffitt H. Immunoperoxidase labeling of albumin at the endothelial cell surface of frog mesenteric microvessels. IntJ Microcirc Clin Exp 1992; 11: 345-358.
14. Adamson RH, Clough G. Plasma proteins modify the endothelial cell glycocalyx of frog mesenteric microvessels.J Physiol 1992;
445:473-486.
15. Ueda A., Shimomura M., Ikeda M. et al. Effect of glycocalyx on shear-dependent albumin uptake in endothelial cells. Am J Physiol Heart Circ Physiol 2004; 287(5): h3287-h3294-
16. Damiano ER., Duling BR, Ley K., Skalak T.C. Axisymmetric pressure-drivenflow of rigid pellets through a cylindrical tube lined with deformable porous wall layer.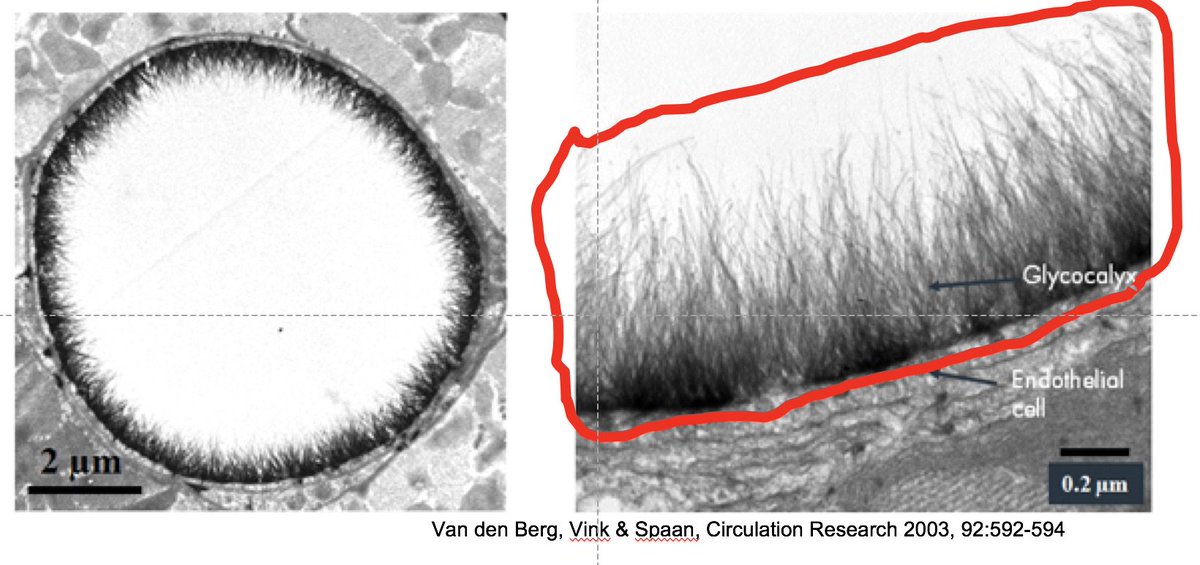 J Fluid Mech 1996; 314:163-189.
J Fluid Mech 1996; 314:163-189.
17. Damiano ER. The effect of the endothelial-cell glycocalyx on the motion of red blood cells through capillaries. Microvasc Res 1998; 55: 77-91.
18. Secomb T.W., Hsu R, Pries AR. A model for red blood cell motion in glycocalyx-lined capillaries. AmJ Physiol 1998; 274(3, Pt 2): h2016-h2022.
19. Secomb T.W., Hsu R, Pries AR. Motion of red blood cells in a capillary with an endothelial surface layer: effect of flow velocity.
Am J Physiol Heart Circ Physiol 2001; 281: H629-H636.
20. van den Berg BM,, Vink H, SpaanJA. The endothelial glycocalyx protects against myocardial edema. Circ Res 2003; 92:592594.
21. Sims DE, Horne MM. Non-aqueousfixative preserves macromolecules on the endothelial cell surface: an in situ study. EurJ Morphol 1993;31:251-255-
EurJ Morphol 1993;31:251-255-
22. Hjalmarsson C., Johansson BR., Haraldsson B. Electron microscopic evaluation of the endothelial surface layer of glomerular capillaries. Microvasc Res 2004; 67:9-17.
23. RostgaardJ, Qvortrup K. Electron microscopic demonstrations of filamentous molecular sieve plugs in capillaryfenestrae.
Microvasc Res 1997; 53:1-13.
24. RostgaardJ, Qvortrup K. Sieve plugs infenestrae of glomerular capillaries—site of thefiltration barrier? Cells Tissues Organs 2002; 170:132-138.
25. Clough G., Michel C.C. Quantitative comparisons of hydraulic permeability and endothelial intercellular cleft dimensions in singlefrog capillaries.J Physiol 1988; 405:563-576.
26.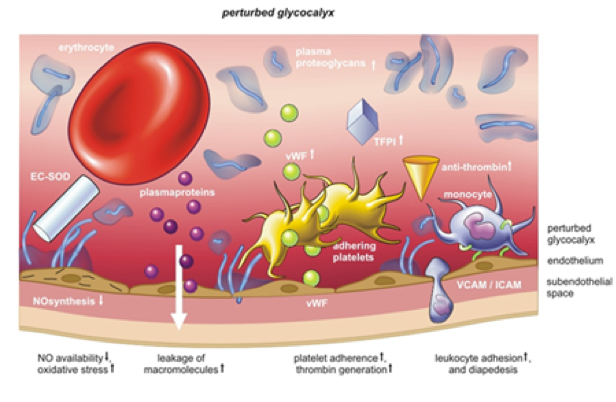 SquireJM,, Chew M., Nneji G. et al. Quasi-periodic substructure in the microvessel endothelial glycocalyx: a possible explanationfor molecular filtering? J Struct Biol 2001; 136:239-255.
SquireJM,, Chew M., Nneji G. et al. Quasi-periodic substructure in the microvessel endothelial glycocalyx: a possible explanationfor molecular filtering? J Struct Biol 2001; 136:239-255.
27. Weinbaum S., Zhang X., Han Y. et al. Mechanotransduction andflow across the endothelial glycocalyx. Proc Natl Acad Sci USA 2003; 100: 7988-799528. Zhang X., Curry FR, Weinbaum S. Mechanism of osmoticflow in a periodicfiber array. AmJ Physiol Heart Circ Physiol2006;
290: H844-H852.
29. Vink H., Duling BR Identification of distinct luminal domainsfor macromolecules, erythrocytes, and leukocytes within mammalian capillaries. Circ Res 1996; 79:581-589.
30. Constantinescu AA, Vink H., SpaanJA Endothelial cell glycocalyx modulates immobilization of leukocytes at the endothelial surface.Arterioscler Thromb VascBiol2003; 23:1541-1547.
31. Vink H., Constantinescu AA, SpaanJA Oxidized lipoproteins degrade the endothelial surface layer: implicationsfor platelet-endothelial cell adhesion. Circulation 2000; 101:1500-1502.
32. Smith ML., Long D.S., Damiano ER., Ley K. Near-wall micro-PIVreveals a hydrodynamically relevant endothelial surface layer in venules in vivo.BiophysJ2003; 85(1): 637-64533. Damiano ER., Long D.S., Smith ML. Estimation of viscosity profiles using velocimetry datafrom parallelflows of linearly viscous
fluids.J Fluid Mech 2004; 512:1-19.
34. Florian JA,, KoskyJR, Ainslie K. et al. Heparan sulfate proteoglycan is a mechanosensor on endothelial cells. Circ Res 2003; 93: e136-e142.
35. Mulivor AW., Lipowsky HH. Inflammation- and ischemia-induced shedding of venular glycocalyx. Am J Physiol Heart Circ Physiol 2004; 286: h2672-h2680.
Am J Physiol Heart Circ Physiol 2004; 286: h2672-h2680.
36. Barker AL., Konopatskaya O., Neal CR et al. Observation and characterisation of the glycocalyx of viable human endothelial cells using confocal laser scanning microscopy. Phys Chem Chem Phys 2004; 6:1006-1011.
37. Megens R.T., Reitsma S., Schiffers PH. et al. Two-photon microscopy of vital murine elastic and muscular arteries. Combined structural andfunctional imaging with subcellular resolution.J Vasc Res 2007; 44: 87-98.
38. Nieuwdorp M., Meuwese M.C., Mooij HL et al. Measuring endothelial glycocalyx dimensions in humans: a potential novel tool to monitor vascular vulnerability. J Appl Physiol 2008; 104: 845-852.
39. den Uil CA., Klijn E., Lagrand WK. et al. The microcirculation in health and critical disease. Prog Cardiovasc Dis 2008; 51:
37
161-170. e M, Park P.W. et al. Functions of cell surface heparan sulfate proteoglycans. Annu Rev Biochem 1999; 68: 729-777.
e M, Park P.W. et al. Functions of cell surface heparan sulfate proteoglycans. Annu Rev Biochem 1999; 68: 729-777.
43. Osterloh K., Ewert U., Pries AR. Interaction of albumin with the endothelial cell surface. Am J Physiol Heart Circ Physiol 2002; 283: h498-h505.
44- Hileman RE., FrommJR., Weiler JM, Linhardt RJ. Glycosaminoglycan-protein interactions: definition of consensus sites in glycosaminoglycan binding proteins. Bioessays 1998; 20:156-167.
45. McGee MP, Liang J. Regulation of glycosaminoglycan function by osmotic potentials. Measurement of water transfer during antithrombin activation by heparin. J Biol Chem 2001; 276:49275-49282.
46. Coombe DR., Kett W.C. Heparan sulfate-protein interactions: therapeutic potential through structure-function insights. Cell Mol Life Sci2005; 62:410-42447. Lipowsky HH. Microvascular rheology and hemodynamics. Microcirculation 2005; 12:5-1548. Arisaka T., Mitsumata M, KawasumiM. et al. Effects of shear stress on glycosaminoglycan synthesis in vascular endothelial
Lipowsky HH. Microvascular rheology and hemodynamics. Microcirculation 2005; 12:5-1548. Arisaka T., Mitsumata M, KawasumiM. et al. Effects of shear stress on glycosaminoglycan synthesis in vascular endothelial
cells. Ann NY Acad Sci 1995; 748:543-55449- ObunikeJ.C., Pillarisetti S., Paka L. et al. The heparin-binding proteins apolipoprotein E and lipoprotein lipase enhance cellular proteoglycan production. Arterioscler Thromb Vasc Biol 2000; 20:111-118.
50. Reitsma S., SlaafD.W, Vink H. et al. The endothelial glycocalyx: composition, functions, and visualization. Pflugers Arch 2007;
454:345-35951. Taylor KR, Gallo RL. Glycosaminoglycans and their proteoglycans: host-associated molecular patternsfor initiation and modulation of inflammation. FASEBJ2006; 20:9-22.
52. Gandhi N. S., Mancera RL. The structure of glycosaminoglycans and their interactions with proteins. Chem Biol Drug Des 2008; 72:455-482.
S., Mancera RL. The structure of glycosaminoglycans and their interactions with proteins. Chem Biol Drug Des 2008; 72:455-482.
53- Jackson RL,, Busch SJ., Cardin AD. Glycosaminoglycans: molecular properties, protein interactions, and role in physiological processes. Physiol Rev 1991; 71:481-53954- OohiraA,, Wight TN., Bornstein P. Sulfatedproteoglycans synthesized by vascular endothelial cells in culture.JBiol Chem 1983; 258:2014-2021.
55- Sasisekharan R., Venkataraman G. Heparin and heparan sulfate: biosynthesis, structure andfunction. Curr Opin Chem Biol 2000; 4: 626-631.
56. Sugahara K., Kitagawa H. Heparin and heparan sulfate biosynthesis. IUBMB Life 2002; 54:163-17557. SilbertJE., Sugumaran G. Biosynthesis of chondroitin/dermatan sulfate. IUBMB Life 2002; 54:177-186.
58. Kusche-Gullberg M., Kjellün L. Sulfotransferases in glycosaminoglycan biosynthesis. Curr Opin Struct Biol2003; 13: 605-611.
Kusche-Gullberg M., Kjellün L. Sulfotransferases in glycosaminoglycan biosynthesis. Curr Opin Struct Biol2003; 13: 605-611.
59- Almond A., SheehanJK. Glycosaminoglycan conformation: do aqueous molecular dynamics simulations agree with x-ray fiber diffraction? Glycobiology 2000; 10:329-338.
60. Seog J, Dean D, Rolauffs B. et al. Nanomechanics of opposing glycosaminoglycan macromolecules. J Biomech 2005; 38:17891797.
61. Laurent T.C, Laurent UB,, Fraser JR The structure andfunction of hyaluronan: An overview. Immunol Cell Biol 1996; 74: A1-A7.
62. Toole BP. Hyaluronan in morphogenesis. J Intern Med 1997; 242:35-40.
63- Iozzo R.V., San Antonio JD. Heparan sulfate proteoglycans: heavy hitters in the angiogenesis arena.J Clin Invest2001; 108: 349-355.
64. Liu D, Shriver Z., Qi Y., Venkataraman G., Sasisekharan R. Dynamic regulation of tumor growth and metastasis by heparan sulfate glycosaminoglycans. Semin Thromb Hemost2002; 28: 67-78.
65- TimarJ., Lapis K., DudisJ. et al. Proteoglycans and tumor progression: Janus-faced molecules with contradictoryfunctions in cancer. Semin Cancer 2002; 12:173-186.
66. Sanderson RD. Heparan sulfate proteoglycans in invasion and metastasis. Semin Cell Dev Biol 2001; 12:89-98.
67- Liu J., Pedersen L.C. Anticoagulant heparan sulfate: structural specificity and biosynthesis. Appl. Microbiol. Biotechnol. 2007;
74:263-272.
68. Filmus J. Glypicans in growth control and cancer. Glycobiology 2001; 11(3): 19R-23R
69. Casu B., Vlodavsky I., Sanderson RD. Non-anticoagulant heparins and inhibition of cancer. Pathophysiol. Haemost. Thromb. 2008; 36:195-20370. Snow AD,, Willmer J, Kisilevsky R. Sulfated glycosaminoglycans: a common constituent of all amyloids? Lab Invest 1987; 56:
Casu B., Vlodavsky I., Sanderson RD. Non-anticoagulant heparins and inhibition of cancer. Pathophysiol. Haemost. Thromb. 2008; 36:195-20370. Snow AD,, Willmer J, Kisilevsky R. Sulfated glycosaminoglycans: a common constituent of all amyloids? Lab Invest 1987; 56:
120-12371. Kisilevsky R., AncsinJB,, Szarek WA, Petanceska S. Heparan sulfate as a therapeutic target in amyloidogenesis: prospects and possible complications.Amyloid2007; 14:21-32.
72. Ley K., Laudanna C., Cybulsky MI, Nourshargh S. Getting to the site of inflammation: the leukocyte adhesion cascade updated.
Nat Rev Immunol2007; 7:678-68973- Rostand K.S., Esko JD. Microbial adherence to and invasion through proteoglycans. Infect Immun 1997; 65:1-8.
74. Esko JF, Kimata K., Lindahl U. in: Essentials of Glycobiology, Second Edition, edit.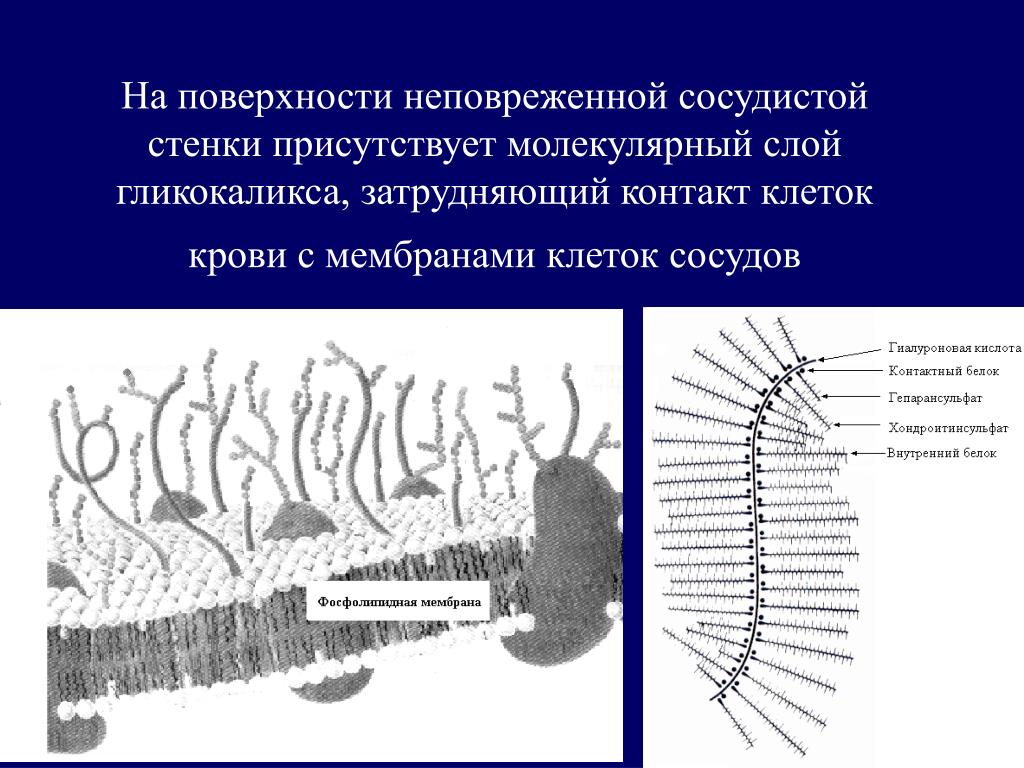 Varki A, Cummings RD., Esko JD, Freeze HH.,
Varki A, Cummings RD., Esko JD, Freeze HH.,
Hart G.W, Etzler ME, Cold spring harbor laboratory press. 2009; 784:229-230.
75. Broekhuizen LN., Mooij HL, KasteleinJJ. et al. Endothelial glycocalyx as potential diagnostic and therapeutic target in cardiovascular disease. Curr OpinLipidol2009; 20:57-62.
76. Ihrcke N.S., Wrenshall LE., Lindman BJ, Platt JL. Role of heparan sulfate in immune system-blood vessel interactions. Immunol Today 1993; 14:500-505.
77. Mulivor AW., Lipowsky HH. Inflammation- and ischemiainduced shedding of venular glycocalyx. Am JPhysiol Heart Circ Physiol 2004; 286: h2672-h2680.
78. Rapraeger A, Jalkanen M., Endo E. et al. The cell surface proteoglycanfrom mouse mammary epithelial cells bears chondroitin sulfate and heparan sulfate glycosaminoglycans. JBiol Chem 1985; 260:11046-11052.
JBiol Chem 1985; 260:11046-11052.
79. Tkachenko E, RhodesJM, SimonsM. Syndecans: new kids on the signaling block. Circ Res 2005;96:488-500.
80. Rosenberg RD., Shworak N.W., Liu J. et al. Heparan sulfate proteoglycans of the cardiovascular system. Specific structures emerge but how is synthesis regulated?J Clin Invest 1997; 99:2062-2070.
81. Halden Y., Rek A., Atzenhofer W. et al. Interleukin-8 binds to syndecan-2 on human endothelial cells. Biochem J2004; 377:
533-538.
82. Kokenyesi R., Bernfield M. Core protein structure and sequence determine the site and presence of heparan sulfate and chondroitin sulfate on syndecan-1.JBiol Chem 1994; 269:12304-12309.
83. Gallo RL. Proteoglycans and cutaneous vascular defense and repair.JInvestig Dermatol Symp Proc 2000;5:55-60.
Proteoglycans and cutaneous vascular defense and repair.JInvestig Dermatol Symp Proc 2000;5:55-60.
84. Fransson LA, Belting M., Cheng F. et al. Novel aspects of glypican glycobiology. Cell Mol Life Sci2004; 61:1016-102485. Belting M. Heparan sulfate proteoglycan as a plasma membrane carrier. Trends Biochem Sci 2003; 28:145-151.
86. van Deurs B., Roepstorff K, Hommelgaard AM, Sandvig K. Caveolae: anchored, multifunctional platforms in the lipid ocean.
Trends Cell Biol 2003; 13:92-100.
87. SegevA., NiliN, StraussBH. The role of perlecan in arterial injury and angiogenesis. Cardiovasc Res 2004; 63: 603-610.
88. Wight TN. Arterial remodeling in vascular disease: a key role for hyaluronan and versican. Front Biosci 2008; 13:4933-4937.
89. Jackson D.G. Immunological functions of hyaluronan and its receptors in the lymphatics. Immunol Rev 2009; 230:216-231.
90. Evanko SP., TammiMl, TammiRH., Wight TN. Hyaluronan-dependent pericellular matrix.AdvDrugDelivRev 2007; 59:
1351-1365.
91. Itano N., Kimata K.Mammalian hyaluronan synthases. IUBMB Life 2002;54:195-199.
92. Weigel PH, DeAngelis PL. Hyaluronan synthases: a decade-plus of novel glycosyltransferases.J Biol Chem 2007; 282:3677736781.
93. Jiang D, Liang J., Noble P.W. Hyaluronan in tissue injury and repair. Annu Rev Cell Dev Biol 2007; 23:435-461.
94. Levi M, van der Poll T., Buller HR. Biderectional relation between imflammation and coagulation. Circulation 2004; 109:
2698-270495. LeviM, Keller T.T., van Gorp E, ten Cate H. Infection and inflammation and the coagulation system. Cardiovasc Res 2003; 60:
26-39.
96. Rbegg C., Mariotti A Vascular integrins: pleiotropic adhesion and signaling molecules in vascular homeostasis and angiogenesis. Cell Mol Life Sci 2003; 60:1135-1157.
97. Barthel SR., GavinoJD, Descheny L, Dimitroff CJ. Targeting selectins and selectin ligands in inflammation and cancer. Expert Opin Ther Targets2007; 11:1473-1491.
98. Galkina E, Ley K. Vascular adhesion molecules in atherosclerosis. Arterioscler Thromb Vasc Biol2007; 27:2292-2301.
99. Gibson RM., Kansas GS, Tedder TE. et al. Lectin and epidermal growthfactor domains of P-selectin at physiologic density are the recognition unit for leukocyte binding. Blood 1995; 85:151-158.
100.Kansas GS., Saunders KB, Ley K. et al. A rolefor the epidermal growthfactor-like domain of P-selectin in ligand recognition and cell adhesion. J Cell Biol 1994; 124:609-618.
101Zarbock A., Ley K. Neutrophil adhesion and activation underflow. Microcirculation 2009; 16:31-42.
102Dole VS., Bergmeier W., Mitchell HA. et al. Activated platelets induce Weibel-Palade-body secretion and leukocyte rolling in vivo: role of P-selectin. Blood2005; 106:2334-2339.
103. Sperandio M, Ley K. The physiology and pathophysiology of P-selectin. Mod Asp Immunobiol2005; 15:24-26.
104Jung U., Ley K. Regulation of E-selectin, P-selectin, and intercellular adhesion molecule 1 expression in mouse cremaster muscle vasculature.Microcirculation 1997; 4:311-319.
105XiongJP, Stehle T., Goodman SL., ArnaoutMA Integrins, cations and ligands: making the connection.J Thromb Haemost 2003; 1:1642-1654-
106.Bombeli T., Schwartz BR, HarlanJM. Adhesion of activated platelets to endothelial cells: evidencefor a GPIIbIIIa-dependent bridging mechanism and novel roles for endothelial intercellular adhesion molecule 1 (ICAM-1), alphavbeta3 integrin, and GPIbalpha.J Exp Med 1998; 187:329-339.
107Mbller AM, Hermanns MI, Cronen C, Kirkpatrick CJ. Comparative study of adhesion molecule expression in cultured human macro- and microvascular endothelial cells. Exp Mol Pathol 2002; 73:171-180.
108.Woodfin A, Voisin MB, Nourshargh S. PECAM-1: a multi-functional molecule in inflammation and vascular biology. Arterioscler Thromb Vasc Biol 2007; 27:2514-2523.
109.Tanaka KA, Key N.S., LevyJH. Blood coagulation: hemostasis and thrombin regulation. AnesthAnalg 2009; 108:1433-1446.
110.Berndt M.C., Shen Y., Dopheide SM. et al. The vascular biology of the glycoprotein Ib-IX-V complex. Thromb Haemost2001; 86:
39
178-188.
111-RuggeriZM. Von Willebrand factor, platelets and endothelial cell interactions.J Thromb Haemost 2003; 1:1335-1342.
112Wu G, Essex D.W., Meloni FJ. et al. Human endothelial cells in culture and in vivo express on their surface allfour components
of the glycoprotein Ib/IX/V complex. Blood 1997; 90:2660-2669.
113- -SquireJM., Chew M
tionfor molecular filtering? J Struct Biol2001; 136:239-255-
114- Weinbaum S., Zhan
2003; 100: 7988-7995.
115. Huxley V.H., Curry
Pt2): h2645-h2654-
116. Henry C.B., Dulin
Pt2): H508-H514.
117. Van Teeffelen J.W., Bra
2007; 17:101-105.
118. Fries E., Kaczmarczyk A. In
119. Platts S.H., Duling
82.
120. Vink H., Duling BR. Ca
Heart Circ Physiol2000; 278: h385-h389.
Гликокаликс — рождение новой клинической парадигмы
В основе многих патологических состояний лежат расстройства эндотелия. Общепринято, что микроальбуминурия при гломерулонефрите, преэклампсии и сепсисе связана с дисфункцией эндотелия. Полиангиопатии, характерные для сахарного диабета, также являются следствием поражения эндотелия. Однако механизмы этих расстройств до последнего времени оставались не до конца понятными. Причиной эндотелиальной дисфункции долгое время считалась сама эндотелиальная клетка, при том что еще в 50-х годах ХХ века на поверхности эндотелиальных клеток обнаружено некое однородное нечеткое покрытие [1], которому в то время не придали особого значения. Как выяснилось впоследствии, именно оно оказалось защитной стеной между кровотоком в сосуде и поверхностью самого эндотелиоцита [2]. Это образование, состоящее из гликопротеинов, протеогликанов и глигозаминогликанов [3, 4] и являющееся интегральной частью эндотелия, получило в дальнейшем название «гликокаликс». Последующие исследования выявили фундаментальную роль, которую играет гликокаликс в процессах регуляции кровотока, воспаления и коагуляции.
В этом обзоре мы постараемся рассмотреть строение и физиологию гликокаликса, а также патофизиологию и клиническое значение повреждения и полного уничтожения гликокаликса.
Краткая предыстория вопроса или «откуда он взялся?»Наличие слоя протеинов на эндотелии впервые постулировано J. Danielli в 1940 г. [5]. В середине 50-х годов XX века G. Palade одним из первых указал на наличие однородного нечеткого покрытия на поверхности эндотелиальных клеток [1].
До того, как термин «гликокаликс» стал общепризнанным, эту структуру именовали как «клеточная стенка», «поверхностный клеточный слой», «мукозное антигенное покрытие», «кутикулярный эритроцитарный антиген» и др. [1, 6, 7]. В 1963 г. H. Bennett [8] предложил термин «гликокаликс» как общее название для этого «внеклеточного сахаридного покрытия», где бы оно ни находилось. Гликокаликс по-гречески означает «сладкая оболочка».
Визуализация гликокаликса сдерживалась отсутствием необходимых методик окрашивания и фиксации, которые не разрушали бы эту хрупкую структуру [3]. В 1966 г. J. Luft [7] был первым, кто предложил использовать рутений красный для визуализации гликокаликса при электронной микроскопии и выявил «тонкую структуру капилляров и эндокапиллярного слоя». Исследования физиологической роли гликокаликса начались в 70-х годах XX века с изучения изменений капиллярного гематокрита, вызванных как физиологическими раздражителями, так и разрушением гликокаликса [9, 10].
В 2003 г. B. van den Berg [4] с помощью электронной микроскопии визуализировал ворсинчатую структуру гликокаликса левого желудочка сердца крысы (рис. 1). Рис. 1. Гликокаликс левого желудочка сердца крысы; ворсинчатая структура гликокаликса (справа) [2]. В последние десятилетия накапливаются данные, свидетельствующие о ключевой роли, которую играет гликокаликс в защите сосудистого русла, модуляции воспаления и гемостазе [3—5].
Строение и свойстваГликокаликс — это сложная гелеподобная структура, расположенная между протекающей кровью и эндотелиально-клеточной стенкой сосуда. Современные методики позволяют визуализировать гликокаликс, он обнаружен на протяжении всего сосудистого русла от крупных сосудов до мельчайших капилляров [3—6]. Его общая площадь у человека составляет в среднем 350 м2 [6].
Гликокаликс вырабатывается эндотелием и располагается в критической зоне раздела тока крови и эндотелиальных клеток [11]. Гликопротеиновый гликокаликс окутывает весь здоровый сосудистый эндотелий. Это составная часть сосудистого барьера [11, 12]. Он взаимодействует с белками и липидами плазмы [13]. Состав и размеры гликокаликса непрерывно меняются, так как протекающая плазма постоянно слущивает его молекулы [14]. Толщина гликокаликса различна на всем протяжении сосудистого русла и составляет по одним данным от 0,1 до 1 мкм [15], по мнению других исследователей, достигает 3 мкм [5]. Толщина гликокаликса в микрососудах может быть определена в подъязычных тканях методом ортогональной поляризационной спектральной визуализации и хорошо коррелирует с результатами дилюционных методик [16] (рис. 2). Рис. 2. Структура гликокаликса. ICAM — интерцеллюлярные молекулы адгезии. РЕСАМ-1 — тромбоцито-эндотелиальные молекулы адгезии 1-го типа; CD44 — эндотелиальные поверхностные рецепторы.
Гликопротеины и протеогликаны формируют основу гликокаликса [6, 11]. Гликопротеины, как правило, это то, что мы себе представляем как рецепторы на поверхности клетки: селектины, интегрины и другие функционально-динамические белки клеточной поверхности [17].
Протеогликаны играют роль стромы гликокаликса и состоят из стволовых белков, плотно прикрепленных к клеточной мембране, к которым в свою очередь прикрепляются отрицательно заряженные боковые цепочки гликозаминогликанов (ГАГ). Протеогликаны различаются по размеру своих протеиновых основ, количеству прикрепленных ГАГ и способам крепления к мембране клетки. Некоторые протеины гликокаликсной основы прочно прикреплены к мембране клетки посредством мембранно-связующего домена (синдеканы), другие — с помощью гликозилфосфатидилинозитолового якоря (глипиканы). Остальные белки основы — перлеканы, версиканы, декорины, бигликаны и мимеканы секретируются после прикрепления боковых цепей ГАГ [5].
Гликопротеины и протеогликаны синтезируются и формируются в несколько этапов по мере того, как они внутриклеточно выделяются из эндоплазматического ретикулума к аппарату Гольджи и, наконец, соединяются с мембраной клетки [17].
ГАГ можно рассматривать как растворимые соединения, в виду того что они синтезируются внеклеточно и позже связываются с протеогликанами и гликопротеинами.
Известны 5 типов гликозаминогликановых цепей: гепарансульфат (ГС), составляющий 50—90%, а также гиалуроновая кислота (ГК) (гиалурононан), хондроитин-, дерматан- и кератинсульфат. Некоторое время назад считали, что ГК — единственная из ГАГ, не связанная с белковой основой и образующая вязкие растворы с водой [4]. Однако затем установлено, что ГК связывается с эндотелиальным поверхностным рецептором CD44 [18, 19]. Именно взаимодействие ГК/CD44 обусловливает фильтрующие свойства молекулярного сита гликокаликса [19].
Гликокаликс формирует на поверхности эндотелиальной клетки сетчатую структуру, позволяющую связывать белки плазмы и растворимые ГАГ [3, 5, 13]. Гликокаликс сам по себе не активен, но как только компоненты плазмы связываются с ним, он формирует физиологически активный эндотелиальный поверхностный слой (ЭПС) [20].
Гликопротеины играют роль молекул адгезии и, участвуя в коагуляции, являются частью систем гемостаза и фибринолиза. Молекулы клеточной адгезии делятся на селектины (Е и Р), интегрины и иммуноглобулины. Гистамин и тромбин стимулируют экспрессию Р-селектина, тогда как интерлейкин (IL-1), фактор некроза опухоли α (TNF-α) и липополисахариды стимулируют экспрессию Е-селектина. Интегрины связаны с коллагеном, фибронектином и ламинином в субэндотелиальный матрикс и регулируют взаимодействие тромбоцитов с эндотелиальной клеткой.
Иммуноглобулины включают интерцеллюлярные молекулы адгезии 1-го и 2-го типов (ICAM-1, ICAM-2), молекулы адгезии сосудистого эндотелия 1-го типа (VCAM-1) и тромбоцитоэндотелиальные молекулы адгезии 1-го типа (PECAM-1). Они являются лигандами для интегринов на лейкоцитах и тромбоцитах, участвуя в адгезии к эндотелию и в диапедезе [5].
Гликокаликс имеет отрицательный заряд, что определяет его взаимодействие с компонентами плазмы. Отрицательный заряд зависит от сульфатации боковой цепи ГАГ, тип которой изменяется во времени, а также под влиянием физиологических и патофизиологических стимулов. Изменения в типе сульфатации влияют на связывание белков и сосудистую проницаемость [5].
Заряженная сетка гликокаликса действует как макромолекулярное сито [3], отталкивая отрицательно заряженные молекулы, а также эритроциты и тромбоциты [4]. Макромолекулы массой более 70 кДа отторгаются гликокаликсом. Несмотря на то что альбумин имеет сетевой отрицательный заряд и массу 67 кДа, он крепко связывается с гликокаликсом благодаря своей амфотерной природе, к тому же, он несет слабый положительный заряд вдоль белковой цепи [6]. Связка гликокаликс—альбумин снижает гидравлическую проводимость через сосудистый барьер [11]. Некоторое количество альбумина проникает через гликокаликс с коэффициентом отражения 0,75—0,95 для различных типов капилляров [21]. В норме альбумин проникает через гликокаликс в интерстиций со скоростью 5% от его общего плазменного объема в час [21].
Гликокаликс отталкивает эритроциты. Это выглядит как зона отчуждения, идущая параллельно эндотелиальному слою и выстраивающая эритроциты в центрированную колонну. Эта зона отчуждения суживается при повреждениях гликокаликса [5].
Гликокаликс демпфирует взаимодействие тромбоцитов и лейкоцитов. Во-первых, его отрицательный заряд отталкивает клетки, а во-вторых, молекулы адгезии, такие как PECAM, VACM и ICAM, скрывающиеся внутри его структуры [5, 15], становятся менее доступными. Интегрины и селектины способствуют адгезии моноцитов и многоядерных нейтрофилов. Кроме того, ICAM-1, ICAM-2, VCAM и PECAM участвуют во взаимодействии клеток крови со стенкой сосуда и адгезии во время диапедеза [22].
Как уже сказано, вся структура гликокаликса в целом вместе с находящимися в нем молекулами и экстравазированной плазмой называется эндотелиальным поверхностным слоем (ЭПС). Он защищает эндотелиальные клетки от избыточного слущивания, вызванного током крови [6]. Вместе с тем повышение слущивания эндотелия вызывает увеличение синтеза оксида азота, который в свою очередь расширяя сосуды, уменьшает стресс [23]. Эндотелиальные клетки пупочной вены человека под воздействием слущивания удваивают продукцию ГК в гликокаликсе. Это также является механизмом, способным компенсировать слущивание [13]. Повреждения гликокаликса нарушают оба эти механизма и снижают устойчивость эндотелия к слущиванию [24].
Связывание лигандов и ферментов с эндотелиальным гликокаликсом способствует клеточной сигнализации и ферментативной модификации [5], например, функционирование фактора роста фибробласта зависит от взаимодействия лиганда и рецептора внутри гликокаликса [25]. Гликокаликс вовлечен также и в липолитическую систему, так как связывает липазу липопротеина с ее лигандом [4].
Некоторые антикоагулянтные медиаторы могут связываться с гликокаликсом. Антитромбин III является ингибитором тромбина и активированных факторов IX и Х. Его антикоагулянтная активность увеличивается при присоединении к ГС, который является одним из ГАГ, обнаруживаемых в гликокаликсе. Гепариновый кофактор II активируется дерматансульфатом, также находящимся в гликокаликсе. Тромбомодулин продуцируется эндотелиальными клетками и содержит еще один ГАГ, хондроитинсульфат, который взаимодействует с тромбином при активации антикоагулянтного каскада протеина С. Ингибитор каскада тканевого фактора связывается с ГС и ингибирует VIIa и Ха [22].
Еще одним механизмом, с помощью которого гликокаликс защищает эндотелий, является его способность связывать ферменты, блокирующие свободные радикалы кислорода, такие как внеклеточная супероксиддисмутаза. Эти ферменты помогают снизить окислительный стресс и поддерживать биодоступность NO, предотвращая таким образом эндотелиальные дисфункции [4].
Скорее всего, до полноты представления о строении и функциях гликокаликса еще достаточно далеко, и исследователи находятся лишь в начале пути.
Деструктивные факторы и слущивающий (shear) стрессЭПС на удивление хрупок. Например, ишемия с реперфузией разрушают ЭПС воздействием свободных кислородных радикалов. Так, 20-минутная ишемия при температуре 37 °C с последующей реперфузией способна вызвать почти полное разрушение гликокаликса [26].
Сосудистый эндотелий — одна из самых первых структур, вовлекаемых в синдром системного воспалительного ответа [15]. Сосудистый эндотелий повреждается при воздействии TNF-α и бактериального липополисахарида. Тучные клетки, активированные TNF-α, высвобождают цитокины, протеазы, гистамин и гепариназу, что усугубляет деструкцию гликокаликса.
Потеря ГАГ ведет к утончению и уплотнению гликокаликса. При этом теряются в основном ГС, хондроитинсульфат и ГК [27, 30]. Уплотнение гликокаликса при потере ГАГ сохраняет его способность препятствовать капиллярной утечке, несмотря на уменьшение толщины и возможное увеличение проницаемости [27]. Уплотнение гликокаликса, появление циркулирующих в плазме ГС [28, 29], ГК [30] или хондроитина [31] служат маркерами повреждения гликокаликса. Это называют «линькой», «слущиванием» или «слущивающим стрессом» (shear-stress) [11, 32] (рис. 3). Рис. 3. Слущивающий стресс (shear-stress). ICAM — интерцеллюлярные молекулы адгезии; РЕСАМ-1 — тромбоцито-эндотелиальные молекулы адгезии 1-го типа; CD44 — эндотелиальные поверхностные рецепторы. Деструкция гликокаликса освобождает молекулы адгезии, служа триггером дальнейшего воспаления, вызывая соприкосновение эритроцитов и тромбоцитов со стенкой сосуда с последующей адгезией [15].
Концентрация синдекана — протеогликана, важнейшего компонента гликокаликса, возрастает в плазме при усиленном слущивании последнего [28, 33, 34].
К настоящему времени известны медиаторы воспаления, разрушающие гликокаликс, включают С-реактивный белок [35], стимуляторы рецептора аденозина А3 [36, 37], TNF-α [38], брадикинин [39] и триптазу тучных клеток [40].
Из результатов последних клинических исследований становится очевидным, что гликокаликс повреждается при системных воспалительных состояниях и других расстройствах, таких как сепсис [33, 41], гипергликемия [42], хирургическая агрессия [28], травма [34] и сахарный диабет [30].
Последствия деструкции гликокаликса от слущивающего стресса нарушают морфологию эндотелиоцитов и влияют на их функциональные возможности [32]. Разрушение гликокаликса может приводить к капиллярной утечке, отеку, резкому воспалению, агрегации тромбоцитов, гиперкоагуляции и потере сосудистой управляемости [15] (рис. 4). Рис. 4. Последствия деструкции гликокаликса.
Повышенная концентрация ГАГ в плазме обнаружена у больных септическим шоком и, как выяснилось, приводила к снижению антибактериальных свойств плазмы [43]. Высокие плазменные концентрации компонентов гликокаликса, отмеченные у септических больных, свидетельствуют о его деструкции и коррелируют с высокой летальностью [43]. Ряд других молекул, выделенных из эндотелия и плазмы и участвующих в процессах коагуляции и воспаления, содержатся в гликокаликсе.
Гипергликемия является одним факторов, разрушающих гликокаликс. У больных сахарным диабетом I типа толщина гликокаликса в 2 раза меньше, чем у здоровых, а у больных диабетом с микроальбуминурией гликокаликс еще тоньше [30]. В том же исследовании у больных диабетом в плазме отмечены высокие концентрации ГК и гиалуронидазы вследствие повышенного слущивания в поврежденном гликокаликсе. При гипергликемии повреждение может быть вызвано кислородными радикалами либо активацией ферментов, деградирующих гликокаликс. Очевидно, что необходимы дальнейшие исследования по изучению вклада расстройств ЭПС в патогенез микроангиопатий при диабете [30, 42, 44].
Гликокаликс утончается при употреблении пищи с высоким содержанием жиров и холестерина, способствуя атерогенезу [45]. Инфузии клинически значимых доз окисленного липопротеина низкой плотности вызывают деструкцию гликокаликса у хомяков и приводят к локальной адгезии тромбоцитов [46].
Быстрая внутривенная инфузия кристаллоидов в опытах на добровольцах приводила к значительному повышению уровня ГК в плазме и поэтому была опасной [47]. У пациентов после острой гиперволемической гемодилюции в качестве процедуры предоперационного кровосбережения 60% инфузированного объема уходило в интерстициальное пространство в течение нескольких минут [48]. Массивная кровопотеря и сопровождающая ее ишемия с реперфузией также являются факторами деструкции [49].
Применение аппарата искусственного кровообращения (АИК) во время оперативных вмешательств также разрушает гликокаликс [47]. Гиповолемия повреждает гликокаликс и является триггером выброса предсердного натриуретического пептида, который оголяет ЭПС [50, 51]. В исследовании, проведенном еще в 1983 г., показано, что лидофлазин, блокатор кальциевых канальцев, ныне ассоциируемый с купированием желудочковых аритмий и пролонгацией интервала QT, защищал гликокаликс пациентов во время операций с АИК [52].
Нормальное функционирование почек возможно только при неповрежденном гликокаликсе. Только 0,06% альбумина может в норме проникать через почечный фильтр, при том что поры в гломерулярном слое значительно больше молекулы альбумина. Возможно, это происходит за счет отрицательного заряда гликокаликсного выстилающего слоя [53]. Микроальбуминурия является свидетельством системной эндотелиальной дисфункции и сердечно-сосудистых осложнений не только у больных диабетом, но также пациентов с обычной гипертензией и женщин с преэклампсией [54, 55].
Исследования с липидными каплями позволили определить, что толщина зоны отчуждения эритроцитов над гломерулярной эндотелиальной поверхностью составляет 175 нм. Причем под влиянием гиалуронидазы, гепариназы и хондроитиназы она еще более уменьшается. Деструкция гликокаликса увеличивает проницаемость гломерулярного капилляра для обычного альбумина, но не для фиколла (электрически нейтральный альбумин), свидетельствуя, что нарушения гликокаликса ведут к потере электрической избирательности [54]. После выполнения хирургических вмешательств на коронарных и периферических артериях отмечено возрастание плазменных концентраций компонентов эндотелиального слоя [15]. Электронная микроскопия позволяет выявлять обнаженные эндотелиальные клетки со слущенными и смытыми ГАГ, увеличением транссудата и проницаемости для коллоидов [56].
Маркеры деструкции гликокаликсаИз сказанного выше очевидно, что большинство, если не все, патологические состояния в организме связаны с той или иной степенью деструкции гликокаликса; поэтому возрастает актуальность вопроса прижизненной диагностики степени деструкции и дисфункции гликокаликса.
МикроальбуминурияПоявление и нарастание микроальбуминурии в сочетании с увеличением сосудистой проницаемости, выражающейся в появлении отеков, является следствием деструкции гломерулярного эндотелиума, часто наблюдаемой в клинике при остром септическом поражении почек [57]. У ряда пациентов соотношение микроальбуминурия/креатинин мочи (МАКС) коррелирует с оценкой тяжести в баллах по шкалам Surgical Stress Score [58], SOFA [59], APACHE II [60], Injury Severity Score [61] и SAPS II, а также с длительностью искусственной вентиляции легких и индексом оксигенации (PaO2/FiO2) [62]. У пациентов с сепсисом высокие уровни МАКС появляются раньше, чем увеличение уровней С-реактивного белка и прокальцитонина [63]. Уровень микроальбуминурии сам по себе может служить маркером тяжести септического процесса [64].
Уровень синдекана-1, циркулирующего в кровотоке, зависит от степени эндотелиального повреждения и деструкции гликокаликса, а также коррелирует с уровнями воспалительных цитокинов [65]. У пациентов с травмой он ассоциируются с различными коагулопатиями и высокой летальностью [34]. Так как уровень синдекана-1 у больных с сепсисом выше, чем у остальных хирургических пациентов, он может служить биомаркером более тяжелой деструкции гликокаликса, учитывая, что синдекан-1 является белком его основы [33].
Эндокан является еще одним белком основы гликокаликса и может выделяться из него при воздействии IL-1 и TNF-α. Он может служить биомаркером у больных сепсисом. Величина свободного эндокана в плазме коррелирует со степенью тяжести септического процесса [66]. Высокие уровни эндокана в плазме у пациентов с тяжелой травмой ассоциируются с острым легочным поражением [67]. Таким образом, эндокан рассматривается как перспективный маркер эндотелиальной дисфункции при сепсисе [32].
ГликозаминогликаныГАГ, в частности ГС и ГК, являются одними из основных структурных элементов гликокаликса. Как уже указано, доля ГС среди всех ГАГ гликокаликса составляет 50—90% [4]. Деструкция гликокаликса вызывает появление в плазме высоких уровней ГАГ [28—30, 47]. Специфические структурные характеристики циркулирующих ГАГ могут дополнительно указывать на функциональное значение фрагментов гликокаликса. Так, дополнительно сульфатированные цепочки ГС могут проявлять биологическую активность, либо связываясь с антитромбином III и вызывая гепариноподобный эффект либо повышая взаимодействие факторов роста с рецепторами [68]. Эти биологически высоко активные субстанции могут значительно влиять на течение патологического процесса у пациентов в критических состояниях. Кроме того, ГС и фрагменты ГК могут сами по себе оказывать повреждающее действие на ткани, вызывая воспаление и микротравмы [69].
Показано, что количество циркулирующих ГС и ГК, а также модели сульфатации цепочек ГС различаются в зависимости от степени легочного поражения при остром респираторном дистресс-синдроме. Уровни свободных ГС коррелировали с продолжительностью пребывания в палате интенсивной терапии и летальностью [70]. Эти данные позволили сделать вывод, что уровень циркулирующих ГАГ может служить как диагностическим, так и прогностическим маркером тяжести состояния у пациентов с острой дыхательной недостаточностью [70]. Высокие уровни свободно циркулирующих ГАГ отмечены у больных с септическим шоком, и эти уровни коррелируют с уровнем летальности [43, 70].
Ангиопоэтины (Ang) являются новым, недавно признанным классом сосудистых факторов роста, играющих существенную роль в воспалительном процессе [71]. Ang-1 повышает структурную стабильность кровеносных сосудов, тогда как Ang-2 вызывает дестабилизацию и увеличивает сосудистую проницаемость [71]. Ang-1 и Ang-2 являются взаимно антагонистичными факторами, участвующими в важнейших процессах клеточной регуляции. У больных в критических состояниях высвобождение Ang-2 напрямую отражает расстройство сосудистого барьера [72]. В исследованиях показано, что Ang-2 резко повышен у больных септическим шоком, и его уровень коррелирует с летальностью [73]. К сожалению, рутинное измерение свободно циркулирующего Ang-2 в клинике пока невозможно.
Несомненно, список приведенных выше маркеров деструкции гликокаликса является далеко не полным, так как постоянно появляются результаты исследований, показывающих возможности использования все новых и новых субстанций в качестве маркеров эндотелиального поражения.
Последние два десятилетия отмечены бурным ростом числа исследований и публикаций, посвященных проблемам гликокаликса и эндотелиальной дисфункции. Это позволило по-иному оценить физиологию и патофизиологию эндотелия, увидеть глубину этой проблемы и те потенциальные выгоды, которые можно получить, изменив подходы к различным клиническим ситуациям, взглянув на них через призму гликокаликса.
Слой гликокаликса является хрупкой структурой и разрушается при быстрой внутривенной инфузии жидкостей, острой гипергликемии, хирургических вмешательствах и сепсисе. Исследования гликокаликса показали его вовлеченность практически во все патологические процессы. Наиболее значительные нарушения строения и функции гликокаликсного барьера отмечены при воспалении, ишемии, гипергликемии и даже гипо- и гиперволемии. При всех воспалительных состояниях целостность эндотелиального гликокаликса в различной степени нарушается. Особенно тяжелые повреждения отмечены при сепсисе. Вызванная воспалением деструкция гликокаликса может быть ответственной за ряд специфических клинических проявлений сепсиса, включая острое поражение почек, дыхательную и печеночную недостаточность.
В ХХ веке стал общепризнанным факт, что виновником многих клинических состояний является эндотелиит. Нынешнему веку удалось обнаружить структуру, регулирующую большинство функций эндотелия. Следующая задача — научиться предотвращать деструкцию и восстанавливать разрушенный гликокаликс.
Наука XXI века стоит на пороге рождения новой клинической парадигмы.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов: автор заявляет об отсутствии конфликта интересов.
Сведения об авторах
Для корреспонденции: Сокологорский Сергей Васильевич, доктор мед. наук, проф. каф. анестезиологии и реаниматологии лечебного факультета ГБОУ ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский университет), 119991, Москва. E-mail: [email protected].
Гликокаликс — Glycocalyx — qaz.wiki
Вязкий, богатый углеводами слой на самой внешней периферии клетки.
Гликокаликса , также известная как околоклеточная матрица, является гликопротеином и гликолипид покрытия , которое окружает клеточные мембраны некоторых бактерий , эпителии и другие клетки. В 1970 году Мартинес и Паломо открыли клеточную оболочку в клетках животных, известную как гликокаликс.
Большинство эпителиальных клеток животных имеют пушистое покрытие на внешней поверхности плазматических мембран . Это покрытие состоит из нескольких углеводных фрагментов мембранных гликолипидов и гликопротеинов , которые служат в качестве опорных молекул основы. Как правило, углеводная часть гликолипидов, обнаруживаемая на поверхности плазматических мембран, помогает этим молекулам вносить свой вклад в распознавание клеток , коммуникацию и межклеточную адгезию.
Гликокаликс — это тип идентификатора, который организм использует, чтобы различать свои собственные здоровые клетки и пересаженные ткани, больные клетки или вторгшиеся организмы. В гликокаликс входят молекулы клеточной адгезии, которые позволяют клеткам прилипать друг к другу и направляют движение клеток во время эмбрионального развития. Гликокаликс играет важную роль в регуляции эндотелиальной сосудистой ткани , включая модуляцию объема красных кровяных телец в капиллярах .
Слизь на внешней стороне рыбы — это пример гликокаликса. Этот термин первоначально применялся к полисахаридной матрице, покрывающей эпителиальные клетки, но было обнаружено, что ее функции выходят далеко за рамки этого.
В эндотелиальной ткани сосудов
Гликокаликс расположен на апикальной поверхности эндотелиальных клеток сосудов, выстилающих просвет . Когда сосуды окрашиваются катионными красителями, такими как краситель альцианового синего , просвечивающая электронная микроскопия показывает небольшой слой неправильной формы, простирающийся примерно на 50–100 нм в просвет кровеносного сосуда. В другом исследовании использовалась крио- трансмиссионная электронная микроскопия и было показано, что толщина эндотелиального гликокаликса может достигать 11 мкм. Он присутствует в разнообразных микрососудистых руслах (капиллярах) и макрососудах (артериях и венах). Гликокаликс также состоит из широкого спектра ферментов и белков, которые регулируют прилипание лейкоцитов и тромбоцитов , поскольку его основная роль в сосудистой сети заключается в поддержании гомеостаза плазмы и стенок сосудов. Эти ферменты и белки включают:
Перечисленные выше ферменты и белки служат для усиления гликокаликсного барьера против сосудистых и других заболеваний. Другая основная функция гликокаликса в эндотелии сосудов состоит в том, что он защищает стенки сосудов от прямого воздействия кровотока, одновременно служа барьером для проницаемости сосудов. Его защитные функции универсальны для всей сосудистой системы, но его относительная важность варьируется в зависимости от его точного расположения в сосудистой сети. В микрососудистой ткани гликокаликс служит барьером для проницаемости сосудов, ингибируя коагуляцию и адгезию лейкоцитов. Лейкоциты не должны прилипать к стенке сосудов, потому что они являются важными компонентами иммунной системы, которые должны иметь возможность перемещаться в определенные области тела при необходимости. В ткани артериальных сосудов гликокаликс также ингибирует коагуляцию и адгезию лейкоцитов, но через посредство высвобождения оксида азота, вызванного напряжением сдвига. Другой защитной функцией сердечно-сосудистой системы является ее способность влиять на фильтрацию межклеточной жидкости из капилляров в межклеточное пространство.
Гликокаликс, расположенный на апикальной поверхности эндотелиальных клеток, состоит из отрицательно заряженной сети протеогликанов , гликопротеинов и гликолипидов.
Разрушение и болезнь
Поскольку гликокаликс настолько заметен во всей сердечно-сосудистой системе, нарушение этой структуры имеет пагубные последствия, которые могут вызвать заболевание. Определенные стимулы, вызывающие атерому, могут привести к повышенной чувствительности сосудистой сети. Первоначальная дисфункция гликокаликса может быть вызвана гипергликемией или окисленными липопротеинами низкой плотности ( ЛПНП ), которые затем вызывают атеротромбоз . В микроциркуляторном русле дисфункция гликокаликса приводит к дисбалансу внутренней жидкости и, возможно, отеку . В ткани артериальных сосудов нарушение гликокаликса вызывает воспаление и атеротромбоз.
Были проведены эксперименты, чтобы точно проверить, как гликокаликс может быть изменен или поврежден. В одном конкретном исследовании использовалась модель изолированного перфузированного сердца, предназначенная для облегчения определения состояния участка сосудистого барьера, и была предпринята попытка вызвать вызванное инсультом выделение гликокаликса, чтобы установить причинно-следственную связь между выделением гликокаликса и проницаемостью сосудов. Гипоксическая перфузия гликокаликса считалась достаточной для запуска механизма деградации эндотелиального барьера. Исследование показало, что поток кислорода по кровеносным сосудам не обязательно должен полностью отсутствовать ( ишемическая гипоксия), но минимального уровня кислорода достаточно, чтобы вызвать разрушение. Выделение гликокаликса может быть вызвано воспалительными стимулами, такими как фактор некроза опухоли альфа . Однако каким бы ни был стимул, выделение гликокаликса приводит к резкому увеличению проницаемости сосудов. Проницаемость стенок сосудов является недостатком, поскольку это может позволить прохождение некоторых макромолекул или других вредных антигенов.
Напряжение сдвига жидкости также представляет собой потенциальную проблему, если гликокаликс по какой-либо причине разрушается. Этот тип напряжения трения вызван движением вязкой жидкости (например, крови) вдоль границы просвета. Другой подобный эксперимент был проведен, чтобы определить, какие виды стимулов вызывают напряжение сдвига жидкости. Первоначальное измерение было выполнено с помощью прижизненной микроскопии, которая показала медленно движущийся слой плазмы, гликокаликс, толщиной 1 мкм. Светлый краситель минимально повредил гликокаликс, но это небольшое изменение увеличило капиллярный гематокрит . Таким образом, флуоресцентную световую микроскопию не следует использовать для изучения гликокаликса, потому что в этом конкретном методе используется краситель. Толщина гликокаликса также может уменьшаться при обработке окисленным ЛПНП. Эти стимулы, наряду со многими другими факторами, могут вызвать повреждение нежного гликокаликса. Эти исследования свидетельствуют о том, что гликокаликс играет решающую роль в здоровье сердечно-сосудистой системы.
В бактериях и природе
Гликокаликс существует у бактерий либо в виде капсулы, либо в виде слоя слизи. Пункт 6 указывает на гликокаликс. Разница между капсулой и слоем слизи заключается в том, что в ней полисахариды прочно прикреплены к клеточной стенке, тогда как в слое слизи гликопротеины слабо прикреплены к клеточной стенке.Гликокаликс, буквально означающий «сахарный покров» ( glykys = сладкий, kalyx = шелуха), представляет собой сеть полисахаридов, которые исходят из клеточных поверхностей бактерий , что классифицирует его как универсальный поверхностный компонент бактериальной клетки, находящийся за пределами бактериальной клетки. клеточная стенка. Отдельный студенистый гликокаликс называется капсулой , а неравномерный диффузный слой — слоем слизи . Эта шерсть очень гидратирована и окрашивается в красный цвет рутением .
Бактерии, растущие в естественных экосистемах, таких как почва, кишечник крупного рогатого скота или мочевыводящие пути человека, окружены своего рода микроколониями, заключенными в гликокаликс . Он служит для защиты бактерии от вредных фагоцитов , создавая капсулы или позволяя бактерии прикрепляться к инертным поверхностям, таким как зубы или камни, через биопленки (например, Streptococcus pneumoniae прикрепляется к клеткам легких, прокариотам или другим бактериям, которые могут слиться. их гликокалисы, чтобы покрыть колонию).
В пищеварительном тракте
Гликокаликса также могут быть найдены на апикальной части микроворсинок в пределах желудочно — кишечного тракта , особенно в тонком кишечнике. Он создает сетку толщиной 0,3 мкм и состоит из кислых мукополисахаридов и гликопротеинов, которые выступают из апикальной плазматической мембраны эпителиальных абсорбирующих клеток. Он обеспечивает дополнительную поверхность для адсорбции и включает ферменты, секретируемые абсорбирующими клетками, которые необходимы для заключительных этапов переваривания белков и сахаров.
Другие обобщенные функции
- Защита: амортизирует плазматическую мембрану и защищает ее от химических повреждений
- Иммунитет к инфекции: позволяет иммунной системе распознавать и выборочно атаковать чужеродные организмы.
- Защита от рака: изменения гликокаликса раковых клеток позволяют иммунной системе распознавать и уничтожать их.
- Совместимость трансплантата: формирует основу для совместимости переливаний крови , трансплантатов тканей и трансплантатов органов.
- Адгезия клеток: связывает клетки вместе, чтобы ткани не распадались.
- Регулирование воспаления: покрытие гликокаликсом на эндотелиальных стенках кровеносных сосудов предотвращает скатывание / связывание лейкоцитов в здоровом состоянии.
- Оплодотворение: позволяет сперматозоидам распознавать яйцеклетки и связываться с ними.
- Эмбриональное развитие: направляет эмбриональные клетки к месту их назначения в организме.
Рекомендации
внешние ссылки
Образование гликокаликса, создание термоизоляционных покровов организма
Образование гликокаликса
Определение 1
Гликокаликс — это внедренные в плазмалемму молекулы олигосахаридов, гликолипидов и гликопротеинов, выполняющее рецепторную и маркерную функции.
Кроме того, гликокаликс участвует в реализации избирательного транспорта веществ через мембрану и направляет процесс пристеночного пищеварения. Гликокаликс характерен для животных клеток.
К основным характеристикам гликокаликса также можно отнести:
- развитие гликокаликса на апикальной мембране каемчатых эритроцитов и создание своеобразного молекулярного сита, которое может пропускать или не пропускать молекулы в зависимости от их заряда и величины, а также других параметров;
- внутри гликокаликса также располагаются пищеварительные ферменты, которые поступают в него из кишечной полости и синтезируются энтерпоцитами;
- толщина гликокаликса колеблется от 15 -ти до 40 нм на боковых поверхностях клеток и 50- 100 нм на апикальной;
- гликокаликс, микроворсинки и мембрана апекса входят в состав исчерченной каемки.
Образование гликокаликса происходит в процессе жизнедеятельности самих клеток. В нем также реализуется внеклеточное пищеварение и происходит клеточная адгезия.
Гликокаликс является прогрессивной эволюционной клеточной структурой, которая отражает возможность специфических клеточных приспособлений к определенному температурному, химическому, и др. изменениям окружающей среды.
Создание теплоизоляционных покровов организма
Также гликокаликс участвует в формировании термоизоляционных покровов организма. Согласно их наличию, все высшие позвоночные животные делается на пойкилотермных и гомойотермных. К последней группе относят два класса высших позвоночных животных – птиц и млекопитающих. Их принципиальное отличие в строении покровов заключается в функционировании активных регуляторных механизмов формирования и поддержания гомеостаза. Такой температурный режим обуславливает тот факт, что биохимические и физиологические процессы протекают в стабильных температурных условиях.
Термоизоляционные покровы гомойотермных животных формируются на основе собственной теплопродукции или эндотермии.
Определение 2
Эндотермия — это важное свойство живых организмов, которое существенно снижает их зависимость от температуры окружающей среды.
У всех гомойотермных животных присутствуют следующие элементы теплоизоляционных покровов:
- покровы;
- часть мускулатуры и пр.
Такая теплоизоляционная оболочка меняет собственную температуру в достаточно широких пределах. Таким образом, устойчивая температура характеризует лишь область локализации важных внутренних органов и процессов.
Теплоизоляционные покровы формируются в зависимости от следующих механизмов терморегуляции: процесса рефлекторного усиления и уменьшения теплопродукции при снижении или повышении температуры окружающей среды.
Теплоизоляционные покровы вырабатывают тепло в ходе окислительно-восстановительных реакций. При этом часть тепла рассеивается во внешней среде. Поэтому поддержание устойчивой температуры тела при снижении температуры окружающей среды провоцирует интенсификацию метаболизма за счет увеличения плотности теплоизоляционных покровов.
Специфическое терморегуляторное теплообразование сосредотачивается в скелетной мускулатуре, как части терморегуляционных покровов. Тонус терморегуляции выражается в микросокращениях фибрилл, что устанавливается в виде повышения электрической активности при охлаждении мышц. Видимые сокращения выражаются в форме холодовой дрожи.
Интенсивность газообмена через покровы при этом возрастает до 300- 400 процентов.
Для покровов млекопитающих характерен недрожжевой термогенез, а именно связанный с окислением бурой жировой ткани вид работы теплоизоляционных покровов. Бурый жир содержит большое количество митохондрий и пронизан многочисленными кровеносными сосудами. Под действием холода возрастает количество тепла, которое вырабатывается в буром жире.
Физическая теплоизоляция заключается в том, чтобы теплоизоляционные покровы удерживают вокруг тела слой воздуха, играющего роль механизма, удерживающего тепло. В рамках механизма теплоизоляции выделяют следующие процессы:
- пиломоторная реакция или рефлекторное управление параметрами покровов;
- изменение объема и плотности покровов, как способ обеспечения быстрого и эффективного ответа организма на нарушение теплового баланса организма.
Для покровов гомойотермных животных также характерно наличие охлаждающих механизмов. Например, это регулируемое испарение воды (пота с теплоизоляционных покровов). Кроме того, к таким механизмам относят: различные сосудистые реакции. Достаточно часто в теплоизоляционных покровах имеется специфическое приспособление «чудесная сеть». Оно представляет собой сплетение сосудов, в котором вены и артерии прижаты друг к другу. Текущая по артериям кровь отдает тепло венам, оно возвращается к телу, а артериальная поступает в конечности охлажденной.
Строение термоизоляционных покровов дополняется специфическими поведенческими адаптациями, которые направлены на экономичное расходование энергии и поддержание терморегуляции. Также человек и животные стараются использовать и поддерживать микроклимат.
Также у гомойотермных животных присутствует такое явление как обратимая гипотермия. Она представляет собой способность живых организмов впадать в оцепенение и снижать интенсивность метаболизма и температуры тела. У таких видов развиты эндогенные биологические часы, а также термофотопериодические реакции.
Подводя итог всему вышесказанному, можно сделать вывод о том, что теплоизоляционные покровы организма становятся дополнительным механизмом, направленным на поддержание температуры тела у разнообразных представителей окружающего органического мира. Специфика теплоизоляционных покровов проявляется на уровне клеточного строения и формируется в целостном многоклеточном организме.
ГЛИКОКАЛИКС — это… Что такое ГЛИКОКАЛИКС?
гликокаликс — гликокаликс … Орфографический словарь-справочник
Гликокаликс — Гликокаликс «заякоренные» в плазмалемме молекулы олигосахаридов, полисахаридов, гликопротеинов и гликолипидов. Гликокаликс выполняет рецепторную и маркерную функции, а также участвует в обеспечении избирательности транспорта веществ и… … Википедия
гликокаликс — Гликопротеин и полисахарид, покрывающие поверхность клетки [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN glycocalyx … Справочник технического переводчика
Гликокаликс — – скопление мукоподобных нитей, полисаха ридный слой, предмембранное образование выполняет функцию межмолекулярного сита, избирательно накапливает некоторые мо лекулы, является барьером для бактерий, здесь происходит 2 ой этап гидролиза… … Словарь терминов по физиологии сельскохозяйственных животных
Энтероцит каёмчатый — (лат. enterocytus limbatus) клетка эпителия кишечника, энтероцит. Другие названия: абсорбтивный каёмчатый энтероцит[1], столбчатый эпителиоцит[2], эпителиоцит кишечный с исчерченной каёмкой, эпителиоцит кишечный с исчерченной каймой, клетка… … Википедия
Клетка — У этого термина существуют и другие значения, см. Клетка (значения). Клетки крови человека (РЭМ) … Википедия
Живая клетка — Клетка элементарная единица строения и жизнедеятельности всех живых организмов (кроме вирусов, о которых нередко говорят как о неклеточных формах жизни), обладающая собственным обменом веществ, способная к самостоятельному существованию,… … Википедия
Клетка (биология) — Клетка элементарная единица строения и жизнедеятельности всех живых организмов (кроме вирусов, о которых нередко говорят как о неклеточных формах жизни), обладающая собственным обменом веществ, способная к самостоятельному существованию,… … Википедия
Комплексный справочник по Биологии — Термин Биология был предложен выдающимся французким естествоиспытателем и эволюционистом Жаном Батистом Ламарком в 1802 году для обозначения науки о жизни как особым явлении природы. Сегодня биология представляет собой комплекс наук, изучающих… … Википедия
Кишечник — у большинства животных пищеварительная трубка, начинающаяся ротовым отверстием и кончающаяся заднепроходным (анальным) отверстием; у организмов с пищеварительным трактом, дифференцированным на отделы, часть его, следующая за желудком (См … Большая советская энциклопедия
Клетки фагоцитоза
В зависимости от особенностей строения клетки (в частности, от наличия ядра) все организмы делят на два надцарства — Прокариоты и Эукариоты. К прокариотам относят бактерий и цианобактерий, к эукариотам — представителей царств Растения, Грибы и Животные.
У одноклеточных животных единственная клетка — это целостный организм, который самостоятельно питается, выводит наружу продукты жизнедеятельности, осуществляет газообмен и т.д. У многоклеточных клетки различных типов выполняют разные функции. Однако, несмотря на все разнообразие клеток животных, всем им присущи общие особенности строения.
Сравним растительную и животную клетки (рис.). И растения, и животные — эукариоты, то есть их клетки состоят из клеточной мембраны, цитоплазмы и ядра (или нескольких ядер). Клетки растений кроме клеточной мембраны имеют еще плотную клеточную стенку. Она состоит преимущественно из клетчатки и обеспечивает постоянство формы клетки.
| Растительная и животная клетки |
У клеток животных снаружи от мембраны находится тоненькая упругая оболочка — гликокаликс. Она неспособна поддерживать постоянную форму клетки. Благодаря этому определенные группы клеток животных могут образовывать непостоянные выросты — ложноножки, или псевдоподии. Например, одноклеточное животное амеба благодаря псевдоподиям передвигается и захватывает частицы пищи.
Процесс захвата твердых частиц называют фагоцитозом.
Фагоцитоз характерен только для клеток животных. Клетки растений, грибов и прокариотов имеют клеточную стенку и поэтому могут поглощать только растворы разнообразных веществ.
Животные, растения и грибы — это представители различных царств эукариотов, имеющие такие общие характерные черты:
- они состоят из клеток, имеющих ядра;
- им присущи общие процессы жизнедеятельности (питание, выделение, размножение, рост, раздражимость и т.д.).
границ | Возникающая роль гликокаликса млекопитающих в организации функциональных мембран и постановлении №
об иммунной системеВведение
Каждая клетка человеческого тела — эндотелиальные клетки, иммунные клетки, мышечные клетки, клетки крови, нейроны и все остальные — демонстрируют гликокаликс. «Гликокаликс» дословно переводится как «сладкая шелуха». «Сладкий» указывает на его ключевые строительные элементы — различные сахара (или моносахариды), такие как глюкоза, манноза, галактоза и многие другие. «Шелуха» указывает на расположение этих сахаров — они располагаются внеклеточно на клеточной мембране, окружая клетку подобно плащу.Сахара в гликокаликсе связаны друг с другом множеством способов, образуя сахарные конъюгаты или «гликаны». Их размеры варьируются от нескольких до десятков тысяч моносахаридных единиц. Гликаны либо свободны, либо связаны с белками, которые создают гликопротеины и протеогликаны, или липидами, которые создают гликолипиды. Термин «гликокаликс», таким образом, является общим термином для всех свободных гликанов, гликопротеинов, протеогликанов и гликолипидов, присутствующих на поверхности клетки (рис. 1).
Рисунок 1. Схематическое изображение гликокаликса. Гликокаликс — центральный компонент любой клетки, состоящий из сахаров, белков и липидов, к которым они присоединены. Для простоты различные сахара, содержащиеся в гликокаликсе, обозначены одним и тем же символом (синие шестиугольники). Обратите внимание, что изображение выполнено примерно в масштабе, то есть мембранные белки погребены под сахарами.
Гликокаликс был связан с множеством фундаментальных клеточных и организменных событий, таких как имплантация бластоцисты, эмбриональное развитие, адгезия лейкоцитов или вирусные и бактериальные инфекции (Matrosovich et al., 2004; Липовский, 2012; Weber et al., 2014; Константину и др., 2015; Стэнли и Каммингс, 2015; Formosa-Dague et al., 2018). Учитывая вездесущность гликокаликса в организме человека и важность процессов, с которыми он был связан, можно предположить, что его функциональная роль была изучена и подробно изучена. Однако это не так. Напротив, гликокаликс оказался на удивление неуловимым. На протяжении многих десятилетий считалось, что гликокаликс просто образует защитный слой на поверхности клетки, не обладающий регулирующим потенциалом.Оглядываясь назад, это может показаться немного удивительным: гликокаликс находится непосредственно на периферии клетки и образует интерфейс клетки с внеклеточным пространством. Таким образом, кажется разумным предположить, что он участвует во многих процессах, связанных с клеточной мембраной.
Однако есть простая причина удивительной неуловимости гликокаликса: гликокаликс ставит перед любым исследователем невероятную сложность на всех уровнях, от синтеза до структурной организации (см. Разделы «От моносахаридов до гликополимеров» и «Биосинтез веществ»). Компоненты гликокаликса »).Из-за этого традиционные методы изучения биологических систем имеют очень ограниченное применение при применении к гликокаликсу (см. Раздел «Проблемы, специфичные для исследования гликокаликса, и подходы к их решению»). Поэтому долгое время картина гликокаликса была очень неполной, так как не было инструментов для ее детального исследования. В частности, заметный размер гликокаликса — обычно от нескольких десятков до нескольких сотен нанометров и, таким образом, обычно скрывает даже большие мембранные белки — долгое время недооценивался.
Эта ситуация резко изменилась за последние годы. Новые инструменты для точного изображения, моделирования, характеристики и управления гликокаликсом сделали его центром внимания биохимических и медицинских исследований. Гликокаликс — это не пассивная оболочка, а активный участник клеточной биологии, в основном участвующий в ряде жизненно важных клеточных процессов.
В этом обзоре я сначала дам краткое общее введение в фундаментальные концепции биологии гликокаликса. Затем я рассмотрю некоторые роли, которые традиционно отводились гликокаликсу, прежде чем представить прорывные открытия, которые в последние годы произвели революцию в этом традиционном представлении.
Основы биологии гликокаликса
От моносахаридов к гликополимерам
Ключевым компонентом гликокаликса являются сахара или моносахариды. Их также называют углеводами, поскольку они изначально были идентифицированы как гидраты углерода, C x (H 2 O) y . Однако это название плохо отражает истинный химический состав сахаров. Скорее, сахара можно рассматривать как полигидроксилированные карбонильные соединения. Например, глюкоза представляет собой альдогексозу, т.е.е., шестичленная цепь атомов углерода, где первый углерод имеет карбонильную группу, а остальные пять групп несут гидроксильную группу. Фруктоза представляет собой кетогексозу: здесь второй атом углерода в цепи несет карбонильную группу. Таким образом, расположение карбонильной группы и ориентация гидроксильной группы у хиральных атомов углерода определяет структуру моносахарида. Например, глюкоза, галактоза и манноза являются альдогексозами, которые различаются только ориентацией одной гидроксильной группы (рис. 2А, верхний ряд), что подчеркивает важность стереохимии в гликобиологии.
Рисунок 2. Важные сахара, обнаруженные в организме человека, и примеры конъюгатов сахаров, обнаруженных в гликокаликсе. (A) Обычные сахара, встречающиеся в организме человека, и их графическое изображение в соответствии с номенклатурой символов для гликанов (SNFG). Обратите внимание, что этот список не является исчерпывающим. Glc, глюкоза; Гал, галактоза; Человек, манноза; NeuAc, N -ацетилнейраминовая кислота; GlcNAc, N -ацетилглюкозамин; GalNAc, N -ацетилгалактозамин; GlaA, глюкуроновая кислота; Ксил, ксилоза; Фук, фукоза. (B) Пять примеров конъюгатов сахаров, обнаруженных в гликокаликсе: GM4, гликолипид; расширенное ядро 4 O -гликозилированная структура; основная структура комплекса N -гликозилирование; боковая цепь, обнаруженная в сульфате хондроитина; гиалуронан или гиалуроновая кислота. Для простоты химия гликозидной связи между каждым моносахаридом не указана.
В растворе моносахариды существуют как смесь открытой цепочечной формы и циклической формы.Последний образуется в результате реакции замыкания внутримолекулярного кольца, когда гидроксильная группа взаимодействует с атомом углерода, несущим карбонильную группу, обычно образуя пяти- или шестичленные кольца с четырьмя или пятью атомами углерода и одним атомом кислорода. Соотношение открытой и закрытой формы зависит от структуры сахара, но закрытая форма обычно энергетически более стабильна и поэтому преобладает. Углерод, полученный из карбонильной группы, называется «аномерный углерод». В зависимости от ориентации гидроксильной группы у аномерного углерода моносахарид существует либо в α-, либо в β-аномере.Через размыкание и повторное включение кольца два аномера могут взаимозаменяться. Подробный обзор интригующей химии сахаров см. В литературе (Lindhorst, 2007).
На рис. 2А показаны наиболее распространенные сахара, встречающиеся в организме человека, и их графические изображения в соответствии с номенклатурой символов для гликанов (SNFG) (Varki et al., 2015; Neelamegies et al., 2019). Как упоминалось выше, стереохимия играет центральную роль в гликобиологии. Вторым аспектом, определяющим идентичность моносахаридов, являются химические модификации, такие как окисление гидроксильных групп, N -ацетилирование, сульфатирование и многие другие.В результате сложность уже на уровне отдельных моносахаридов примечательна.
Однако сложность моносахаридов является лишь небольшим намеком на сложность олиго- и полисахаридов, то есть гликоконъюгатов от нескольких до многих моносахаридных единиц. Например, давайте рассмотрим образование дисахарида, состоящего из двух единиц глюкозы. Глиозидная связь образована аномерным углеродом первого звена глюкозы и любой гидроксильной группой другого звена глюкозы.Поскольку каждая из двух единиц может существовать в α- или β-аномере, уже существует 19 дисахаридов, состоящих из двух единиц глюкозы. Переходя к немного более крупным гексасахаридам, которые могут включать в себя все сахара, обнаруженные в организме человека, количество возможных изомеров составляет не менее 1,05 × 10 12 (Laine, 1994) по сравнению с 4096 гексануклеотидами и приблизительно 86 миллионами гексапептидов. Конечно, не все из этих возможных гексасахаридных структур реализованы, но количество различных структур гликоконъюгатов в организме, от небольших конъюгатов всего в несколько сотен Да до полимеров в несколько МДа, по-прежнему огромно (Рисунок 2B) (Marino et al. al., 2010; Gagneux et al., 2015; Стэнли и Каммингс, 2015).
Обычный способ организовать компоненты гликокаликса в основные классы — это рассмотреть, присоединены ли они к другой биомолекуле или свободны. Если гликан присоединен к липидному якору, полученный конъюгат называется гликолипидом. Если один или несколько гликанов присоединены к белку, обычно проводится дополнительная дифференциация: если гликановая часть представляет собой олигосахариды приблизительно от 3 до 20 моносахаридов, полученный конъюгат называется гликопротеином.В случае, если прикрепленные гликаны представляют собой длинные полимерные цепи, приводящие к значительному содержанию сахара, полученный конъюгат называется протеогликаном. Наконец, свободные гликаны обычно представляют собой полимеры, поэтому их называют гликополимерами.
Примечательно, что два основных класса гликопротеинов делятся в соответствии с присоединением гликана к белку: если гликан присоединен через атом азота боковой цепи аспарагина, говорят о N -гликозилировании и N — гликаны.Если гликан присоединен через атом кислорода в боковой цепи серина или треонина, говорят о O -гликозилировании и O -гликанах.
Биосинтез компонентов гликокаликса
Биосинтез компонентов гликокаликса происходит во многих местах клетки и представляет собой сложный, взаимосвязанный процесс. Учитывая многочисленные подробные обзоры, посвященные этой теме (Spiro, 2002; Breton et al., 2006; Moremen et al., 2012; Krasnova, Wong, 2016), я остановлюсь на ней лишь кратко.
Для гликопротеинов и гликолипидов биосинтез осуществляется в эндоплазматическом ретикулуме (ER) и аппарате Гольджи (секреторный путь). Вновь синтезированная белковая цепь обычно котрансляционно вставляется в ER. Внутри ЭР пептидная цепь свернута. Процедура гликозилирования свернутой белковой цепи зависит от типа гликозилирования: N -гликаны предварительно собираются и переносятся целиком на пептидную цепь внутри ER. В процессе созревания в аппарате Гольджи они могут подвергаться дальнейшим изменениям.Для гликозилирования O только один сахар присоединяется к ER, и дополнительные сахара добавляются поэтапно в аппарате Гольджи. Гликаны на гликолипидах также поэтапно собираются в аппарате Гольджи. После завершения синтеза конечные продукты упаковываются в секреторные гранулы, транспортируются к клеточной мембране и секретируются.
Некоторые компоненты гликокаликса не синтезируются посредством пути аппарата ER-Golgi. Например, сборка гиалуроновой кислоты происходит непосредственно на мембране с помощью интегральных мембранных белков, гиалуронансинтаз.Активированные сахара добавляются к цепи гликополимера, пока она секретируется во внеклеточное пространство (Toole, 2004; Weigel and Deangelis, 2007).
Многие ферменты, которые принимают участие в синтезе гликанов в ER и аппарате Гольджи, располагаются внутри секреторного пути в соответствии с реакцией, которую они катализируют. Однако стоит отметить, что многие из этих ферментов имеют широкий спектр субстратов и реакций и что они постоянно перемещаются туда и обратно по секреторному пути (Bieberich, 2014).Более того, доступность донорных молекул для гликозилирования, обычно активированных моносахаридов, сильно зависит от клеточного метаболизма (Lau et al., 2007). Поскольку метаболическое состояние клетки изменяется при раке, эта связь между клеточным метаболизмом и состоянием гликокаликса напрямую указывает на ремоделирование гликокаликса при онкогенных событиях (Павлова и Томпсон, 2016; Деберардинис и Шандел, 2020). Действительно, были обнаружены многие взаимосвязи между метаболизмом опухоли, гликокаликсом и состоянием клеток, например, ключевая роль муцина Muc1 в выживаемости при гипоксии (обсуждение муцинов см. В разделе «Гликокаликс контролирует морфологию клеток») (Инь и другие., 2007; Чайка и др., 2012). Эти открытия могут быть первыми шагами к единой концепции, связывающей метаболизм опухоли и состояние гликокаликса.
В совокупности синтез гликанов регулируется, но имеет значительные стохастические компоненты, которые вносят вклад в наблюдаемое структурное разнообразие синтезированных гликоконъюгатов (Müller et al., 2016; Varki, 2017). Таким образом, совокупность гликозилированных видов организма или даже отдельной клетки, «гликома», является ошеломляющей.
Проблемы, характерные для исследования гликокаликса, и подходы к их решению
Из-за сложности гликокаликса на всех уровнях его исследование нетривиально. Можно назвать множество уникальных проблем, которые необходимо решить для изучения гликокаликса, однако в основе задачи лежат три проблемы:
• Гликокаликс обычно имеет поперечные размеры от нескольких 10 с до нескольких 100 с нм. Поэтому его размер меньше или близок к дифракционному пределу света, который составляет примерно 250 нм.Таким образом, размер гликокаликса редко можно определить с помощью обычной оптической микроскопии, а тонкие структуры недоступны. Второй основной метод микроскопии, используемый для изучения биологических систем, электронная микроскопия, требует тщательной подготовки образцов, и сообщения в литературе противоречат друг другу, влияют ли и как требуемые процедуры на результат (Ebong et al., 2011; Hegermann et al., 2016; Chevalier и др., 2017). Более того, электронная микроскопия обычно не дает информации о молекулярной идентичности отображаемых видов.Учитывая огромное количество плотно упакованных гликанов и гликоконъюгатов, обнаруженных в гликокаликсе, это особенно прискорбно.
• Компоненты гликокаликса являются продуктами вторичных генов. Таким образом, их структура не кодируется напрямую в геноме, скорее, она является продуктом многих взаимозависимых биосинтетических путей и, кроме того, зависит от метаболического состояния клетки (Lau et al., 2007). Кроме того, вовлеченные ферменты часто обладают частично совпадающей специфичностью. Следовательно, классические генетические методы маркировки гликокаликса или идентификации регуляторных сетей во время синтеза посредством нокаута в значительной степени непригодны.
• Разница между двумя моносахаридами может быть такой же тонкой, как ориентация одной функциональной группы, но химический и биологический эффект часто бывает огромным. Это резко затрудняет специфическое мечение гликокаликса, поскольку любой подход к мечениям должен иметь возможность точно различать два гликоконъюгата, которые структурно почти идентичны.
Кроме того, разработка модельных систем, которая оказалась очень полезной для исследований ДНК и белков, является гораздо более сложной задачей для гликоконъюгатов.Из-за сложной стереохимии и большого количества функциональных групп синтез гликоконъюгатов не является тривиальным. Однако новаторские работы лабораторий Питера Сибергера, Герт-Яна Бунса, Чи-Хьюи Вонга и многих других значительно упростили эту проблему, и многие гликоконъюгаты в настоящее время могут быть синтезированы автоматически (Schmaltz et al., 2011; Wang et al. ., 2013; Hahm et al., 2017; Budhadev et al., 2019; Guberman, Seeberger, 2019).
Три ключевых проблемы биологии гликокаликса, по сути, все еще сохраняются, однако было обнаружено множество попыток хотя бы частичного их решения.Например, если структура гликоконъюгатов в гликокаликсе представляет больший интерес, чем их конкретная локализация на клеточной мембране, масс-спектрометрия является отличным инструментом для решения таких вопросов (Pan et al., 2011; Han and Costello, 2013).
Существует несколько стратегий маркировки компонентов гликокаликса. Встречающиеся в природе гликан-связывающие белки, называемые лектинами, успешно использовались для воздействия на отдельные гликановые структуры для различных приложений, однако они могут страдать от низкого сродства или низкой специфичности (Rudiger and Gabius, 2001; Lehmann et al., 2006; Смит и Каммингс, 2013; Уилан и Белл, 2015). Создание антител против гликановых структур было сложной задачей, поскольку требовалась очистка гликоконъюгатов-мишеней из сложной биологической смеси с высокими выходами. Однако с недавними достижениями в синтезе гликанов (см. Выше) можно ожидать, что гликановые антитела станут более доступными (Paschinger et al., 2005; Broecker et al., 2015).
Уникальный подход к маркировке определенных компонентов гликокаликса называется метаболической маркировкой.При таком подходе клетки или целые организмы снабжаются молекулой-предшественником, которая интернализуется клеткой (ами) и используется для синтеза гликокаликса (Keppler et al., 1995; Laughlin and Bertozzi, 2007; Baskin et al., 2010). . Важно то, что молекула-предшественник демонстрирует неестественную модификацию, которая присоединяется таким образом, что предшественник обычно обрабатывается клеточным биосинтетическим аппаратом: модификация «невидима» для клетки. Таким образом, модифицированный предшественник вставляется в компоненты гликокаликса, и неприродная модификация может быть химически адресована для присоединения, например, флуорофоров.Из-за биоортогональной природы используемых неестественных модификаций, например азидогрупп, такое нацеливание совместимо с потребностями живых клеток и организмов. Этот подход обеспечивает отличную специфичность и высокую степень маркировки и, таким образом, очень эффективен. Его основным недостатком является то, что в настоящее время он позволяет нацеливаться только на отдельные сахара, такие как сиаловые кислоты или GalNAc, не сообщая о гликановой структуре, частью которой является меченый сахар.
Визуализация гликокаликса с помощью флуоресцентной микроскопии желательна, поскольку она позволяет использовать имеющиеся в настоящее время и будущие специфические химические методы маркировки.Это позволяет оценить организацию компонентов гликокаликса с известной молекулярной идентичностью. Однако обычная оптическая микроскопия в значительной степени не подходит для получения подробных сведений о структуре и размерах гликокаликса из-за небольшого размера гликокаликса. Одним из решений этой проблемы является использование микроскопии сверхвысокого разрешения, которая обеспечивает разрешение 10–20 нм (Moerner, 2012; Von Diezmann et al., 2017). В последнее время этот метод использовался в сочетании с метаболической маркировкой или окрашиванием на основе лектина для успешной визуализации и исследования гликокаликса в культивируемых клетках (Letschert et al., 2014; Цзян и др., 2015; Чен и др., 2016; Möckl et al., 2019). В целом, одномолекулярные методы кажутся ценными инструментами для решения вопросов в исследовании гликокаликса из-за их беспрецедентной разрешающей способности и специфичности (Lakshminarayanan et al., 2018).
Три ключевые проблемы биологии гликокаликса, упомянутые в начале этого раздела, долгое время были препятствиями и мешали признанию гликокаликса жизненно важным клеточным компонентом. В последние годы был проведен значительный процесс для их решения, но даже несмотря на то, что наше понимание гликокаликса значительно улучшилось, эти проблемы не решены, и требуется дальнейшая работа.
Функции, традиционно приписываемые Glycocalyx
Несмотря на то, что функциональная роль гликокаликса для клеточной и мембранной биологии долгое время недооценивалась, было бы неверно предполагать, что гликокаликс вообще не имел соответствующей биологической цели. На протяжении десятилетий гликокаликсу приписывали несколько функций. Особое внимание в медицине уделяется эндотелиальному гликокаликсу, выстилающему кровеносные сосуды.
Вероятно, первой идентифицированной функцией гликокаликса была защита.Гликокаликс — это плотная гелеобразная сетка, которая окружает клетку и представляет собой физический барьер для любого объекта, который может проникнуть в клетку. Например, было установлено, что гликокаликс играет важную роль в предотвращении проникновения патогенов в клетку. Следовательно, бактерии и вирусы используют специальные механизмы для заражения (Bomsel and Alfsen, 2003; Mcguckin et al., 2011). Аналогичным образом, в контексте наномедицины было показано, что эндотелиальный гликокаликс действует как барьер для проникновения наночастиц (Gromnicova et al., 2016; Möckl et al., 2017; Уль и др., 2017). Кроме того, нежелательная адгезия лейкоцитов предотвращается эндотелиальным гликокаликсом (Lipowsky, 2012).
Эндотелиальный гликокаликс постоянно контактирует с кровотоком и действует как жизненно важный механосенсор на эндотелиальных клетках. В частности, в этом процессе участвуют длинные протеогликаны с сильным гликозилированием, такие как гепарансульфат или хондроитинсульфат. Часто используется образ ветра, скользящего сквозь деревья: в этой аналогии «ветер» кровотока воздействует на протеогликановые «деревья» гликокаликса, изгибая их, создавая крутящий момент, который передается на внутреннюю часть гликокаликса. клетки.Это приводит к различным внутриклеточным ответам, таким как высвобождение вазодилататора оксида азота, перестройка актинового цитоскелета и поляризация клеток (Florian et al., 2003; Thi et al., 2004; Pahakis et al., 2007; Zeng et al., 2018). ). Примечательно, что прерывание кровотока из-за, например, ишемии / реперфузии, как патологической, так и из-за хирургического вмешательства, вызывает существенное выделение эндотелиального гликокаликса, что приводит к серьезным побочным эффектам (Rehm et al., 2007; Annecke et al. 2011).
Что касается регуляции и организации гликокаликса, галектины и решетка галектина были идентифицированы как важные агенты.Галектины — это класс белков, которые связываются с β-галактозидами, например, распространенный дисахарид гликокаликса N -ацетиллактозамин (Johannes et al., 2018). Галектины обладают либо двумя сайтами связывания для β-галактозидов, либо самоорганизуются. Таким образом, они могут связывать несколько гликанов, связывая их и белки, к которым они прикреплены. Это приводит к кластеризации связанных компонентов гликокаликса и образованию так называемой «решетки галектина». Следовательно, интернализация и диффузия рецепторов изменяются, вызывая изменения в передаче сигналов в клетках (Nieminen et al., 2007; Möckl et al., 2015), которые также можно искусственно вызвать для точной настройки силы образования решетки (Möckl et al., 2016).
Однако, похоже, что значительная часть чрезвычайно сложной истории галектина еще не открыта. Напр., Недавно было показано, что галектин-1 перемещается в ядро, где он является частью регуляции морфогенеза (Bhat et al., 2016). Галектин-3 участвует в таких разнообразных клеточных процессах, как организация первичной реснички, ослабление апоптоза и эндоцитоз (Furtak et al., 2001; Koch et al., 2010; Harazono et al., 2014). Интересно, что ослабление апоптоза требует гетеродимеризации с Bax, белком, который проявляет интригующую аллостерию (Jiang et al., 2016). Более того, galectin-3 взаимодействует с главным регулятором KRAS, который в случае мутации является одним из основных драйверов различных типов рака (Shalom-Feuerstein et al., 2008). Наконец, лектины также используются высокопатогенными бактериями, такими как Mycobacterium tuberculosis , Pseudomonas aeruginosa и уропатогенные Escherichia coli , для облегчения адгезии и проникновения клеток (Mitchell et al., 2002; Имберти и др., 2008; Хартманн и Линдхорст, 2011; Кольбе и др., 2019).
Учитывая, что галектины одновременно являются белками, организующими гликокаликс, и участвуют во множестве клеточных процессов, похоже, что гликокаликс может действовать как «хранилище» для галектинов и потенциально других белков. После запуска событий они высвобождаются и перемещаются в клетку, где выполняют свою функцию. Эта ось клеточной организации, контролируемая гликокаликсом, вероятно, оказывает значительное влияние на состояние клетки, но в настоящее время это не изучено.
Новый взгляд на гликокаликс
Гликокаликс контролирует морфологию клеток
Клеточные мембраны могут иметь различную морфологию. В частности, трубчатые удлинения известны уже несколько десятилетий (Колата, 1975). Первоначально предполагалось, что их основная роль заключается в увеличении площади поверхности клеток, например, для секреции и абсорбции. Однако более поздние исследования показали, что эти выступы или мембранные канальцы участвуют в различных процессах. Они актуальны в таких разнообразных областях, как надзор за антигенами (Jung et al., 2016), развитие тканей (Bischoff et al., 2013), передача сигналов клеток (Ramirez-Weber and Kornberg, 1999; Rustom et al., 2004) и образование пузырьков во время прогрессирования рака (Al-Nedawi et al., 2008; Антоняк и др., 2011; Беккер и др., 2016).
Интересно, что механизмы, ответственные за образование мембранных канальцев, до недавнего времени были плохо изучены. Было высказано предположение, что филаменты цитоскелета выталкивают эти выступы (Tricarico et al., 2017), но подробные процессы не были ясны.Одна из причин этого может быть связана с проблемой создания модельных гликокаликов различных размеров с точным генетическим контролем.
Именно эта проблема была решена в исследовании 2018 года, в котором был представлен метод экспрессии муцина Muc1 с четко определенными размерами в модельных клетках (Shurer et al., 2018). Муцины являются важным компонентом гликокаликса и особенно важны в контексте рака (рис. 3A) (Kufe, 2009). Они демонстрируют белковый каркас, который в основном состоит из множества тандемных повторов характерных аминокислотных последовательностей, вместе называемых «муциновыми доменами».Поскольку каждый домен сильно гликозилирован, цельные муцины, которые могут иметь длину персистентности в несколько микрон, регулярно несут более 50% содержания гликозилирования по массе, а иногда и до 85% (Patton et al., 1995; Felder et al., 2014 ; Das et al., 2015). Это сильное гликозилирование делает муцины практически инертными по отношению к обычным протеазам, что серьезно затрудняет их исследования. Однако недавно идентифицированная муцин-селективная протеиназа преодолела это ограничение, что, безусловно, будет очень полезно для изучения муцинов (Malaker et al., 2019).
Рисунок 3. Влияние муцинов на морфологию клеток. (A) Схематическое изображение муцина. Муцины имеют структуру типа «бутылочная щетка»: сильно гликозилированный белковый каркас O прикреплен к мембране через мембранный якорь. (B) Повышенная плотность муцина на клеточной мембране вызывает фундаментальное изменение морфологии клеток от плоского, прикрепленного фенотипа до сильной тубуляризации мембраны и подъема клеток. (C) При низкой плотности муцины принимают фенотип компактных грибов.Когда плотность муцина увеличивается выше порогового значения, муцины распространяются на полимерную щетку. Повышенный порядок налагает на систему энтропийный штраф, который снижается из-за изгиба мембраны, что дает муцинам больше ориентационных степеней свободы.
Трудность экспрессии определенных компонентов гликокаликса убедительно иллюстрируется муцинами: использование стандартной стратегии экспрессии приводит к экспрессии муцинов с широким распределением по размеру, обычно меньшим, чем предполагалось, и с низким выходом.Однако, используя индивидуальный подход, основанный на транспозонах, Shurer et al. (2019) смогли экспрессировать Muc1 в модельных клетках с высоким выходом, точным контролем размера и узким распределением по размерам.
Основываясь на своей более ранней фундаментальной работе, группа Мэтта Пашека продолжила изучение влияния гликокаликса на морфологию мембран (Shurer et al., 2019). Поразительно, они наблюдали, что клетки MCF10A, которые почти не показывают мембранных канальцев при отсутствии лечения, подвергаются массивной тубуляризации мембраны при экспрессии муцинов (рис. 3В).Этот эффект был специфическим для гликокаликса, поскольку экспрессия мембранного белка без гликозилирования не вызывала тубуляризацию. Учитывая, что раковые клетки часто сверхэкспрессируют муцины и обычно проявляют деполяризованный, мигрирующий и канальцевый фенотип, результаты Shurer et al. (2019) также предоставляют весьма актуальную информацию о взаимосвязи биофизики мембран и прогрессирования рака.
Чтобы понять физические механизмы тубуляризации мембраны, Shurer et al.(2019) провели подробный теоретический анализ с использованием полимерной щеточной модели гликокаликса. При увеличении концентрации муцина в мембране свернутые, довольно компактные муцины начинают взаимодействовать. Чтобы избежать друг друга, они растягиваются, образуя полимерную кисть («переход от гриба к щетке»). Изгиб мембраны снижает энергию системы, поскольку каждый муцин приобретает большую конформационную свободу, увеличивая спонтанную кривизну (рис. 3C). Поразительно, но Шурер и др. (2019) определили, что энергия, необходимая для «выталкивания» мембранной трубки в режиме щетки, составляет максимально несколько пН и снижается значительно ниже 1 пН при высокой плотности муцина.В то же время давление цитоплазмы, необходимое для поддержания пузыря сферической мембраны, резко возрастает и быстро становится нефизиологичным. Поскольку одиночный полимеризующийся актиновый филамент проявляет силу приблизительно 1 пН, теоретический анализ объясняет, почему при определенной плотности муцина тубуляризация мембраны является единственным релевантным клеточным фенотипом.
Важно отметить, что Shurer et al. (2019) показали, что этот эффект не ограничивается муцинами. Используя живую синовиальную ткань, выделенную из запястья лошади, они продемонстрировали, что тот же фенотип можно наблюдать в синовиоцитах.Синовиоциты — это специализированные клетки, отвечающие за синтез гиалуроновой кислоты. Они обладают сильно трубчатой мембраной, очень похожей на генетически модифицированные клетки, экспрессирующие муцин. При лечении гиалуронидазой, разрушающей гиалуроновую кислоту, полностью устраняется тубуляризация мембраны, Shurer et al. (2019) подтвердили, что тубуляризация мембраны не является специфической для экспрессии муцина, но в равной степени может вноситься другими полимерными компонентами гликокаликса.
Следует подчеркнуть, что такая регуляция морфологии клеточной мембраны является прекрасным примером важного мотива: гликокаликс часто (хотя и не исключительно) действует посредством физических взаимодействий.Стерические эффекты, молекулярная скученность, электростатические эффекты (например, отталкивание сульфатированных сахаров и захват противоионов), эффекты многовалентности, исключение размера и другие явления, которые играют ключевую роль в биологии гликокаликса (Kuo et al., 2018; Gandhi et al. ., 2019). Характерно, что каждый случай перечисленных явлений оказывает на систему лишь небольшую силу, но из-за больших размеров гликокаликса многие небольшие силы складываются в значительную общую силу, оказывая значительное влияние на состояние клетки.
Гликокаликс участвует в регуляции диффузии мембранных белков
Диффузия мембранных белков, ее регуляция и ее взаимодействие с составом мембран является одним из наиболее важных аспектов мембранной биологии (Jacobson et al., 1987, 2019; Pluhackova and Böckmann, 2015), и для описания этот ключевой процесс (Сингер и Николсон, 1972; Хендерсон и Анвин, 1975; Робертсон, 1981). Одна модель конкретно обращается к взаимодействию между мембранными белками и цитоскелетом: модель пикет-забор (Kusumi and Sako, 1996).Эта модель предполагает, что «пикеты», то есть обильные мембранные белки, связывают «забор», то есть цитоскелет рядом с клеточной мембраной, который устанавливает мембранные домены, которые, например, влияют на диффузию мембранных белков.
В недавнем исследовании лаборатории Серджио Гринштейна был выявлен отличный кандидат на пикет, и актуальность гликокаликса была убедительно продемонстрирована (Freeman et al., 2018). Freeman et al. (2018) сосредоточили внимание на регуляции фагоцитоза в макрофагах.Они показали, что пикеты и заборы опосредуют диффузию рецепторов, функционально изменяя фагоцитоз на субклеточном уровне.
В своем исследовании Freeman et al. (2018) определили CD44 как добросовестный пикет. CD44 очень распространен в мембране макрофагов, происходящих из костного мозга (~ 10 6 копий на клетку), и, как было описано ранее, он участвует в различных клеточных контекстах (Goodison et al., 1999). Как показано на рисунке 4А, CD44 связывается внутриклеточно с актиновым цитоскелетом коры головного мозга через линкерные белки, такие как эзрин и другие.Примечательно, что CD44 проявляет другой способ связывания: внеклеточно он взаимодействует с ключевым компонентом гликокаликса гиалуроновой кислотой. Таким образом, CD44 действует как пикет, а актиновый цитоскелет коры головного мозга, а также гиалуронан на внеклеточной стороне служат барьерами. Вместе эти три компонента образуют надстройку, которая определяет мембранные домены, регулируя диффузию мембранных белков (рис. 4B).
Рисунок 4. Модель штакетника и ее влияние на диффузию мембранных белков. (A) CD44, обильный трансмембранный белок, связывает гиалуроновую кислоту, составляющую гликокаликс, с ее внеклеточным доменом. Внутриклеточно он взаимодействует с кортикальным актиновым цитоскелетом через эзрин и другие линкерные белки. (B) Гиалуронан, CD44 и кортикальный актин разграничивают мембранные домены (красная пунктирная линия), которые регулируют диффузию мембранных белков (красная точка).
Freeman et al. (2018) показали, что каждый компонент надстройки необходим для эффективного контроля диффузии.Нокаут CD44 значительно увеличивал диффузию мембранных белков. Синтетическая конструкция, состоящая из трансмембранного домена FcR и эзрина, слитых вместе, была использована для исследования роли связывания актина. Конструкция показала значительно увеличенную диффузионную способность, когда связывание эзрина с актином было нарушено посредством точечной мутации в домене эзрина. Наконец, сверхэкспрессия синтазы 3 гиалуроновой кислоты значительно снижает диффузию мембранных белков. Таким образом, три компонента структуры «штакетник» (CD44, гиалуронан и кортикальный актин) действуют вместе, регулируя диффузию мембранных белков.
Важно отметить, что регуляция диффузии мембранных белков оказывает существенное влияние на субклеточную организацию и фагоцитоз исследуемых макрофагов. Freeman et al. (2018) обнаружили, что мигрирующие макрофаги разрушают надстройку CD44-гиалуронан-актин на переднем крае клетки, но не на заднем конце. Это вызывает более высокую подвижность рецепторов на переднем крае, позволяя образовывать кластеры рецепторов и инициировать фагоцитоз в области макрофага, которая наиболее близка, например, к патогену, который необходимо поглотить.
Кроме того, это исследование также предполагает регулирующий потенциал мембранных белков обратно на гликокаликс: взаимодействие одной молекулы CD44 с гиалуронаном является слабым, но из-за огромного количества событий связывания CD44-гиалуронана длинные молекулы гиалуронана прочно увлеченный. Это было подтверждено исследованием взаимодействия бактерий Salmonella typhimurium с макрофагами дикого типа или с дефицитом CD44. Неподвижные бактерии гораздо легче связываются с макрофагами с дефицитом CD44, чем с макрофагами дикого типа, что позволяет предположить, что отсутствие CD44 вызывает снижение содержания гиалуронана на поверхности клеток.Интересно, что подвижные бактерии одинаково хорошо связывались как с макрофагами дикого типа, так и с макрофагами с дефицитом CD44. Это указывает на то, что сила, создаваемая бактериями, достаточна для проникновения через гликокаликс, что было подтверждено экспериментами по центрифугированию с использованием опсонизированных гранул: макрофаги с дефицитом CD44 будут связывать гораздо больше гранул, чем макрофаги дикого типа, когда сила не применяется, но оба типа будет связывать такое же количество шариков, когда шарики прижимаются к поверхности клетки посредством центрифугирования.
Гликокаликс функционально важен для развития рака на всех стадиях
За десятилетия накопились доказательства ключевой роли гликокаликса в развитии и прогрессировании рака (Ohtsubo and Marth, 2006; Pinho and Reis, 2015; Tarbell and Cancel, 2016). Напр., Изменение структуры клеточного метаболизма посредством эффекта Варбурга характерно изменяет гликозилирование мембранных белков (Dennis et al., 2009; Heiden et al., 2009). Это измененное гликозилирование вызывает изменения в поведении белков, например.g., увеличенное время пребывания на мембране за счет длительного взаимодействия с решеткой галектина (Rudd et al., 1999; Lau et al., 2007). В результате клеточная передача сигналов сдвигается, что в конечном итоге приводит к изменению клеточного поведения. Другие исследования показали, что раковый гликокаликс действует как механосенсор при инвазии, регулируемой потоком (Qazi et al., 2013, 2016; Moran et al., 2019).
Опухолевые клетки обратились против здоровых клеток организма и поэтому должны выжить во враждебной среде. В частности, образование метастазов осложняется: стремятся удалить циркулирующие опухолевые клетки из кровотока, а неконтролируемая адгезия циркулирующих клеток затруднена.Несколько недавних открытий показали, что физические характеристики ракового гликокаликса играют важную роль в этих процессах, непосредственно примируя опухолевые клетки к адгезии и продлению выживаемости.
Paszek et al. (2014) изучали влияние толщины гликокаликса на опосредованную интегрином клеточную адгезию, рост и выживаемость. Они показали, что, возможно, парадоксально на первый взгляд, толстый гликокаликс сильно увеличивает адгезию, опосредованную интегрином, за счет образования больших адгезионных бляшек, которые прочно прикрепляют клетку к субстрату, например.g., внеклеточный матрикс (ЕСМ). Этот эффект, однако, можно объяснить с помощью модели кинетической ловушки: при активации интегрины претерпевают конформационные изменения, заставляя их вытягиваться на 15-20 нм от поверхности клетки (Campbell and Humphries, 2011; Dai et al., 2015). Таким образом, тонкий гликокаликс высотой примерно 10 нм не препятствует взаимодействию интегринов с ЕСМ (рис. 5А). Напротив, толстый гликокаликс в несколько десятков нм в значительной степени предотвращает взаимодействие интегринов с ECM.Однако, если взаимодействие устанавливается в какой-то момент, активация интегрина будет происходить преимущественно в уже установленном месте взаимодействия. Если активные интегрины отделяются от ЕСМ, они, скорее всего, не покинут зону взаимодействия из-за толстого гликокаликса вокруг. Таким образом, толстый гликокаликс обеспечивает сильную интегрин-опосредованную адгезию за счет кинетических воронок или ловушек (рис. 5В). Поразительно, но Paszek et al. (2014) обнаружили, что большие объемные гликопротеины и протеогликаны, такие как муцины, сильно экспрессируются на многих циркулирующих опухолевых клетках, что подчеркивает прямую клиническую значимость выявленного механизма.
Рисунок 5. Раковой гликокаликс в опосредованной интегрином выживаемости клеток и его изменение при онкогенных событиях. (A) Клетки прикрепляются к компонентам внеклеточного матрикса (ЕСМ) через интегрины. Если гликокаликс тонкий, интегрины выходят за пределы гликокаликса. (B) Толстый гликокаликс, который часто экспрессируется раковыми клетками, простирается значительно дальше во внеклеточное пространство, чем активные интегрины. В результате взаимодействия между интегринами и ЕСМ невозможны в большинстве областей клеточной поверхности, однако горячие точки связывания интегрина с ЕСМ создаются через кинетическую воронку. (C) При протоонкогенных событиях, таких как эпителиально-мезенхимальный переход (EMT) или онкогенная активация RAS (например, KRAS G12D ), высота гликокаликса увеличивается, что способствует прогрессированию опухоли и выживанию. Онкогенный эффект опосредуется такими медиаторами, как GALNT7, и другими.
Исследование Woods et al. (2017) взяли эту идею in vivo . Здесь клетки карциномы молочной железы, несущие короткие (~ 3 нм) или длинные (~ 90 нм) синтетические гликополимеры, вводили в хвостовые вены мышей.Синтетические гликополимеры имитируют муцины клеточной поверхности и имеют специальный липидный якорь, который приводит к хранению синтетических гликопротеинов во внутриклеточных везикулах. Таким образом, вместо разложения гликополимеры возвращаются обратно на поверхность клетки в течение многих дней, что позволяет проводить долгосрочные исследования (Woods et al., 2015). Через 15 дней мышей умерщвляли и вырезали легкие, по которым мигрировали инъецированные клетки. Бремя опухоли сильно увеличивалось, когда инъецированные клетки содержали длинную форму синтетического гликополимера по сравнению с короткой формой.Согласно исследованию Paszek et al. (2014) и Woods et al. (2017) обнаружили, что длинный синтетический гликополимер стимулирует механочувствительность интегрина-FAK, подчеркивая важность опосредованной интегрином адгезии и выживания опухолевых клеток.
В недавнем исследовании, проведенном лабораториями W. E. Moerner и Carolyn Bertozzi, размеры и наноразмерная архитектура гликокаликса были исследованы с помощью микроскопии сверхвысокого разрешения (Möckl et al., 2019). Повышенное разрешение позволило напрямую определять размеры гликокаликса от клеточной мембраны вверх.Этот подход использовался для мониторинга изменений высоты гликокаликса при двух ключевых онкогенных событиях: переход от эпителия к мезенхиме (EMT) и активация протоонкогена, в данном случае экспрессия KRAS G12D , одной из наиболее распространенных известных онкогенных мутаций. (Каллури, Вайнберг, 2009; Cox et al., 2014). Они обнаружили, что при обоих онкогенных событиях высота гликокаликса значительно увеличивалась. Поскольку и EMT, и KRAS G12D запускают множество сигнальных каскадов, Möckl et al.(2019) продолжили идентифицировать гены-медиаторы для воздействия KRAS G12D на гликокаликс. Транскриптомный анализ выявил несколько многообещающих совпадений, среди которых наиболее заметной оказалась галактозилтрансфераза GALNT7 : у пациентов, страдающих аденокарциномой поджелудочной железы, тип опухоли, при котором KRAS несет активирующую мутацию более чем в 90% случаев, GALNT7 был сильно выражен. коррелировали с выживаемостью пациентов, предполагая связь между KRAS и GALNT7 .Действительно, в клетках, экспрессирующих KRAS G12D , siRNA-опосредованный нокдаун GALNT7 вызвал сильное снижение высоты гликокаликса, что указывает на то, что GALNT7 действительно является медиатором одного гена воздействия онкогенного KRAS на гликокаликс. Учитывая исследования Paszek et al. (2014) и Woods et al. (2017), эти результаты убедительно свидетельствуют о том, что раковые клетки активно реконструируют свой гликокаликс с первых онкогенных событий, что способствует прогрессированию опухоли, метастазированию и выживанию (рис. 5C).
Гликокаликс играет ключевую роль в регулировании иммунной системы и ингибировании контрольных точек
В предыдущих разделах описаны недавние важные открытия, которые подтверждают центральную роль гликокаликса в определении морфологии клеток, организации мембран и прогрессировании рака. Каждое из этих исследований можно легко перенести на терапевтическое применение. Кроме того, недавние исследования лаборатории Кэролайн Бертоцци начали изучать потенциал гликокаликса в терапии и, в частности, в иммунотерапии рака.
Одним из отличительных признаков рака является уклонение от иммунитета (Bhatia and Kumar, 2014). Обычно неконтролируемая пролиферация клеток распознается и прекращается, но при раке это уже не так. Таким образом, иммунотерапия рака направлена на стимуляцию иммунной системы, чтобы восстановить ее нормальный ответ на борьбу с раком (Scott et al., 2012). Этого можно достичь различными способами, например, используя антитела, которые блокируют пути, ответственные за снижение активности иммунной системы.
Компонент гликокаликса, который в основном определяет значение гликокаликса для регуляции иммунной системы, — это сиаловая кислота.Сиаловые кислоты являются моносахаридами в большом количестве в гликокаликсе. Среди множества клеточных и организменных процессов, в которые они вовлечены, их роль в качестве «маркера самости» имеет особое значение (Paulson et al., 2012; Varki and Gagneux, 2012; Blaum et al., 2015), и многие исследования показали, что убедительно продемонстрирована важность сиаловых кислот и рецепторов, связывающих сиаловую кислоту на клеточной мембране, названных «сиглеками» (сокращение от лектинов иммуноглобулинового типа, связывающих сиаловую кислоту, принадлежащих к семейству лектинов I-типа) (Crocker et al., 2007; Jandus et al., 2014; Läubli et al., 2014). В соответствии с этой картиной многие раковые клетки сверхэкспрессируют сиалированные белки и липиды и их мембраны, и можно показать, что эта сверхэкспрессия напрямую участвует в подавлении иммунной системы, позволяя раковой клетке уклоняться от атаки иммунных клеток (Hudak et al. , 2014; Болиган и др., 2015).
Эта стратегия уклонения от иммунной системы очень эффективна. Например, одна из иммунотерапевтических стратегий лечения рака груди заключается в использовании моноклональных антител, известных как трастузумаб (Tras).Tras связывается со сверхэкспрессируемым белком поверхности раковых клеток, рецептором 2 эпидермального фактора роста человека (HER2), и вызывает иммунный ответ, который приводит к интернализации и подавлению HER2 (Bange et al., 2001). Кроме того, Tras связывается с FCγRIII (также известным как CD16), который экспрессируется на естественных киллерных (NK) клетках. Таким образом, Tras способен связывать NK-клетки с раковыми клетками, увеличивая время взаимодействия и увеличивая опосредованное NK-клетками уничтожение раковых клеток. Однако ситуация более сложная.74% пациентов с раком груди обнаруживают экспрессию HER2, но только группа пациентов с наивысшими уровнями HER2 (~ 20%) вообще отвечает на лечение (Lee et al., 2011). Еще больше озадачивает то, что менее 20% этой группы пациентов проявляют реакцию только на Tras. Даже комбинированная терапия дает ответ от 50 до 80% (Bartsch et al., 2007).
Xiao et al. (2016) показали, что причина этого неэффективного действия Tras опосредуется раковым гликокаликсом. Он представляет сиалированные виды сиглекам на иммунных клетках, например, NK-клеткам.Сиглеки содержат мотивы ингибирования на основе цитозольного иммунорецептора тирозина (ITIM) и мотивы переключения на основе тирозина иммунорецептора (ITSM). При связывании сиалилированных видов с раковой клеткой SHP1 и -2 (сокращение от Src homology 2 domain -sing protein tyrosine phosphatase 1 и 2) рекрутируются и активируются, что вызывает снижение активности NK-клеток (рис. 6A). Кроме того, связывание рецепторов, активирующих NK-клетки, таких как NK-активирующий рецептор, группа естественных киллеров 2D (NKG2D), нарушается гиперсиалированием гликанов раковых клеток.Следовательно, лечение Tras может удалить HER2 из картины, но если ингибирование, опосредованное сиаловой кислотой и сиглеком, достаточно сильное, у пациента не будет реакции на Tras. Таким образом, сиаловые кислоты и сиглеки способствуют устойчивости к лекарствам.
Рисунок 6. Сиглек и сиаловая кислота в регуляции иммунной системы и специфическом воздействии на сиалом рака для стратегий лечения. (A) Сиалированные липиды раковых клеток связываются с сиглек-рецепторами иммунных клеток, например.g., естественные киллерные (NK) клетки. Сиглекы содержат мотивы ингибирования иммунорецепторного тирозина (ITIM) и мотивы переключения иммунорецепторного тирозина (ITSM), которые рекрутируют фосфатазы, такие как Src-домен, содержащий домен 2, тирозинфосфатазы 1 и 2 (SHP1 и -2), что вызывает снижение активности клетки НК. (B) Конъюгат антитело-сиалидаза T-Sia 2.0 для специфического десиалилирования раковых клеток. (C) T-Sia 2.0 связывается с мембранными белками, которые обычно сверхэкспрессируются раком.Сиалидаза вызывает десиалирование рака, что отменяет связывание сиглеков NK-клеток и предотвращает их подавление.
Это наблюдение напрямую увеличивает возможность нацеливания на сиалом рака для более эффективного лечения. Однако широкое неспецифическое десиалирование может привести к серьезным побочным эффектам из-за повсеместного присутствия сиаловой кислоты в организме. Таким образом, Xiao et al. (2016) разработали конъюгат Tras-sialidase, названный T-Sia, который избирательно десиалилирует раковые клетки.Это вызвало повышенную активность опосредованной Tras цитотоксичности NK-клеток, что привело к более высокой эффективности против клеток с низкими уровнями HER2 по сравнению с лечением одним Tras.
Недавно Грей и др. Разработали улучшенную версию T-Sia меньшего размера. (2019), названный T-Sia 2.0, показанный на рисунке 6B. Более старый T-Sia показал нежелательную Tras-независимую активность, которая была вызвана сродством сиалидазы, производной Vibrio cholerae , к поливалентным субстратам, таким как поверхности клеток, из-за присутствия лектиновых доменов.T-Sia 2.0 использует сиалидазу из Salmonella typhimurium , которая значительно снижает Tras-независимое десиалирование клеток. Это сильно повысило цитотоксичность и специфичность T-Sia 2.0. Подобно T-Sia, T-Sia 2.0 связывается с HER2 в иммуносинапсе, где он удаляет сиаловые кислоты из сиалилированных белков и липидов, что предотвращает связывание сиглеков на иммунной клетке и восстанавливает взаимодействие рецепторов, активирующих NK-клетки, таких как NKG2D. со своими лигандами. Следовательно, SHP1 / 2 не рекрутируется в ITIM и ITSM домены сиглеков, и активность иммунных клеток не снижается (рис. 6C).Благодаря улучшенной активности и специфичности T-Sia 2.0 стало возможным изучить эффект направленного десиалилирования раковых клеток in vivo с использованием сингенной ортотопической модели рака молочной железы HER2 +. Лечение T-Sia 2.0 задерживало рост опухоли и усиливало инфильтрацию и активацию иммунных клеток, что приводило к увеличению выживаемости. Таким образом, целенаправленная десиалиляция раковых клеток была признана многообещающей стратегией преодоления гликоиммунных контрольных точек in vivo .
Обсуждение и прогноз
До недавнего времени гликокаликс считался клеточной структурой с важными функциями, но обычно не предполагалось, что гликокаликс является агентом, способным фундаментально определять состояние клеток и организма.Эта точка зрения резко изменилась, когда серия революционных исследований за последние несколько лет установила, что гликокаликс является органеллой со значительным регуляторным потенциалом. Теперь мы знаем, что гликокаликс функционально вовлечен в ядро клеточных событий, имеющих большое значение как для здоровья, так и для болезней — от организации мембран до прогрессирования рака. Более того, эти исследовательские усилия не остановились на простом описании роли гликокаликса, но также показали, что гликокаликс является бесценной клинической мишенью.
Гликокаликс — это удивительный плавильный котел химии, физики, биологии и медицины. Его поразительная молекулярная и структурная сложность коренится в разнообразии химического состава углеводов. Эта сложность приводит к клеточным эффектам, которые затрагивают различные области клеточной биологии: передачу сигналов, метаболизм, иммунитет, миграцию клеток, адгезию и пролиферацию и многие другие. Наконец, сложность гликокаликса также часто объединяется в одно целое, становясь силой, действующей почти исключительно через физические силы.
Несмотря на то, что недавние открытия произвели революцию в нашем взгляде на гликокаликс, нам предстоит еще долгий путь. Необходимо найти новые подходы, чтобы определить детальную архитектуру гликокаликса, понять взаимодействие между гликокаликсом и состоянием клетки и отслеживать его динамические изменения при ключевых клеточных событиях в состоянии здоровья и болезни.
Создание необходимых инструментов позволит получить первые проблески в более глубокое, комплексное понимание связи между гликокаликсом и клеткой, которое мы приобрели до сих пор.Нам еще предстоит открыть для себя самые увлекательные аспекты биологии гликокаликса: эра гликокаликса только началась.
Авторские взносы
Рукопись написанаЛ.М.
Финансирование
Частичная поддержка со стороны Национального института общих медицинских наук (грант № R35GM118067) с благодарностью.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Автор благодарит W. E. Moerner, Carolyn Bertozzi, Kayvon Pedram и Anna-Karin Gustavsson из Стэнфордского университета за ценные обсуждения и вычитку рукописи.
Список литературы
Аль-Недави К., Михан Б., Микаллеф Дж., Лотак В., Мэй Л., Гуха А. и др. (2008). Межклеточный перенос онкогенного рецептора EGFrvIII микровезикулами, происходящими из опухолевых клеток. Nat. Cell Biol. 10, 619 – U624.
Google Scholar
Аннеке Т., Fischer, J., Hartmann, H., Tschoep, J., Rehm, M., Conzen, P., et al. (2011). Отторжение коронарного эндотелиального гликокаликса: эффекты гипоксии / реоксигенации по сравнению с ишемией / реперфузией. руб. J. Anaesth. 107, 679–686. DOI: 10.1093 / bja / aer269
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Антоняк, М. А., Ли, Б., Боро, Л. К., Джонсон, Дж. Л., Друсо, Дж. Э., Брайант, К. Л. и др. (2011). Микровезикулы, происходящие из раковых клеток, вызывают трансформацию путем переноса тканевой трансглутаминазы и фибронектина в клетки-реципиенты. Proc. Natl. Акад. Sci. США A. 108, 4852–4857. DOI: 10.1073 / pnas.1017667108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барч Р., Венцель К. и Стегер Г. Г. (2007). Трастузумаб в лечении рака груди на ранней и поздней стадии. Biol. Цель. Ther. 1, 19–31.
Google Scholar
Баскин, Дж. М., Денерт, К. В., Лафлин, С. Т., Амахер, С. Л., и Бертоцци, К. Р. (2010). Визуализация гликанов обволакивающего слоя во время раннего эмбриогенеза рыбок данио. Proc. Natl. Акад. Sci. США 107, 10360–10365. DOI: 10.1073 / pnas.01107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беккер А., Такур Б. К., Вайс Дж. М., Ким, Х. С., Пейнадо, Х. и Лайден, Д. (2016). Внеклеточные везикулы при раке: межклеточные медиаторы метастазирования. Cancer Cell 30, 836–848. DOI: 10.1016 / j.ccell.2016.10.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бхат, Р., Беларди, Б., Mori, H., Kuo, P. W., Tam, A., Hines, W. C., et al. (2016). Ядерное перераспределение галектина-1 с помощью внеклеточного гликанового переключателя регулирует морфогенез молочных желез. Proc. Natl. Акад. Sci. США 113, E4820 – E4827.
Google Scholar
Бхатия А., Кумар Ю. (2014). Клеточные и молекулярные механизмы иммунного ускользания от рака: всесторонний обзор. Exp. Преподобный Clin. Иммунол. 10, 41–62. DOI: 10.1586 / 1744666x.2014.865519
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Биберих, Э.(2014). Синтез, обработка и функция N-гликанов в N-гликопротеинах. Adv. Neurobiol. 9, 47–70.
Google Scholar
Бишофф М., Градилья А. К., Сейхо И., Андрес Г., Родригес-Навас К., Гонсалес-Мендес Л. и др. (2013). Цитонемы необходимы для установления нормального градиента морфогена Hedgehog в эпителии Drosophila . Nat. Cell Biol. 15, 1269 – U1240.
Google Scholar
Блаум, Б.С., Ханнан, Дж. П., Герберт, А. П., Кавана, Д., Урин, Д., и Стехле, Т. (2015). Структурная основа опосредованного сиаловой кислотой самопознания фактором комплемента H. Nat. Chem. Биол. 11, 77–82. DOI: 10.1038 / nchembio.1696
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Болиган, К. Ф., Меса, К., Фернандес, Л. Э., и фон Гантен, С. (2015). Приобретенный раковый интеллект (CIA): коды гликозилирования и сиалирования опухоли, разрушающие противоопухолевую защиту. Cell.Мол. Life Sci. 72, 1231–1248. DOI: 10.1007 / s00018-014-1799-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бретон, К., Снайдрова, Л., Жанно, К., Коджа, Дж., И Имберти, А. (2006). Строения и механизмы гликозилтрансфераз. Гликобиология 16, 29R – 37R. DOI: 10.1093 / glycob / cwj016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брокер Ф., Аниш К. и Сибергер П. Х. (2015). Создание моноклональных антител против определенных олигосахаридных антигенов. Methods Mol. Биол. 1331, 57–80. DOI: 10.1007 / 978-1-4939-2874-3_5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Budhadev, D., Saxby, K., Walton, J., Davies, G., Tyler, P.C., Schworer, R., et al. (2019). Использование автоматизированной сборки гликанов (AGA) для практического синтеза предшественников гепарансульфатных олигосахаридов. Орган. Biomol. Chem. 17, 1817–1821. DOI: 10.1039 / c8ob02756k
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чайка, Н.V., Gebregiworgis, T., Lewallen, M. E., Purohit, V., Radhakrishnan, P., Liu, X., et al. (2012). Муцин MUC1 стабилизирует и активирует индуцируемый гипоксией фактор 1 альфа для регулирования метаболизма при раке поджелудочной железы. Proc. Natl. Акад. Sci. США, 109, 13787–13792. DOI: 10.1073 / pnas.1203339109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, Дж. Л., Гао, Дж., Чжан, М., Цай, М. Дж., Сюй, Х. Дж., Цзян, Дж. Г. и др. (2016). Системная локализация семи основных типов углеводов на клеточных мембранах с помощью визуализации dSTORM. Sci. Отчет 6: 30247.
Google Scholar
Chevalier, L., Selim, J., Genty, D., Baste, J.M., Piton, N., Boukhalfa, I., et al. (2017). Электронная микроскопия для визуализации эпителиального и эндотелиального гликокаликса. Морфология 101, 55–63. DOI: 10.1016 / j.morpho.2017.04.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Константину П. Э., Моргадо М. и Карсон Д. Д. (2015). Трансмембранная экспрессия и функция муцина при имплантации эмбриона и плацентации.регулирование имплантации и установления беременности у млекопитающих: к 45-летию Роджера В. Shorts Mater. Узнай. Preg. 216, 51–68. DOI: 10.1007 / 978-3-319-15856-3_4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кокс, А.Д., Фесик, С.В., Киммельман, А.С., Луо, Дж., И Дер, К. Дж. (2014). Накачать неуправляемую РАС наркотиками: миссия возможна? Nat. Преподобный Drug Discover. 13, 828–851. DOI: 10.1038 / nrd4389
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дай, А., Е., Ф., Тейлор, Д. В., Ху, Г. К., Гинзберг, М. Х., и Тейлор, К. А. (2015). Структура интегрированного в мембрану интегрина полной длины, связанного с физиологическим лигандом. J. Biol. Chem. 290, 27168–27175. DOI: 10.1074 / jbc.m115.682377
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дас, С., Маджхи, П. Д., Аль-Муготир, М. Х., Рачагани, С., Сорген, П., и Батра, С. К. (2015). Расщепление MUC16 проксимальным мембранным эктодоменом происходит в подкисляющих компартментах Гольджи / пост-Гольджи. Sci. Отчет 5: 9759.
Google Scholar
Деберардини, Р. Дж., И Чандель, Н. С. (2020). Нам нужно поговорить об эффекте Варбурга. Nat. Метаб. 2, 127–129. DOI: 10.1038 / s42255-020-0172-2
CrossRef Полный текст | Google Scholar
Эбонг, Э. Э., Макалузо, Ф. П., Спрей, Д. К., Тарбелл, Дж. М. (2011). Визуализация эндотелиального гликокаликса in vitro с помощью просвечивающей электронной микроскопии с быстрым замораживанием / замещением замораживания. Arteriosc.Тромб. Васк. Биол. 31, 1908–1915. DOI: 10.1161 / atvbaha.111.225268
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фельдер М., Капур А., Гонсалес-Боске Дж., Хорибата С., Хайнц Дж., Альбрехт Р. и др. (2014). MUC16 (CA125): опухолевый биомаркер для лечения рака, работа в стадии разработки. Мол. Рак 13: 129. DOI: 10.1186 / 1476-4598-13-129
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Флориан Дж. А., Коски Дж.Р., Эйнсли, К., Панг, З. Ю., Дул, Р. О., и Тарбелл, Дж. М. (2003). Гепарансульфат протеогликан является механосенсором эндотелиальных клеток. Circul. Res. 93, E136 – E142.
Google Scholar
Формоза-Даг, К., Кастелайн, М., Мартин-Икен, Х., Дункер, К., Даг, Э. и Слетмун, М. (2018). Роль гликанов в бактериальной адгезии к поверхностям слизистых оболочек: как методы использования одной молекулы могут улучшить наше понимание? Микроорганизмы 6:39. DOI: 10.3390 / микроорганизмы6020039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фриман, С.A., Vega, A., Riedl, M., Collins, R.F., Ostrowski, P.P., Woods, E.C., et al. (2018). Трансмембранные пикеты соединяют цито- и перицеллюлярные скелеты, образуя барьеры для взаимодействия с рецепторами. Ячейка 172, 305–317.
Google Scholar
Фуртак В., Хэтчер Ф. и Очиенг Дж. (2001). Галектин-3 опосредует эндоцитоз интегринов бета-1 клетками карциномы молочной железы. Biochem. Биофиз. Res. Commun. 289, 845–850. DOI: 10.1006 / bbrc.2001.6064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ганьё, П., Эби, М., и Варки, А. (2015). «Эволюция гликанового разнообразия», в Essentials of Glycobiology , eds A. Varki, R. D. Cummings, J. D. Esko, P. Stanley, G. W. Hart, M. Aebi, et al. (Колд-Спринг-Харбор, Нью-Йорк: Лаборатория Колд-Спринг-Харбор Пресс).
Google Scholar
Ганди, Дж. Г., Кох, Д. Л., и Пашек, М. Дж. (2019). Равновесное моделирование механики и структуры гликокаликса рака. Biophys. J. 116, 694–708. DOI: 10.1016 / j.bpj.2018.12.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грей М., Станчак М. А., Сяо Х., Пийненборг Дж. Ф., Мантуано Н. Р., Малакер С. А. и др. (2019). Направленное десиалирование преодолевает гликоиммунные контрольные точки и усиливает противоопухолевый иммунный ответ in vivo. ChemRxiv. [Препринт]. ChemRxiv.8187146.v2.
Google Scholar
Громникова Р., Кая М., Ромеро И. А., Уильямс П., Сатчелл С., Шаррак Б. и др. (2016).Транспорт наночастиц золота эндотелием сосудов из различных тканей человека. Plos One 11: e0161610. DOI: 10.1371 / journal.pone.0161610
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hahm, H. S., Schlegel, M. K., Hurevich, M., Eller, S., Schuhmacher, F., Hofmann, J., et al. (2017). Автоматическая сборка гликанов с использованием синтезатора Glyconeer 2.1. Proc. Natl. Акад. Sci. США 114, E3385 – E3389.
Google Scholar
Хан, Л., и Костелло, К. Э. (2013). Масс-спектрометрия гликанов. Biochem. Моско. 78, 710–720.
Google Scholar
Harazono, Y., Kho, D.H., Balan, V., Nakajima, K., Zhang, T.P., Hogan, V., et al. (2014). Галектин-3 приводит к ослаблению апоптоза за счет гетеродимеризации Bax в клетках карциномы щитовидной железы человека. Oncotarget 5, 9992–10001.
Google Scholar
Хартманн, М., Линдхорст, Т. К. (2011). Бактериальный лектин fimh, мишень для открытия лекарств — углеводные ингибиторы бактериальной адгезии, опосредованной фимбриями 1 типа. Eur. J. Organ. Chem. 2011, 3583–3609. DOI: 10.1002 / ejoc.201100407
CrossRef Полный текст | Google Scholar
Hegermann, J., Lunsdorf, H., Ochs, M., and Haller, H. (2016). Визуализация гломерулярного эндотелиального гликокаликса с помощью электронной микроскопии с использованием катионного коллоидного диоксида тория. Histochem. Cell Biol. 145, 41–51. DOI: 10.1007 / s00418-015-1378-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хайден, М.Г. В., Кэнтли, Л. С., и Томпсон, К. Б. (2009). Понимание эффекта Варбурга: метаболические потребности пролиферации клеток. Наука 324, 1029–1033. DOI: 10.1126 / science.1160809
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Худак, Дж. Э., Кэнхэм, С. М., и Бертоцци, К. Р. (2014). Гликокаликс-инженерия раскрывает основанный на Siglec механизм иммуноэвазии NK-клеток. Nat. Chem. Биол. 10, 69 – U111.
Google Scholar
Имберти, А., Чабре, Ю. М., и Рой, Р. (2008). Гликомиметики и гликодендримеры как высокоаффинные микробные антиадгезины. Chem. Евро. J. 14, 7490–7499. DOI: 10.1002 / chem.200800700
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Якобсон К., Исихара А. и Инман Р. (1987). Боковая диффузия белков в мембранах. Ann. Rev. Physiol. 49, 163–175.
Google Scholar
Джандус, К., Болиган, К. Ф., Чидзиоке, О., Лю, Х., Dahlhaus, M., Demoulins, T., et al. (2014). Взаимодействие между рецепторами Siglec-7/9 и лигандами влияет на зависимый от NK-клеток иммунный надзор за опухолью. J. Clin. Расследование. 124, 1810–1820. DOI: 10.1172 / jci65899
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цзян, Х., Инглиш, Б. П., Хазан, Р. Б., Ву, П., и Оврин, Б. (2015). Отслеживание поверхностных гликанов на живых раковых клетках с одномолекулярной чувствительностью. Angew. Chem. Int. Эд. 54, 1765–1769.DOI: 10.1002 / anie.201407976
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Юнг, Ю. М., Ривен, И., Фейгельсон, С. В., Картвелишвили, Э., Тохья, К., Миясака, М., и др. (2016). Трехмерная локализация Т-клеточных рецепторов относительно микроворсинок с использованием комбинации микроскопов сверхвысокого разрешения. Proc. Natl. Акад. Sci. США 113, E5916 – E5924.
Google Scholar
Кепплер, О. Т., Стеллинг, П., Херрманн, М., Кайзер, Х., Grunow, D., Reutter, W., et al. (1995). Биосинтетическая модуляция зависимых от сиаловой кислоты взаимодействий вирус-рецептор двух вирусов полиомы приматов. J. Biol. Chem. 270, 1308–1314. DOI: 10.1074 / jbc.270.3.1308
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кох А., Пуарье Ф., Джейкоб Р. и Делакур Д. (2010). Галектин-3, новый ассоциированный с центросомами белок, необходимый для морфогенеза эпителия. Мол. Биол. Cell 21, 219–231. DOI: 10.1091 / mbc.e09-03-0193
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кольбе К., Велети С. К., Рейлинг Н. и Линдхорст Т. К. (2019). Лектины микобактерий туберкулеза — редко изучаемые белки. Beilst. J. Organ. Chem. 15, 1–15. DOI: 10.3762 / bjoc.15.1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Краснова, Л., Вонг, К. Х. (2016). Понимание химии и биологии гликозилирования с синтезом гликанов. Ann. Rev. Biochem. 85, 599–630. DOI: 10.1146 / annurev-biochem-060614-034420
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Куо, Дж. К. Х., Ганди, Дж. Г., Зия, Р. Н. и Пашек, М. Дж. (2018). Физическая биология гликокаликса раковых клеток. Nat. Phys. 14, 658–669. DOI: 10.1038 / s41567-018-0186-9
CrossRef Полный текст | Google Scholar
Кусуми А., Сако Ю. (1996). Организация клеточной поверхности мембранным скелетом. Curr. Opin. Cell Biol. 8, 566–574. DOI: 10.1016 / s0955-0674 (96) 80036-6
CrossRef Полный текст | Google Scholar
Лайне Р. А. (1994). Расчет всех возможных изомеров олигосахаридов, как разветвленных, так и линейных, дает 1,05×10 (12) структур для восстанавливающего гексасахарида — изомер-барьер для разработки систем секвенирования или синтеза сахаридов с помощью одного метода. Гликобиология 4, 759–767. DOI: 10.1093 / гликоб / 4.6.759
CrossRef Полный текст | Google Scholar
Лакшминараянан, А., Ричард М. и Дэвис Б. Г. (2018). Изучение гликобиологии на уровне отдельных молекул. Nat. Rev. Chem. 2, 148–159. DOI: 10.1038 / s41570-018-0019-5
CrossRef Полный текст | Google Scholar
Лау, К. С., Партридж, Э. А., Григорян, А., Сильвеску, К. И., Рейнхольд, В. Н., Деметриу, М., и др. (2007). Количество сложных N-гликанов и степень разветвления взаимодействуют, чтобы регулировать пролиферацию и дифференцировку клеток. Ячейка 129, 123–134. DOI: 10.1016 / j.cell.2007.01.049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ляубли, Х., Пирс, О. М. Т., Шварц, Ф., Сиддики, С. С., Дэн, Л. К., Станчак, М. А., и др. (2014). Вовлечение миеломоноцитарных сиглеков ассоциированными с опухолью лигандами модулирует врожденный иммунный ответ на рак. Proc. Natl. Акад. Sci. США 111, 14211–14216. DOI: 10.1073 / pnas.140
11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лафлин, С.Т., и Бертоцци, К. Р. (2007). Метаболическое мечение гликанов азидосахарами и последующее профилирование гликанов и визуализация с помощью лигирования по Штаудингеру. Nat. Protoc. 2, 2930–2944. DOI: 10.1038 / nprot.2007.422
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, А. Х. С., Ки, Х. П., Белл, Дж. А., Ходи, З., и Эллис, И. О. (2011). Карциномы груди с пограничным (2+) иммуногистохимическим анализом HER2: процент клеток с полным окрашиванием мембран на HER2 и частота амплификации HER2. J. Clin. Патол. 64, 490–492. DOI: 10.1136 / jcp.2011.089177
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леманн, Ф., Тиралонго, Э., и Тиралонго, Дж. (2006). Лектины, специфичные для сиаловой кислоты: возникновение, специфичность и функции. Cell. Мол. Life Sci. 63, 1331–1354. DOI: 10.1007 / s00018-005-5589-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Letschert, S., Gohler, A., Franke, C., Bertleff-Zieschang, N., Memmel, E., Doose, S., et al. (2014). Визуализация гликанов плазматической мембраны в сверхвысоком разрешении. Angew. Chem. Int. Эд. 53, 10921–10924. DOI: 10.1002 / anie.201406045
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линдхорст, Т. К. (2007). Основы химии и биохимии углеводов. Weinheim: Viley-VCH.
Google Scholar
Липовски, Х. Х. (2012). Эндотелиальный гликокаликс как барьер для адгезии лейкоцитов и его опосредование внеклеточными протеазами. Ann. Биомед. Англ. 40, 840–848. DOI: 10.1007 / s10439-011-0427-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Малакер С. А., Педрам К., Ферракейн М. Дж., Бенсинг Б. А., Кришнан В., Петт К. и др. (2019). Муцин-селективная протеаза StcE позволяет проводить молекулярный и функциональный анализ муцинов, связанных с раком человека. Proc. Natl. Акад. Sci. США, 116, 7278–7287. DOI: 10.1073 / pnas.1813020116
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Марино, К., Кости, Дж., Каттла, Дж. Дж., И Радд, П. М. (2010). Системный подход к анализу гликозилирования белков: путь через лабиринт. Nat. Chem. Биол. 6, 713–723. DOI: 10.1038 / nchembio.437
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Матросович М. Н., Матросович Т. Ю., Грей Т., Робертс Н. А., Кленк Х. Д. (2004). Нейраминидаза важна для инициации вирусной инфекции гриппа в эпителии дыхательных путей человека. J. Virol. 78, 12665–12667.DOI: 10.1128 / jvi.78.22.12665-12667.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mitchell, E., Houles, C., Sudakevitz, D., Wimmerova, M., Gautier, C., Perez, S., et al. (2002). Структурная основа олигосахаридной адгезии Pseudomonas aeruginosa в легких пациентов с муковисцидозом. Nat. Struct. Биол. 9, 918–921. DOI: 10.1038 / nsb865
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мёкль, Л., Хирн, С., Торрано, А.А., Уль, Б., Браухле, К., и Кромбах, Ф. (2017). Гликокаликс регулирует поглощение наночастиц эндотелиальными клетками человека in vitro. Наномедицина 12, 207–217. DOI: 10.2217 / nnm-2016-0332
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Möckl, L., Horst, A. K., Kolbe, K., Lindhorst, T. K., and Brauchle, C. (2015). Образование микродоменов контролирует пространственно-временную динамику гликопротеинов клеточной поверхности. Chembiochem 16, 2023–2028.DOI: 10.1002 / cbic.201500361
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Möckl, L., Lindhorst, T. K., and Brauchle, C. (2016). Искусственное формирование и настройка гликопротеиновых сетей на мембранах живых клеток: исследование отслеживания одной молекулы. Chemphyschem 17, 829–835. DOI: 10.1002 / cphc.201500809
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мёкль, Л., Педрам, К., Рой, А. Р., Кришнан, В., Густавссон, А. К., Дориго, О., и другие. (2019). Количественная микроскопия гликокаликса млекопитающих сверхвысокого разрешения. Dev. Cell 50, 57–72. DOI: 10.1016 / j.devcel.2019.04.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моран, Х., Кансел, Л. М., Майер, М. А., Кази, Х., Манн, Л. Л., и Тарбелл, Дж. М. (2019). Гликокаликс-протеогликан-глипикан-1 раковых клеток опосредует механотрансдукцию интерстициального потока для усиления миграции клеток и метастазирования. Биореология 56, 151–161.DOI: 10.3233 / бир-180203
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мормен, К. В., Таймейер, М., Нэрн, А. В. (2012). Гликозилирование белков позвоночных: разнообразие, синтез и функции. Nat. Rev. Mol. Cell Biol. 13, 448–462. DOI: 10.1038 / nrm3383
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ниламегхам, С., Аоки-Киношита, К., Болтон, Э., Франк, М., Лизачек, Ф., Люттеке, Т. и др. (2019). Обновления номенклатуры символов для рекомендаций по гликанам. Гликобиология 29, 620–624. DOI: 10.1093 / glycob / cwz045
CrossRef Полный текст | Google Scholar
Ниеминен, Дж., Куно, А., Хирабаяси, Дж., И Сато, С. (2007). Визуализация олигомеризации галектина-3 на поверхности нейтрофилов и эндотелиальных клеток с использованием резонансного переноса энергии флуоресценции. J. Biol. Chem. 282, 1374–1383. DOI: 10.1074 / jbc.m604506200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пахакис, М.Ю., Коски, Дж. Р., Дулл, Р. О., Тарбелл, Дж. М. (2007). Роль компонентов эндотелиального гликокаликса в механотрансдукции напряжения сдвига жидкости. Biochem. Биофиз. Res. Commun. 355, 228–233. DOI: 10.1016 / j.bbrc.2007.01.137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пан С., Чен Р., Эберсолд Р. и Брентнал Т. А. (2011). Гликопротеомика на основе масс-спектрометрии — с точки зрения протеомики. Мол. Клетка. Proteom. 10: R110.003251.
Google Scholar
Пашингер, К., Фабини, Г., Шустер, Д., Рендик, Д., и Уилсон, И. Б. Х. (2005). Определение иммуногенных углеводных эпитопов. Acta Biochim. Полон. 52, 629–632. DOI: 10.18388 / abp.2005_3422
CrossRef Полный текст | Google Scholar
Paszek, M.J., Dufort, C.C., Rossier, O., Bainer, R., Mouw, J.K., Godula, K., et al. (2014). Раковой гликокаликс механически стимулирует рост и выживание, опосредованные интегрином. Природа 511, 319–325. DOI: 10.1038 / природа13535
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паттон, С., Гендлер, С. Дж., И Спайсер, А. П. (1995). Эпителиальный муцин, MUC1, молока, молочной железы и других тканей. Biochim. Биофиз. Acta Rev. Biomembr. 1241, 407–423. DOI: 10.1016 / 0304-4157 (95) 00014-3
CrossRef Полный текст | Google Scholar
Полсон, Дж. К., Маколи, М. С., и Кавасаки, Н. (2012). Сиглекы как сенсоры «я» при врожденных и адаптивных иммунных реакциях. Гликобиол. Имму. Res. 1253, 37–48. DOI: 10.1111 / j.1749-6632.2011.06362.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кази, Х., Паломино, Р., Ши, З. Д., Манн, Л. Л., и Тарбелл, Дж. М. (2013). Гликокаликс раковых клеток опосредует механотрансдукцию и инвазию, регулируемую потоком. Интеграция. Биол. 5, 1334–1343. DOI: 10.1039 / c3ib40057c
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кази, Х., Ши, З.Д., Сонг, Дж. У., Кансел, Л. М., Хуанг, П., Цзэн, Ю. и др. (2016). Гепарансульфат-протеогликаны опосредуют метастазирование карциномы почек. Внутр. J. Cancer 139, 2791–2801. DOI: 10.1002 / ijc.30397
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рамирес-Вебер, Ф. А., и Корнберг, Т. Б. (1999). Цитонемы: клеточные процессы, которые проецируются в главный сигнальный центр в имагинальных дисках Drosophila . Cell 97, 599–607.
Google Scholar
Рем, М., Bruegger, D., Christ, F., Conzen, P., Thiel, M., Jacob, M., et al. (2007). Отторжение эндотелиального гликокаликса у пациентов, перенесших серьезную сосудистую операцию с глобальной и региональной ишемией. Тираж 116, 1896–1906. DOI: 10.1161 / cycleaha.106.684852
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Робертсон, Дж. Д. (1981). Структура мембраны. J. Cell Biol. 91: 189.
Google Scholar
Радд, П. М., Вормальд, М.R., Stanfield, R.L., Huang, M.D., Mattsson, N., Speir, J.A., et al. (1999). Роль гликозилирования рецепторов клеточной поверхности, участвующих в распознавании клеточного иммунитета. J. Mol. Биол. 293, 351–366. DOI: 10.1006 / jmbi.1999.3104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рюдигер, Х., и Габиус, Х. Дж. (2001). Лектины растений: возникновение, биохимия, функции и применение. Glycoconj. J. 18, 589–613.
Google Scholar
Рустом, А., Saffrich, R., Markovic, I., Walther, P., and Gerdes, H.H. (2004). Нанотубулярные магистрали для межклеточного транспорта органелл. Наука 303, 1007–1010. DOI: 10.1126 / science.10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скотт, А. М., Волчок, Дж. Д., и Олд, Л. Дж. (2012). Антитела терапия рака. Nat. Rev. Cancer 12, 278–287.
Google Scholar
Шалом-Фейерштейн, Р., Пахарь, С. Дж., Ротблат, Б., Ариотти, Н., Тиан, Т. Х., Хэнкок, Дж. Ф. и др. (2008). Нанокластеризация K-Ras нарушается сверхэкспрессией каркасного белка галектина-3. Cancer Res. 68, 6608–6616. DOI: 10.1158 / 0008-5472.can-08-1117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шурер, К. Р., Колвилл, М. Дж., Гупта, В. К., Хед, С. Е., Кай, Ф., Лакинс, Дж. Н. и др. (2018). Генетически закодированный набор инструментов для инженерии гликокаликса: настраиваемый контроль клеточной адгезии, выживаемости и поведения раковых клеток. ACS Biomater. Sci. Англ. 4, 388–399. DOI: 10.1021 / acsbiomaterials.7b00037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шурер, К. Р., Куо, Дж. К. Х., Робертс, Л. М., Ганди, Дж. Г., Колвилл, М. Дж., Эноки, Т. А. и др. (2019). Физические принципы регуляции формы мембраны гликокаликсом. Cell 177, 1757–1770.
Google Scholar
Смит Д. Ф. и Каммингс Р. Д. (2013). Применение микроматриц для расшифровки структуры и функции человеческого гликома. Мол. Клетка. Proteom. 12, 902–912. DOI: 10.1074 / mcp.r112.027110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Спиро, Р. Г. (2002). Гликозилирование белков: природа, распределение, ферментативное образование и влияние гликопептидных связей на заболевание. Гликобиология 12, 43r – 56r. DOI: 10.1093 / гликоб / 12.4.43r
CrossRef Полный текст | Google Scholar
Стэнли П. и Каммингс Р. (2015). «Структуры, общие для различных гликанов», в Essentials of Glycobiology , eds A.Варки, Р. Д. Каммингс, Дж. Д. Эско, П. Стэнли, Г. В. Харт, М. Эби и др. (Колд-Спринг-Харбор, Нью-Йорк: Лаборатория Колд-Спринг-Харбор Пресс).
Google Scholar
Ти, М. М., Тарбелл, Дж. М., Вайнбаум, С., и Спрей, Д. С. (2004). Роль гликокаликса в реорганизации актинового цитоскелета под действием напряжения сдвига жидкости: модель «бамперной машины». Proc. Natl. Акад. Sci. США 101, 16483–16488. DOI: 10.1073 / pnas.0407474101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уль, Б., Hirn, S., Immler, R., Mildner, K., Mockl, L., Sperandio, M., et al. (2017). Эндотелиальный гликокаликс контролирует взаимодействие квантовых точек с эндотелием и их перемещение через границу между кровью и тканью. ACS Nano 11, 1498–1508. DOI: 10.1021 / acsnano.6b06812
CrossRef Полный текст | Google Scholar
Варки А., Каммингс Р. Д., Эби М., Пакер Н. Х., Сибергер П. Х., Эско Дж. Д. и др. (2015). Номенклатура символов для графического представления гликанов. Гликобиология 25, 1323–1324.
Google Scholar
Фон Дицманн, А., Шехтман, Ю., Мёрнер, В. Э. (2017). Трехмерная локализация одиночных молекул для визуализации сверхвысокого разрешения и отслеживания одиночных частиц. Chem. Ред. 117, 7244–7275. DOI: 10.1021 / acs.chemrev.6b00629
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wang, Z., Chinoy, Z. S., Ambre, S. G., Peng, W. J., Mcbride, R., De Vries, R.P., et al.(2013). Общая стратегия химико-ферментативного синтеза асимметрично разветвленных н-гликанов. Наука 341, 379–383. DOI: 10.1126 / science.1236231
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вебер Т., Чандрасекаран В., Стамер И., Тайгесен М. Б., Терфорт А. и Линдхорст Т. К. (2014). Переключение бактериальной адгезии к гликозилированной поверхности за счет обратимой переориентации углеводного лиганда. Angew. Chem. Int. Эд. 53, 14583–14586.DOI: 10.1002 / anie.201409808
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уилан, Д. Р., Белл, Т. Д. М. (2015). Артефакты изображения в микроскопии локализации одиночных молекул: почему важна оптимизация протоколов пробоподготовки. Sci. Отчет 5: 7924.
Google Scholar
Вудс, Э. К., Кай, Ф., Барнс, Дж. М., Педрам, К., Пикап, М. У., Холландер, М. Дж. И др. (2017). Объемный гликокаликс способствует образованию метастазов, способствуя развитию клеточного цикла G1. eLife 6: e25752.
Google Scholar
Вудс, Э. К., Йи, Н. А., Шен, Дж., И Бертоцци, К. Р. (2015). Разработка гликокаликса с рециркулирующим гликополимером, который увеличивает выживаемость клеток in vivo. Angew. Chem. Int. Эд. 54, 15782–15788. DOI: 10.1002 / anie.201508783
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сяо, Х., Вудс, Э. К., Вукойчич, П., и Бертоцци, К. Р. (2016). Прецизионное редактирование гликокаликса как стратегия иммунотерапии рака. Proc. Natl. Акад. Sci. США 113, 10304–10309. DOI: 10.1073 / pnas.1608069113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Инь, Л., Харбанда, С., Куфе, Д. (2007). Онкопротеин муцина 1 блокирует индуцируемую гипоксией активацию фактора 1 альфа в ответ на гипоксию. J. Biol. Chem. 282, 257–266. DOI: 10.1074 / jbc.m610156200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цзэн Ю., Чжан Х.Ф., Фу, Б. М. М., Тарбелл, Дж. М. (2018). Роль эндотелиального поверхностного гликокаликса в механочувствительности и трансдукции. Мол. Клетка. Tissue Eng. Vascul. Syst. 1097, 1–27. DOI: 10.1007 / 978-3-319-96445-4_1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2.5A: Гликокаликс (капсулы) и биопленки
Полисахариды или полипептиды, связанные с бактериальным гликокаликсом или капсулой, действуют как антигены и инициируют адаптивный иммунитет. Антиген определяется как форма молекулы, которая реагирует с молекулами антител и рецепторами антигена на лимфоцитах.Мы признаем эти молекулярные формы чужеродными или отличными от молекулярных форм нашего тела, потому что они соответствуют определенным рецепторам антигена на наших В-лимфоцитах и Т-лимфоцитах, клетках, которые осуществляют адаптивный иммунитет.
Фактические части или фрагменты антигена, которые реагируют с антителами и рецепторами на В-лимфоцитах и Т-лимфоцитах, называются эпитопами. Эпитоп обычно представляет собой группу из 5-15 аминокислот уникальной формы, которая составляет часть белкового антигена, или 3-4 сахарных остатка, ответвляющихся от полисахаридного антигена.У одного микроорганизма есть сотни эпитопов различной формы, которые наши лимфоциты могут распознавать как чужеродные и противодействовать им.
Организм распознает антиген как чужеродный, когда эпитопы этого антигена связываются с В-лимфоцитами и Т-лимфоцитами посредством молекул эпитоп-специфических рецепторов, имеющих форму, комплементарную форме эпитопа. Рецептор эпитопа на поверхности B-лимфоцита называется рецептором B-клетки и фактически представляет собой молекулу антитела.Рецептор Т-лимфоцита называется рецептором Т-лимфоцитов (TCR).
Есть две основные ветви адаптивных иммунных ответов: гуморальный иммунитет и клеточно-опосредованный иммунитет.
1. Гуморальный иммунитет: Гуморальный иммунитет включает выработку молекул антител в ответ на антиген и опосредуется B-лимфоцитами. С помощью различных механизмов эти антитела способны удалять или нейтрализовать микроорганизмы и их токсины после связывания с их эпитопами. Например, антитела против капсульных антигенов могут прикреплять бактерии к фагоцитам — процесс, называемый опсонизацией.
2. Клеточно-опосредованный иммунитет. Клеточный иммунитет включает производство цитотоксических Т-лимфоцитов, активированных макрофагов, активированных NK-клеток и цитокинов в ответ на антиген и опосредуется Т-лимфоцитами. Эти защитные клетки помогают удалять инфицированные клетки и раковые клетки, демонстрирующие чужеродные эпитопы.
Адаптивный иммунитет будет обсуждаться более подробно в Разделе 6.
Биопленки
Многие патогенные бактерии, а также нормальная флора и многие бактерии окружающей среды образуют сложные бактериальные сообщества в виде биопленок.Биопленки — это группы бактерий, прикрепленных к поверхности и заключенных в общую секретируемую адгезивную матрицу, обычно полисахаридную по своей природе. Бактерии в биопленках часто могут общаться друг с другом с помощью процесса, называемого кворум-зондированием (обсуждается позже в Блоке 2), и могут взаимодействовать и адаптироваться к своей среде как популяция бактерий, а не как отдельные бактерии. Живя сообществом бактерий в виде биопленки, эти бактерии лучше способны:
- противостоять атакам антибиотиков;
- улавливают питательные вещества для роста бактерий и остаются в благоприятной нише;
- прилипают к окружающим поверхностям и сопротивляются смыванию;
- живут в тесной ассоциации и общаются с другими бактериями в биопленке; и
- сопротивляются фагоцитозу и атакам со стороны путей комплемента организма.
Таким образом, биопленки являются функциональными, взаимодействующими и растущими бактериальными сообществами. Биопленки даже содержат собственные водные каналы для доставки воды и питательных веществ по всему сообществу биопленок.
- Электронная микрофотография биопленки Haemophilus influenzae с сайта Biomedcentral.com
- Микрофотография биопленки с водными каналами из Центров по контролю и профилактике заболеваний Родни М. Донлан: «Биопленки: микробная жизнь на поверхности 65» Биопленка 909 Pseudomonas aeruginosa из лаборатории Ausubel, отделение молекулярной биологии, Массачусетская больница общего профиля
Чтобы инициировать образование биопленки, планктонные бактерии (отдельные бактерии, не находящиеся в биопленке) контактируют с поверхностью окружающей среды посредством подвижности или случайного столкновения.Затем эти планктонные бактерии прикрепляются к этой поверхности с помощью пилей или адгезинов клеточной стенки. Это прикрепление затем сигнализирует об экспрессии генов, участвующих в восприятии кворума и, в конечном итоге, в формировании биопленки. По мере того как матрица биопленки секретируется, подвижные бактерии теряют свои жгутики и становятся неподвижными.
Planktonic Pseudomonas aeruginosa , например, использует свой полярный жгутик, чтобы двигаться через воду или слизь и вступать в контакт с твердой поверхностью, такой как слизистые оболочки тела.Затем он может использовать пили и адгезины клеточной стенки для прикрепления к эпителиальным клеткам слизистой оболочки. Прикрепление активирует гены передачи сигналов и чувствительности кворума, чтобы в конечном итоге позволить популяции P. aeruginosa начать синтез полисахаридной биопленки, состоящей из альгината. По мере роста биопленки бактерии теряют свои жгутики, становятся неподвижными и выделяют различные ферменты, которые позволяют населению получать питательные вещества из клеток-хозяев. В конце концов, биопленка разрастается и развивает водные каналы, доставляя воду и питательные вещества ко всем бактериям в биопленке.Поскольку биопленка начинает становиться слишком переполненной бактериями, определение кворума позволяет некоторым из Pseudomonas снова производить жгутики, выходить из биопленки и колонизировать новое место (см. Фиг. 11A-11G).
Streptococcus mutans и Streptococcus sobrinus , две бактерии, участвующие в возникновении кариеса зубов, расщепляют сахарозу на глюкозу и фруктозу. Streptococcus mutans может использовать фермент, называемый декстрансахаридом, для преобразования сахарозы в липкий полисахарид, называемый декстраном, который образует биопленку, позволяющую бактериям прилипать к эмали зуба и образовывать зубной налет.Это будет обсуждаться более подробно позже в Блоке 2 в разделе «Бактериальная патогенность». S. mutans и S. sobrinus также ферментируют глюкозу для выработки энергии. Ферментация глюкозы приводит к образованию молочной кислоты, которая выделяется на поверхность зуба и вызывает кариес.
- Сканирующая электронная микрофотография Streptococcus , растущего в эмали зуба. © Ллойд Симонсон, автор. Лицензия на использование ASM MicrobeLibrary.
- Сканирующая электронная микрофотография зубного налета © Х. Бушер, Х. ван дер Мей, У. Йонгблоед, Р. Бос, авторы. Лицензия на использование ASM MicrobeLibrary.
- Сканирующая электронная микрофотография Staphylococcus aureus , образующего биопленку в постоянном катетере, любезно предоставлено CDC.
- Биопленка Staphylococcus aureus из Университета штата Монтана
Ряд биопленкообразующих бактерий, таких как уропатогенные Escherichia coli (UPEC), энтерогеморрагические E.coli (EHEC), видов Citrobacter , видов Salmonella и Mycobacterium tuberculosis способны продуцировать амилоидные волокна, которые могут играть роль в таких процессах, как прикрепление к клеткам-хозяевам, вторжение в клетки-хозяева и образование биопленок. Curli является примером такого амилоидного волокна, производимого UPEC и Salmonella .
Многие хронические и трудноизлечимые инфекции вызываются бактериями в биопленках. Внутри биопленок бактерии растут медленнее, демонстрируют иную экспрессию генов, чем свободные планктонные бактерии, и более устойчивы к антимикробным агентам, таким как антибиотики, из-за пониженной способности этих химикатов проникать в плотную матрицу биопленок.Биопленки участвуют в возникновении туберкулеза, камней в почках, инфекций, вызванных стафилококком, , болезни легионеров и заболеваний пародонта. Кроме того, по оценкам, до 10 миллионов человек в год в США могут заболеть инфекциями, связанными с биопленками, в результате инвазивных медицинских процедур и хирургических имплантатов.
YouTube Фильм и анимация: что такое биопленки? |
Статья в Medscape об инфекциях, связанных с организмами, упомянутыми в этом учебном объекте.Регистрация для доступа к этому сайту бесплатна.
5″> ВВЕДЕНИЕЭндотелий сосудов — самый большой орган в организме, образующий поверхность раздела между кровотоком и стенкой кровеносных сосудов. Он выстилает изнутри все кровеносные сосуды тела. Люминальная поверхность всех эндотелиальных клеток сосудов покрыта эндотелиальным гликокаликсом (eGCX), который включает связанные с мембраной отрицательно заряженные протеогликаны, гликопротеины, гликолипиды и гликозаминогликаны [1]. Он обеспечивает строительный блок, необходимый для прочного и функционального эндотелия сосудов.В течение последних нескольких лет потенциальные возможные патофизиологические роли eGCX были в центре внимания интенсивных исследований. Нарушение или дисфункция eGCX были связаны с болезненными состояниями, такими как диабет, хроническая болезнь почек (ХБП), воспалительные состояния, сепсис, гипернатриемия, гиперволемия и ишемия / реперфузионное повреждение. Кроме того, изменения в eGCX были связаны с ответами на лечение при таких состояниях, как сепсис. В этом обзоре мы обобщаем данные о структуре и функции eGCX, изменениях eGCX при различных состояниях болезней и вариантах лечения. Повреждение eGCx во время СД и других системных заболеваний, по-видимому, является ключевым фактором эндотелиальной дисфункции. Дополнительная идентификация факторов, регулирующих стабильность и восстановление eGCx в стрессовых условиях, и патофизиологические роли eGCx могут в конечном итоге привести к разработке новых диагностических и терапевтических стратегий для заболеваний, характеризующихся эндотелиальной дисфункцией или повреждением сосудов, включая ХБП. 9″> ЗАЯВЛЕНИЕ О КОНФЛИКТЕ ИНТЕРЕСОВНе объявлено. 1″ data-legacy-id=»REF1″> ССЫЛКИ1Reitsma S ,Slaaf DW ,Vink H et al.Эндотелиальный гликокаликс: состав, функции и визуализация .Pflugers Arch 2007 ;454 :345 —359 2Gouverneur M ,Spaan JAE ,Pannekoek H et al.Напряжение сдвига жидкости стимулирует включение гиалуронана в гликокаликс эндотелиальных клеток .Am J Physiol 2006 ;290 :h558 —h562 3Pries AR ,Secomb TW ,Gaehtgens P. Поверхностный слой эндотелия .Pflugers Arch 2000 ;440 :653 —666 4Липовски HH. Реология микрососудов и гемодинамика .Микроциркуляция 2005 ;12 :5 —15 5Haraldsson B ,Nystrom J ,Deen WM. Свойства клубочкового барьера и механизмы протеинурии .Physiol Rev 2008 ;88 :451 —487 6Gotte M. Syndecans в воспалении .FASEB J 2003 ;17 :575 —591 7Alphonsus CS ,Rodseth RN. Эндотелиальный гликокаликс: обзор сосудистого барьера .Анестезия 2014 ;69 :777 —784 8Pahakis MY ,Kosky JR ,Dull RO и др.Роль компонентов эндотелиального гликокаликса в механотрансдукции напряжения сдвига жидкости .Biochem Biophys Res Commun 2007 ;355 :228 —233 9Уиллер-Джонс CP ,Фаррар CE ,Питсиллиды AA. Нацеливание на гиалуронан эндотелиального гликокаликса для терапевтического вмешательства .Curr Opin Investigations Drugs 2010 ;11 :997 —1006 10van den Berg BM ,Nieuwdorp M ,Stroes ES et al.Гликокаликс и эндотелиальная (дис) функция: от мышей к человеку .Pharmacol Rep 2006 ;58 :75 —80 11Хаарен PMA ,VanBavel E ,Vink H и др.Модификация заряда эндотелиального поверхностного слоя модулирует барьер проницаемости изолированных мелких артерий брыжейки крысы .Am J Physiol 2005 ;289 :h3503 —h3507 12Chelazzi C ,Villa G ,Mancinelli P et al.Гликокаликс и вызванные сепсисом изменения сосудистой проницаемости .Crit Care 2015 ;19 :26 13Винк H ,Duling BR. Поверхностный слой эндотелия капилляров избирательно уменьшает объем распределения растворенных веществ в плазме .Am J Physiol Heart Circ Physiol 2000 ;278 :h385 —h389 14Vink H ,Constantinescu AA ,Spaan JA. Окисленные липопротеины разрушают поверхностный слой эндотелия: последствия для адгезии тромбоцитов и эндотелиальных клеток .Тираж 2000 ;101 :1500 —1502 15Ait-Oufella H ,Maury E ,Lehoux S и др.Эндотелий: физиологические функции и роль в недостаточности микроциркуляции при тяжелом сепсисе .Intensive Care Med 2010 ;36 :1286 —1298 16Mulivor AW ,Lipowsky HH. Роль гликокаликса в адгезии лейкоцитов и эндотелиальных клеток .Am J Physiol Heart Circ Physiol 2002 ;283 :h2282 —h2291 17Schmidt EP ,Yang Y ,Janssen WJ et al.Легочный эндотелиальный гликокаликс регулирует адгезию нейтрофилов и повреждение легких во время экспериментального сепсиса .Nat Med 2012 ;18 :1217 —1223 18Rubanyi GM ,Romero JC ,Vanhoutte PM. Высвобождение релаксирующего фактора эндотелия, вызванное потоком .Am J Physiol 1986 ;250 (6 Pt 2) :h2145 —h2149 19Burke-Gaffney A ,Evans TW. Чтобы мы не забыли эндотелиальный гликокаликс при сепсисе .Crit Care 2012 ;16 :121 20Флориан JA ,Kosky JR ,Ainslie K et al.Гепарансульфат протеогликан является механосенсором на эндотелиальных клетках .Circ Res 2003 ;93 :e136 —e142 21Shi Z-D ,Wang H ,Tarbell JM. Гепарансульфатные протеогликаны опосредуют механотрансдукцию интерстициального потока, регулируя экспрессию MMP-13 и подвижность клеток через FAK-ERK в 3D-коллагене .PLoS One 2011 ;6 :e15956 22Lee TC ,Long D ,Clarke R. Влияние перераспределения эндотелиального слоя гликокаликса на пороэластогидродинамику микрососудов .J Fluid Mech 2016 ;798 :812 —852 23Nieuwdorp M ,Mooij HL ,крона J et al.Повреждение эндотелиального гликокаликса совпадает с микроальбуминурией при диабете 1 типа .Диабет 2006 ;55 :1127 —1132 24Оберлейтнер H ,Peters W ,Куше-Вихрог K et al.Перегрузка солью повреждает гликокаликсный натриевый барьер эндотелия сосудов .Pflugers Arch 2011 ;462 :519 —528 25Рем M ,Haller M ,Orth V et al.Изменения объема крови и гематокрита во время острой предоперационной объемной нагрузки 5% -ным раствором альбумина или 6% -ным раствором гетакрахмала у пациентов перед радикальной гистерэктомией .Анестезиология 2001 ;95 :849 —856 26Влаху CA ,Lemkes BA ,Struijk DG et al.Повреждение эндотелиального гликокаликса у диализных больных .J Am Soc Nephrol 2012 ;23 :1900 —1908 27Padberg J-S ,Wiesinger A ,di Marco GS et al.Поражение эндотелиального гликокаликса при хронической болезни почек .Атеросклероз 2014 ;234 :335 —343 28Nieuwdorp M ,van Haeften TW ,Gouverneur MCLG et al.Потеря эндотелиального гликокаликса во время острой гипергликемии совпадает с эндотелиальной дисфункцией и активацией коагуляции in vivo .Диабет 2006 ;55 :480 —486 29Broekhuizen LN ,Lemkes BA ,Mooij HL et al.Влияние сулодексида на гликокаликс эндотелия и проницаемость сосудов у пациентов с сахарным диабетом 2 типа .Диабетология 2010 ;53 :2646 —2655 30Хади HAR ,Карр CS ,Аль Сувайди Дж .Эндотелиальная дисфункция: факторы риска сердечно-сосудистых заболеваний, терапия и исходы .Vasc Health Risk Manag 2005 ;1 :183 —198 31Sen N ,Ozlu MF ,Akgul EO et al.Повышенный уровень асимметричного диметиларгинина в плазме у пациентов с острым инфарктом миокарда как предиктор неблагоприятного прогноза и ангиографического нарушения реперфузии .Атеросклероз 2011 ;219 :304 —310 32Канбай M ,Afsar B ,Siriopol D и др.Эндостатин при хронической болезни почек: ассоциации с воспалением, сосудистыми аномалиями, сердечно-сосудистыми событиями и выживаемостью .Eur J Intern Med .2016 ;33 :81 —87 33Озкок A ,Озкок S ,Takir M et al.Уровни сывороточной гепараназы связаны с эндотелиальной дисфункцией у пациентов с синдромом обструктивного апноэ сна .Clin Respir J 2018 ;12 :1693 —1699 34Канбай M ,Afsar B ,Siriopol D и др.Актуальность мочевой кислоты и асимметричного диметиларгинина для моделирования прогнозирования сердечно-сосудистого риска у пациентов с хронической болезнью почек .Инт Урол Нефрол 2016 ;48 :1129 —1136 35Канбай M ,Yilmaz MI ,Sonmez A и др.Сывороточная мочевая кислота независимо предсказывает сердечно-сосудистые события при запущенной нефропатии .Am J Nephrol 2012 ;36 :324 —331 36Канбай M ,Yilmaz MI ,Sonmez A и др.Уровень мочевой кислоты в сыворотке и эндотелиальная дисфункция у пациентов с недиабетической хронической болезнью почек .Am J Nephrol 2011 ;33 :298 —304 37Aciksari G ,Kavas M ,Atici A et al.Уровни эндокана и эндотелиальная дисфункция у пациентов с саркоидозом .Ангиология 2018 ;69 :878 —883 38Dogne S ,Flamion B ,Caron N. Эндотелиальный гликокаликс как защита от диабетических сосудистых осложнений: участие гиалуронана и гиалуронидазы .Артериосклер Тромб Васк Биол 2018 ;38 :1427 —1439 39Perrin RM ,Harper SJ ,Bates DO. Роль эндотелиального гликокаликса в регуляции проницаемости микрососудов при сахарном диабете .Cell Biochem Biophys 2007 ;49 :65 —72 40Генри CB ,Duling BR. TNF-α увеличивает проникновение макромолекул в гликокаликс эндотелиальных клеток просвета .Am J Physiol Heart Circ Physiol 2000 ;279 :h3815 —h3823 41Nelson A ,Berkestedt I ,Schmidtchen A et al.Повышенный уровень гликозаминогликанов во время септического шока: связь со смертностью и антибактериальным действием плазмы .Ударная 2008 ;30 :623 —627 42Рамнат R ,Foster RR ,Qiu Y и др.Опосредованное матриксной металлопротеиназой 9 отложение синдекана 4 в ответ на фактор некроза опухоли альфа: участник дисфункции гликокаликса эндотелиальных клеток .FASEB J 2014 ;28 :4686 —4899 43Лукаш A ,Hillgruber C ,Oberleithner H et al.Распад эндотелиального гликокаликса опосредуется ангиопоэтином-2 .Cardiovasc Res 2017 ;113 :671 —680 44Schott U ,Solomon C ,Fries D et al.Эндотелиальный гликокаликс и его разрушение, защита и регенерация: повествовательный обзор .Scand J Trauma Resusc Emerg Med 2016 ;24 :48 45Becker BF ,Chappell D ,Bruegger D et al.Терапевтические стратегии, направленные на эндотелиальный гликокаликс: острый дефицит, но большой потенциал .Cardiovasc Res 2010 ;87 :300 —310 46Martin L ,Koczera P ,Zechendorf E et al.Эндотелиальный гликокаликс: новые диагностические и терапевтические подходы при сепсисе .BioMed Res Int 2016 ;2016 :8 47Caironi P ,Tognoni G ,Masson S et al.Замена альбумина у пациентов с тяжелым сепсисом или септическим шоком .N Engl J Med 2014 ;370 :1412 —1421 48лира A ,Пинский MR. Выбор типа и объема жидкости во время реанимации: влияние на результаты лечения пациентов .Ann Intensive Care 2014 ;4 :38 49Nieuwdorp M ,Meuwese MC ,Vink H et al.Эндотелиальный гликокаликс: потенциальный барьер между здоровьем и сосудистыми заболеваниями .Curr Opin Lipidol 2005 ;16 :507 —511 50Mitra R ,O’Neil GL ,Harding IC et al.Гликокаликс в функции эндотелия, связанной с атеросклерозом, и в качестве терапевтической мишени .Curr Atheroscler Rep 2017 ;19 :63 51Chappell D ,Jacob M ,Hofmann-Kiefer K et al.Антитромбин снижает отхождение эндотелиального гликокаликса после ишемии / реперфузии .Cardiovasc Res 2009 ;83 :388 —396 52Meuwese M ,Mooij L ,Nieuwdorp H et al.Частичное восстановление эндотелиального гликокаликса после терапии розувастатином у пациентов с гетерозиготной семейной гиперхолестеринемией .J Lipid Res 2009 ;50 :148 —153 53Mennander AA ,Shalaby A ,Oksala N et al.Диазоксид может защитить целостность эндотелиального гликокаликса во время аортокоронарного шунтирования .Scand Cardiovasc J 2012 ;46 :339 —344 54Nagasu H ,Satoh M ,Yorimitsu D et al.Сравнение комбинированной терапии олмесартаном и азелнидипином или гидрохлоротиазидом при повреждении почек и сосудов у крыс SHR / NDmcr-cp .Kidney Blood Press Res 2011 ;34 :87 —96 55Yilmaz MI ,Sonmez A ,Saglam M и др.Продольный анализ сосудистой функции и биомаркеров метаболических нарушений костей до и после трансплантации почки .Am J Nephrol 2013 ;37 :126 —134 56Ресио-Майорал A ,Banerjee D ,Streather C et al.Эндотелиальная дисфункция, воспаление и атеросклероз при хроническом заболевании почек: перекрестное исследование пациентов с преддиализом, диализом и трансплантацией почки .Атеросклероз 2011 ;216 :446 —451 57Офлаз H ,Туркменский A ,Тургут F и др.Изменения функции эндотелия до и после трансплантации почки .Transplant Int 2006 ;19 :333 —337 58Kocak H ,Ceken K ,Yavuz A et al.Влияние трансплантации почки на функцию эндотелия у пациентов, находящихся на гемодиализе .Циферблат нефрола 2006 ;21 :203 —207 59Дейн MJC ,Хайрун M ,Ли DH и др.Связь функции почек с изменениями поверхностного слоя эндотелия .Clin J Am Soc Nephrol 2014 ;9 :698 —704 60Харальдссон BS. Эндотелий как часть интегративного гломерулярного барьерного комплекса .Kidney Int 2014 ;85 :8 —11 61Oltean S ,Qiu Y ,Ferguson JK et al.Фактор роста эндотелия сосудов-A165b является защитным и восстанавливает эндотелиальный гликокаликс при диабетической нефропатии .J Am Soc Nephrol 2015 ;26 :1889 —1904 62Перес-Гомес MV ,Санчес-Ниньо MD ,Sanz AB et al.Противодействие воспалению при диабетической болезни почек: ранние клинические испытания .Заключение эксперта по исследованию наркотиков 2016 ;25 :1045 —1058 63Boels MGS ,Koudijs A ,Avramut MC et al.Системное ингибирование хемотаксического белка-1 моноцитов изменяет почечные макрофаги и восстанавливает гликокаликс эндотелия клубочков и барьерную функцию при диабетической нефропатии .Am J Pathol 2017 ;187 :2430 —2340 64Boels MGS ,Avramut MC ,Koudijs A и др.Атрасентан снижает альбуминурию за счет восстановления барьера гломерулярного эндотелия гликокаликса при диабетической нефропатии .Диабет 2016 ;65 :2429 —2439 65Рем M ,Bruegger D ,Christ F et al.Отделение эндотелиального гликокаликса у пациентов, перенесших серьезную сосудистую операцию с глобальной и региональной ишемией .Тираж 2007 ;116 :1896 —1906 66Snoeijs MG ,Vink H ,Voesten N et al.Острое ишемическое повреждение микрососудов почек при трансплантации почки человеку .Am J Physiol 2010 ;299 :F1134 —F1140 67Jeansson M ,Haraldsson B. Морфологические и функциональные доказательства важной роли гликокаликса эндотелиальных клеток в гломерулярном барьере .Am J Physiol Renal Physiol 2006 ;290 :F111 —F116 68Obeidat M ,Obeidat M ,Ballermann BJ. Эндотелий клубочков: пористое сито и грозный барьер .Exp Cell Res 2012 ;318 :964 —972 69Влаху CA ,Лопес Баррето D ,Struijk DG et al.Связан ли системный эндотелиальный гликокаликс микрососудов у пациентов на перитонеальном диализе с перитонеальным транспортом? Nephron Clin Pract 2014 ;128 :159 —165 70Ortiz A ,Wieslander A ,Linden T и др.3,4-DGE важен для побочных эффектов при перитонеальном диализе, а также его роль при диабете .Curr Med Chem 2006 ;13 :2695 —1702 71Сантамария B ,Ucero AC ,Reyero A et al.3,4-дидезоксиглюкозон-3-ен как медиатор перитонеальной демезотелизации .Циферблат нефрола 2008 ;23 :3307 —3015 72Adamson RH ,Clough G. Белки плазмы модифицируют гликокаликс эндотелиальных клеток мезентериальных микрососудов лягушки .J Physiol 1992 ;445 :473 —486 73Карри F-RE ,Adamson RH. Сфингозин-1-фосфат и «эффект альбумина» на венулярные микрососуды крыс .FASEB J 2013 ;27 (1 дополнение) :896 74Zeng Y ,Adamson RH ,Curry FR et al.Сфингозин-1-фосфат защищает эндотелиальный гликокаликс, ингибируя выделение синдекана-1 .Am J Physiol Heart Circ Physiol 2014 ;306 :h463 —h472 75Rahbar E ,Cardenas JC ,Baimukanova G et al.Эндотелиальный гликокаликс и проницаемость сосудов у пациентов с тяжелыми травмами .J Transl Med 2015 ;13 :117 76Garsen M ,Lenoir O ,Rops ALWMM et al.Эндотелин-1 вызывает протеинурию за счет гепараназного нарушения гликокаликса клубочков .J Am Soc Nephrol 2016 ;27 :3545 —3551 77Satchell SC ,Tooke JE. Каков механизм микроальбуминурии при диабете: роль эндотелия клубочков? Диабетология 2008 ;51 :714 —725 78Satchell S. Роль эндотелия клубочков в обработке альбумина .Nat Rev Nephrol 2013 ;9 :717 79Desideri S ,Лук KL ,Qiu Y et al.Новый анализ обеспечивает чувствительное измерение физиологически значимых изменений проницаемости альбумина в изолированных клубочках человека и грызунов .Почки Int 2018 ;93 :1086 —1097 80Лосось AHJ ,Ferguson JK ,Burford JL et al.Потеря эндотелиального гликокаликса связывает альбуминурию и сосудистую дисфункцию .J Am Soc Nephrol 2012 ;23 :1339 —1350 81Оберлейтнер H. Два барьера для натрия в эндотелии сосудов? Ann Med 2012 ;44 (Дополнение 1):S143 —S148 82Оберлейтнер H. Натрий-селективный гликокаликс эритроцитов и солевая чувствительность у человека .Архив Пфлюгерса 2015 ;467 :1319 —1325 83Siegel G ,Walter A ,Kauschmann A et al.Анионные биополимеры как датчики кровотока .Biosens Bioelectron 1996 ;11 :281 —294 84Оберлейтнер H ,Riethmuller C ,Schillers H et al.Натрий в плазме укрепляет эндотелий сосудов и снижает выброс оксида азота .Proc Natl Acad Sci USA 2007 ;104 :16281 —16286 85Куше-Вихрог K ,Schmitz B ,Марка E. Соль контролирует фенотип эндотелия и сосудов .Pflugers Arch 2015 ;467 :499 —512 86Доэрти M ,Багги DJ. Интраоперационные жидкости: сколько — это много? Br J Anaesth 2012 ;109 :69 —79 87Chappell D ,Bruegger D ,Potzel J et al.Гиперволемия увеличивает высвобождение предсердного натрийуретического пептида и высвобождение эндотелиального гликокаликса .Crit Care 2014 ;18 :538 88Bruegger D ,Schwartz L ,Chappell D et al.Выделение предсердного натрийуретического пептида предшествует отщеплению эндотелиального гликокаликса в равной степени у пациентов, перенесших операцию коронарного шунтирования с включенной и выключенной помпой .Basic Res Cardiol 2011 ;106 :1111 —1121 89Bruegger D ,Jacob M ,Rehm M et al.Предсердный натрийуретический пептид вызывает выделение эндотелиального гликокаликса в коронарном сосудистом русле сердца морских свинок .Am J Physiol Heart Circ Physiol 2005 ;289 :h2993 —h2999 90Guidet B ,Ait-Oufella H. Жидкая реанимация должна учитывать слой эндотелиального гликокаликса .Crit Care 2014 ;18 :707 91Вальдшнеп TE. Объем плазмы, отек тканей и стационарный принцип Старлинга .BJA Education 2017 ;17 :74 —78 92Zazzeron L ,Gattinoni L ,Caironi P. Роль альбумина, крахмала и желатина по сравнению с кристаллоидами в объемной реанимации тяжелобольных пациентов .Curr Opin Crit Care 2016 ;22 :428 —436 93Вальдшнеп TE ,Вальдшнеп TM. Пересмотренное уравнение Старлинга и гликокаликсная модель трансваскулярного обмена жидкости: улучшенная парадигма для назначения внутривенной инфузионной терапии .Br J Anaesth 2012 ;108 :384 —394 94Potter DR ,Jiang J ,Damiano ER. Время восстановления гликокаликса эндотелиальных клеток in vivo и его значение in vitro .Circ Res 2009 ;104 :1318 —1125 95Tarbell JM ,Отмена LM. Гликокаликс и его значение в медицине человека .J Intern Med 2016 ;280 :97 —113 96Перес-Гомес M ,Санчес-Ниньо M ,Sanz A et al.Horizon 2020 при диабетической болезни почек: конвейер клинических испытаний дополнительных методов лечения в дополнение к блокаде ренин-ангиотензиновой системы .J Clin Med 2015 ;4 :1325 —1347 97Li T ,Liu X ,Zhao Z et al.Сулодексид восстанавливает эндотелиальную функцию посредством реконструкции гликокаликса в модели сонной артерии крысы, поврежденной баллоном.Oncotarget 2017 ;8 : — 98Song JW ,Zullo JA ,Liveris D и др.Лечебное восстановление эндотелиального гликокаликса при сепсисе .J Pharmacol Experimental Therapeutics 2017 ;361 :115 —121 99Jacob M ,Paul O ,Mehringer L et al.Увеличение альбумина улучшает состояние сердца морской свинки после 4 часов холодной ишемии .Трансплантация 2009 ;87 :956 —965 100Адамсон RH ,Clark JF ,Радева M и др.Альбумин модулирует доставку S1P из красных кровяных телец в перфузируемых микрососудах: механизм действия белка .Am J Physiol 2014 ;306 :h2011 —h2017 101Zeng Y ,Adamson RH ,Curry F-RE et al.Сфингозин-1-фосфат защищает эндотелиальный гликокаликс, ингибируя выделение синдекана-1 .Am J Physiol 2014 ;306 :h463 —h472 102Haywood-Watson RJ ,Holcomb JB et al.Модуляция выделения синдекана-1 после геморрагического шока и реанимации .PLoS One 2011 ;6 :e23530 103Chappell D ,Jacob M ,Hofmann-Kiefer K et al.Гидрокортизон сохраняет сосудистый барьер, защищая эндотелиальный гликокаликс .Анестезиология 2007 ;107 :776 —84 104Chappell D ,Hofmann-Kiefer K ,Jacob M et al.TNF-α-индуцированное отторжение эндотелиального гликокаликса предотвращается гидрокортизоном и антитромбином .Basic Res Cardiol 2009 ;104 :78 —89 © Автор (ы) 2019.Опубликовано Oxford University Press от имени ERA-EDTA. Это статья в открытом доступе, распространяемая в соответствии с условиями некоммерческой лицензии Creative Commons Attribution (http://creativecommons.org/licenses/by-nc/4.0/), которая разрешает некоммерческое повторное использование, распространение, и воспроизведение на любом носителе при условии правильного цитирования оригинала. По вопросам коммерческого повторного использования обращайтесь по адресу [email protected].Функции эндотелиального гликокаликса и их влияние на результаты пациентов в периоперационный период.Обзор современных методов оценки структурно-функциональных отношений в гликокаликсе как в фундаментальных исследованиях, так и в клинических условияхПервый онлайн: AbstractГликокаликс устанавливает разницу осмотического давления белков плазмы на стенке сосудов и играет важную роль в определении распределения инфузионных жидкостей как в нормальных, так и в клинических условиях.Потеря гликокаликса нарушает удержание введенной жидкости в объеме плазмы. На основе результатов улучшенных подходов к сохранению и отображению структур гликокаликса, а также количественных оценок взаимодействия воды и эритроцитов с компонентами гликокаликса, гликокаликс теперь лучше всего понимать как волокнистые сети с различным составом в трехмерной структуре: квази- периодический внутренний матрикс, связанный с мембраной эндотелиальной клетки, который образует барьер проницаемости, и более пористую внешнюю область, состав которой изменяется с расстоянием от эндотелиальной мембраны и который определяет гемодинамику эритроцитов.В этой главе объясняется, почему общая концепция, согласно которой изменения толщины слоев гликокаликса, простирающиеся более чем на 0,5 микрона от поверхности эндотелия, могут использоваться в качестве биомаркеров функции гликокаликса, должна быть тщательно оценена. В нем представлен подробный анализ двух современных подходов к измерению функции гликокаликса в клинических условиях: (1) измерение объема гликокаликса как разницы между объемами распределения эритроцитов и макромолекулярных индикаторов; и (2) прямая визуализация изменений проникновения эритроцитов в бесклеточный слой на стенках подъязычных микрососудов.Метод 1 переоценивает объем гликокаликса, поскольку предполагает, что концентрации индикаторов в гликокаликсе и плазме одинаковы, а также предполагает, что гематокрит большого сосуда обеспечивает беспристрастную оценку объема плазмы во всем кровообращении. Метод 2, по-видимому, характеризует некоторую дисфункцию микрососудов, но игнорирует различия в пористости между внутренним и внешним слоями гликокаликса и роль изменений в механике эритроцитов, независимо от гликокаликса, в влиянии на проникновение в бесклеточный слой.Выявив эти ограничения, глава должна обеспечить основу для переоценки представлений о распределении инфузионных жидкостей внутри и через гликокаликс во время периоперационной инфузионной терапии, поощрить дальнейшее совершенствование этих и аналогичных методов и позволить сравнения с аналитическими подходами для измерения накопления жидкости. специфические компоненты гликокаликса в плазме и моче как биомаркеры функции гликокаликса. Основываясь на принципах, изложенных в этой главе, в окончательном резюме рассматриваются некоторые из часто задаваемых вопросов о функции гликокаликса и балансе жидкости, которые могут возникнуть во время периоперационной инфузионной терапии. Ключевые словаGlycocalyx Структура-функция Glycocalyx Объем гликокаликса Трехмерная реконструкция гликокаликса Визуализация темного поля в боковом потоке Пересмотренный Принцип Старлинга Состав гликокаликса Электронная микроскопия гликокаликсаЭто предварительный просмотр содержимого подписки, войдите в, чтобы проверить доступ. ПримечанияБлагодарностьKPA выражает признательность British Heart Foundation (PG / 15/37/31438) и Программе стипендий Bizkaia Talent Fellowship (AYD-000-256). СсылкиИнформация об авторских правах© Springer International Publishing Switzerland 2016 Авторы и аффилированные лицаНаноархитектура и динамика энтеросолюбильного гликокаликса мыши исследованы с помощью свободного электронного томографического травления. микроскопияГликокаликс состоит из сети столбчатых нитейКишечный эпителий представляет собой одноклеточный слой, выстилающий весь просвет желудочно-кишечного тракта.В тонком кишечнике он свернут в ворсинки, выступы, которые служат для увеличения площади абсорбирующей поверхности слизистой оболочки (рис. 1а). Эпителиальный слой состоит преимущественно из столбчатых эпителиальных клеток (энтероцитов), апикальная поверхность которых покрыта микроворсинками (рис. 1а), выступами на основе актина, которые дополнительно увеличивают абсорбирующую поверхность в десять раз 30 и все вместе известны как щеточная кайма. Гликокаликс образует слой на поверхности микровилл (рис. 1а). Фиг.1: Кишечный гликокаликс образует однородный трансцеллюлярный слой, покрывающий богатую микроворсинками щеточную кайму.a Схема просвета тонкой кишки, извитой из ворсинок. Крупный план энтероцита, показывающий слой гликокаликса над его микроворсинками. b , c Криосрезы тонкого кишечника мыши были помечены иммуномечением (вверху) флуоресцентно меченным WGA (зеленый) и (внизу) человеческим анти-MUC17 (зеленый), чтобы выделить гликокаликсовый умывальник над богатой актином щеточной каймой ( пурпурный). d Электронная микрофотография реплики тонкого кишечника мыши после травления методом замораживания, показывающая многослойную организацию богатой микроворсинками щеточной каймы и слоев гликокаликса. e Крупным планом вид апикальной области энтероцита, показывающий гликокаликс, отделяющий микроворсинки щеточной каймы от просвета кишечника. f Более сильное увеличение микроворсинок, выделяющих нити гликокаликса, выходящие из дистальных концов микровилл. На этой панели также показаны пузырьки (стрелка) и глобулярная структура (наконечник стрелки), встроенные в сеть гликокаликса. г Изображение незакрепленного образца подтверждает сеть гликокаликса, выходящую из кончиков микровилл. Нити гликокаликса выходят из кончиков микроворсинок и их можно отличить от боковых связей между микроворсинками (наконечники стрелок). h Один томографический срез 2 нм через кончик микроворсинки, показывающий, что столбчатые нити выходят из мембраны (стрелка), что соответствует трансмембранному муцину. Масштабные линейки: b , c = 2 мкм; d = 1 мкм; e = 500 нм; f , h = 100 нм; г = 50 нм. Чтобы сначала убедиться в сохранении и непрерывности гликокаликса в нашем препарате, мы исследовали срезы криостата тонкой кишки взрослой мыши, меченные флуоресцентно меченным агглютинином зародышей пшеницы (WGA), который может связывать сиаловую кислоту и N -ацетилглюкозаминильные фрагменты 31 , которые, как известно, украшают богатые пролином, треонином и серином домены, обнаруженные в муцинах 32 . Мы наблюдали иммунореактивность WGA непосредственно над щеточной каймой, идентифицированной фаллоидиновым мечением актина (рис.1б). Мы также пометили срезы антителом против консервативного домена SEA (белок спермы, энтерокиназа и домен агрина) человеческого MUC17. Предполагается, что это антитело метит MUC3 мыши (структурный гомолог MUC17 человека) 33 и, вероятно, будет связывать другие муцины, содержащие домен SEA 19 . Иммунореактивность MUC17 показала тот же образец мечения, что и WGA, состоящий из непрерывного слоя над краем кисти (фиг. 1c). Затем мы исследовали реплики замораживания-травления апикальной поверхности тонкого кишечника мыши, чтобы визуализировать ультраструктурные детали кишечного гликокаликса (рис.1д – з). Процедура глубокого травления включает этап фиксации и промывание ткани дистиллированной водой для удаления любых растворимых компонентов (соли и небольших молекул), которые могут покрывать поверхностные структуры при сублимации воды. Низкое увеличение реплик замораживанием-травлением показывает, что гликокаликс на поверхности щеточной каймы образует непрерывный (рис. 1d), трансцеллюлярный слой без границ между клетками (дополнительный рис. 1), соответствующий окрашиванию муцина. Слой имел равномерную толщину 1.0 ± 0,1 мкм ( n = 53), что было сопоставимо с длиной микроворсинок (1,02 ± 0,05 мкм, n = 23) и состояло из плотно переплетенных столбчатых нитей (рис. 1e). Множественные филаменты гликокаликса выходят специфически из дистальных концов или кончиков отдельных микроворсинок и почти сразу же образуют латеральные взаимодействия, в том числе с филаментами, выходящими из соседних микроворсинок (Fig. 1f and Supplementary Fig. 1a). В то время как большинство нитей, по-видимому, сливаются, образуя сеть гликокаликса микронной длины и, вероятно, состоят из длинных муцинов, мы не можем исключить, что некоторые из нитей, выходящих из кончиков микроворсинок, соответствуют более коротким трансмембранным муцинам (дополнительный рис.1а). Чтобы убедиться, что столбчатые нити и их латеральные взаимодействия не являются артефактами этапа фиксации до замораживания, мы также выполнили прямое замораживание и глубокое травление в незафиксированной ткани. В этом случае, в то время как волокна и поверхностные структуры слегка скрыты растворимыми компонентами, которые остаются после травления льда, волокна гликокаликса и их латеральные взаимодействия (рис. 1g) были сопоставимы с наблюдаемыми в фиксированных тканях (рис. 1f). ). Рисунок 1f также подчеркивает четкое различие между звеньями 34 между микроворсинками и филаментами гликокаликса, которые выходят исключительно из кончика каждой микроворсинки.Плотность нитей затрудняла определение точного количества нитей на кончик микровиллара. Среднее количество нитей, выходящих из кончиков микроворсинок, составляло 7 ± 1,5 ( n = 54) при подсчете из поперечных трещин замораживания-травления, которые проходят непосредственно над микроворсинками, и 6,7 ± 2 ( n = 22 микроворсинки) при подсчете количество нитей, которые можно было визуализировать, выходящих из кончиков на боковых проекциях микроворсинок. Эти значения, вероятно, занижают количество муцинов из-за слияния нитей.Хотя сеть гликокаликса казалась в значительной степени лишенной нефиламентозных структур, иногда мы наблюдали гранулярные структуры размером 20-50 нм (рис. 1f, стрелка) и везикулы 50-120 нм, встроенные в матрикс гликокаликса (рис. 1f, стрелка), с размерами диаметром 50–120 нм. Природу и состав этих структур невозможно определить по изображениям, полученным методом замораживания. Некоторые из структур могут соответствовать более крупным экзосомам или пузырькам, которые, как сообщается, происходят или выделяются из кончиков микроворсинок 35 . Нити гликокаликса образуют зигзагообразные боковые контактыДалее мы проанализировали латеральные взаимодействия между нитями гликокаликса в трехмерном пространстве. Нити, выходящие из кончиков микровилл, продолжали формировать переплетающуюся трехмерную сетку, что видно как на обычных проекционных проекциях реплик замораживания-травления (рис. 2a), так и на реконструированных томограммах полного объема, сегментированных для визуализации организации сети гликокаликса (рис. 2b). ). Сложные зигзагообразные контакты между нитями дают нерегулярную и сложную трехмерную сетку.Чтобы оценить размер ячейки или поры в сети, мы измерили максимальное расстояние между волокнами, очерчивая случайно выбранные открытые пространства в 3D-сети (рис. 2c). Среднее максимальное расстояние между соседними нитями составляло 29 ± 10 нм ( n = 101; получено из двух изображений вида сбоку нитей гликокаликса размером 6 × 1,5 и 5 × 1,5 мкм). Качественно оказалось, что межфиламентные контакты чаще встречаются в середине слоя гликокаликса, чем на концах просвета или микровилл (дополнительный рис.2), а размер ячейки в этой средней области был относительно меньше. На срезах томограммы и трехмерных изображениях мы наблюдали, как волокна сходятся и отделяются друг от друга, образуя сложные кабели разного диаметра (рис. 2d – f). В некоторых случаях боковые контакты между двумя соседними нитями показали узкий зазор (рис. 2e), в то время как в других разделение не могло быть устранено даже путем поворота трехмерных изображений томограмм (дополнительный рис. 3). Рис. 2: Гликокаликс образован трехмерной сетью столбчатых нитей, образующих боковые контакты.a Электронная микрофотография, сфокусированная на сложной сети нитей, как показано на рис. 1e, которые составляют слой гликокаликса. b Сегментация томографического объема трехмерной сети. c Распределение размера пор между нитями. Среднее значение = 29 ± 10 нм, n = 101. d — g Томограммы, показывающие отчетливые взаимодействия между нитями. e Последовательные томографические срезы, показывающие боковой контакт (стрелки) между соседними нитями. f Последовательные томографические срезы, показывающие контакт без разрешимого разделения между нитями. г Томограмма среза поперечного сечения нити, показывающая платиновое покрытие (серое на левой панели, золото на правой панели), покрывающее сегментированную нить (выделено синим). ч Распределение толщины нити после учета платинового покрытия. Среднее значение = 5,3 ± 1,3 нм, n = 51. i Локальный изгиб (стрелки) отдельных нитей вызывает коробление соседних сегментов сети, что свидетельствует о том, что волокна находятся под напряжением. j Последовательные срезы, показывающие квазипериодическую субструктуру (стрелки) на поверхности реплики, покрывающей нить, а также в полой сердцевине (синий цвет), которая очерчивает фактическую топографию нити (стрелки). Полоса: a 200 нм; d — g , i , j 20 нм. Сегментация нитей гликокаликсаТочность реплик замораживания-травления характерно ограничивается зернистостью и толщиной платиновой / углеродной пленки, нанесенной на замороженную биологическую поверхность 36,37,38 .Реплика образует литой структуру на поверхности гликопротеинов, с изображениями реплик, показывающими покрытие платина / углерод, а не реальную структуру нитей. Чтобы частично преодолеть это внутреннее ограничение реплик замораживающего травления, мы сегментировали отпечаток филамента, оставшийся на реплике (пустое пространство, оставшееся после переваривания ткани) на реконструированных томограммах (рис. 2g, синим цветом выделены волокна и их контакты; золото выделяет реплику литой). Виды этого сегментированного пустого пространства являются более точным представлением топографии поверхности и размеров волокон, чем те, которые наблюдаются на обычных видах поверхности реплики (рис.2г). Измеренный диаметр нити, который может представлять либо отдельные нити муцина, либо нити муцинов, образующих боковые контакты, варьировался от 3 до 15 нм со средним значением 5,3 ± 1,3 нм; n = 51 (рис. 2з). Изгиб отдельных филаментов, по-видимому, коррелирует с деформацией или короблением соседних сегментов сети (Рис. 2i), указывая на то, что филаменты и сеть находятся под напряжением. Наконец, при просмотре крупным планом мы смогли заметить, что поверхность волокна (рис. 2j, стрелки) не была однородной, а скорее отображала квазипериодическую субструктуру.Квазипериодическая субструктура волокна наблюдается также на томографических реконструкциях реплики (рис. 2j, стрелки). Концы гликокаликса образуют упорядоченные глобулярные кончикиОсновываясь на однородной длине слоя гликокаликса, мы затем попытались определить его организацию на границе просвета. Мы обнаружили, что отдельные или множественные филаменты сходятся в глобулярную структуру (рис. 3). Примечательно, что все нити гликокаликса оканчиваются в одной плоскости, образуя один слой равномерно расположенных шаровидных головок, очень похожих на поверхность булавочной щетки с шариковыми кончиками (рис.3a – d и дополнительный рис. 4). Шаровидные кончики были относительно однородными, их средний диаметр составлял 10,2 ± 1,2 нм ( n = 82). Затем мы оценили организацию шаровидных наконечников и обнаружили, что их упаковка варьируется в зависимости от региона, от упорядоченной гексагональной упаковки (рис. 3e, f, h) до жидкой (рис. 3g), что, как мы предполагаем, является результатом сдвигового напряжения на гликокаликс в жидкокристаллическую упаковку (рис. 3ж). Расстояние между этими концами волокон гликокаликса зависит от формы упаковки, которая варьировалась от упорядоченной гексагональной до жидкокристаллической.Используя функцию радиального распределения, мы оценили, что среднее расстояние между концами варьируется от 31 до 36 нм (рис. 3e – g). Чтобы дополнительно оценить, как расположены концы филаментов гликокаликса, мы выполнили трехмерный анализ на большом томографическом объеме (рис. 3i) и получили среднее расстояние между ближайшими соседями между концами филаментов 32,0 ± 7,9 нм ( n = 1188). Мы также оценили расстояния между концами, используя функцию автокорреляции и функцию радиального распределения на двумерном проекционном изображении томографического объема, которое показало расстояния 38.5 и 40,3 нм соответственно (дополнительный рис. 5). Разница в значениях, полученных этими тремя методами, связана с измерением минимального расстояния между нитями в анализе ближайшего соседа по сравнению со средним расстоянием между нитями в более инклюзивной функции автокорреляции и радиального распределения. Рис. 3: Концы волокон гликокаликса сливаются, образуя равномерно расположенные глобулярные концы.a Микрофотографии люминальной поверхности гликокаликса, полученные методом замораживания, демонстрируют практически непрерывный слой регулярно упорядоченных глобулярных структур, показывая, что концы нити гликокаликса образуют глобулярные головки, расположенные в одной плоскости на границе просвета. b Крупный план глобулярных структур показывает, что они окружены радиальным градиентом отложения платины (стрелки), что может указывать на то, что пространства, прилегающие к каждому концу, содержат некоторый элемент, ограничивающий травление. c Наклонный вид, показывающий, что единственная плоскость глобулярных структур соответствует точке, где резко заканчиваются концы филаментов гликокаликса (стрелки). d Изображение с большим увеличением, показывающее, как сходятся несколько нитей (стрелки) перед тем, как они оканчиваются в глобулярную структуру. e — g Шаровидные структуры демонстрируют различные локальные двумерные упаковки, от гексагонально упорядоченной ( e , f ) до жидкой ( g ) упаковки. Анализ функции радиального распределения показал расстояние между концами 31, 35,4 и 35,5 нм ( e — g ) соответственно. h На вставке показано БПФ e с указанием гексагональной организации. i Распределение с подгонкой по Гауссу расстояния до ближайшего соседа между концами нити гликокаликса.Среднее значение = 32,0 ± 7,9 нм, n = 1188. Масштабные полосы: a 100 нм; b 20 нм; c 50 нм; d 20 нм; e , f 100 нм. Интересно, что реплики замораживания-травления также показывают пониженную скорость травления льда вокруг кончиков шаров (рис. 3b). Более высокая стойкость к сублимации воды вокруг шаровидных наконечников предполагает наличие очень тонкого компонента, который не разрешается в репликах замораживания-травления, который ограничивает сублимацию воды и удерживает концы нити на постоянном расстоянии друг от друга.Одна из возможностей состоит в том, что существует обогащение сахарными группами, украшающими нити, так же, как проволочная щетка для труб. Исследование пористости гликокаликса флуоресцентными декстранамиНаконец, для оценки проницаемости и деформируемости кишечного гликокаликса млекопитающих мы использовали два подхода. В первом мы удалили сегменты тонкой кишки у мышей дикого типа и зафиксировали их в тех же условиях, что и в экспериментах по травлению замораживанием («Методы»), сразу после эвтаназии.Затем на эти сегменты воздействовали растворами декстрана разного размера, конъюгированными с флуорофором. Мы обнаружили, что фиксируемый флуоресцентный декстран 3 кДа с радиусом Стокса 1,2 нм 39,40 был способен проникать в гликокаликс и украшать извитую поверхность микроворсинок, но не проникать в энтероциты (рис. 4a, b, пурпурный). Интересно, что флуоресцентный сигнал был сильнее в микроворсинках, чем в слое гликокаликса (рис. 4b), что, скорее всего, является результатом повышенного сродства фиксируемого декстрана к реактивным группам фиксатора глутаральдегида, присутствующего в ткани, или относительного исключения из него. сеть столбчатых филаментов с высоким содержанием гликозилированного муцина.И наоборот, более крупный флуоресцентный декстран 2000 кДа с расчетным радиусом Стокса ~ 27 нм 39,41 не смог значительно проникнуть в гликокаликс, что видно по явному отсутствию сигнала флуоресценции (рис. 4a, b, зеленый). . Поскольку декстраны представляют собой гибкие линейные молекулы, а фактические молекулярные массы, присутствующие в конкретном образце, могут иметь широкое распределение, некоторый сигнал флуоресценции от декстрана 2000 кДа наблюдался в слое гликокаликса после более длительного воздействия раствора декстрана (рис.4а, б, зеленый). Рис. 4: Конфокальная микроскопия показывает, что гликокаликс действует как прочный, но деформируемый фильтр.a Конфокальное поперечное сечение щеточной границы фиксированных сегментов кишечника, подвергшихся воздействию фиксируемых флуоресцентных декстранов с различными молекулярными массами: 3 кДа (пурпурный) и 2000 кДа (зеленый). Декстран 3 кДа проникает через слой гликокаликса (gly) и накапливается в микроворсинках (mic), в то время как декстран 2000 кДа в основном исключен как из слоя гликокаликса, так и из микроворсинок. b Сканирование линии интенсивности флуоресценции вдоль пунктирной линии в a показывает изменение интенсивности флуоресценции декстрана от цитоплазмы (Cy) до микроворсинок (Mi), до гликокаликса (Gly) и просвета (Lu). c Изображение прижизненной микроскопии просвета кишечника мыши mTomato, показывающее щеточную кайму и очертания плазматической мембраны энтероцитов в каждой ворсинке. d , e Изображения прижизненной микроскопии просвета кишечника, заполненного флуоресцентным декстраном 3 кДа (белый).Эритроциты исключают флуоресцентный сигнал. Даже будучи зажатыми между соседними ворсинками ( d ) или плотно упакованными, чтобы они контактировали друг с другом ( e ), эритроциты не могут контактировать с микровиллярным слоем из-за присутствия гликокаликса. Стрелки в d , e указывают на локальные вариации отделения красных кровяных телец от поверхности микроворсинок, согласующиеся с локальными деформациями гликокаликса. f Реплика нефиксированного, непосредственно замороженного тонкого кишечника мыши с травлением методом замораживания, подчеркивающая, что гликокаликс может быть локально деформирован (желтые стрелки).Масштабные линейки: и 2 мкм; c 10 мкм; d , e 5 мкм; f 500 нм. Зондирование деформируемости гликокаликса с помощью прижизненной микроскопииВ рамках нашего второго подхода мы стремились исследовать свойства гликокаликса в физиологическом контексте, in vivo, и разработали подход с использованием прижизненной конфокальной микроскопии для прямого изображения просвета кишечника живых организмов под наркозом. мышей, после хирургического воздействия на кишечник 42 и в конечном итоге просвет кишечника.Мы использовали трансгенных мышей, экспрессирующих mTomato 43 , флуоресцентно меченный маркер плазматической мембраны, который очерчивал мембраны энтероцитов, включая щеточную кайму (рис. 4c). Затем мы непосредственно наносили декстран 3 кДа на хирургически обработанный просвет мышей дикого типа (рис. 4d, e). Просвет быстро заполнялся декстраном, который, как и прежде, пронизывал гликокаликс и заполнял межмикровиллярные пространства (рис. 4d, e). Важно отметить, что присутствие флуоресцентного декстрана в просвете также позволило визуализировать эритроциты за счет исключения сигнала флуоресценции (рис.4г, д). Во время получения прижизненного изображения кишечник испытывает сокращения, а также пассивные движения, вызванные дыханием и сердцебиением, что вызывает обширные движения жидкости вокруг ворсинок кишечника. Из-за хирургического вскрытия кишечника часто происходило локальное нарушение кровеносных сосудов и дополнительный ток жидкости на поверхности кишечного эпителия в поле зрения. Мы случайно обнаружили, что эритроциты, протекающие через просвет, скользили по поверхности микровиллярного слоя, но никогда не соприкасались с ним, всегда сохраняя четкое разделение, даже когда они зажаты между двумя ворсинками, как на рис.4d и дополнительный ролик 1. В случаях, когда эритроциты плотно упаковывались друг в друга до точки соприкосновения и взаимной деформации, отчетливое отделение от микроворсинок по-прежнему сохранялось, предположительно гликокаликсом. Из-за дифракционно ограниченного характера этих съемок мы не могли точно измерить толщину слоя гликокаликса. Однако наблюдаемое скольжение и вариации отделения эритроцитов от поверхности микроворсинок (рис. 4d, e, стрелки) подчеркивают гибкость / пластичность слоя гликокаликса и то, что мы интерпретируем как вязкоупругий ответ при распределении локальных механических повреждений. стрессы по всей сети. Чтобы проверить, показывает ли нефиксированный гликокаликс деформации, мы выполнили замораживание-травление непосредственно замороженного кишечного эпителия. Сегменты тонкой кишки осторожно промывали и замораживали в бессывороточной культуральной среде. Как и ожидалось, во время стадии травления вода сублимируется, оставляя смесь эвтектических солей, перемешанную и украшающую поверхность нитей гликокаликса, тем самым ограничивая визуализацию организации сети гликокаликса. Тем не менее, мы смогли проверить, что в некоторых регионах, в частности, где часть содержимого просвета оставалась в контакте со слоем гликокаликса, сетка выглядела уплотненной и деформированной (рис.4е). Мы интерпретируем уплотнение и деформацию сети как структурные корреляты деформируемости, наблюдаемой при визуализации в реальном времени. Модуляция структуры эндотелиального гликокаликса в условиях воспаленияГликокаликс эндотелия — это внутрисосудистое пространство, которое создает барьер между циркулирующей кровью и стенкой сосуда. Предполагается, что гликокаликс играет важную роль во многих физиологических процессах, включая регуляцию проницаемости сосудов, предотвращение отхождения клеток крови от стенки сосуда и передачу напряжения сдвига.Различные теоретические модели и экспериментальные подходы предоставляют данные об изменениях структуры и функций гликокаликса при различных типах воспалительных состояний. Предполагается, что эти изменения способствуют воспалительным процессам в сосудах и вносят вклад в патогенез ряда заболеваний. В этом обзоре мы обобщаем текущие знания о модуляции гликокаликса при воспалительных состояниях и последствиях течения воспаления в сосудах. Структура и функции эндотелиального гликокаликса кратко обсуждаются в контексте методологических подходов к определению эндотелиального гликокаликса, а также неопределенности и проблем, связанных с определением структуры гликокаликса.Кроме того, резюмируется изменение структуры гликокаликса при воспалительных состояниях и возможные последствия для патогенеза отдельных заболеваний и медицинских состояний (в частности, диабета, атеросклероза, ишемии / реперфузии и сепсиса). Наконец, обсуждаются терапевтические стратегии для улучшения дисфункции гликокаликса, предложенные различными авторами. 1. ВведениеНа основе теоретических моделей и экспериментальных исследований за последние несколько десятилетий было показано, что гликокаликс представляет собой многокомпонентный слой протеогликанов и гликопротеинов, покрывающий люминарный эндотелий [1–4].За последние несколько десятилетий появилось все больше доказательств того, что поверхностный слой эндотелия играет значительную физиологическую роль, особенно в отношении проницаемости сосудов, адгезии лейкоцитов и тромбоцитов, опосредования напряжения сдвига и модуляции воспалительных процессов [ 2, 5–7]. Васкулопротекторные функции гликокаликса стенки сосуда предполагаются на основании экспериментальных данных, демонстрирующих, что нарушение гликокаликса сопровождается повышенной чувствительностью сосудистой сети к воспалительным и атерогенным раздражителям [8, 9].Подробные описания биологических систем и методологий, приводящие к этим выводам, были опубликованы и проанализированы ранее [2, 3, 7, 10, 11]; поэтому мы даем лишь краткий обзор функций гликокаликса, связанных с модуляцией гемостатических и воспалительных процессов. 2. Структура эндотелиального гликокаликсаПоверхность эндотелиальных клеток покрыта слоем, состоящим из мембраносвязанных протеогликанов и гликопротеинов, связанных с адсорбированными компонентами плазмы, которые находятся в динамическом равновесии с током крови в зависимости от условий местного микроокружения (рис. ).Взаимодействие между мембраносвязанными и растворимыми компонентами гликокаликса обеспечивает стабильность этого нежного слоя; однако состав гликокаликса не статичен; существует баланс между биосинтезом и выделением компонентов гликокаликса. Основными молекулами гликокаликса являются протеогликаны и гликопротеины, которые в основном связаны с поверхностью эндотелиальных клеток [2]. По своей структуре они принадлежат к гликопротеинам с коровыми белками переменного размера, характеризующимися длинной (около 200 сахарных остатков) неразветвленной боковой цепью гликозаминогликана (GAG), связанной посредством O -гликозильной связи.Было продемонстрировано разнообразие сахаридных мотивов, включая галактозильные остатки, а также N -ацетилглюкозамин и N -ацетилгалактозамин [7]. 2.1. ПротеогликаныСреди протеогликанов, присутствующих в эндотелиальном гликокаликсе, есть синдеканы, глипиканы, мимекан (также известный как остеоглицин) и бигликан. Синдеканы связаны с клеточной мембраной через однопролетный трансмембранный домен. Кроме того, они имеют короткий цитоплазматический домен с консервативными областями C1 (проксимальнее мембраны) и C2 (дистальнее мембраны) и вариабельную область V между C1 и C2, уникальную для специфического синдекана.Размер синдеканов колеблется от 20 до 45 кДа. Существует 4 подтипа синдеканов с внеклеточным доменом, специфичным для каждого подтипа синдекана, который связывает 3-5 цепей гепарансульфата (HS) или хондроитинсульфата (CS). Этот домен является вариабельным в зависимости от структурного разнообразия цепей HS и CS, возникающих в результате серии посттрансляционных модификаций. Основным синдеканом в эндотелии сосудов является синдекан-2. Большинство синдеканов связывают HS; большие синдеканы -1 и -3 также могут связывать CS. Интересно, что эктодомены синдекана могут отделяться от клеток и конкурировать за связывание с клеточной поверхностью [2, 12–14].Глипиканы имеют молекулярную массу около 60–70 кДа. Они связаны с клеточной мембраной через якорь гликозилфосфатидилинозитола (GPI) и, таким образом, могут высвобождаться за счет активности фосфолипазы [7]. Существует 6 подтипов глипикана, которые имеют модульную структуру с N-концевой сигнальной последовательностью, предположительно глобулярный домен, содержащий характерный образец из 14 остатков цистеина, домен с сайтами присоединения GAG и гидрофобную C-концевую последовательность, которая является участвует в формировании якорной конструкции GPI.Они связывают исключительно HS вблизи поверхности клетки [15, 16]. Мимекан и бигликан относятся к семейству небольших протеогликанов, богатых лейцином (SLRP), которые связывают CS, дерматансульфат (DS) и кератансульфат (KS) [17, 18]. Размер белков SLRP составляет до 42 кДа, и они характеризуются богатыми лейцином повторами (LRR) в их центральном домене. Каждый LRR имеет консервативный мотив LXXLxLXXNxL, где L представляет собой лейцин (возможна замена изолейцином, валином или другой гидрофобной аминокислотой), а x может быть любой аминокислотой.Есть четыре цистеина с класс-консервативным доменом на N-конце всех SLRP; однако N-конец по-разному модифицируется в различных SLRP [18]. Семейство SLRP делится на 5 классов. Мимекан относится к III классу. Biglycan относится к классу I [18]. Он замещен одной или двумя ковалентно связанными цепями CS / DS, которые присоединены к аминокислотам на N-конце [17, 19]. 2.2. ГликозаминогликаныГАГ представляют собой линейные полимеры дисахаридов, которые состоят из D-глюкуроновой кислоты, L-идуроновой кислоты или D-галактозы, связанных либо с D- N -ацетилглюкозамином, либо с D- N -ацетилгалактозамином.Полимеры ГАГ различаются по длине и в различной степени модифицируются путем сульфатирования и / или (де) ацетилирования. Из-за наличия карбоксильных и сульфатных групп ГАГ в физиологических условиях имеют отрицательный заряд [11]. Glycocalyx GAG, за исключением гиалуронана (гиалуроновая кислота; HA), ковалентно связаны с коровыми протеогликанами путем связывания их восстанавливающего конца с коровыми белками [2, 20]. Обычно ГАГ присутствуют в гликокаликсе в следующих соотношениях: HS, более 50% от объема; HA составляет более 40%, а DS — около 10%.В гораздо меньшей степени в гликокаликсе присутствуют другие ГАГ, такие как KS. HS наиболее распространен в гликокаликсе, поскольку протеогликаны HS составляют 50–90% всех протеогликанов в эндотелиальном гликокаликсе [2]. Цепи HS могут варьироваться в зависимости от состава дисахаридов, расположения доменов и размера. В общем, HS может составлять от 50 до 150 дисахаридных единиц. Структурное разнообразие HS основано на серии ферментативных реакций в аппарате Гольджи, которые приводят к удалению ацетильных групп и сульфатированию, эпимеризации глюкуроновой кислоты до идуроновой кислоты и сульфатированию гидроксильных групп C-6 и C-3. глюкозамина и C-2-гидроксильных групп уроновых остатков [21].Цепи HS связываются в первую очередь с эктодоменами синдекана, часто близко к N-концу. Они связаны с коровым белком синдекана серин-глициновой последовательностью, лежащей в пределах консенсусных областей, богатых кислотными остатками, через тетрасахаридный линкер ксилоза-галактоза-галактоза-уроновая кислота [12, 22]. Структурное разнообразие определяет функциональные свойства HS; тонкая структура, по-видимому, представляет собой специфичную для клетки сигнатуру, различающуюся для протеогликанов из разных источников, но не для разных протеогликанов из одного источника [15]. CS — еще один широко распространенный ГАГ в эндотелиальном гликокаликсе. Соотношение HS и CS в эндотелии сосудов обычно составляет 4: 1. CS типа B, в котором глюкуроновая кислота может эпимеризоваться в идуроновую кислоту и влиять на функциональность, называется дерматансульфатом (DS) и иногда классифицируется как уникальный класс ГАГ [2]. CS ковалентно связан с коровым белком через так называемую область связывания GAG-белка (GlcA β 1-3Gal β 1-3Gal β 1-4Xyl β 1-O-Ser) [23] .Количество цепей CS, связанных с коровым белком, может сильно варьироваться, а молекулярная масса CS-GAG может достигать 3000 кДа [24]. HA представляет собой высокомолекулярный несульфатированный полимер (MW> 10 6 Да), который является единственным GAG, который не связан с коровым белком. Он может связываться с клеточной мембраной и взаимодействовать с цитоскелетом через гиладгерины (например, CD44 или RHAMM) [16]. HA синтезируется на плазматической мембране с помощью HA-синтаз и выталкивается из мембраны в ECM. Конфигурация ГА представляет собой псевдослучайную катушку.ГК очень гигроскопичен и в водном состоянии очень вязкий и эластичный [25]. 2.3. ГликопротеиныГликопротеины — еще одна группа молекул «скелета», соединяющих гликокаликс с клеточной мембраной. Это гликоконъюгаты с относительно небольшими (5–12 сахарных остатков) и разветвленными боковыми углеводными цепями [2, 7]. Среди наиболее распространенных функционально важных гликопротеинов гликокаликса — селектины, интегрины и другие адгезионные молекулы со структурными доменами иммуноглобулинов [2, 26–28].Экспрессия большинства этих молекул адгезии на эндотелии значительно варьируется в зависимости от активации или стимуляции клеток [2]. Селектины содержат небольшой цитоплазматический хвост, трансмембранный домен, несколько консенсусных повторов, а также EGF-подобный домен и концевой лектин-подобный домен на конце NH 2 . Последний отвечает за связывание углеводных групп с гликозилированными белками или липидами. EGF-подобный домен участвует в распознавании лиганда селектина. На эндотелии сосудов экспрессируются E- (64 кДа — вычислено из последовательности; различные гликозилированные формы варьируют от 100 до 115 кДа) и P- (140 кДа) селектины, которые отличаются количеством консенсусных повторов: P-селектин имеет 9 и консенсусные повторы E-селектина 6 [2, 27, 28]. Интегрины представляют собой гетеродимерные интегральные мембранные белки, состоящие из нековалентно связанных трансмембранных гликопротеинов типа I α (18 известных у людей) и β субъединиц (8 известных), образующих 24 различных гетеродимера. Оба они имеют большие внеклеточные домены, одинарные трансмембранные домены и короткий цитоплазматический хвост [26, 29]. Другие гликопротеины, содержащиеся в гликокаликсе, представляют собой молекулы адгезии, такие как молекулы межклеточной адгезии 1 и 2, молекула адгезии тромбоцитов / эндотелиальных клеток 1 и молекула адгезии сосудистых клеток 1, а также гликопротеины, участвующие в коагуляции, фибринолизе и гомеостазе, такие как Ib-IX- V комплекс [2]. 2.4. Растворимые компонентыС эндотелиальным гликокаликсом связан широкий спектр других молекул, таких как белки и растворимые протеогликаны, которые происходят либо из эндотелия, либо из кровотока. С функциональной точки зрения, эндотелиальный гликокаликс содержит белки, участвующие в воспалении, коагуляции, фибринолизе и гемостазе, в основном связанные с васкулопротекторной функцией гликокаликса [25]. Они могут быть физически связаны с гликокаликсом разными механизмами.Во-первых, это рецепторы или ферменты (например, рецептор фактора роста фибробластов, липопротеинлипаза и липопротеин низкой плотности (ЛПНП)). Другая группа состоит из молекул, происходящих из плазмы, которые связываются с гликокаликсом и приводят к градиенту концентрации (альбумин, фибриноген, оросомукоид). Гликокаликс просеивает эти растворимые компоненты плазмы, устанавливая динамическое равновесие между компонентами крови и теми, которые удерживаются в гликокаликсе [2, 25]. Наконец, есть группа молекул, связанных со структурой гликокаликса посредством взаимодействия с ГАГ.В частности, протеогликаны HS содержат множество сайтов связывания белков в силу специфических паттернов сульфатирования [4]. К лигандам, связывающим цепь HS, относятся факторы роста (например, фактор роста фибробластов, факторы роста эндотелия сосудов, трансформирующий фактор роста- β , факторы роста тромбоцитов), белки внеклеточного матрикса (например, фибронектин, витронектин, коллагены и тромбоспондин). -1), белки плазмы (например, внеклеточная супероксиддисмутаза (SOD)) и факторы ингибиторов свертывания (антитромбин-III, система протеина C и ингибирование пути тканевого фактора) [2, 12–14, 30]. 3. Размер гликокаликса эндотелияТочная оценка структурной организации нормального или поврежденного гликокаликса эндотелия требует надежных методов визуализации [2, 7]. Из-за структурного состава этого очень хрупкого и нестабильного слоя особенно сложно визуализировать и измерить его трехмерную структуру. Первичное определение, проведенное с помощью просвечивающей электронной микроскопии (ПЭМ), показало, что толщина слоя гликокаликса составляет порядка десятков нанометров [1, 2, 7, 31].Однако текущий анализ с модифицированной фиксацией образцов для ПЭМ или других методов, таких как прижизненная микроскопия и конфокальная микроскопия, показал видимую толщину поверхностного слоя> 5 мкм м [2, 10, 31]. Это показало, что первоначальные описания значительно занижали его реальный размер [5, 6]. В целом, методологические подходы, использованные для определения толщины гликокаликса, дали самые разные результаты; Таким образом, этот обзор представляет собой сводку различных способов визуализации эндотелиального гликокаликса до настоящего времени. 3.1. Электронная микроскопияПервое изображение эндотелиального гликокаликса было получено с помощью обычного ПЭМ, выявляющего небольшой слой размером примерно 20 нм в капиллярах [32]. С тех пор многие последующие подходы с использованием ПЭМ, наряду с различным составом перфузата или фиксаторами, выявили окрашенные структуры на поверхности эндотелиальных клеток по всем сосудам и культивируемым клеткам с большими вариациями размеров и внешнего вида [8, 9]. В некоторых исследованиях [33, 34] использовали окрашивание рутением красным в сочетании с фиксацией глутаральдегид / тетроксид осмия.Однако предполагается, что из-за своего относительно большого молекулярного размера рутениевый красный не может проникать во весь гликокаликс и может влиять на геометрию гликокаликса, изменяя электростатические взаимодействия между макромолекулами, присутствующими на поверхности мембраны [7]. Интересно, что когда применялись специальные методы фиксации, которые стабилизируют отрицательно заряженные структуры, предотвращая потерю и / или коллапс этих структур, таких как лантан [34–37] или альциановый синий [35, 38, 39], это свидетельствует о толстом поверхностном эндотелиальном слое. шириной примерно до 800 нм [39, 40]. Различные результаты в отношении толщины и структуры гликокаликса, возникающие при использовании различных подходов ПЭМ, могут зависеть от того, фиксируется ли образец перфузией или погружением. Chappell et al. документально подтвердили резкое различие между фиксированными перфузией и фиксированной иммерсией пупочными сосудами, где в последних не было гликокаликса [36]. Однако метод перфузии с использованием солевого раствора, не содержащего белков, может вызвать сжатие гликокаликса из-за частичного вымывания белков, отложившихся внутри гликокаликса, что может объяснить большое расхождение между измерениями in vivo и , полученными для фиксированного перфузией материала [37].Некоторые исследования указывают на артефакты, вызванные присутствием водных фиксаторов, которые могут растворять некоторые структуры слоя гликокаликса. Тем не менее, чтобы обойти это ограничение, некоторые группы [41, 42] модифицировали протокол окрашивания ТЕМ, используя неводные фиксаторы на основе тетроксида осмия, растворенного во фторуглероде. Этот метод компенсирует методы, требующие процедур отмывки, которые могут удалить белки плазмы, прикрепленные к структурам гликокаликса [2, 7, 43]. Однако во всех этих случаях требуется обезвоживание спиртом как ступенька к заделке образцов ПЭМ.Такая замена воды органическими растворителями может привести к значительному коллапсу гидратированного и гелеобразного состояния гликокаликса [7, 31, 44]. Чтобы преодолеть эту проблему, Ebong et al., Например, применили быстрое замораживание и методику ПЭМ с заменой замораживания, тем самым избегая использования обычных фиксаторов. Эти попытки сохранить естественное состояние структуры гликокаликса, которая имеет высокое содержание воды, привели к кажущейся толщине поверхностного слоя> 5 мкм м [10, 31].Более того, этот метод выявил различия в толщине гликокаликса в зависимости от типа клеток и среды культивирования [31]. В заключение, ПЭМ может предоставить информацию о заряде, составе и структуре гликокаликса; однако результаты сильно различаются в зависимости от используемых методов фиксации и окрашивания, и ТЕМ нельзя использовать in vivo [45]. 3.2. Прижизненная микроскопияСпустя несколько десятилетий после того, как были сделаны первые изображения ПЭМ, некоторые исследования показали различия между системным и микрососудистым гематокритом на мышцах кремастера, предполагая, что слой гликокаликса намного толще, чем было показано при использовании оригинальных подходов ПЭМ [1, 8, 9, 40, 46 ].Внутрипросветное распределение эритроцитов (эритроцитов) в сочетании с различными флуоресцентно меченными молекулами-индикаторами (например, декстраном) по сравнению с положением эндотелиальной стенки в капиллярах обеспечило более полное понимание исключительных свойств гликокаликса [2, 47, 48]. Проникновение инертных макромолекул в гликокаликс определяется как зарядом, так и размером макромолекул [46–49]. Используя этот методологический подход, толщина гликокаликса в капиллярах мышцы cremaster хомяка in vivo была оценена как ~ 0.4-0,5 мкм м [47]. Методы измерения толщины гликокаликса на основе глубины инфильтрации флуоресцентно меченых молекул индикаторов одновременно позволили разработать другие методы, такие как системная инфузия по сравнению с прямой перфузией и использование различных видов (хомяков, мышей, крыс) и / или различные классы микрососудов (артериолы, капилляры или венулы) [2, 49–51]. Одним из основных ограничений этих методов, основанных на исключении красителя in vivo , является требуемое разрешение, которое близко к практическим пределам разрешения оптической микроскопии in vivo .Это ограничивает эти определения микрососудами диаметром менее 15 мкм [52]. Чтобы устранить это ограничение, некоторые авторы использовали прижизненную прижизненную флуоресцентную велосиметрию изображения микрочастиц с высоким разрешением ( мкм, -PIV). Метод µ -PIV позволяет исследовать профиль скорости у стенки сосуда в микрососудах диаметром более 20 µ м [53, 54]. Наконец, современные клинически применимые микроскопические подходы, которые оценивают индивидуальные размеры капиллярного гликокаликса на основе изменения ширины столба капиллярных эритроцитов после прохождения капиллярных лейкоцитов в микроциркуляторном русле, представляют собой спектральную визуализацию с ортогональной поляризацией (ОПС, измеренную в подъязычной области) и ее преемник, боковая визуализация темного поля (SDF, измеренная на ногтевом валике) [16, 55–58].Однако эти методы также имеют технические ограничения, такие как тот факт, что измерение гликокаликса под язык дает информацию только о капиллярных кровеносных сосудах [56]. 3.3. Конфокальная микроскопия и другие методыНизкое пространственное разрешение прижизненного оптического микроскопа позволяет точно измерить толщину гликокаликса только на тонких тканях, допускающих трансиллюминацию [55]. Усовершенствованные методы микроскопии приносят значительные улучшения, которые позволяют эпи-освещение более толстых поверхностей органов [2].Прямая визуализация гликокаликса может быть выполнена с помощью нескольких подходов, в основном с использованием флуоресцентно меченных лектинов, которые связывают определенные дисахаридные фрагменты гликозаминогликановых цепей. Флуоресцентно меченые антитела, распознающие синдекан-1, и флуоресцентно меченый HA-связывающий белок можно использовать аналогичным образом. Конфокальная лазерная сканирующая микроскопия также позволяет делать оптические срезы, позволяя реконструировать образец в 3D. Применение конфокальной микроскопии показало поверхностный слой толщиной в 2.5–4,5 мкм м в зависимости от размеров сосудов [2]. Однако в целом конфокальная микроскопия все еще менее подходит для визуализации гликокаликса в артериях из-за ограниченного проникновения света со значительной потерей разрешения на больших глубинах (> 40 мкм м) [2]. Артерии должны быть разрезаны в продольном направлении, что может нарушить структуру гликокаликса [43]. Кроме того, как и при анализе ПЭМ, основной проблемой является фиксация образцов. Консервация образцов с использованием формальдегида или глутаральдегида может вызвать искажение гликокаликса из-за индуцированного альдегидом перекрестного сшивания компонентов гликокаликса и последующего сжатия гликокаликса к поверхности клетки [31].Чтобы устранить эту проблему, Barker et al. применили конфокальную микроскопию к живым клеткам без нарушения важных функциональных характеристик исследуемых образцов, тем самым продемонстрировав неинвазивную экспрессию in vitro гликокаликса [59]. Перспективным методом прямой визуализации сосудов большего размера является двухфотонная лазерная сканирующая микроскопия (TPLSM), подробное описание которой в отношении ее преимуществ для определения гликокаликса дано в [2, 43, 60, 61].Среди основных преимуществ, делающих TPLSM подходящей техникой для прямой визуализации тонкого эндотелиального гликокаликса, являются повышенная глубина проникновения, хорошее разрешение, оптическое сечение и низкая фототоксичность. При визуализации гликокаликса с помощью TPLSM в интактных сонных артериях мыши толщина гликокаликса оказалась равной 4,5 мкм м [2]. Механические свойства гликокаликса можно определить с помощью других методов, таких как атомно-силовая микроскопия [62]. 3.4. Неопределенности и проблемы в отношении определения структуры гликокаликсаКак описано выше, существует несколько основных трудностей, ограничивающих демонстрацию трехмерной структуры эндотелиального гликокаликса. Основные неопределенности возникают из-за сравнения гликокаликса, определенного с использованием культивированных in vitro эндотелиальных клеток и сосудов in vivo , а также дальнейшего сравнения различных методологических подходов. Что касается клеточных культур, общие данные показывают, что существует больше аспектов, которые могут изменять формирование гликокаликса, таких как плотность клеток, условия культивирования, тип клеток и напряжение сдвига [59, 63].Некоторые исследования продемонстрировали различия в структуре и составе гликокаликса в клетках, подвергшихся длительному сдвигу, по сравнению с клетками, выращенными в статических условиях [10, 62, 64, 65]. Более того, сравнение методов ТЕА и мкм -PIV предполагает, что толщина гликокаликса, определенная с использованием моделей in vitro, клеточных культур, может быть значительно меньше, чем толщина гликокаликса, определенная in vivo [34, 36, 53, 63], несмотря на то, что было продемонстрировано, что культивируемые клетки продуцируют некоторые компоненты гликокаликса [7, 66].Поскольку обоснованность использования экспериментов на клеточных культурах для изучения структуры и функции эндотелиального гликокаликса недавно была поставлена под сомнение, еще предстоит определить, можно ли использовать структуру поверхностного слоя культивируемого эндотелия в качестве модели для модели, наблюдаемой в in vivo условиях. [10, 31, 45, 62, 64, 65]. С точки зрения методических подходов, фиксация и / или обезвоживание образцов во время их подготовки к ПЭМ-анализу является одним из основных недостатков, ограничивающих демонстрацию степени эндотелиального гликокаликса in vitro и .Кроме того, прямая визуализация эндотелиального гликокаликса и измерение его размеров и свойств in vivo также являются проблемой, в основном из-за того, что эндотелиальный гликокаликс является очень тонкой структурой, критически зависящей от наличия текущей плазмы. Интересно, что есть некоторые методы, используемые для определения гликокаликса in vivo , которые не основаны на методах визуализации. Обычно используемый подход для оценки деградации гликокаликса in vivo — определение компонентов гликокаликса, таких как HS, синдекан-1 или HA в плазме [67, 68].При многочисленных метаболических (диабет), сосудистых (атеросклероз, гипертензия) и хирургических состояниях (ишемия / реперфузионное повреждение, травма) было показано, что концентрация ГАГ в плазме увеличивается и что она коррелирует с концентрацией маркеров воспаления [69, 70]. Другой интересный метод косвенного сравнения толщины гликокаликса — сравнение разницы между нециркулирующим внутрисосудистым объемом и циркулирующим объемом с использованием проницаемого для гликокаликса и непроницаемого для гликокаликса индикатора [5, 6, 71, 72].Объем гликокаликса оценивается путем вычитания этих двух объемов. Декстран 40 (молекулярная масса 40 кДа) и индоцианиновый зеленый используются в качестве проницаемого для гликокаликса индикатора, а подходящий непроницаемый индикатор представляет собой флуоресцентно меченый эритроцит. Интересно, что гликокаликс, по оценкам, составляет целых 25% от общего внутрисосудистого пространства у человека, что дает среднюю толщину гликокаликса до 2 мкм м [30, 36, 56, 71–73]. Однако оценка системного объема гликокаликса не дает информации о неоднородности свойств гликокаликса между органами, и методика по-прежнему вызывает разногласия [5, 6]. В заключение отметим, что неоднородность толщины и структуры гликокаликса, о которых сообщают разные авторы, частично объясняется различиями в применяемых методах; использование систем / моделей in vivo, , ex vivo, и in vitro, ; различия в процедурах подготовки проб; неоднородность видов и органов; различия в условиях выращивания (рисунок 2). 4. Физиологические функции гликокаликсаСлой гликокаликса состоит из множества высокосульфатированных цепей ГАГ, обеспечивающих отрицательный заряд поверхностному слою эндотелия.Благодаря этим электростатическим свойствам гликокаликс с высокой молекулярной плотностью может играть роль в регулировании проницаемости сосудов и жидкостного баланса путем ограничения проникновения определенных молекул плазмы на основе их заряда, а не только на основе размера и стерических препятствий [2, 5 , 6, 8–10, 70, 74]. Нарушение гликокаликса может привести к потере функции барьера проницаемости с последующим образованием отека. Кроме того, отрицательный заряд также может способствовать отталкиванию красных кровяных телец от эндотелия и, таким образом, влиять на взаимодействие кровяных клеток и стенок сосудов.Кроме того, неповрежденный гликокаликс служит барьером против случайной адгезии тромбоцитов и лейкоцитов к стенке сосудов [2, 5, 6, 75]. Толщина гликокаликса, которая оценивается примерно в 0,5 мкм мкм, превышает размеры молекул клеточной адгезии, таких как молекулы межклеточной адгезии 1, молекула адгезии сосудистых клеток 1 и P- и L-селектины и, следовательно, ослабляют взаимодействие клеток крови с этими молекулами [5, 6, 10, 76]. Таким образом, выделение, по-видимому, необходимо для прикрепления лейкоцитов к стенке сосуда, потому что в нормальных условиях лейкоциты должны быть защищены от контакта со своими молекулами адгезии гликокаликсом [75, 77]. В последние годы несколько исследований выдвинули гипотезу о том, что гликокаликс играет важную роль в механотрансдукции [3, 11, 78]. Структуры гликокаликса, преобразующие биохимические и механические силы в биохимические сигналы как следствие гемодинамических изменений, ответственны за конформационные изменения, ведущие к изменениям клеточных ответов. Одним из таких изменений является усиление регуляции эндотелиальной синтазы оксида азота и увеличение продукции оксида азота (NO), который является важным фактором, определяющим сосудистый тонус [2, 78, 79].В любом случае механотрансдукция гликокаликса является результатом взаимодействия всех различных компонентов. Кроме того, было высказано предположение о важности гликокаликса в защите эндотелиальных клеток от повреждения различными медиаторами окислительного стресса. В физиологических условиях гликокаликс способствует своему васкулопротекторному эффекту, связывая основные ферментные системы. Одним из наиболее важных ферментов является внеклеточная SOD, связанная с протеогликанами гепарансульфата (HS), что способствует снижению окислительного стресса за счет тушения кислородных радикалов и поддержания биодоступности NO [1, 2, 30]. Предполагается, что гликокаликс играет важную роль в регуляции свертывания, поскольку ряд медиаторов, участвующих в регуляции путей коагуляции, таких как антитромбин III, кофактор гепарина II, тромбомодулин и ингибитор пути тканевого фактора, связаны внутри структура гликокаликса. Наконец, эндотелиальный гликокаликс может также связывать цитокины, которые оказывают сильное влияние на синтез соединений гликокаликса, или модулировать воспалительный ответ, ослабляя связывание цитокинов с рецепторами клеточной поверхности [2, 7–9, 30, 79]. Все эти физиологические процессы, регулируемые гликокаликсом, вносят вклад в природу здорового эндотелия и гомеостаза сосудов. 5. Изменения функций эндотелиального гликокаликса, опосредованные воспалениемЭндотелий сосудов является одним из первых участков повреждения во время воспаления. Быстрая потеря функций гликокаликса прямо и косвенно подтверждается различными системными и местными воспалительными реакциями, такими как диабет, атеросклероз, хирургическая ишемия / реперфузионное повреждение и сепсис [5, 6, 80].Как обсуждалось выше, функции гликокаликса зависят от интактной структуры гликокаликса. Нарушение структуры может варьироваться от разрушения до фундаментального разрушения слоя гликокаликса. Утрата компонентов эндотелиального гликокаликса, называемая шеддингом, может включать в себя избирательное расщепление HS и CS или серьезное нарушение, представленное удалением целых белков ядра синдекана и глипикана вместе с присоединенными боковыми цепями гликозаминогликанов [5, 6]. Выделение гликокаликса в ответ на медиаторы воспаления, такие как цитокины и хемоаттрактанты, было обнаружено в артериолах, капиллярах и венулах при различных экспериментальных моделях воспаления [5, 6, 80].Хотя на первый взгляд уменьшение гликокаликса может показаться благоприятным для снабжения питательными веществами, микрососудистые изменения, связанные с потерей гликокаликса и нарушением защиты сосудов, могут отрицательно влиять на функции сосудов [4]. Для усиления воспаления, по-видимому, имеет решающее значение высвобождение медиаторов воспаления, которые могут инициировать доступ лейкоцитов к молекулам адгезии путем разрушения обволакивающего гликокаликса, как было описано в Chappell et al. [80]. Основываясь на механизме действия, медиаторы воспаления могут напрямую влиять на эндотелиальные клетки, которые в ответ изменяют структуры гликокаликса.Кроме того, при воспалительных условиях активированные субпопуляции лейкоцитов, такие как полиморфно-ядерные лейкоциты, макрофаги и тучные клетки, дегранулируют ферменты, которые затем могут способствовать деградации гликокаликса [4, 81]. 5.1. Медиаторы, высвобождающиеся во время воспаления, способствующие разрушению гликокаликсаПосле активации воспалительные клетки высвобождают широкий спектр ферментов и реактивных веществ, которые могут способствовать повреждению гликокаликса. В частности, активированные нейтрофильные гранулоциты, наиболее распространенные лейкоциты крови у людей, могут вызывать повреждение гликокаликса, продуцируя активные формы кислорода и азота (ROS / RNS) и высвобождая протеазы из их запасающих гранул [70].Более того, тучные клетки, менее многочисленная субпопуляция лейкоцитов, могут напрямую выделять гепараназу со значительным потенциалом нарушения структуры гликокаликса через деградацию HS [5, 6, 79, 80, 82–84]. Признано, что ROS / RNS способны ухудшать HA, HS и CS. Не все АФК / РНС представляют собой прямую угрозу для гликокаликса. Фрагментация гликокаликса опосредуется третичными частицами, такими как гидроксильный радикал или гипогалогеновые кислоты, которые образуются в результате катализа МПО, полученного из нейтрофилов, связанного с отрицательно заряженными цепями GAG [70].Кроме того, предполагается, что ROS / RNS способны атаковать гликокаликс, генерируемый в непосредственной близости от эндотелиальной выстилки [70]. Расщепление HS после ROS / RNSs, связанное с увеличением пассажа макромолекул, следует аналогичной схеме, наблюдаемой после обработки ферментами, разрушающими HS [38, 85]. Более того, белковое ядро протеогликанов может также подвергаться окислению / нитрозированию, и эти окислительные и нитрозативные модификации на уровне протеогликанов могут отрицательно влиять на целостность гликокаликса [70].Кроме того, ROS / RNS не только представляют прямую угрозу для гликокаликса, но также могут усиливать протеолиз гликокаликса за счет активации матриксных металлопротеиназ (MMP) и инактивации ингибиторов эндогенных протеаз [70]. Протеазы — важные медиаторы, высвобождаемые и активируемые во время воспалительных состояний, которые представляют значительную угрозу для гликокаликса [76, 86]. К ним относятся, в частности, ММП и эластаза нейтрофилов. ММП хранятся в пузырьках фагоцитов и эндотелия и после соответствующей стимуляции высвобождаются и активируются [87].Ингибирование активности ММП доксициклином значительно снижает выделение гликокаликса [86–88]. Было высказано предположение, что расщепление всего эктодомена синдекана с присоединенными ответвлениями GAG с помощью MMPs может быть ответственным за отщепление гликокаликса [86, 87]. Интересно, что MMPs, как было показано, обладают высоким сродством к HSs, и эта HS-опосредованная иммобилизация MMPs на компонентах гликокаликса подчеркивает деструктивный потенциал MMPs [89]. Более того, было высказано предположение, что ММП непосредственно расщепляют ГАГ, HS протеогликан синдекан-1 и рецептор HA CD44 [90–92]. Помимо ММП, предполагается важность эластазы нейтрофилов в деградации эндотелиального гликокаликса в условиях системного или местного воспаления. Нейтрофильная эластаза высвобождается из азурофильных гранул нейтрофильных гранулоцитов после активации. Нейтрофильная эластаза может связываться с ответвлениями HS синдекана, вероятно, посредством взаимодействия с сульфатными фрагментами и способна к деградации синдекана [70]. В целом, как описано выше, воспалительные медиаторные изменения структуры гликокаликса или его отторжение лучше всего описываются как результат высвобождения протеаз и других деградирующих ферментов из разных типов фагоцитов и самих эндотелиальных клеток [93]. 5.2. Другие медиаторыКроме того, деградация гликокаликса может быть вызвана низким и / или турбулентным напряжением сдвига или воздействием на эндотелий окисленного липопротеина низкой плотности [94, 95]. Было также высказано предположение, что эндотелиальные клетки напрямую реагируют на медиаторы воспаления, такие как фактор некроза опухоли α (TNF- α ) или бактериальный липополисахарид, отщепляя гликокаликс [36, 67, 81, 93, 96]. Возможно, это связано с активацией или высвобождением внутриклеточных или мембраносвязанных ферментов деградации, таких как протеазы [11, 76, 80]. 6. Патофизиологические последствия альтернативной структуры и функций гликокаликсаКак было обобщено выше, в физиологических условиях гликокаликс способствует регуляции проницаемости и тонуса сосудов и служит барьером, сдерживающим адгезию лейкоцитов [70]. Таким образом, изменения этих функций связаны с широким спектром патофизиологических последствий, таких как синдром утечки капилляров, образование отека, ускоренное воспаление, гиперагрегация тромбоцитов, гиперкоагуляция и потеря сосудистой чувствительности [11].В целом считается, что участки сосудов с уменьшенным гликокаликсом более уязвимы для провоспалительных и атеросклеротических последствий [1, 4–6] (Рисунок 3). Важность потери барьерных функций гликокаликса, приводящей к увеличению проницаемости сосудов, была предложена на основании экспериментов, показывающих, что деградация гликокаликса связана с уменьшением исключения анионных декстранов [49] с повышенной проницаемостью для белков [97], с повышенным клиренсом альбумина в клубочках [98, 99] и формированием периваскулярного отека [39].Кроме того, предполагается, что потеря гликокаликса раскрывает молекулы адгезии к поверхности мембраны, которые усиливают адгезию лейкоцитов к стенке сосуда [5, 6]. Таким образом, повышенная адгезия лейкоцитов и повышенная проницаемость сосудов являются основными экспериментально подтвержденными последствиями нарушения барьерной функции гликокаликса. Интересно, что были предложены другие механизмы, лежащие в основе этого феномена повышенной проницаемости сосудов, включая потерю барьерной функции и индукцию перестройки межклеточных эндотелиальных соединений.В этом случае передача сигналов через syndecans интегрирует внеклеточные сигналы за счет их ассоциации с цитозольными эффекторами, что приводит к перестройке цитоскелетных белков и изменению межклеточных соединений, которые становятся более проницаемыми, что делает возможной экстравазацию жидкости [69]. Кроме того, предполагается, что некоторые патологические последствия связаны с потерей различных ферментов и сигнальных молекул, хранящихся в структуре гликокаликса, включая СОД, антитромбин III и тромбомодулин [8, 9, 79].Возможно, это способствует дисбалансу в ферментативных системах, таких как коагуляция и антиоксидантная защита [79]. Наконец, различные авторы обсуждают патологические последствия потери механотрансдукционных функций из-за повреждения структуры гликокаликса [1, 3, 11, 79, 100, 101]. Сосредоточившись на воспалительной реакции, следует также принять во внимание, что деградация гликокаликса медиаторами воспаления и высвобождение его фрагментов в кровоток могут значительно способствовать усилению воспалительных процессов, запуску и поддержанию потенциально деструктивного механизма обратной связи.Предполагается, что сброшенные фрагменты HS и HA, которые могут высвобождаться при нарушении гликокаликса, действуют как провоспалительные молекулы, например, со значительными хемотаксическими свойствами [16, 69, 102, 103]. 7. Патологические состояния, связанные с измененной структурой гликокаликсаИзменения функций эндотелиального слоя гликокаликса участвуют во многих патологических состояниях, основанных на воспалении. Недавние исследования на людях показали, что степень выделения гликокаликса зависит от степени воспалительного состояния и что существуют корреляции между тяжестью заболевания и уровнем компонентов гликокаликса в крови [69, 70, 104].Была подчеркнута важность изменений гликокаликса в хронических воспалительных реакциях, предполагая, что стенка сосудов у пациентов с хроническими воспалительными заболеваниями более чувствительна, например, к проатерогенным стимулам [79]. В этом обзоре мы более подробно обсудим такие состояния, как диабет, атеросклероз, ишемия / реперфузия и сепсис, при которых имеют место воспалительные заболевания. 7.1. ДиабетСахарный диабет — это клинически четко выраженное метаболическое заболевание, связанное с отсутствием инсулина или резистентностью к нему и последующей гипергликемией.У больных сахарным диабетом выявлена тенденция к развитию сосудистых осложнений, таких как микроальбуминурия, ретино- и нефропатия, а также повышенный риск атеротромботических сердечно-сосудистых событий [2, 74]. Фундаментальные патогенетические механизмы сосудистого заболевания, связанного с диабетом, включают усиленное воспаление сосудов и повышенный окислительный стресс [105]. Предполагается, что эти осложнения связаны с измененными функциями сосудов, такими как повышенная проницаемость эндотелия и нарушение функции NO-синтазы, что указывает на нарушение защитной способности стенки сосуда [71, 72, 74, 106–109].Интересно предположить, что эти типичные патологические проявления нарушения функции эндотелия у больных сахарным диабетом проявляют признаки деградации гликокаликса [71, 72, 110]. В клубочках повреждение эндотелиального гликокаликса может изменить проницаемость капиллярного русла, что клинически проявляется как альбуминурия, сопровождающаяся повышенной системной проницаемостью микрососудов [106]. Было показано, что изменения гломерулярного эндотелиального гликокаликса при ранней диабетической нефропатии согласуются с ранней потерей избирательности заряда, которая происходит на животных моделях диабетической нефропатии и у людей с диабетом 1 и 2 типа и микроальбуминурией [98, 99, 111] .Вызванная гипергликемией деградация гликокаликса неоднократно демонстрировалась рядом авторов, которые предоставили данные о том, что острая и длительная гипергликемия связана с глубоким истончением гликокаликса и деградацией гликокаликса, что определяется различными методами [71, 72, 112]. Предполагается, что за снижение структуры гликокаликса у пациентов с диабетом ответственны несколько молекулярных механизмов. В первую очередь, некоторые авторы предполагают, что это напрямую вызвано повышенным уровнем глюкозы, поскольку многие из этих эффектов могут быть экспериментально вызваны и у недиабетических субъектов.Интересно, что даже кратковременная перфузия сосудов с повышением уровня глюкозы выше физиологического уровня была связана с нарушениями функции сосудов, такими как вызванная напряжением сдвига артериальная дилатация и проницаемость сосудов, что может быть связано с деградацией гликокаликса [72, 74, 107–109]. Было высказано предположение, что глюкоза может влиять на структуру гликокаликса из-за гликопротеиновой природы гликокаликса, с которым взаимодействует глюкоза [72]. Другой предполагаемый механизм связан с измененным биосинтезом HS, поскольку он был серьезно нарушен воздействием высоких концентраций глюкозы на монослои клубочковых эндотелиальных клеток человека, что связано с нарушением структуры эндотелиального гликокаликса и повышенным прохождением альбумина через монослой [113].Наконец, связь между изменениями метаболизма ГК и сосудистой дисфункцией, связанной с гипергликемией, была недавно рассмотрена Ленноном и Синглтоном [25]. Было обнаружено, что уровни ГК и гиалуронидазы в плазме повышены у пациентов с диабетом, что отражает повышенный синтез и выделение ГК в условиях гипергликемии [71, 72, 112, 114]. Кроме того, не связанные напрямую с изменениями структуры гликокаликса, медиаторы воспаления также могут увеличивать ширину соединения эндотелиальная клетка-клетка и в некоторых случаях индуцировать параюнктивные трансцеллюлярные отверстия, связанные с повышенной проницаемостью, как было показано на моделях на животных и пациентах с диабетом [115] .Кроме того, опосредованное гипергликемией повреждение подоцитов может приводить к снижению продукции фактора роста эндотелия сосудов, что приводит к дисфункции эндотелиальных клеток клубочков и, возможно, также к нарушению гликокаликса [116]. 7.2. АтеросклерозАтеросклероз — это заболевание крупных артерий, инициирующим этапом патогенеза которого является дисфункция сосудистого эндотелиального барьера. За этим следует субэндотелиальная задержка атерогенных липопротеинов, холестерина и моноцитов, образующих бляшку с нарушенными профилями кровотока.Впоследствии наблюдается усиление дисфункции эндотелиального барьера и пролиферация гладкомышечных клеток сосудов, что в конечном итоге приводит к разрыву бляшки и тромбозу [25, 48, 95, 117, 118]. В целом, роль эндотелиального гликокаликса в атерогенезе еще не установлена, но есть некоторые интересные наблюдения, указывающие на его участие. Гликокаликс визуализировали в крупных артериях на различных животных моделях, предполагая, что гликокаликс может усиливать васкулопротекторные свойства сосудистой стенки в макрососудистой сети [30, 119].Защитные функции гликокаликса предполагаются из исследований экспериментального снижения образования гликокаликса за счет ингибирования синтеза HA, что привело к повышенной адгезии лейкоцитов в сонной артерии мышей с дефицитом ApoE и, в конечном итоге, к усилению атеросклероза [117]. Интересно, что толщина гликокаликса уменьшается в областях с высоким риском сонной артерии мыши (участки внутри артериальной системы с низкой или нарушенной скоростью сдвига) по сравнению с областями с низким риском, что подтверждает потенциальную роль разрушения гликокаликса в обеспечении нарушенного кровотока. регионы, более подверженные атерогенезу [30, 120].Помимо напряжения сдвига, еще одним фактором риска, который, как было показано, нарушает сосудистый гликокаликс, является отношение окисленных липопротеинов к ЛПНП [95]. Винк, ван ден Берг и его коллеги показали нарушение гликокаликса, вызванное диетой с высоким содержанием жиров и холестерина или введением клинически значимых доз бычьего ЛПНП, вызывая, например, повышенную адгезию тромбоцитов в микроциркуляции мышц хомяка. [95, 118]. Кроме того, воздействие на эндотелиальные клетки окисленного LDL in vitro снижает количество протеогликанов HS, связанных с поверхностью просветных клеток.Потеря гликокаликса также привела к отщеплению эндогенных защитных ферментов, таких как внеклеточная SOD, и увеличила окислительный стресс на эндотелиальные клетки. Интересно, что важность АФК в этом процессе была подчеркнута тем фактом, что совместное слияние СОД и каталаз аннулировало эффект ох-ЛПНП [95]. В целом, можно предположить, что слой гликокаликса играет важную роль в защите крупных сосудов от атеротромботического заболевания и что изменения эндотелиального гликокаликса участвуют в инициации и прогрессировании атеросклеротического процесса. 7.3. Ишемия / реперфузияИшемия / реперфузионное повреждение приводит к повреждению ткани, вызванному восстановлением кровотока к ткани / органу после периода нарушения кровотока, вызывающего полную или частичную ишемию. Хотя степень повреждения в результате ишемии / реперфузии варьируется в зависимости от ткани, общим компонентом этого патологического процесса является дисфункция микрососудов [2, 7, 93, 121]. В частности, в посткапиллярных венулах эндотелиальные клетки страдают от повышенного окислительного стресса, адгезии и трансмиграции лейкоцитов, а также проницаемости сосудов [2, 122].Участие изменений эндотелиального гликокаликса в этом процессе подтверждается данными, показывающими, что ишемия / реперфузионное повреждение может стимулировать отторжение гликокаликса [7, 93, 121–123]. Как показали Mulivor и Lipowsky, кишечная ишемия / реперфузия приводила к значительному уменьшению толщины гликокаликса в брыжеечных венулах крыс [93]. Аналогичным образом Bruegger et al. показали, что в исследовании ишемии-реперфузии с использованием изолированных сердец морских свинок нарушение вазодилатации эндотелия сопровождалось нарушением эндотелиального гликокаликса [122].У людей выделение гликокаликса было продемонстрировано у пациентов, перенесших серьезную сосудистую операцию с глобальной или региональной ишемией [124]. Интересно, что важность окислительного стресса в этом явлении также была подтверждена исследованиями, показавшими, что эффекты ишемии / реперфузии на гликокаликс могут быть ослаблены блокадой ксантин-оксидоредуктазы, эндогенного фермента, продуцирующего АФК, связанного с доменами HS в гликокаликс [121]. Взятые вместе, эти данные подтверждают роль эндотелиального гликокаликса в патофизиологии воспалительной реакции, связанной с повреждением тканей, вызванным ишемией / реперфузией. 7.4. Системное воспаление и травмаСистемный воспалительный ответ на микробную инфекцию или обширное повреждение тканей приводит к серьезным патологическим состояниям, таким как сепсис и полиорганная недостаточность [80]. Эти состояния сопровождаются нарушением функций сосудов, опосредованным различными факторами, включая нарушение регуляции синтеза NO и массовое высвобождение провоспалительных цитокинов, таких как TNF- α [80, 125]. Утечка из-за дефектов функции эндотелиального барьера — одна из основных клинических проблем, с которыми сталкиваются тяжелобольные [80, 104].Это приводит к серьезному нарушению микроциркуляции и, как следствие, нарушению системного кровообращения. В комплексном исследовании Schmidt et al. продемонстрировали, что эндотоксемия у мышей быстро индуцирует деградацию гликокаликса микрососудов легких через TNF- α -зависимые механизмы, включающие активацию эндотелиальной гепараназы [125]. Эта деградация гликокаликса эндотелия легких была связана с прилипанием нейтрофилов и воспалением и, возможно, с дыхательной недостаточностью, связанной с сепсисом [125].В предыдущих исследованиях экспериментально индуцированная эндотоксемия у крыс вызвала высвобождение ГК в плазме и уменьшение толщины эндотелиальной поверхности, что свидетельствует о деградации гликокаликса [126]. Точно так же экспериментально индуцированная эндотоксемия у мышей привела к увеличению уровней синдекана-1 в плазме, что указывает на деградацию гликокаликса [127]. В клинических исследованиях напрямую определяемое уменьшение толщины гликокаликса у пациентов в критическом состоянии было показано Donati et al., Которые наблюдали более глубокое уменьшение толщины у пациентов с более тяжелым сепсисом [128].Другие авторы показали, что повышенные уровни компонентов гликокаликса, таких как HS или синдекан-1, появляются в крови пациентов с септическим шоком и травмами [104, 125, 129–131], и что такие повышенные уровни были даже значительно выше у тех, кто не выжил, или положительно коррелировали. с повышенной летальностью [104, 131]. Кроме того, значительно повышенные уровни HS и синдекана-1 наблюдались у пациентов после обширных постабдоминальных операций даже без синдрома системной воспалительной реакции [130]. Значительное разрушение гликокаликса вскоре после индукции травмы также подтверждается данными, полученными Ostrowski et al.в отношении пациентов с тяжелыми травмами [132]. 8. Терапевтические стратегии для улучшения дисфункции гликокаликсаКак описано выше, при воспалительных условиях целостность эндотелиального гликокаликса ухудшается в различной степени, особенно во время генерализованных воспалительных реакций организма. Чтобы отследить эндогенное восстановление гликокаликса in vivo , Поттер и др. Провели интересное исследование, которые обнаружили, что после острой ферментативной или цитокин-опосредованной деградации гликокаликса для восстановления гликокаликса требуется от 5 до 7 дней. его первоначальная толщина.Таким образом, потенцирование этого процесса должно ограничивать воспалительные процессы в сосудах. Положительные эффекты терапевтических стратегий, которые могли бы предотвратить выделение компонентов гликокаликса, предотвратить деградацию структуры гликокаликса и потенцировать восстановление структуры гликокаликса, можно предположить для ряда патологических состояний, связанных с воспалительными процессами в сосудах, упомянутых выше. Терапевтические стратегии можно рассматривать с нескольких точек зрения. В принципе, можно различать терапевтические стратегии, непосредственно направленные на сохранение, поддержку или восстановление структуры гликокаликса, и стратегии с косвенным механизмом действия, подавляющие воспалительные процессы, которые приводят к повреждению структуры гликокаликса. 8.1. Сохранение структуры гликокаликса с помощью экзогенно применяемых ГАГОтделение ГАГ от структуры гликокаликса наблюдается как экспериментально, так и в клинических испытаниях. Таким образом, внутрисосудистое добавление сульфатированных полисахаридов для поддержки структуры гликокаликса или восстановления эндотелиального гликокаликса кажется интуитивно выгодным. Можно предположить, что повышенные уровни предшественников гликопротеинов в гликокаликсе могут вызывать регенерацию этих гликопротеинов. In vivo , гепарин, вводимый внутривенно, быстро и специфично взаимодействует с эндотелием [133]. Кроме того, было показано, что комбинация двух ГАГ, богатых гликокаликсом, HA и CS, вводимых путем инфузии, частично регенерирует капиллярный гликокаликс, поврежденный гиалуронидазой у хомяков [49]. Интересно, что обработка любой из этих молекул по отдельности не дала эффекта [49]. Интересно, что также in vitro , Potter и Damiano наблюдали поверхностно-связанный слой GAG на культивированном эндотелии пупочной вены человека только после добавления в культуральную среду GAG, HA и CS [53].Константинеску и др. продемонстрировали, что внутрисосудистое добавление HS и гепарина, но не декстрансульфата, ослабляет индуцированную окс-ЛПНП адгезию лейкоцитов и эндотелиальных клеток в венулах кремастера мышей после деградации эндотелиального гликокаликса путем местной микроинъекции гепаритиназы [77]. Интересно, что они показали, что флуоресцентно меченые HS и гепарин, но не декстрансульфат, прикреплялись к поверхности просвета венулы после введения ox-LDL. Точно так же внутривенное введение гепарина подавляло отрицательные эффекты ишемии / реперфузии, которые были определены прижизненной микроскопией в кремастерических микрососудах мышей как исключение макромолекул и внутрикапиллярное распределение эритроцитов [121].Однако предполагалось, что этот эффект связан со снижением продукции АФК, а не непосредственно с включением экзогенного гепарина в структуру гликокаликса. Интересно, что сулодексид, смесь предшественников гликокаликса GAG, состоящая из сульфата гепарина (80%) и дерматансульфата (20%), может быть включен в число соединений, предлагаемых в качестве возможного лечения дисфункционального гликокаликса. [112]. Это было показано Гамбаро и соавт. что длительное введение этого препарата ГАГ предотвращает морфологические и функциональные изменения почек и, по-видимому, восстанавливает установленные диабетические поражения почек при экспериментальной диабетической нефропатии, индуцированной у крыс [134].В клинических испытаниях Broekhuizen et al. продемонстрировали, что введение сулодексида в течение 2 месяцев увеличивало толщину гликокаликса, которая, как было обнаружено, в первую очередь изменялась у пациентов с диабетом 2 типа по сравнению со здоровыми людьми в контрольной группе, как было оценено в двух различных сосудистых руслах с использованием боковой визуализации темного поля и комбинированной ангиографии флуоресцеина и индоцианина зеленого для подъязычные сосуды и сосуды сетчатки соответственно [112]. Хотя устранение нарушений гликокаликса при диабете было лишь частичным, этот подход кажется многообещающим.В другом исследовании терапия сулодексидом в течение одного года снижала альбуминурию у пациентов с диабетом [135]. Препарат оказался активным при сахарном диабете 1 и 2 типа, а также у пациентов с микро- и макроальбуминурией. Не сообщалось об изменении метаболического контроля и системных побочных эффектах [135]. Наконец, сулодексид показал значительный кардиозащитный эффект после реваскуляризации миокарда у кроликов [136]. Однако ни в одном из этих исследований авторы не определили влияние на свойства гликокаликса. В отличие от вышеупомянутых исследований, внутривенное введение гепарина было связано с увеличением сосудистой утечки декстранов и нарушением артериолярной вазодилатации у мышей [101]. Кроме того, внутривенное введение гепарина привело к немедленному высвобождению восьми белков, которые, как было показано, локализуются в гликокаликсе со свойствами связывания HS у пациентов с нефропатией [137]. Авторы предполагают, что это было связано с ранее описанным высвобождением связанных с гликокаликсом белков из-за их конкурентного связывания с экзогенным гепарином [137], что затем отрицательно влияло на барьерные свойства гликокаликса и механотрансдукцию напряжения сдвига к эндотелию [101].В целом, эти авторы приходят к выводу, что провокация гепарином может оказывать неблагоприятное воздействие на гомеостаз сосудов, и предполагают, что нарушение гликокаликса может быть связано с этим явлением. Однако действие гепарина на интактный гликокаликс может отличаться от его эффекта на измененный гликокаликс, что является случаем предполагаемых положительных эффектов секвестрации экзогенного гепарина на функцию сосудов. 8.2. Сохранение структуры гликокаликса за счет естественного уровня белков плазмыПростейшим предлагаемым способом защиты гликокаликса является поддержание достаточно высокой концентрации белков плазмы [5, 6].С теоретической точки зрения Becker et al. предсказывают, что можно ожидать более плохую механическую стабильность гликокаликса, лишенного белков, повышенную восприимчивость к атаке протеазами, а также вторичное повреждение стенки сосуда, вызванное большим прилипанием воспалительных клеток [5, 6]. Защитный эффект добавок альбумина на сохранение гликокаликса на модели индуцированного трансплантацией ишемии / реперфузионного повреждения гликокаликса был представлен Jacob et al. [138]. Добавки альбумина значительно ослабляли выраженное выделение гликокаликса, а также интерстициальный отек и повышенную адгезию лейкоцитов, наблюдаемую после холодовой ишемии.Интересно, что экспериментальные исследования показывают, что концентрации альбумина, значительно более низкие, чем физиологические значения, могут быть достаточными для защиты целостности сосудов [139]. 8.3. Ингибиторы или поглотители токсинов, повреждающих гликокаликсВ этой части обсуждается прямое ингибирование факторов, участвующих в деградации гликокаликса. 8.4. В бесчисленных исследованиях было обнаружено, что антиоксиданты и антиоксиданты NOзащищают ткани и органы от ишемического / реперфузионного повреждения.Это действие может в значительной степени включать защиту гликокаликса [48, 95, 121, 140]. Однако ни в каких клинических исследованиях, направленных на сохранение проницаемости сосудов, этот подход убедительно не использовался. НЕТ может играть определенную роль. Это важная сигнальная молекула для сосудистых клеток. В то же время предполагается, что низкие уровни NO предотвращают окислительное повреждение клеток. Экспериментальное исследование Bruegger et al. описали защитный эффект NO, применяемый только во время реперфузии, на поддержание гликокаликса и барьера проницаемости перед лицом окислительно-восстановительного стресса [122].Это последнее действие проявлялось только в том случае, если гликокаликс не был предварительно разрушен ферментативно; таким образом, авторы считают ответственным за прямое улавливание радикалов NO [122]. 8,5. Ингибиторы протеазКак обсуждалось выше, поскольку сообщалось, что протеазы, такие как тромбин, поддерживают расщепление синдекановых эктодоменов, может быть открыта возможность терапевтического использования ингибиторов протеаз [36, 68, 141]. Среди протестированных ингибиторов — доксициклин. В нескольких исследованиях Mulivor и Lipowsky с соавторами продемонстрировали ингибирование активности ММП доксициклином, что значительно уменьшило отрыв гликокаликса и адгезию лейкоцитов к эндотелиальным клеткам в ответ на воспалительные и ишемические стимулы [76, 86–88].Другой кандидат — антитромбин III, физиологический ингибитор множества сериновых протеаз, естественно присутствующих в гликокаликсе, как описано выше. В нескольких исследованиях Чаппел и др. показали, что антитромбин значительно защищает гликокаликс от TNF- α и индуцированного ишемией / реперфузией выделения в сердце [36, 67, 68, 142]. Защита гликокаликса сопровождалась снижением адгезии постишемических лейкоцитов в сердце, снижением проницаемости сосудов, уменьшением утечки коронарных артерий и уменьшением интерстициального отека [36, 67, 68, 142]. 8.6. Подходы к сохранению структуры гликокаликса с косвенными механизмами действия (модулирование процессов, которые приводят к повреждению структуры гликокаликса)Другие подходы, которые можно было бы предложить для защиты гликокаликса, основаны на модуляции процессов, которые приводят к повреждению гликокаликса. В контексте описанного выше пагубного воздействия воспалительных процессов на целостность гликокаликса уменьшение воспалительных процессов с помощью различных типов лекарств можно предположить как высокопотенциальные терапевтические подходы. 8.7. TNF-α Ингибирование сигналовTNF- α является одним из ключевых медиаторов в развитии острого и хронического воспаления. Интересно, что клинически используемый ингибитор передачи сигналов TNF- α , этанерцепт, аналог рецептора TNF- α , значительно снижает выделение компонентов гликокаликса, активацию коагуляции и функциональные нарушения функции сосудов, вызванные экспериментальным применением эндотоксина у людей. [57]. 8.8. ГлюкокортикоидыГлюкокортикоиды обычно применяются для предотвращения интерстициального отека и набухания из-за значительного снижения проницаемости сосудов для макромолекул [5, 6, 36, 67, 68, 83, 142, 143]. Важность сохранения гликокаликса подтверждается результатами изолированной модели сердца, в которой предварительное кондиционирование гидрокортизоном значительно снижает выделение гликокаликса как после ишемии / реперфузии, так и после воспаления, вызванного TNF- α [36, 67, 83, 142] .Интересно, что клинические данные показывают, что гидрокортизон значительно снижает воспалительную реакцию и потребность в поддержке кровообращения и вентиляции у кардиохирургических пациентов, что, как предполагалось, связано с поддержанием функции сосудистого барьера, то есть с предотвращением выделения гликокаликса [143]. ]. Несмотря на положительный эффект глюкокортикоидов, точный механизм их действия остается неясным [83]. Помимо прямого действия гидрокортизона на эндотелиальные клетки, также было отмечено ингибирующее действие на иммунные эффекторные клетки.Некоторые авторы подчеркивают важность глюкокортикоидной стабилизации тучных клеток, которая должна предотвращать дегрануляцию и, следовательно, устранять протеолитическое повреждение гликокаликса и потенцирование воспаления [5, 6]. 8.9. Летучие анестетики Севофлуран и изофлуранБыло высказано предположение, что летучие анестетики, такие как севофлуран и изофлуран, обладают противовоспалительным действием и улучшают разрушение эндотелиального гликокаликса, вызванное воспалительной реакцией, опосредованной ишемией / реперфузией [144–146].Было показано, что севофлуран оказывает комплексное противовоспалительное действие на клетки крови, лейкоциты и тромбоциты и обеспечивает эндотелиальную защиту от ишемии / реперфузионного повреждения in vivo [147–149]. Прямое действие на эндотелиальные клетки было показано в исследовании in vitro , демонстрирующем немедленные и отсроченные защитные эффекты предварительной обработки изофлураном на цитокин-индуцированное повреждение эндотелиальных клеток человека [150]. Опосредованная севофлураном защита от разрушения эндотелиального гликокаликса была продемонстрирована в экспериментах по деградации, вызванной ишемией / реперфузией, на сердцах морских свинок, причем как прекондиционирование, так и быстрое посткондиционирование были успешными [144–146].Эти авторы предположили, что механизм включает ослабление высвобождения лизосомального катепсина B [145]. 8.10. Снижение гипергликемии или гиперхолестеринемииПоскольку предполагается, что объем гликокаликса значительно уменьшается во время гипергликемии или гиперхолестеринемии, как обсуждалось выше, терапевтическая нормализация уровней глюкозы в крови или липидного статуса крови может быть предложена для предотвращения этих изменений структуры гликокаликса. Однако, насколько нам известно, в настоящее время больше нет отчетов, которые предоставляли бы экспериментальные или клинические данные, демонстрирующие прямое улучшение структуры или функции гликокаликса после лечения препаратами, снижающими уровень глюкозы, такими как инсулин. Можно предположить снижение гиперхолестеринемии статинами. Интересно, что частичное восстановление объема системного гликокаликса по сравнению со здоровым контролем наблюдалось у пациентов с семейной гиперхолестеринемией после лечения розувастатином [151]. Однако в исследовании не проясняется, было ли это прямым эффектом статина на эндотелиальные клетки или более связанным с улучшением липидного статуса. 9. ЗаключениеШирокий спектр данных, как экспериментальных, так и клинических, демонстрирует, что целостность эндотелиального гликокаликса ухудшается в различной степени при воспалительных состояниях, особенно во время генерализованной воспалительной реакции организма.Однако необходимы усовершенствования методов, которые позволят провести достоверные исследования микрососудистого гликокаликса на изолированных эндотелиальных клетках, чтобы окончательно определить, является ли механотрансдукция функцией эндотелиального цитоскелета или артериального гликокаликса [78]. Интересно, что данные экспериментальных и клинических исследований предполагают возможность защиты или сохранения гликокаликса различными способами. Однако, несмотря на некоторые положительные результаты в нескольких исследованиях, существует скептицизм относительно их клинического использования в ближайшем будущем.Поскольку патологический процесс возникает на ранней стадии воспалительного процесса, такая стратегия теоретически проблематична. Однако, основываясь на текущих данных различных моделей, любой терапевтический подход, который улучшит структуру и функцию гликокаликса, будет иметь хороший потенциал для предотвращения патологических процессов, связанных с воспалением сосудов. Конфликт интересовАвторы заявляют об отсутствии конфликта интересов. БлагодарностиЭта работа была поддержана Чешским научным фондом No.P305 / 12 / J038 и Deutsche Forschungsgemeinschaft (KL 2516 / 1-1 и BA1870 / 9-1). Лукаш Кубала также получил поддержку Европейского фонда регионального развития, проект FNUSA-ICRC (№ CZ.1.05 / 1.1.00 / 02.0123). Роль альбумина в сохранении целостности эндотелиального гликокаликса и микроциркуляции: обзор | Анналы интенсивной терапии |

Leave A Comment