Решение задач по биологии на генетический код и биосинтез белка (9 класс)
Решение задач по биологии
Задача №1
Участок молекулы ДНК, кодирующий часть полипептида, имеет следующее строение:
-А –Ц –Ц –А –Т –А – Г –Т – Ц – Ц – А – А – Г – Г – А –
Определите последовательность аминокислот в полипептиде.
Дано: Решение:
Участок молекулы ДНК, 1. Зная кодирующую цепь ДНК,
кодирующий часть полипептида: по принципу комплемента
-А–Ц–Ц–А –Т–А–Г–Т–Ц–Ц– А– А– Г–Г–А –
Найти: последовательность аминокислот
в полипептиде.
ДНК: — А –Ц –Ц – А – Т – А – Г – Т – Ц – Ц – А – А – Г – Г – А –
и –РНК:-У – Г – Г – У – А – У – Ц – А – Г – Г –У – У – Ц – Ц – У –
2. Используя таблицу генетического кода, определяем последовательность аминокислот в полипептиде.
УГГ – триптофан
УАУ – тирозин
ЦАГ – глутамин
ГУУ – валин
ЦЦУ – пролин
Ответ: триптофан – тирозин – глутамин – валин – пролин
Задача №2
Сколько нуклеотидов содержит ген (обе цепи ДНК), в котором запрограммирован белок инсулин из 51 аминокислоты?
Дано: Решение:
Белок инсулин – 51 аминокислота Одним из свойств генетического кода
Найти: количество нуклеотидов, является то, что каждая аминокислота
содержащихся в гене, в котором кодируется триплетом ДНК.
запрограммирован белок инсулин?
1.Подсчитаем количество нуклеотидов в одной цепи ДНК.
51* 3=153 нуклеотида
2.Подсчитаем, сколько нуклеотидов содержит ген (обе цепи ДНК)
153* 2 =306 нуклеотидов
Ответ: 306 нуклеотидов.
Задача №3
Одна из цепей ДНК имеет молекулярную массу 34155. Определите количество мономеров
Определите количество мономеров
Белка, запрограммированного в этой ДНК.
Дано: Решение
Масса ДНК – 34155 Молекулярная масса одного нуклео-
Найти: количество мономеров белка? тида 345
1. Подсчитаем количество нуклеотидов в ДНК.
34155 : 345 = 99 нуклеотидов
2.Подсчитаем количество мономеров белка.
99 : 3 =33 триплета в ДНК кодируют 33 аминокислоты белка
Ответ: 33 мономера
Задача №4
Какова молекулярная масса гена (двух цепей ДНК), если в одной его цепи
Запрограммирован белок с молекулярной массой 1500?
Дано: Решение
Масса белка – 1500 1.Подсчитаем количество
Найти: массу гена двух цепей ДНК? аминокислот в белке.
1500: 100 = 15 аминокислот
2. Подсчитаем количество нуклеотидов в одной цепи гена.
15* 3 =45 нуклеотидов
3.Найдем молекулярную массу одной цепи гена.
45* 345 = 15525
4.Найдем молекулярную массу двух цепей.
15525 * 31050
Ответ: 31050
Задача №5
Фрагмент молекулы ДНК содержит 2348 нуклеотидов. На долю адениновых приходится 420. Сколько содержится других нуклеотидов? Найдите массу и длину фрагмента ДНК.
Дано: Решение.
ДНК – 2348 нуклеотидов 1. Исходя из принципа комплементар-
А -420 ности можно определить количество Т.
Найти: Т- ? Г — ? Ц — ? А = Т , А = 420, значит и Т = 420
Массу ДНК — ? 2. Подсчитаем общее количество Г и Ц.
Подсчитаем общее количество Г и Ц.
Длина ДНК — ? 2348 -840 = 1508
2. Определяем количество Г и Ц.
3. 1508 : 2 = 754
4. Подсчитаем массу и длину ДНК.
mДНК — 2348 * 345 = 810060
LДНК – 1174 * 0,34 нм = 399,16 нм
Ответ: А – 420, Т = 420, Г = 754, Ц = 754;
MДНК — 810060
LДНК – 399,19 нм
Задания для самостоятельной работы
Задача №1
Сколько нуклеотидов содержит ген (обе цепи ДНК), в котором запрограммирован белок инсулин из 51 аминокислоты?
Задача №2
Какова молекулярная масса гена (двух цепей ДНК), если в одной его цепи
Запрограммирован белок с молекулярной массой 1800?
Задача №3
Участок молекулы ДНК, кодирующий часть полипептида, имеет следующее строение:
-А –Ц –Ц –А –Т –А – Г –Т – Ц – Ц – А – А – А – Ц – Ц –
Определите последовательность аминокислот в полипептиде.
Задача №4 Одна из цепей ДНК имеет молекулярную массу 41400. Определите количество мономеров белка, запрограммированного в этой ДНК.
Задача №5
Фрагмент молекулы ДНК содержит 3048 нуклеотидов. На долю цитозиновых приходится 460. Сколько содержится других нуклеотидов? Найдите массу и длину фрагмента ДНК.
Литература.
А.Ю. Гаврилова Биология 10 класс . Поурочные планы. Часть 1. Волгоград. Изд. «Учитель»
Решение задач по молекулярной биологии
Решение задач по молекулярной биологии предполагает закрепление знаний о строении и свойствах нуклеиновых кислот, умений пользоваться биологической терминологией и символикой, подготовку к решению задач ЕГЭ.
Для успешного решения задач по молекулярной биологии учащиеся должны знать следующий материал:
Один шаг это полный виток спирали ДНК–поворот на 360
Один шаг составляют 10 пар нуклеотидов
Длина одного шага – 3,4 нм
Расстояние между двумя нуклеотидами – 0,34 нм
В молекуле ДНК: А+Г=Т+Ц (Правило Чаргаффа: ∑(А) = ∑(Т), ∑(Г) = ∑(Ц), ∑(А+Г) =∑(Т+Ц)
Комплементарность нуклеотидов: А=Т; Г=Ц
Цепи ДНК удерживаются водородными связями, которые образуются между комплементарными азотистыми основаниями: аденин с тимином соединяются 2 водородными связями, а гуанин с цитозином тремя
Рассмотрим некоторые типы решения задач по молекулярной биологии
1. Участок одной цепи молекулы ДНК имеет последовательность нуклеотидов: А-Г-Т-Ц-Т-А-А-Ц-Т-Г-А-Г-Ц-А-Т. Запишите последовательность нуклеотидов второй цепи ДНК.
Участок одной цепи молекулы ДНК имеет последовательность нуклеотидов: А-Г-Т-Ц-Т-А-А-Ц-Т-Г-А-Г-Ц-А-Т. Запишите последовательность нуклеотидов второй цепи ДНК.
Дано: ДНК А-Г-Т-Ц-Т-А-А-Ц-Т-Г-А-Г-Ц-А-Т
Решение: ( нуклеотиды второй цепи ДНК подбираем по принципу комплементарности А-Т, Г-Ц) ДНК А Г Т Ц Т А А Ц Т Г А Г Ц А Т ДНК Т Ц А Г А Т Т Г А Ц Т Ц Г Т А
Ответ : вторая цепь ДНК имеет последовательность нуклеотидов Т-Ц-А-Г-А-Т-Т-Г-А-Ц-Т-Ц-Г-Т-А
2. Участок цепи молекулы ДНК имеет последовательность нуклеотидов: Ц-Т-А-А-Ц-Ц-А-Т-А-Г-Т-Т-Г-А-Г. Запишите последовательность нуклеотидов иРНК.
Дано: ДНК Ц-Т-А-А- Ц-Ц-А-Т-А-Г-Т-Т- Г- А- Г
Решение: ( нуклеотиды иРНК подбираем по принципу комплементарности к ДНК : А-У, Г-Ц)
ДНК Ц Т А А Ц Ц А Т А Г Т Т Г А Г
РНК Г А У У Г Г У А У Ц А А Ц У Ц;
Ответ : иРНК имеет последовательность нуклеотидов Г-А-У-У-Г- Г-У-А-У-Ц-А-А-Ц-У-Ц
 Определите последовательность нуклеотидов иРНК, антикодоны молекул тРНК , если фрагмент ДНК имеет последовательность нуклеотидов Г-Ц-Ц-Т-А-Ц-Т-А-А-Г-Т-Ц
Определите последовательность нуклеотидов иРНК, антикодоны молекул тРНК , если фрагмент ДНК имеет последовательность нуклеотидов Г-Ц-Ц-Т-А-Ц-Т-А-А-Г-Т-ЦДано: ДНК Г-Ц-Ц-Т-А-Ц-Т-А-А-Г-Т-Ц
Решение: (нуклеотиды подбираем по принципу комплементарности А-У, Г-Ц под ДНК сначала строим иРНК, затем тРНК)
ДНК Г Ц Ц Т А Ц Т А А Г Т Ц
иРНК Ц Г Г А У Г А У У Ц А Г
тРНК Г Ц Ц У А Ц У А А Г У Ц
Ответ : иРНК имеет последовательность нуклеотидов Ц Г Г А У Г А У У Ц А Г антикодоны тРНК Г Ц Ц У А Ц У А А Г У Ц
Второй тип задач — на вычисление количества нуклеотидов, их процентное соотношение в цепи ДНК, иРНК.
1. В одной молекуле ДНК нуклеотидов с тимином Т -22% . Определите процентное содержание нуклеотидов с А, Г, Ц по отдельности в этой молекуле ДНК.
Дано: Т -22%
Найти: % А, Г, Ц
Решение
1: согласно правилу Чаргаффа А+Г = Т+Ц, все нуклеотиды в ДНК составляют 100%.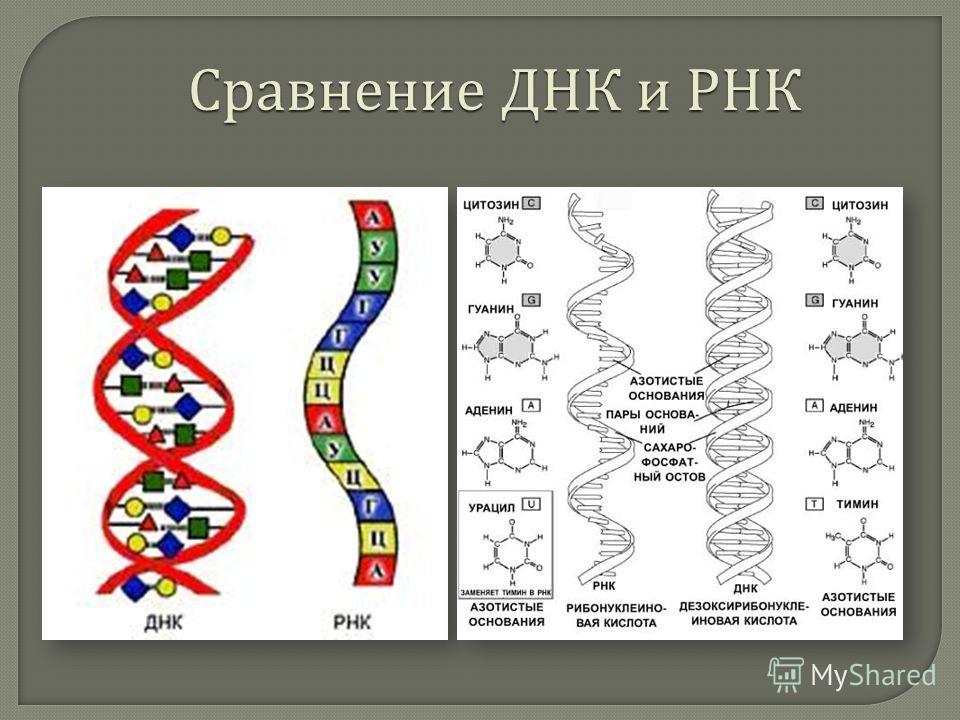 Так как тимин комплементарен аденину, то А=22%. 22+22=44% ( А+Т) 100- 44 =56% (Г+Ц) Так как гуанин комплементарен цитозину, то их количество тоже равно, поэтому 56 : 2 =28% (Г, Ц)
Так как тимин комплементарен аденину, то А=22%. 22+22=44% ( А+Т) 100- 44 =56% (Г+Ц) Так как гуанин комплементарен цитозину, то их количество тоже равно, поэтому 56 : 2 =28% (Г, Ц)
2: согласно правилу Чаргаффа А+Г = Т+Ц, все нуклеотиды в ДНК составляют 100% или А+Г и Т+Ц по 50 % Так как тимин комплементарен аденину, то А=22%. следовательно 50 — 22=28% (Г, Ц, т.к. они комплементарны)
Ответ : А=22%, Г=28%, Ц=28%
2. Сколько содержится нуклеотидов А, Т, Г, во фрагменте молекулы ДНК, если в нем обнаружено 1500 нуклеотидов Ц, что составляет 30% от общего количества нуклеотидов в этом фрагменте ДНК?
Дано: Ц- 30% =1500 нуклеотидов
Найти: количество нуклеотидов А, Т, Г
Решение: Так как Ц комплементарен Г и их количество равно, то Г =30%, что составляет 1500 нуклеотидов. согласно правилу Чаргаффа А+Г = Т+Ц, все нуклеотиды в ДНК составляют 100% А+Г и Т+Ц по 50 % следовательно 50-30=20% (А, Т).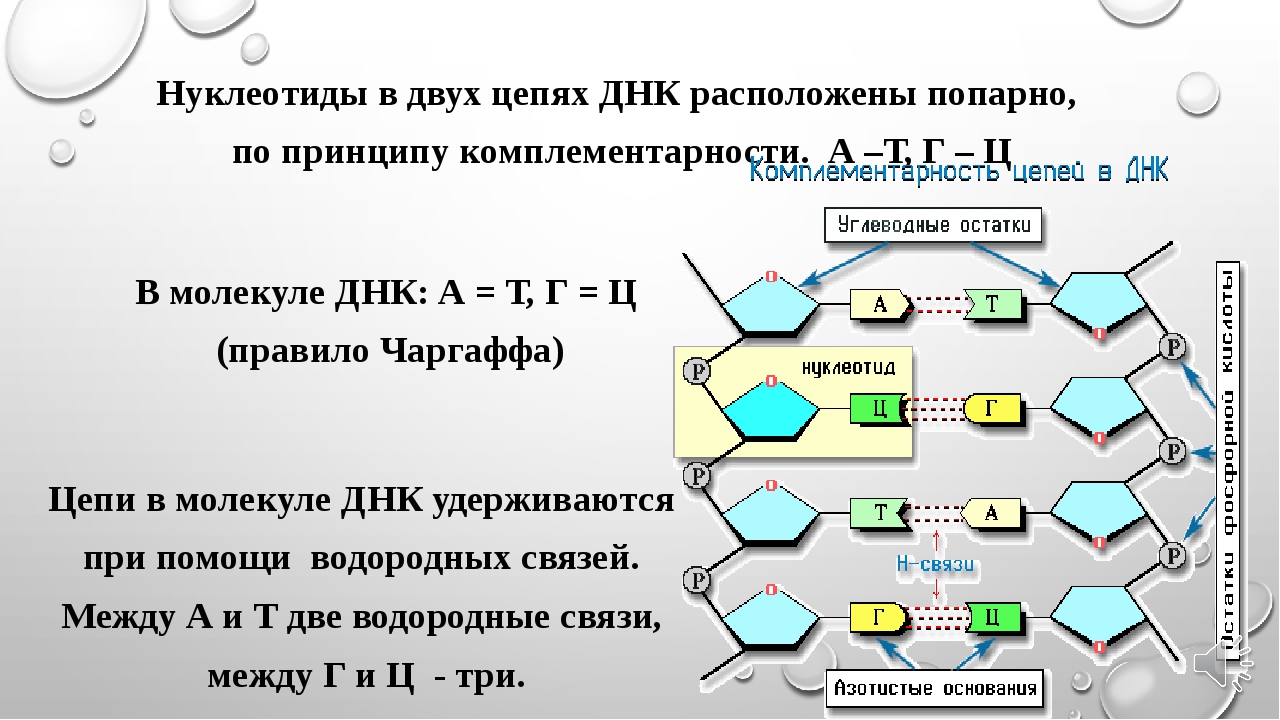 Составим пропорцию 30% — 1500 20% — ? 20х1500 : 30 =1000 нуклеотидов (А, Т)
Составим пропорцию 30% — 1500 20% — ? 20х1500 : 30 =1000 нуклеотидов (А, Т)
Ответ: во фрагменте молекулы ДНК содержится: Г=1500 нуклеотидов, А=1000 нуклеотидов, Т=1000 нуклеотидов.
3. Участок молекулы ДНК ( одна цепочка) содержит: 150 нуклеотидов – А, 50 нуклеотидов – Т, 300 нуклеотидов – Ц, 100 нуклеотидов — Г. Определите : количество нуклеотидов во второй цепи с А, Т, Г, Ц и общее количество нуклеотидов с А, Т, Ц, Г в двух цепях ДНК.
Дано: нуклеотидов в 1-й цепи ДНК: А-150, Т-50, Ц-300, Г-100.
Найти: А, Т, Ц, Г в двух цепях ДНК.
Решение: А=Т, Г=Ц, так как они комплементарны, поэтому во второй цепи Т-150, А-50, Г-300, Ц-100 Всего нуклеотидов: А(150+50)+Т(50+150)+Г(300+100)+Ц(100+300)=1200
Ответ: нуклеотидов во второй цепи Т-150, А-50, Г-300, Ц-100; 1200 нуклеотидов в двух цепях.
Третий тип задач на вычисление количества водородных связей.
1. Две цепи ДНК удерживаются водородными связями. Определите число водородных связей в этой цепи ДНК, если известно, что нуклеотидов с аденином 12, с гуанином 20.
Дано: А-12, Г-20
Найти: водородных связей в ДНК
Решение: А=Т, Г=Ц, так как они комплементарны Между А и Т двойная водородная связь, поэтому 12х2=24 связи Между Г и Ц тройная водородная связь, поэтому 20х3=60 связей 24+60=84 водородных связей всего
Ответ: 84 водородных связей.
Четвертый тип задач определение длины, ДНК, иРНК
Участок молекулы ДНК состоит из 60 пар нуклеотидов. Определите длину этого участка (расстояние между нуклеотидами в ДНК составляет 0, 34 нм)
Дано: 60 пар нуклеотидов
Найти: длину участка
Решение: длина нуклеотида 0, 34 нм 60х0,34= 20,4 нм
Ответ: 20,4 нм ;
Длина участка молекулы ДНК составляет 510нм. Определите число пар нуклеотидов в этом участке.
Определите число пар нуклеотидов в этом участке.
Дано: длина участка ДНК 510нм
Найти: Определите число пар нуклеотидов
Решение: длина нуклеотида 0, 34 нм 510:0,34= 1500 нуклеотидов
Ответ: 1500 нуклеотидов;
Число нуклеотидов в цепи ДНК равно 100. Определите длину этого участка Число нуклеотидов в цепи ДНК равно 100. Определите длину этого участка
Дано: 100 нуклеотидов
Найти: длину участка
Решение: длина нуклеотида 0, 34 нм , ДНК состоит из 2-х цепей значит 50 пар нуклеотидов. 50х0,34=17нм
Ответ: 17нм;
Выход | Изменить
Закрыть
Генные мутации, задачи на генные мутации
Генные мутации, задачи на генные мутации. Генная мутация-изменение нуклеотидной последовательности одного гена.
Генная мутация-изменение нуклеотидной последовательности одного гена.
Типы генных мутаций:
- Замена одного нуклеотида в гене на другой нуклеотид (миссенс мутация). Происходит из-за ошибки ДНК-полимеразы при репликации ДНК.
Последствия миссенс мутаций:
а) Миссенс мутация приводит к изменению первичной структуры и функции соответствующего белка, если образовавшейся в результате мутации кодон кодирует новую аминокислоту.
До мутации:
ДНК: АТГЦЦАААГГГА
иРНК: УАЦГГУУУЦЦЦУ
первичная стр-ра белка: Тир Гли Фен Про
После мутации:
ДНК: АТГЦЦАААТГГА
иРНК: УАЦГГУУУАЦЦУ
первичная стр-ра белка: Тир Гли Лей Про
В результате мутации произошла замена одной аминокислоты, следовательно, первичная структура и функция белка изменились.
б) Миссенс мутация не приводит к изменению первичной структуры и функции соответствующего белка, если образовавшейся в результате мутации кодон кодирует ту же аминокислоту, что и исходный (из-за свойства вырожденности генетического кода).
До мутации:
ДНК: АТГЦЦАААГГГА
иРНК: УАЦГГУУУЦЦ
первичная стр-ра белка: Тир Гли Фен Про
После мутации:
ДНК: АТГЦЦААААГГА
иРНК: УАЦГГУУУУЦЦУ
первичная стр-ра белка: Тир Гли Фен Про
В результате мутации произошла замена Г на А в составе последовательности ДНК. Однако эта мутация не привела к изменению структуры и функции соответствующего белка, так как новый кодон УУУ кодирует ту же аминокислоту (Фен), что и исходный – УУЦ.
- Выпадение или вставка одного или нескольких кодонов в составе нуклеотидной последовательности гена. Выпадение одного кодона происходит из-за ошибки ДНК-полимеразы при репликации ДНК и приводит к выпадению одной аминокислоты из первичной структуры белка.
 Соответственно, такая мутация приводит к изменению структуры и функции соответствующего белка.
Соответственно, такая мутация приводит к изменению структуры и функции соответствующего белка.
До мутации:
ДНК: АТГЦЦАААГГГА
иРНК: УАЦГГУУУЦЦЦУ
первичная стр-ра белка: Тир Гли Фен Про
После мутации:
ДНК: АТГААГГГА
иРНК: УАЦУУЦЦЦУ
первичная стр-ра белка: Тир Фен Про
- Вставка или выпадение одного или 2-х нуклеотидов (Мутация со смещением открытой рамки считывания). Происходит из-за ошибки ДНК-полимеразы при репликации ДНК. Данная мутация приводит к изменению всех аминокислот в первичной структуре белка, начиная с точки мутации. Это в большинстве случаев приводит к полному нарушению структуры и функции белка.
До мутации:
ДНК: АТГЦЦЦАТААГЦ
иРНК: УАЦГГГУАУУЦГ
первичная стр-ра белка: Тир Гли Тир Сер
В результате мутации произошла вставка 1 нуклеотида
После мутации:
ДНК: АТГГЦЦЦАТААГЦ
иРНК: УАЦЦГГГУАУУЦГ
первичная стр-ра белка: Тир Арг Вал Фен
- Появление стоп-кодона в кодирующей части гена (нонсенс мутация).
 В результате, полипептидная цепь соответствующего белка становится короче, что приводит к значительному изменению первичной структуры и функции белка.
В результате, полипептидная цепь соответствующего белка становится короче, что приводит к значительному изменению первичной структуры и функции белка.
До мутации:
ДНК: АТГЦЦЦАТААГЦ
иРНК: УАЦГГГУАУУЦГ
первичная стр-ра белка: Тир Гли Тир Сер
Произошла замена Т на Ц в последовательности нуклеотидов соответствующего гена. В результате в кодирующей части мРНК возник стоп-кодон – УАГ, что привело к преждевременной остановке трансляции.
После мутации:
ДНК: АТГЦЦЦАЦААГЦ
иРНК: УАЦГГГУАГУЦГ
первичная стр-ра белка: Тир Гли
Одна из задач ЕГЭ на тему «Генные мутации»
Задача 6
В результате генной мутации в полипептидной цепи соответствующего белка аминокислота Про заменилась на Цис. Последовательность иРНК до мутации: ГЦУУУЦЦЦЦГАЦУЦА. Определите аминокислотный состав молекулы нормального и мутированного белка, а также возможные последовательности нуклеотидов мутированной иРНК. Ответ поясните.
Определите аминокислотный состав молекулы нормального и мутированного белка, а также возможные последовательности нуклеотидов мутированной иРНК. Ответ поясните.
До мутации:
иРНК: ГЦУУУЦЦЦЦГАЦУЦА
белок: Ала Фен Про Асп Сер
Причиной замены третьей аминокислоты Про на Цис являлась генная мутация в нуклеотидной последовательности соответствующего гена, в результате которой произошло изменение триплета в составе мРНК, кодирующего третью аминокислоту. Исходя из свойства вырожденности генетического кода, аминокислота Цис может быть закодирована двумя возможными триплетами – УГУ, УГЦ. Соответственно, в результате мутации в иРНК мог появиться любой из этих триплетов. Вероятнее всего УГЦ, так как при этом должно замениться меньше всего нуклеотидов.
Варианты мутированной последовательности иРНК: ГЦУУУЦУГУГАЦУЦА; ГЦУУУЦУГЦГАЦУЦА
После мутации:
иРНК: ГЦУУУЦУГЦГАЦУЦА
белок: Ала Фен Цис Асп Сер
Ответ: последовательности иРНК с мутацией: ГЦУУУЦУГУГАЦУЦА; ГЦУУУЦУГЦГАЦУЦА.
Первичная структура нормального белка: Ала Фен Про Асп Сер
Первичная структура белка после мутации: Ала Фен Цис Асп Сер
Краткий словарь генетических терминов
Краткий словарь основных понятий и терминов, использующихся в генетике
Для понимания того, с чем работает наша компания и зачем эта работа нужна, какие результаты мы получаем и что они вам расскажут, можно прийти на консультацию к специалистам ЦГРМ «ГЕНЕТИКО». А для того, чтобы Вы не забыли, о чем был разговор, и не утонули в море новой информации, мы составили для Вас небольшой словарик основных понятий и терминов, использующихся в генетике.
Основным положением биологической науки является то, что клетка – это самое маленькое из возможных проявление жизни и что новая клетка может появиться только от уже существующей и никак не может возникнуть сама по себе. Конечно, это приводит к большому количеству вопросов о том, как зародилась жизнь и каким образом могла сформироваться самая первая клетка. Но для удобства будем считать обозначенные положения верными в современной реальности планеты Земля, где мы живем. Несмотря на невообразимо огромное разнообразие живых существ, все они состоят из клеток. И у всех клеток есть схожие черты, которые обусловлены самыми простыми жизненными необходимостями. Во-первых, клетка должна как-то отделяться от внешнего пространства – для этого есть специальная оболочка.
Но для удобства будем считать обозначенные положения верными в современной реальности планеты Земля, где мы живем. Несмотря на невообразимо огромное разнообразие живых существ, все они состоят из клеток. И у всех клеток есть схожие черты, которые обусловлены самыми простыми жизненными необходимостями. Во-первых, клетка должна как-то отделяться от внешнего пространства – для этого есть специальная оболочка.
Во-вторых, клетка должна питаться – для этого есть разные системы, способные преобразовать энергию света или химических связей в необходимые для жизни вещества и удобную для использования энергию. И еще клетка умеет размножаться. Для выполнения всех этих функций необходимы механизмы, основу которых составляют белки и РНК. А вот инструкция, как эти молекулы должны выглядеть и работать, хранится в специальном отсеке клетки – ядре – в виде ДНК. Ошибки в этой инструкции, которая разрабатывалась миллионы лет, приводят к смерти клетки. А в многоклеточном организме, таком, как у человека, например, клетки взаимодействуют друг с другом, поэтому нарушение в работе одной или нескольких клеток может привести не к смерти всего организма, а к нарушениям его работы – заболеваниям. Также необходимо помнить, что человеческий организм огромная система, ансамбль миллионов разнообразных маленьких организмов, которые выросли из одной единственной клетки – зиготы – результата слияния яйцеклетки и сперматозоида.
Также необходимо помнить, что человеческий организм огромная система, ансамбль миллионов разнообразных маленьких организмов, которые выросли из одной единственной клетки – зиготы – результата слияния яйцеклетки и сперматозоида.
ДНК – ДезоксиРибонуклиновая Кислота – полимер, то есть молекула с большим количеством последовательно повторяющихся структурных элементов, который несет всю информацию о генах и белках, необходимых для жизни всего организма. ДНК является картотекой, библиотекой и матрицей, с которой считывается информация в определенной последовательности и определенных условиях, разъяснения о которых записаны как в самой ДНК, так и с помощью различных дополнительных модификаций этой молекулы. Каждой хромосоме соответствует 1 молекула ДНК. Структурными блоками этого полимера являются дезоксирибонуклеотиды (=нуклеотиды), которые бывают 4х видов (А, Т, Г, Ц).
Последовательность ДНК – это то, в каком порядке в молекуле ДНК идут ее структурные элементы – нуклеотиды. Таким образом, генетической информацией является именно последовательность ДНК, а молекула ДНК является ее физическим носителем.
Таким образом, генетической информацией является именно последовательность ДНК, а молекула ДНК является ее физическим носителем.
Хромосома – это молекула ДНК, специальным образом обернутая различными белками, которые помогают управляться с такой длинной молекулой, чтобы она не порвалась, не перепуталась с другими ДНК-молекулами и была физически доступна для белков, осуществляющих работу всего генетического аппарата.
РНК –РибоНуклиновая Кислота – полимер, который выполняет функциональную роль переносчика информации, то есть копии, которая делается с ДНК и используется для создания функциональных молекул: специальных РНК или белков. Специальные молекулы РНК могут не являться матрицами, на базе которых синтезируется белок, а сами выполняют структурные, ферментативные или транспортные функции. Главное, что последовательность структурных блоков в молекуле РНК всегда определена последовательностью ДНК соответствующего участка.
Белок – основная функциональная единица живой клетки с самым широчайшим спектром функций и возможностей.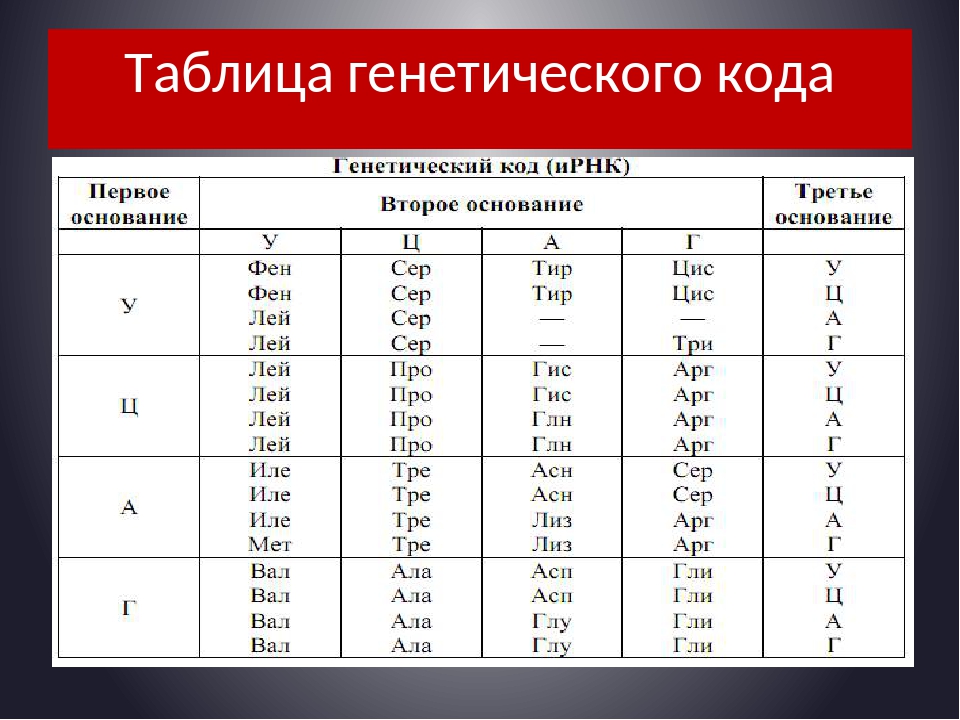 Как ДНК и РНК, является полимером, однако имеет химически иные структурные блоки – аминокислоты. Их последовательность, с одной стороны, напрямую зависит от соответствующей последовательности ДНК и может изменяться только в ограниченных и предусмотренных в ДНК инструкций, с другой стороны является основой структуры, в том числе пространственной, возможностей и функции белков разных типов.
Как ДНК и РНК, является полимером, однако имеет химически иные структурные блоки – аминокислоты. Их последовательность, с одной стороны, напрямую зависит от соответствующей последовательности ДНК и может изменяться только в ограниченных и предусмотренных в ДНК инструкций, с другой стороны является основой структуры, в том числе пространственной, возможностей и функции белков разных типов.
Ген – определение гена включает два аспекта: теоретический и физический. Теоретически, то есть умозрительно, геном называют последовательность ДНК (слово, записанное на языке генетики), обладающее определенными свойствами. Как и слово в языке, ген является основой наследственной информации, в то время как различные другие структуры можно отнести к знакам препинания или вспомогательным элементам. Ген является подробной инструкцией для синтеза белка или специфической РНК, которую он кодирует. Причем эта инструкция описывает не только последовательность молекул, но и то в каких условиях и как они должны работать и выполнять свои функции. С физической, то есть материальной, точки зрения, ген – это часть молекулы ДНК с определенными структурными элементами. Как внутри слова есть приставка, корень, суффикс и окончание, позволяющие слову адаптироваться для каждой конкретной фразы, так и у гена есть промотор, экзоны и интроны. Первый обозначает начало гена, экзоны – это ключевая информация о последовательности РНК или белка, а интроны необходимы для регуляции и тонкой настройки работы гена в условиях разных тканей, органов и изменяющейся окружающей среды.
С физической, то есть материальной, точки зрения, ген – это часть молекулы ДНК с определенными структурными элементами. Как внутри слова есть приставка, корень, суффикс и окончание, позволяющие слову адаптироваться для каждой конкретной фразы, так и у гена есть промотор, экзоны и интроны. Первый обозначает начало гена, экзоны – это ключевая информация о последовательности РНК или белка, а интроны необходимы для регуляции и тонкой настройки работы гена в условиях разных тканей, органов и изменяющейся окружающей среды.
Экспрессия гена – это эффективность работы гена, так как для его функционирования недостаточно его наличия в геноме – с него должна считываться информация. Именно то, как часто и в каком объеме считывается информация с гена, выражают термином экспрессия.
Локус – участок молекулы ДНК, содержащий различный структурные элементы, в том числе один или несколько генов.
Геном– это последовательность всех молекул ДНК организма. Важно помнить, что в каждой клетке одного организма в норме содержатся одинаковые по количеству и последовательностям молекулы ДНК, а различается экспрессия конкретных генов.
Важно помнить, что в каждой клетке одного организма в норме содержатся одинаковые по количеству и последовательностям молекулы ДНК, а различается экспрессия конкретных генов.
Экзом – это последовательности ДНК экзомных участков генов, то есть так называемая основная кодирующая составляющая. Это то, с чем работает организм, в то время как остальная часть генома объясняет, как работать и в каких условиях как применять и настраивать кодирующую часть генома.
Мутация – изменение последовательности ДНК по сравнению другими клетками организма или другими представителями вида. Мутации могут возникать как из-за воздействия внешних неблагоприятных условий, так и из-за того, что наши ферменты работают пусть с редкими, но ошибками. Так как происходит физическое изменение в носителе информации – ДНК, такое изменение может передаваться из поколения в поколение.
Частота мутаций — относительное значение, показывающее у какой доли людей в геноме есть конкретная мутация. Частоту мутации можно рассчитать, как среднюю для всех людей, так и отдельно по расовым или национальным, или любы другим группам. В медицинской генетике под мутацией подразумевают изменение ДНК, которое может быть связано с каким-то заболеванием, и противопоставляют ее полиморфизму. Хотя по общей логике полиморфизм – это частный случай мутации.
Частоту мутации можно рассчитать, как среднюю для всех людей, так и отдельно по расовым или национальным, или любы другим группам. В медицинской генетике под мутацией подразумевают изменение ДНК, которое может быть связано с каким-то заболеванием, и противопоставляют ее полиморфизму. Хотя по общей логике полиморфизм – это частный случай мутации.
Полиморфизм – нейтральная, а точнее безвредная, мутация, которая сравнительно часто встречается у какой-то группы организмов одного вида. Некоторые мутации встречаются часто у всех людей, некоторые – только среди представителей определенных рас или народностей.
Аллель – вариант последовательности гена в разном виде: от различия в одной букве последовательности до отсутствия целого куска последовательности или вставке лишнего. Эти различия возникают из-за мутации, которая могла произойти у далекого предка и передаться потомству через поколения. Таким образом, каждый ген у отдельного человека может быть представлен конкретным вариантом – аллелем. Для понимания аллелизма необходимо объяснить, что, например, различия в цвете глаз, волос, росте, чувствительности к алкоголю объясняются именно разными аллельными состояниями соответствующих генов.
Для понимания аллелизма необходимо объяснить, что, например, различия в цвете глаз, волос, росте, чувствительности к алкоголю объясняются именно разными аллельными состояниями соответствующих генов.
Генотип – это все гены конкретной особи с указанием аллельного состояния каждого гена и наличия/отсутствия мутаций в межгенных участках ДНК.
Доминантный аллель. В геноме человека содержится по 2 копии каждой хромосомы. Это означает, что в каждом геноме есть две очень похожие по длине и последовательности генов молекулы ДНК, которые отличаются аллельными состояниями генов и мутациями/полиморфизмами в межгенных участках этих молекул ДНК. Из этого следует, что и каждый ген представлен в геноме 2 копиями, каждая из которых может быть определенным вариантом (аллелем) этого гена. Доминантным аллелем называется тот, одной копии которого достаточно для проявления его особенностей. То есть если хотя бы на одной из хромосом ген находится в состоянии доминантного аллеля, то ген будет работать по тому варианту, который описывается именно этим аллелем. Важно, что так как у одного гена может быть более двух вариантов (аллелей), то и доминантность аллеля определяется по отношению к каждому из вариантов, хотя есть и те, которые доминантны по сравнению со всеми другими. Встречаются варианты с одинаковой предпочтительностью для работы, тогда проявляется совместное влияние этих вариантов.
Важно, что так как у одного гена может быть более двух вариантов (аллелей), то и доминантность аллеля определяется по отношению к каждому из вариантов, хотя есть и те, которые доминантны по сравнению со всеми другими. Встречаются варианты с одинаковой предпочтительностью для работы, тогда проявляется совместное влияние этих вариантов.
Рецессивный аллель – по аналогии с доминантным аллелем, это такое состояние гена, которое наименее предпочтительно для проявления. Поэтому если в геноме есть другая копия гена, доминантная, то задавать темп работы гена будет именно она, но если и вторая копия гена представлена рецессивным аллелем, то будет работать этот, хотя менее предпочтительный, но в такой ситуации единственно имеющийся вариант. Хотя в большинстве случаев связанные с возникновением заболевания аллели рецессивны, это вредность/полезность не является единственным определяющим фактором рецессивности/доминантности аллеля.
Гомозигота. Гомозиготой по определенной мутации/полиморфизму/аллелю называют такую клетку или организм, в генотипе которой/которого обе копии гена на двух хромосомах представлены одним вариантом, то есть не отличаются по этой мутации/полиморфизму/аллелю.
Гетерозигота. Гетерозиготой по определенной мутации/полиморфизму/аллелю называют такую клетку или организм, в генотипе которой/которого две копии гена на двух хромосомах представлены разными вариантами, то есть отличаются по этой мутации/полиморфизму/аллелю.
Секвенирование – это группа методов, позволяющая узнать последовательность нуклеотидов в молекуле ДНК. Этот метод обладает некоторыми особенностями. Во-первых, пока что ни один способ секвенирования не позволяет прочитать всю последовательность одной хромосомы, чтение идет сравнительно небольшими отрезка от 50 до несколько тысяч нуклеотидов. Во-вторых, почти все методы устроены так, что из кусочка ДНК делается много одинаковых и читаются они все. Эта особенность проявляется в таком параметре секвенирования, как глубина секвенирования, обозначаемая 10Х, 20Х, 50Х. Чем больше это значение, тем больше раз прочитан один и тот же кусок молекулы, тем точнее можно выявить ошибки секвенирования и особенности участка, например, его гетерозиготность по какой-либо мутации/полиморфизму.
Гаплотип — совокупность состояний/вариантов определенных локусов, которые расположены на одной хромосоме, и вследствие структурных особенностей эти состояния всегда наследуются вместе. То есть, например, если в одном локусе (1) гаплотипа имеется мутация (1А), а в другом (2) имеется уже другая мутация (2M), то именно в таком составе они будут наследоваться (1А2М), а смешанных вариантов (1B2M или 1A2N) не бывает или они относятся к другому гаплотипу.
Гаплогруппа — совокупность особей, имеющих сходный гаплотип по определенным локусам, которые задаются в соответствии с тем, какую задачу нужно решить, определяя гаплогруппу
Митохондриальная ДНК. Если разбираться подробнее и глубже, то генетическая информация одного человека находится не только в 46 хромосомах, располагающихся в специальном отсеке клетки – ядре, но и в клеточных органах митохондриях. У митохондрий в клетке своя задача – преобразовывать энергию, заключенную в химической связи определенных атомов, в более удобную для клетки, то есть они готовят эффективные питательные запасы из разного сырья. Митохондрии довольно сложны, их оболочка хитро устроена, чтобы опасные побочные продукты готовки не могли попасть в остальную часть клетки, поэтому все время таскать туда нужные для их работы белки не слишком продуктивно. Таким образом, у них есть своя ДНК, которая несет информацию о разных особенных белках и РНК, которые нужны именно для работы митохондрии. Такую ДНК называют митохондриальной и она является неотъемлемой и обязательной частью нашего генотипа. Передается она только от мамы, так как сперматозоид для возможности быстро перемещаться и долго оставаться живым несет самый минимум необходимой генетической информации – 23 хромосомы. А вот яйцеклетка, которой для выполнения основной функции не нужно находится в агрессивной окружающей среде, может позволить себе бОльшую массу и дополнительные запасы в виде готовых к работе станций приготовления питания – митохондрий и заранее синтезированных белков и РНК.
Митохондрии довольно сложны, их оболочка хитро устроена, чтобы опасные побочные продукты готовки не могли попасть в остальную часть клетки, поэтому все время таскать туда нужные для их работы белки не слишком продуктивно. Таким образом, у них есть своя ДНК, которая несет информацию о разных особенных белках и РНК, которые нужны именно для работы митохондрии. Такую ДНК называют митохондриальной и она является неотъемлемой и обязательной частью нашего генотипа. Передается она только от мамы, так как сперматозоид для возможности быстро перемещаться и долго оставаться живым несет самый минимум необходимой генетической информации – 23 хромосомы. А вот яйцеклетка, которой для выполнения основной функции не нужно находится в агрессивной окружающей среде, может позволить себе бОльшую массу и дополнительные запасы в виде готовых к работе станций приготовления питания – митохондрий и заранее синтезированных белков и РНК.
Гены половой дифференцировки – группа генов, играющая ведущую роль в определении будет эмбрион развиваться как девочка или как мальчик. В геноме человека основой проявления мужских или женских половых признаков является наличие/отсутствие половой хромосомы Y, а именно особо локуса этой хромосомы – SRY (Sex-determining Region on the Y chromosome). Важно отметить, что нарушения в этом локусе могут приводить не к внешним проявлениям, а к сниженной репродуктивной способности мужчины или ее полному отсутствию. Процесс дифференцировки пола у человека можно представить тремя стадиями: 1) какой набор хромосом получается при слиянии яйцеклетки (всегда несет хромосому X) и сперматозоида (с хромосомой X или Y), 2) формирование женских или мужских половых органов в зависимости от работы генов локуса SRY, 3) развитие вторичных половых органов в соответствии с типом половых органов. Нарушения на разных этапах приводят к разным проявлениям и разным заболеваниям.
В геноме человека основой проявления мужских или женских половых признаков является наличие/отсутствие половой хромосомы Y, а именно особо локуса этой хромосомы – SRY (Sex-determining Region on the Y chromosome). Важно отметить, что нарушения в этом локусе могут приводить не к внешним проявлениям, а к сниженной репродуктивной способности мужчины или ее полному отсутствию. Процесс дифференцировки пола у человека можно представить тремя стадиями: 1) какой набор хромосом получается при слиянии яйцеклетки (всегда несет хромосому X) и сперматозоида (с хромосомой X или Y), 2) формирование женских или мужских половых органов в зависимости от работы генов локуса SRY, 3) развитие вторичных половых органов в соответствии с типом половых органов. Нарушения на разных этапах приводят к разным проявлениям и разным заболеваниям.
Локус AZF – это участок Y-хромосомы, на котором располагаются так называемые факторы азооспермии (AZF — AZoospermia Factors). Это особые участки, которые названы так, потому что если какой-то из них отсутствует из-за мутации, то развивается азооспермия (отсутствие сперматозоидов) или олигозооспермия (малое количество сперматозоидов). Всего обнаружено три таких фактора AZFa, AZFb и AZFc. В норме наличие всех трех является минимальным необходимым условием нормального формирования сперматозоидов. Если в геноме отсутствует один из AZFa и AZFb или оба, то нарушается созревание сперматозоидов и, как следствие, полностью отсутствует репродуктивная функция. При отсутствии локуса AZFc нарушения могут быть не столь сильными, поэтому деторождение остается возможным в некоторых случаях.
Всего обнаружено три таких фактора AZFa, AZFb и AZFc. В норме наличие всех трех является минимальным необходимым условием нормального формирования сперматозоидов. Если в геноме отсутствует один из AZFa и AZFb или оба, то нарушается созревание сперматозоидов и, как следствие, полностью отсутствует репродуктивная функция. При отсутствии локуса AZFc нарушения могут быть не столь сильными, поэтому деторождение остается возможным в некоторых случаях.
Хромосомные аномалии – это крупные мутации, которые связаны с изменением последовательности ДНК не в рамках отдельного гена или нескольких, а в масштабе хромосомы или генома. Например, отсутствие (делеция) большой части или всей хромосомы, лишняя хромосома, или часть одной хромосомы соединена с частью другой хромосомы и т.д.
Наследственное заболевание – это заболевание, вызванное нарушениями в геноме, то есть мутациями, которые либо мешают формированию нормального белка (так как ген – инструкция по его построению – поврежден), либо изменяют регуляцию, то есть условия, когда, в каком месте или с кем такой белок или ген должен работать.
Моногенное заболевание – это наследственное заболевание, вызванное мутацией в одном только в одном гене. Несмотря на то, что все остальные почти 30000 генов могут быть в порядке, изменение последовательности ДНК в этом гене вызывает нарушения функционирования всего организма.
Хромосомное заболевание – наследственное заболевание, вызванное хромосомными аномалиями.
Носительство мутации – это состояние гетерозиготы по аллелю, обладающему какими-то негативными клиническими проявлениями, если он находится в геноме в виде гомозиготы.
Пробанд – человек, с которого начинается составление генеалогического дерева (родословной). Обычно пробанд – это носитель или пациент с наследственным заболеванием, проявление которого и вызвало необходимость генеалогического анализа.
Сиблинг – в генетике таким термином обозначают потомков одних родителей, то есть братьев и сестер, но не близнецов.
Автор: Жикривецкая Светлана
Биолог-исследователь
Задания Турнира юных биологов | bioturnir.ru
Для обсуждения на Турнире юных биологов используется заранее опубликованный список заданий. Это задания открытого типа: не имеющие окончательного и однозначного ответа, допускающие использование разнообразных подходов для их решения. Условия заданий сформулированы максимально кратко и не содержат всех необходимых для решения данных, поэтому часто необходимо самостоятельно сделать определенные допущения, выбрать модель для построения ответа. Задания выполняются коллективно. Решение задач предполагает проведение самостоятельных теоретических исследований с использованием различных информационных источников. Разрешается помощь при подготовке решений со стороны наставников команд, а также различные консультации со специалистами.1. «Бесхребетный друг» Человеком было одомашнено немало позвоночных животных, однако среди беспозвоночных доместицированными считаются лишь медоносная пчела и тутовый шелкопряд. Сформулируйте критерии одомашнивания. Будут ли они различаться для позвоночных и беспозвоночных животных? Предложите список из пяти беспозвоночных животных, которых было бы выгодно одомашнить современному человеку. Опишите поэтапно стратегию одомашнивания для одного из предложенных вами беспозвоночных животных, доместикация которого была бы наиболее выгодна.
Сформулируйте критерии одомашнивания. Будут ли они различаться для позвоночных и беспозвоночных животных? Предложите список из пяти беспозвоночных животных, которых было бы выгодно одомашнить современному человеку. Опишите поэтапно стратегию одомашнивания для одного из предложенных вами беспозвоночных животных, доместикация которого была бы наиболее выгодна.
2. «Сантилюди» У микронасекомых размеры тела составляют сотни микрометров, тогда как у других насекомых средний размер тела — порядка сантиметра. Предположите, какие биологические проблемы могли бы возникнуть, если бы размеры человека уменьшились до 1 — 2 сантиметров. Изменение каких анатомических, физиологических и биохимических параметров могло бы разрешить эти проблемы?
3. «Встань и иди!» Жизненная форма животного обычно предполагает активное передвижение, однако существуют и сидячие животные. Какими могут быть предпосылки эволюционного перехода к активному передвижению на взрослой стадии у сидячих животных? Предложите три класса многоклеточных животных, представители которых не способны к активному передвижению на взрослой стадии, но, вероятнее всего, могли бы приобрести эту способность. Предложите эволюционный сценарий перехода от сидячей формы к активному передвижению для наиболее перспективного представителя одного из предложенных вами классов.
Предложите эволюционный сценарий перехода от сидячей формы к активному передвижению для наиболее перспективного представителя одного из предложенных вами классов.
4. «Метапаразит» У современных паразитов редко бывает больше трех смен хозяев на протяжении жизненного цикла. С какими проблемами сталкиваются паразиты с большим числом смен хозяев и как им удается их разрешить? Предложите модель паразита с максимальным числом смен хозяев, принадлежащих при этом к разным классам животных. Какими экологическими и физиологическими особенностями будет обладать такой паразит? К какой систематической группе он, скорее всего, будет относиться?
5. «Ихтиандр 2.0» В эволюции позвоночных у вторичноводных животных жабры не образуются, а легкие не пригодны для дыхания в воде. С чем это может быть связано? Предложите, как могло бы быть устроено «жабролегкое» млекопитающих, способное к эффективному газообмену в водной и воздушной средах одновременно. Какими недостатками будет обладать предложенная вами модель «жабролегкого» и как их можно было бы преодолеть?
6. «Самый неприступный» Растения значительно уступают в подвижности животным, поэтому они разрабатывают системы пассивной защиты от паразитов и хищников. Предложите критерии оценки защищенности растения и приведите соответствующие примеры. Предположите, какими анатомическими и физиолого-биохимическими особенностями должно обладать максимально защищенное растение. С какими проблемами столкнется этот организм и как он может их преодолеть?
«Самый неприступный» Растения значительно уступают в подвижности животным, поэтому они разрабатывают системы пассивной защиты от паразитов и хищников. Предложите критерии оценки защищенности растения и приведите соответствующие примеры. Предположите, какими анатомическими и физиолого-биохимическими особенностями должно обладать максимально защищенное растение. С какими проблемами столкнется этот организм и как он может их преодолеть?
7. «От винта!» Способность к полёту возникала многократно в различных группах многоклеточных животных. Какие анатомические, физиологические и экологические особенности благоприятствуют приобретению способности к полету? В каких трех классах беспозвоночных, в которых сейчас нет летающих организмов, было бы вероятно возникновение «летунов»? Какой из выбранных вами классов был бы наиболее перспективен с этой точки зрения?
8. «Играй, гормонь!» Развитие цивилизации довольно сильно изменило условия жизни человека, причем скорость изменений часто превышает скорость адаптации в ходе биологической эволюции. Системный ответ на ключевые стимулы у позвоночных обеспечивают гормоны. Составьте список особенностей образа жизни и среды обитания современного человека, для приспособления к которым был бы полезен системный ответ с участием нового гормона. Предложите механизм работы для наиболее актуальной системы эндокринной регуляции, основанной на введении новой пары гормон-рецептор: опишите ключевые стимулы, запускающие ответ, и физиологические эффекты данного гормона. В результате модификации какой уже существующей пары гормон-рецептор данная система могла бы возникнуть в ходе эволюции?
Системный ответ на ключевые стимулы у позвоночных обеспечивают гормоны. Составьте список особенностей образа жизни и среды обитания современного человека, для приспособления к которым был бы полезен системный ответ с участием нового гормона. Предложите механизм работы для наиболее актуальной системы эндокринной регуляции, основанной на введении новой пары гормон-рецептор: опишите ключевые стимулы, запускающие ответ, и физиологические эффекты данного гормона. В результате модификации какой уже существующей пары гормон-рецептор данная система могла бы возникнуть в ходе эволюции?
9. «Древотравы» Человек выращивает растения, находящиеся в различных жизненных формах: травы, кустарники, деревья. Какими факторами определяется жизненная форма растения? С точки зрения сельского хозяйства, каковы могут быть преимущества и недостатки выращивания растений в необычной для них жизненной форме? Какие важные для человека растения наиболее выгодно было бы перевести из травянистой формы в древесную и наоборот?
10. «Клептоман» Известно, что организмы разных видов могут «воровать» друг у друга клетки или части клеток (например, клептокниды). С какими преимуществами и недостатками связана стратегия приобретения организмом целых чужеродных клеток? Каковы могут быть механизмы захвата и интеграции таких клеток? Предположите, как мог бы быть устроен самый «вороватый» многоклеточный организм, использующий максимальное число типов клеток из организмов других видов.
«Клептоман» Известно, что организмы разных видов могут «воровать» друг у друга клетки или части клеток (например, клептокниды). С какими преимуществами и недостатками связана стратегия приобретения организмом целых чужеродных клеток? Каковы могут быть механизмы захвата и интеграции таких клеток? Предположите, как мог бы быть устроен самый «вороватый» многоклеточный организм, использующий максимальное число типов клеток из организмов других видов.
11. «ДНКлинер» В клетке существуют системы, которые уничтожают РНК и белки, не способные выполнять свои функции. Почему системы, позволяющие элиминировать нефункциональные участки ДНК (к примеру, псевдогены, некоторые повторы и интроны), не распространены? Предположите, как мог бы быть устроен молекулярно-биологический механизм, осуществляющий такой процесс. Что в предложенном вами механизме будет ключевым признаком, позволяющим распознавать нефункциональные участки ДНК?
12. «Чужой среди своих» Методы генетической инженерии позволяют создавать организмы с новыми свойствами гораздо проще и быстрее, чем с помощью методов классической селекции. Для сельского хозяйства польза от применения этих методов очевидна, однако интродукция генетически-модифицированных организмов в естественные экосистемы может представлять опасность. Предложите три гипотетических или существующих генетически-модифицированных животных или растений, которые можно было бы интродуцировать в естественные экосистемы. Какую пользу человек может извлечь из интродукции этих организмов? Какие потенциальные риски связаны с такой интродукцией и как их можно минимизировать?
Для сельского хозяйства польза от применения этих методов очевидна, однако интродукция генетически-модифицированных организмов в естественные экосистемы может представлять опасность. Предложите три гипотетических или существующих генетически-модифицированных животных или растений, которые можно было бы интродуцировать в естественные экосистемы. Какую пользу человек может извлечь из интродукции этих организмов? Какие потенциальные риски связаны с такой интродукцией и как их можно минимизировать?
13. «Оборотни в мембранах» Многие одноклеточные организмы способны к горизонтальному переносу генов, в том числе между разными видами. Как мог бы быть устроен механизм передачи из клетки одного вида в клетку другого вида не отдельных генов, а генома целиком с целью замены хозяйского генома и «захвата» клетки? Какими преимуществами мог бы обладать этот механизм перед размножением делением? С какими трудностями столкнется одноклеточный организм, использующий такой механизм «захвата» клеток?
14. «Химера и Беллерофонт» Одним из актуальных способов борьбы с бактериальными инфекциями является использование бактериофагов, однако аналогичные биологические способы борьбы с вирусными инфекциями не распространены. С чем это может быть связано? Предложите пару из вируса человека и биологического агента (вируса, прокариота или одноклеточного эукариота), который мог бы использоваться в качестве эффективного лекарства против данного вируса. Какие модификации данного агента позволили бы повысить его успешность в борьбе с вирусом?
«Химера и Беллерофонт» Одним из актуальных способов борьбы с бактериальными инфекциями является использование бактериофагов, однако аналогичные биологические способы борьбы с вирусными инфекциями не распространены. С чем это может быть связано? Предложите пару из вируса человека и биологического агента (вируса, прокариота или одноклеточного эукариота), который мог бы использоваться в качестве эффективного лекарства против данного вируса. Какие модификации данного агента позволили бы повысить его успешность в борьбе с вирусом?
15. «Будильник на все времена» Биологические процессы могут иметь различную периодичность: к примеру, раз в минуту, раз в сутки, раз в год и т.д. В основе каждого из них лежит своеобразный биологический «будильник», который срабатывает с заданной частотой. Какие биохимические и физиологические механизмы лежат в основе работы биологических «будильников» и как они влияют на частоту их срабатывания? Предложите конструкцию биологического «будильника», которая позволяет задавать максимальный диапазон срабатывания без ущерба для точности.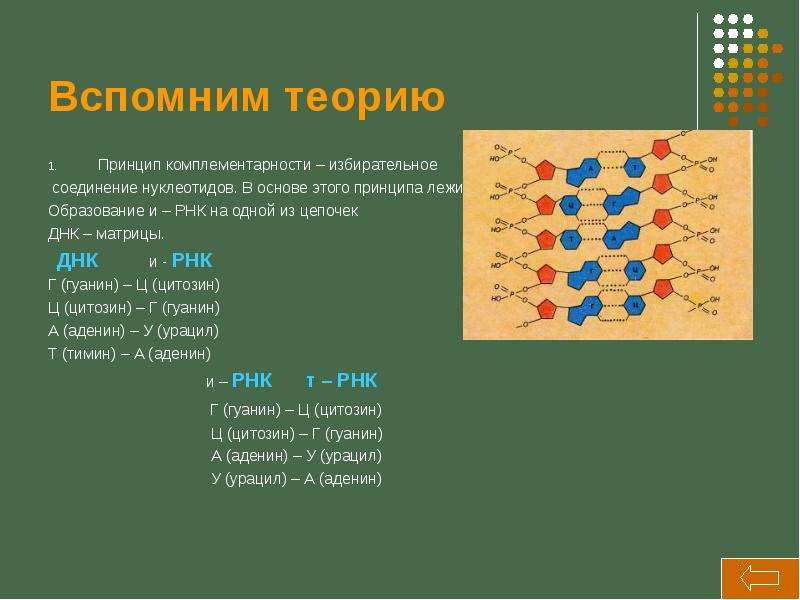
Авторы задач: А.А. Агапов, Н.А. Алкин, Н.С. Бизяев, В.С. Вьюшков, Ю.И. Есин, В.А. Катруха, А.И. Костюк, И.А. Кузин, Д.В. Кузьмин, Н.А. Ломов, А.В. Олина, Д.В. Пупов, Р.И. Раевский, Д.Ю. Трушников, М.А. Черных, Е.С. Шилов, О.Н. Шилова.
Урок ДНК в девятом классе, часть 1 — Структура и функции
Сообщите учащимся, что теперь они будут выполнять задание, складываемое из бумаги, которое позволит им моделировать и понимать репликацию ДНК. Предоставьте как устные, так и письменные инструкции по завершению складного задания с использованием ЖК-проектора для разных типов учащихся. Отобразите нить шаблона ДНК на ЖК-проекторе.
Раздайте 8 1/2 x 11 листов бумаги и маркеры. Расскажите и смоделируйте, как складывать бумагу:
1.Сложите бумагу на две равные части по длине. Студенты иногда называют этот тип фолда «хот-дог».
2. Возьмите сложенную бумагу, как раскрытую книгу, и загните верхний клапан к загнутому краю слева. Оставьте нижнюю страницу развернутой.
Походите, чтобы помочь студентам, которые не умеют следовать вербальному или визуальному моделированию. Поскольку некоторым ученикам может быть трудно сложить лист бумаги, может быть полезно предварительно сложить лист перед тем, как раздавать его, чтобы правильно сложить лист и не помешать завершению упражнения.
Используя стратегию «мысли вслух», опишите шаги 1–6 и смоделируйте, как учащиеся выполнят складную репликацию ДНК, используя правило пар оснований.
Шаг №1
Попросите учащихся выбрать маркер, чтобы записать последовательность азотистых оснований, отображаемых на доске под левым внешним клапаном бумаги. Моделируйте на примере, чтобы учащиеся четко понимали, где писать буквы (A, T, C или G).
Шаг №2
Возьмите цветной маркер 2 и и проведите линию от буквы, только что написанной на левой стороне листа, до внешнего края правой стороны листа, оставляя достаточно места для написания еще одной буквы. Спросите студентов, что, по их мнению, может представлять эта линия. Найдите их, чтобы определить, что эта линия представляет водородную связь, соединяющую азотные основания.
Спросите студентов, что, по их мнению, может представлять эта линия. Найдите их, чтобы определить, что эта линия представляет водородную связь, соединяющую азотные основания.
Шаг №3
Напишите дополнительное основание для каждого азотного основания рядом с линией, только что проведенной поперек страницы, соединяющей два азотистых основания. Помните правило базовой пары.
Шаг № 4
Теперь моделируйте репликацию, открыв лист до полного размера 8 ½ x 11. Макре уверен, что студенты знают, что предназначена для моделирования распаковки ДНК.
Шаг №5
Добавьте азотное основание к на каждой открытых сторон исходной пряди шаблона, написав букву дополнительной основы на обеих сторонах двух исходных сторон. Подчеркните важность точной репликации, чтобы не произошло никаких мутаций. Во время работы учащиеся задавайте вопросы, чтобы укрепить концепции. Например, «Какой фермент расстегивает двойную спираль?» Или, какой фермент добавляет азотистые основания к обнаженным азотистым основаниям на цепи-шаблоне?
Шаг № 6
Модель с добавлением дополнительных оснований к первым 2-3 азотистым основаниям в последовательности. Во время работы ходите по комнате, используя интерактивный блокнот, чтобы убедиться, что учащиеся следят за вами и пишут, пока вы пишете. Сообщите учащимся, что они завершат добавление дополнительных оснований для обеих двойных спиралей самостоятельно. Попросите их пометить выполненную задачу — репликация ДНК.
Во время работы ходите по комнате, используя интерактивный блокнот, чтобы убедиться, что учащиеся следят за вами и пишут, пока вы пишете. Сообщите учащимся, что они завершат добавление дополнительных оснований для обеих двойных спиралей самостоятельно. Попросите их пометить выполненную задачу — репликация ДНК.
| 1 | Дезоксирибонуклеиновая кислота | Рибонуклеиновая кислота |
| 2 | Молекула сахара в ДНК представляет собой дезоксирибозу (рибозный сахар в ДНК представляет собой дезоксигенированный сахар. его положение 2 ‘.2 ’область имеет — H). | Молекула сахара в РНК представляет собой рибозу (оксигенированную в ее 2 ’положении. 2’ область содержит -ОН). |
| 3 | Обычно ДНК имеет двухцепочечную структуру (встречается также одноцепочечная ДНК). | Обычно РНК одноцепочечная (встречается двухцепочечная РНК). |
| 4 | ДНК имеет двойную спиральную конформацию. | Обычно встречается в виде неправильно сложенных структур. |
| 5 | Спираль в ДНК имеет форму B (существуют формы A и Z). | Геометрия спирали в РНК представляет собой форму А. |
| 6 | ДНК — очень стабильная молекула. | Стабильность РНК меньше. |
| 7 | ДНК выступает как носитель генетической информации. | Обычно действует как промежуточная молекула между генетическим материалом (ДНК) и его экспрессирующими молекулами (белками).В некоторых вирусах РНК также действует на генетический материал. |
| 8 | Азотные основания ДНК: Пурины-аденин и гуанин Пиримидины: тимин и цитозин. | Азотные основания РНК: Пурины: аденин и гуанин Пиримидины: урацил и цитозин.  |
| 9 | Спаривание оснований в ДНК: A — T и G — C. | Спаривание оснований в РНК: A — U и G — C. |
| 10 | В ДНК количество пуринов всегда равно количеству пиримидина. | Количество пуринов никогда не будет равным пиримидину. |
| 11 | Отношение пурина к пиримидину в ДНК всегда 1: 1. | Отношение пурина к пиримидину сильно варьируется. |
| 12 | ДНК следует правилу Чаргаффа. | РНК не подчиняется правилу Чаргаффа. |
| 13 | ДНК очень редко содержит неестественные основания или основания, отличные от A, T, G, C. | Некоторые РНК содержат неприродные основания, такие как псевдоуридин и 4-тиуридин |
| 14 | ДНК обычно связывается с гистоновыми белками у эукариот. | РНК не связана с гистоновыми белками. |
| 15 | ДНК может взаимодействовать с нуклеопротеидами с образованием хроматина и хромосом. | Может взаимодействовать с множеством белков, но не может образовывать хроматин или хромосомы. |
| 16 | ДНК располагается преимущественно в ядре. ДНК также присутствует в клеточных органеллах, таких как митохондрии и хлоропласты. | РНК обнаружена в ядре, цитоплазме и клеточных органеллах, таких как митохондрии и хлоропласты. |
| 17 | ДНК имеет сравнительно меньшие бороздки и, следовательно, они защищены от ферментативных атак. | РНК имеет сравнительно большие бороздки и, следовательно, они очень уязвимы для атаки гидролитических ферментов. |
| 18 | ДНК устарела в щелочных условиях, поскольку в ней отсутствует положение группы -ОН 2 ’. | РНК нестабильна в щелочных условиях из-за присутствия -ОН в 2 ’части. Группа -ОН в положении 2 ’очень реактивна. Группа -ОН в положении 2 ’очень реактивна. |
| 19 | ДНК не обладают каталитической активностью | Некоторые молекулы РНК обладают каталитической активностью (рибозимы). Пример: пептидилтрансфераза. |
| 20 | ДНК чрезвычайно чувствительна к УФ-излучению. | РНК сравнительно устойчива к УФ-излучению. |
| 21 | Количество ДНК фиксируется в клетках. | Количество РНК не фиксировано; он сильно варьируется в разных состояниях клеточного цикла. |
| 22 | ДНК — это сравнительно длинные структуры с высокой молекулярной массой. ДНК содержит миллионы пар оснований. | РНК представляет собой сравнительно короткие структуры, обычно от нескольких до 15000 нуклеотидов. |
| 23 | В зависимости от функции во всех организмах обнаружен только один тип ДНК. | Различные типы РНК обнаруживаются в клетках в зависимости от ее функций, таких как рРНК, тРНК, мРНК, миРНК, миРНК, мяРНК и т. Д. |
| 24 | ДНК не может находиться в цитоплазме в свободном состоянии. | РНК может находиться в цитоплазме в свободном состоянии. |
| 25 | Остаток сахара дезоксирибозы в ДНК является C2 ’эндо формой. | Остаток сахара рибозы в РНК представляет собой C3 ’эндо-форму. |
| 26 | ДНК-краситель синий с азурофталатным красителем. | Окраска РНК в красный цвет азурофталатным красителем. |
| 27 | ДНК окрашивает зеленым красителем пиронин. | Окраска РНК в красный цвет пирониновым красителем. |
Прошлое и настоящее
Извлечение ДНК, РНК и белка — основной метод, используемый в молекулярной биологии. Эти биомолекулы можно выделить из любого биологического материала для последующих процессов, аналитических или препаративных целей. В прошлом процесс экстракции и очистки нуклеиновых кислот был сложным, длительным, трудоемким и ограниченным с точки зрения общей производительности. В настоящее время существует множество специализированных методов, которые можно использовать для извлечения чистых биомолекул, например протоколы на основе растворов и колонок.Ручной метод, безусловно, прошел долгий путь с течением времени с различными коммерческими предложениями, которые включали полные наборы, содержащие большинство компонентов, необходимых для выделения нуклеиновой кислоты, но большинство из них требует повторных этапов центрифугирования с последующим удалением супернатантов в зависимости от типа образца и дополнительная механическая обработка. Спрос на автоматизированные системы, предназначенные для средних и крупных лабораторий, в последние годы вырос. Это альтернатива трудоемким ручным методам.Технология должна обеспечивать высокую пропускную способность образцов; выход, чистота, воспроизводимость и масштабируемость биомолекул, а также скорость, точность и надежность анализа должны быть максимальными при минимальном риске перекрестного загрязнения.
В прошлом процесс экстракции и очистки нуклеиновых кислот был сложным, длительным, трудоемким и ограниченным с точки зрения общей производительности. В настоящее время существует множество специализированных методов, которые можно использовать для извлечения чистых биомолекул, например протоколы на основе растворов и колонок.Ручной метод, безусловно, прошел долгий путь с течением времени с различными коммерческими предложениями, которые включали полные наборы, содержащие большинство компонентов, необходимых для выделения нуклеиновой кислоты, но большинство из них требует повторных этапов центрифугирования с последующим удалением супернатантов в зависимости от типа образца и дополнительная механическая обработка. Спрос на автоматизированные системы, предназначенные для средних и крупных лабораторий, в последние годы вырос. Это альтернатива трудоемким ручным методам.Технология должна обеспечивать высокую пропускную способность образцов; выход, чистота, воспроизводимость и масштабируемость биомолекул, а также скорость, точность и надежность анализа должны быть максимальными при минимальном риске перекрестного загрязнения.
Извлечение биомолекул, ДНК, РНК и белков — наиболее важный метод, используемый в молекулярной биологии [1]. Это отправная точка для последующих процессов и разработки продуктов, включая диагностические комплекты. ДНК, РНК и белок можно выделить из любого биологического материала, такого как живые или консервативные ткани, клетки, вирусные частицы или другие образцы для аналитических или препаративных целей [1].
Две категории, которые участвуют в очистке ДНК, включают выделение конструкций рекомбинантной ДНК, таких как плазмиды или бактериофаги, и выделение хромосомной или геномной ДНК от прокариотических или эукариотических организмов [2]. Как правило, для успешной очистки нуклеиновых кислот требовалось четыре важных этапа: эффективное разрушение клеток или тканей; денатурация нуклеопротеидных комплексов; инактивация нуклеаз, например, РНКазы для экстракции РНК и ДНКазы для экстракции ДНК; вдали от загрязнения [2].Нуклеиновая кислота-мишень не должна содержать примесей, включая белки, углеводы, липиды или другие нуклеиновые кислоты, например, ДНК без РНК или РНК без ДНК [3]. Качество, а также целостность выделенной нуклеиновой кислоты будут напрямую влиять на результаты всех последующих научных исследований [4].
Качество, а также целостность выделенной нуклеиновой кислоты будут напрямую влиять на результаты всех последующих научных исследований [4].
С другой стороны, РНК является нестабильной молекулой и имеет очень короткий период полураспада после извлечения из клетки или тканей [5]. Существует несколько типов встречающихся в природе РНК, включая рибосомную РНК (рРНК) (80–90%), информационную РНК (мРНК) (2.5% –5%) и транспортной РНК (тРНК) [3]. Особая осторожность и меры предосторожности требуются для выделения РНК, поскольку она подвержена деградации [3, 6]. РНК особенно нестабильна из-за повсеместного присутствия РНКаз, которые представляют собой ферменты, присутствующие в крови, всех тканях, а также в большинстве бактерий и грибов в окружающей среде [3, 5] . Сильные денатуранты всегда использовались при выделении интактной РНК для ингибирования эндогенных РНКаз [2]. Экстракция РНК основана на хорошей лабораторной технике и методе без РНКазы.РНКаза термостабильна и повторно складывается после тепловой денатурации. Их трудно инактивировать, поскольку они не требуют кофакторов [2]. Наиболее распространенные методы выделения можно разделить на два класса: использование 4 M тиоцианата гуанидиния и использование фенола и SDS [2].
Их трудно инактивировать, поскольку они не требуют кофакторов [2]. Наиболее распространенные методы выделения можно разделить на два класса: использование 4 M тиоцианата гуанидиния и использование фенола и SDS [2].
Очистка белков — одна из наиболее важных частей в исследованиях белков для понимания их функции, поскольку они могут частично или полностью участвовать в любой деятельности по синтезу ДНК. Очистка белка необходима для определения его уникальных характеристик, включая размер, заряд, форму и функцию [7].Экстракция на основе клеток — это начальный этап почти любой очистки белка. Белок может быть извлечен несколькими методами, такими как лизис детергентом, усилие сдвига, обработка солью с низким содержанием ионов (высаливание) и быстрые изменения давления, которые направлены на ослабление и разрушение мембран, окружающих клетку, чтобы позволить белкам уйти [7 ]. При работе с белками следует учитывать некоторые факторы. Обычно экстракция белка выполняется при очень низкой температуре (), поскольку белки легко денатурируются, как только они высвобождаются из клеток. Состояние буфера — один из основных факторов, которые необходимо учитывать. Рекомендуется поддерживать определенные буферные условия из-за чувствительности белков к изменениям pH окружающей среды [4]. Чистота воды будет влиять на выход конечных продуктов, так как неочищенная вода содержит много микроорганизмов или протеаз, которые приводят к деградации белка [4]. Ингибитор белка, который может существовать в растворе или буферах, вызывает гидролиз белков. Моющее средство, еще один важный фактор, которым нельзя пренебрегать при очистке белка, состоит из гидрофобной части линейного или разветвленного углеводородного «хвоста» и гидрофильной «головы» [4].Они солюбилизируют мембранный белок и представляют собой амфифатические молекулы, которые образуют мицеллы с гидрофильной головкой белков [4]. Восстановители будут добавлены в раствор или буфер для экстракции и очистки белка, чтобы избежать потери активности белков или ферментов, вызванной окислением. Хранение белков важно, поскольку период полураспада белка обычно зависит от температуры хранения [4].
Состояние буфера — один из основных факторов, которые необходимо учитывать. Рекомендуется поддерживать определенные буферные условия из-за чувствительности белков к изменениям pH окружающей среды [4]. Чистота воды будет влиять на выход конечных продуктов, так как неочищенная вода содержит много микроорганизмов или протеаз, которые приводят к деградации белка [4]. Ингибитор белка, который может существовать в растворе или буферах, вызывает гидролиз белков. Моющее средство, еще один важный фактор, которым нельзя пренебрегать при очистке белка, состоит из гидрофобной части линейного или разветвленного углеводородного «хвоста» и гидрофильной «головы» [4].Они солюбилизируют мембранный белок и представляют собой амфифатические молекулы, которые образуют мицеллы с гидрофильной головкой белков [4]. Восстановители будут добавлены в раствор или буфер для экстракции и очистки белка, чтобы избежать потери активности белков или ферментов, вызванной окислением. Хранение белков важно, поскольку период полураспада белка обычно зависит от температуры хранения [4].
Для очистки белка требуется специальный анализ. Для очистки белка должен быть известен быстрый и простой метод анализа, чтобы можно было определить известную молекулярную массу, удельную аффинность или иммуноаффинность интересующего неферментативного белка с помощью соответствующего метода [7].Есть несколько методов, обычно используемых для очистки белка. Это ионообменная хроматография, гель-фильтрация, аффинная хроматография и гель-электрофорез [4].
2. История
2.1. Экстракция нуклеиновой кислоты
Самое первое выделение ДНК было сделано швейцарским врачом Фридрихом Мишером в 1869 году [8] . Он надеялся разгадать фундаментальные принципы жизни, определить химический состав клеток. Он попытался выделить клетки из лимфатических узлов для своего эксперимента, но чистота лимфоцитов была трудной и невозможно было получить в достаточных количествах.Поэтому он переключился на лейкоциты, где получил их из гноя на собранных хирургических повязках.
Первоначально Мишер сосредоточился на различных типах белков, из которых состоят лейкоциты, и показал, что белки являются основными компонентами цитоплазмы клетки. Во время своих тестов он заметил, что при добавлении кислоты из раствора выпадало вещество, которое снова растворялось при добавлении щелочи. Это был первый раз, когда он получил неочищенный осадок ДНК.
Во время своих тестов он заметил, что при добавлении кислоты из раствора выпадало вещество, которое снова растворялось при добавлении щелочи. Это был первый раз, когда он получил неочищенный осадок ДНК.
Чтобы отделить ДНК от белков в экстрактах своих клеток, Мишер разработал новый протокол для отделения ядер клеток от цитоплазмы, а затем выделил ДНК.Однако его первый протокол не дал достаточно материала для продолжения дальнейшего анализа. Ему пришлось разработать второй протокол для получения большего количества очищенного нуклеина, который позже его ученик Ричард Альтман назвал «нуклеиновой кислотой» [8].
2.2. Экстракция белка
В восемнадцатом веке белки были известны как отдельный класс биологических молекул Антуаном Фуркроем и другими. Они различали эту молекулу по ее способности коагулировать под действием тепла или кислоты.Однако первое описание белка было выполнено голландским химиком Герхардусом Йоханнесом Малдером в 1893 году [9]. Его исследования состава веществ животного происхождения, в основном фибрина, альбумина и желатина, показали присутствие углерода, водорода, кислорода и азота [9]. Более того, он признал, что сера и фосфор иногда присутствуют в животных веществах, состоящих из большого количества атомов, и установил, что эти «вещества» были макромолекулами [9].
Более того, он признал, что сера и фосфор иногда присутствуют в животных веществах, состоящих из большого количества атомов, и установил, что эти «вещества» были макромолекулами [9].
Большинство ранних исследований было сосредоточено на белках, которые можно было очищать в больших количествах.Например, кровь, яичный белок и различные токсины. Большинство белков трудно очистить в количествах, превышающих миллиграммы, даже с помощью современных высокотехнологичных методов. Большинство методов очистки белков были разработаны в рамках проекта, возглавляемого Эдвином Джозефом Коном, ученым-белком, во время Второй мировой войны. Он отвечал за очистку крови и разработал методы выделения фракции сывороточного альбумина из плазмы крови, которая важна для поддержания осмотического давления в кровеносных сосудах, что помогает солдатам выжить [10].
3. Текущая тенденция
После судьбоносного события, когда Мишеру удалось получить ДНК из клетки, многие другие последовали его примеру, что привело к дальнейшему развитию протокола выделения и очистки ДНК. Первоначальные рутинные лабораторные процедуры экстракции ДНК были разработаны на основе стратегий центрифугирования в градиенте плотности. Мезельсон и Шталь использовали этот метод в 1958 г., чтобы продемонстрировать полуконсервативную репликацию ДНК [3]. В более поздних процедурах использовались различия в растворимости больших хромосомных ДНК, плазмид и белков в щелочном буфере [3].
Первоначальные рутинные лабораторные процедуры экстракции ДНК были разработаны на основе стратегий центрифугирования в градиенте плотности. Мезельсон и Шталь использовали этот метод в 1958 г., чтобы продемонстрировать полуконсервативную репликацию ДНК [3]. В более поздних процедурах использовались различия в растворимости больших хромосомных ДНК, плазмид и белков в щелочном буфере [3].
В настоящее время существует множество специализированных методов извлечения чистой ДНК, РНК или белка. Как правило, они делятся на протоколы на основе решений или на основе столбцов. Большинство из этих протоколов были преобразованы в коммерческие наборы, которые упрощают процессы экстракции биомолекул.
3.1. Тип экстракции нуклеиновой кислоты
3.1.1. Традиционный метод
Экстракция тиоцианата гуанидиния, фенола и хлороформа
Соль является обычной примесью в образцах нуклеиновых кислот.Всегда требовалось удалить его из образцов нуклеиновой кислоты до того, как можно будет проводить какие-либо последующие процессы и анализ. Следовательно, для обессоливания образца, содержащего нуклеиновую кислоту, необходимы однократные или многократные стадии разделения и / или очистки [11]. Общие этапы очистки нуклеиновых кислот включают лизис клеток, который разрушает клеточную структуру с образованием лизата, инактивацию клеточных нуклеаз, таких как ДНКаза и РНКаза, и отделение желаемой нуклеиновой кислоты от клеточного мусора [2].Органический растворитель — экстракция фенол-хлороформ является одним из примеров, который широко используется для выделения нуклеиновой кислоты.
Следовательно, для обессоливания образца, содержащего нуклеиновую кислоту, необходимы однократные или многократные стадии разделения и / или очистки [11]. Общие этапы очистки нуклеиновых кислот включают лизис клеток, который разрушает клеточную структуру с образованием лизата, инактивацию клеточных нуклеаз, таких как ДНКаза и РНКаза, и отделение желаемой нуклеиновой кислоты от клеточного мусора [2].Органический растворитель — экстракция фенол-хлороформ является одним из примеров, который широко используется для выделения нуклеиновой кислоты.
Хотя фенол, легковоспламеняющаяся, едкая и токсичная карболовая кислота, может быстро денатурировать белки, он не полностью подавляет активность РНКазы [12]. Решить эту проблему можно, используя смесь фенол: хлороформ: изоамиловый спирт (25: 24: 1). Белки, липиды, углеводы и остатки клеток удаляются путем экстракции водной фазы органической смесью фенола и хлороформа [12, 13].При добавлении фенола и хлороформа образуется двухфазная эмульсия. Затем гидрофобный слой эмульсии осаждается на дне, а гидрофильный слой — наверху путем центрифугирования [3]. Собирают верхнюю фазу, содержащую ДНК, и ДНК можно осаждать из супернатанта путем добавления этанола или изопропанола в соотношении 2: 1 или 1: 1 и высокой концентрации соли [3]. Осадок ДНК собирают центрифугированием, избыток соли промывают 70% этанолом и центрифугируют, чтобы удалить этанольный супернатант.Затем осадок ДНК растворяют в буфере ТЕ или стерильной дистиллированной воде [3].
Собирают верхнюю фазу, содержащую ДНК, и ДНК можно осаждать из супернатанта путем добавления этанола или изопропанола в соотношении 2: 1 или 1: 1 и высокой концентрации соли [3]. Осадок ДНК собирают центрифугированием, избыток соли промывают 70% этанолом и центрифугируют, чтобы удалить этанольный супернатант.Затем осадок ДНК растворяют в буфере ТЕ или стерильной дистиллированной воде [3].
Использование изотиоцианата гуанидиния для экстракции РНК впервые было упомянуто Ulrich et al. (1977). Метод был трудоемким. Поэтому он был заменен одностадийной техникой, известной как экстракция гуанидиния тиоцианат-фенол-хлороформ, Хомчински и Сакки (1987) [12], при которой гомогенат экстрагируется фенолом / хлороформом при пониженном pH. Тиоцианат гуанидиния — это хаотропный агент, используемый при расщеплении белков.Принцип этого одностадийного метода заключается в том, что РНК отделяется от ДНК после экстракции кислым раствором, состоящим из тиоцианата гуанидиния, ацетата натрия, фенола и хлороформа [13].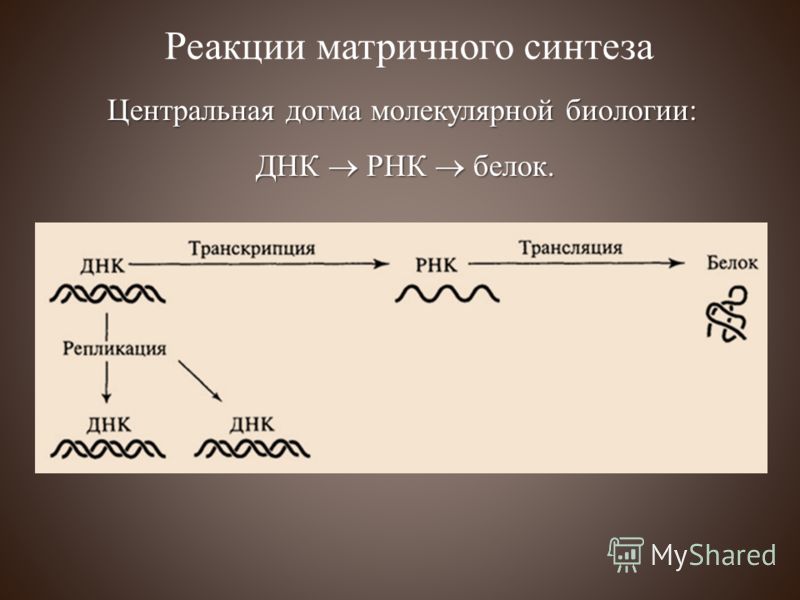 В кислых условиях общая РНК будет оставаться в верхней водной фазе всей смеси, в то время как ДНК и белки останутся в межфазной или нижней органической фазе. Затем проводят восстановление общей РНК путем осаждения изопропанолом [12].
В кислых условиях общая РНК будет оставаться в верхней водной фазе всей смеси, в то время как ДНК и белки останутся в межфазной или нижней органической фазе. Затем проводят восстановление общей РНК путем осаждения изопропанолом [12].
Метод щелочной экстракции
Щелочной лизис использовали для выделения плазмидной ДНК и E.coli [12]. Он хорошо работает со всеми штаммами E. coli и с бактериальными культурами размером от 1 мл до более 500 мл в присутствии додецилсульфата натрия (SDS). Принцип метода основан на селективной щелочной денатурации высокомолекулярной хромосомной ДНК, в то время как ковалентно замкнутая кольцевая ДНК остается двухцепочечной [14]. Бактериальные белки, разрушенные клеточные стенки и денатурированная хромосомная ДНК объединены в большие комплексы, покрытые додецилсульфатом.Плазмидную ДНК можно выделить из супернатанта после удаления денатурированного материала центрифугированием.
Метод экстракции CTAB
Для экстракции растений первым шагом, который необходимо сделать, является измельчение образца после его замораживания жидким азотом. Цель выполнения этого шага — разрушить материал клеточной стенки образца и предоставить доступ к нуклеиновой кислоте, в то время как вредные клеточные ферменты и химические вещества остаются инактивированными. После измельчения образца его можно ресуспендировать в подходящем буфере, таком как CTAB.
Цель выполнения этого шага — разрушить материал клеточной стенки образца и предоставить доступ к нуклеиновой кислоте, в то время как вредные клеточные ферменты и химические вещества остаются инактивированными. После измельчения образца его можно ресуспендировать в подходящем буфере, таком как CTAB.
Бромид цетилтриметиламмония (CTAB) представляет собой неионный детергент, который может осаждать нуклеиновые кислоты и кислые полисахариды из растворов с низкой ионной силой [15]. Между тем в этих условиях белки и нейтральные полисахариды остаются в растворе. В растворах с высокой ионной силой CTAB не осаждает нуклеиновые кислоты и образует комплексы с белками. Таким образом, CTAB полезен для очистки нуклеиновой кислоты от организмов, которые продуцируют большие количества полисахаридов, таких как растения и некоторые грамотрицательные бактерии [15].
В этом методе также используются органические растворители и осаждение спиртом на более поздних этапах [12]. Нерастворимые частицы удаляют центрифугированием для очистки нуклеиновой кислоты. Растворимые белки и другие материалы разделяются путем смешивания с хлороформом и центрифугирования. После этого нуклеиновую кислоту необходимо осадить из надосадочной жидкости и тщательно промыть для удаления загрязняющих солей. Затем очищенную нуклеиновую кислоту ресуспендируют и хранят в буфере ТЕ или стерильной дистиллированной воде.
Растворимые белки и другие материалы разделяются путем смешивания с хлороформом и центрифугирования. После этого нуклеиновую кислоту необходимо осадить из надосадочной жидкости и тщательно промыть для удаления загрязняющих солей. Затем очищенную нуклеиновую кислоту ресуспендируют и хранят в буфере ТЕ или стерильной дистиллированной воде.
Бромид этидия () -хлорид цезия () Градиентное центрифугирование
Градиентное центрифугирование — это сложный, дорогой и трудоемкий метод по сравнению с другими протоколами очистки.Это требует крупномасштабного бактериального культивирования. Следовательно, он не подходит для минипрепаратов плазмидной ДНК [4]. Нуклеиновые кислоты можно концентрировать центрифугированием в градиенте после осаждения спиртом и ресуспендирования. Интеркаляция изменяет плавающую плотность молекулы в высокомолярные ковалентно замкнутые круговые молекулы, которые будут накапливаться при более низких плотностях градиента, поскольку они включают меньше на пару оснований по сравнению с линейными молекулами. После экстракции гидрофобные вещества удаляют соответствующими гидрофобными растворителями.Очищенную нуклеиновую кислоту переосаждают спиртом [1].
После экстракции гидрофобные вещества удаляют соответствующими гидрофобными растворителями.Очищенную нуклеиновую кислоту переосаждают спиртом [1].
Очистка поли РНК с помощью хроматографии Oligp (dT) -целлюлозы
Поли РНК является матрицей для трансляции белка, и большинство мРНК эукариот несут ее участки на своих 3 ’конца [4, 15]. Он составляет от 1 до 2% от общей РНК и может быть разделен с помощью аффинной хроматографии на олиго (dT) -целлюлозе. Поли (A) хвосты образуют стабильные гибриды РНК-ДНК с короткими цепями олиго (dT), которые прикрепляются к различным поддерживающим матрицам [4, 15].В хроматографический буфер необходимо добавить большое количество соли для стабилизации дуплексов нуклеиновых кислот, поскольку образуются только несколько пар оснований dT-A. Буфер с низким содержанием соли используется после того, как неполиаденилированные РНК были отмыты от матрицы. Этот буфер помогает дестабилизировать двухцепочечные структуры и элюировать поли РНК из смолы [15].
Существует два метода, обычно используемых при выборе поли РНК — колоночная хроматография на олиго (dT) колонках и периодическая хроматография. Колоночная хроматография обычно используется для очистки больших количеств (> 25 г) нерадиоактивной РНК поли (A) + , выделенной из клеток млекопитающих.При работе с небольшими количествами (<50 г) тотальной РНК млекопитающих предпочтительным методом является периодическая хроматография. Его можно использовать, когда нужно обработать много образцов РНК, радиоактивных или нет. Периодическая хроматография проводится с мелкодисперсной олиго (dT) целлюлозой при оптимальных температурах для связывания и элюирования [15].
3.1.2. Твердофазная экстракция нуклеиновых кислот
Твердофазная очистка нуклеиновых кислот можно найти в большинстве имеющихся на рынке коммерческих наборов для экстракции.Он позволяет производить быструю и эффективную очистку по сравнению с традиционными методами [16]. Многие проблемы, связанные с экстракцией жидкость-жидкость, такие как неполное разделение фаз, можно предотвратить. Твердофазная система будет поглощать нуклеиновую кислоту в процессе экстракции в зависимости от pH и содержания соли в буфере. Процесс абсорбции основан на следующих принципах: связывающее водород взаимодействие с гидрофильной матрицей в хаотропных условиях, ионный обмен в водных условиях посредством анионита, а также механизмы сродства и исключения по размеру.
Твердофазная система будет поглощать нуклеиновую кислоту в процессе экстракции в зависимости от pH и содержания соли в буфере. Процесс абсорбции основан на следующих принципах: связывающее водород взаимодействие с гидрофильной матрицей в хаотропных условиях, ионный обмен в водных условиях посредством анионита, а также механизмы сродства и исключения по размеру.
Твердофазную очистку обычно проводят на спин-колонке, работающей под действием центробежной силы [17]. Этот метод позволяет быстро очистить нуклеиновую кислоту по сравнению с обычными методами. Матрицы из диоксида кремния, частицы стекла, диатомовая земля и анионообменные носители являются примерами, которые использовались в методе твердофазной экстракции в качестве твердой подложки. Четыре ключевых этапа твердофазной экстракции — это лизис клеток, адсорбция нуклеиновых кислот, промывка и элюция [6].
Первым шагом в процессе твердофазной экстракции является подготовка колонки для адсорбции пробы.Кондиционирование колонки может быть выполнено с использованием буфера при определенном pH для преобразования поверхности или функциональных групп твердого вещества в определенную химическую форму. [17]. Затем образец, который был разрушен с использованием буфера для лизиса, наносится на колонку. Желаемая нуклеиновая кислота будет абсорбироваться колонкой с помощью высокого pH и концентрации соли связывающего раствора [17]. Другие соединения, такие как белок, также могут иметь прочную специфическую связь с поверхностью колонки. Эти загрязнения могут быть удалены на стадии промывки с использованием промывочного буфера, содержащего конкурентный агент [17].На стадии элюирования вводится ТЕ-буфер или вода, чтобы высвободить нужную нуклеиновую кислоту из колонки, чтобы ее можно было собрать в очищенном состоянии [17]. Обычно на этапах промывки и элюирования процесса очистки требуется быстрое центрифугирование, вакуумная фильтрация или разделение колонок.
[17]. Затем образец, который был разрушен с использованием буфера для лизиса, наносится на колонку. Желаемая нуклеиновая кислота будет абсорбироваться колонкой с помощью высокого pH и концентрации соли связывающего раствора [17]. Другие соединения, такие как белок, также могут иметь прочную специфическую связь с поверхностью колонки. Эти загрязнения могут быть удалены на стадии промывки с использованием промывочного буфера, содержащего конкурентный агент [17].На стадии элюирования вводится ТЕ-буфер или вода, чтобы высвободить нужную нуклеиновую кислоту из колонки, чтобы ее можно было собрать в очищенном состоянии [17]. Обычно на этапах промывки и элюирования процесса очистки требуется быстрое центрифугирование, вакуумная фильтрация или разделение колонок.
Были описаны твердофазная экстракция нуклеиновой кислоты в смешанном слое и ее использование для выделения нуклеиновой кислоты [18]. Твердые фазы смешанного слоя по настоящему изобретению представляют собой смеси по меньшей мере двух различных твердых фаз, могут быть твердыми или полутвердыми, пористыми или непористыми. Каждая твердая фаза может связываться с нуклеиновой кислотой-мишенью в различных условиях раствора и высвобождать нуклеиновую кислоту в аналогичных условиях элюирования [18].
Каждая твердая фаза может связываться с нуклеиновой кислотой-мишенью в различных условиях раствора и высвобождать нуклеиновую кислоту в аналогичных условиях элюирования [18].
Матрицы из диоксида кремния
В основе большинства продуктов, связанных с очисткой нуклеиновых кислот, лежат уникальные свойства матриц из диоксида кремния по избирательному связыванию ДНК. Типы материалов из диоксида кремния, включая частицы стекла, такие как стеклянный порошок, частицы диоксида кремния и стеклянные микроволокна, полученные путем измельчения фильтровальной бумаги из стекловолокна, включая диатомовую землю [19].Матрица из гидратированного диоксида кремния, которую получали кипячением с обратным холодильником диоксида кремния в гидроксиде натрия или гидроксиде калия при молярном соотношении примерно от 2: 1 до 10: 1 в течение по меньшей мере примерно 48 часов, была введена в процесс очистки ДНК. ДНК связывается с неорганической матрицей и выделяется в нагретой воде [20].
Принцип очистки матриц кремнезема основан на высоком сродстве отрицательно заряженной основной цепи ДНК к положительно заряженным частицам кремнезема [21]. Натрий играет роль катионного мостика, который притягивает отрицательно заряженный кислород в фосфатном остове нуклеиновой кислоты [22].Катионы натрия разрывают водородные связи между водородом в воде и отрицательно заряженными ионами кислорода в кремнеземе в условиях высокой концентрации соли (pH ≤7) [22]. ДНК прочно связана, и тщательная промывка удаляет все загрязнения. Очищенные молекулы ДНК можно элюировать при низкой ионной силе (pH ≥7) позже с использованием буфера ТЕ или дистиллированной воды [21].
Натрий играет роль катионного мостика, который притягивает отрицательно заряженный кислород в фосфатном остове нуклеиновой кислоты [22].Катионы натрия разрывают водородные связи между водородом в воде и отрицательно заряженными ионами кислорода в кремнеземе в условиях высокой концентрации соли (pH ≤7) [22]. ДНК прочно связана, и тщательная промывка удаляет все загрязнения. Очищенные молекулы ДНК можно элюировать при низкой ионной силе (pH ≥7) позже с использованием буфера ТЕ или дистиллированной воды [21].
Известно, что помимо матриц из диоксида кремния, нитроцеллюлозные и полиамидные мембраны, такие как нейлоновые матрицы, связываются с нуклеиновыми кислотами, но с меньшей специфичностью.Эти материалы часто используются в качестве твердофазных матриц для переноса нуклеиновых кислот и гибридизации [23]. Полиамидные матрицы более долговечны, чем нитроцеллюлоза, и, как известно, необратимо связывают нуклеиновые кислоты. Нуклеиновые кислоты можно иммобилизовать на полиамидных матрицах в буфере с низкой ионной силой [23].
Стеклянная частица
Стеклянные частицы, порошок и шарики пригодны для очистки нуклеиновых кислот. Например, выделение ДНК из агарозных гелей включает использование хаотропных солей для облегчения связывания ДНК с обычным силикатным стеклом, бесцветным стеклом и боросиликатным стеклом (стекловолоконный фильтр).Адсорбция нуклеиновой кислоты на стеклянную подложку, скорее всего, происходит по механизму и принципу, аналогичному адсорбционной хроматографии [24]. Очистку нуклеиновых кислот можно также проводить на смеси силикагеля и стекла [19]. В этом изобретении было обнаружено, что смесь силикагеля и стеклянных частиц может использоваться для отделения нуклеиновой кислоты от других веществ в присутствии раствора хаотропных солей.
Диатомовая земля
Диатомовая земля, также известная как кизельгур или диатомит, содержит до 94% кремнезема [25].Он использовался для фильтрации и в хроматографии, и он полезен для очистки плазмид и другой ДНК путем иммобилизации ДНК на ее частицах в присутствии хаотропного агента.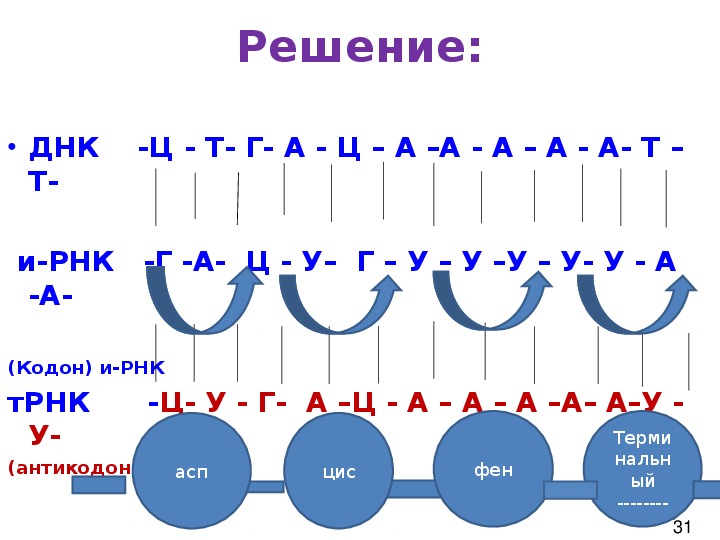 Затем полученная ДНК, связанная с диатомовой землей, промывается спиртосодержащим буфером. Затем спиртосодержащий буфер удаляется, и ДНК элюируется малосолевым буфером или дистиллированной водой [25].
Затем полученная ДНК, связанная с диатомовой землей, промывается спиртосодержащим буфером. Затем спиртосодержащий буфер удаляется, и ДНК элюируется малосолевым буфером или дистиллированной водой [25].
Очистка нуклеиновых кислот с помощью магнитных шариков
Магнитное разделение — это простой и эффективный способ, который используется в настоящее время для очистки нуклеиновых кислот.Многие магнитные носители сейчас коммерчески доступны. Частицы, имеющие магнитный заряд, могут быть удалены с помощью постоянного магнита в приложении магнитного поля. Часто для процесса выделения используются магнитные носители с иммобилизованными аффинными лигандами или полученные из биополимера, демонстрирующего сродство к целевой нуклеиновой кислоте. Например, магнитные частицы, которые производятся из различных синтетических полимеров, биополимеров, пористого стекла или магнитных частиц на основе неорганических магнитных материалов, таких как оксид железа с модифицированной поверхностью. Для связывания нуклеиновых кислот предпочтительно использовать материалы с большой площадью поверхности. Материалы с магнитными частицами, такие как шарики, более предпочтительны в качестве подложки в процессе изоляции из-за их большей связывающей способности. Процесс связывания нуклеиновой кислоты может поддерживаться нуклеиновой кислотой, «обертывающей» носитель. Магнит может быть приложен к стороне сосуда, который содержит смесь образцов для агрегирования частиц у стенки сосуда и выливания остатка образца [26].
Для связывания нуклеиновых кислот предпочтительно использовать материалы с большой площадью поверхности. Материалы с магнитными частицами, такие как шарики, более предпочтительны в качестве подложки в процессе изоляции из-за их большей связывающей способности. Процесс связывания нуклеиновой кислоты может поддерживаться нуклеиновой кислотой, «обертывающей» носитель. Магнит может быть приложен к стороне сосуда, который содержит смесь образцов для агрегирования частиц у стенки сосуда и выливания остатка образца [26].
Частицы, обладающие магнитными или парамагнитными свойствами, используются в изобретении, где они заключены в полимер, такой как намагничивающаяся целлюлоза [27]. В присутствии определенных концентраций соли и полиалкиленгликоля намагничивающаяся целлюлоза может связываться с нуклеиновыми кислотами. Небольшая нуклеиновая кислота требует более высоких концентраций соли для прочного связывания с намагничивающимися частицами целлюлозы. Следовательно, концентрацией соли можно выборочно управлять для высвобождения нуклеиновой кислоты, связанной с намагничивающейся целлюлозой, в зависимости от размера. Намагничивающаяся целлюлоза, связавшаяся с нуклеиновой кислотой, будет промыта подходящим промывочным буфером до того, как они будут контактировать с подходящим элюирующим буфером для отделения желаемой нуклеиновой кислоты от целлюлозы. Отделение намагничивающейся целлюлозы от надосадочной жидкости во время всех стадий очистки может быть выполнено путем приложения магнитного поля, которое притягивает или притягивает их к стенке сосуда [27]. Намагничивающаяся целлюлоза, используемая в этом изобретении, имеет содержание оксида железа примерно до 90% по массе от общей массы целлюлозы.Магнитный компонент целлюлозы также может быть заменен другими магнитными соединениями, такими как оксид железа или оксид никеля [27].
Намагничивающаяся целлюлоза, связавшаяся с нуклеиновой кислотой, будет промыта подходящим промывочным буфером до того, как они будут контактировать с подходящим элюирующим буфером для отделения желаемой нуклеиновой кислоты от целлюлозы. Отделение намагничивающейся целлюлозы от надосадочной жидкости во время всех стадий очистки может быть выполнено путем приложения магнитного поля, которое притягивает или притягивает их к стенке сосуда [27]. Намагничивающаяся целлюлоза, используемая в этом изобретении, имеет содержание оксида железа примерно до 90% по массе от общей массы целлюлозы.Магнитный компонент целлюлозы также может быть заменен другими магнитными соединениями, такими как оксид железа или оксид никеля [27].
Набор для экстракции, основанный на принципе очистки нуклеиновых кислот с помощью магнитных шариков, коммерчески доступен на рынке [28]. Особенностью этого набора является то, что поставляемые реагенты предназначены для использования с магнитными инструментами. Этот магнитный инструмент рекомендуется использовать при работе в формате микропробирки. Это практичное устройство для разделения на основе технологии магнитных частиц.Набор не требует каких-либо органических растворителей и исключает необходимость повторного центрифугирования, вакуумной фильтрации или разделения колонок. Протокол основан на модифицированной процедуре щелочного лизиса с последующим связыванием нуклеиновой кислоты с магнитными частицами. Магнитный инструмент используется для захвата магнитных частиц со связанной нуклеиновой кислотой, и загрязнения удаляются промывкой с помощью предусмотренного промывочного буфера. Затем нуклеиновая кислота элюируется с магнитных частиц буфером для элюции [28].
Это практичное устройство для разделения на основе технологии магнитных частиц.Набор не требует каких-либо органических растворителей и исключает необходимость повторного центрифугирования, вакуумной фильтрации или разделения колонок. Протокол основан на модифицированной процедуре щелочного лизиса с последующим связыванием нуклеиновой кислоты с магнитными частицами. Магнитный инструмент используется для захвата магнитных частиц со связанной нуклеиновой кислотой, и загрязнения удаляются промывкой с помощью предусмотренного промывочного буфера. Затем нуклеиновая кислота элюируется с магнитных частиц буфером для элюции [28].
Другой набор для экстракции работает по тому же принципу, что и описанная выше экстракция, в которой для очистки нуклеиновых кислот использовалась технология магнитных частиц [29]. Он сочетает в себе скорость и эффективность очистки ДНК на основе диоксида кремния с удобством работы с магнитными частицами. Магнитный стержень, защищенный крышкой стержня, используется для захвата магнитных частиц.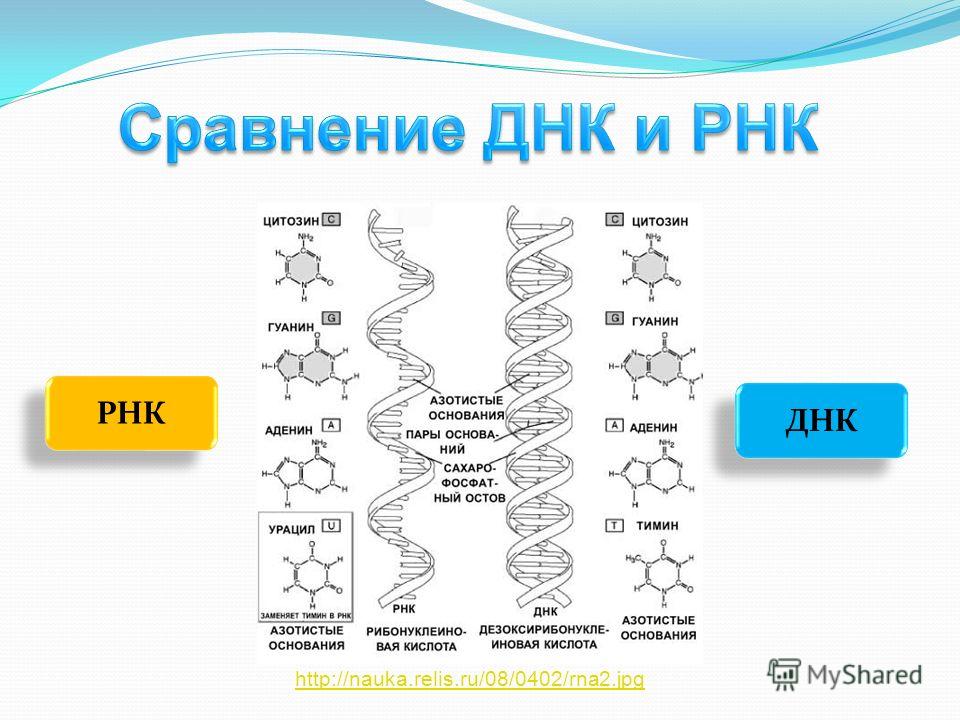 Он попадает в сосуд с образцами и притягивает магнитные частицы. Затем крышка магнитного стержня помещается над другим сосудом, и магнитные частицы высвобождаются [29].
Он попадает в сосуд с образцами и притягивает магнитные частицы. Затем крышка магнитного стержня помещается над другим сосудом, и магнитные частицы высвобождаются [29].
Очистка нуклеиновой кислоты с использованием гранул диоксида циркония — это еще один тип очистки на основе магнитных гранул. Эти микросферические парамагнитные шарики имеют большую доступную поверхность связывания и могут быть диспергированы в растворе. Эта характеристика позволяла тщательно связывать, промывать и элюировать нуклеиновые кислоты. Набор для выделения полной нуклеиновой кислоты, в котором используется эта технология для очистки нуклеиновой кислоты, использует механическое разрушение образцов с помощью гранул диоксида циркония в растворе на основе тиоцианата гуанидиния, который не только высвобождает нуклеиновую кислоту, но и инактивирует нуклеазу в матрице образца [ 30].После стадии лизиса образцы разбавляются изопропанолом. Парамагенетические гранулы добавляют к образцам для связывания нуклеиновых кислот. Смесь гранул и нуклеиновой кислоты иммобилизуют на магнитах и промывают для удаления белка и загрязнений. Удаление остаточного связывающего раствора выполняется вторым промывочным раствором, и, наконец, нуклеиновая кислота элюируется буфером с низким содержанием соли [30].
Смесь гранул и нуклеиновой кислоты иммобилизуют на магнитах и промывают для удаления белка и загрязнений. Удаление остаточного связывающего раствора выполняется вторым промывочным раствором, и, наконец, нуклеиновая кислота элюируется буфером с низким содержанием соли [30].
Твердофазная технология на основе парамагенетических шариков с обратимой иммобилизацией была использована в системе очистки ПЦР для получения качественной ДНК.Это требует простого протокола без центрифугирования и фильтрации. ПЦР-ампликоны связываются с парамагенетическими частицами, которые выводят их из раствора, позволяя смывать такие загрязнители, как dNTP, праймеры и соли [31].
Магнитный олиго (dT) шарик является альтернативой другим олиго (dT) матрицам для очистки поли РНК из образца тотальной РНК [4]. Поли РНК может быть извлечена путем введения магнитных шариков, покрытых олиго (dT). РНК с поли-А-хвостом присоединяется к олиго (dT). Затем шарики будут вытягиваться на дно пробирки, удаляя мРНК непосредственно из общей РНК. Специально обработанные магнитные шарики минимизируют неспецифическое связывание других нуклеиновых кислот и обеспечивают чистоту мРНК [32].
Специально обработанные магнитные шарики минимизируют неспецифическое связывание других нуклеиновых кислот и обеспечивают чистоту мРНК [32].
Анионообменный материал
Анионообменная смола — один из популярных примеров, в которых используется принцип анионного обмена [33]. Он основан на взаимодействии между положительно заряженными группами диэтиламиноэтилцеллюлозы (DEAE) на поверхности смолы и отрицательно заряженными фосфатами основной цепи ДНК. Анионообменная смола состоит из гранул диоксида кремния с большим размером пор, гидрофильного поверхностного покрытия и высокой плотности заряда [34].Большая площадь поверхности смолы позволяет плотно связывать группы DEAE. Смола работает в широком диапазоне условий pH (pH 6–9) и / или концентрации соли (0,1–1,6 M), что может оптимизировать отделение ДНК от РНК и других примесей [34]. Следовательно, концентрация соли и условия pH буферов являются одними из основных факторов, определяющих, связана ли нуклеиновая кислота или элюируется из колонки. ДНК может связываться с группой DEAE в широком диапазоне концентраций соли. Примеси, такие как белок и РНК, вымываются из смолы с использованием буферов со средним содержанием соли, в то время как ДНК остается связанной до тех пор, пока не будет элюирована буфером с высоким содержанием соли [34].
ДНК может связываться с группой DEAE в широком диапазоне концентраций соли. Примеси, такие как белок и РНК, вымываются из смолы с использованием буферов со средним содержанием соли, в то время как ДНК остается связанной до тех пор, пока не будет элюирована буфером с высоким содержанием соли [34].
Способ использования анионообменных материалов для выделения нуклеиновой кислоты был раскрыт в изобретении [35], где использовались коммерчески доступные сильные или слабые положительно заряженные анионообменные материалы с выбранными растворами с известной ионной силой для адсорбции и элюирования. Большинство водорастворимых компонентов, таких как белок, можно промыть через колонку, используя раствор с известной ионной силой для связывания нуклеиновых кислот с материалами анионообменной колонки.Ионная сила для элюирования генерируется с использованием известной концентрации соли, которая смешивается с буфером для контроля силы pH, в идеале соответствующей самой низкой ионной силе, при которой нуклеиновые кислоты будут полностью элюироваться [35].
3.2. Тип экстракции белка Метод
Первым этапом очистки белка является лизис клеток. Чтобы эффективно очищать и анализировать белок, они должны быть сначала высвобождены из клетки-хозяина в растворимой форме. Плазматическая мембрана клеток млекопитающих, состоящая из фосфолипидов и белков, легко разрушается [36].Для сравнения, экстракция белка из грибов и бактерий кажется более сложной задачей из-за их стабильной клеточной стенки, которая прочнее плазматической мембраны.
Ткани растений содержат широкий спектр белков, которые различаются по своим свойствам. Некоторые специфические факторы необходимо учитывать при разработке протокола экстракции белка для растений [37]. Например, наличие жесткой клеточной стенки из целлюлозы необходимо разрезать, чтобы высвободить содержимое клетки. Конкретные загрязняющие соединения, такие как фенольные соединения и ряд протеиназ, могут приводить к деградации или модификации белка.Поэтому для экстракции и очистки белка из растений требуются особые условия [38].
Для удаления клеточной стенки используются методы механического разрушения, такие как French Press или стеклянные шарики, с последующей экстракцией общего белка на основе детергента [39].
3.2.1. Ионообменная хроматография
Ионообменная хроматография разделяет белки на основе их поверхностного ионного заряда с использованием смол, которые модифицированы положительно или отрицательно заряженными химическими группами [4, 7].Большинство белков имеют общий отрицательный или положительный заряд в зависимости от их изоэлектрической точки (pI) при заданном pH, что позволяет им взаимодействовать с противоположно заряженной хроматографической матрицей [7]. Если чистый заряд белка положительный при pH ниже значения pI, белок будет связываться с катионитом; при pH выше значения pI чистый заряд белка отрицательный, и белок будет связываться с анионообменником [38].
Белки, которые слабо взаимодействуют со смолами, например, слабый положительно заряженный белок, пропущенный через смолу, модифицированную отрицательно заряженной группой, элюируются в буфере с низким содержанием соли. С другой стороны, белки, которые сильно взаимодействуют, требуют для элюирования большего количества соли. Белки с очень похожими зарядовыми характеристиками могут быть разделены на разные фракции по мере их элюирования из колонки путем увеличения концентрации соли в элюирующем буфере [7].
С другой стороны, белки, которые сильно взаимодействуют, требуют для элюирования большего количества соли. Белки с очень похожими зарядовыми характеристиками могут быть разделены на разные фракции по мере их элюирования из колонки путем увеличения концентрации соли в элюирующем буфере [7].
Ионообменная колонка — одна из технологий, использующих принцип ионообменной хроматографии [33]. Он использует мембранно-абсорбционную технологию в качестве хроматографической матрицы для разделения белков. Мембранные абсорбенты в колоннах изготовлены на основе стабилизированной целлюлозы с высокопористой структурой, которая обеспечивает легкий доступ белков к заряженной поверхности.Взаимодействие между молекулами и активными центрами на мембране происходит в конвективных сквозных порах. Следовательно, адсорбционные мембраны могут поддерживать высокую эффективность при очистке больших биомолекул с низкой диффузией [33].
3.2.2. Гель-фильтрационная хроматография
Гель-фильтрационная хроматография, также называемая эксклюзионной или гель-проникающей хроматографией, разделяет белки в соответствии с размером и формой молекул, при этом молекулы не связываются с хроматографической средой [39]. Это процесс, при котором большие молекулы проходят через колонку быстрее, чем маленькие. Маленькие молекулы могут проникать во все крошечные отверстия матрицы и получать доступ к большей части столбца. Белки малого размера будут проходить через эти отверстия, и для их выхода из колонки потребуется больше времени по сравнению с белками большого размера, которые не могут попасть в эти отверстия, но выходят непосредственно из колонки через пустое пространство в колонке [4, 7].
Это процесс, при котором большие молекулы проходят через колонку быстрее, чем маленькие. Маленькие молекулы могут проникать во все крошечные отверстия матрицы и получать доступ к большей части столбца. Белки малого размера будут проходить через эти отверстия, и для их выхода из колонки потребуется больше времени по сравнению с белками большого размера, которые не могут попасть в эти отверстия, но выходят непосредственно из колонки через пустое пространство в колонке [4, 7].
Набор для гель-фильтрационной хроматографии использует принцип гель-фильтрационной хроматографии [40].Целевой образец наносят поверх столбца, который содержит пористые шарики, пример матрицы в столбце. Молекулы разделяются, когда молекулы проходят через столбик пористых шариков. Разделение молекул можно разделить на три основных типа: полное исключение, избирательная проницаемость и общий предел проницаемости. Полное исключение — это та часть, из-за которой большие молекулы не могут проникать в поры и быстро элюироваться. Для области селективного проникновения промежуточные молекулы могут проникать в поры и могут иметь среднее время пребывания в частицах в зависимости от их размера и формы.Что касается предела общего проникновения, маленькие молекулы имеют наибольшее время пребывания, когда они попадают в поры колонки [40]. Преимущество хроматографии на основе гель-фильтрации заключается в том, что она подходит для биомолекул, которые могут быть чувствительны к изменениям pH, концентрации ионов металлов и суровым условиям окружающей среды [39].
Для области селективного проникновения промежуточные молекулы могут проникать в поры и могут иметь среднее время пребывания в частицах в зависимости от их размера и формы.Что касается предела общего проникновения, маленькие молекулы имеют наибольшее время пребывания, когда они попадают в поры колонки [40]. Преимущество хроматографии на основе гель-фильтрации заключается в том, что она подходит для биомолекул, которые могут быть чувствительны к изменениям pH, концентрации ионов металлов и суровым условиям окружающей среды [39].
3.2.3. Аффинная хроматография
Аффинная хроматография зависит от конкретного взаимодействия между белком и твердой фазой, которое влияет на отделение от примесей.Он состоит из тех же этапов, что и ионообменная хроматография [38]. Он позволяет очищать белок на основе его биологической функции или индивидуальной химической структуры [41]. Белки, обладающие высоким сродством к определенным химическим группам, таким как лиганды, будут ковалентно присоединяться и связываться с матрицей столбца, в то время как другие белки проходят через столбец [38]. Электростатические или гидрофобные взаимодействия, силы Ван-дер-Ваальса и водородные связи — это биологические взаимодействия между лигандами и белками-мишенями [41].Связанные белки будут элюированы из колонки раствором, содержащим высокую концентрацию растворимой формы лиганда [36].
Электростатические или гидрофобные взаимодействия, силы Ван-дер-Ваальса и водородные связи — это биологические взаимодействия между лигандами и белками-мишенями [41].Связанные белки будут элюированы из колонки раствором, содержащим высокую концентрацию растворимой формы лиганда [36].
Биоспецифический лиганд, который может ковалентно присоединяться к хроматографической матрице, является одним из требований для успешной аффинной очистки. Связывание между лигандом и молекулами белка-мишени должно быть обратимым, чтобы белки могли быть удалены в активной форме [41]. После смывания загрязнений связанный лиганд должен сохранять свое специфическое сродство связывания с целевыми белками.Некоторые примеры биологических взаимодействий, которые обычно используются в аффинной хроматографии, перечислены в таблице 1 (см. [41]).
| |||||||||||||||||||||||||
 На рынок выпущен полный набор, который содержит шариковые колонки с аффинной смолой, основанный на принципе аффинной хроматографии [42]. Аффинную смолу можно использовать в формате периодической или микроцентрифужной спин-колонки в зависимости от масштаба и типа проводимого эксперимента. Кроме того, он может быть упакован в какую-либо более крупную гравитационную колонну [42].
На рынок выпущен полный набор, который содержит шариковые колонки с аффинной смолой, основанный на принципе аффинной хроматографии [42]. Аффинную смолу можно использовать в формате периодической или микроцентрифужной спин-колонки в зависимости от масштаба и типа проводимого эксперимента. Кроме того, он может быть упакован в какую-либо более крупную гравитационную колонну [42].3.2.4. Гель-электрофорез
Гель-электрофорез — это метод разделения белков в соответствии с их размером и зарядовыми свойствами.Частично очищенный белок из хроматографических разделений можно дополнительно очистить с помощью неденатурирующего электрофореза в полиакриламидном геле (PAGE) или электрофореза в нативном геле [4]. В PAGE белки управляются приложенным током через гелеобразную матрицу [43]. Движение белка через этот гель зависит от плотности заряда (заряда на единицу массы) молекул. Молекулы с зарядом высокой плотности быстро мигрируют. Размер и форма белка — еще два важных фактора, влияющих на фракционирование в ПААГ [43]. Размер пор акриламида играет роль молекулярного сита для разделения белков разного размера [4]. Чем крупнее белок, тем медленнее он мигрирует, поскольку он больше запутывается в геле [43]. Форма также является одним из факторов, поскольку компактные глобулярные белки перемещаются быстрее, чем удлиненные волокнистые белки сопоставимой молекулярной массы [43].
Размер пор акриламида играет роль молекулярного сита для разделения белков разного размера [4]. Чем крупнее белок, тем медленнее он мигрирует, поскольку он больше запутывается в геле [43]. Форма также является одним из факторов, поскольку компактные глобулярные белки перемещаются быстрее, чем удлиненные волокнистые белки сопоставимой молекулярной массы [43].
ПААГ обычно проводят в присутствии додецилсульфата натрия (ДСН) [44]. Белок, обработанный SDS, обычно устраняет вторичную, третичную и четвертичную структуру белка [4, 7].Белки разворачиваются в подобную стержнеобразную форму из-за электростатического отталкивания между связанными молекулами SDS. Количество молекул SDS, которые связываются с белком, приблизительно пропорционально молекулярной массе белка (около 1,4 г SDS / г белка) [43]. Каждый вид белка имеет эквивалентную плотность заряда и проходит через гель с одинаковой силой [43]. Кроме того, PAGE может минимизировать денатурацию белков. Многие белки все еще сохраняют свою биологическую активность после выполнения PAGE [7]. Однако более крупные белки удерживаются в большей степени, чем более мелкие белки, потому что полиакриламид сильно сшит [43]. Следовательно, белки разделяются с помощью SDS-PAGE на основе их молекулярной массы. SDS-PAGE можно использовать для определения молекулярной массы смеси белков путем сравнения положений полос с полосами, продуцируемыми белками известного размера [43]. SDS, используемый в электрофорезе, разрешает смесь белков в соответствии с длиной отдельных полипептидных цепей [7].
Однако более крупные белки удерживаются в большей степени, чем более мелкие белки, потому что полиакриламид сильно сшит [43]. Следовательно, белки разделяются с помощью SDS-PAGE на основе их молекулярной массы. SDS-PAGE можно использовать для определения молекулярной массы смеси белков путем сравнения положений полос с полосами, продуцируемыми белками известного размера [43]. SDS, используемый в электрофорезе, разрешает смесь белков в соответствии с длиной отдельных полипептидных цепей [7].
Метод, называемый двумерным гель-электрофорезом, был разработан Патриком О’Фарреллом в 1975 году. Он используется для фракционирования сложных смесей белков с использованием двух различных методов — изоэлектрического фокусирования и SDS-PAGE [43]. Сначала белки разделяются в соответствии с их изоэлектрической точкой в трубчатом геле. После этого разделения гель удаляют и помещают на пластину из полиакриламида, насыщенного SDS. Белки перемещаются в пластинчатый гель и разделяются в соответствии с их молекулярной массой [43]. Двумерный гель-электрофорез подходит для обнаружения изменений белков, присутствующих в клетке в различных условиях, на разных стадиях развития или клеточного цикла или в разных организмах [43].
Двумерный гель-электрофорез подходит для обнаружения изменений белков, присутствующих в клетке в различных условиях, на разных стадиях развития или клеточного цикла или в разных организмах [43].
3.2.5. Юго-западный блоттинг (иммуноблоттинг)
Юго-западный блоттинг — это метод, который используется для выделения, идентификации и характеристики ДНК-связывающих белков по их способности связываться со специфическими олигонуклеотидными зондами [44, 45]. Многие ДНК-связывающие белки в клетке необходимо выделить индивидуально и охарактеризовать, чтобы определить функцию гена [44].Этот метод состоит из трех этапов. Сначала экстракты ядерных белков разделяют электрофорезом в SDS-PAGE. Затем разделенные белки переносятся на нитроцеллюлозный фильтр, поливинилидендифторид (ПВДФ) или катионную нейлоновую мембрану [12]. Затем фильтр будет инкубирован с олигонуклеотидными зондами для анализа адсорбированных белков [44, 45]. Однако этот метод сопряжен с такими проблемами, как необходимость в больших количествах ядерных белков (обычно 50–100 мг), деградация белка во время выделения, трудности в достижении эффективного электрофоретического разделения и переноса белков в широком диапазоне молекулярных размеров [45]. .
.
3.3. Экстракция биомолекул «все в одном»
Как правило, доступные на рынке методы экстракции или очистки или наборы позволяют извлекать только один тип нуклеиновой кислоты, ДНК или РНК, или белок из целевого организма. Когда клеточный материал ограничен, желательно извлекать ДНК, РНК и белок из одного источника.
Вариант одностадийного метода выделения Chomczynski and Sacchi (1987), в котором гомогенат тицианата гуанидиния экстрагируется фенолом: хлороформом при пониженном pH, позволяет получать ДНК, РНК и белок из ткани или клеток.Этот метод включает лизис клеток изотиоцианатом гуанидина и фенолом в однофазном растворе. Вторая фаза образуется после добавления хлороформа, где ДНК и белки экстрагируются, оставляя РНК в водном супернатанте. ДНК и белки могут быть выделены из органической фазы осаждением этанолом или изопропанолом, а РНК осаждена из водной фазы изопропанолом [15].
В настоящее время на рынке представлено несколько комплектов для экстракции «все в одном». Например, набор для экстракции на колонке, предназначенный для одновременной очистки геномной ДНК, общей РНК и общего белка из одного биологического образца без использования токсичных веществ, таких как фенол или хлороформ, и осаждения спиртом [46]. Он совместим с небольшими количествами широкого спектра культивируемых клеток и собранных тканей животного и человеческого происхождения. Целевой образец не нужно разделять на 3 части перед очисткой ДНК, РНК и белка [46].
Например, набор для экстракции на колонке, предназначенный для одновременной очистки геномной ДНК, общей РНК и общего белка из одного биологического образца без использования токсичных веществ, таких как фенол или хлороформ, и осаждения спиртом [46]. Он совместим с небольшими количествами широкого спектра культивируемых клеток и собранных тканей животного и человеческого происхождения. Целевой образец не нужно разделять на 3 части перед очисткой ДНК, РНК и белка [46].
Набор для экстракции 3-в-1 на основе раствора, доступный на рынке, является еще одним примером набора для неорганических растворов, который может извлекать и очищать ДНК, РНК и белок из различных организмов любых типов и размеров [47] .Его протокол из трех простых шагов, который занимает от 15 до 30 минут, обеспечивает быстрый и простой способ извлечения различных биомолекул. Следовательно, можно ожидать более высокого выхода, поскольку меньшее количество шагов приводит к меньшим потерям [47].
3.4. Автоматическая система экстракции
Автоматизированная система экстракции, большая, дорогая и сложная аппаратура, разработанная для высокопроизводительной обработки образцов, помогла упростить выделение нуклеиновых кислот [48].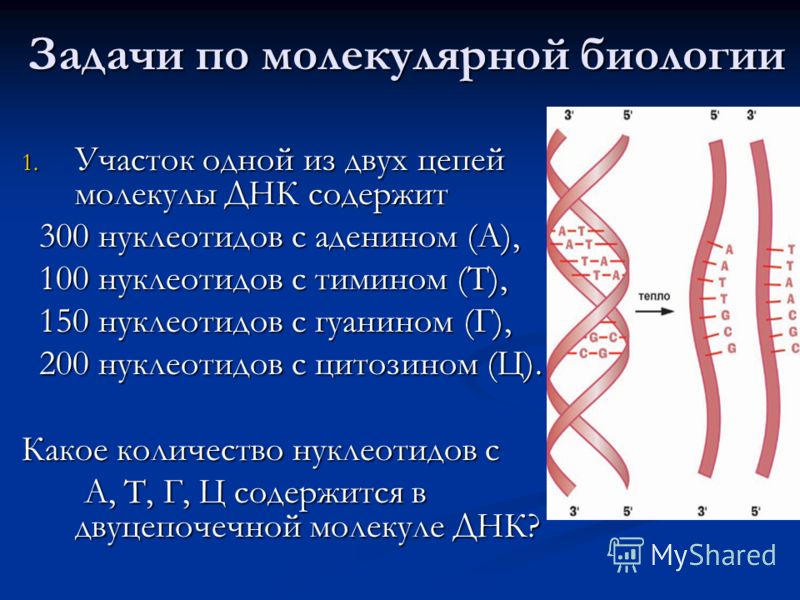 Эта система была разработана для средних и крупных лабораторий, количество которых выросло за последние годы [49].Автоматизация процесса экстракции нуклеиновых кислот потенциально выгодна по ряду причин, в том числе для сокращения рабочего времени, снижения затрат на рабочую силу, повышения безопасности труда, а также дает возможность повышения воспроизводимости и качества результатов [50]. Кроме того, это ключевое решение для повышения эффективности лаборатории [48] .
Эта система была разработана для средних и крупных лабораторий, количество которых выросло за последние годы [49].Автоматизация процесса экстракции нуклеиновых кислот потенциально выгодна по ряду причин, в том числе для сокращения рабочего времени, снижения затрат на рабочую силу, повышения безопасности труда, а также дает возможность повышения воспроизводимости и качества результатов [50]. Кроме того, это ключевое решение для повышения эффективности лаборатории [48] .
В клинических лабораториях очистка высококачественных биомолекул, таких как ДНК, РНК и белок, от различных исходных материалов будет использоваться в последующих испытаниях.Очень важно получить очищенные образцы достаточного качества и чистоты [48]. Следовательно, автоматизированные экстракции должны быть более последовательными и воспроизводимыми. Скорость, точность и надежность всего процесса экстракции должны быть максимальными и в то же время минимизировать риск перекрестного загрязнения [49]. Необходимо найти решение для повышения эффективности пробоподготовки без ущерба для качества. Возможность перекрестного загрязнения должна быть уменьшена, и системы должны быть приспособлены для отслеживания образцов со штрих-кодом [51].
Возможность перекрестного загрязнения должна быть уменьшена, и системы должны быть приспособлены для отслеживания образцов со штрих-кодом [51].
Система экстракции, доступная на рынке, удовлетворяет указанным выше требованиям. Он предлагает лабораториям судебной экспертизы быструю и надежную обработку образцов наряду с высококачественной автоматической очисткой ДНК [52]. Это система обработки парамагнитных частиц для обработки проб и обеспечения постоянного выхода и чистоты, поскольку нет обнаруживаемого перекрестного загрязнения между пробами. Весь процесс экстракции занимает около 20 минут от начала до конца, потому что нужно всего три простых шага: добавить жидкие образцы в картридж с реактивами; поместите картриджи с реактивами в аппарат; нажмите кнопку Пуск.В конце процесса ДНК элюируется в буфер для элюирования [52].
Был представлен еще один пример автоматизированной системы, которая является гибкой и эффективной для экстракции нуклеиновых кислот и белков [53]. С помощью этой системы можно обрабатывать различные исходные материалы, которые предназначены для малых и средних проб. Он использовал функционализированные на поверхности парамагнитные частицы для адсорбции выделенной нуклеиновой кислоты [53]. Гибкость этой системы позволяет извлекать нуклеиновую кислоту из двенадцати образцов одновременно.Процесс экстракции занимает от 20 до 40 минут в зависимости от области применения. Наборы, оптимизированные для этой системы, могут извлекать геномную ДНК, клеточную РНК, вирусные или бактериальные нуклеиновые кислоты [53].
Он использовал функционализированные на поверхности парамагнитные частицы для адсорбции выделенной нуклеиновой кислоты [53]. Гибкость этой системы позволяет извлекать нуклеиновую кислоту из двенадцати образцов одновременно.Процесс экстракции занимает от 20 до 40 минут в зависимости от области применения. Наборы, оптимизированные для этой системы, могут извлекать геномную ДНК, клеточную РНК, вирусные или бактериальные нуклеиновые кислоты [53].
4. Возможное направление в будущем
Извлечение биомолекул — это первый шаг, который необходимо выполнить для последующего анализа или процесса манипуляции. Требование обращения с жидкостью — самый сложный аспект. Следовательно, любая автоматическая система должна включать в себя не только автоматическое оборудование для каждой стадии экстракции, но и оборудование для автоматизации передачи жидкости между машинами.Автоматизация помогла увеличить производительность и надежность процесса, но эти системы по-прежнему предназначены для использования только в лабораторных условиях. Некоторые из имеющихся на рынке систем экстракции нуклеиновых кислот имеют большие размеры и требуют ручной предварительной обработки лабораторным персоналом с техническими знаниями [54]. Таким образом, роботизированные рабочие станции для экстракции нуклеиновых кислот должны выполнять настоящую автоматизацию «от руки», что означает полностью автоматизированный процесс [49].Комбинация универсального раствора и метода экстракции биомолекул с полностью автоматизированной системой экстракции может стать перспективным изобретением в будущем. Очистка ДНК, РНК или белка от различных организмов может выполняться одновременно с использованием этого типа экстракционной системы с помощью всего лишь одного метода экстракции.
Некоторые из имеющихся на рынке систем экстракции нуклеиновых кислот имеют большие размеры и требуют ручной предварительной обработки лабораторным персоналом с техническими знаниями [54]. Таким образом, роботизированные рабочие станции для экстракции нуклеиновых кислот должны выполнять настоящую автоматизацию «от руки», что означает полностью автоматизированный процесс [49].Комбинация универсального раствора и метода экстракции биомолекул с полностью автоматизированной системой экстракции может стать перспективным изобретением в будущем. Очистка ДНК, РНК или белка от различных организмов может выполняться одновременно с использованием этого типа экстракционной системы с помощью всего лишь одного метода экстракции.
Часто бывает неудобно отправлять образец целевых биомолекул животного, растения или даже клинический образец в лабораторию для его извлечения и анализа [54].Образцы, особенно клинические образцы, такие как кровь, необходимо охладить и передать в ближайшую лабораторию для извлечения и анализа. Следовательно, портативная система экстракции биомолекул, которая дает несколько преимуществ, таких как сокращение трудозатрат, уменьшение количества отходов и повышение скорости процесса экстракции, может стать потенциальной разработкой в будущем [54]. Комбинация портативной системы экстракции с анализатором ДНК, РНК или белков может быть создана в будущем, чтобы помочь исследователям сократить рабочее время и повысить эффективность работы.
Следовательно, портативная система экстракции биомолекул, которая дает несколько преимуществ, таких как сокращение трудозатрат, уменьшение количества отходов и повышение скорости процесса экстракции, может стать потенциальной разработкой в будущем [54]. Комбинация портативной системы экстракции с анализатором ДНК, РНК или белков может быть создана в будущем, чтобы помочь исследователям сократить рабочее время и повысить эффективность работы.
Дальнейшее совершенствование миниатюризации станет будущей тенденцией роботизированной автоматизации в лаборатории [28]. Многие клинические лаборатории проводят анализ рабочего процесса и обнаруживают, что системы меньшего размера с меньшей пропускной способностью больше соответствуют рабочей нагрузке клинических лабораторий. Кроме того, эта система автоматизации может быть реализована с относительно низкими затратами, что сокращает время выполнения работ, а также снижает трудозатраты [55].
5. Заключение
Поскольку первое выделение ДНК было успешно выполнено Фридрихом Мишером в 1869 году, а первоначальная экстракция ДНК была разработана Мезельсоном и Шталем на основе стратегий центрифугирования в градиенте плотности в 1958 году, было разработано множество методов очистки биомолекул. От экстракции тиоцианат-фенол-хлороформ гуанидиния до колоночной технологии, которая широко используется для экстракции ДНК и РНК, и метода очистки хроматографии до иммуноблоттинга, который используется для экстракции белков, экстракция биомолекул помогла исследователям и ученым в манипулировании последующим анализом молекулярной биологии, чтобы чтобы лучше понимать биологические материалы Земли.
От экстракции тиоцианат-фенол-хлороформ гуанидиния до колоночной технологии, которая широко используется для экстракции ДНК и РНК, и метода очистки хроматографии до иммуноблоттинга, который используется для экстракции белков, экстракция биомолекул помогла исследователям и ученым в манипулировании последующим анализом молекулярной биологии, чтобы чтобы лучше понимать биологические материалы Земли.
Автоматизированная система экстракции нуклеиновых кислот была разработана благодаря влиянию быстрого роста технологий автоматизации в настоящее время.Автоматизация процесса экстракции нуклеиновых кислот потенциально выгодна по ряду причин, в том числе для сокращения рабочего времени, снижения затрат на рабочую силу, повышения безопасности труда и в то же время дает возможность повышения воспроизводимости и качества результатов. Однако устранение недостатков некоторых инструментов необходимо проводить постоянно. Между тем, универсальная система экстракции биомолекул или изобретение миниатюрной и портативной системы экстракции может стать перспективным развитием в будущем.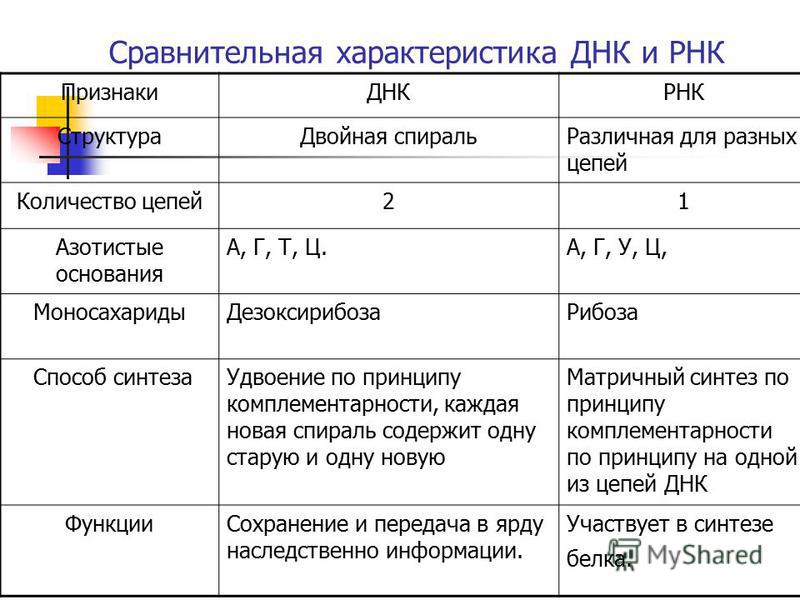
ДНК, РНК и белки — MCAT Biology
Прионы являются предполагаемой причиной широкого спектра нейродегенеративных заболеваний у млекопитающих. Согласно преобладающей теории, прионы представляют собой инфекционные частицы, состоящие только из белка и обнаруживаемые в высоких концентрациях в головном мозге инфицированных животных. Все млекопитающие продуцируют нормальный прионный белок PrP C , трансмембранный белок, функция которого остается неясной.
Инфекционные прионы PrP Res вызывают конформационные изменения в существующих белках PrP C в соответствии со следующей реакцией:
PrP C + PrP Res → PrP Res + PrP Res
Предполагается, что PrP Res накапливается в нервной ткани инфицированных пациентов и вызывает заболевание.Эта модель передачи генерирует реплицированные белки, но делает это в обход стандартной модели центральной догмы молекулярной биологии. Транскрипция и трансляция, по-видимому, не играют роли в этом процессе репликации.
Транскрипция и трансляция, по-видимому, не играют роли в этом процессе репликации.
Эта теория является серьезным отходом от ранее установленной биологической догмы. Ученый решает проверить теорию распространения прионов, основанную только на белках. Он устанавливает свой эксперимент следующим образом:
Гомогенизированное мозговое вещество инфицированных кроликов вводят в мозг здоровых кроликов согласно следующей таблице:
Кролики 1 и 2: инъецировали физиологический раствор в дни 1 и 2
Вышеупомянутые испытания служат в качестве контроля.
Кролик 3 и 4: инъецировали гомогенизированное вещество мозга в дни 1 и 2
В вышеуказанных испытаниях использовалось немодифицированное мозговое вещество.
Кролик 5 и 6: инъекция облученного гомогенизированного вещества головного мозга в дни 1 и 2
В вышеуказанных испытаниях используется вещество мозга, которое было облучено для разрушения нуклеиновых кислот в гомогенате.
Кролики 7 и 8: им инъецировали центрифугированное гомогенизированное вещество мозга, не содержащее белков, в дни 1 и 2
В вышеуказанных испытаниях использовалось вещество мозга, которое было центрифугировано для получения гомогената, не содержащего белка, и гомогената, богатого белком, в зависимости от молекулярной массы.
Кролики 9 и 10: инъекции вареного гомогенизированного вещества головного мозга в дни 1 и 2
В вышеуказанных испытаниях использовалось мозговое вещество, которое было кипячено для уничтожения любых бактериальных примесей в гомогенате.
вопросов о структуре ДНК
вопрос о структуре ДНК Вопросы по структуре ДНК для студентовСтруктура ДНК: http://molvis.sdsc.edu/dna
Учителя: см. План урока.
От вас не ждут, что вы узнаете все ответы.Использовать
кнопки в учебнике ДНК, чтобы исследовать. Поиграть
с молекулой ДНК, чтобы попытаться выяснить ответ на вопрос! Если вы находите вопросы слишком сложными, возможно, вам будет полезно
посещение Вступительный рассказ Эндрю Картера о структуре ДНК.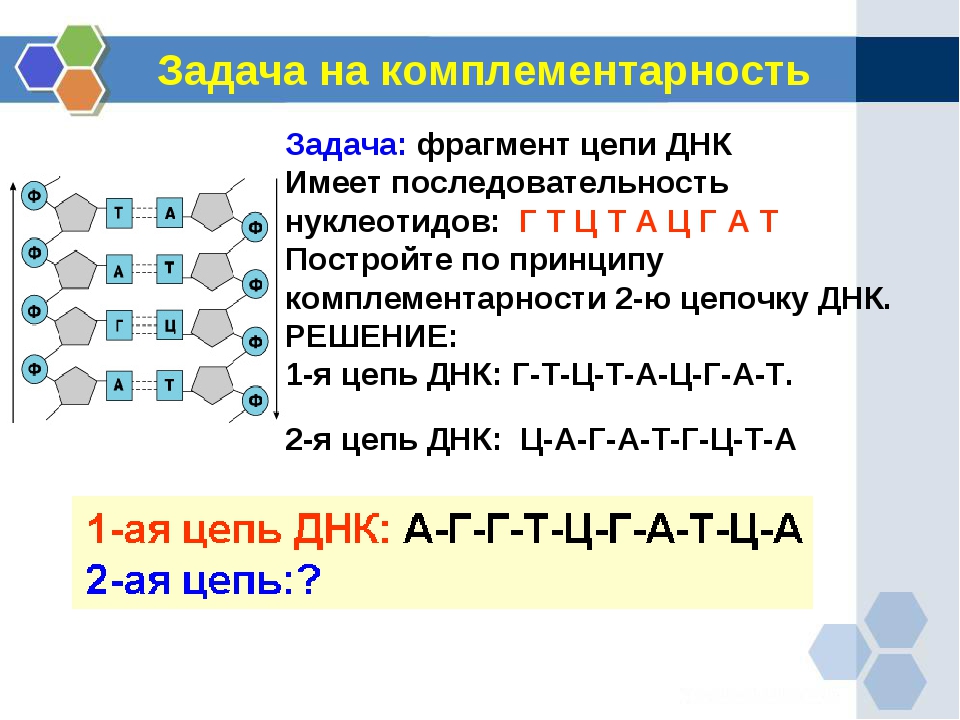
- Что такое «нить» ДНК?
- Сколько нитей образуют двойную спираль ДНК?
- Каждая нить состоит из двух зон или областей. Одна зона каждой нити состоит из одинаковых повторяющихся звеньев, в то время как другая зона состоит из разных единиц.Что это зоны каждой пряди называются?
- Что удерживает одну нить другой в двойной спирали?
- Как клетки делают точные копии ДНК?
- Когда клетки дублируют свою ДНК?
- Какая информация закодирована в ДНК?
- Что такое «кодон»?
- Что такое «транскрипция» ДНК?
- Что такое «трансляция» ДНК?
Набор вопросов B (для детей от 18 лет и старше) - Какие четыре пары оснований ДНК образуют двойную спираль?
- Как А отличить Т от С?
- Какую двойную спираль ДНК, по вашему мнению, сложнее? разделены на две цепи: ДНК, состоящая преимущественно из основания AT пар или пар оснований GC? Почему?
- Что такое мутация?
- Двойная спираль ДНК выглядит как витая лестница.
 Что
составляет каждую ступеньку лестницы? Что скрепляет перекладины по бокам?
Что
составляет каждую ступеньку лестницы? Что скрепляет перекладины по бокам? - Есть ли по большей части пустое пространство между атомами в двойной спирали ДНК?
- Одна пара оснований не может сформировать нормальный Watson-Crick водородные связи. Вы можете это найти? (Примечание: нажав на любой основе в D. Концы, антипараллельность сообщает свою букву и порядковый номер внизу браузера в строке состояния после слова «Группа». Используйте эту функцию для получения букв и порядковых номеров аномальная пара оснований, как только вы ее обнаружите.)
- Как белки распознают определенные последовательности ДНК?
(Подробнее об этом.)
Набор вопросов C (для детей от 20 лет и старше) - Какие основания являются пуринами? Пиримидины?
- Если пурин был заменен на пиримидин на одном положение в одной цепи двойной спирали ДНК, что произойдет?
- Почему в двойной спирали ДНК не образуют две буквы А или Т? водородные связи (из трех возможных) с G или C?
- Сколько видов 5-членных колец в ДНК?
- Сколько видов 6-членных колец в ДНК?
- Имеет ли «свободное плечо» дезоксирибоза (углерод, не являющийся член пентозного кольца) указывают в направлении, в котором кодировка читается или против?
- На основе показанных кодонов (в фильме Codons в разделе Б.
 Код ), это показанная нить ДНК.
нить шаблона или нить кодирования?
Код ), это показанная нить ДНК.
нить шаблона или нить кодирования?
Набор вопросов A (для детей 14 лет и старше)
Ответы доступны преподавателям, которые задают вопросы электронное письмо на адрес [email protected] с подтверждением их должности преподавателей, например, со ссылкой на школу или факультет перечисления веб-сайта колледжа. Я буду не отправлять ответы , если вы назовите свое полное имя, должность (студент, преподаватель и т. д.), учреждение, город штат Страна. Если вы не учитель, скажите, пожалуйста, имя и адрес электронной почты вашего учителя, а также веб-сайт вашего учителя, если он есть.
Вопросы Фриды Райхсман (MoleculesInMotion.Com) и Эрик Марц. Отзыв Эрику Марцу.
Глоссарий :: ДНК с начала
Говорящий глоссарий генетических терминов от Национального исследовательского института генома человека.
- Активатор ( Ac )
- Автономный переносной элемент кукурузы, который также контролирует движение другого транспозона, диссоциатора ( DS ).

32 Анимация, 32 Видео - аденин
- Одно из четырех оснований, составляющих ДНК.Обозначается буквой «А».
15 Анимация; 19 Анимация; 20 Анимация; 21 Анимация; 22 Анимация; 23 Анимация, 23 Задача; 26 Анимация; 28 Анимация - аденовирус
- Аденовирусы содержат двухцепочечную ДНК и необычайно стабильны, что позволяет им выживать в течение длительных периодов времени вне организма. Аденовирусы поражают оболочки дыхательных путей, глаз, кишечника и мочевыводящих путей и могут вызывать респираторные инфекции и желудочно-кишечные расстройства.
24 Анимация, 24 Биография - Электрофорез в агарозном геле
- Матрица, состоящая из высокоочищенного
форма агара используется для разделения более крупных молекул ДНК и РНК в диапазоне
от 100 до 20 000 нуклеотидов.
23 Анимация; 24 анимации, 24 видео, 24 биографии; 29 Анимация - алкаптонурия
- Редкое наследственное заболевание, при котором моча человека приобретает темно-коричнево-черный цвет при контакте с воздухом.
 Мутация в гене HGD вызывает состояние.
Мутация в гене HGD вызывает состояние.
13 Bio, 13 Problem; 16 Анимация - аллель
- Альтернативная версия гена, например, растения гороха Грегора Менделя имеют цветы двух цветов: белого и красновато-пурпурного. Ген окраски цветка в этом случае имеет два аллеля, один для белого, а другой для красновато-пурпурного.
2 Анимация; 4 Анимация, 4 Задачи; 5 Анимация, 5 Проблем; 11 Анимация; 16 Анимация - аминокислота
- Класс молекул, которые являются строительными блоками белков. В состав белков входят 20 различных аминокислот.
15 анимаций, 15 видео, 15 биографий; 16 Анимация - апоптоз (гибель клеток)
- Естественный процесс запрограммированной гибели клеток как часть нормального роста и развития.
38 Анимация, 38 Задача - Антеннапедия
- Гомеотическая мутация Drosophila , при которой пара ног заменяет антенну.
37 Анимация, 37 Галерея - аутосома
- Хромосома, не участвующая в определении пола.

39 концепция - бактерии / бактерии
- Одноклеточный прокариотический организм. (см. Escherichia coli)
17 Анимация, 17 Био; 18 Анимация; 27 Анимация, 27 Биография; 28 Анимация; 30 Анимация; 40 Био - бактериофаг (фаг или фаговая частица)
- Вирус, поражающий бактерии. Измененные формы используются в качестве векторов для клонирования ДНК.
18 Анимация; 27 Анимация; 39 Анимация - базовая пара
- Открытие Джеймса Ватсона, которое сыграло ключевую роль в разгадывании структуры ДНК. Основания, составляющие пары ДНК друг с другом: от A до T и от G до C. Пары удерживаются вместе водородными связями
19 Анимация - BRCA1 / BRCA2
- Мутации в генах супрессоров опухолей BRCA1 и BRCA2 связаны с наследственным раком груди и яичников.
36 Анимация - Библиотека, состоящая из дополнительных копий клеточного
мРНК.
36 Анимация39 Анимация40 Анимация - клеточный цикл
- Процесс деления и репликации клеток.
 В эукариотических клетках клеточный цикл имеет два периода: интерфазный, когда клетка растет и дублирует свою ДНК (фазы G1, S и G2), и митоз (фаза M), когда клетка разделяется на две дочерние клетки.
В эукариотических клетках клеточный цикл имеет два периода: интерфазный, когда клетка растет и дублирует свою ДНК (фазы G1, S и G2), и митоз (фаза M), когда клетка разделяется на две дочерние клетки.
38 Анимация - Центральная догма
- Теория, разработанная Джеймсом Уотсоном и Фрэнсисом Криком для описания процесса производства белка: ДНК к РНК к белку.
21 анимация, 21 биография; 25 Анимация, 25 Биография - центромер
- Области хромосом, состоящие из некодирующей, очень повторяющейся ДНК. Во время митоза эта область соединяет сестринские хроматиды и прикрепляет волокна веретена, которые тянут разделенные хромосомы к противоположным полюсам.
7 Анимация; 8 Анимация; 39 Анимация - хроматида
- Каждая из двух дочерних цепей дублированной хромосомы
соединяются в центромере во время митоза и мейоза.
7 Анимация; 8 Анимация; 31 Анимация - хроматин
- Относится к объединенному материалу ДНК и белка, который сворачивается в хромосомы.

29 Анимация - хромосома
- Хромосомы — это пакеты ДНК, обнаруженные в ядре клетки. У человека 46 хромосом.
8 Анимация, 8 Биография; 9 Анимация, 9 Видео, 9 Биография; 10 анимаций, 10 видео, 10 биографий; 11 Анимация, 11 Видео, 11 Галерея, 11 Биография; 29 Анимация, 29 Видео, 29 Задача - клон
- Обозначает реплику.Молекулы ДНК можно клонировать с использованием бактерий или вирусов в качестве хозяев. Генетический клон также может относиться к организму, который является генетической копией оригинала, полученной с использованием различных методов in vitro.
34 Анимация, 34 Видео; 39 Анимация - кодон
- Три основания в последовательности ДНК, которая кодирует тип аминокислоты, которая должна быть помещена в белок. Например, кодон G-T-G означает аминокислоту валин.
22 Анимация, 22 Видео, Биография; 23 Анимация - комплементарная ДНК (кДНК)
- Соответствующая цепь молекулы ДНК, с которой связаны ее основания.

19 Анимация; 20 Анимация; 22 Анимация; 36 Анимация; 39 Анимация - конъюгация
- Перенос генетического материала между бактериальными клетками. ДНК передается от клетки-донора к клетке-реципиенту через прямой межклеточный контакт или соединение между двумя бактериальными клетками.
18 Анимация - переход
- Обмен последовательностями ДНК между хроматидами гомологичных хромосом во время мейоза.
11 Анимация, 11 Видео; 27 Анимация - цитозин
- Одно из четырех оснований, составляющих ДНК.Обозначается буквой C.
15 Анимация; 19 Анимация; 20 Анимация; 21 Анимация; 22 Анимация; 23 Анимация, 23 Задача; 26 Анимация; 28 Анимация - ДНК
(дезоксирибонуклеиновая кислота) - Органическая кислота и полимер, состоящий из четырех азотистых оснований — аденина, тимина, цитозина и гуанина —
связаны через промежуточные единицы фосфата и дезоксирибозы сахара пентозы. ДНК — это генетический материал большинства организмов и обычно
существует как двухцепочечная молекула, в которой две антипараллельные цепи удерживаются вместе водородными связями между аденин-тимином и цитозин-гуанином.

17 Анимация; 19 Анимация; 20 Анимация - Массив ДНК
- ДНК-массивы (также известные как микроматрицы или генные чипы) могут анализировать паттерны экспрессии генов и показывать, как экспрессия генов реагирует на внешние факторы.
36 Анимация, 36 Видео, 36 Биография, 36 Задача - Секвенирование ДНК
- Процедуры определения нуклеотидной последовательности
фрагмент ДНК.
21 Bio; 23 Анимация; 35 Анимация; 39 Анимация - делеция
- Мутация в ДНК, при которой удален участок ДНК.Некоторые делеции не имеют никакого эффекта, в то время как другие могут иметь резкий эффект, в зависимости от того, сколько ДНК было удалено и была ли делеция в области ДНК, кодирующей белок.
27 Анимация; 29 Bio; 32 Bio; 41 Анимация - Центрифугирование в градиенте плотности
- Метод, при котором клетки, органеллы или молекулы могут быть разделены с помощью центробежной силы в зависимости от их размера, формы и плотности.

20 анимаций, 20 видео, 20 биографий, 20 задач; 21 Анимация - дезоксирибонуклеиновая кислота
- (см. ДНК)
- дидезоксинуклеотид
- Дезоксинуклеотид, у которого отсутствует 3′-гидроксильная группа, и поэтому он не может
образуют 3′-5′-фосфодиэфирную связь, необходимую для удлинения цепи.Дидезоксинуклеотиды используются для секвенирования ДНК и лечения
вирусные заболевания.
23 Анимация - диплоид
- Состояние, при котором геном организма состоит из двух
копии каждой хромосомы.
8 Проблема - Диссоциатор ( DS )
- Переносной элемент кукурузы, подвижность которого зависит от другого элемента, Активатор ( Ac )
32 Анимация, 32 Видео - доминирующая
- Генетический признак или заболевание является доминантным, когда для развития признака необходима только одна копия гена.При наследовании двух копий гена развивается рецессивный признак или заболевание.
4 Анимация, 4 Проблем; 5 Анимация, 5 Проблем; 13 Анимация, 13 Задача - двойная спираль
- Описывает свертывание антипараллельных нитей
Молекула ДНК, напоминающая спиральную лестницу, в которой спарены основания
образуют ступеньки, а сахарно-фосфатные основы образуют рельсы.
17 Анимация; 19 Анимация; 20 Анимация - Drosophilia melanogaster (плодовая муха)
- Система моделей животных, используемая для изучения генетики.Дрозофилы просты в содержании, имеют большое количество потомков, быстро растут, а геном относительно легко нарушить и ввести чужеродные гены.
10 анимаций, 10 видео, 10 задач; 11 Анимация, 11 Видео, 11 Задача; 27 Анимация; 37 Анимация, 37 Галерея, 37 Видео, 37 Задач; 39 Анимация - электрофорез
- Техника разделения заряженных молекул
в матрице, к которой приложено электрическое поле.
23 анимации, 24 анимации, 24 видео, 24 биографии - Escherichia coli (бактерии)
- Тип бактерий, населяющих толстую кишку человека.E. coli — один из наиболее важных организмов в исследованиях молекулярной генетики, особенно в области рекомбинантной ДНК, поскольку она служит хозяином для плазмид и других векторов клонирования.
18 Анимация, проблема; 34 Анимация, 34 Видео, 34 Задачи - евгеника
- Попытка вывести лучших людей путем поощрения воспроизводства людей с «хорошими» генами и отпугивания людей с «плохими» генами. Движение евгеники 19 века зародилось в Соединенных Штатах и в конечном итоге было дискредитировано.
14 Анимация, 14 Галерея, 14 Задачи - эволюция
- Долгосрочный процесс, посредством которого население
организмов накапливает генетические изменения, которые позволяют его членам
успешно адаптироваться к условиям окружающей среды и лучше использовать
пищевые ресурсы.
12 Анимация, Галерея, 12 Видео, 12 Биография - экзон
- Часть гена, содержащая инструкции по созданию белка.
24 Анимация, 24 Задача; 26 Анимация; 34 Анимация - ген
- Часть ДНК, содержащая инструкции по созданию белка.
6 Анимация; 10 Анимация; 11 анимаций, 12 анимаций, 16 анимаций - экспрессия гена
- Процесс производства белка из его последовательностей, кодирующих ДНК и мРНК.
33 Анимация; 36 Анимация; 37 Анимация; 39 Анимация - генетическая (сцепная) карта
- Линейная карта относительного
положения генов в хромосоме. Расстояния устанавливаются с помощью анализа сцепления, который определяет частоту, с которой два генных локуса разделяются во время хромосомной рекомбинации.
11 Анимация, 24 Анимация - GeneChips®
- Процесс создания и встраивания определенных последовательностей ДНК на поверхность, которая будет использоваться для крупномасштабного анализа ДНК (см. Также массив ДНК).
36 Анимация, 36 Видео, 36 Биография - генетический код
- Трехбуквенный код, переводящий последовательность нуклеиновой кислоты в последовательность белка (см. Также кодон).
21 Анимация; 22 видео, 22 анимация - геном
- Относится ко всей ДНК организма — всему генетическому компоненту.
30 Анимация; 39 Анимация, Видео - генотип
- Структура ДНК, определяющая экспрессию
признак (фенотип).
2 Анимация; 5 Анимация - зародышевые линии
- Последовательность клеток, которые имеют генетический материал, который может передаваться потомству, например, от зиготы к гаметоциту, к сперматозоиду и яйцеклеткам. Клетки зародышевой линии могут воспроизводиться бесконечно.
- гуанин
- Одно из четырех оснований, составляющих ДНК. Обозначается буквой ‘G.’
15 Анимация; 19 Анимация; 20 Анимация; 21 Анимация; 22 Анимация; 23 Анимация, 23 Задача; 26 Анимация; 28 Анимация - гаплоид
- Число хромосом, равное одному комплекту генетической одаренности эукариотического организма.
8 Анимация, 8 Задачи - гетерозиготные
- Обладает двумя разными формами (аллелями) гена, по одной унаследованной от каждого родителя. Также известен как «генный носитель».
- гистон
- Любой из пяти родственных белков, состоящий в основном из основных
аминокислоты, которые являются каркасом, вокруг которого намотана ДНК с образованием
структура хроматина эукариотических хромосом.
29 Анимация, 29 Галерея, 29 Задача - гомеотический ген
- Гены, контролирующие паттерны развития, определяющие, где, когда и как развиваются сегменты и структуры тела. Изменения в этих генах вызывают изменения в структуре частей тела у животных и растений.
37 Анимация, 37 Видео, 37 Задача - гомолог
- Любой член набора генов или последовательностей ДНК от разных организмов, нуклеотидные последовательности которых демонстрируют высокую степень однозначного соответствия.
11 Анимация, 40 Анимация - гомозиготный
- Обладает двумя идентичными формами (аллелями) гена, унаследованными от каждого родителя.
- Искусственная хромосома человека (HAC)
- Искусственный вектор, используемый для переноса или экспрессии больших фрагментов ДНК человека, подобный искусственной хромосоме дрожжей (YAC) и бактериальной искусственной хромосоме (BAC).
- Проект «Геном человека»
- Международное сотрудничество по секвенированию и аннотированию всего генома человека.Публичная часть проекта была реализована различными центрами секвенирования по всему миру при участии тысяч ученых. Приватную часть проекта взяла на себя Celera Genomics.
39 Анимация, 39 Видео, 39 Галерея, 39 Биография; 41 Анимация - гибрид
- Потомство двух родителей, различающихся по крайней мере одним генетическим признаком (признаком). А также гетеродуплексная ДНК или молекула ДНК-РНК.
5 анимаций, 5 биографий; 12 Анимация, 12 Задача - гибридизация
- Водородная связь комплементарных последовательностей ДНК и / или РНК с образованием дуплексной молекулы.
31 Анимация, 31 Био - водородная связь
- Относительно слабая связь, образованная между атомом водорода (который ковалентно связан с атомом азота или кислорода) и азотом или кислородом с неподеленной электронной парой.
19 Анимация - вставка
- Мутация в ДНК, в которую вставлен участок ДНК. Некоторые вставки не имеют никакого эффекта, в то время как другие могут иметь резкий эффект, в зависимости от того, сколько ДНК было вставлено и была ли вставка в области ДНК, кодирующей белок.
- инсулин
- Пептидный гормон, секретируемый островками Лангерганса поджелудочной железы, регулирующий уровень сахара в крови.
23 Анимация, 23 Биография - интерферон
- Семейство небольших белков, которые стимулируют устойчивость клеток к вирусам.
35 Анимация - интрон
- Часть гена, не содержащая инструкций по созданию белка. Интроны отделяют друг от друга экзоны (кодирующие участки гена).
24 Анимация, 24 Задача; 26 Анимация - нокаут
- Ген, работа которого в организме невозможна. «Нокаут-гены» можно использовать для изучения неизвестных эффектов конкретного гена. «Нокаутная мышь» — это мышь, у которой «выбиты» один или несколько генов.
- лак оперон
- «Оперон» — это близкое расположение родственных генов и их общая регуляция. Lac-оперон контролирует транспорт и метаболизм лактозы в бактериях и включает как положительную, так и отрицательную регуляцию.
33 анимации, 33 видео, 33 биографии, 33 задачи - библиотека
- Коллекция клеток, обычно бактерий или дрожжей, которые были трансформированы рекомбинантными векторами, несущими вставки ДНК одного вида.
10 Анимация; 36 Анимация; 39 Анимация - рычажный
- Частота совместного наследования пары генов и / или генетических маркеров, которая обеспечивает меру их физической близости друг к другу на хромосоме.
11 Анимация, 11 Биография - отображение
- Определение физического расположения гена или генетического маркера на хромосоме.
11 Анимация; 24 Анимация - маркер
- Используемый для идентификации клеток, индивидуумов или видов, маркер представляет собой ген или последовательность ДНК с известным хромосомным положением.
- мейоз
- Процесс редукционного деления, при котором образуются гаплоидные гаметы и споры, состоящий из одной дупликации генетического материала, за которой следуют два митотических деления.
8 Анимация, 8 Галерея, 8 Биография; 11 Анимация - Менделирующее наследование
- Правила, описывающие наследование характеристик, основанные на доминантных и рецессивных моделях наследования.Первый закон Менделя гласит, что каждая гамета получает по одной копии каждого родительского аллеля; Второй закон Менделя гласит, что аллели сортируются независимо друг от друга во время образования гамет.
- информационная РНК (мРНК)
- Тип РНК, участвующий в производстве белка. ДНК транскрибируется в мРНК, которая затем транслируется в аминокислоты с образованием белков.
21 Анимация, 21 Галерея, 21 Био; 22 Анимация, 22 Задача; 24 анимации, 24 галереи, 24 видео, 24 биографии; 31 Анимация; 39 Анимация - метафаза
- Фаза эукариотического клеточного цикла, когда конденсированные хромосомы выравниваются в середине делящейся клетки до того, как клетка разделяется на две дочерние клетки.
- микрочип
- (см. Массив ДНК)
- митоз
- Процесс деления клеток, в ходе которого образуются соматические клетки. В митозе одна клетка делится равномерно с образованием двух дочерних клеток с одинаковым числом хромосом.
7 анимаций, 7 биографий, 7 задач; 8 Анимация - митохондрия
- Органелла, вырабатывающая аденозинтрифосфат (АТФ), основной источник клеточной энергии. Митохондрии также участвуют в передаче сигналов, дифференцировке и контроле клеточного цикла и имеют свой собственный независимый геном, отдельный от ядерной ДНК клетки.
- митохондриальная ДНК
- Митохондрии имеют собственный независимый геном, отдельный от ядерной ДНК клетки (мтДНК). Геном обычно является кольцевым, независимо реплицируется и состоит в основном из генов, участвующих в производстве аденозинтрифосфата (АТФ), основного источника клеточной энергии.
30 Анимация, 30 Видео, 30 Задачи - модель организма
- Нечеловеческий организм, такой как дрожжи, плодовая муха или мышь, используемый для изучения биологических явлений, таких как генетика.Модельные организмы имеют много общих генов, биохимических и физиологических процессов с людьми.
- мутация
- Изменение генетического кода (A, C, G и T) гена.
27 Анимация, 27 Галерея, 27 Видео, 27 Биография; 28 Анимация; 32 Анимация - Neurospora crassa (форма для хлеба)
- Гаплоидный модельный организм, наиболее широко используемый Бидлом и Татумом для изучения метаболических путей и выдвижения гипотезы «один ген, один фермент».
16 Анимация, 16 Галерея - нитроцеллюлоза
- Мембрана, используемая для иммобилизации ДНК, РНК или белка, которую затем можно исследовать с помощью меченой последовательности или антитела.
36 Анимация - азотистых оснований
- Пурины (аденин и гуанин) и пиримидины (тимин, цитозин и урацил), которые составляют молекулы ДНК и РНК.
15 Анимация, 15 Задач; 19 Анимация - нуклеаза
- Класс ферментов, разрушающих молекулы ДНК и / или РНК путем расщепления фосфодиэфирных связей, связывающих соседние нуклеотиды.
17 Анимация, 17 Задач; 25 Анимация, 25 Задачи - нуклеин
- Термин, используемый Фридрихом Мишером для описания ядерного материала, открытого им в 1869 году, который сегодня известен как ДНК.
15 Анимация - нуклеотид
- Строительный блок ДНК и РНК, состоящий из азотистого основания, пятиуглеродного сахара и фосфатной группы.
15 Анимация; 15 Проблема; 23 Анимация, 23 Задача - ядро
- Мембраносвязанная область эукариотической клетки, содержащая хромосомы.
7 Анимация, 7 Проблем; 8 Анимация, 8 Задача; 30 Анимация - онкоген
- Ген, который способствует образованию рака при мутации или несоответствующей экспрессии.
40 Анимация - оператор
- Прокариотический регуляторный элемент, который взаимодействует с репрессором для контроля транскрипции соседних структурных генов.
33 Анимация, 33 Задачи - P53
- Белок, который действует как «контрольная точка» в клетках, вызывая либо остановку роста, либо восстановление ДНК, либо гибель клеток при повреждении ДНК клетки. Большинство раковых клеток имеют мутации в белке p53.
- родословная
- Диаграмма, отображающая генетическую историю конкретной семьи.
13 Анимация, 13 Задач; 14 Анимация, 14 Задачи - фаг
- (см. Бактериофаг)
- фенотип
- Выражение признака, основанного на генетическом составе или генотипе.
2 Анимация; 4 Анимация; 5 Анимация, 5 Проблем; 10 анимаций, 10 задач; 11 Анимация, 11 Задача - фосфат
- Один из компонентов ДНК, фосфодиэфирные связи, образующие сахарно-фосфатный остов. Аденозинтрифосфат (АТФ) также является основным источником клеточной энергии.
15 Анимация; 23 Анимация - физическая карта
- Карта, показывающая физические местоположения в молекуле ДНК, такие как сайты рестрикции, RFLP и сайты с метками последовательностей.
- плазмида
- Круглые фрагменты ДНК с бактериальными компонентами. Они существуют вне бактериальных хромосом и реплицируются вместе с ними. В одной бактериальной клетке может быть несколько копий плазмиды. Чужеродная ДНК может быть добавлена в плазмиды с использованием молекулярных ферментов для «вырезания» и «вставки» ДНК.
33 Анимация; 34 Анимация; 39 Анимация - полилинкер
- Короткая последовательность ДНК, содержащая несколько сайтов узнавания рестрикционного фермента, которая содержится в клонирующих векторах.
34 Задача - полимераза
- Фермент, катализирующий добавление нескольких субъединиц к молекуле субстрата.
ДНК: 20 анимация, 20 видео
ДНК: 21 анимация; 33 Анимация - полимеразная цепная реакция (ПЦР)
- Процедура ферментативной амплификации целевой последовательности ДНК до нескольких тысяч пар оснований путем повторной репликации ДНК-полимеразой.
39 Анимация - полинуклеотид
- ДНК-полимер, состоящий из нескольких нуклеотидов.
15 Анимация, 15 Задачи - полипептид (белок)
- Полимер, состоящий из нескольких аминокислотных единиц, связанных пептидными связями.
15 Анимация - праймер
- Короткий фрагмент ДНК или РНК, отожженный до одноцепочечной ДНК, из которого ДНК-полимераза расширяет новую цепь ДНК с образованием дуплексной молекулы.
23 Анимация; 39 Анимация, 39 Задача; 41 Анимация, 41 Проблема - проинсулин
- Полипептид-предшественник проинсулина, 24-аминокислотная последовательность сигнального пептида которого отвечает за внеклеточную секрецию.
34 Анимация - прокариот
- Организм, клетка (клетки) которого лишены ядра и других мембраносвязанных везикул. Прокариоты включают всех членов Королевства Монера.
18 Анимация - промоутер
- Область ДНК, простирающаяся на 150–300 п.н. выше сайта начала транскрипции, которая содержит сайты связывания для РНК-полимеразы и ряда белков, которые регулируют скорость транскрипции соседнего гена.
33 Анимация; 37 Анимация - протеаза
- Фермент, расщепляющий пептидные связи, связывающие аминокислоты в молекулах белка.
17 Анимация, 17 Задача; 25 Анимация, 25 Задачи - белок
- Полимер аминокислот, связанных пептидными связями, который может состоять из двух или более полипептидных цепей.
15 Анимация - РНК (рибонуклеиновая кислота)
- Органическая кислота, состоящая из повторяющихся нуклеотидных единиц аденина, гуанина, цитозина и урацила, рибозные компоненты которых связаны фосфодиэфирными связями.
21 Анимация, 21 Задача; 26 Анимация, 26 Видео, 26 Задача; 24 Анимация, 24 Галерея, 24 Видео, 24 Задачи; 25 Анимация, 25 Видео, 25 Задачи - радиоактивный зонд / бирка
- Фрагмент ДНК или РНК, используемый для обнаружения конкретных нуклеотидных последовательностей с использованием принципа комплементарности ДНК.Зонд «помечен» радиоактивным или флуоресцентным молекулярным маркером для визуализации.
18 Анимация; 20 Анимация; 21 Анимация; 23 Анимация; 25 Анимация, 25 Задачи - рамка чтения
- Серия триплетных кодонов, начинающихся с определенного нуклеотида. В зависимости от того, где она начинается, каждая цепь ДНК содержит три разные рамки считывания.
22 Анимация, 22 Задача; 27 Анимация - рецептор
- Белковая молекула, которая связывает один или несколько определенных типов сигнальных молекул (лигандов), что вызывает изменение формы (конформации) рецептора.Это может затем вызвать потерю или усиление активности белка и, как следствие, клеточные реакции.
33 Анимация; 35 Анимация, 35 Задачи - рецессивный
- Рецессивный генетический признак или заболевание проявляется только в том случае, если две копии гена передаются по наследству. Для доминантного признака или расстройства необходима одна копия гена для развития признака.
4 Анимация, 4 Задачи; 5 Анимация, 5 Проблем; 13 Анимация, 13 Задача Последовательность распознавания - (сайт)
- Нуклеотидная последовательность, обычно состоящая из 4, 6 или 8 нуклеотидов, распознаваемая эндонуклеазой рестрикции.Разрезанные ферменты типа II (и соответствующие им модифицирующие ферменты метилат) внутри или очень близко к узнаванию см. Последовательность распознавания (сайт)
24 Анимация, 24 Задачи; 34 Анимация, 34 Задача - рекомбинация
- Процесс, при котором часть ДНК (или иногда РНК) разрывается и присоединяется к другой части ДНК, естественным или искусственным путем, что делает возможной генетическую изменчивость. Обычный естественный пример — хромосомный кроссовер.
11 Анимация, 11 Видео, 11 Проблем; 27 Анимация; 32 Анимация - репрессор
- ДНК-связывающий белок прокариот, который блокирует транскрипцию гена путем связывания с оператором.
33 Анимация, 33 Видео, 33 Задача - эндонуклеаза рестрикции (фермент)
- Класс эндонуклеаз, которые расщепляют ДНК после распознавания определенной последовательности.
24 Анимация, 24 Видео, 24 Задачи; 34 Анимация, 34 Задача; 39 Анимация - Полиморфизм длины рестрикционного фрагмента (RFLP)
- Различия в нуклеотидной последовательности между аллелями в хромосомном локусе приводят к рестрикционным фрагментам различной длины, обнаруживаемым с помощью саузерн-анализа.
39 Анимация - карта ограничений
- Физическая карта, показывающая расположение сайтов узнавания рестрикционного фермента.
24 Анимация, 24 Задачи; 39 Анимация - ретровирус
- Член класса РНК-вирусов, который использует фермент обратной транскриптазы для обратного копирования своего генома в промежуточный ДНК, который интегрируется в хромосому клетки-хозяина. Многие естественные виды рака позвоночных животных
вызваны ретровирусами.
25 Анимация, 25 Галерея, 25 Видео - обратная транскриптаза (РНК-зависимая ДНК-полимераза)
- Фермент, выделенный из инфицированных ретровирусом клеток, который синтезирует комплементарную (c) цепь ДНК из матрицы РНК.
25 Анимация, 25 Видео, 25 Задач; 36 Анимация; 39 Анимация - рибонуклеиновая кислота (РНК)
- Органическая кислота, состоящая из
повторяющиеся нуклеотидные единицы аденина, гуанина, цитозина и урацила,
компоненты рибозы которого связаны фосфодиэфирными связями.
15 Анимация, 21 Анимация - рибосомы
- Структура, состоящая из белков и РНК, которые являются местами производства белка в клетке. Рибосомы декодируют информационную РНК (мРНК) и собирают аминокислоты в белки на основе сценария мРНК.
21 Анимация; 22 Анимация - Saccharomyces cerevisiae
- Дрожжи пивные
38 Анимация; 40 Анимация - выбираемый маркер
- Ген, экспрессия которого позволяет идентифицировать клетки, которые были трансформированы или трансфицированы вектором, содержащим маркерный ген.
18 Анимация, 18 Задача; 27 Анимация; 34 Анимация, 34 Задача - полуконсервативная репликация
- Во время дупликации ДНК каждая цепь родительской молекулы ДНК является матрицей для синтеза ее новой комплементарной цепи.Таким образом, половина существующей молекулы ДНК сохраняется во время каждого цикла репликации.
20 Анимация, 20 Видео, 20 Задачи - половая хромосома
- Половые хромосомы в половых клетках большинства животных и некоторых растений в совокупности определяют половые и связанные с полом характеристики человека. Половые хромосомы обычно обозначают X и Y, причем самки — это XX, а мужские — XY.
- секс связан
- Тип наследования, когда аллель расположен на половой хромосоме, и поэтому фенотип аллеля связан с полом организма.Поскольку у людей больше генов на Х-хромосоме, чем в Y-хромосоме, у человека больше Х-сцепленных черт и заболеваний, чем—сцепленных.
- преобразование сигнала
- Биохимические события, передающие сигнал гормона или фактора роста из внешней части клетки через клеточную мембрану в цитоплазму. Это включает в себя ряд молекул, включая рецепторы, G-белки и вторичные мессенджеры.
35 Анимация, 35 Задачи - сварка
- Обработка информационной РНК (мРНК) после транскрипции для удаления интронов и присоединения экзонов для обеспечения трансляции мРНК в белки.
24 Анимация, 24 Задачи - стволовых клеток
- Стволовые клетки могут дифференцироваться в ряд специализированных клеток (они «плюрипотентны»). Эмбриональные и взрослые стволовые клетки можно выращивать искусственно и потенциально использовать в лечебных целях.
41 Анимация - липких концов
- Выступающая одноцепочечная нуклеотидная последовательность, образующаяся, когда эндонуклеаза рестрикции отщепляет центр в ее последовательности узнавания.
34 Анимация, 34 Задача - стоп-кодон
- Любая из трех последовательностей мРНК (UGA, UAG, UAA), которые не кодируют аминокислоту и, таким образом, сигнализируют об окончании синтеза белка.
22 Анимация, Проблема; 27 Анимация - субтрактивная гибридизация
- Мощный метод изучения экспрессии генов в определенных тканях или типах клеток на определенной стадии развития.
36 Анимация, 36 Видео - ген самоубийства
- Гены, вызывающие клеточную гибель («апоптоз»). Эти гены могут быть активированы посредством множества сигнальных процессов, при этом белок р53 является обычным «переключателем».
38 Анимация - суперспираль ДНК
- плотно упакована в ядре за счет добавления скручиваний для создания структурного напряжения, которое затем снимается с помощью суперспиральных структур.Сначала ДНК оборачивается вокруг гистонов, образуя 10-нм волокно, затем это волокно скручивается в 30-нм волокно, которое затем снова наматывается на себя.
29 Анимация, 29 Галерея, 29 Видео, 29 Задачи - супернатант
- Растворимая жидкая фракция образца после центрифугирования или осаждения нерастворимых твердых веществ.
17 Анимация; 20 Анимация; 21 Анимация; 25 анимаций, 25 задач, 35 анимаций - шаблон
- РНК или одноцепочечная молекула ДНК, на которой синтезируется комплементарная нуклеотидная цепь.
20 Анимация; 21 Анимация; 22 Анимация; 23 Анимация; 24 Анимация; 25 анимаций, 25 биографий; 26 Анимация; 31 Анимация - кодон терминации
- (см. Стоп-кодон)
- тимин
- Одно из четырех оснований, составляющих ДНК, сокращенно «Т». Тимин заменен в РНК на урацил.
15 Анимация; 19 Анимация; 20 Анимация; 21 Анимация; 22 Анимация; 23 Анимация, 23 Задача; 26 Анимация; 28 Анимация - черта
- (см. Фенотип)
- транскрипция
- Процесс, посредством которого ДНК копируется в информационную РНК (мРНК) для производства белка.
21 Анимация - транспортная РНК (тРНК)
- Конкретный класс молекул РНК, которые переносят живые кислоты к рибосомам для сборки в белок. Для каждой из 20 аминокислот существует своя тРНК.
21 Анимация, 21 Видео - трансформация
- У прокариот — естественное или индуцированное поглощение и экспрессия чужеродной последовательности ДНК — обычно рекомбинантной плазмиды в экспериментальных системах. У высших эукариот превращение культивируемых клеток в злокачественный фенотип — обычно через заражение
опухолевый вирус или трансфекция онкогеном.
34 Анимация, 34 Видео - принцип трансформации
- Гипотеза, теперь доказанная, что бактерии способны передавать генетическую информацию посредством трансформации.
17 Анимация - трансгенный
- Организм позвоночного, в котором ген чужеродной ДНК (трансген) стабильно включен в его геном на ранних этапах эмбрионального развития. Трансген присутствует как в соматических, так и в половых клетках, экспрессируется в одной или нескольких тканях и наследуется потомством по менделевской манере.
41 Анимация - перевод
- Процесс, посредством которого информационная РНК (мРНК) используется и декодируется для производства белка. Это происходит на фабриках по производству белка клетки, называемых рибосомами.
21 Анимация; 22 Анимация, 22 Видео, 22 Задача - транслокация
- Обрыв большого сегмента ДНК одной хромосомы с последующим присоединением этого сегмента к другой хромосоме.
29 Bio; 32 Био - транспозон
- (переносной или подвижный генетический элемент).Относительно небольшой сегмент ДНК, который может перемещаться из одной хромосомной позиции в другую.
32 анимации, 32 видео, 32 биографии, 32 задачи - трипсин
- Протеолитический фермент, который гидролизует пептидные связи на карбоксильной стороне аминокислот аргинина и лизина.
25 Анимация, 25 Задач - Ультрабиторакс (Ubx)
- Гомеотический ген, влияющий на развитие грудных сегментов T2 и
Т3 у Drosophila .
37 Анимация - урацил
- Обнаруженное в РНК, это производное пиримидина соединяется с аденином и заменяет тимин во время транскрипции ДНК.
21 Анимация, 21 Задача; 22 Анимация, 22 Задача; 26 Анимация - вектор
- Автономно реплицирующаяся молекула ДНК, в которую вставляются чужеродные фрагменты ДНК и затем размножаются в клетке-хозяине.
41 Анимация, 41 Задача - вирус (см. Также ретровирус)
- Инфекционная частица, состоящая из белковой капсулы и ядра нуклеиновой кислоты, репликация которой зависит от организма-хозяина.
18 Анимация; 25 анимаций, 25 галерей, 25 биографий; 27 Анимация; 24 Био - Рентгеновская кристаллография
- Дифракционная картина рентгеновских лучей, проходящих через чистый кристалл вещества, использованного для определения его атомной структуры.
19 Анимация, 19 Биография; 20 Био - Дифракция рентгеновских лучей
- Метод, используемый для определения структуры таких молекул, как ДНК. Поток рентгеновских лучей, направленных на кристалл, дифрагирует и рассеивается при встрече с атомами.Рассеянные лучи интерферируют друг с другом и образуют пятна разной интенсивности, которые можно записать на пленку.
19 Анимация; 29 Анимация - Х-сцепленная мутация
- Генетическая мутация, расположенная на Х-хромосоме, также называемая наследованием, сцепленным с полом, поскольку существует другой образец наследования между мужчинами и женщинами.
10 Анимация; 14 Анимация; 27 Анимация, 27 Видео - дрожжи
- (см. Saccharomyces cerevisiae)
38 Анимация; 40 Анимация
А
B
С
Библиотека кДНКD
E
G
H
я
К
L
M
N
O
-п.
R
S
Т
U
В
Х
Y
Программируемая недорогая платформа на основе ДНК для обнаружения вирусной РНК
Abstract
Обнаружение вирусов имеет решающее значение для борьбы с распространением болезней.Недавние возникающие вирусные угрозы, включая вирус Зика, вирус Эбола и SARS-CoV-2, вызывающий коронавирусную болезнь 2019 (COVID-19), подчеркивают стоимость и сложность быстрого реагирования. Чтобы решить эти проблемы, мы разрабатываем платформу для недорогого и быстрого обнаружения вирусной РНК с помощью нанопереключателей ДНК, которые механически изменяют конфигурацию в ответ на определенные вирусы. Используя вирус Зика в качестве модельной системы, мы демонстрируем неферментативное обнаружение вирусной РНК с селективным и мультиплексным обнаружением между родственными вирусами и вирусными штаммами.Для клинической чувствительности биологических жидкостей мы объединили анализ с пробоподготовкой с использованием экстракции РНК или изотермической предварительной амплификации. Наш анализ требует минимальной лабораторной инфраструктуры и может быть адаптирован к другим вирусам, что продемонстрировано быстрым развитием нанопереключателей ДНК для обнаружения РНК SARS-CoV-2 в слюне. Дальнейшая разработка и внедрение на местах улучшат нашу способность обнаруживать возникающие вирусные угрозы и, в конечном итоге, ограничить их влияние.
ВВЕДЕНИЕ
Новые или возрождающиеся вирусы создают серьезные проблемы для систем здравоохранения, особенно в связи с тем, что глобализация способствовала безудержному распространению этих вирусов ( 1 ).РНК-вирусы часто являются причиной массовых вспышек, поскольку эти вирусы имеют высокую частоту мутаций и, таким образом, быстро развиваются ( 2 , 3 ). Примеры этого включают ежегодную вспышку гриппа, вирус Эбола, вирус Зика (ZIKV) и вирус SARS-CoV-2, ответственный за пандемию коронавирусного заболевания 2019 года (COVID-19). Технологические достижения в структурной биологии и геномике были важны для идентификации вирусов и для продвижения фундаментальных вирусных исследований и противовирусной терапии ( 4 ).Однако клинические методы надежного, недорогого и быстрого обнаружения вирусных инфекций остаются серьезной проблемой для новых вирусов, особенно в районах с ограниченными ресурсами.
Обнаружение РНК-вирусов в клинических условиях обычно выполняется с использованием иммунологического обнаружения на основе твердофазного иммуноферментного анализа (ELISA) для выявления антител к иммуноглобулину M (IgM) или тестирования нуклеиновых кислот (NAT) на основе полимеразной цепной реакции с обратной транскрипцией. (RT-PCR) анализ для обнаружения вирусной РНК ( 5 — 8 ).Диагностика РНК-вирусов затруднена из-за нескольких факторов, включая ограниченное время для обнаружения, низкую или изменяющуюся вирусную нагрузку, перекрестно-реактивные антитела IgM и лабораторные ресурсы. Временные окна обнаружения могут широко варьироваться от нескольких дней до нескольких месяцев ( 5 ), а методы молекулярного обнаружения обычно наиболее надежны, если они выполняются в течение первых 2 недель заболевания ( 9 , ). 10 ). В зависимости от времени тестирования относительно инфекции, даже высокочувствительные анализы NAT могут по-прежнему давать ложноотрицательные или ложноположительные результаты ( 6 ).С другой стороны, результаты серологических тестов на IgM часто не позволяют различить родственные вирусы или разные штаммы одного и того же вируса из-за перекрестной реактивности антител IgM, что приводит к ложноположительным результатам ( 11 , 12 ). Эти проблемы обнаружения еще больше усугубляются, когда вспышки происходят в условиях ограниченных ресурсов, где может отсутствовать инфраструктура для этих интенсивных лабораторных тестов, что ускоряет распространение болезни ( 7 , 13 ).
В ответ на некоторые из этих проблем разрабатываются новые методы обнаружения новых вирусов.Среди них методы, использующие наночастицы ( 14 ), биосенсоры на основе графена ( 15 ) и методы на основе CRISPR ( 16 , 17 ), и это лишь некоторые из них. Многие из этих предложенных стратегий, хотя и основаны на передовых технологиях, требуют множественных реакций или этапов преобразования сигналов. Здесь мы решили эти проблемы биочувствительности, разработав анализ, в котором используются программируемые нанопереключатели ДНК ( 18 ) для обнаружения вирусной РНК на клинически значимых уровнях.Мы проверяем нашу стратегию обнаружения вирусной РНК, используя ZIKV в качестве модельного вируса. Зика имеет большое значение для глобального здравоохранения и представляет постоянную угрозу из-за того, что он снова переносится комарами. Хотя инфекции ZIKV обычно связаны с легкими симптомами, они связаны с серьезными врожденными дефектами, связанными с внутриутробными инфекциями, развитием синдрома Гийана-Барре у взрослых и возможностью передачи половым путем ( 7 , 10 ). Более того, несмотря на существенный прогресс в понимании молекулярной биологии ZIKV, все еще существует недостаток противовирусных препаратов и вакцин, что делает надежное обнаружение ZIKV жизненно важным для контроля распространения заболевания и проведения раннего лечения ( 19 ).
Наша стратегия обнаружения присутствия вирусной РНК основана на использовании нанопереключателей ДНК, которые были разработаны, чтобы претерпевать конформационные изменения (с линейных на петлевые) при связывании вирусной РНК-мишени (рис. 1А). На присутствие вирусной РНК может указывать смещенная миграция петлевого нанопереключателя с помощью гель-электрофореза. Система разработана для использования обычного окрашивания нуклеиновой кислотой самого нанопереключателя, который может интеркалировать тысячи молекул красителя, обеспечивая по своей природе сильный сигнал.Ранее мы продемонстрировали чувствительное и специфическое обнаружение олигонуклеотидов ДНК ( 20 ) и микроРНК (длиной ~ 22 нуклеотида) ( 21 ) с использованием этого подхода. Применительно к обнаружению вирусной РНК мы решаем многие задачи по обнаружению длинной вирусной РНК (> 10 000 нуклеотидов) в клинически значимых образцах. Мы разрабатываем стратегию фрагментации РНК, новую стратегию умножения сигналов, индивидуальный алгоритм для выбора целевых последовательностей и новые рабочие процессы для измерения вирусной нагрузки в биологических и имитационных клинических образцах с предварительной амплификацией РНК или без нее.Используя этот подход, мы показываем, как мультиплексирование может использоваться для обнаружения нескольких вирусов одновременно из одного образца, и демонстрируем высокую специфичность даже между близкородственными штаммами вируса Зика. В ответ на пандемию COVID-19 мы быстро разработали и проверили ДНК-нанопереключатели (рис. 1B) для обнаружения РНК SARS-CoV-2, содержащейся в слюне человека. Наш подход по своей сути неферментативен, но при желании может быть объединен с этапом изотермической амплификации, что позволяет использовать его в областях с низким уровнем ресурсов (рис.1С). Эта работа позволяет прямое обнаружение вирусной РНК без амплификации и открывает путь к недорогому анализу для обнаружения РНК-вирусов.
Рис. 1. Стратегия нанопереключателя ДНК для зондирования вирусной РНК.( A ) Схема нанопереключателя ДНК и обнаружение последовательности вирусной РНК. nt, нуклеотид. ( B ) Быстрый цикл разработки нанопереключателей для РНК-вирусов. ( C ) Анализ на основе нанопереключателя позволяет прямое обнаружение с использованием неферментативного подхода (вверху) и может необязательно сочетаться с этапом изотермической амплификации, таким как NASBA (амплификация на основе последовательностей нуклеиновых кислот) (внизу).
РЕЗУЛЬТАТЫ
В качестве первого доказательства концепции обнаружения ZIKV мы разработали нанопереключатели ДНК для нацеливания на уже проверенную последовательность в геноме ZIKV, которая использовалась для связывания праймеров в количественной ПЦР (qPCR) ( 22 ) (все олигонуклеотиды). последовательности указаны в таблицах с S1 по S10). Мы сделали нанопереключатели ДНК путем гибридизации олигонуклеотидов одноцепочечной ДНК (оцДНК) с линеаризованной одноцепочечной геномной ДНК M13mp18 (M13) в рампе термического отжига в течение 1 часа ( 18 ) и очистили их с помощью высокоэффективной жидкостной хроматографии (LC ) ( 23 ).Для нашей начальной цели обнаружения мы in vitro транскрибировали РНК из инфекционной плазмиды pFLZIKV, содержащей полноразмерный геном камбоджийского изолята ZIKV (FSS13025) (рис. S1) ( 24 ). Предыдущие результаты показали надежное обнаружение нанопереключателем небольших последовательностей ДНК и РНК (20-30 нуклеотидов), но ожидается, что длинная вирусная РНК будет иметь сильные вторичные структуры, которые могут помешать нашему обнаружению ( 25 ). Чтобы преодолеть это, мы использовали метод химической фрагментации, чтобы сегментировать РНК на небольшие части, которые в большинстве своем короче 200 нуклеотидов (рис.2, А и В, и рис. S2). Путем инкубации с нашим нанопереключателем при повышении температуры отжига мы показали успешное обнаружение фрагментированных вирусных РНК с помощью гель-электрофореза, что подтвердило наш подход (рис. 2С).
Рис. 2 Обнаружение вирусной РНК с помощью нанопереключателей ДНК.( A ) Схема фрагментации вирусной РНК и последующего обнаружения нанопереключателем ДНК. ( B ) Фрагментационный анализ РНК ZIKV, которая была фрагментирована при 94 ° C в течение 1, 3, 6 и 9 минут.( C ) Подтверждение концепции, показывающее обнаружение целевой области, выбранной из литературы ( 22 ) (0,8% агарозный гель в 0,5 × трисборатном буфере EDTA). ( D ) Схема конструкции нескольких нанопереключателей для обнаружения со стратегией умножения сигнала. T1 – Tn — это конкретные цели в целевом пуле размером «n», которые реагируют на нанопереключатели с NS1 по NSn. ( E ) Проверка стратегии умножения сигнала: сигнал обнаружения был увеличен для фиксированного пула ДНК-мишеней при использовании нескольких нацеленных нанопереключателей.( F ) Чувствительность обнаружения объединенных нанопереключателей для РНК ZIKV в 10 мкл реакции. Планки погрешностей представляют собой стандартное отклонение от трех экспериментов.
Продемонстрировав успешное обнаружение РНК ZIKV с использованием одной целевой последовательности, мы поняли, что можем использовать большой размер генома (~ 11000 нуклеотидов) для увеличения нашего сигнала обнаружения через несколько мишеней. После фрагментации длинной вирусной РНК количество доступных целевых последовательностей заметно увеличивается. Поскольку наш сигнал обнаружения пропорционален количеству петлевых нанопереключателей, ожидается, что смесь нанопереключателей для различных целевых последовательностей в вирусном геноме обеспечит усиленный сигнал.Чтобы проверить это, мы разработали алгоритм выбора нескольких участков последовательности в вирусном геноме, на которые могут нацеливаться нанопереключатели (примечание S1). Во-первых, мы выбрали длину мишени по умолчанию, равную 30 нуклеотидам, на основе результатов скрининга нанопереключателей с различной длиной плеча обнаружения (рис. S3). Затем алгоритм выборочно исключил целевые последовательности, которые могли образовывать стабильные вторичные структуры (рис. S4) и перекрестное связывание с олигонуклеотидами основной цепи нанопереключателя (рис. S5), а также обеспечил содержание GC и уникальность последовательностей.На основе этих критериев мы выбрали 18 целевых областей вдоль всей РНК ZIKV для тестирования и разработали нанопереключатели. Чтобы облегчить использование нашего программного обеспечения на основе MATLAB, мы создали графический интерфейс пользователя (рис. S6) и сделали его бесплатным (файл данных S1).
Затем мы проверили качество и работу каждого нанопереключателя на панели из 18 нанопереключателей. Все нанопереключатели хорошо работали при молярном избытке положительных контролей ДНК (20: 1 от контроля ДНК к нанопереключателю), хотя они показали большее изменение сигнала с фрагментированной РНК ZIKV (рис.S7). Мы ранжировали нанопереключатели от самого сильного до самого слабого сигнала и составили серию эквимолярных смесей нанопереключателей. Используя эти смеси, мы подтвердили нашу собственную стратегию умножения сигналов, используя пул эквимолярных фрагментов ДНК с низкой концентрацией для имитации фрагментированной РНК. Мы заметили, что наш сигнал обнаружения постоянно увеличивался примерно до 12 различных нанопереключателей (рис. 2, D и E), а затем выходил на плато выше этого значения. Это плато не было неожиданностью, учитывая, что самые большие смеси добавляли менее эффективные нанопереключатели, которые могут вносить меньший вклад в общий образец.Поскольку между 12 и 18 не было заметных изменений в производительности, мы продолжили использовать смесь 18 нанопереключателей для наших последующих экспериментов.
Высокая чувствительность — одно из ключевых требований для обнаружения вирусов. Клинические уровни РНК ZIKV в биологических жидкостях инфицированных пациентов часто находятся в фемтомолярном диапазоне ( 7 , 17 , 26 ), что делает амплификацию необходимым условием для большинства подходов к обнаружению. На основании нашего более раннего наблюдения, что ДНК-нанопереключатели могут обнаруживать микроРНК (~ 22 нуклеотида) в субпикомолярной (суб-пМ) шкале ( 21 ) без амплификации, мы хотели оценить чувствительность нашего подхода к обнаружению РНК ZIKV.Мы прореагировали на смесь нанопереключателей ДНК с различным количеством фрагментированной РНК при 12-часовом изменении температуры отжига от 40 ° до 25 ° C. Результаты показали видимое обнаружение РНК ZIKV всего на уровне 12,5 пг (~ 3,5 амоль или ~ 2,1 × 10 6 копий) в реакционном объеме 10 мкл (фиг. 2F и фиг. S8). В соответствии с рис. 2Е, подход, основанный на использовании смеси нанопереключателей, превзошел самые эффективные нанопереключатели, используемые в качестве единственного агента, который имел видимое обнаружение до примерно 50 пг (~ 14 амоль) (рис.S9).
Еще одним ключевым требованием к клиническому анализу обнаружения вирусов является специфичность. Поскольку ZIKV и вирус денге (DENV) имеют частично совпадающее географическое распространение и клинические симптомы, инфицирование любым вирусом может привести к неправильному клиническому диагнозу ( 27 ). Известно, что серологические диагностические тесты показывают перекрестную реактивность антител между двумя вирусами, и DENV имеет некоторое сходство с ZIKV в своем белке оболочки ( 11 ) и последовательности генома ( 17 , 25 ).Чтобы проверить специфичность нашего подхода, мы разработали аналогичную панель нанопереключателей для обнаружения DENV (рис. S10). Используя объединенные нанопереключатели, специфичные для ZIKV и DENV, мы смешали каждый набор с РНК, транскрибированной in vitro от каждого вируса, и обнаружили идеальную специфичность, при этом каждый анализ выявлял только свою правильную РНК-мишень (рис. 3A). Используя возможность программирования нанопереключателя, мы дополнительно продемонстрировали мультиплексную систему для одновременного обнаружения ZIKV и DENV. В данном случае мы модифицировали чувствительные нанопереключатели DENV, чтобы сформировать петлю меньшего размера (рис.S11), в результате чего две отдельные полосы обнаружения перемещаются в разные положения в геле. В частности, комплекс ZIKV РНК – нанопереключатель мигрировал медленнее / выше в геле, в то время как комплекс РНК DENV и нанопереключатель мигрировал быстрее / ниже в геле (рис. 3B). Таким образом, за одну реакцию наш нанопереключатель показал дифференциальное и специфическое обнаружение РНК ZIKV и DENV. Программируя петли разных размеров для разных мишеней, этот анализ можно расширить до пяти вирусных мишеней ( 21 ).
Рис. 3 Нанопереключатели ДНК специфически и по-разному обнаруживают РНК от двух разных флавивирусов и между двумя очень похожими изолятами ZIKV. Нанопереключатели ZIKV( A ) специфически обнаруживают РНК ZIKV, но не РНК DENV, и наоборот. ( B ) Мультиплексное обнаружение РНК ZIKV и DENV. ( C ) Иллюстрация, показывающая культуру и экстракцию РНК штаммов ZIKV Камбоджа и Уганда. Показаны несоответствия в репрезентативной целевой последовательности между двумя штаммами.( D ) Тест на специфичность штаммов РНК ZIKV в Камбодже и Уганде. * обозначает полосу загрязняющей клеточной ДНК после выделения РНК.
Помимо возможного ошибочного диагноза между различными вирусами, существует дополнительная проблема при определении конкретного штамма вируса. Например, в Латинской Америке известно, что четыре разных серотипа DENV присутствуют и совместно циркулируют, где неправильный диагноз инфекционного штамма может иметь существенные последствия для вариантов лечения ( 28 ).Таким образом, возможность точно идентифицировать циркулирующий штамм вируса широко влияет на медицинское обслуживание, эпиднадзор и борьбу с переносчиками ( 29 ). ZIKV был впервые идентифицирован в Уганде в 1947 году, а затем распространился в Азии и Америке, а штаммы ZIKV (относящиеся к африканским или азиатским линиям) обладают значительной гомологией последовательностей ( 30 ). Чтобы выяснить, может ли наш анализ различать азиатские и африканские клоны, мы протестировали наши нанопереключатели против двух штаммов ZIKV, которые имеют ~ 89% гомологии последовательностей, а именно, FSS13025, выделенного из Камбоджи, и штамма MR766, изолированного из Уганды.При разработке штамм-специфичных нанопереключателей ZIKV мы идентифицировали пять целевых областей, каждая из которых имеет разницу от пяти до шести нуклеотидов (рис. 3C и рис. S12). Чтобы добиться лучшего распознавания сигнала обнаружения, нанопереключатели для штамма Уганда были спроектированы так, чтобы образовывать петли меньшего размера, чем те, которые были разработаны для Камбоджи. Затем клеточную линию гепатоцеллюлярной карциномы человека (Huh7) инфицировали либо камбоджийским, либо угандийским штаммом ZIKV. Инфицированные клетки обрабатывали для извлечения общей РНК, которая затем фрагментировалась и инкубировалась с нанопереключателями для проверки вирусной РНК из клеток, инфицированных ZIKV Cambodia или ZIKV Uganda.Результаты показали, что наш анализ позволил различить два штамма одного и того же вируса даже с высоким генетическим сходством (рис. 3D и рис. S12).
Далее применяя нашу технику для обнаружения РНК ZIKV в биологических образцах, мы либо имитировали инфицированные, либо инфицированные клетки Huh7 штаммом ZIKV Камбоджи при множественности заражения 1 и экстрагировали РНК из инфицированных ZIKV клеток через 1, 2 и 3 дня. после заражения ( 31 ). Анализ с помощью нанопереключателя обнаруживал вирусную РНК ZIKV из инфицированных клеток, но не из имитирующих инфицированных клеток (рис.4, А и В, и рис. S13). Результат нашего обнаружения показал, что количество копий РНК ZIKV в инфицированных клетках неуклонно увеличивалось после заражения и выходило на плато через 2 и 3 дня после заражения (рис. 4C). Эти данные демонстрируют, что наш анализ может обнаруживать РНК ZIKV в инфицированных клеточных линиях и в отличие от типичных анализов ОТ-ПЦР без амплификации вирусной РНК.
Рис. 4 Нанопереключатели ДНК непосредственно обнаруживают РНК ZIKV, экстрагированную из инфицированных клеток печени человека. РНК( A ), выделенная из ложно инфицированных клеток Huh7 через 1, 2 и 3 дня после заражения, не обнаруживает ZIKV.( B ) РНК, выделенная из инфицированных вирусом Зика клеток Huh7 через 1, 2 и 3 дня после заражения, показывает возрастающее обнаружение РНК ZIKV с течением времени, при этом красные стрелки обозначают полосы обнаружения. * обозначает полосу загрязняющей клеточной ДНК после экстракции РНК. ( C ) Количественная оценка сигнала обнаружения нанопереключателя с полосами ошибок, представляющими стандартное отклонение от трех экспериментов.
Двигаясь к клиническому применению, мы стремились продемонстрировать обнаружение соответствующих уровней РНК ZIKV в биологических жидкостях.ZIKV присутствует в сыворотке, моче и других биологических жидкостях инфицированных пациентов ( 32 ). Вирусные нагрузки могут заметно варьироваться в зависимости от человека, жидкости организма и времени после инфицирования ( 6 , 7 ), но часто находятся в субфемтомолярном (суб-фМ) и фемтомолярном диапазоне, при этом ZIKV в моче человека достигает 220 × 10 6 копий на миллилитр (365 фМ) ( 26 ). В то время как чувствительность нашего нанопереключателя к транскрибированной in vitro вирусной РНК в буфере приближается к клинически значимым концентрациям, обнаружение в биологических жидкостях дополнительно затрудняется из-за варьирования вирусной нагрузки и биологических жидкостей, которые могут снизить производительность нанопереключателей из-за физиологических условий и активности нуклеаз ( 20 , 33 ).Чтобы преодолеть эти потенциальные трудности, мы исследовали два независимых решения: (i) добавление стадии предварительной обработки для извлечения РНК из жидкостей организма, таких как моча, или (ii) добавление стадии изотермической предварительной амплификации. В первом подходе мы добавили клинически значимое количество in vitro транскрибированной РНК ZIKV в мочу человека и обработали экстракцию вирусной РНК с использованием коммерческого набора для экстракции РНК. Ингибиторы рибонуклеазы (РНКазы) были включены для минимизации деградации РНК в моче. Затем мы смешали экстрагированную РНК с нанопереключателями и продемонстрировали неферментативное обнаружение РНК на клиническом уровне на 1.7 × 10 5 копий / мкл (0,28 пМ) (фиг. 5A и фиг. S14). Во втором подходе мы продемонстрировали, что наше обнаружение может быть связано с другими подходами амплификации, такими как амплификация на основе последовательностей нуклеиновых кислот (NASBA) ( 34 ). NASBA объединяет несколько ферментов и праймеров для достижения амплификации РНК в изотермической реакции в одном сосуде (рис. S15A). Во-первых, мы показали возможность амплификации РНК ZIKV с помощью NASBA в воде с последующим обнаружением нанопереключателя (рис. S15). Чтобы имитировать клинические образцы, мы добавили инфекционные частицы ZIKV либо в фосфатно-солевой буфер (PBS), либо в 10% мочу человека на клинических уровнях (от 897 до 20 БОЕ / мкл).Из этих образцов наш анализ обнаружил РНК ZIKV через ~ 5 часов (рис. 5B и рис. S15). Мы пошли еще дальше и показали, что наш анализ может быть выполнен с использованием имеющегося в продаже безбуферного гелевого картриджа (Thermo Fisher Scientific E-Gel) и отображен на небольшом и потенциально портативном гелевом ридере (рис. S16). С помощью амплификации NASBA обнаруживающая способность нашего метода увеличилась примерно в 1000 раз, от суб-пМ (~ 10 5 копий / мкл) (рис. 5A) до суб-фМ (~ 10 2 копий). / мкл) (рис.S15), а время обнаружения уменьшено с ~ 13 до ~ 5 часов.
Рис. 5 Предварительная экстракция или предварительная амплификация целевой РНК облегчает обнаружение РНК ZIKV и SARS-CoV-2 на клинически значимых уровнях в биожидкостях.( A ) Положительная идентификация РНК ZIKV в моче с добавками путем выделения сначала транскрибированной РНК-мишени in vitro с использованием коммерчески доступного набора для выделения вирусной РНК с последующим прямым неферментативным обнаружением с помощью нанопереключателей ДНК. ( B ) Положительная идентификация РНК ZIKV из вирусных частиц, внесенных в мочу, на основе NASBA.( C ) Положительное обнаружение транскрибированной in vitro РНК SARS-CoV-2 в слюне человека на основе NASBA. Планки погрешностей представляют собой стандартное отклонение от трех экспериментов.
В связи с надвигающейся вспышкой SARS-CoV-2 в январе 2020 года мы воспользовались возможностью разработать и протестировать наши нанопереключатели ДНК против нового вируса. Следуя стратегии, аналогичной ZIKV, мы идентифицировали целевую область, разработали нанопереключатели и использовали стратегию NASBA для обнаружения РНК SARS-CoV-2 в 10% человеческой слюне. Следуя нашему протоколу ZIKV, мы подтвердили обнаружение нанопереключателем транскрипта короткого сегмента РНК SARS-CoV-2 in vitro за ~ 5 часов и перекрестно проверили с помощью ОТ-ПЦР (рис.S17). Дальнейшая оптимизация времени протокола, мы достигли обнаружения РНК SARS-CoV-2 — положительного контроля при концентрации всего 200 копий / мкл [около клинической медианы; ( 35 — 37 )] примерно за 2 часа (1-часовой NASBA, 40-минутная инкубация с нанопереключателем, 25-минутный гель) (фиг. 5C и фиг. S18).
Вместе мы демонстрируем, что программируемые нанопереключатели ДНК можно превратить в надежную платформу обнаружения вирусной РНК, которая легко адаптируется, как мы показали при обнаружении SARS-CoV-2.Платформа имеет ключевые преимущества по сравнению с существующими методологиями с точки зрения селективности и специфичности, как показали наши эксперименты с ZIKV и близкородственным DENV, а также с двумя тесно связанными штаммами ZIKV. Кроме того, стратегия обнаружения вирусной РНК с помощью нанопереключателя ДНК имеет фемтомолярный предел обнаружения без этапа амплификации РНК и предел обнаружения аттомолярного при использовании с амплификацией. Эти пределы находятся в клинически значимом диапазоне, и поэтому наш анализ ДНК-нанопереключателя вместе с безбуферным гелевым картриджем представляет собой предполагаемый диагностический тест для клинического обнаружения РНК-вирусов в областях с ограниченными ресурсами без существенной лабораторной инфраструктуры.
ОБСУЖДЕНИЕ
Функциональность наших ДНК-нанопереключателей в значительной степени обеспечивается ДНК-нанотехнологией, которая стала широко известной областью применения ДНК в качестве функционального материала для создания наноструктур ( 38 ). Биосенсинг является особенно многообещающим применением ДНК-нанотехнологии ( 39 ), и были продемонстрированы реконфигурируемые устройства ДНК ( 40 ) для обнаружения ДНК ( 40 ), РНК ( 41 ), белков ( 42 ). ) и pH ( 43 ).Однако большинство конструкций сложны и требуют трудоемкого считывания показаний с помощью современной микроскопии, что снижает их практичность. Несколько подходов преодолели это практическое препятствие, чтобы обеспечить широко полезные решения проблем в биологической визуализации [например, накопление точек ДНК для визуализации в наноразмерной топографии (DNA-PAINT) в микроскопии сверхвысокого разрешения ( 44 ) и каркасы ДНК для ЯМР ( 45 ) и криогенная электронная микроскопия (крио-ЭМ) ( 46 )] и биосенсор [e.g., обнаружение лизосомных нарушений ( 47 ) и картирование клеточных путей эндоцитоза ( 48 )]. Наши нанопереключатели ДНК используют редукционистский подход, в результате чего анализы являются надежными и чувствительными, но простыми в адаптации и не требуют многоэтапного или дорогостоящего оборудования. С помощью этой работы мы добавляем обнаружение вирусов к существующему набору анализов нанопереключателей ДНК, который уже включает обнаружение белков ( 33 ) и микроРНК ( 21 ).
Наш простой анализ на основе нанопереключателей ДНК для обнаружения вирусной РНК преодолевает некоторые ограничения доступных в настоящее время методов клинического обнаружения РНК-вирусов в областях с ограниченными ресурсами.К ним относятся (i) надежное обнаружение без ферментов или оборудования, (ii) сохранение низкой стоимости и простоты и (iii) обеспечение специфичности и универсальности. Неожиданно нынешняя пандемия COVID-19 показала нам, что эти проблемы могут затронуть и богатые страны, и многие из них изо всех сил пытаются опередить вирусное распространение благодаря тестированию.
Исключительно высокий сигнал наших нанопереключателей здесь усилен новой стратегией «размножения мишеней», в которой мы используем фрагментацию вирусной РНК, чтобы увеличить количество мишеней и, таким образом, увеличить интенсивность сигнала.Используя этот подход, мы достигли почти клинических уровней обнаружения в моче без использования ферментно-опосредованных стратегий амплификации. Это достижение важно, потому что ферменты могут быть ключевыми факторами стоимости и сложности анализа из-за требований, включая хранение / транспортировку в холодильнике, специальные буферы и реагенты, а также строгие рабочие температуры. Эти факторы затрудняют использование ферментативных анализов в полевых условиях или в районах с ограниченными ресурсами без современной лабораторной инфраструктуры. Несмотря на эти проблемы, большинство доступных в настоящее время методов основаны на инициируемой ферментом амплификации ( 7 , 17 , 49 ).Для нашего анализа мы продемонстрировали совместимость и заметное улучшение сигнала с необязательной стадией ферментативной предварительной амплификации (рис. 5, B и C). Однако мы считаем, что дальнейшие улучшения должны позволить полностью охватить клинический диапазон без использования ферментов. 30-миллилитровый образец мочи от инфицированного ZIKV пациента будет содержать от 10 5 до 10 9 копий вирусной РНК ( 50 ), что теоретически превышает наш текущий предел обнаружения. Эффективная пробоподготовка с использованием набора для выделения вирусной РНК (рис.5A), например, может облегчить использование с нашим анализом нанопереключателя ДНК.
Две ключевые особенности нашего подхода — простота и низкая стоимость. Наши нанопереключатели ДНК соответствуют целям движения «бережливой науки», где стоимость и доступность новых технологий оцениваются наряду с типичными показателями производительности ( 51 , 52 ). Наши нанопереключатели стоят около 1 пенни за реакцию и могут храниться в сухом виде при комнатной температуре не менее месяца и могут быть доставлены по всему миру без проблем с транспортировкой или биобезопасностью.Анализ состоит из нескольких этапов и может быть выполнен в течение нескольких часов при ограниченных лабораторных потребностях (рис. S19). В нашем анализе используется считывание результатов с помощью гель-электрофореза, что относительно недорого и уже является частью рабочего процесса во многих лабораториях, что сравнительно проще, чем многие анализы на основе нанотехнологий, включающие несколько этапов инкубации и промывки. Улучшение считывания сигналов потенциально может помочь сделать этот подход еще более независимым от лаборатории. Успешное обнаружение с помощью имеющейся в продаже безбуферной гелевой системы (рис.S16) приближает нас к тому, чтобы сделать возможным использование нашего анализа в полевых условиях, а приготовлению образцов могут помочь другие подходы в области бережливой науки, такие как использование «paperfuge» ( 53 ) и недорогого термоциклера ( 54 ) . Если в NASBA используется очищенная вирусная РНК, то полное обнаружение может быть сокращено до 2 часов с 30-минутным этапом NASBA ( 17 ) и 1-часовым анализом обнаружения нанопереключателя ( 21 ).
Программируемость нашей системы делает ее универсальной для широкого спектра вирусов, включая ZIKV, DENV и SARS-CoV-2, как мы показали.Эти вирусы могут быть обнаружены с высокой специфичностью, как мы показали для ZIKV и DENV (рис. 3, A и B), а также для различных штаммов ZIKV (рис. 3, C и D), даже в мультиплексном режиме. Мы сосредоточились здесь на одноцепочечных РНК-вирусах, но анализы для других РНК или ДНК-вирусов, вероятно, могут быть разработаны аналогичным образом. Быстрые процессы конструирования и очистки могут способствовать быстрому производству ДНК-нанопереключателей для обнаружения появляющейся вирусной угрозы, потенциально всего за 1-2 дня с момента получения информации о целевых последовательностях, что ограничивается в основном временем цикла синтеза олигонуклеотидов (рис.1Б). Из-за низкой стоимости теста наш анализ также может быть полезен для мониторинга вирусного прогрессирования с течением времени у пациентов или для тестирования потенциально инфицированных насекомых или животных. Следовательно, с будущей оптимизацией для клинических приложений в местах оказания медицинской помощи в условиях ограниченных ресурсов платформа, которую мы описываем здесь, может повысить точность и простоту диагностики у людей, переносчиков инфекции и других животных. В конечном итоге эта система может повысить нашу способность контролировать распространение инфекции и более быстро реагировать на возникающие вирусные угрозы, включая пандемию COVID-19, а также работать в направлении сокращения числа погибших и экономического бремени от этих болезней.
МАТЕРИАЛЫ И МЕТОДЫ
Конструирование и очистка нанопереключателей
Олигонуклеотиды были приобретены у Integrated DNA Technologies (IDT) со стандартным обессоливанием, а полные последовательности всех цепей перечислены в дополнительных материалах (таблицы от S1 до S10). Нанопереключатели были сконструированы, как описано ранее ( 18 , 21 ). Геномную оцДНК (New England Biolabs, M13mp18) линеаризовали с использованием целевого расщепления рестрикционным ферментом Bts CI.Затем линеаризованную оцДНК смешивали с молярным избытком смеси олигонуклеотидов, содержащей олигонуклеотиды основной цепи и детекторы, и отжигали от 90 ° до 20 ° C при 1 ° C мин. -1 в термоциклере T100 (Bio-Rad, США). После конструирования нанопереключатели очищали с использованием очистки ЖХ ( 23 ) для удаления избыточных олигонуклеотидов. Концентрация очищенных нанопереключателей определялась путем измерения абсорбции A260 с помощью Thermo Fisher Scientific NanoDrop 2000.
Транскрипция вирусной РНК in vitro
Плазмиды, содержащие полноразмерный ZIKV (штамм Cambodia FSS13025; pFLZIKV) и DENV-2 (штамм 16681). , pD2 / IC-30P) кДНК были подарены P.-Y. Ши (Медицинский филиал Техасского университета) и К. Хуанг (Центры по контролю заболеваний) соответственно ( 24 , 55 ). pFLZIKV линеаризовали с помощью Cla I (New England Biolabs, NEB), а pD2 / IC-30P линеаризовали с помощью Xba I (NEB). Расщепленные плазмиды экстрагировали смесью фенол: хлороформ: изоамиловый спирт и затем осаждали. Линеаризованные плазмиды транскрибировали in vitro (Thermo Fisher Scientific), и полученную вирусную РНК очищали с помощью набора MEGAclear Transcription Clean-Up Kit (Thermo Fisher Scientific).Мы следовали протоколам этих двух наборов, за исключением того, что мы не нагревали колонку для очистки на этапе элюирования вирусной РНК, потому что мы заметили, что высокая температура может привести к деградации вирусной РНК.
Тест на фрагментацию вирусной РНК
Вирусную РНК фрагментировали с использованием 10-кратного буфера для фрагментации (NEB) и рекомендованного протокола. Вкратце, РНК ZIKV, полученная в результате транскрипции in vitro (IVT), смешивали с буфером для фрагментации (1 × конечный), а затем инкубировали при 94 ° C в термоциклере в течение 1, 3, 6 или 9 мин.Анализатор фрагментации РНК (Agilent, модель 5003) использовали для количественной оценки распределения длин фрагментов РНК с помощью набора DNF-471 Standard Sensitivity RNA Analysis Kit (рис. 2B). 10 мМ заменимые аминокислоты (NEAA; Life Technologies) и 5 мМ l-глутамин (Life Technologies).Клетки пассировали один раз каждые 3 дня и поддерживали при 37 ° C с 5% CO 2 . За двадцать четыре часа до заражения клетки Huh7 высевали в планшеты для тканевых культур. На следующий день подсчитали одну тарелку. Два других планшета использовали для фиктивной инфекции и инфекции ZIKV, где клетки были инфицированы с множественностью инфицирования 1. Исходные образцы ZIKV для Камбоджи и Уганды (MR766) были подарком Б. Линденбаха (Йельская школа медицины). Для выделения РНК из ложных и ZIKV-инфицированных клеток среду из клеток аспирировали, а затем монослой клеток промывали один раз ледяным PBS.После этого клетки в каждом планшете для тканевых культур лизировали в 1 мл TRIzol (Invitrogen), и общую РНК экстрагировали в соответствии с инструкциями производителя.
Для экспериментов с использованием инфекционных частиц ZIKV в PBS / моче (фиг. 5B) клетки Huh7 инфицировали, как описано выше. Через 24 часа после инфицирования среды для культивирования клеток из инфицированных ZIKV клеток, которые содержали вновь собранные и высвободившиеся вирионы, собирали и концентрировали с использованием центрифужных фильтров Amicon Ultra 15. Затем концентрированный вирус хранили при -80 ° C.Анализы налета, как описано ранее ( 31 ), использовали для определения количества инфекционных частиц.
Обнаружение нанопереключателя ДНК
Общий объем образца для обнаружения составлял 10 мкл с 10 мМ MgCl 2 , 1 × PBS, нанопереключатель при конечной концентрации 100 пМ. Образцы инкубировали в термоциклере с термическим отжигом от 40 ° до 25 ° C при 1 ° C мин. -1 или комнатной температуре (например, детекции, связанные с NASBA). Перед загрузкой в гель образцы окрашивали GelRed (Biotium Inc.) в 1-кратной концентрации (или 3,3-кратной для определения общей РНК) и смешивали с 2 мкл 6-кратного загрузочного красителя (15% фиколла с 6,6% насыщенного раствора бромфенолового синего в воде).
Обнаружение вирусной РНК
Для эксперимента, показанного на фиг. 2С, 5 нг (~ 8,5 × 10 8 копий) РНК ZIKV использовали в 10 мкл анализа обнаружения. Образцы обрабатывали в 25 мл 0,8% агарозных гелей, отлитых из агарозы для молекулярной биологии (Fisher BioReagents), растворенной в 0,5-кратном буфере трис-борат-EDTA (TBE). Для экспериментов на рис.2F и рис. S8, сначала все нанопереключатели были очищены с помощью ЖХ, а затем их концентрации были определены путем измерения поглощения A260 с помощью Thermo Fisher Scientific NanoDrop 2000. Смеси нанопереключателей были приготовлены путем смешивания нанопереключателей в эквимолярных концентрациях. Объем реакции обнаружения составляет 10 мкл с нанопереключателем (конечная концентрация 100 пМ), MgCl 2 (10 мМ), 1 × PBS и блокирующими олигонуклеотидами (200 нМ). Блокирующие олигонуклеотиды представляют собой короткие олигонуклеотиды (14 нуклеотидов), которые могут препятствовать связыванию целевой РНК с внутренней поверхностью пластиковых пробирок ( 21 ).Образцы инкубировали в термоциклере с термическим отжигом от 40 ° до 25 ° C в течение ~ 12 часов (при -0,1 ° C на цикл и 5 минут на каждый цикл, всего 150 циклов).
Обнаружение вирусной РНК из тотальной РНК
Сначала 500 нг полной РНК, экстрагированной из неинфицированных / инфицированных клеток, фрагментировали при 94 ° C в течение 9 минут в 1-кратном буфере для фрагментации. Затем фрагментированную тотальную РНК смешивали с нанопереключателями [100 пМ, MgCl 2 (10 мМ) и PBS (1 ×)], и смесь доводили до 10 мкл водой, свободной от нуклеаз.Затем образцы инкубировали в рампе термического отжига от 40 ° до 25 ° C в течение ~ 12 часов (при -0,1 ° C на цикл и 5 минут на каждый цикл, всего 150 циклов). После инкубации образцы окрашивали GelRed при 3,3-кратной концентрации и инкубировали при комнатной температуре в течение 30 мин. Перед загрузкой геля 2 мкл 6-кратного синего загрузочного красителя смешивали с каждым образцом, и 10 мкл образца загружали в каждую лунку. Образцы обрабатывали в 0,8% агарозном геле при 65-75 В в течение примерно 70-90 минут в холодной комнате.
Обнаружение вирусной РНК, экстрагированной из мочи
Для обнаружения вирусной РНК, экстрагированной из мочи, мы сначала добавили защитный буфер ДНК / РНК (входит в комплект Quick-RNA Viral Kit от ZYMO Research) в мочу, а затем смешали с РНК. с блокирующими олигонуклеотидами (200 нМ) в 200 мкл человеческой мочи (приобретенной у Innovative Research Inc.) для имитации клинического образца и немедленно выполнили экстракцию РНК. Затем мы использовали набор Quick-RNA Viral Kit (Zymo Research) для извлечения вирусной РНК из мочи.После экстракции РНК к раствору добавляли ингибитор РНКазы (конечная концентрация 1 Ед / мкл). Мы протестировали различные количества РНК ZIKV (рис. 5А). Здесь количество человеческой мочи может быть увеличено по мере необходимости в соответствии с протоколом набора. Наконец, вирусную РНК элюировали из фильтровальной колонки с использованием 15 мкл воды, свободной от нуклеаз. Затем 5 мкл экстрагированной РНК фрагментировали при 94 ° C в течение 9 минут с использованием 0,2-кратного буфера для фрагментации (NEB) перед проведением обнаружения нанопереключателя. Здесь мы снизили использование буфера для фрагментации с учетом небольшого количества РНК в извлеченном образце, так как мы заметили, что слишком много буфера фрагментации может разрушить нанопереключатели ДНК.
Изотермическое усиление с помощью NASBA
Во-первых, мы использовали классический протокол NASBA ( 34 ) для подтверждения концепции (рис. S15). Реакция в одном горшке на 25 мкл содержала 3 мкл образца РНК в различных концентрациях, 0,4 мкМ прямой и обратный праймеры, 8 ед. AMV (вирус птичьего миелобластоза), обратная транскриптаза, 50 ед. РНК-полимеразы Т7, 0,1 ед. РНКазы H, 40 ед. РНКазы. Ингибитор (NEB, мышиный), смесь 2 мМ нуклеотидтрифосфата (NTP), смесь 1 мМ rNTP, 12 мМ MgCl 2 , 40 мМ трис-HCl, 42 мМ KCl, 5 мМ дитиотреитол, 15% (об. / Об.) Диметил сульфоксид.Праймеры были выбраны из ( 17 ). Образец инкубировали при 41 ° C в течение 2 часов в термоциклере с последующим нагреванием при 94 ° C в течение 10 минут для дезактивации всех ферментов. Три микролитра образца NASBA использовали в следующем анализе обнаружения нанопереключателя ДНК в пробирках для ПЦР с конечными объемами 10 мкл. После смешивания с нанопереключателем ДНК и реакционным буфером смесь инкубировали при комнатной температуре в течение 2 часов. GelRed (Biotium Inc.) в концентрации 1 × добавляли к образцам для обнаружения перед загрузкой в 0.8% агарозный гель. Гель прогоняли при комнатной температуре в течение 45 минут при 75 В.
Для экспериментов NASBA, связанных с ZIKV, сначала мы добавляли инфекционные частицы ZIKV (начиная с 1180 БОЕ / мкл) в 1 × PBS или 10% человеческую мочу ( приобретены у Innovative Research Inc.) до концентраций 897, 200 и 20 БОЕ / мкл. Затем добавляли блокирующий олиго (200 нМ), и вирусная РНК высвобождалась путем нагревания образцов при 94 ° C в течение 3 минут в объеме 10 мкл. Для образцов мочи человека перед нагреванием также добавляли ингибитор РНКазы (NEB, мышиный) в концентрации 2 Ед / мкл.После охлаждения до комнатной температуры 0,5 мкл ингибитора РНКазы в концентрации 40 Ед / мкл (NEB, мышиный) добавляли к 10 мкл образца мочи человека для защиты вирусной РНК. Общий объем каждой реакции NASBA был уменьшен до 6 мкл, что содержит 1,25 мкл фермента COCKTAIL (NEC-1-24), 2 мкл 3-кратного буфера (NECB-24), 0,48 мкл смеси NTP при 25 мМ, 0,3 мкл dNTP смешивают при 20 мМ, 0,2 мкл двух праймеров смешивают при 10 мкМ, 0,2 мкл ингибитора РНКазы при 40 ед. / Мкл (NEB, мышиный) и 1,57 мкл вирусной РНК. Образец инкубировали при 41 ° C в течение 2 часов в термоциклере с последующим нагреванием при 94 ° C в течение 5 минут для дезактивации всех ферментов.Затем 1 мкл образца NASBA использовали в следующем анализе обнаружения нанопереключателя ДНК в пробирках для ПЦР с конечными объемами 10 мкл. Анализ завершали инкубированием при комнатной температуре в течение 2 часов. После смешивания с GelRed при 1-кратной концентрации и 2 мкл 6-кратного синего загрузочного красителя образцы для обнаружения загружали в 25-мл 0,8% -ный агарозный гель, который прогоняли в 0,5-кратном буфере TBE при 75 В при комнатной температуре в течение 45 мин. .
Обнаружение РНК SARS-CoV-2
Фрагмент гена gBlock сегмента РНК SARS-CoV-2 ( 56 ) был приобретен у IDT (таблица S9).Затем использовали ПЦР-амплификацию (Qiagen, Taq PCR Core Kit) для создания дополнительных копий с промотором Т7, который был добавлен к 5′-концу прямого праймера. Послесловие: матрицу двухцепочечной ДНК очищали с помощью набора для очистки QIAquick PCR Purification Kit (Qiagen). Наконец, РНК SARS-CoV-2 была получена с помощью IVT (NEB, HiScribe T7 High Yield RNA Synthesis Kit) и очищена с помощью набора MEGAclear Transcription Clean-Up Kit (Thermo Fisher Scientific). Обнаружение ОТ-ПЦР выполняли с использованием набора Luna Universal One-Step RT-qPCR от NEB в соответствии с его протоколом.Образец РНК (1,5 мкл) использовали в 20 мкл реакционной смеси.
Для приготовления образца слюны человека объединенную слюну человека (приобретенную у Lee Biosolutions Inc.) нагревали при 94 ° C в течение 3 минут для имитации процесса разрушения вирусного капсида с высвобождением РНК. Затем РНК SARS-CoV-2 добавляли в разбавленную слюну (10%) с блокирующими олигонуклеотидами (~ 200 нМ) и ингибитором РНКазы (2 Ед / мкл). Для обнаружения РНК SARS-CoV-2 на основе NASBA, приобретенных у Twist Biosciences, наборы NASBA, приобретенные у Life Sciences Advanced Technologies Inc.были использованы. Вкратце, 3,3 мкл 3-кратного буфера (NECB-24), 1,7 мкл 6-кратной смеси нуклеотидов, 0,4 мкл двух смешанных праймеров при 10 мкМ, 0,25 мкл ингибитора РНКазы при 40 Ед / мкл (NEB, мышиный) и 2 мкл. Сначала смешивали мкл образца вирусной РНК с различными концентрациями и нагревали при 65 ° C в течение 2 минут, а затем образцы инкубировали при 41 ° C и смешивали 2,5 мкл фермента COCKTAIL (NEC-1-24). Образцы инкубировали при 41 ° C в течение 40 минут в термоциклере с последующим нагреванием при 94 ° C в течение 5 минут для дезактивации всех ферментов.
Затем 1 мкл образца РНК, амплифицированного NASBA, использовали в следующем анализе обнаружения нанопереключателя ДНК в пробирках для ПЦР с 10 мкл конечных объемов. Были разработаны два нанопереключателя, которые использовали для нацеливания амплифицированных частей РНК на два разных участка (рис. S18). Анализ завершали инкубированием при комнатной температуре в течение 40 мин. После смешивания с GelRed при 1-кратной концентрации и 2 мкл 6-кратного синего загрузочного красителя образцы для обнаружения загружали в 25-мл 0,8% -ный агарозный гель, который прогоняли в 0.5 × буфер TBE при 90 В при комнатной температуре в течение 25 мин.
Визуализация и анализ геля
Образцы для обнаружения обрабатывали в 25 мл 0,8% агарозных гелях, если не указано иное, отлитых из агарозы для молекулярной биологии (Fisher BioReagents), растворенной в 0,5 × буфере TBE. Типичные рабочие условия были 75 В в течение 45-70 минут при комнатной температуре или в холодной комнате. Перед загрузкой образцы смешивали с синим загрузочным красителем на основе фиколла. Визуализацию проводили на тепловизоре Bio-Rad Gel Doc XR + с разным временем экспозиции в зависимости от яркости полос обнаружения.Эффективность обнаружения анализировали с использованием прилагаемого программного обеспечения Image Lab (рис. 2E). Профили полос обнаружения были получены в ImageJ ( 57 ), а затем их интегральные интенсивности были получены с использованием функции анализа пиков в Origin (OriginLab Corporation), например данных, представленных на фиг. 2F, 4C и 5 (A и B). Подробную процедуру анализа можно найти в нашей предыдущей публикации ( 21 ). Для экспериментов, связанных с E-Gel, мы использовали агарозную систему Invitrogen E-Gel (Thermo Fisher Scientific) и ее готовый агарозный гель (1.0%, окрашенный SYBR). Десять микролитров образца для обнаружения нанопереключателя загружали в каждую дорожку, и гель запускали при 48 В в течение 1 часа при комнатной температуре. Поскольку система E-Gel не позволяет пользователю контролировать напряжение, мы использовали внешний источник питания, подключенный к отрицательному и положительному электродам готового агарозного геля для подачи 48 В.
Благодарности: Мы благодарим A. Berglund, К. Шотвеллу и Дж. Ричардсону за облегчение использования анализатора фрагментов РНК; Д. Ян, В.П. Вонгу за помощь и предложения по адаптации системы E-gel с нанопереключателями; Г. Фуксу и Б. К. Дею за комментарии и предложения по экспериментам и рукописи. Финансирование: Исследование, описанное в этой публикации, было поддержано NIH в рамках награды R35GM124720, предоставленной K.H., и награды R01GM123050 и R21AI133617, предоставленной C.T.P. Авторы полностью несут ответственность за содержание и не обязательно отражают официальную точку зрения NIH. Вклад авторов: К.Х. задумал и руководил проектом. L.Z., K.H. и C.T.P. разработал эксперименты. L.Z., A.R.C., J.A.P., S.C., O.L., C.C. и K.H. провели эксперименты с нанопереключателем. G.B., P.B. и C.T.P. проводили культивирование клеток и выделение общей РНК из инфицированных клеток. L.Z. разработал инструмент в MATLAB и написал первый черновик рукописи. L.Z., A.R.C., J.A.P., C.T.P. и K.H. Соавтор более поздних проектов рукописи. Конкурирующие интересы: K.H. является автором трех патентов / патентных заявок, связанных с этой работой, поданных президентом и научными сотрудниками Гарвардского колледжа и Корпорации детских медицинских центров (U.Патент S. 98, выдано 13 марта 2018 г .; Заявка на патент США № 20170369935, опубликовано 28 декабря 2017 г .; и заявка на патент США № 201802

 Соответственно, такая мутация приводит к изменению структуры и функции соответствующего белка.
Соответственно, такая мутация приводит к изменению структуры и функции соответствующего белка. В результате, полипептидная цепь соответствующего белка становится короче, что приводит к значительному изменению первичной структуры и функции белка.
В результате, полипептидная цепь соответствующего белка становится короче, что приводит к значительному изменению первичной структуры и функции белка. Что
составляет каждую ступеньку лестницы? Что скрепляет перекладины по бокам?
Что
составляет каждую ступеньку лестницы? Что скрепляет перекладины по бокам? Код ), это показанная нить ДНК.
нить шаблона или нить кодирования?
Код ), это показанная нить ДНК.
нить шаблона или нить кодирования?
 Мутация в гене HGD вызывает состояние.
Мутация в гене HGD вызывает состояние. 
 В эукариотических клетках клеточный цикл имеет два периода: интерфазный, когда клетка растет и дублирует свою ДНК (фазы G1, S и G2), и митоз (фаза M), когда клетка разделяется на две дочерние клетки.
В эукариотических клетках клеточный цикл имеет два периода: интерфазный, когда клетка растет и дублирует свою ДНК (фазы G1, S и G2), и митоз (фаза M), когда клетка разделяется на две дочерние клетки. 
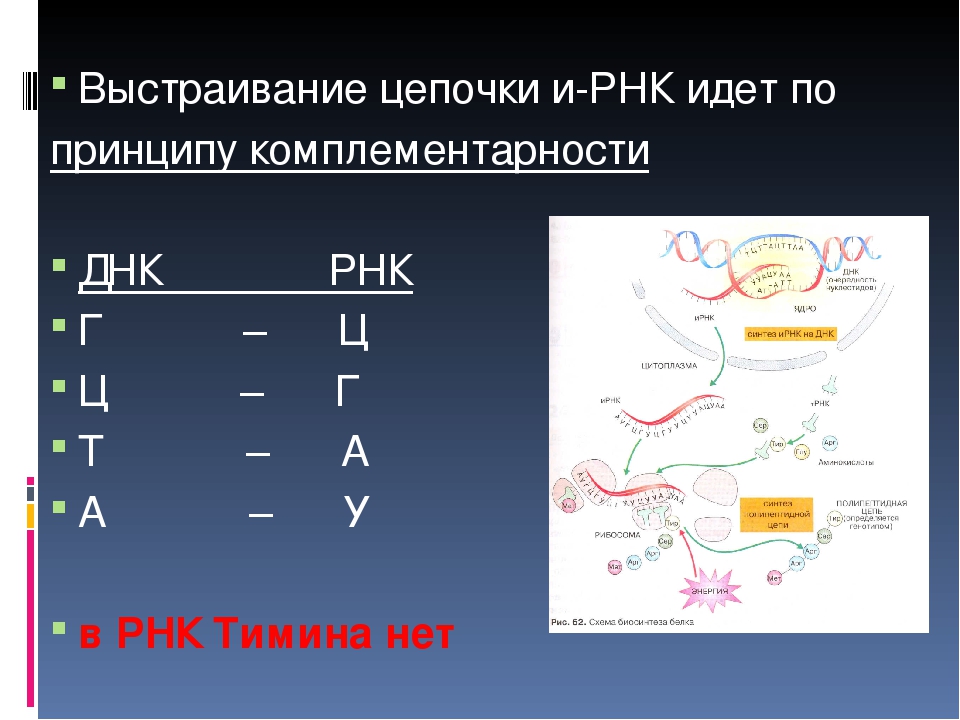

Leave A Comment