Задания для подготовки к егэ. Задания для подготовки к егэ Масса уксусной кислоты которую следует растворить
Задание №1
Определите массу воды, которую надо выпарить из 50 г 3%-ного раствора поваренной соли для получения раствора с массовой долей соли 10%. (Запишите число с точностью до целых.)
Ответ: 35 г
Пояснение:
Вычислим массу поваренной соли в исходном растворе:
m(NaCl) = m(р-ра NaCl) · ω(NaCl) = 50 г · 0,03 = 1,5 г
Масса растворенного вещества рассчитывает по формуле:
ω(в-ва) = m(в-ва)/m(р-ра)
В получившемся после выпаривания воды растворе массовая доля поваренной соли равна 0,1. Обозначим за x массу выпаренной воды, тогда:
0,1 = 1,5/(50 – x), отсюда x = 35
Задание №2
Вычислите массу нитрата калия (в граммах), которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. (Запишите число с точностью до десятых.)
Ответ: 3,4
Пояснение:
Рассчитаем массу нитрата калия в исходном растворе:
m (1) (KNO 3) = m (1) (р-ра)∙ w (1) (KNO 3)/100% = 150 ∙ 10/100 = 15 г;
Пусть масса добавленного нитрата калия равна x г. Тогда масса всей соли в конечном растворе будет равна (15 + x ) г, а масса раствора (150 + x ) , а массовую долю нитрата калия в конечном растворе можно записать как:
Тогда масса всей соли в конечном растворе будет равна (15 + x ) г, а масса раствора (150 + x ) , а массовую долю нитрата калия в конечном растворе можно записать как:
w (3) (KNO 3) = 100% ∙ (15 + x )/(150 + x )
В то же время, из условия известно, что w (3) (KNO 3) = 12%. В связи с этим можем записать следующее уравнение:
100% ∙ (15 + x )/(150 + x ) = 12%
(15 + x )/(150 + x ) = 0,12
15 + x = 18 + 0,12
0,88x = 3
x = 3/0,88 = 3,4
т.е. масса добавленного нитрата калия равна 3,4 г.
Задание №3
К 70 г раствора с массовой долей хлорида кальция 40% добавили 18 мл воды и 12 г этой же соли. Массовая доля соли в полученном растворе равна __________%. (Запишите число с точностью до целых.)
Ответ: 40
Пояснение:
Плотность воды равна 1 г/мл. Это значит, что масса воды, выраженная в граммах численно равна объему воды выраженному в миллилитрах. Т.е. масса добавленной воды равна 18 г.
Т.е. масса добавленной воды равна 18 г.
Рассчитаем массу хлорида кальция в исходном 40%-ном растворе:
m (1) (CaCl 2) = 40% ∙ 70 г/100% = 28 г,
Общая масса хлорида кальция в конечном растворе равна сумме масс хлорида кальция в исходном растворе и добавленного хлорида кальция. Т.е.
m общ. (CaCl 2) = 28 г + 12 г = 40 г,
Масса конечного раствора равна сумме масс исходного раствора и добавленных воды и соли:
m общ. (р-ра CaCl 2) = 70 г + 18 г + 12 г = 100 г,
Таким образом, массовая доля соли в конечном растворе равна:
w (3) (CaCl 2) = 100% ∙ m общ. (CaCl 2)/m общ. (р-ра CaCl 2) = 100% ∙ 40/100 = 40%
Задание №4
Какую массу воды надо добавить к 50 г 70%-ного раствора серной кислоты для получения раствора с массовой долей кислоты 5%? (Запишите число с точностью до целых.)
Ответ: 650
Пояснение:
Рассчитаем массу чистой серной кислоты в 50 г 70%-ного раствора серной кислоты:
m(H 2 SO 4) = 50 ∙ 0,7 = 35 г,
Пусть масса добавляемой воды равна x г.
Тогда масса конечного раствора равна (50+x) г, а массовую долю кислоты в новом растворе можно выразить как:
w (2) (H 2 SO 4) = 100% ∙ 35/(50+х)
В то же время из условия известно, что массовая доля кислоты в новом растворе равна 5%. Тогда справедливо уравнение:
100% ∙ 35/(50+х) = 5%
35/(50+х) = 0,05
35 = 0,05 ∙ (50+х)
35 = 2,5 + 0,05х
x = 650, т.е. масса воды, которую надо добавить равна 650 г.
Задание №5
К раствору нитрата кальция массой 80 г с массовой долей 4% добавили 1,8 г этой же соли. Массовая доля соли в полученном растворе равна _____ %. (Запишите число с точностью до десятых.)
Ответ: 6,1
Пояснение:
Рассчитаем массу чистого нитрата кальция в исходном 4%-ном растворе:
m (1) (Ca(NO 3) 2) = 80 г ∙ 4%/100% = 3,2 г
Масса чистого нитрата кальция в конечном растворе складывается из массы нитрата кальция в исходном растворе и добавленного нитрата кальция, т.е.:
m (3) (Ca(NO 3) 2) = 3,2 + 1,8 = 5 г
Аналогично масса конечного раствора складывается из масс исходного раствора и добавленного нитрата кальция:
m (3) (р-ра Ca(NO 3) 2) = 80 + 1,8 = 81,8 г
w (3) (Ca(NO 3) 2) = 100% ∙ 5/81,8 ≈ 6,1 %
Задание №6
Вычислите массу воды (в граммах), которую надо выпарить из 1 кг 3%-ного раствора сульфата меди для получения 5%-ного раствора. (Запишите число с точностью до целых.)
(Запишите число с точностью до целых.)
Ответ: 400
Пояснение:
Переведем единицы измерения массы исходного раствора из кг в г:
m (1) (р-ра CuSO 4) = 1 кг = 1000 г
Рассчитаем массу чистого сульфата меди в исходном растворе:
m (1) (CuSO 4) = 1000 г ∙ 3%/100% = 30 г
При упаривании раствора соли изменяется масса воды, а масса соли остается неизменной, т.е. равной 30 г. Обозначим массу воды, которую нужно выпарить как x г. Тогда масса нового раствора будет равна (1000-х) г, а массовую долю соли в новом растворе можно записать как:
w (2) (CuSO 4) = 100% ∙ 30/(1000-x)
В то же время, в условии задачи сказано, что массовая доля соли в конечном растворе равна 5%. Тогда, очевидно, справедливо уравнение:
100% ∙ 30/(1000-x) = 5%
30/(1000-x) = 0,05
x = 400, т.е. масса воды, которую нужно выпарить равна 400 г.
Задание №7
Вычислите массу уксусной кислоты, которую следует растворить в 150 г столового 5%-ного уксуса для получения 10%-ного раствора.
Ответ: 8,3
Пояснение:
Рассчитаем массу чистой уксусной кислоты в исходном 5%-ном растворе:
m (1) (CH 3 COOH) = 150 г ∙ 5%/100% = 7,5 г
Пусть масса добавляемой уксусной кислоты равна x г. Тогда общая масса уксусной кислоты в конечном растворе равна (7,5 + x) г, а масса самого раствора — (150 + x) г
Тогда массовая доля уксусной кислоты в конечном растворе равна:
m(CH 3 COOH) = 100% ∙ (7,5 + x)/(150 + x)
В то же время, из условия известно, что массовая доля уксусной кислоты в конечном растворе равна 10%. Следовательно, справедливо уравнение:
100% ∙ (7,5 + x)/(150 + x) = 10%
(7,5 + x)/(150 + x) = 0,1
75 + 10x = 150 + x
Т.е. масса уксусной кислоты, которую надо добавить примерно равна 8,3 г (при округлении до десятых).
Задание №8
Определите массу 10%-ного раствора поваренной соли (в граммах), полученного при разбавлении 50 г раствора с массовой долей соли 30%? (Запишите число с точностью до целых. )
)
Пояснение:
Рассчитаем массу чистой поваренной соли в 30%-ном растворе:
m(NaCl) = 50 ∙ 30%/100% = 15 г
Конечный 10%-ный раствор получают разбавлением исходного 30%-ного. Это значит, что в конечном растворе содержится такое же количество соли, что и в исходном. Т.е. масса соли в конечном растворе равна 15 г, а концентрация — 10%. Таким образом мы можем посчитать массу этого раствора:
m (2) (р-ра NaCl) = 100% ∙ 15 г/10% = 150 г
Задание №9
Ответ: 6
Пояснение:
Плотность воды равна 1 г/мл. Это значит, что масса воды, выраженная в граммах численно равна объему воды выраженному в миллилитрах. Т.е. масса добавленной воды равна 160 г:
Посчитаем массу чистой соли в исходном 10%-ном растворе:
m(NaCl) = 240 г ∙ 10%/100% = 24 г
Масса конечного раствора равна сумме масс исходного раствора и добавленной воды:
m (2) (р-ра NaCl) = 240 + 160 = 400 г
Масса соли одинакова в исходном и конечном растворах, поэтому массовую долю соли в конечном растворе можно рассчитать так:
w (2) (р-ра NaCl) = 100% ∙ 24 г/400 г = 6%
Задание №10
Смешали 80 г раствора с массовой долей нитрата натрия 10% и 120 г 25%-ного раствора этой же соли. Определите массовую долю соли в полученном растворе. (Запишите число с точностью до целых.)
Определите массовую долю соли в полученном растворе. (Запишите число с точностью до целых.)
Ответ: 19
Пояснение:
Очевидно, что масса конечного раствора будет складываться из масс первого и второго растворов:
m(р-ра NaNO 3) = m (1) (р-ра NaNO 3) + m (2) (р-ра NaNO 3) = 80 г + 120 г = 200 г
m (1) (NaNO 3) = m (1) (р-ра NaNO 3) ∙ ω (1) (р-ра NaNO 3) /100% = 80 ∙ 10/100 = 8 г
Масса соли в первом растворе равна:
m (2) (NaNO 3) = m (2) (р-ра NaNO 3) ∙ ω (2) (р-ра NaNO 3) /100% = 120 ∙ 25/100 = 30 г
Таким общая масса соли в растворе полученном при сливании первого и второго растворов:
m(NaNO 3) = m (1) (NaNO 3) + m (2) (NaNO 3) = 8 + 30 = 38 г,
Массовая доля соли в конечном растворе:
ω(NaNO 3) = 100% ∙ m(NaNO 3)/m(р-ра NaNO 3) = 100% ∙ 38 /200 = 19 %.
Задание №11
Какую массу воды необходимо добавить к 150 г раствора гидроксида натрия с массовой долей 10%, чтобы получить раствор с массовой долей 2%? (Запишите число с точностью до целых. )
)
Ответ: 600
Пояснение:
Рассчитаем массу гидроксида натрия в исходном 10%-ном растворе:
m(NaNO 3) = 150 г ∙ 10%/100% = 15 г
Пусть масса воды, которую нужно добавить 1о%-ному раствору равна x г.
Тогда масса конечного раствора будет равна (150 + x) г.
Масса гидроксида натрия остается неизменной после разбавления исходного раствора водой, т.е. равной 15 г. Таким образом:
Массовая доля гидроксида натрия в новом растворе равна:
ω (3) (NaOH) = 100% ∙ 15/(150 + x), в то же время из условия ω (3) (NaOH) = 2%. Поэтому, очевидно, справедливо уравнение:
100% ∙ 15/(150 + x) = 2%
15/(150 + x) = 0,02
Таким образом, масса воды, которую необходимо добавить равна 600 г.
Задание №12
Какую массу воды необходимо выпарить из 500 г 4%-ного раствора гидроксида калия, чтобы получить раствор с массовой долей щелочи 10%? (Запишите число с точностью до целых.)
Ответ: 300
Пояснение:
Рассчитаем массу гидроксида калия в исходном растворе:
m (1) (KOH) = 500 г ∙ 4%/100% = 20 г
Пусть масса воды, которую необходимо выпарить равна x г.
Тогда масса нового раствора будет равна:
m(р-ра KOH) = (500 — x) г, а массовая доля гидроксида калия равна:
ω(KOH) = 100% ∙ 20 г/(500 — x).
В то же время, из условия известно, что массовая доля щелочи в новом растворе составляет 10%.
100% ∙ 20/(500 — x) = 10%
20/(500 — x) = 0,1
Таким образом, масса воды, которую надо выпарить равна 300 г.
Задание №13
К 214 г 7%-ного раствора карбоната калия добавили 16 г этой же соли. Определите массовую долю соли в полученном растворе. (Запишите число с точностью до десятых.)
Ответ: 13,5
Пояснение:
Масса конечного раствора равна сумме масс исходного раствора и добавленного карбоната калия:
m (3) (р-ра K 2 CO 3) = 214 + 16 = 230 г
Рассчитаем массу карбоната калия в исходном 7%-ном растворе:
m (1) (K 2 CO 3) = 214 ∙ 7%/100% = 214 ∙ 0,07 = 14,98 г
Тогда масса карбоната калия в конечном растворе будет равна сумме масс карбоната калия в исходном растворе и добавленного карбоната калия:
m (1) (K 2 CO 3) = 14,98 + 16 = 30,98 г
ω(K 2 CO 3) = 100% ∙ 30,98 г/230 г ≈ 13,5 г
Задание №14
Смешали 250 г раствора с массовой долей соли 12% и 300 г раствора с массовой долей этой же соли 8%. Определите массовую долю соли в полученном растворе. (Запишите число с точностью до десятых.)
Определите массовую долю соли в полученном растворе. (Запишите число с точностью до десятых.)
Ответ: 9,8
Пояснение:
Масса нового раствора соли равна:
m (3) (р-ра соли) = m (1) (р-ра соли) + m (2) (р-ра соли) = 250 + 300 = 550 г
Найдем массу соли в первом растворе:
m (1) (соли) = 250 г ∙ 12%/100% = 30 г
и во втором растворе:
m (2) (соли) = 300 г ∙ 8%/100% = 24 г
Тогда общая масса соли в конечном растворе будет равна:
m (3) (соли) = m (1) (соли) + m (2) (соли) = 30 г + 24 г = 54 г,
а массовая доля соли в конечном растворе:
ω (3) (соли) = 100% ∙ 54 г/550 г ≈ 9,8 %
Задание №15
Из 150 г раствора с массовой долей бромида натрия 6% выпарили 10 г и добавили 5 г этой же соли. Определите массовую долю соли в полученном растворе. (Запишите число с точностью до десятых.)
Ответ: 9,7
Пояснение:
Очевидно, что масса полученного в результате описанных в условии задания действий равна:
m получ. (р-ра NaBr) = 150 г — 10 г + 5 г = 145 г
(р-ра NaBr) = 150 г — 10 г + 5 г = 145 г
Рассчитаем массу бромида натрия в исходном 6%-ном растворе:
m (1) (NaBr) = 150 г ∙ 6%/100% = 9 г
Поскольку бромид натрия — вещество ионного строения, т.е. имеет крайне высокую температуру кипения, то в отличии от воды при упаривании раствора испаряться не будет. Т.е. выпаренные 10 г из раствора представляют собой чистую воду.
Тогда общая масса соли в конечном растворе будет равна сумме масс соли в исходном растворе и добавленной соли.
m (3) (NaBr) = 9 г + 5 г = 14 г
Таким образом массовая доля соли в конечном растворе будет равна:
ω (3) (NaBr) = 100% ∙ 14 г/145 г ≈ 9,7 %
Задание №16
Массовая доля ацетата натрия в растворе, полученном при добавлении 120 г воды к 200 г раствора с массовой долей соли 8%, равна _____ %. (Запишите число с точностью до целых.)
Ответ: 5
Пояснение:
Рассчитаем массу ацетата натрия в исходном 8%-ном растворе:
m(CH 3 COONa) = 200 г ∙ 8%/100% = 16 г
Масса полученного раствора равна сумме масс исходного 8%-ного раствора и добавленной воды:
m получ. (р-ра) = 200 г + 120 г = 320 г
(р-ра) = 200 г + 120 г = 320 г
Масса соли после добавления воды, очевидно, не изменилась, т.е. осталась равной 16 г.
Таким образом, очевидно, что массовая доля ацетата натрия в полученном растворе равна:
ω(CH 3 COOH) = 100% ∙ 16 г/320 г = 5%
Задание №17
Ответ: 17,2
Пояснение:
Рассчитаем массу хлорида натрия в исходном 8%-ном растворе:
m (1) (NaCl) = 180 г ∙ 8%/100% = 14,4 г
Очевидно, что масса всего хлорида натрия в конечном растворе равна сумме масс хлорида натрия в исходном растворе и добавленного хлорида натрия, т.е.:
m (3) (NaCl) = m (1) (NaCl) + m (2) (NaCl) = 14,4 г + 20 г = 34,4 г,
Также очевидно, что масса конечного раствора равна сумме масс исходного раствора и добавленного NaCl.
Ответы в самом низу встроенного документа
1. Какую массу гидроксида калия необходимо растворить в 150 г воды для получения раствора с массовой долей 25 %?
2. К раствору нитрата меди(П) массой 80 г с массовой долей 4% добавили 1,8 г этой же соли. Рассчитайте массовую долю соли в полученном растворе.
Рассчитайте массовую долю соли в полученном растворе.
3. Смешали 300 г раствора с массовой долей соли 20% и 500 г раствора с массовой долей 40 %. Рассчитайте массовую долю соли в полученном растворе.
Ответ:_%. (Запишите ответ с точностью до десятых.)
4. Рассчитайте массу нитрата калия, которую необходимо растворить в 150 г раствора с массовой долей 10% для получения раствора с массовой долей 12%.
5. Рассчитайте массовую долю азотной кислоты в растворе, полученном после добавления 20 г воды к 160 г её 5 %-ного раствора.
Ответ:_%. (Запишите число с точностью до десятых.)
6. Какую массу поваренной соли нужно добавить к 250 г раствора этой же соли с массовой долей 10% для получения раствора соли с массовой долей 18 %?
Ответ:_г. (Запишите число с точностью до десятых.)
7. Рассчитайте массу уксусной кислоты, которая содержится в 0,5 л раствора с массовой долей 80% (плотность 1,1 г/мл).
Ответ:_г. (Запишите число с точностью до целых. )
)
1. Сколько граммов хлорида натрия необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %?
Ответ:_г. (Запишите число с точностью до десятых.)
2. К раствору сульфида калия массой 60 г с массовой долей 4 % добавили 1,6 г этой же соли. Рассчитайте массовую долю соли в полученном растворе.
Ответ:_%. (Запишите число с точностью до десятых.)
3. К 240 г раствора соли с массовой долей 10% добавили 160 мл воды. Рассчитайте массовую долю соли в полученном растворе.
4. Найдите, какую массу раствора уксусной кислоты с массовой долей 40% необходимо добавить к 500 г воды для получения раствора с массовой долей 15 %.
Ответ:_г. (Запишите число с точностью до целых.)
5. Смешали 80 г раствора нитрата натрия с массовой долей 6 % и 200 г раствора этой же соли с массовой долей 8 %. Сколько граммов нитрата натрия содержится в полученном растворе?
Ответ:_г. (Запишите число с точностью до целых.)
6. При упаривании 400 г 5 %-ного раствора соли получили 320 г раствора. Какова массовая доля соли в нём?
Какова массовая доля соли в нём?
Ответ: %. (Запишите число с точностью до сотых.)
7. Сколько граммов азотной кислоты содержится в 180 мл 4 %-ного раствора (плотность 1,05 г/мл)?
1. К 160 г раствора карбоната калия с массовой долей 5 % добавили 40 г раствора этой же соли с массовой долей 10%. Рассчитайте массовую долю соли в полученном растворе.
Ответ:_%. (Запишите число с точностью до целых.)
2. Рассчитайте массу хлороводорода, который необходимо растворить в 1000 г воды для получения раствора соляной кислоты с массовой долей 3,65%.
Ответ:_г. (Запишите число с точностью до целых.)
3. Рассчитайте массу уксусной кислоты, которую следует растворить в 150 г столового 5 %-ного уксуса для получения 10 %-ного раствора.
Ответ:_г. (Запишите число с точностью до десятых.)
4. В 280 г раствора хлорида цинка с массовой долей 15 % растворили 12 г этой же соли. Вычислите массу хлорида цинка в полученном растворе.
Ответ:_г. (Запишите ответ целым числом. )
)
5. Смешали 120 г раствора сульфата натрия с массовой долей 2,5 % и 10 г раствора той же соли с массовой долей 5 %. Рассчитайте массовую долю соли в полученном растворе.
Ответ:_%. (Запишите число с точностью до десятых.)
6. К 110 г раствора с массовой долей хлорида натрия 20 % добавили 22 мл воды и 18 г этой же соли. Рассчитайте массовую долю соли в полученном растворе.
Ответ:_%. (Запишите число с точностью до десятых.)
7. Определите массу воды, которую надо добавить к 20 г раствора азотной кислоты с массовой долей 70 % для получения раствора кислоты с массовой долей 3 %.
Ответ:_г. (Запишите число с точностью до целых.)
1. Вычислите массу нитрата натрия, которую необходимо растворить в 250 г раствора с массовой долей 10% для получения раствора с массовой долей 0,2.
Ответ:_г. (Запишите число с точностью до сотых.)
2. Какую массу поваренной соли нужно добавить к 250 г раствора этой же соли с массовой долей 10% для получения раствора соли с массовой долей 18 %?
Ответ:_г. (Запишите число с точностью до десятых.)
(Запишите число с точностью до десятых.)
3. Смешали 200 г раствора серной кислоты с массовой долей 20% и 300 г раствора серной кислоты с массовой долей 40%. Вычислите массу кислоты в полученном растворе.
Ответ:_г. (Запишите число с точностью до целых.)
4. К 700 г водного раствора этанола с массовой долей 20 % добавили 240 мл С2Н5ОН (плотность 0,80 г/мл). Рассчитайте массу воды в полученном растворе.
Ответ:_г. (Запишите число с точностью до целых.)
5. Вычислите массу хлороводорода, которую необходимо растворить в 100 г воды для получения раствора соляной кислоты с массовой долей 3,65%.
Ответ:_г. (Запишите число с точностью до десятых.)
6. Вычислите массу ледяной уксусной кислоты, которую следует растворить в 150 г столового 5 %-ного уксуса для получения 8 %-ного раствора.
Ответ:_г. (Запишите число с точностью до десятых.)
7. К 80 г раствора с массовой долей нитрата калия 25 % добавили 10 г этой же соли. Сколько миллилитров воды надо добавить в полученный раствор для того, чтобы массовая доля соли равнялась 15 %?
1. Вычислите массу нитрата меди(Н), которую необходимо добавить к 400 г 5 %-ного раствора этой соли для того, чтобы увеличить массовую долю соли до 15%.
Вычислите массу нитрата меди(Н), которую необходимо добавить к 400 г 5 %-ного раствора этой соли для того, чтобы увеличить массовую долю соли до 15%.
Ответ:_г. (Запишите число с точностью до десятых.)
2. Смешали 200 г 10 %-ной и 300 г 20 %-ной соляной кислоты. Рассчитайте массовую долю хлороводорода в полученном растворе.
Ответ:_%. (Запишите число с точностью до целых.)
3. Смешали 25 г раствора гидроксида калия с массовой долей 16 % и 30 мл раствора (р = 1,2 г/мл) с массовой долей того же вещества 20 %. Рассчитайте массовую долю щёлочи в полученном растворе.
Ответ:_%. (Запишите число с точностью до десятых.)
4. К 220 г раствора с массовой долей хлорида натрия 20 % добавили 44 мл воды и 36 г этой же соли. Вычислите массовую долю соли в полученном растворе.
Ответ:_%к (Запишите число с точностью до десятых.)
5. При нагревании 150 г 15 %-ного раствора аммиака 10 г этого вещества улетучилось. Вычислите массовую долю аммиака в растворе после нагревания.
Ответ:_%. (Запишите число с точностью до десятых.)
6. Определите массу воды, содержащуюся в 60 г раствора гидроксида натрия с массовой долей 20%.
Ответ:_г. (Запишите число с точностью до целых.)
7. К 700 г водного раствора этанола с массовой долей 20 % добавили 240 мл С2Н5ОН (р = 0,80 г/мл). Рассчитайте массу спирта в полученном растворе.
Ответ:_г. (Запишите число с точностью до целых.)
1. К 250 мл 32 %-ной азотной кислоты плотностью 1,2 г/мл прибавили 0,5 л воды. Определите массовую долю кислоты в полученном растворе.
Ответ:_%. (Запишите число с точностью до целых.)
2. Вычислите массовую долю хлороводорода в растворе, полученном при растворении 112 л НС1 (н. у.) в 0,5 л воды.
3. Из 150 г раствора с массовой долей йодида натрия 6 % выпарили 10 г воды и добавили 5 г этой же соли. Вычислите массовую долю соли в полученном растворе.
Ответ:_%. (Запишите число с точностью до десятых.)
4. Вычислите массу воды, которую надо выпарить из I кг 3 %-ного раствора сульфата железа(Ш) для получения 5 %-ного раствора.
Ответ:_г. (Запишите число с точностью до целых.)
5. К 50 г раствора нитрата кальция с массовой долей 4% добавили 1 г этой же соли и 10 г воды. Вычислите массовую долю соли в полученном растворе.
Ответ:_%. (Запишите число с точностью до десятых.)
6. Какой объём 96 %-ной серной кислоты (р = 1,86 г/мл) необходимо добавить к 1 л раствора 30 %-ной серной кислоты (р = 1,3 г/мл) для того, чтобы получить 40 %-ный раствор?
Ответ:_мл. (Запишите число с точностью до десятых.)
7. Раствор, полученный растворением 64 г нитрата калия в 336 мл воды, упарили, в результате концентрация соли увеличилась на 25%. Вычислите массу испарившейся воды.
Ответ:_г. (Запишите число с точностью до целых.)
1. К раствору хлорида кальция массой 140 г с массовой долей 10% добавили 10 г этой же соли и 25 мл воды. Вычислите массовую долю соли в полученном растворе.
Ответ:_%. (Запишите число с точностью до десятых.)
2. После добавления нитрата натрия к 400 мл 16 %-ного раствора карбоната натрия плотностью 1,17 г/мл массовая доля вещества в растворе возросла до 18%. Вычислите массу добавленного вещества.
Вычислите массу добавленного вещества.
Ответ:_г. (Запишите число с точностью до десятых.)
3. 11,2 л бромоводорода (н.у.) растворили в 1 л воды. Вычислите массовую долю бромоводородной кислоты в полученном растворе.
Ответ:_%. (Запишите число с точностью до десятых.)
4. К раствору сульфата калия, состоящему из воды массой 126 г и 14 г соли, добавили 10 г этой же соли и 25 мл воды. Вычислите массовую долю соли в полученном растворе.
Ответ:_%. (Запишите число с точностью до десятых.)
5. Сколько миллилитров воды необходимо добавить к 100 мл 20%-ного раствора серной кислоты (плотность 1,14 г/мл), чтобы получить 5 %-ный раствор серной кислоты?
Ответ:_мл. (Запишите число с точностью до целых.)
6. Сколько граммов сульфида натрия требуется для приготовления 3 л 8 %-ного раствора, плотность которого равна 1,07 г/мл?
Ответ:_г. (Запишите число с точностью до десятых.)
7. Вычислите массу серной кислоты, содержащейся в 196 мл 10 %-ного раствора кислоты (р = 1,07 г/мл).
Ответ:_г. (Запишите число с точностью до целых.)
1. При нагревании 200 г 25 %-ного раствора аммиака 20 г этого вещества улетучилось. Вычислите массовую долю аммиака в растворе после нагревания.
Ответ:_%. (Запишите число с точностью до сотых.)
2. Вычислите массу сульфата аммония, которую необходимо растворить в 200 г раствора с массовой долей 10 % для получения раствора с массовой долей 15%.
Ответ:_г. (Запишите число с точностью до десятых.)
3. Смешали 120 г раствора гидроксида натрия с массовой долей 15% и 80 г раствора этого же вещества с массовой долей 22%. Вычислите массу щёлочи в полученном растворе.
Ответ:_г. (Запишите число с точностью до десятых.)
4. К 400 мл 30%-ной кислоты плотностью 1,15 г/мл прибавили 0,7 кг воды. Определите массовую долю кислоты в полученном растворе.
Ответ:_%. (Запишите число с точностью до десятых.)
5. Смешали 250 г 16 %-ного раствора гидроксида натрия и 300 мл 20 %-ного (плотностью 1,2 г/мл) раствора едкого натра. В полученный раствор добавили 50 мл воды. Рассчитайте массовую долю гидроксида натрия в растворе.
В полученный раствор добавили 50 мл воды. Рассчитайте массовую долю гидроксида натрия в растворе.
Ответ:_%. (Запишите число с точностью до целых.)
6. Вычислите массу азотной кислоты, содержащейся в 250 мл 10 %-ного раствора азотной кислоты (р = 1,07 г/мл).
Ответ:_г. (Запишите число с точностью до сотых.)
7. Сколько килограммов воды необходимо прибавить к 500 мл 52 %-ного раствора азотной кислоты (плотность 1,322 г/мл), чтобы получить 10 %-ный раствор кислоты?
Ответ:_кг. (Запишите число с точностью до сотых.)
1. При растворении в 270 г воды сульфата натрия был получен раствор с массовой долей соли 10%. Рассчитайте массу растворённого Na2S04
Ответ:_г. (Запишите число с точностью до целых.)
2. К 200 мл 16 %-ного раствора гидроксида натрия плотностью 1,17 г/мл добавили гидроксид натрия, в результате концентрация вещества в растворе возросла до 20%. Рассчитайте массу добавленного гидроксида натрия.
Ответ:_г. (Запишите число с точностью до десятых. )
)
3. К раствору нитрата меди(П) массой 80 г с массовой долей 8% добавили 3,6 г этой же соли и 18 мл воды. Рассчитайте массовую долю соли в полученном растворе.
Ответ:_%. (Запишите число с точностью до сотых.)
4. Вычислите массовую долю йодоводорода (%) в растворе, полученном при растворении 112 л (н.у.) HI в 1 л воды.
Ответ:_%. (Запишите число с точностью до целых.)
5. Какую массу нитрата серебра необходимо добавить к 250 г раствора этой соли с массовой долей 10 % для получения 18 %-ного раствора нитрата серебра?
Ответ:_г. (Запишите число с точностью до сотых.)
6. Через 500 мл раствора с концентрацией аммиака 4 моль/л (р = 1,05 г/мл) пропустили 67,2 л (н.у.) аммиака. Рассчитайте массовую долю аммиака в полученном растворе.
Ответ:_%. (Запишите число с точностью до десятых.)
7. Рассчитайте массу соли, которая вводится в организм человека при вливании 706 г физиологического раствора, содержащего 0,85 % по массе хлорида натрия.
Ответ:_г. (Запишите число с точностью до целых.)
(Запишите число с точностью до целых.)
1. К 1 л раствора серной кислоты (массовая доля 0,3 и плотность 1,13 г/мл) добавили 196 г кислоты. Рассчитайте массовую долю кислоты в полученном растворе.
Ответ:_%. (Запишите число с точностью до десятых.)
2. Какой объём (н.у.) бромоводорода необходимо растворить в 1 л воды для получения раствора с массовой долей 8,1 %?
3. 200 мл 36,5 %-ного раствора соляной кислоты (плотность 1,18 г/мл) оставили в открытой колбе в вытяжном шкафу, в результате концентрация кислоты снизилась до 30%. Рассчитайте массу испарившегося хлороводорода.
Ответ:_г. (Запишите число с точностью до сотых.)
4. Рассчитайте массу воды, которую необходимо добавить к 200 г раствора, приготовленного с использованием 10,6 г карбоната натрия, для того, чтобы уменьшить массовую долю карбоната натрия до 2%.
Ответ:_г. (Запишите число с точностью до целых.)
5. Сколько миллилитров воды необходимо добавить к 40 мл уксусной эссенции (содержание кислоты 70%, плотность 1,3 г/мл) для того, чтобы получить 5 %-ную уксусную кислоту (пищевой уксус)?
Ответ:_мл. (Запишите число с точностью до целых.)
(Запишите число с точностью до целых.)
6. Рассчитайте массу 12 %-ного раствора соляной кислоты, которую необходимо добавить к 200 г 36,5 %-ного раствора для того, чтобы получить 25 %-ный раствор кислоты.
Ответ:_г. (Запишите число с точностью до десятых.)
7. Сколько граммов сульфата железа(П) необходимо добавить к 400 г 2,5 %-ного раствора сульфата железа для того, чтобы увеличить массовую долю соли в 4 раза?
Ответ:_%. (Запишите число с точностью до десятых.)
Вопрос 25. Расчёты объёмных отношений газов при химических реакциях. Тепловой эффект химической реакции. Термохимические уравнения. Расчёты теплового эффекта реакции.
Расчёты по химическим уравнениям включают несколько обязательных этапов:
1) составить уравнение реакции;
2) установить логические связи между веществами, которые будут участвовать в расчёте;
3) найти количество «чистых» известных веществ;
4) найти по уравнению реакции количество неизвестного вещества;
6) если необходимо, перейти к ответу на дополнительные вопросы, сформулированные в условии («осложнения»). + 802 кДж
+ 802 кДж
выделилось 3580 кДж теплоты. Сколько литров (н.у.) метана потребуется для этого?
2С1207(Г) = 2С12(Г) + 702(Г) + 570 кДж
в реакцию вступил оксид хлора(УН) массой 3,66 г. Рассчитайте количество выделившейся теплоты.
Ответ:_кДж. (Ответ приведите с точностью до десятых.)
2AgN03(KP) = 2Ag(KP) + 2N02(r) + 02(Г) — 317 кДж
получили 10,8 г серебра. Вычислите количество затраченной теплоты. Ответ:_кДж. (Ответ приведите с точностью до сотых.)
1. Какой объём (н.у.) кислорода необходим для полного сжигания 100 л (н.у.) этана?
Ответ:_л. (Ответ приведите с точностью до целых.)
2. Какой объём (н.у.) кислорода потребуется для каталитического окисления 100 л (н.у.) аммиака до оксида азота(П)?
Ответ:_л. (Ответ приведите с точностью до целых.)
3. Какой объём (н. у.) кислорода требуется для сжигания 60 г этана?
Ответ:_л. (Ответ приведите с точностью до целых.)
4. В соответствии с термохимическим уравнением реакции
СаС03(ТВ} = CaO^g) + С02(Г) — 180 кДж,
выделилось 56 л (н. 2(Г.) ‘*»412 кДж,
2(Г.) ‘*»412 кДж,
выделилось 206 кДж теплоты. Какая масса угля вступила в реакцию горения?
Ответ:_г. (Ответ приведите с точностью до целых.)
1. Какой объём (н.у.) оксида углерода(1\0 образуется при сжигании 50 л пропана в избытке кислорода?
Ответ:_л. (Ответ приведите с точностью до целых.)
2. Какой объём (н.у.) оксида углерода(И) можно окислить с использованием 57 л (н.у.) кислорода?
Ответ:_л. (Ответ приведите с точностью до целых.)
3. Вычислите массу азота, образующегося при полном сгорании 5 л аммиака (н.у.).
Ответ:_г. (Запишите число с точностью до десятых.)
4. В результате реакции, термохимическое уравнение которой
2С1207(Г) = 2С12(Г) + 702(Г) + 570 кДж,
выделилось 11,4 кДж теплоты. Какой объём (н.у.) хлора выделился? Ответ:_л. (Ответ приведите с точностью до десятых.)
2С1207(Г) = 2С12(Г) + 702(Г) + 570 кДж, выделилось 5,7 кДж теплоты. Рассчитайте объём (н.у.) выделившегося кислорода.
Ответ:_л. (Ответ приведите с точностью до десятых.)
(Ответ приведите с точностью до десятых.)
2AgN03(TB) = 2Ag(TB) + 2N02(f) + 02(Г) — 317 кДж,
поглотилось 15,85 кДж теплоты. Вычислите массу выделившегося серебра.
Ответ:_г. (Запишите число с точностью до десятых.)
1. Какой объём (н.у.) водорода теоретически необходим для синтеза 100 л (н. у.) аммиака?
Ответ:_л. (Запишите число с точностью до целых.)
2. Какой объём кислорода (н.у.) необходим для полного сгорания 1 моль газообразного аммиака?
Ответ:_л. (Запишите число с точностью до десятых.)
3. Какой объём (н.у.) кислорода потребуется для каталитического окисления 200 л (н.у.) аммиака до оксида азота(П)?
Ответ:_л. (Запишите число с точностью до целых.)
4. Взаимодействие угарного газа с кислородом описывается термохимическим уравнением
2СО(Г) + 02(Г) = 2С02(Г) + 283 кДж.
Вычислите количество теплоты, выделившееся при сгорании 224 л (н.у.) угарного газа.
5. В результате осуществления реакции, термохимическое уравнение которой
СаО(тв) + Н20(Ж) = Са(ОН)2(ТВ} + 70 кДж, было получено 185 г гидроксида кальция. Вычислите количество выделившейся теплоты.
Вычислите количество выделившейся теплоты.
Ответ:_кДж. (Запишите число с точностью до целых.)
6. В результате реакции, термохимическое уравнение которой
С(ТВ.) + °2(Г.) = С°2(Г.) + 393’5
выделилось 1967,5 кДж теплоты. Вычислите объём (н.у.) образовавшегося при этом углекислого газа.
Ответ:_л. (Запишите число с точностью до целых.)
1. Какой объём (н.у.) кислорода потребуется для полного сгорания 56 л (н.у.) метана?
Ответ: л. (Запишите число с точностью до целых.)
2. Сколько килограммов кислорода потребуется для полного сгорания 560 л (н.у.) метана?
Ответ:_кг. (Запишите число с точностью до десятых.)
3. Какой объём (н.у.) азота теоретически необходим для синтеза 300 л (н.у.) аммиака?
Ответ:_л. (Запишите число с точностью до целых.)
4. В результате реакции, термохимическое уравнение которой
2AgN03(TB) = 2Ag(TB) + 2N02(F) + 02(Г) — 317 кДж,
поглотилось 15,85 кДж теплоты. Вычислите массу выделившегося оксида азота (IV).
Ответ:_г. (Запишите число с точностью до десятых.)
5. В соответствии с термохимическим уравнением реакции
2С1207 = 2С12 + 702 + 570 кДж
прореагировало 18,3 г оксида хлора(УП). Вычислите количество выделившейся при этом теплоты.
6. В результате реакции, термохимическое уравнение которой
С2Н5ОН(Ж j + 302(Г) = 2С02(Г) + ЗН20(Г) + 1374 кДж,
выделилось 687 кДж теплоты. Какое количество вещества этанола вступило в реакцию?
1. Какое количество воды образуется при сгорании пентена в 6,72 л кислорода (н.у.)?
Ответ:_моль. (Запишите число с точностью до десятых.)
2. Вычислите объём газа (н.у.), который образуется при горении 40 л этана в 40 л кислорода.
Ответ:_л. (Запишите число с точностью до десятых.)
3. При сгорании аммиака образовалось 5,6 г газа. Рассчитайте, какой объём аммиака вступил в реакцию.
Ответ:_л. (Запишите число с точностью до целых.)
4. Вычислите количество теплоты, которое необходимо затратить для того, чтобы получить 89,6 л угарного газа, если термохимическое уравнение процесса
СН4(Г) + С02^ = 2CO(pj + 2Н2(Г) — 248 кДж.
Ответ:_кДж. (Запишите число с точностью до целых.)
5. В результате реакции, термохимическое уравнение которой
2С2Н2 +502 = 4С02 + 2Н20 + 2610 кДж,
выделилось 652,5 кДж теплоты. Вычислите объём сгоревшего ацетилена.
Ответ:_л. (Запишите число с точностью до десятых.)
6. В соответствии с термохимическим уравнением
С6Н1206 + 602 = 6С02 + 6Н20 + 2816 кДж
выделяется 1408 кДж теплоты. Какое количество кислорода участвует в реакции?
Ответ:_моль. (Запишите число с точностью до целых.)
1. Сколько граммов сернистого газа образуется при сжигании 30,24 л (н. у.) сероводорода?
Ответ:_г. (Запишите число с точностью до десятых.)
2. Рассчитайте объём газа, образующегося при сжигании 40 л (н. у.) метана в 40 л (н. у.) кислорода.
Ответ:_л. (Запишите число с точностью до целых.)
3. Рассчитайте, какой объём будет занимать газовая смесь, состоящая из 40 (н.у.) кислорода и 20 л (н.у.) сероводорода, после сжигания и охлаждения смеси до нормальных условий. 2(Г.)= С02(Г) + 393,5 кДж, выделилось 1967,5 кДж теплоты. Объём (н.у.) образовавшегося при этом углекислого газа равен
2(Г.)= С02(Г) + 393,5 кДж, выделилось 1967,5 кДж теплоты. Объём (н.у.) образовавшегося при этом углекислого газа равен
Ответ:_л. (Запишите число с точностью до целых.)
5. В результате реакции, термохимическое уравнение которой
С2Н5ОН + 302 = 2СО, + ЗН20 + 1374 кДж,
выделилось 412,2 кДж теплоты. Какое количество этанола вступило в реакцию?
Ответ:_моль. (Запишите число с точностью до десятых.)
6. Термохимическое уравнение разложения гидрокабоната натрия имеет вид
2NaHC03(TB) = Na2C03(TB} + С02(Г) + Н20(Г) — 64 кДж.
Какое количество теплоты необходимо затратить для получения карбоната натрия из 252 г гидрокарбоната?
Ответ:_кДж. (Запишите число с точностью до целых.)
1. Рассчитайте массу газа, образующегося при взаимодействии с избытком кислорода 30,24 л (н.у.) оксида азота(П).
Ответ:_г. (Запишите число с точностью до десятых.)
2. Окисление метана описывается термохимическим уравнением
2СН4(Г) + 02(Г) = 2СО(Г) + 4Н2(Г^ + 70 кДж.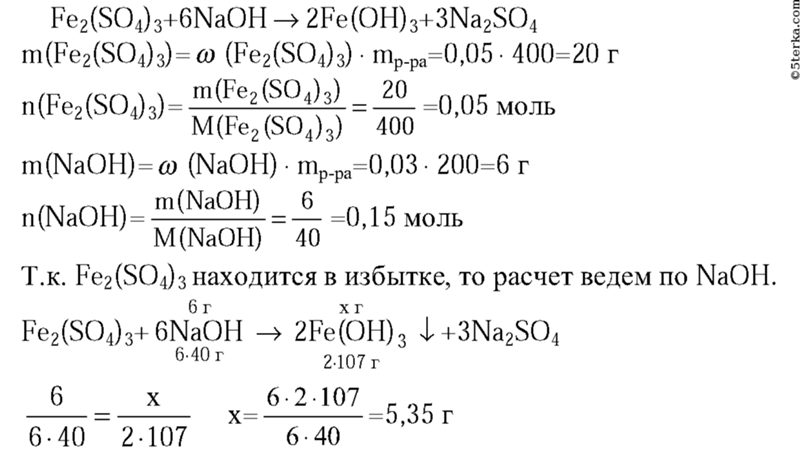
Какой объём метана необходим для получения 1400 кДж тепла? Ответ:_л. (Запишите число с точностью до целых.)
3. Термохимическое уравнение получения аммиака из простых веществ имеет вид
N2(f) + ЗН2(Г)= 2Nh4(r) + 95 кДж.
Какое количество теплоты выделится при получении 840 мл (н.у.) аммиака?
Ответ:__ кДж. (Запишите число с точностью до десятых.)
4. В результате реакции, термохимическое уравнение которой
Nh5N02(TB J = N2(R) + 2Н20(Ж) + 316 кДж,
выделилось 94,8 кДж теплоты. Сколько граммов нитрита натрия вступило в реакцию?
Ответ:_г. (Запишите число с точностью до десятых.)
5. Какой объём (н.у.) кислорода потребуется для полного сгорания 10 л (н.у.) ацетилена?
Ответ:_л. (Запишите число с точностью до целых.)
6. Получение железа описывается термохимическим уравнением Fe203
Какое количество теплоты необходимо затратить для получения 33,6 г железа?
Ответ:_кДж. (Запишите число с точностью до десятых.)
1. Какой объём (н.у.) кислорода потребуется для полного сгорания 34 л (н. у.) метана?
Какой объём (н.у.) кислорода потребуется для полного сгорания 34 л (н. у.) метана?
Ответ:_л. (Ответ приведите с точностью до целых.)
2. Рассчитайте, какой объём (н.у.) углекислого газа теоретически образуется при сжигании 5 л (н. у.) угарного газа.
Ответ:_л. (Ответ приведите с точностью до целых.)
3. Какой объём (н.у.) сероводорода необходимо сжечь в избытке воздуха для получения 128 г оксида серы(1У)?
Ответ:_л. (Ответ приведите с точностью до десятых.)
4. Согласно термохимическому уравнению реакции
СаО(тв} + Н20 (Ж} = Са(ОН)2(ТВ} + 70 кДж выделилось 150 кДж теплоты. Сколько граммов оксида кальция вступило в реакцию?
Ответ:_г. (Запишите число с точностью до целых.)
5. В результате реакции, термохимическое уравнение которой
2S02(r) + 02 = 2S03(r) + 198 кДж,
выделилось 2970 кДж теплоты. Какой объём (н.у.) оксида cepbi(IV) вступил в реакцию?
Ответ:_л. (Запишите число с точностью до целых.)
6. Теплота образования 1 моль оксида меди(Н) из простых веществ равна 154,5 кДж. Какое количество теплоты выделится при взаимодействии с кислородом 512 г меди?
Какое количество теплоты выделится при взаимодействии с кислородом 512 г меди?
Ответ:_кДж. (Запишите число с точностью до целых.)
ЕГЭ задание 24.
1. К 700 г водного раствора этанола с массовой долей 20% добавили 240 мл С 2 Н 5 ОН (плотностью 0,80 г/мл). Рассчитайте массу воды в полученном растворе.
2. Смешали 25 г раствора гидроксида калия с массовой долей 16% и 30 мл раствора (ρ=1,2 г/мл) с массовой долей того же вещества 20%. Рассчитайте массовую долю щелочи в полученном растворе.
Ответ: ________%. (Запишите число с точностью до десятых.)
3. Масса хлороводорода, которую необходимо растворить в 100 г воды для получения раствора соляной кислоты с массовой долей 3,65%.Ответ: ________%. (Запишите число с точностью до десятых.)
4. Какую массу поваренной соли требуется добавить к 250 г раствора этой же соли с массовой долей 10% для получения раствора соли с массовой долей 18%? Ответ: ________%. (Запишите число с точностью до десятых.)
5. К 220г раствора с массовой долей хлорида натрия 20% добавили 44 мл воды и 36г этой же соли. Вычислите массовую долю соли в полученном растворе. Ответ: ________%. (Запишите число с точностью до десятых.)
К 220г раствора с массовой долей хлорида натрия 20% добавили 44 мл воды и 36г этой же соли. Вычислите массовую долю соли в полученном растворе. Ответ: ________%. (Запишите число с точностью до десятых.)
6. К 700г водного раствора этанола с массовой долей 20% добавили 240мл С 2 Н 5 ОН (ρ=0,80г/мл.) Рассчитайте массу спирта в полученном растворе. Ответ: ________г. (Запишите с точностью до целых.)
7. Вычислите массу ледяной уксусной кислоты, которую следует растворить в 150 г столового 5%-ного уксуса для получения 8%-ного раствора. Ответ: ________г. (Запишите число с точностью до десятых.)
8. Из 150 г раствора с массовой долей бромида натрия 6% выпарили 10 г воды и добавили 5 г этой же соли. Вычислите массовую долю соли в полученном растворе. Ответ: ________%. (Запишите число с точностью до десятых.)
9. К 80г раствора с массовой долей хлорида кальция 25% добавили 10 г этой же соли. Сколько миллилитров воды надо добавить в полученный раствор для того, чтобы массовая доля соли равнялась 15%? Ответ: ________мл. (Запишите число с точностью до целых.)
(Запишите число с точностью до целых.)
10. К раствору хлорида магния массой 140г с массовой долей 10% добавили 10 г этой же соли и 25мл воды. Вычислите массовую долю соли в полученном растворе. Ответ: ________%. (Запишите число с точностью до десятых.)
11. Вычислите массовую долю бромоводородной кислоты в растворе, полученном при растворении 11,2 л бромоводорода (н.у.) в 1л воды. Ответ: ________%. (Запишите число с точностью до десятых.)
12. Смешали 25 г раствора гидроксида натрия с массовой долей16% и 30 мл раствора (ρ=1,2г/мл) с массовой долей этого же вещества 20%. Рассчитайте массовую долю гидроксида натрия в полученном растворе. Ответ: ________%. (Запишите число с точностью до десятых.)
13. Вычислите массу серной кислоты, содержащейся в 196 мл 10%-ного раствора кислоты (ρ=1,07г/мл). Ответ: ________г. (Запишите число с точностью до целых.)
14. При нагревании 200 г 25%-ного раствора аммиака 20 г этого же вещества улетучилось. Вычислите массовую долю аммиака в растворе после нагревания. Ответ: ________%. (Запишите число с точностью до десятых.)
Ответ: ________%. (Запишите число с точностью до десятых.)
15. Вычислите массу воды, которую надо выпарить из 1 кг 3%-ного раствора сульфата меди(II) для получения 5%-ного раствора. Ответ: ________г. (Запишите число с точностью до целых.)
16. К 50 г раствора нитрата кальция с массовой долей 4% добавили 1г этой же соли и 10г воды. Вычислите массовую долю соли в полученном растворе. Ответ: ________%. (Запишите число с точностью до десятых.)
17. Вычислите массу сульфата калия, которую необходимо растворить в 200г раствора с массовой долей 10% для получения раствора с массовой долей 15%. Ответ ________г. (Запишите число с точностью до десятых.)
18. К 500 мл 32%-ной кислоты плотностью 1,2 г/мл прибавили 1 л воды. Определите массовую долю кислоты в полученном растворе. Ответ: ________%. (Запишите число с точностью до целых.)
19. К раствору хлорида кальция, состоящему из воды массой 126 г и 14 г соли, добавили 10 г этой же соли и 25мл воды. Вычислите массовую долю соли в полученном растворе. Ответ: ________%. (Запишите число с точностью до десятых.)
Ответ: ________%. (Запишите число с точностью до десятых.)
20. Вычислите массовую долю хлороводорода в растворе, полученном при растворении 224 л HCI (н.у.) в 1 л воды. Ответ: ________%. (Запишите число с точностью до десятых.)
21. Вычислите массу сульфата железа(II), которую необходимо добавить к 800 г 5%-ного раствора этой соли для того, чтобы увеличить массовую долю соли до 12,5%. Ответ: ________г. (Запишите число с точностью до десятых.)
22. Какой объем 96%-ной серной кислоты (ρ=1,86г/мл) необходимо добавить к 5 л 30%-ной кислоты (ρ=1,3г/мл) для того, чтобы получить 40%-ный раствор? Ответ: ________мл. (Запишите число с точностью до целых.)
23. 32 г сульфата меди(II) растворили в 168 г воды. Раствор упарили, в результате концентрация соли увеличилась на 25%. Вычислите массу испарившейся воды. Ответ: ________г. (Запишите число с точностью до целых.)
24. Смешали 120 г раствора гидроксида натрия с массовой долей 15% и 8 г раствора этого же вещества с массовой долей 20%. Вычислите массовую долю щелочи в полученном растворе. Ответ: ________%. (Запишите число с точностью до десятых.)
Вычислите массовую долю щелочи в полученном растворе. Ответ: ________%. (Запишите число с точностью до десятых.)
25. К 1 л аккумуляторной серной кислоты (ρ=1,3г/мл, массовая доля кислоты 0,3) добавили 2 моль серной кислоты и 100 мл воды. Вычислите массовую долю кислоты в полученном растворе.
Ответ: ________%. (Запишите число с точностью до десятых.)
26. К 500 мл 30%-ной кислоты плотностью 1,15 г/мл прибавили 1л воды. Определите массовую долю кислоты в полученном растворе. Ответ: ________%. (Запишите число с точностью до целых.)
27. Смешали 250 г 16%-ного раствора гидроксида натрия и 300 мл 20%-ного (плотностью 1,2г/мл) раствора едкого натра. В полученный раствор добавили 50 мл воды. Рассчитайте массовую долю гидроксида натрия в растворе. Ответ: ________%. (Запишите число с точностью до сотых.)
28. После добавления карбоната натрия к 200 мл 16%-ного раствора карбоната натрия плотностью 1,17 г/мл массовая доля вещества в растворе возросла до 20%. Вычислите массу добавленного вещества. Ответ: ________г. (Запишите число с точностью до десятых.)
Ответ: ________г. (Запишите число с точностью до десятых.)
29. Вычислите массовую долю хлороводорода (%) в растворе, полученном при растворении 112 л (н.у.) HCI в 1л воды. Ответ: ________%. (Запишите число с точностью до десятых.)
30. Вычислите массу серной кислоты, содержащейся в 196 мл 10%-ного раствора серной кислоты (ρ=1,07г/мл). Ответ: ________г. (Запишите число с точностью до сотых.)
Расчёты с использованием понятия «массовая доля вещества в растворе». Часть 1
В начале страницы вы можете выполнить тест онлайн (после ввода ответа нажимайте кнопку «Проверить решение»: если ответ неверный, то вводите другой ответ, пока не введёте верный или нажмите кнопку «Показать ответ» и у вас появится правильный ответ на это задание и вы сможете перейти к следующему заданию). В середине страницы вы увидите текстовые условия заданий, а текстовые ответы представлены в конце страницы.
Задание 27
Вычислите массовую долю (в %) хлороводорода в растворе, полученном при растворении 11,2 л (н.
 у.) хлороводорода в 1 л воды. (Запишите число с точностью до десятых.)
у.) хлороводорода в 1 л воды. (Запишите число с точностью до десятых.)К раствору хлорида кальция массой 90 г с массовой долей 5 % добавили 10 г этой же соли. Массовая доля соли в полученном растворе равна _____ % . (Запишите число с точностью до десятых.)
К раствору нитрата кальция массой 80 г с массовой долей 4 % добавили 20 г этой же соли. Вычислите массовую долю соли в полученном растворе. (Запишите число с точностью до десятых.)
Смешали два раствора: один массой 130 г с массовой долей соли 6 %, другой массой 70 г с массовой долей этой же соли 2 %. Массовая доля соли, содержащейся в образовавшемся растворе, равна ____%. (Запишите число с точностью до десятых.)
К 180 г 4%-ного раствора ацетата калия добавили 120 г б%-ного раствора этой же соли. Массовая доля соли в полученном растворе равна ____%. (Запишите число с точностью до десятых.)
Смешали 120 г раствора нитрата калия с массовой долей 15 % и 80 г раствора этой же соли с массовой долей 20 %.
 Массовая доля соли в полученном растворе равна ____%. (Запишите число с точностью до целых.)
Массовая доля соли в полученном растворе равна ____%. (Запишите число с точностью до целых.)Какое количество (моль) вещества нитрата кальция необходимо для приготовления 820 г раствора с массовой долей 4 %? (Запишите число с точностью до десятых.)
Смешали 300 г раствора с массовой долей соли 20 % и 500 г раствора с массовой долей этой же соли 40 %. Массовая доля соли в полученном растворе равна ____%. (Запишите число с точностью до десятых.)
Смешали два раствора: один массой 120 г с массовой долей соли 15 % , другой массой 125 г с массовой долей этой же соли 10 %. Чему равна масса (г) соли, содержащейся в образовавшемся растворе? (Запишите число с точностью до десятых.)
К 300 г раствора нитрата калия с массовой долей 20 % добавили 40 г той же соли. Чему равна массовая доля (%) нитрата калия в полученном растворе? (Запишите число с точностью до десятых.)
К 110 г раствора с массовой долей хлорида натрия 20% добавили 22 мл воды и 18 г этой же соли.
 Вычислите массовую долю соли (в процентах) в полученном растворе. (Запишите число с точностью до десятых.)
Вычислите массовую долю соли (в процентах) в полученном растворе. (Запишите число с точностью до десятых.)Вычислите массовую доля серной кислоты (в процентах) в растворе, образующемся при смешивании 120 г 20%-ного и 40 г 50%-ного растворов этой же кислоты. (Запишите число с точностью до десятых.)
Вычислите массу соли (в граммах), которую нужно взять для приготовления 10 кг физиологического раствора с массовой долей хлорида натрия 0,85%. (Запишите число с точностью до целых.)
К 200 г 8%-ного раствора хлорида натрия добавили 80 г воды. Вычислите массовую долю соли (в процентах) в образовавшемся растворе. (Запишите число с точностью до десятых.)
Вычислите массовую долю ацетата натрия (в процентах) в растворе, полученном при добавлении 120 г воды к 200 г раствора с массовой долей соли 8%. (Запишите число с точностью до целых.)
Вычислите массовую долю хлорида аммония (в процентах) в растворе, полученном при добавлении 50 г воды к раствору, состоящему из 70 г воды и 20 г хлорида аммония.
 (Запишите число с точностью до десятых.)
(Запишите число с точностью до десятых.)Вычислите массу нитрата калия (в граммах), которую следует растворить в 150,0 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. (Запишите число с точностью до десятых.)
К раствору, состоящему из 45 г воды и 15 г соли, добавили 65 г воды и 10 г той же соли. Вычислите массовую долю (%) соли в полученном растворе. (Запишите число с точностью до десятых.)
К 100 г раствора с массовой долей хлорида натрия 15% добавили 35 мл воды и 25 г этой же соли. Вычислите массовую долю (%) соли в полученном растворе. (Запишите число с точностью до целых.)
К 110 г раствора с массовой долей хлорида магния 10% добавили 21 мл воды и 21 г этой же соли. Вычислите массовую долю (%) соли в полученном растворе. (Запишите число с точностью до целых.)
Смешали 70 г раствора с массовой долей нитрата натрия 30% и 130 г раствора этой же соли с массовой долей 20%.
 Вычислите массовую долю (%) соли в полученном растворе. (Запишите число с точностью до десятых.)
Вычислите массовую долю (%) соли в полученном растворе. (Запишите число с точностью до десятых.)Вычислите массу (г) уксусной кислоты, которую следует растворить в 150 г столового 5%-ного уксуса для получения 10%-ного раствора. (Запишите число с точностью до десятых.)
Смешали 120 г раствора с массовой долей нитрата натрия 25% и 80 г раствора этой же соли с массовой долей 50%. Вычислите массовую долю соли (в процентах) в полученном растворе. (Запишите число с точностью до целых.)
К 70 г раствора с массовой долей хлорида кальция 40% добавили 18 мл воды и 12 г этой же соли. Вычислите массовую долю соли (в процентах) в полученном растворе. (Запишите число с точностью до целых.)
К 115 г раствора с массовой долей хлорида натрия 20% добавили 58 мл воды и 2 г этой же соли. Вычислите массовую долю хлорида натрия (в процентах) в полученном растворе. (Запишите число с точностью до целых.)
К 130 г раствора с массовой долей нитрата магния 10% добавили 17 г этой же соли и выпарили 27 мл воды.
 Вычислите массовую долю нитрата магния (в процентах) в полученном растворе. (Запишите число с точностью до целых.)
Вычислите массовую долю нитрата магния (в процентах) в полученном растворе. (Запишите число с точностью до целых.)К раствору, состоящему из 70 г воды и 20 г хлорида аммония, добавили 50 г воды. Вычислите массовую долю соли (в процентах) в полученном растворе. (Запишите число с точностью до десятых.)
К 75 г раствора с массовой долей соли 14% добавили 10 г той же соли и 10 мл воды. Вычислите массовую долю (%) соли в полученном растворе. (Запишите число с точностью до десятых.)
Вычислите массу воды (в граммах), которую нужно выпарить из 200 г 12%‐го раствора нитрата натрия, чтобы получить раствор, в котором массовая доля соли равна 20%. Ответ округлите до целых.
Вычислите массу нитрата натрия (в граммах), которую нужно добавить к 500 г 20%‐го раствора нитрата натрия, чтобы получить раствор, в котором массовая доля соли равна 25%. Ответ округлите до десятых.
Ответы:
- 1,8
- 14,5
- 23,2
- 4,6
- 4,8
- 17
- 0,2
- 32,5
- 30,5
- 29,4
- 26,7
- 27,5
- 85
- 5,7
- 5
- 14,3
- 3,4
- 18,5
- 25
- 21
- 23,5
- 8,3
- 35
- 40
- 14
- 25
- 14,3
- 21,6
- 80
- 33,3
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
#егэпохимии Instagram posts (photos and videos)
Что я думаю о ЕГЭ? Как и у всего в нашей жизни, у ЕГЭ есть свои «+» и «-«. Лично я считаю, что плюсов гораздо больше. 👍Во-первых, это единственная система, которая позволяет школьнику как с Дальнего Востока, например, так и школьнику из Москвы НА РАВНЫХ УСЛОВИЯХ поступать в одни и те же вузы.
Для ребят из других городов это потрясающая возможность переехать при желании в другой город с минимальными ненужными затратами времени и денег. Не надо ехать сдавать внутренние экзамены во всех вузах по отдельности, готовиться к этим разным экзаменам, снимать жилью и тд. Требуется только самое главное — усердно заниматься и по-настоящему хорошо разобраться в предмете и критериях ЕГЭ. 👍Во-вторых, наоборот — это возможность ребятам с более низкими баллами поступить на бюджет в вузы с более щадящими проходными, в том числе в региональные. 👍В-третьих, есть относительно четкая регламентация того, что надо знать, а что нет. Есть определенный формат заданий и структура экзамена.
Многие тут говорят, что детей «натаскивают» на определенные типы заданий, экзамен не показывает реальных знаний и тд.
Мое мнение — «натаскаться» не так-то просто.
ЕГЭ развивает умение концентрироваться, быть внимательным, выполнять задание четко в соответствии с инструкцией. Я считаю, эти навыки очень важны, ведь на реальной работе будет также: вряд ли врачу или инженеру необходимо выполнять задание супер-творчески и «по-своему», обычно необходимо четко следовать определенному разработанному алгоритму, уметь мыслить в его рамках и эффективно применять.
В рамках алгоритма, одну и ту же задачу тоже можно решать разными способами, но получить при этом необходимо один и тот же точный, правильный результат.
Требуется только самое главное — усердно заниматься и по-настоящему хорошо разобраться в предмете и критериях ЕГЭ. 👍Во-вторых, наоборот — это возможность ребятам с более низкими баллами поступить на бюджет в вузы с более щадящими проходными, в том числе в региональные. 👍В-третьих, есть относительно четкая регламентация того, что надо знать, а что нет. Есть определенный формат заданий и структура экзамена.
Многие тут говорят, что детей «натаскивают» на определенные типы заданий, экзамен не показывает реальных знаний и тд.
Мое мнение — «натаскаться» не так-то просто.
ЕГЭ развивает умение концентрироваться, быть внимательным, выполнять задание четко в соответствии с инструкцией. Я считаю, эти навыки очень важны, ведь на реальной работе будет также: вряд ли врачу или инженеру необходимо выполнять задание супер-творчески и «по-своему», обычно необходимо четко следовать определенному разработанному алгоритму, уметь мыслить в его рамках и эффективно применять.
В рамках алгоритма, одну и ту же задачу тоже можно решать разными способами, но получить при этом необходимо один и тот же точный, правильный результат. 👍четвертых, коррупция при поступлении сведена к минимуму. Конечно, есть минусы, например: 1. Всеобщая паника вокруг ЕГЭ, его изменений, тотального контроля. Мне кажется, это все можно пережить. 2. На месте разработчиков, я бы выпускала сборники с заданиями, близкими по уровню сложности к реальному ЕГЭ, чтобы дети могли тренироваться. Огромное спасибо за это репетиторам и учителям, они делают эту работу за них. Ребята, не бойтесь ЕГЭ! Учитесь и любое задание будет вам по плечу! 🥰
👍четвертых, коррупция при поступлении сведена к минимуму. Конечно, есть минусы, например: 1. Всеобщая паника вокруг ЕГЭ, его изменений, тотального контроля. Мне кажется, это все можно пережить. 2. На месте разработчиков, я бы выпускала сборники с заданиями, близкими по уровню сложности к реальному ЕГЭ, чтобы дети могли тренироваться. Огромное спасибо за это репетиторам и учителям, они делают эту работу за них. Ребята, не бойтесь ЕГЭ! Учитесь и любое задание будет вам по плечу! 🥰
Патент США на процесс восстановления сульфата калия Патент (Патент № 7,041,268, выданный 9 мая 2006 г.)
ОБЛАСТЬ ИЗОБРЕТЕНИЯ Настоящее изобретение обеспечивает интегрированный способ извлечения сульфата калия (СОП) из богатой сульфатом биткойна. Для этого процесса в качестве сырья требуются только битум и известь, и кроме СОП, он дает низкое содержание бора, содержащее Mg (OH) 2 , гипс и соль в качестве побочных продуктов, причем все они получаются в чистом виде.
СОП представляет собой двойное удобрение, содержащее 50% K 2 O и 18% S. Оно имеет самый низкий солевой индекс и практически не содержит хлоридов, что делает его превосходным удобрением по сравнению с хлористым калием ( СС). С другой стороны, MOP легко производить, особенно когда рассол / выпь с низким содержанием сульфатов, например, в Мертвом море, и это объясняет его более низкую цену по сравнению с SOP. Такие страны, как Индия, которые не имеют низкосульфатной выпи, но имеют адекватную морскую выпь и субпочвенное происхождение, получили бы большую выгоду, если бы СОП можно было экономично производить из таких источников выпи.Помимо использования в качестве удобрения, сульфат калия также имеет множество промышленных применений.
Mg (OH) 2 коммерчески используется в целлюлозно-бумажной промышленности, а также в качестве антацида и антипирена. Очистка сточных вод и кислотных стоков представляет собой дополнительные области, в которых она активно растет. Mg (OH) 2 также используется для производства магния (MgO), карбоната магния и других химикатов магния. Mg (OH) 2 с низким содержанием примесей B 2 O 3 особенно подходит для производства тугоплавкого MgO.Высококачественный гипс (CaSO 4 .2H 2 O) находит применение в производстве белого цемента и для производства высокопрочного альфа- и бета-гипса в Париже. Хлорид натрия, содержащий небольшие количества хлорида калия, находит применение в производстве пищевой соли.
Mg (OH) 2 также используется для производства магния (MgO), карбоната магния и других химикатов магния. Mg (OH) 2 с низким содержанием примесей B 2 O 3 особенно подходит для производства тугоплавкого MgO.Высококачественный гипс (CaSO 4 .2H 2 O) находит применение в производстве белого цемента и для производства высокопрочного альфа- и бета-гипса в Париже. Хлорид натрия, содержащий небольшие количества хлорида калия, находит применение в производстве пищевой соли.
Ссылка делается на хорошо известный процесс Мангейма, включающий реакцию MOP с серной кислотой. Основная проблема процесса заключается в том, что он энергоемкий и создает проблему управления HCl, когда поблизости нет применения соразмерного объема для HCl.Дж. А. Фернандес Лозано и А. Винт («Производство сульфата калия с помощью процесса аммонизации», Chemical Engineer, 349, стр. 688–690, октябрь 1979 г.) описывают процесс производства СОП из СС посредством реакции с гипсом в присутствии аммиак.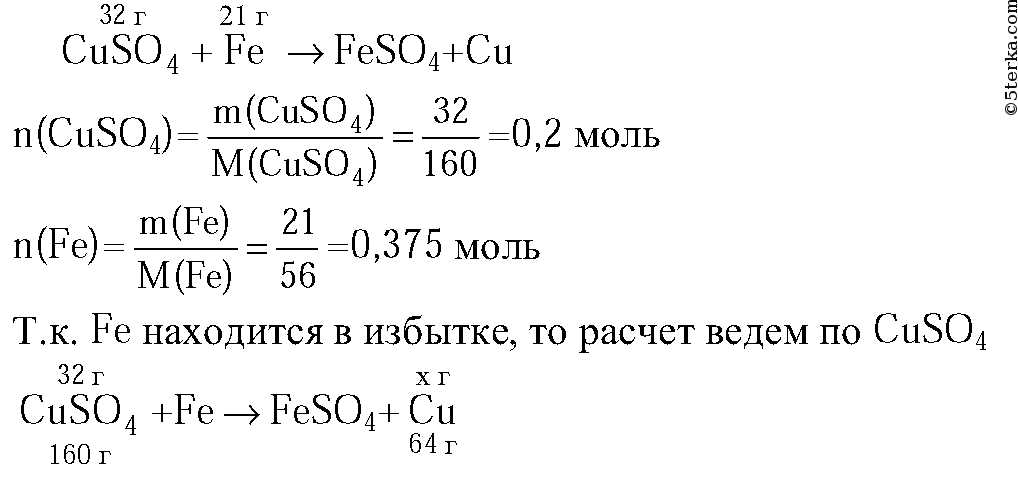 Принцип процесса заключается в реакции двойного разложения гипса и хлорида калия в присутствии аммиака при 0 ° C. Основным недостатком процесса является то, что он является энергоемким и требует тщательного проектирования реактора для безопасной работы.
Принцип процесса заключается в реакции двойного разложения гипса и хлорида калия в присутствии аммиака при 0 ° C. Основным недостатком процесса является то, что он является энергоемким и требует тщательного проектирования реактора для безопасной работы.
H. Scherzberg et al. («Мессо пилотирует новый процесс сульфата калия», Фосфор, и Калий, 178, март – апрель 1992 г., стр. 20) описывают успешные испытания процесса, включающего реакцию MOP с сульфатом натрия с получением глазерита с двойной солью ( 3K 2 SO 4 .Na 2 SO 4 ). Глазерит, в свою очередь, реагирует с MOP с образованием SOP. Главный недостаток процесса заключается в том, что он не подходит для тех, кто не имеет доступа к такому сырью.Более того, процесс включает в себя несколько сложных единичных операций, включая необходимость охлаждения. Такие процессы имеют свои ограничения в большом масштабе.
Х. Шерцберг и Р. Шмитц («Альтернатива Дуйсберга Мангейму», Фосфор и Калий, 178, март – апрель 1992 г. , стр. 20) описывают интегрированный процесс производства СОП из KCl и MgSO 4 или Na 2 SO 4 . Главный недостаток способа состоит в том, что количество NaCl в сырье имеет решающее влияние на процесс и, как таковое, менее применимо к сырой смешанной соли, полученной из морской выпи.Другой недостаток состоит в том, что процесс включает нагрев и охлаждение, что делает его энергоемким. Еще один недостаток заключается в том, что полученный побочный продукт представляет собой MgCl 2 в форме концентрированного раствора, который имеет ограниченный рынок и меньшую привлекательность по сравнению с низким B 2 O 3 , содержащим Mg (OH) 2 , твердое вещество, полученное как часть интегрированного процесса настоящего изобретения.
, стр. 20) описывают интегрированный процесс производства СОП из KCl и MgSO 4 или Na 2 SO 4 . Главный недостаток способа состоит в том, что количество NaCl в сырье имеет решающее влияние на процесс и, как таковое, менее применимо к сырой смешанной соли, полученной из морской выпи.Другой недостаток состоит в том, что процесс включает нагрев и охлаждение, что делает его энергоемким. Еще один недостаток заключается в том, что полученный побочный продукт представляет собой MgCl 2 в форме концентрированного раствора, который имеет ограниченный рынок и меньшую привлекательность по сравнению с низким B 2 O 3 , содержащим Mg (OH) 2 , твердое вещество, полученное как часть интегрированного процесса настоящего изобретения.
G. D. Bhatt et al. («Mixed Salt from Sea Bittern», Salt Research & Industry, 2, 126–128, 1969) описывают процесс производства смешанной соли, т.е.е., состоящий из смеси NaCl и каинита (KCl. MgSO43H 2 O), полученной из морской выпи путем испарения на солнце и фракционной кристаллизации.
MgSO43H 2 O), полученной из морской выпи путем испарения на солнце и фракционной кристаллизации.
Patel et al. ( Salt Research и Industry , Vol. 6, No. 14, 1969) раскрывают способ получения сингенита из смешанной соли в чистом виде. KP Patel, RP Vyas и K. Seshadri («Сульфат калия из сингенита», Salt Research и Industry , Vol. 6, No. 2, апрель 1969) раскрывают способ получения SOP выщелачиванием сингенита (K 2 СО 4 .CaSO 4 .H 2 O) горячей водой с последующим выделением ее путем испарения на солнце. Главный недостаток процесса — энергоемкость. Кроме того, производство сингенита из примесной соли само по себе является сложным делом.
K. Sehsadri et al (« Производство хлорида калия и побочных продуктов из морской выпи» Salt Research and Industry , апрель – июль 1970 г., том 7, стр. 39–44) описывают процесс, в котором смешанная соль (NaCl и каинит ), полученный из выпи, диспергируют в соответствующей пропорции с выпью высокой плотности и нагревают до температуры 110 ° C. когда образуется кизерит (MgSO 4 .H 2 O), который отделяется фильтрованием суспензии в горячих условиях. Фильтрат охлаждают до температуры окружающей среды, когда карналлит выкристаллизовывается. Карналлит разлагается водой, чтобы получить твердую смесь хлорида натрия и хлорида калия, а хлорид магния переходит в раствор. Твердая смесь хлорида калия и хлорида натрия очищается известными методами для получения чистого хлорида калия. Недостатки этого процесса заключаются в том, что он не использует сульфат, содержащийся в выпь, и вместо этого предлагает сложный процесс производства MOP, который в любом случае уступает SOP в качестве удобрения.
когда образуется кизерит (MgSO 4 .H 2 O), который отделяется фильтрованием суспензии в горячих условиях. Фильтрат охлаждают до температуры окружающей среды, когда карналлит выкристаллизовывается. Карналлит разлагается водой, чтобы получить твердую смесь хлорида натрия и хлорида калия, а хлорид магния переходит в раствор. Твердая смесь хлорида калия и хлорида натрия очищается известными методами для получения чистого хлорида калия. Недостатки этого процесса заключаются в том, что он не использует сульфат, содержащийся в выпь, и вместо этого предлагает сложный процесс производства MOP, который в любом случае уступает SOP в качестве удобрения.
Заявка на патент США № 2003/0080066 от 29 октября 2001 г., выданная Vohra, Rajinder N. et. al. раскрывает интегрированный способ извлечения соли высокой чистоты, хлорида калия и конечной выпи, содержащей 7,5 г / л Br. Процесс основан на десульфатации рассола отходами дистилляционной промышленности кальцинированной соды или хлоридом кальция, полученным из известняка и кислоты. Основным недостатком заявки на патент является то, что процесс менее привлекателен, когда поблизости нет отходов дистиллятора, и процесс становится менее экономичным, когда карналлит должен быть получен из выпи без производства соли промышленного качества.Более того, как и в случае, упомянутом выше, желательно использовать сульфат, содержащийся в выпи, и производить СОП, а не СОП.
Основным недостатком заявки на патент является то, что процесс менее привлекателен, когда поблизости нет отходов дистиллятора, и процесс становится менее экономичным, когда карналлит должен быть получен из выпи без производства соли промышленного качества.Более того, как и в случае, упомянутом выше, желательно использовать сульфат, содержащийся в выпи, и производить СОП, а не СОП.
Майкл Фриман («Большое Соленое озеро — плодородный урожай для IMC» в Phosphorus, & Kalium, 225, январь – февраль 2000 г.) описывает процесс, включающий концентрирование рассола, содержащего 0,2–0,4% KCl, сбор смешанной соли. , разделение фракции с высоким содержанием хлорида натрия посредством флотации, выщелачивание насыщенным сульфатом рассолом для получения шенита, растворение шенита в горячей воде, фракционная кристаллизация SOP и рециркуляция маточного раствора, содержащего до 30% исходного калия, в пруд-испаритель.Основными недостатками процесса являются: (i) необходимость флотации, которая включает использование органических химикатов, удаление которых проблематично, (ii) потребность во внешнем тепле для извлечения СОП из шенита посредством фракционной кристаллизации при повышенной температуре, (iii) потребность в рециркуляция до 30% калия в пруды-испарители, где он снова загрязняется другими компонентами рассола.
В энциклопедии промышленной химии Ульмана, шестое издание, 1999 г., в разделе «Соединения калия» дается описание процесса производства СОП на Сицилии, каинита (KCl.MgSO 4 .2.75H 2 O), получают из калийной руды путем флотации. Затем он преобразуется в шенит примерно при 30 мин. 25 ° C путем перемешивания с маточным раствором, содержащим сульфаты калия и магния с более поздних стадий процесса. Шенит отфильтровывают и разлагают водой при температуре ок. 48 ° C. Это вызывает растворение сульфата магния и часть сульфата калия и кристаллизацию большей части сульфата калия. Кристаллы фильтруют и сушат. Сульфатный маточный раствор рециркулируют на стадию конверсии каинита в шенит.Основными недостатками процесса являются отсутствие упоминания о судьбе маточного раствора, полученного при превращении каинита в шенит, что неизбежно повлечет за собой значительную потерю калия, а также необходимость во внешнем источнике тепла для осуществления фракционной кристаллизации СОП.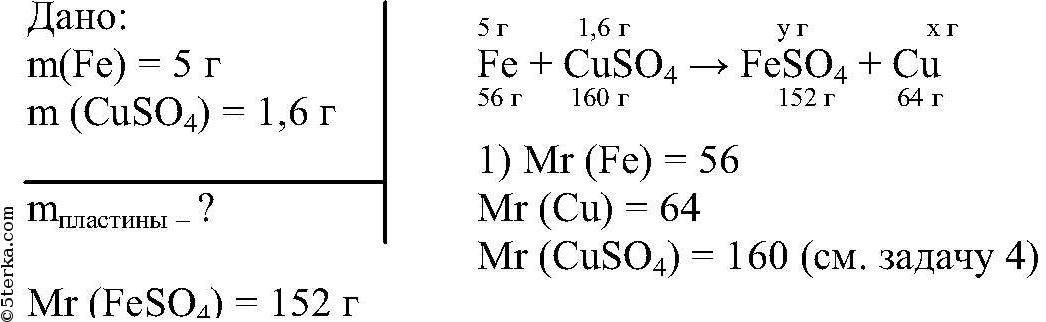 .
.
Патент Китая № 1281822, соответствующий заявке № CN 2000-112497, 29 августа 2000 г., Song, Wenyi; Лю, Ю; Чжао, Шисян; Dai, Fangfa, озаглавленный способ получения K 2 SO 4 из сульфатного типа K-содержащей выпь.Способ включает концентрирование выпи, отделение NaCl, концентрирование для получения сырой соли K-Mg, содержащей 10–45% NaCl, измельчение, смешивание с насыщенной выпью для получения раствора с концентрацией 20–40%, удаление NaCl обратной флотацией, концентрирование, обезвоживание для получения очищенной соли K-Mg, содержащей менее 5% NaCl, смешивание соли K-Mg и воды в заданном соотношении, позволяя смеси реагировать при 10-60 ° P в течение 0,5-3 часов, разделение с получением шенита , смешивание с KCl и водой в заданном соотношении, позволяя смеси реагировать при 10–70 ° F.в течение 0,25–3 ч и разделение с получением K 2 SO 4 . Недостатками процесса являются (i) необходимость в тщательно продуманном методе очистки смешанной соли, который включает удаление NaCl менее желательным методом обратной флотации, который включает использование органических химикатов, (ii) отсутствие какого-либо упоминания способа, которым рассматриваются различные сточные потоки и (iii) зависимость от KCl, переданного на аутсорсинг, поскольку не упоминается какой-либо процесс производства KCl как часть процесса.
Дж.Х. Хильдебранд («Извлечение калия и других компонентов из морской выпи» в Journal of Industrial and Engineering Chemistry, Vol. 10, No. 2, 1918, pp 96–106) описывает теоретические аспекты восстановления калийных удобрений из морской выпи. и предложить способ извлечения. В соответствии с этим процессом биттер выпаривается при температуре 100–120 ° C, образуя твердую смесь хлорида натрия и кизерита (MgSO 4 .H 2 O), разделяя эту смесь в горячих условиях в центрифугу с подогревом и охлаждение маточного раствора в холодильнике для отделения карналлита.Карналлит разлагается и промывается водой с образованием хлорида калия. Недостатком этого процесса является то, что он требователен с точки зрения потребности в энергии, и невозможно получить достаточно чистый карналлит. Основным недостатком способа является загрязнение кизерита NaCl, что потребует дополнительной очистки для получения продуктов в товарной форме. Другой недостаток способа состоит в том, что он требует энергии для удаления сульфата из выпи в форме кизерита, тогда как было бы предпочтительно использовать сульфат для производства SOP.
DJ Mehta et al («Производство сульфата калия из смешанной соли, полученной на соляных заводах Little Rann Of Kutch» Salt Research & Industry , Vol. 2 No. 4, October 1965) описывают процесс с использованием техники флотации. для производства сульфата калия из двух типов смешанной соли, которую можно получить на соляных заводах Маленького Ранна в Кутче. Недостатком способа является его непригодность при использовании морской выпи с высоким содержанием сульфатов и необходимость пенной флотации, которая является дорогостоящей, громоздкой и загрязняющей.
Ссылка сделана на главу в Энциклопедии промышленной химии Ульмама, шестое издание, 2002 г. (электронная версия), посвященную соединениям магния, написанную Маргарет Зигер, Вальтером Отто, Вильгельмом Флихом, Фридрихом Бикельгауптом и Отто. С. Аккерман, где описан процесс получения гидроксида магния из морской воды. В нем упоминается, что получение магнезии с низким содержанием бора требует чрезмерного известкования морской воды до pH 12 для поддержания содержания B 2 O 3 ниже 0. 05% в магнезии. Избыточное известкование связано с более высокой стоимостью извести, необходимостью нейтрализации супернатанта и приводит к получению коллоидной суспензии, которую нелегко фильтровать. Другим недостатком является отсутствие сточных вод, содержащих хлорид кальция, которые сбрасываются обратно в море.
05% в магнезии. Избыточное известкование связано с более высокой стоимостью извести, необходимостью нейтрализации супернатанта и приводит к получению коллоидной суспензии, которую нелегко фильтровать. Другим недостатком является отсутствие сточных вод, содержащих хлорид кальция, которые сбрасываются обратно в море.
Патентная заявка № 423211, CA 1203666, Вендлинг и др., Озаглавленная «Способ производства сульфата калия обработкой раствора, содержащего хлорид магния и хлорид калия», описывает способ производства сульфата калия из растворов, содержащих хлорид магния. , например, растворы карналлитовой руды и, в частности, равновесные маточные растворы установки для обработки карналлита.В соответствии с этим процессом к растворам, содержащим хлорид магния, добавляют сульфат натрия и хлорид калия, чтобы осадить хлорид натрия и шенит, K 2 SO 4 MgSO 4 6H 2 O, и получают шенит. обрабатывается известным способом для получения сульфата калия. Основным недостатком процесса является необходимость передачи сульфата натрия на аутсорсинг и отсутствие какого-либо упоминания о решении проблемы потери KCl в отходящих потоках.
Основным недостатком процесса является необходимость передачи сульфата натрия на аутсорсинг и отсутствие какого-либо упоминания о решении проблемы потери KCl в отходящих потоках.
H.Гурбуз и др. («Извлечение солей калия из выпи кристаллизацией пентабората калия» в Separation Science & Technology, 31 (6), 1996, стр. 857–870) раскрывают получение пентаботата натрия из реакции Тинкала и рециклированного H 3 BO 3 в присутствии воды с последующей обработкой солевым раствором для селективного осаждения пентабората калия, который, в свою очередь, подкисляется серной кислотой и фракционно кристаллизуется для удаления K 2 SO 4 и рециркуляции H 3 BO 3 в процессе. Основные недостатки процесса заключаются в том, что маточный раствор содержит значительные количества бора, что влечет за собой сложную процедуру выделения бора, и, кроме того, MgO, полученный из такого маточного раствора, будет непригоден для промышленного использования . Более того, хотя такой способ все еще можно рассматривать для бедной сульфатом выпи, он не был бы предпочтительным путем, когда выпь богата сульфатом. Еще одним недостатком является необходимость охлаждения подкисленного продукта для получения высокого выхода.
Более того, хотя такой способ все еще можно рассматривать для бедной сульфатом выпи, он не был бы предпочтительным путем, когда выпь богата сульфатом. Еще одним недостатком является необходимость охлаждения подкисленного продукта для получения высокого выхода.
A. S. Mehta ( Indian Chemical Engineer, 45 (2), 2003, стр. 73) описывает процесс производства брома из выпи. Выпь подкисляют серной кислотой до pH 3,0–3,5, а затем бромид-ион окисляют хлором и удаляют с помощью пара.Кислый дебромированный биттер нейтрализуется известью, образовавшийся таким образом шлам удаляется, а сточные воды сливаются. Бромные заводы, расположенные поблизости от естественных соляных пластов в Большом Ранне Кач в Гуджарате, Индия, используют природную выпь для производства брома вышеуказанным методом и сбрасывают свои сточные воды обратно в Ранн. Утилизация ила на этих предприятиях представляет собой серьезную проблему.
Chr. Баларев, Д. Рабаджиева и С. Тепавичарова (Международный симпозиум по солям « Улучшенная обработка рассолов», 2000, стр. 531–554) описывают восстановление морских химикатов.Авторы описывают использование извести для осаждения Mg (OH) 2 из части имеющейся выпи и десульфатации остальной выпи с полученным раствором CaCl 2 для восстановления KCl через карналлит. Авторы не обсуждали какую-либо схему использования такой методики для производства СОП из сульфатной выпи. Более того, как станет очевидно позже, Mg (OH) 2 , полученный непосредственно из сырой выпи, имеет гораздо более высокое содержание B 2 O 3 по сравнению с Mg (OH) 2 , полученным из источника Mg 2+ . настоящего изобретения, которое связано с производством СОП.
531–554) описывают восстановление морских химикатов.Авторы описывают использование извести для осаждения Mg (OH) 2 из части имеющейся выпи и десульфатации остальной выпи с полученным раствором CaCl 2 для восстановления KCl через карналлит. Авторы не обсуждали какую-либо схему использования такой методики для производства СОП из сульфатной выпи. Более того, как станет очевидно позже, Mg (OH) 2 , полученный непосредственно из сырой выпи, имеет гораздо более высокое содержание B 2 O 3 по сравнению с Mg (OH) 2 , полученным из источника Mg 2+ . настоящего изобретения, которое связано с производством СОП.
Патент Китая № 1084492, Лу Чжэн, описывает процесс производства СОП из выпи и хлорида калия. В этом процессе биттер обрабатывается выпариванием, охлаждением, флотацией, а затем реагирует с хлоридом калия с образованием сульфата калия и побочных продуктов промышленной соли и остаточного рассола. Основные недостатки этого процесса заключаются в том, что он требует сложных методов разделения, таких как флотация, для удаления NaCl из смешанной соли, а KCl, необходимый для производства СОП из шенита, необходимо приобретать отдельно.Более того, хотя общий выход по извлечению калия составляет 95%, выход в отношении такого добытого KCl не упоминается.
Основные недостатки этого процесса заключаются в том, что он требует сложных методов разделения, таких как флотация, для удаления NaCl из смешанной соли, а KCl, необходимый для производства СОП из шенита, необходимо приобретать отдельно.Более того, хотя общий выход по извлечению калия составляет 95%, выход в отношении такого добытого KCl не упоминается.
Важной целью настоящего изобретения является получение улучшенного удобрения, СОП, из источников, богатых сульфатами, таких как морская выпь и натуральная выпь (включая подпочвенную выпь и выпь с высоким содержанием калия), которые содержит эффективные количества K, Mg и SO 4 , подходящие для производства каинита экономически эффективным способом за счет интеграции с производством ценных побочных продуктов.
Другая цель состоит в том, чтобы избавиться от необходимости во флотации для удаления NaCl из смешанной соли и вместо этого выщелачивать NaCl из маточного раствора (SEL) и одновременно превращать каинит в шенит.
Другой целью является производство SOP из шенита в условиях окружающей среды с помощью известного метода реакции с KCl в присутствии воды, при этом MOP генерируется из SEL, что исключает необходимость его внешнего источника,
Другой целью является максимальное извлечение поташ в виде СОП из смешанной соли.
Другой целью является рентабельная десульфатирование SEL для стимулирования образования карналлита.
Другой целью является испарение десульфатированного SEL в многоцелевом испарителе для восстановления воды для повторного использования.
Другой целью является использование выделенного NaCl в виде пищевой соли.
Другой целью является использование разложенного щелока (CDL), обогащенного MgCl 2 , для рентабельного производства CaCl 2 и Mg (OH) 2 посредством обработки известью.
Другой целью является использование промывных вод от Mg (OH) 2 для получения гашеной извести из негашеной извести, которая сохраняет воду и рециркулирует остаточный CaCl 2 в промывках.
Другой целью является использование вышеупомянутого раствора CaCl 2 для десульфатации SEL.
Другой целью является восстановление KCl, который теряется в CDL, путем рециркуляции последнего способом, описанным выше.
Другая цель — показать, что MgO, полученный из вышеуказанного Mg (OH) 2 , содержит очень низкое (<0.03%) уровни примеси B 2 O 3 .
Другая цель — минимизировать образование стоков в процессе и вместо этого использовать сточные воды для увеличения извлечения калийных удобрений или преобразования в продукты с добавленной стоимостью.
Другой целью является замена обычно используемой гашеной извести на Mg (OH) 2 , образующийся в процессе изобретения для нейтрализации кислой дебромированной выпи, чтобы исключить образование осадка, когда кислоты, такие как серная кислота, используются для подкисления выпи, а вместо нее сделайте такую выпь сразу полезной для производства смешанной соли. Горечь, используемая в изобретении, регенерирует наименьшее количество испарений для получения смешанной соли каинита и отработанных источников горечи, включая дебромированные сточные воды.
Горечь, используемая в изобретении, регенерирует наименьшее количество испарений для получения смешанной соли каинита и отработанных источников горечи, включая дебромированные сточные воды.
Настоящее изобретение обеспечивает интегрированный способ получения сульфата калия из горечи, включающий
- (i) фракционную кристаллизацию выпи для получения смешанной соли типа каинита с высоким содержанием каинита и MgCl. 2 — конечная выпь с богатым содержанием MgCl2 и десульфатация конечной выпи с высоким содержанием MgCl2;
- (ii) обработка смешанной соли типа каинита водой и маточным раствором, полученным на стадии (xiii) ниже, для выщелачивания практически всего NaCl из смешанной соли и одновременного превращения каинита в шенит;
- (iii) фильтрование шенита и отделение фильтрата,
- (iv) десульфатирование фильтрата водным CaCl 2 ;
- (v) фильтрация гипса, полученного на стадии (iv), и смешивание фильтрата с фильтратом, обогащенным MgCl 2 , полученным на стадии (vii) ниже,
- (vi) выпаривание раствора, полученного на стадии (v), и охлаждение до температуры окружающей среды для кристаллизации сырого карналлита,
- (vii) центрифугирование сырого карналлита и возврат необходимого количества фильтрата на стадию (v),
- (viii) разложение сырого карналлита с соответствующим количеством воды со стадии (vi) с получением неочищенного раствора KCl и разложенного карналлита;
- (ix) фильтрация неочищенного KCl и промывка водой для удаления приставшего MgCl 2 и горячее выщелачивание для получения MOP и NaCl,
- (x) смешивание щелока, разложившегося на карналлите, со стадии (viii) и промывка со стадии (ix) и обработки гашеной известью,
- (xi) фильтруют суспензию и промывают лепешку с получением Mg (OH) 2 и CaCl 2 -содержащего фильтрата для процесса десульфатирования на стадии (iv).

- (xii) обработка известным способом шенита, полученного на стадии (iii), с помощью MOP, полученного на стадии (ix), для получения SOP в условиях окружающей среды,
- (xiii) фильтрация SOP и сбор отдельно маточного раствора, далее именуемого KEL,
- (xiv) повторное использование KEL стадии (xiii) в процессе стадии (ii).
Можно отметить, что определенные этапы вышеупомянутого процесса инициируются сначала CaCl 2 и водой, полученной извне, а затем они в значительной степени генерируются в процессе изобретения, как описано выше.В одном варианте осуществления изобретения смешанная соль содержит KCl — 15–22%, NaCl — 15–22%, MgSO 4 — 28–40%, MgCl 2 — 5–10%.
В варианте осуществления настоящего изобретения биттеры с плотностью в диапазоне 29–34 ° Be (удельная масса 1,25–1,31) используются для производства смешанной соли, как описано в предшествующем уровне техники, а затем превращаются в шенит с одновременное выщелачивание NaCl из твердой массы.
В другом варианте настоящего изобретения смешанную соль обрабатывают 0.3–0,5: 1 соотношение воды и KEL с высоким содержанием KCl и MgSO 4 и низким содержанием NaCl и MgCl 2 для минимизации потерь K из смешанной соли без затруднения превращения каинита в шенит и выщелачивания NaCl из смешанной соли. .
В другом варианте осуществления настоящего изобретения шенит взаимодействует с MOP и водой в соотношении 1: 0,3–0,6: 1-2 с образованием SOP и KEL, и при этом MOP получают in situ из SEL.
В другом варианте настоящего процесса MOP получают из карналлита, который, в свою очередь, получают десульфатацией SEL, обработкой 400–440 г / л раствора MgCl 2 в соотношении 1 часть десульфатированной выпи и 0.7–0,9 частей раствора MgCl 2 и принудительное выпаривание до тех пор, пока раствор не достигнет температуры 120–128 ° C при атмосферном давлении.
В другом варианте настоящего процесса фильтрат, полученный после удаления NaCl, охлаждают до комнатной температуры, в результате чего при фильтрации получают карналлит, в то время как фильтрат содержит 400–440 г / л MgCl 2 и возвращается обратно в свежий партия десульфатированного SEL для дальнейшего производства карналлита.
В другом варианте настоящего процесса влажный карналлит обрабатывают водой в соотношении 1: 0.4–0,6 для получения сырого KCl.
В другом варианте настоящего процесса хлорид магния в щелоке после разложения карналлита дополняется MgCl 2 в конечном растворе и обрабатывается на линии для получения Mg (OH) 2 и необходимого количества раствора хлорида кальция (20 –30% (вес / объем) для десульфатирования SEL.
В другом варианте настоящего процесса Mg (OH) 2 прокаливают в диапазоне температур 800-900 ° C с получением MgO с <0.04% B 2 O 3 .
В другом варианте настоящего процесса потребность в свежей воде сводится к минимуму за счет рециркуляции воды со стадии принудительного испарения вместе с промывкой, образующейся при очистке гипса, Mg (OH) 2 и KCl.
В другом варианте настоящего процесса подкисленный дебромированный биттер, который является идеальным сырьем для смешанного производства, нейтрализуется неочищенным Mg (OH) 2 вместо извести, чтобы исключить образование осадка.
Основным изобретательским шагом является признание того факта, что стадия превращения каинита в смешанной соли в шенит и выщелачивание NaCl из смешанной соли можно одновременно выполнять за одну операцию с минимальными потерями KCl в смешанной соли. Другим изобретательским шагом является самообеспечение, при котором потребность в внешнем MOP сводится к минимуму за счет производства его вместо фильтрата отходов производства шенита. Другим изобретательским шагом является десульфатирование SEL, необходимого для производства MOP, с использованием хлорида кальция, генерируемого in situ из MgCl 2 в десульфатированном SEL, который проявляется как потоки, обогащенные MgCl 2 , щелока, разложенного карналлитом, и конечного щелока.Другим изобретательским шагом является сочетание производства Mg (OH) 2 с десульфатацией SEL и, таким образом, устранение проблемы обращения с отходами CaCl 2 , которые обычно встречаются при производстве Mg (OH) 2 из рассола или солевой смеси. — это использование CDL в первую очередь для производства Mg (OH) 2 , что значительно снижает примеси B 2 O 3 в Mg (OH) 2 и, как следствие, в MgO, полученном оттуда. Еще одним изобретательским шагом является местное использование сырого Mg (OH) 2 для нейтрализации подкисленной дебромированной выпи перед получением смешанной соли.Еще одним изобретательским шагом является рециркуляция жидких стоков для минимизации потребности в пресной воде при одновременном повышении извлечения и решении проблемы удаления стоков.
— это использование CDL в первую очередь для производства Mg (OH) 2 , что значительно снижает примеси B 2 O 3 в Mg (OH) 2 и, как следствие, в MgO, полученном оттуда. Еще одним изобретательским шагом является местное использование сырого Mg (OH) 2 для нейтрализации подкисленной дебромированной выпи перед получением смешанной соли.Еще одним изобретательским шагом является рециркуляция жидких стоков для минимизации потребности в пресной воде при одновременном повышении извлечения и решении проблемы удаления стоков.
Следующие ниже примеры даны для иллюстрации и не должны рассматриваться как ограничивающие объем настоящего изобретения.
ПРИМЕР-1 В типичном процессе 200 M 3 морской выпь 29,5 ° Be ‘(уд. Вес 1,255) подвергали солнечному испарению в поддоне с облицовкой.Первую фракцию (20 тонн), содержащую в основном сырую соль, удаляли при 34 ° Ве ‘(удельная масса 1,306). Затем выпаривали до 35,5 ° Ве ‘(удельная масса 1,324) и сели Mixt. фракция (15 тонн) была отделена. Полученную выпь (100 M 3 ) перенесли во вторую облицованную чашу и продолжили солнечное испарение, после чего получили 16 тонн смешанной соли каинитового типа и 26 M 3 конечной выпи. Смешанную соль дополнительно обрабатывали для получения шенита, как описано в последующих примерах, в то время как часть конечной выпи десульфировали с использованием стороннего хлорида кальция для получения десульфатированной конечной выпи.Часть десульфатированной конечной выпи затем обрабатывали гашеной известью для получения хлорида кальция и гидроксида магния. Раствор хлорида кальция фильтровали и использовали для десульфатирования SEL из Примера-6. Другую часть десульфатированной конечной выпи использовали в качестве источника MgCl 2 в том же примере для стимулирования образования карналлита из десульфатированного SEL. Аналогичные эксперименты были проведены с другими источниками выпи, такими как подпочвенная выпь и выпь, полученная после извлечения брома.
Затем выпаривали до 35,5 ° Ве ‘(удельная масса 1,324) и сели Mixt. фракция (15 тонн) была отделена. Полученную выпь (100 M 3 ) перенесли во вторую облицованную чашу и продолжили солнечное испарение, после чего получили 16 тонн смешанной соли каинитового типа и 26 M 3 конечной выпи. Смешанную соль дополнительно обрабатывали для получения шенита, как описано в последующих примерах, в то время как часть конечной выпи десульфировали с использованием стороннего хлорида кальция для получения десульфатированной конечной выпи.Часть десульфатированной конечной выпи затем обрабатывали гашеной известью для получения хлорида кальция и гидроксида магния. Раствор хлорида кальция фильтровали и использовали для десульфатирования SEL из Примера-6. Другую часть десульфатированной конечной выпи использовали в качестве источника MgCl 2 в том же примере для стимулирования образования карналлита из десульфатированного SEL. Аналогичные эксперименты были проведены с другими источниками выпи, такими как подпочвенная выпь и выпь, полученная после извлечения брома.
142,0 кг смешанной соли типа каинита, имеющей химический состав: KCl — 15,5%, NaCl — 14,6%, MgSO 4 — 39,5% и, обрабатывали 140 л воды и перемешивали в течение 2,5 часов. в сосуде. Суспензию фильтровали с использованием корзиночной центрифуги и получали 32,0 кг шенита в виде твердого продукта, анализируя K 2 SO 4 — 38,0%, MgSO 4 — 30,2% и NaCl — 1,2%, и 200 л фильтрата ( SEL), анализируя KCl — 7,6, NaCl — 16,1%, MgSO 4 —21.1%, а MgCl 2 —8,4%. Шенит обрабатывали раствором 12,5 кг MOP в 49,0 л воды при перемешивании в течение 3,5 часов. Суспензию фильтровали с получением 16,0 кг SOP, анализируя K 2 SO 4 —95,0%, NaCl — 1,0%, MgSO 4 —1,0% и 60 л фильтрата (KEL), анализируя KCl — 15,0%. NaCl — 1,5%, MgSO 4 — 9,7%, MgCl 2 — 3,9%.
ПРИМЕР-3 60,0 кг смешанной соли, имеющей такой же состав, как в Примере-2, брали вместе с KEL, полученным в Примере-2.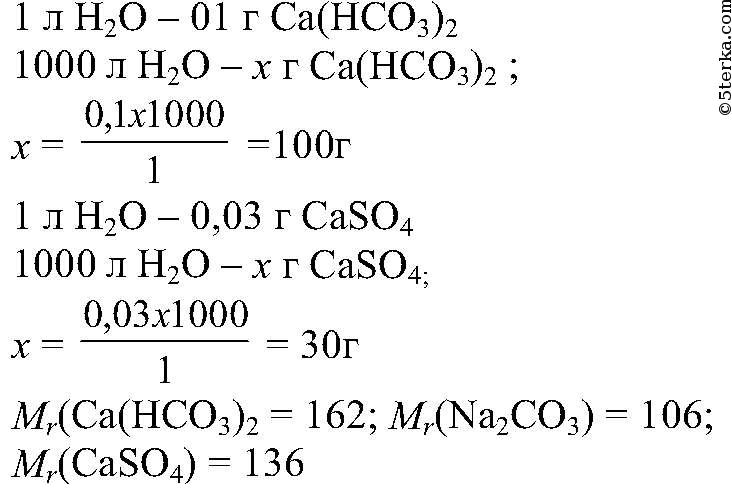 Дополнительно добавляли 27 л воды и содержимое перемешивали в течение 2,5 часов. Суспензию фильтровали на центрифуге, чтобы получить 26,0 кг шенита, анализируя K 2 SO 4 —39,7%, MgSO 4 —29,5%, NaCl — 0,7% и MgCl 2 —0,6% и 95,0 Л фильтрата (SEL), анализируя как KCl — 9,9%, NaCl — 13,0%, MgSO 4 — 18,6% и MgCl 2 — 6,0% d. Шенит реагировал с раствором 10,4 кг MOP в 38 л воды в сосуде при перемешивании в течение 3.5 ч. Полученную суспензию фильтровали с помощью центрифуги для получения 14,5 кг SOP, анализирующего K 2 SO 4 -98,1, NaCl-0,2%, MgSO 4 -1,4% и 45 л фильтрата (KEL), анализируемого как K 2 SO 4 —12,4%, KCl — 6,15%, NaCl — 0,9%, MgSO 4 —1,0% и MgCl 2 —10,2%,
Дополнительно добавляли 27 л воды и содержимое перемешивали в течение 2,5 часов. Суспензию фильтровали на центрифуге, чтобы получить 26,0 кг шенита, анализируя K 2 SO 4 —39,7%, MgSO 4 —29,5%, NaCl — 0,7% и MgCl 2 —0,6% и 95,0 Л фильтрата (SEL), анализируя как KCl — 9,9%, NaCl — 13,0%, MgSO 4 — 18,6% и MgCl 2 — 6,0% d. Шенит реагировал с раствором 10,4 кг MOP в 38 л воды в сосуде при перемешивании в течение 3.5 ч. Полученную суспензию фильтровали с помощью центрифуги для получения 14,5 кг SOP, анализирующего K 2 SO 4 -98,1, NaCl-0,2%, MgSO 4 -1,4% и 45 л фильтрата (KEL), анализируемого как K 2 SO 4 —12,4%, KCl — 6,15%, NaCl — 0,9%, MgSO 4 —1,0% и MgCl 2 —10,2%,
104 кг смешанной соли, анализирующей KCl -14,1%, NaCl-16,5%, MgSO4-41,6%, вводили в реакцию со 100 л KEL, анализируя как K 2 SO 4 -13. 9%, 2,8% NaCl и 11,6% MgCl 2 и 40 л воды в течение 2 часов. Суспензию центрифугировали, чтобы получить 34,8 кг шенита, анализируя K 2 SO 4 —37,0%, MgSO 4 —30,3% и NaCl — 4,9%, и 190,0 л фильтрата (SEL), анализируемого как KCl — 9,5. %, NaCl —13,0010%, MgSO 4 —15,1%, MgCl 2 —8,0%, и. Затем шенит подвергали взаимодействию с раствором 12,5 кг MOP в 46,0 л воды в течение 3,5 часов с получением 17,5 кг SOP и 80 л KEL. СОП анализируется как K 2 SO 4 —97.3%, NaCl — 0,2% и MgSO 4 — 3,0% и KEL в виде KCl — 16,7%, NaCl — 1,3%, MgSO 4 — 11,0% и MgCl 2 — 2,7%.
9%, 2,8% NaCl и 11,6% MgCl 2 и 40 л воды в течение 2 часов. Суспензию центрифугировали, чтобы получить 34,8 кг шенита, анализируя K 2 SO 4 —37,0%, MgSO 4 —30,3% и NaCl — 4,9%, и 190,0 л фильтрата (SEL), анализируемого как KCl — 9,5. %, NaCl —13,0010%, MgSO 4 —15,1%, MgCl 2 —8,0%, и. Затем шенит подвергали взаимодействию с раствором 12,5 кг MOP в 46,0 л воды в течение 3,5 часов с получением 17,5 кг SOP и 80 л KEL. СОП анализируется как K 2 SO 4 —97.3%, NaCl — 0,2% и MgSO 4 — 3,0% и KEL в виде KCl — 16,7%, NaCl — 1,3%, MgSO 4 — 11,0% и MgCl 2 — 2,7%.
В этом эксперименте 150,0 кг смешанной соли, анализируемой как KCl — 13,1%, NaCl — 19,8%, MgSO 4 — 38,0%, MgCl 2 — 1,9%, и были взяты в сосуд по с 160 л KEL, анализируя KCl — 17,0%, NaCl — 3,3%, MgSO 4 —9,0%, MgCl 2 —1,9% и 60 л воды и перемешивали в течение 2 часов. Полученную суспензию центрифугировали, чтобы получить 49.9 кг шенита с анализом K 2 SO 4 —42,0%, MgSO 4 —32,2%, NaCl — 0,7% и 255 л фильтрата (SEL), анализируемого как KCl — 10,5%, NaCl — 12,3%, MgSO 4 —13,7%, MgCl 2 —6,70%. Шенит реагировал с раствором 19,0 кг MOP в 75 л воды в течение 3,5 часов в сосуде при непрерывном перемешивании. Суспензию центрифугировали, чтобы получить 27,0 кг СОП, проанализированного как K 2 SO 4 — 94,3%, NaCl — 0,2% и MgSO 4 — 3,7%, и 85 л фильтрата (KEL), анализируя как KCl. -15.5%, NaCl — 0,8%, MgSO 4 — 10,5% и MgCl 2 — 3,0%.
Полученную суспензию центрифугировали, чтобы получить 49.9 кг шенита с анализом K 2 SO 4 —42,0%, MgSO 4 —32,2%, NaCl — 0,7% и 255 л фильтрата (SEL), анализируемого как KCl — 10,5%, NaCl — 12,3%, MgSO 4 —13,7%, MgCl 2 —6,70%. Шенит реагировал с раствором 19,0 кг MOP в 75 л воды в течение 3,5 часов в сосуде при непрерывном перемешивании. Суспензию центрифугировали, чтобы получить 27,0 кг СОП, проанализированного как K 2 SO 4 — 94,3%, NaCl — 0,2% и MgSO 4 — 3,7%, и 85 л фильтрата (KEL), анализируя как KCl. -15.5%, NaCl — 0,8%, MgSO 4 — 10,5% и MgCl 2 — 3,0%.
59 л десульфатированной конечной выпи, полученной в Примере-1, имеющей химический состав: KCl — 1,15%, NaCl — 1,3%, MgCl 2 — 41,2%, CaSO 4 Следы были разбавлены 40 Л воды и обрабатывают 14,7 кг свежеприготовленной гашеной извести (активная сила 87,7%) в течение 1 часа. Полученную суспензию фильтровали, и лепешку промывали 30 л воды. 90 л общего фильтрата, содержащего CaCl 2 -22.3% и MgCl 2 —3,0%. Твердый гидроксид магния дополнительно промывали 100 л воды, чтобы освободить его от растворимых примесей. 15,7 кг Mg (OH) 2 с 86,9% содержанием Mg (OH) 2 получали при сушке в лотковой сушилке. Часть Mg (OH) 2 прокалили при 850 ° C с получением MgO 90,0%. 90 л фильтрата, содержащего 22,3% CaCl 2 , использовали для десульфатации 90 л SEL, полученного в Примере-3. Полученную суспензию фильтровали, чтобы получить 142 л десульфатированного SEL и 21 л.0 кг побочного продукта гипса, 57 л десульфатированного SEL смешивали с 41 л десульфатированной конечной выпь из Примера-1 с концентрацией Mg 10,3%. Полученный раствор подвергали принудительному испарению в испарителе с открытой тарой до тех пор, пока раствор не достигал точки кипения 120 ° C. Горячий щелок фильтровали для отделения 5,5 кг сырого NaCl, имеющего состав: NaCl — 85%, KCl — 2,9% и MgCl 2 —12,1%.
Полученную суспензию фильтровали, и лепешку промывали 30 л воды. 90 л общего фильтрата, содержащего CaCl 2 -22.3% и MgCl 2 —3,0%. Твердый гидроксид магния дополнительно промывали 100 л воды, чтобы освободить его от растворимых примесей. 15,7 кг Mg (OH) 2 с 86,9% содержанием Mg (OH) 2 получали при сушке в лотковой сушилке. Часть Mg (OH) 2 прокалили при 850 ° C с получением MgO 90,0%. 90 л фильтрата, содержащего 22,3% CaCl 2 , использовали для десульфатации 90 л SEL, полученного в Примере-3. Полученную суспензию фильтровали, чтобы получить 142 л десульфатированного SEL и 21 л.0 кг побочного продукта гипса, 57 л десульфатированного SEL смешивали с 41 л десульфатированной конечной выпь из Примера-1 с концентрацией Mg 10,3%. Полученный раствор подвергали принудительному испарению в испарителе с открытой тарой до тех пор, пока раствор не достигал точки кипения 120 ° C. Горячий щелок фильтровали для отделения 5,5 кг сырого NaCl, имеющего состав: NaCl — 85%, KCl — 2,9% и MgCl 2 —12,1%. Фильтрат охлаждали в резервуаре для кристаллизации карналлита. Полученную суспензию фильтровали, чтобы получить 11.3 кг карналлита, анализируемого как KCl — 21,7%, NaCl — 9,7%, MgCl 2 —31,4% и CaSO 4 —2,7%, и 48 л конечной выпи, анализируемой как MgCl 2 —40,2%, KCl —0,8%, NaCl — 1,1%. 9,2 кг карналлита разложили с использованием 3,6 л воды и отфильтровали, получив 8,0 л щелока разложенного карналлита (CDL), имеющего химический состав: KCl — 1,6%, NaCl — 2,8%; MgCl 2 — 30,5%; CaSO 4 следы и 2,9 кг CDP, имеющего химический состав: KCl — 75,3%, NaCl — 20,2%, MgCl 2 -2.0% и CaSO 4 -2,5%. CDP обрабатывали 1,9 л воды при температуре окружающей среды (30 ° C) с получением 2,0 кг KCl, имеющего состав: KCl — 90,0%, NaCl — 3,3%; MgCl 2 —0,4% и CaSO 4 —6,0 и 2,2 л насыщенного раствора, имеющего химический состав KCl — 14,0% и NaCl — 20,0%.
Фильтрат охлаждали в резервуаре для кристаллизации карналлита. Полученную суспензию фильтровали, чтобы получить 11.3 кг карналлита, анализируемого как KCl — 21,7%, NaCl — 9,7%, MgCl 2 —31,4% и CaSO 4 —2,7%, и 48 л конечной выпи, анализируемой как MgCl 2 —40,2%, KCl —0,8%, NaCl — 1,1%. 9,2 кг карналлита разложили с использованием 3,6 л воды и отфильтровали, получив 8,0 л щелока разложенного карналлита (CDL), имеющего химический состав: KCl — 1,6%, NaCl — 2,8%; MgCl 2 — 30,5%; CaSO 4 следы и 2,9 кг CDP, имеющего химический состав: KCl — 75,3%, NaCl — 20,2%, MgCl 2 -2.0% и CaSO 4 -2,5%. CDP обрабатывали 1,9 л воды при температуре окружающей среды (30 ° C) с получением 2,0 кг KCl, имеющего состав: KCl — 90,0%, NaCl — 3,3%; MgCl 2 —0,4% и CaSO 4 —6,0 и 2,2 л насыщенного раствора, имеющего химический состав KCl — 14,0% и NaCl — 20,0%.
Из 10 л CDL, полученного в вышеупомянутом эксперименте, 5,7 л холодного фильтрата, с которым неочищенная соль, полученная в предыдущем примере, также было промыто для восстановления содержания в нем магния, имеющего химический состав: KCl-7. 0%, NaCl — 8,2%, MgCl 2 — 21,5% и CaSO 4 — следы, и 15 л воды обрабатывали 2,5 кг свежеприготовленной гашеной извести, имеющей активность 90%, в течение 1 часа. Полученную суспензию фильтровали и твердый осадок промывали 10 л воды с получением 34 л фильтрата, содержащего 7,7% CaCl 2 . Твердый гидроксид магния дополнительно промывали 30 л воды, чтобы освободить его от растворимых примесей. Mg (OH) 2 сушили с получением 2,3 кг Mg (OH) 2 , который прокаливали с получением MgO, анализируемого как 92% MgO, содержащего 0.034% B 2 O 3 в виде примеси. 34 л рассола, содержащего CaCl 2 , использовали для десульфатации 17 л SEL, имеющего химический состав KCl — 7,2%, NaCl — 12,4%, MgSO 4 — 16,0% и MgCl 2 — 6,5%. Полученную суспензию фильтровали для удаления 5,2 кг влажного сульфата кальция и получения 49 л десульфатированного SEL с содержанием Mg 2,03%. К десульфатированному SEL добавляли 75 л конечной выпи с концентрацией Mg 9,6%, полученной в предыдущем эксперименте.
0%, NaCl — 8,2%, MgCl 2 — 21,5% и CaSO 4 — следы, и 15 л воды обрабатывали 2,5 кг свежеприготовленной гашеной извести, имеющей активность 90%, в течение 1 часа. Полученную суспензию фильтровали и твердый осадок промывали 10 л воды с получением 34 л фильтрата, содержащего 7,7% CaCl 2 . Твердый гидроксид магния дополнительно промывали 30 л воды, чтобы освободить его от растворимых примесей. Mg (OH) 2 сушили с получением 2,3 кг Mg (OH) 2 , который прокаливали с получением MgO, анализируемого как 92% MgO, содержащего 0.034% B 2 O 3 в виде примеси. 34 л рассола, содержащего CaCl 2 , использовали для десульфатации 17 л SEL, имеющего химический состав KCl — 7,2%, NaCl — 12,4%, MgSO 4 — 16,0% и MgCl 2 — 6,5%. Полученную суспензию фильтровали для удаления 5,2 кг влажного сульфата кальция и получения 49 л десульфатированного SEL с содержанием Mg 2,03%. К десульфатированному SEL добавляли 75 л конечной выпи с концентрацией Mg 9,6%, полученной в предыдущем эксперименте. Полученную смесь растворов подвергали принудительному выпариванию в испарителе с открытой тарой до температуры кипения раствора 126 ° C.Горячий щелок охлаждали в резервуаре для кристаллизации карналлита. Полученную суспензию фильтровали с получением 18,8 кг карналлита, имеющего химический состав: KCl — 14,3%, NaCl — 12,7%, MgCl 2 — 31,9% и CaSO 4 — 1,9% и 46,5 л конечной выпи, имеющей химический состав. MgCl 2 —46,1%, KCl — 0,2%, NaCl — 0,5%. 18,8 кг карналлита разложили с использованием 8 л воды и отфильтровали, получив 15,5 л CDL, имеющего химический состав; KCl — 4,8%, NaCl3,2%, MgCl 2 —32.5% и CaSO 4 — следы; и 5,7 кг CDP, имеющего химический состав: KCl — 33,9% и NaCl — 46,3%, MgCl 2 — 1,4%, CaSO 4 — 5,1% и влажность — 13%. CDP подвергали горячему выщелачиванию вместе с CDP, полученным в следующем примере известным способом для отделения KCl, как подробно описано ниже.
Полученную смесь растворов подвергали принудительному выпариванию в испарителе с открытой тарой до температуры кипения раствора 126 ° C.Горячий щелок охлаждали в резервуаре для кристаллизации карналлита. Полученную суспензию фильтровали с получением 18,8 кг карналлита, имеющего химический состав: KCl — 14,3%, NaCl — 12,7%, MgCl 2 — 31,9% и CaSO 4 — 1,9% и 46,5 л конечной выпи, имеющей химический состав. MgCl 2 —46,1%, KCl — 0,2%, NaCl — 0,5%. 18,8 кг карналлита разложили с использованием 8 л воды и отфильтровали, получив 15,5 л CDL, имеющего химический состав; KCl — 4,8%, NaCl3,2%, MgCl 2 —32.5% и CaSO 4 — следы; и 5,7 кг CDP, имеющего химический состав: KCl — 33,9% и NaCl — 46,3%, MgCl 2 — 1,4%, CaSO 4 — 5,1% и влажность — 13%. CDP подвергали горячему выщелачиванию вместе с CDP, полученным в следующем примере известным способом для отделения KCl, как подробно описано ниже.
15,5 л CDL, полученного в вышеуказанном эксперименте, имеющего химический состав: KCl — 5,0%, NaCl — 3,2%, MgCl 2 — 32,5% и CaSO 4 — следы; и 15 л воды обработали 3. 0 кг свежеприготовленной гашеной извести с активностью 90,0% в течение 1 часа. Полученную суспензию фильтровали и твердые частицы промывали 10 л воды с получением 27,5 л фильтрата, содержащего 10,60% CaCl 2 . Твердый гидроксид магния дополнительно промывали 30 л воды, чтобы освободить его от растворимых примесей. Mg (OH) 2 сушили с получением 2,9 кг Mg (OH) 2 и затем прокаливали с получением кальцинированного каустика MgO, имеющего 95% содержания MgO и 0,03% примеси B 2 O 3 .Раствор, содержащий CaCl 2 , использовали для десульфатации 25 л SEL, имеющего химический состав KCl —7,2%, NaCl ~ 12,4%, MgSO 4 16,0% и MgCl 2 —6,5%. Полученную суспензию фильтровали для удаления 5,7 кг сульфата кальция и получения 46 л десульфатированного SEL с содержанием Mg 3,05%. 33 л конечной выпи с концентрацией Mg 11,8%, полученной в предыдущем эксперименте, добавляли к десульфатированному SEL. Полученную смесь растворов подвергали принудительному выпариванию в испарителе с открытой тарой до температуры кипения раствора 125 ° C.
0 кг свежеприготовленной гашеной извести с активностью 90,0% в течение 1 часа. Полученную суспензию фильтровали и твердые частицы промывали 10 л воды с получением 27,5 л фильтрата, содержащего 10,60% CaCl 2 . Твердый гидроксид магния дополнительно промывали 30 л воды, чтобы освободить его от растворимых примесей. Mg (OH) 2 сушили с получением 2,9 кг Mg (OH) 2 и затем прокаливали с получением кальцинированного каустика MgO, имеющего 95% содержания MgO и 0,03% примеси B 2 O 3 .Раствор, содержащий CaCl 2 , использовали для десульфатации 25 л SEL, имеющего химический состав KCl —7,2%, NaCl ~ 12,4%, MgSO 4 16,0% и MgCl 2 —6,5%. Полученную суспензию фильтровали для удаления 5,7 кг сульфата кальция и получения 46 л десульфатированного SEL с содержанием Mg 3,05%. 33 л конечной выпи с концентрацией Mg 11,8%, полученной в предыдущем эксперименте, добавляли к десульфатированному SEL. Полученную смесь растворов подвергали принудительному выпариванию в испарителе с открытой тарой до температуры кипения раствора 125 ° C. Горячий щелок охлаждали в резервуаре для кристаллизации карналлита. Полученную суспензию фильтровали, чтобы получить 14 кг карналлита, имеющего химический состав: KCl — 15,0%, NaCl — 24,7%, MgCl 2 — 25,1% и CaSO 4 — 4,0% и 33,8 л конечной выпи, имеющей химический состав. , MgCl 2 — 44,8%, KCl — 0,1%, NaCl — 0,46%. 14,0 кг карналлита разложили с использованием 6,3 л воды и профильтровали, получив 12 л CDL, имеющего химический состав: KCl — 5,6%, NaCl — 4,4%; MgCl 2 -27.6% и CaSO 4 — следы; и 5,0 кг CDP, имеющего химический состав: KCl — 26,1% и NaCl — 51,1%, MgCl 2 — 7,1%, CaSO 4 — 5,1% и влажность — 9,0%. CDP, полученный вместе с CDP из Примера-7, весом 10,8 кг, был подвергнут горячему выщелачиванию известным способом с получением 3,5 кг MOP, имеющего содержание KCl 93,6%.
Горячий щелок охлаждали в резервуаре для кристаллизации карналлита. Полученную суспензию фильтровали, чтобы получить 14 кг карналлита, имеющего химический состав: KCl — 15,0%, NaCl — 24,7%, MgCl 2 — 25,1% и CaSO 4 — 4,0% и 33,8 л конечной выпи, имеющей химический состав. , MgCl 2 — 44,8%, KCl — 0,1%, NaCl — 0,46%. 14,0 кг карналлита разложили с использованием 6,3 л воды и профильтровали, получив 12 л CDL, имеющего химический состав: KCl — 5,6%, NaCl — 4,4%; MgCl 2 -27.6% и CaSO 4 — следы; и 5,0 кг CDP, имеющего химический состав: KCl — 26,1% и NaCl — 51,1%, MgCl 2 — 7,1%, CaSO 4 — 5,1% и влажность — 9,0%. CDP, полученный вместе с CDP из Примера-7, весом 10,8 кг, был подвергнут горячему выщелачиванию известным способом с получением 3,5 кг MOP, имеющего содержание KCl 93,6%.
В этом примере MOP, полученный в вышеприведенном Примере-8, использовали для приготовления SOP. 9,0 кг каинитовой смешанной соли в расчете на KCl-14.2%, NaCl — 16,5%, MgSO 4 — 40,2%, MgCl 2 — 1,2%, реагировали с 8 л воды в течение 2 часов. Суспензию центрифугировали с получением 3,0 кг шенита, анализируемого как K 2 SO 4 —35,5%, MgSO 4 —31,0% и NaCl — 3,3%, и 9,5 л фильтрата (SEL), анализируемого как и KCl. -7,6%, NaCl-12,6%, MgSO 4 -15,1%, MgCl 2 -9,5%, 0,488 кг шенита подвергали дальнейшей реакции с раствором 0,190 кг MOP (из полученного в приведенном выше Примере-8) в 0,753 Л воды на 3.5 часов, чтобы получить 0,255 кг SOP и 0,860 л KEL. СОП, анализируемый как K 2 SO 4 —93,0%, NaCl — 0,6%, MgSO 4 —5,4% и KEL как KCl — 14,8%, NaCl — 1,4%, MgSO 4 —7,7%, MgCl 2 —4,1%.
9,0 кг каинитовой смешанной соли в расчете на KCl-14.2%, NaCl — 16,5%, MgSO 4 — 40,2%, MgCl 2 — 1,2%, реагировали с 8 л воды в течение 2 часов. Суспензию центрифугировали с получением 3,0 кг шенита, анализируемого как K 2 SO 4 —35,5%, MgSO 4 —31,0% и NaCl — 3,3%, и 9,5 л фильтрата (SEL), анализируемого как и KCl. -7,6%, NaCl-12,6%, MgSO 4 -15,1%, MgCl 2 -9,5%, 0,488 кг шенита подвергали дальнейшей реакции с раствором 0,190 кг MOP (из полученного в приведенном выше Примере-8) в 0,753 Л воды на 3.5 часов, чтобы получить 0,255 кг SOP и 0,860 л KEL. СОП, анализируемый как K 2 SO 4 —93,0%, NaCl — 0,6%, MgSO 4 —5,4% и KEL как KCl — 14,8%, NaCl — 1,4%, MgSO 4 —7,7%, MgCl 2 —4,1%.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
 Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.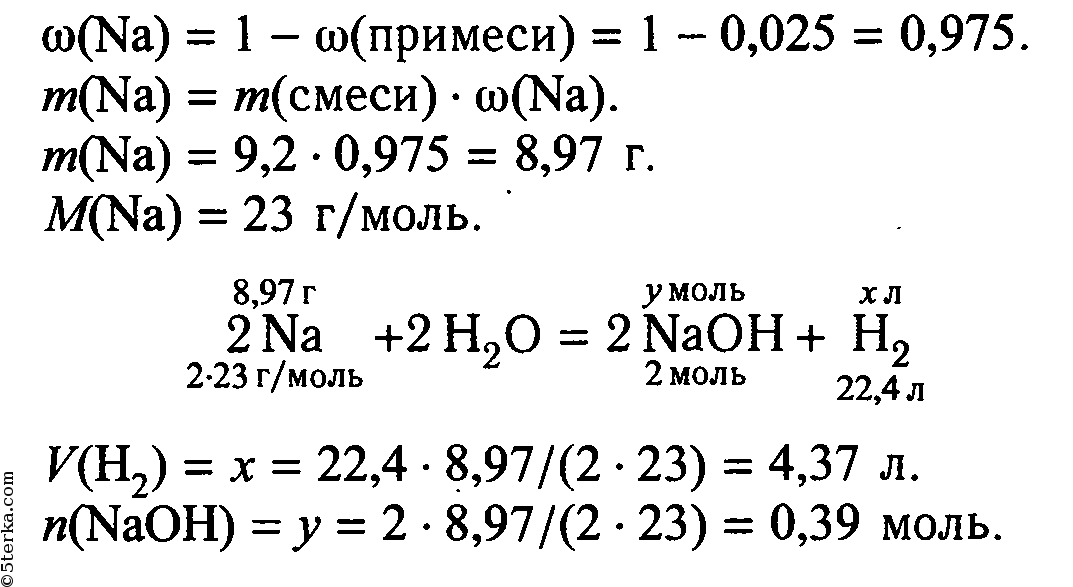
Очистка водных эфиров целлюлозы (Технический отчет)
Бартшерер К. А., де Пабло Дж. Дж., Боннин М. С. и Праусниц Дж. М. Очистка водных эфиров целлюлозы .США: Н. п., 1990.
Интернет. DOI: 10,2172 / 6084196.
Бартшерер К. А., де Пабло Дж. Дж., Боннин М. С. и Праусниц Дж. М. Очистка водных эфиров целлюлозы . Соединенные Штаты. https://doi.org/10.2172/6084196
Бартшерер, К. А., де Пабло, Дж. Дж., Боннин, М. К., и Праусниц, Дж. М.Солнце .
«Очистка водных эфиров целлюлозы». Соединенные Штаты. https://doi.org/10.2172/6084196. https://www.osti.gov/servlets/purl/6084196.
@article {osti_6084196,
title = {Очистка водных эфиров целлюлозы},
author = {Бартшерер, К. А. и де Пабло, Дж. Дж. и Боннин, М. К. и Праусниц, Дж. М.},
А. и де Пабло, Дж. Дж. и Боннин, М. К. и Праусниц, Дж. М.},
abstractNote = {Производство простых эфиров целлюлозы обычно связано с большим количеством побочных солевых продуктов.Для нанесения продукта необходимо удалить соль. В этой работе мы изучили закачку CO {sub 2} под высоким давлением в водный раствор полимерной соли; мы обнаружили, что при добавлении изопропанола в дополнение к CO {sub 2} раствор разделяется на две фазы. Одна фаза богата полимером и водой, а другая фаза содержит в основном изопропанол, воду и CO {sub 2}. Соль распределяется между двумя фазами, что открывает интересные возможности для разработки нового процесса очистки водорастворимых полимеров.В этой работе представлены экспериментальные данные фазового равновесия для гидроксиэтилцеллюлозы и карбоксиметилцеллюлозы натрия с ацетатом натрия и сульфатом калия, соответственно, в области 40 ° C и от 30 до 80 бар. На основании этих данных мы предлагаем процесс производства и очистки водорастворимых эфиров целлюлозы. 15 исх., 14 фиг., 9 таб.},
15 исх., 14 фиг., 9 таб.},
doi = {10.2172 / 6084196},
url = {https://www.osti.gov/biblio/6084196},
journal = {},
number =,
объем =,
place = {United States},
год = {1990},
месяц = {7}
}
ChemTeam: окислительно-восстановительное титрование
ChemTeam: окислительно-восстановительное титрованиеРедокс-титрование
Вернуться в меню окислительно-восстановительного потенциала
Проблема №1: 0.2640 г оксалата натрия растворяют в колбе, и требуется 30,74 мл перманганата калия (из бюретки), чтобы титровать его и вызвать розовый цвет (конечная точка).
Уравнение этой реакции:
5Na 2 C 2 O 4 (вод.) + 2KMnO 4 (вод.) + 8H 2 SO 4 (вод.) —> 2MnSO 4 (вод.) + K 2 SO 4 (вод.) + 5Na 2 SO 4 (вод.) + 10CO 2 (г) + 8H 2 O ()
(а) Сколько молей оксалата натрия находится в колбе?
(b) Сколько молей перманганата калия титровали в колбу, чтобы достичь конечной точки?
(c) Какова молярность перманганата калия?
Решение для (a):
0.2640 г / 134,00 г / моль = 0,001970149 мольдо четырех сигнатур, это будет 0,001970 моль
Решение для (b):
Из вычисленного уравнения молярное соотношение оксалата и перманганата составляет пять к двум.0,001970149 моль оксалата раз (2 моль перманганата / 5 моль оксалата) = 0,00078806 моль перманганата
на четыре сиг-инжира, это 0,0007881 моль
Решение для (c):
0,00078806 моль / 0,03074 L = 0.02564 M (до четырех сиг инжир)
Задача № 2: Дихромат калия используется для титрования пробы, содержащей неизвестный процент железа. Образец растворяют в смеси H 3 PO 4 / H 2 SO 4 для восстановления всего железа до ионов Fe 2+ . Затем раствор титруют 0,01625 M K 2 Cr 2 O 7 , получая ионы Fe 3+ и Cr 3+ в кислом растворе. На титрование требуется 32.26 мл K 2 Cr 2 O 7 на 1,2765 г образца.
Образец растворяют в смеси H 3 PO 4 / H 2 SO 4 для восстановления всего железа до ионов Fe 2+ . Затем раствор титруют 0,01625 M K 2 Cr 2 O 7 , получая ионы Fe 3+ и Cr 3+ в кислом растворе. На титрование требуется 32.26 мл K 2 Cr 2 O 7 на 1,2765 г образца.
(a) Уравновесить чистое ионное уравнение с помощью метода полуреакции.
(b) Определите процентное содержание железа в образце.
(c) Является ли проба йодатом железа, фосфатом железа или ацетатом железа?
Решение для (a):
6Fe 2+ + Cr 2 O 7 2 ¯ + 14H + —> 6 Fe 3+ + 2Cr 3+ + 7H 2 OМеханика балансировки предоставляется читателю.
Ключевым моментом является молярное отношение ионов двухвалентного железа к дихромату, которое составляет шесть к одному.
Решение для (b):
1) Определите Fe (II) в растворе:
(0,01625 моль / л) (0,03226 л) = 0,000524225 моль дихромата0,000524225 моль раз (6 моль Fe (II) / 1 моль дихромата) = 0,00314535 моль Fe (II)
0,00314535 моль Fe (II), умноженное на 55,845 г / моль = 0,175652 г
2) Определите процентное содержание железа в образце:
0.175652 г / 1,2765 г = 13,76%
Решение для (c):
Какое соединение содержит 13,76% железа? Единственный способ определить это — вычислить процентный состав трех веществ.
Йодат железа:
Fe (IO 3 ) 2% Fe: 55,845 г / моль разделить на 405,67 г / моль = 13,77%
Думаю, у нас есть победитель!
Вот калькулятор процентного состава, который я использовал для расчета трехпроцентного состава.Вот еще два вещества, о которых идет речь:
Fe 3 (PO 4 ) 2 = 46,87%Fe (C 2 H 3 O 2 ) 2 = 32,11%
Задача № 3: Раствор содержит ионы железа (II) и железа (III). Образец раствора объемом 50,0 мл титруют 35,0 мл 0,00280 M KMnO 4 , который окисляет Fe 2+ до Fe 3+ . Ион перманганта восстанавливается до иона марганца (II).Другой образец раствора объемом 50,0 мл обрабатывают металлическим цинком, который восстанавливает все Fe 3+ до Fe 2+ . Полученный раствор снова титруют 0,00280 M KMnO 4 , на этот раз требуется 48,0 мл. Каковы концентрации Fe 2+ и Fe 3+ в растворе?
Образец раствора объемом 50,0 мл титруют 35,0 мл 0,00280 M KMnO 4 , который окисляет Fe 2+ до Fe 3+ . Ион перманганта восстанавливается до иона марганца (II).Другой образец раствора объемом 50,0 мл обрабатывают металлическим цинком, который восстанавливает все Fe 3+ до Fe 2+ . Полученный раствор снова титруют 0,00280 M KMnO 4 , на этот раз требуется 48,0 мл. Каковы концентрации Fe 2+ и Fe 3+ в растворе?
Решение:
1) Представляет интерес химическое уравнение:
5Fe 2+ + 8H + + MnO 4 ¯ —> 5Fe 3+ + Mn 2+ + 4H 2 OСтехиометрическое отношение Fe 2+ к перманганту пять к одному.
2) Рассчитайте количество молей Fe 2+ прореагировавшего:
(0,00280 моль / л) (0,0350 л) = 0,000098 моль MnO 4 ¯(0,0000980 моль MnO 4 ¯) (5 моль Fe / 1 моль MnO 4 ¯) = 0,000490 моль Fe (II)
3) Определите ОБЩЕЕ содержание железа. Для этого мы будем использовать второй образец объемом 50,0 мл после обработки цинком. Поскольку весь Fe 3+ был восстановлен до Fe 2+ , мы можем определить, сколько железа было во вторых 50.Образец 0 мл.
Для этого мы будем использовать второй образец объемом 50,0 мл после обработки цинком. Поскольку весь Fe 3+ был восстановлен до Fe 2+ , мы можем определить, сколько железа было во вторых 50.Образец 0 мл.
(0,00280 моль / л) (0,0480 л) = 0,0001344 моль MnO 4 ¯(0,0001344 моль MnO 4 ¯) (5 моль Fe / 1 моль MnO 4 ¯) = 0,000672 моль всего Fe
4) Определите Fe (III) в растворе и его молярность:
0,000672 моль — 0,000490 моль = 0,000182 моль0,000182 моль / 0,050 L = 0,00364 M
5) Определите молярность Fe (II):
0,000490 моль / 0,050 L = 0,0098 M
Задача № 4: Количество сурьмы в образце может быть определено окислительно-восстановительным титрованием с окислителем.Образец 9,62 г антимонита, руды сурьмы, растворяют в горячей концентрированной HCl (водн.) И пропускают через восстановитель, так что вся сурьма находится в форме Sb 3+ . Sb 3+ (водный) полностью окисляется 43,70 мл 0,1250 М раствора KBrO 3 . Рассчитайте количество сурьмы в пробе и ее процентное содержание в руде.
Sb 3+ (водный) полностью окисляется 43,70 мл 0,1250 М раствора KBrO 3 . Рассчитайте количество сурьмы в пробе и ее процентное содержание в руде.
Решение:
1) Уравновесите уравнение (в кислотном растворе помните HCl из постановки задачи):
Несбалансированное уравнение реакции:BrO 3 ¯ (водн.) + Sb 3+ (водн.) —> Br¯ (водн.) + Sb 5+ (водн.)Вычисленное уравнение:
6H + (водн.) + BrO 3 ¯ (водн.) + 3Sb 3+ (водн.) —> Br¯ (водн.) + 3Sb 5+ (водн.) + 3H 2 О (ℓ)Ключевым моментом является молярное отношение бромата к Sb (III), которое составляет один к трем.
2) Определите используемый бромат:
(0,1250 моль / л) (0,04370 л) = 0,0054625 моль бромата
3) Определите Sb (III), который прореагировал:
0,0054625 моль броматных раз (3 моль Sb (III) / 1 моль бромата) = 0,0163875 моль Sb (III)
4) Определите граммы сурьмы:
0,0163875 моль, умноженная на 121,760 г / моль = 1,995342 гна три сиг-инжира, это 2,00 г
5) Рассчитайте процентное содержание сурьмы в пробе:
1.995342 г / 9,62 г = 20,7416%
на три сиг-инжира, это 20,7%
Задача № 5: Образец породы должен быть проанализирован на содержание олова путем окислительно-восстановительного титрования с I 3 ¯ (водн.). Образец породы массой 10,00 г измельчают, растворяют в серной кислоте и пропускают через восстановитель, так что все олово находится в форме Sn 2+ . Sn 2+ (водный) полностью окисляется 34,60 мл 0,5560 М раствора NaI 3 .Сбалансированное уравнение реакции имеет вид
I 3 ¯ (водн.) + Sn 2+ (водн.) —> Sn 4+ (водн.) + 3I¯ (вод.)
Рассчитайте количество олова в образце и его массовый процент в породе.
Решение:
1) Определите количество использованного трииодида:
(0,5560 моль / л) (0,03460 л) = 0,0192376 моль I 3 ¯ прореагировало
2) Определите прореагировавший Sn (II):
ключевым моментом является молярное соотношение 1: 1 между трииодидом и ионом двухвалентного олова.следовательно, 0.0192376 моль Sn (II) прореагировало
3) Вычислите количество иона олова (II) в граммах:
0,0192376 моль, умноженная на 118,710 г / моль = 2,284 г (для четырех сигнатур)
4) Рассчитайте массовый процент:
2,284 г / 10,00 г = 22,84%
Задача № 6: Количество I 3 ¯ (водн.) В растворе может быть определено титрованием раствором, содержащим известную концентрацию S 2 O 3 2 ¯ (водн.) (тиосульфат-ион).Определение основано на сбалансированном уравнении:
I 3 ¯ (вод.) + 2S 2 O 3 2 ¯ (вод.) —> 3I¯ (вод.) + S 4 O 6 2 ¯ (вод. )
Учитывая, что для титрования I 3 ¯ (водн.) В пробе 15,00 мл требуется 36,40 мл 0,3300 M Na 2 S 2 O 3 (водн. ), Рассчитайте молярность I 3 ¯ (aq) в растворе.
), Рассчитайте молярность I 3 ¯ (aq) в растворе.
Решение:
1) Определите количество используемого тиосульфата:
(0.3300 моль / л) (0,03640 л) = 0,012012 моль тиосульфата
2) Определите трийодид, который реагирует:
из вычисленного уравнения молярное соотношение между трииодидом и тиосульфатом составляет:один на дваследовательно:0,012012 моль тиосульфатных раз (1 моль трииодида / 2 моль тиосульфата) = 0,006006 моль трииодида
3) Определите молярность:
0,006006 моль / 0,01500 L = 0,4004 M (на 4 сигн. Инжира)
Проблема № 7: Количество Fe 2+ (водн.) В растворе FeSO 4 (водн.) Может быть определено титрованием раствором, содержащим известную концентрацию Ce 4+ (водн.) .Определение основано на реакции
Fe 2+ (водн.) + Ce 4+ (водн.) —> Fe 3+ (водн.) + Ce 3+ (водн.)
Учитывая, что требуется 37,50 мл 0,09650 М Ce 4+ (водн.) Для окисления Fe 2+ (водн.) В образце объемом 35,00 мл до Fe 3+ (водн.), Рассчитайте молярность Fe 2+ (водн.) И количество миллиграммов железа в образце.
Решение:
1) Определите количество Ce (IV), которое вступает в реакцию:
(0.09650 моль / л) (0,03750 л) = 0,00361875 моль
2) Определите количество иона железа (II), которое реагирует:
Между Fe (II) и Ce (IV) молярное соотношение 1: 1, следовательно:0,00361875 моль Fe (II) реагирует
3) Определите молярность:
0,00361875 моль / 0,03500 L = 0,1034 M (для четырех сигнатур)
4) Определите миллиграммы:
0,00361875 моль раз 55,845 г / моль = 0,2021 г = 202,1 мг
Задача № 8: Раствор I 3 ¯ (водн. ) Можно стандартизировать, используя его для титрования As 4 O 6 (водн.).Для титрования 0,1021 г As 4 O 6 (s), растворенного в 30,00 мл воды, требуется 36,55 мл I 3 ¯ (водн.). Рассчитайте молярность раствора I 3 ¯ (водн.). Несбалансированное уравнение
) Можно стандартизировать, используя его для титрования As 4 O 6 (водн.).Для титрования 0,1021 г As 4 O 6 (s), растворенного в 30,00 мл воды, требуется 36,55 мл I 3 ¯ (водн.). Рассчитайте молярность раствора I 3 ¯ (водн.). Несбалансированное уравнение
As 4 O 6 (с) + I 3 ¯ (водн.) —> As 4 O 10 (с) + I¯ (водн.)
Решение:
1) Сбалансируйте уравнение:
4H 2 O + As 4 O 6 (с) + 4I 3 ¯ (вод.) —> As 4 O 10 (с) + 12I¯ (вод.) + 8H +См. Обсуждение этого уравнения в конце решения.
2) Определите, сколько молей As 4 O 6 прореагировало:
0,1021 г разделить на 395,6828 г / моль = 0,000258035 моль
3) Определите количество молей трииодида, которые реагируют:
молярное соотношение между As 4 O 6 и I 3 ¯ составляет:от одного до четырехследовательно:0,000258035 моль As 4 O 6 раз (4 моль I 3 ¯ / 1 моль As 4 O 6 ) = 0,00103214 моль
4) Рассчитайте молярность:
0.00103214 моль / 0,03655 L = 0,02824 M (для четырех сигнатур)
Комментарий: фактические реакции отличаются от приведенного выше уравнения. Их можно посмотреть здесь.
Обратите внимание, что четыре H 3 AsO 4 будут произведены из одного As 4 O 6 . Однако для производства одного As 4 O 10 потребуются четыре H 3 AsO 4 . Таким образом, приведенное выше уравнение, хотя и не показывает реальных химических реакций, точно представляет соотношение (которое составляет 1: 4) между As 4 O 6 и трииодидом.
Задача № 9: Образец 32,15 мл раствора MoO 4 2 ¯ (водный) был пропущен через восстановитель Джонса (колонка цинкового порошка) для превращения всего MoO 4 2 ¯ (водн.) К Mo 3+ (водн.). Для фильтрата требовалось 20,85 мл 0,09550 M KMnO 4 — (водн.) Для реакции, представленной формулой
MnO 4 ¯ (водн.) + Mo 3+ (водн.) —> Mn 2+ (водн.) + MoO 2 2+ (водн.)
Уравновесите это уравнение, а затем рассчитайте концентрацию исходного раствора MoO 4 2 ¯ (водн.).
Решение:
1) Сбалансируйте уравнение:
сбалансированные полуреакции:5e¯ + 8H + + MnO 4 ¯ (водн.) —> Mn 2+ (водн.) + 4H 2 O (ℓ)
2H 2 O + Mo 3+ (водн.) —> MoO 2 2+ (водн.) + 4H + + 3e ¯вычисленное уравнение:
4H + + 3MnO 4 ¯ (водный) + 5Mo 3+ (водный) —> 3Mn 2+ (водный) + 5MoO 2 2+ (водный) + 2H 2 O
2) Рассчитайте необходимое количество молей перманганата:
(0.09550 моль / л) (0,02085 л) = 0,0019 моль
3) Рассчитайте количество молей молибдата:
ключевым моментом является молярное соотношение между перманганатом и молибдатом, которое составляет:от трех до пятиследовательно:
0,0019 моль перманганатных раз (5 моль молибдата / 3 моль перманганата = 0,003318625 моль молибдата
4) Рассчитайте концентрацию:
0,003318625 моль / 0,03215 L = 0,1032 M (для четырех сигнатур)
Задача № 10: Руда должна быть проанализирована на содержание железа путем окислительно-восстановительного титрования перманганат-ионом. Образец руды 4,230 г растворяют в соляной кислоте и пропускают через восстановитель, так что все железо находится в форме Fe 2+ . Fe 2+ (водный) полностью окисляется 31,60 мл 0,05120 М раствора KMnO 4 . Несбалансированное уравнение реакции имеет вид
Образец руды 4,230 г растворяют в соляной кислоте и пропускают через восстановитель, так что все железо находится в форме Fe 2+ . Fe 2+ (водный) полностью окисляется 31,60 мл 0,05120 М раствора KMnO 4 . Несбалансированное уравнение реакции имеет вид
KMnO 4 (вод.) + HCl (вод.) + FeCl 2 (вод.) —> MnCl 2 (вод.) + FeCl 3 (вод.) + H 2 O (ℓ)
Рассчитайте количество железа в пробе и его массовую долю в руде.
Решение:
1) Несбалансированное чистое ионное уравнение:
MnO 4 ¯ + Fe 2+ —> Mn 2+ + Fe 3+сбалансированное уравнение:
8H + + MnO 4 ¯ + 5Fe 2+ —> Mn 2+ + 5Fe 3+ + 4H 2 O
2) Рассчитайте количество молей перманганата:
(0,05120 моль / л) (0,03160 л) = 0,00161792 моль
3) Определите количество вступившего в реакцию Fe (II):
молярное соотношение для реакции перманганата и Fe (II) составляет:от одного до пятиследовательно:0.00161792 моль перманганатных раз (5 моль железа (II) / 1 моль перманганата) = 0,0080896 моль железа (II)
4) Вычислите количество железа в образце в граммах, а затем его массовую долю:
0,0080896 моль железа (II), умноженное на 55,845 г / моль = 0,4518 г (для четырех сигнатур)0,4517637 г / 4,230 г = 10,68%
Задача № 11: 10,0 см 3 из 0,10 моль-дм -3 водный сульфат железа (II) титруется 0,025 моль дм -3 водный манганат калия (VII) в присутствии избытка ионы водорода и ионы фтора.Установлено, что для достижения конечной точки требуется ровно 10,0 см 3 раствора манганата (VII). Какова степень окисления марганца в конечной точке? (Предупреждение от ChemTeam: обязательно прочтите комментарий в конце решения.)
Решение:
1) Определите, сколько присутствует Fe 2+ :
(0,10 моль / л) (0,0100 л) = 0,0010 моль
2) Определите, сколько MnO 4 ¯ прореагировало:
(0.025 моль / л) (0,0100 л) = 0,00025 моль
3) Рассчитайте количество окисленного Fe 2+ на один восстановленный MnO 4 ¯:
0,0010 моль / 0,00025 моль = 4
4) Вывод:
Mn снижено с +7 до +3
Комментарий: это проблема с поддельным ответом. При указанных химических условиях марганец восстанавливается до Mn 2+ . Эта задача преднамеренно создана, чтобы поймать «быстрый» ответ ученика, который знает, что в реальном мире Fe увеличивается от +2 до +3, а Mn — от +7 до +2.
Частью реального мира, лежащего в основе этой проблемы, является знание о том, что Mn, находящийся в самой высокой степени окисления, может быть только восстановлен. Следовательно, Fe должно быть окислено, и, исходя из реальных знаний, оно может изменяться только от +2 до +3.
Следовательно, мы можем предположить, что степень окисления Mn понижается на 4.
Задача № 12: Образец 2,50 г бронзы, сплава меди и олова, растворяли в серной кислоте. Медь в сплаве реагирует с серной кислотой, как показано следующей сбалансированной реакцией:
Медь в сплаве реагирует с серной кислотой, как показано следующей сбалансированной реакцией:
Cu + 2H 2 SO 4 —> Cu 2+ + SO 2 + 2H 2 O + SO 4 2 ¯
Добавление KI дает CuI и триодид, I 3 ¯
2Cu 2+ + 5I ¯ —> 2CuI + I 3 ¯
Наконец, титрование I 3 ¯ с S 2 O 3 2 ¯
I 3 ¯ + 2S 2 O 3 2 ¯ —> 3I¯ + S 4 O 6 2 ¯
предоставляет косвенный метод определения количества Cu в исходном образце.Рассчитайте массовое процентное содержание меди в образце бронзы, если на титрование израсходовано 31,50 мл 1.000 M S 2 O 3 2 ¯.
Решение:
1) Определите количество молей S 2 O 3 2 ¯ израсходовано:
(1.000 моль / л) (0,03150 л) = 0,03150 моль
2) S 2 O 3 2 ¯ реагирует с трииодидом в молярном соотношении 2: 1. Сколько было употреблено трииодида?
2 равно 0.03150 моль как 1 к xx = 0,01575 моль
3) Трииодид находится в молярном соотношении 2: 1 с ионом Cu 2+ . На каждый произведенный 1 трииодид потреблялись два иона меди. Сколько было израсходовано Cu 2+ ?
1 равно 0,01575 моль как 2 равно xx = 0,03150 моль Cu 2+
4) В реакции между Cu и серной кислотой молярное соотношение между Cu и Cu 2+ составляет 1: 1. Это означает, что было израсходовано 0,03150 моль Cu.Сколько это граммов Cu?
0,03150 моль умножить на 63,546 г / моль = 2,00 г (для трех сигнатур)
5) Процентное содержание меди в бронзе составляет:
(2,00 г / 3,50 г) * 100 = 57,1%
6) Небольшое изменение может быть связано с объединенными химическими уравнениями. Возьмите последнее уравнение в вопросе и переставьте его следующим образом:
Возьмите последнее уравнение в вопросе и переставьте его следующим образом:
I 3 ¯ —> 3I¯ + S 4 O 6 2 ¯ — 2S 2 O 3 2 ¯Обратите внимание, как я вычел 2S 2 O 3 2 ¯.
7) Теперь замените I 3 ¯ во втором уравнении вопроса:
2Cu 2+ + 5I¯ —> 2CuI + 3I¯ + S 4 O 6 2 ¯ — 2S 2 O 3 2 ¯В приведенном выше уравнении следует отметить молярное отношение 1: 1 между S 2 O 3 2 ¯ и Cu 2+ . Это означает, что 0,03150 моль S 2 O 3 2 ¯ реагирует с 0.03150 моль Cu 2+ . Мы можем пропустить расчет с участием трииодида.
Иногда то, что я сделал, можно сделать. Иногда это слишком сложно, поэтому вы всасываете его и просто выполняете все обратные вычисления по одному шагу за раз.
Проблема № 13: Было обнаружено, что 0,500 г цинкового порошка восстанавливают подкисленный раствор 25,50 мл 0,200 M AO 2 + . Какова конечная степень окисления металла А?
Решение:
0.500 г / 65,409 г / моль = 0,0076442 моль ZnZn —> Zn + + 2e ¯
0,0076442 моль, умноженное на 2 = 0,0152884 моль произведенных электронов
MV = моль
(0,200 моль / л) (0,02550 л) = 0,00510 моль AO 2 +
0,0152884 моль / 0,00510 моль = 2,998 = 3
В AO 2 + степень окисления A составляет +5. Снижена на 3 степени окисления до +2.
+2 — это ответ.
Вернуться в меню окислительно-восстановительного потенциала
3.2 Определение эмпирических и молекулярных формул — химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Вычислить процентный состав соединения
- Определите эмпирическую формулу соединения
- Определите молекулярную формулу соединения
В предыдущем разделе обсуждалась взаимосвязь между объемной массой вещества и количеством атомов или молекул, которые оно содержит (молей). Зная химическую формулу вещества, можно определить количество вещества (молей) по его массе, и наоборот. Но что делать, если химическая формула вещества неизвестна? В этом разделе эти же принципы будут применены для вывода химических формул неизвестных веществ на основе экспериментальных измерений массы.
Зная химическую формулу вещества, можно определить количество вещества (молей) по его массе, и наоборот. Но что делать, если химическая формула вещества неизвестна? В этом разделе эти же принципы будут применены для вывода химических формул неизвестных веществ на основе экспериментальных измерений массы.
Процентный состав
Элементный состав соединения определяет его химическую идентичность, а химические формулы являются наиболее кратким способом представления этого элементного состава.Когда формула соединения неизвестна, измерение массы каждого из составляющих его элементов часто является первым шагом в процессе определения формулы экспериментальным путем. Результаты этих измерений позволяют рассчитать процентный состав соединения, определяемый как процентное содержание каждого элемента в соединении по массе. Например, рассмотрим газообразное соединение, состоящее исключительно из углерода и водорода. Процентный состав этого соединения можно представить следующим образом:
% H = масса соединения Hmass × 100 %% H = масса соединения Hmass × 100% % C = масса соединения Cmass × 100 %% C = масса Cmass соединения × 100% Если анализ файла 10. Образец 0 г этого газа показал, что он содержит 2,5 г H и 7,5 г C, процентный состав будет рассчитан как 25% H и 75% C:
Образец 0 г этого газа показал, что он содержит 2,5 г H и 7,5 г C, процентный состав будет рассчитан как 25% H и 75% C:
Пример 3.9
Расчет процентного состава
Анализ образца жидкого соединения массой 12,04 г, состоящего из углерода, водорода и азота, показал, что он содержит 7,34 г C, 1,85 г H и 2,85 г N. Каков процентный состав этого соединения?Решение
Чтобы вычислить процентный состав, разделите экспериментально полученную массу каждого элемента на общую массу соединения, а затем преобразуйте в процент: % С = 7.34 г соединения C12,04 г × 100% = 61,0 %% H = 1,85 г h22,04 г соединения × 100% = 15,4 %% N = 2,85 г соединения N12,04 г × 100% = 23,7 %% C = 7,34 г соединения C12,04 г × 100% = 61,0 %% H = 1,85 г h22,04 г соединения × 100% = 15,4 %% N = 2,85 г N12,04 г соединения × 100% = 23,7% Результаты анализа показывают, что соединение содержит 61,0% C, 15,4% H и 23,7% N по массе.
Проверьте свои знания
Образец газообразного соединения, содержащего только углерод, кислород и хлор, массой 24,81 г содержит 3,01 г C, 4,00 г O и 17,81 г Cl. Каков процентный состав этого соединения?Ответ:
12.1% C, 16,1% O, 71,8% Cl
Определение процентного состава по молекулярным или эмпирическим формулам
Процентный состав также полезен для оценки относительного содержания данного элемента в различных соединениях известных формул. В качестве одного из примеров рассмотрим обычные азотсодержащие удобрения: аммиак (NH 3 ), нитрат аммония (NH 4 NO 3 ) и мочевину (CH 4 N 2 O). Элемент азот является активным ингредиентом для сельскохозяйственных целей, поэтому массовый процент азота в соединении является практической и экономической проблемой для потребителей, выбирающих среди этих удобрений.Для такого рода приложений процентный состав соединения легко выводится из его формульной массы и атомных масс составляющих его элементов. Молекула NH 3 содержит один атом N весом 14,01 а.е.м. и три атома H общим весом (3 × 1,008 а.е.м.) = 3,024 а.е.м. Таким образом, формульная масса аммиака (14,01 а.е.м. + 3,024 а.е.м.) = 17,03 а.е.м., а его процентный состав составляет:
Молекула NH 3 содержит один атом N весом 14,01 а.е.м. и три атома H общим весом (3 × 1,008 а.е.м.) = 3,024 а.е.м. Таким образом, формульная масса аммиака (14,01 а.е.м. + 3,024 а.е.м.) = 17,03 а.е.м., а его процентный состав составляет:
Этот же подход может быть использован для пары молекул, дюжины молекул или моля молекул и т. Д. Последнее количество наиболее удобно и будет просто включать использование молярных масс вместо атомных и формульных масс, как показано в примере. 3.10. Если молекулярная или эмпирическая формула рассматриваемого соединения известна, процентный состав может быть получен из атомных или молярных масс элементов соединения.
Пример 3.10
Определение процентного состава по молекулярной формуле
Аспирин представляет собой соединение с молекулярной формулой C 9 H 8 O 4 . Каков его процентный состав?
Каков его процентный состав?Решение
Для расчета процентного состава необходимы массы C, H и O с известной массой C 9 H 8 O 4 . Удобно считать 1 моль C 9 H 8 O 4 и использовать его молярную массу (180.159 г / моль, определяется по химической формуле) для расчета процентного содержания каждого из его элементов: % C = 9 моль C × молярная масса C молярная масса C9H8O4 × 100 = 9 × 12,01 г / моль 180,159 г / моль × 100 = 108,09 г / моль 180,159 г / моль × 100% C = 60,00% C% C = 9 моль C × молярная масса C молярная масса C9H8O4 × 100 = 9 × 12,01 г / моль 180,159 г / моль × 100 = 108,09 г / моль 180,159 г / моль × 100% C = 60,00% C% H = 8 моль H × молярная масса H молярная масса C9H8O4 × 100 = 8 × 1,008 г / моль 180,159 г / моль × 100 = 8,064 г / моль 180,159 г / моль × 100% H = 4,476% H% H = 8 моль H × молярная масса H молярная масса C9H8O4 × 100 = 8 × 1,008 г / моль 180,159 г / моль × 100 = 8. 064 г / моль 180,159 г / моль × 100% H = 4,476% H% O = 4 моль O × молярная масса Омолярная масса C9H8O4 × 100 = 4 × 16,00 г / моль 180,159 г / моль × 100 = 64,00 г / моль 180,159 г / моль × 100% O = 35,52 %% O = 4 моль O × молярная масса Омолярная масса C9H8O4 × 100 = 4 × 16,00 г / моль 180,159 г / моль × 100 = 64,00 г / моль 180,159 г / моль × 100% O = 35,52%
064 г / моль 180,159 г / моль × 100% H = 4,476% H% O = 4 моль O × молярная масса Омолярная масса C9H8O4 × 100 = 4 × 16,00 г / моль 180,159 г / моль × 100 = 64,00 г / моль 180,159 г / моль × 100% O = 35,52 %% O = 4 моль O × молярная масса Омолярная масса C9H8O4 × 100 = 4 × 16,00 г / моль 180,159 г / моль × 100 = 64,00 г / моль 180,159 г / моль × 100% O = 35,52%Обратите внимание, что сумма этих процентов равна 100,00% при надлежащем округлении.
Проверьте свои знания
С точностью до трех значащих цифр, каков массовый процент железа в соединении Fe 2 O 3 ?Определение эмпирических формул
Как упоминалось ранее, наиболее распространенный подход к определению химической формулы соединения — сначала измерить массы составляющих его элементов.Однако имейте в виду, что химические формулы представляют собой относительные числа , а не массы атомов в веществе. Следовательно, любые экспериментально полученные данные, включающие массу, должны использоваться для получения соответствующего количества атомов в соединении. Это достигается с использованием молярных масс для преобразования массы каждого элемента в количество молей. Эти молярные количества используются для расчета целочисленных соотношений, которые могут быть использованы для вывода эмпирической формулы вещества. Рассмотрим образец соединения, содержащего 1.71 г C и 0,287 г H. Соответствующее количество атомов (в молях) составляет:
Это достигается с использованием молярных масс для преобразования массы каждого элемента в количество молей. Эти молярные количества используются для расчета целочисленных соотношений, которые могут быть использованы для вывода эмпирической формулы вещества. Рассмотрим образец соединения, содержащего 1.71 г C и 0,287 г H. Соответствующее количество атомов (в молях) составляет:
Таким образом, это соединение может быть представлено формулой C 0,142 H 0,284 . Согласно соглашению, формулы содержат индексы целых чисел, что может быть достигнуто путем деления каждого индекса на меньший индекс:
C0.1420.142H0.2840.142orCh3C0.1420.142H0.2840.142orCh3(Напомним, что индексы «1» не записываются, а предполагаются, если нет другого числа.)
Таким образом, эмпирическая формула этого соединения: CH 2 . Это также может быть или не быть молекулярной формулой соединения ; однако для этого необходима дополнительная информация (как обсуждается далее в этом разделе).
Это также может быть или не быть молекулярной формулой соединения ; однако для этого необходима дополнительная информация (как обсуждается далее в этом разделе).
Рассмотрим в качестве другого примера образец соединения, содержащего 5,31 г Cl и 8,40 г O. Следуя тому же подходу, получаем предварительную эмпирическую формулу:
C10.150O0.525 = Cl0.1500.150O0.5250.150 = ClO3.5C10.150O0.525 = Cl0.1500.150O0.5250.150 = ClO3.5В этом случае деление на наименьший нижний индекс по-прежнему оставляет нам десятичный нижний индекс в эмпирической формуле . Чтобы преобразовать это в целое число, умножьте каждый из нижних индексов на два, сохраняя то же атомное соотношение и получив Cl 2 O 7 в качестве окончательной эмпирической формулы.
Таким образом, эмпирические формулы получены на основе экспериментально измеренных масс элементов:
- Определение количества молей каждого элемента из его массы
- От деления молярного количества каждого элемента на наименьшее молярное количество, чтобы получить индексы для предварительной эмпирической формулы
- Умножение всех коэффициентов на целое число, если необходимо, чтобы обеспечить наименьшее целочисленное отношение индексов
Рисунок 3. 11 описывает эту процедуру в виде блок-схемы для вещества, содержащего элементы A и X.
11 описывает эту процедуру в виде блок-схемы для вещества, содержащего элементы A и X.
Рис. 3.11 Эмпирическая формула соединения может быть получена из масс всех элементов в образце.
Пример 3.11
Определение эмпирической формулы соединения по массам его элементов
Образец черного минерала гематита (рис. 3.12), оксида железа, содержащегося во многих железных рудах, содержит 34,97 г железа и 15,03 г кислорода. Какая эмпирическая формула гематита?Рисунок 3.12 Гематит — это оксид железа, который используется в ювелирных изделиях. (кредит: Мауро Катеб)
Решение
Эта задача обеспечивает массу в граммах каждого элемента. Начните с поиска родинок каждого: 34,97 г Fe (моль Fe55,85 г) = 0,6261 моль Fe15,03 г O (моль O16,00 г) = 0,9394 моль O 34,97 г Fe (моль Fe55,85 г) = 0,6261 моль Fe15,03 г O (моль O16,00 г) = 0,9394 моль OЗатем выведите молярное отношение железа к кислороду путем деления на меньшее количество молей:
0,62610,6261 = 1,000 моль Fe0,93940,6261 = 1,500 моль O0,62610,6261 = 1. 000 моль Fe0.93940.6261 = 1.500 моль O
000 моль Fe0.93940.6261 = 1.500 моль OОтношение 1.000 моль железа к 1.500 моль кислорода (Fe 1 O 1,5 ). Наконец, умножьте соотношение на два, чтобы получить наименьшие возможные индексы целых чисел, сохраняя при этом правильное соотношение железа и кислорода:
2 (Fe1O1,5) = Fe2O32 (Fe1O1,5) = Fe2O3Эмпирическая формула: Fe 2 O 3 .
Проверьте свои знания
Какова эмпирическая формула соединения, если образец содержит 0,130 г азота и 0.370 г кислорода?Ссылка на обучение
Дополнительные проработанные примеры, иллюстрирующие вывод эмпирических формул, можно найти в коротком видеоролике.
Получение эмпирических формул из процентного состава
Наконец, что касается вывода эмпирических формул, рассмотрите случаи, в которых доступен процентный состав соединения, а не абсолютные массы составляющих его элементов. В таких случаях процентный состав можно использовать для расчета масс элементов, присутствующих в любой удобной массе соединения; затем эти массы можно использовать для получения эмпирической формулы обычным способом.
Пример 3.12
Определение эмпирической формулы на основе процентного состава
Бактериальная ферментация зерна для производства этанола дает газ с процентным составом 27,29% C и 72,71% O (рис. 3.13). Какова эмпирическая формула этого газа?Рис. 3.13. Оксид углерода удаляется из этих бродильных чанов через большие медные трубы наверху. (кредит: «Dual Freq» / Wikimedia Commons)
Решение
Поскольку шкала для процентов равна 100, удобнее всего рассчитать массу элементов, присутствующих в образце весом 100 г.Расчет является «наиболее удобным», потому что согласно определению процентного состава масса данного элемента в граммах численно эквивалентна массовому процентному содержанию элемента. Эта числовая эквивалентность является результатом определения «процентной» единицы, название которой происходит от латинской фразы процентов , означающей «сотнями». Учитывая это определение, представленные массовые проценты могут быть более удобно выражены в виде дробей: 27,29% C = 27,29 г C 100 г соединения 72. 71% O = 72,71 г O 100 г соединения 27,29% C = 27,29 г C 100 г соединения 72,71% O = 72,71 г O 100 г соединения
71% O = 72,71 г O 100 г соединения 27,29% C = 27,29 г C 100 г соединения 72,71% O = 72,71 г O 100 г соединенияМолярные количества углерода и кислорода в 100-граммовой пробе рассчитываются путем деления массы каждого элемента на его молярную массу:
27,29 г C (моль C12,01 г) = 2,272 моль C72,71 г O (моль O16,00 г) = 4,544 моль O27,29 г C (моль C12,01 г) = 2,272 моль C72,71 г O (моль O16,00 г) = 4,544 моль OКоэффициенты для предварительной эмпирической формулы выводятся путем деления каждого молярного количества на меньшее из двух:
2,272 моль C2,272 = 14,544 моль O2.272 = 22,272 моль C2,272 = 14,544 моль O2,272 = 2Поскольку в результате получается соотношение один углерод к двум атомам кислорода, эмпирическая формула CO 2 .
Проверьте свои знания
Какова эмпирическая формула соединения, содержащего 40,0% C, 6,71% H и 53,28% O?Получение молекулярных формул
Напомним, что эмпирические формулы — это символы, представляющие относительных номеров элементов соединения. Для определения абсолютного числа атомов, составляющих одну молекулу ковалентного соединения, требуется знание как его эмпирической формулы, так и его молекулярной массы или молярной массы.Эти величины могут быть определены экспериментально с помощью различных методов измерения. Молекулярная масса, например, часто определяется из масс-спектра соединения (см. Обсуждение этого метода в предыдущей главе об атомах и молекулах). Молярную массу можно измерить с помощью ряда экспериментальных методов, многие из которых будут представлены в следующих главах этого текста.
Для определения абсолютного числа атомов, составляющих одну молекулу ковалентного соединения, требуется знание как его эмпирической формулы, так и его молекулярной массы или молярной массы.Эти величины могут быть определены экспериментально с помощью различных методов измерения. Молекулярная масса, например, часто определяется из масс-спектра соединения (см. Обсуждение этого метода в предыдущей главе об атомах и молекулах). Молярную массу можно измерить с помощью ряда экспериментальных методов, многие из которых будут представлены в следующих главах этого текста.
Молекулярные формулы получены путем сравнения молекулярной или молярной массы соединения с его массой, полученной по эмпирической формуле.Как следует из названия, эмпирическая формула массы — это сумма средних атомных масс всех атомов, представленных в эмпирической формуле. Если молекулярная (или молярная) масса вещества известна, ее можно разделить на массу, полученную по эмпирической формуле, чтобы получить количество эмпирических формульных единиц на молекулу ( n ):
молекулярная или молярная масса (amu orgmol) эмпирическая формула масса (amu orgmol) = nformula единиц / молекуламолекулярная или молярная масса (amu orgmol) эмпирическая формула масса (amu orgmol) = nformula единиц / молекулаМолекулярная формула затем получается путем умножения каждого нижнего индекса в эмпирической формуле на n , как показано общей эмпирической формулой A x B y :
(AxBy) n = AnxBny (AxBy) n = AnxBny Например, рассмотрим ковалентное соединение, эмпирическая формула которого определена как CH 2 O. Масса по эмпирической формуле для этого соединения составляет приблизительно 30 а.е.м. (сумма 12 а.е.м. для одного атома C, 2 а.е.м. для двух атомов H и 16 а.е.м. для одного атома O). Если молекулярная масса соединения определена равной 180 а.е.м., это означает, что молекулы этого соединения содержат в шесть раз больше атомов, представленных в эмпирической формуле:
Масса по эмпирической формуле для этого соединения составляет приблизительно 30 а.е.м. (сумма 12 а.е.м. для одного атома C, 2 а.е.м. для двух атомов H и 16 а.е.м. для одного атома O). Если молекулярная масса соединения определена равной 180 а.е.м., это означает, что молекулы этого соединения содержат в шесть раз больше атомов, представленных в эмпирической формуле:
Молекулы этого соединения затем представлены молекулярными формулами, индексы которых в шесть раз превышают индексы в эмпирической формуле:
(Ch3O) 6 = C6h22O6 (Ch3O) 6 = C6h22O6Обратите внимание, что этот же подход может быть использован, когда вместо молекулярной массы (а.е.м.) используется молярная масса (г / моль).В этом случае рассматривается один моль эмпирических формульных единиц и молекул, в отличие от отдельных единиц и молекул.
Пример 3.
 13
13Определение молекулярной формулы никотина
Никотин, алкалоид из семейства пасленовых растений, который в основном ответственен за привыкание сигарет, содержит 74,02% C, 8,710% H и 17,27% N. Если 40,57 г никотина содержат 0,2500 моль никотина, какова молекулярная формула ?Решение
Определение молекулярной формулы на основе предоставленных данных потребует сравнения массы эмпирической формулы соединения с его молярной массой.В качестве первого шага используйте процентный состав, чтобы получить эмпирическую формулу соединения. Допустим, 100-граммовый образец никотина дает следующие молярные количества его элементов: (74,02 г C) (1 моль C12,01 г C) = 6,163 моль C (8,710 г H) (1 моль ч2,01 г H) = 8,624 моль H (17,27 г N) (1 моль N 14,01 г N) = 1,233 моль N (74,02 г C) (1 моль C12,01 г C) = 6,163 моль C (8,710 г H) (1 моль ч2,01 г H) = 8,624 моль H (17,27 г N) (1 моль N 14,01 г N) = 1,233 моль N Затем рассчитайте молярные отношения этих элементов относительно наименее распространенного элемента, N.
Молярные отношения C-to-N и H-to-N соотношения достаточно близки к целым числам, и поэтому эмпирическая формула C 5 H 7 N. Таким образом, масса по эмпирической формуле для этого соединения составляет 81,13 а.е.м. / формульную единицу, или 81.Формульная единица 13 г / моль.
Рассчитайте молярную массу никотина исходя из заданной массы и молярного количества соединения:
40,57 г никотина 0,2500 моль никотина = 162,3 г моль 40,57 г никотина 0,2500 моль никотина = 162,3 г мольСравнение молярной массы и эмпирической формулы массы показывает, что каждая молекула никотина содержит две формульные единицы:
162,3 г / моль 81,13 г формульная единица = 2 формульных единицы / молекула 162,3 г / моль 81,13 г формульная единица = 2 формульные единицы / молекулаНаконец, выведите молекулярную формулу никотина из эмпирической формулы, умножив каждый индекс на два:
(C5H7N) 2 = C10h24N2 (C5H7N) 2 = C10h24N2Проверьте свои знания
Какова молекулярная формула соединения с процентным составом 49. 47% C, 5,201% H, 28,84% N и 16,48% O и молекулярная масса 194,2 а.е.м.
47% C, 5,201% H, 28,84% N и 16,48% O и молекулярная масса 194,2 а.е.м.Ce2 (so4) 3 кривая растворимости
Ацидоз (HCO3 <3, pH <7,2) и увеличение K / Cl ++ 0,5 ммоль / кг для каждого желаемого увеличения в HCO3; конечная точка HCO3> 8 / клиническое улучшение / pH 7,2; Инфузия 10-25 ммоль / час Более вероятно, что потребуется в NAGMA, поскольку проблема 1Y — потеря HCO3, в отличие от AGMA, где проблема 1Y — усиление. Растворимость соли в воде зависит от температуры. 2. Параметры модели подобраны с учетом экспериментальной растворимости и активности воды в суб-бинарных и суб-трехкомпонентных системах названной четвертичной системы.KNO3 Ce2 (SO4) 3 Nh4 KClO3 Nh5Cl KCl NaCl WS — проблемы чтения диаграммы растворимости 1. Растворимость хлорида натрия Растворимость сульфата меди. Температура (⁰C) Растворимость (г растворенного вещества / 100 мл h3O) 0 35,7 10 35,8 20 35,9 30 36 40 36,4 60 37,1 80 38 90 38,5 100 39,2 Температура (⁰C) Растворимость (г растворенного вещества / 100 мл h3O) 0 23 10 27,5 20 32 30 38 40 44,5 60 62 80 84 100 114 2. 1. Давление: растворимость газа зависит от давления газа на поверхности жидкости. 2. Температура: уровни насыщения и зависят от состояния вещества.высокая температура = более низкая растворимость газа и обычно более высокая растворимость твердых веществ (исключение Ce2 (SO4) 3). низкая температура = более высокая растворимость газа и обычно более низкая растворимость твердых веществ (есть исключения). 3. Образец 18-гидрата сульфата алюминия Al2 (SO4) 3 18h3O, содержащий 159,3 мг, растворяют в 1.000 л раствора. Рассчитайте следующее: Al2 (SO4) 3 = 342 г / моль. Для большей точности вы также можете подобрать кривую для данных растворимости. Я бы не стал выносить это далеко за пределы ~ 150 ° C, где у вас давление ~ 3,74 бара (вероятно, несколько меньшее давление для вашего сат.Раствор KCl). Вы действительно не хотите несчастных случаев с паром высокой температуры / высокого давления. Как показано на фиг. 3, A, M, D, C и W обозначают твердый NaBr, твердый MgBr 2 · 6H 2 O, твердый MgBr 2, твердый NaBr · 2H 2 O и H 2 O соответственно; точка Q, инвариантная точка, отражает пересыщенный раствор MgBr 2 · 6H 2 O и NaBr · 2H 2 O при 313,15 К, с (NaBr) = 0,0418 и (MgBr 2) = 0,4781; N и H представляют растворимость MgBr 2 и NaBr в воде при 313,15 К соответственно.
1. Давление: растворимость газа зависит от давления газа на поверхности жидкости. 2. Температура: уровни насыщения и зависят от состояния вещества.высокая температура = более низкая растворимость газа и обычно более высокая растворимость твердых веществ (исключение Ce2 (SO4) 3). низкая температура = более высокая растворимость газа и обычно более низкая растворимость твердых веществ (есть исключения). 3. Образец 18-гидрата сульфата алюминия Al2 (SO4) 3 18h3O, содержащий 159,3 мг, растворяют в 1.000 л раствора. Рассчитайте следующее: Al2 (SO4) 3 = 342 г / моль. Для большей точности вы также можете подобрать кривую для данных растворимости. Я бы не стал выносить это далеко за пределы ~ 150 ° C, где у вас давление ~ 3,74 бара (вероятно, несколько меньшее давление для вашего сат.Раствор KCl). Вы действительно не хотите несчастных случаев с паром высокой температуры / высокого давления. Как показано на фиг. 3, A, M, D, C и W обозначают твердый NaBr, твердый MgBr 2 · 6H 2 O, твердый MgBr 2, твердый NaBr · 2H 2 O и H 2 O соответственно; точка Q, инвариантная точка, отражает пересыщенный раствор MgBr 2 · 6H 2 O и NaBr · 2H 2 O при 313,15 К, с (NaBr) = 0,0418 и (MgBr 2) = 0,4781; N и H представляют растворимость MgBr 2 и NaBr в воде при 313,15 К соответственно. 26 февраля 2017 г. · Неизвестно, придется искать в специальном тексте.Эта ссылка дает растворимость «сульфата церия (III)» как 9,25 * г «на 100 мл воды при комнатной температуре».
26 февраля 2017 г. · Неизвестно, придется искать в специальном тексте.Эта ссылка дает растворимость «сульфата церия (III)» как 9,25 * г «на 100 мл воды при комнатной температуре».
1. Давление: растворимость газа зависит от давления газа на поверхности жидкости. 2. Температура: уровни насыщения и зависят от состояния вещества. высокая температура = более низкая растворимость газа и обычно более высокая растворимость твердых веществ (исключение Ce2 (SO4) 3). низкая температура = более высокая растворимость газа и обычно более низкая растворимость твердых веществ (есть исключения). 3. Уравновесьте реакцию Na2SO4 + CuCl2 = NaCl + CuSO4, используя балансировщик химических реакций! Правило 3: Ионные соединения, содержащие анионы Cl Br I, являются РАСТВОРИМЫМИ —— ИСКЛЮЧЕНИЯ —— В сочетании с Ag, Hg2, Pb делают их Нерастворимыми: Правило 4: Ионные соединения, содержащие SO4, являются РАСТВОРИМЫМИ —— ИСКЛЮЧЕНИЯ —— В сочетании с A: Правило 5: Ионные соединения, содержащие О или ОН, НЕРАСТВОРИМЫ. Используйте предоставленный график кривой растворимости, чтобы ответить на следующие вопросы.1. Каковы обычные единицы растворимости на кривых растворимости? … б. 10 г Ce2 (SO4 …
Используйте предоставленный график кривой растворимости, чтобы ответить на следующие вопросы.1. Каковы обычные единицы растворимости на кривых растворимости? … б. 10 г Ce2 (SO4 …
9) При какой температуре хлорат калия (KClO3) и хлорид калия (KCl) имеют одинаковую растворимость в? воды? 10) При 50ºC 100 см3 воды. НАСЫЩЕННЫЙ. с сульфатом церия (Ce2 (SO4) 3). Сколько грамм сульфата церия. необходимо добавить для насыщения раствора при 0ºC? (ПОДСКАЗКА: сначала определите, сколько граммов уже было в оригинале. Это привело к увеличению растворимости окислительно-восстановительной пары более чем на 150%, увеличению равновесного полуэлементного потенциала окислительно-восстановительной пары более чем на 200 мВ и увеличению увеличение пиковой плотности мощности DLRFC более чем на 200% (79 мВт / см² по сравнению с25 мВт / см²) относительно системы на основе сульфатов. Растворимость: растворим в воде и кислоте. Применение: Сульфат церия в основном используется в качестве хромогенного агента для анилиновой сажи, может использоваться для гальваники олова. Используется как хромогенный агент и аналитический реагент. Новое поступление промышленного класса цена сульфата церия Ce2 (SO4) 3 растворимость от низкого содержания карбонатов почвы до высокого содержания доломита. Inc.снижение ионной силы раствора увеличивало. растворимость большинства твердых карбонатных материалов.При понижении температуры растворимость увеличивалась. Когда . so4. присутствовал в растворе, растворимость обоих кальция 20 августа 2006 г. · Сульфат церия, Ce2 (SO4) 3, является единственным известным мне примером. Согласно моей таблице, растворимость нонагидрата составляет 17,35 г / 100 мл при 0 ° C, но только 3,73 г / 100 мл при 60 ° C. 3. РАБОЧИЙ ЛИСТ КРИВОЙ РАСТВОРИМОСТИ … 10 Ce2 (SO4) 3 0 0 10 20 30 40 50 60 70 80 90 100 Температура (° C) a. Какое из соединений наименее растворимо при 90 ° C? Решено: 1 … Это позволяет прогнозировать фазовые равновесия в n + 1-компонентной системе на основе данных о фазовых равновесиях в n-компонентных системах и строить их фазовые диаграммы.
Используется как хромогенный агент и аналитический реагент. Новое поступление промышленного класса цена сульфата церия Ce2 (SO4) 3 растворимость от низкого содержания карбонатов почвы до высокого содержания доломита. Inc.снижение ионной силы раствора увеличивало. растворимость большинства твердых карбонатных материалов.При понижении температуры растворимость увеличивалась. Когда . so4. присутствовал в растворе, растворимость обоих кальция 20 августа 2006 г. · Сульфат церия, Ce2 (SO4) 3, является единственным известным мне примером. Согласно моей таблице, растворимость нонагидрата составляет 17,35 г / 100 мл при 0 ° C, но только 3,73 г / 100 мл при 60 ° C. 3. РАБОЧИЙ ЛИСТ КРИВОЙ РАСТВОРИМОСТИ … 10 Ce2 (SO4) 3 0 0 10 20 30 40 50 60 70 80 90 100 Температура (° C) a. Какое из соединений наименее растворимо при 90 ° C? Решено: 1 … Это позволяет прогнозировать фазовые равновесия в n + 1-компонентной системе на основе данных о фазовых равновесиях в n-компонентных системах и строить их фазовые диаграммы. Установлено, что исследуемая система при 25 оС характеризуется наличием 5 невариантных точек, 16 моновариантных кривых и 18 дивариантных полей. Правила растворимости. Существует ряд закономерностей в данных, полученных при измерении растворимости различных солей. Эти закономерности составляют основу правил, изложенных в таблице ниже, которые могут помочь в прогнозировании того, будет ли данная соль растворяться в воде.
Установлено, что исследуемая система при 25 оС характеризуется наличием 5 невариантных точек, 16 моновариантных кривых и 18 дивариантных полей. Правила растворимости. Существует ряд закономерностей в данных, полученных при измерении растворимости различных солей. Эти закономерности составляют основу правил, изложенных в таблице ниже, которые могут помочь в прогнозировании того, будет ли данная соль растворяться в воде.
Используйте приведенную ниже кривую растворимости, чтобы ответить на следующие вопросы: Вот пример того, как читать график.Найдите кривую для KClO3. При 30 ° C примерно 10 г KClO3 растворяется в 100 г воды. Если температура повышается до 80 ° C, примерно _____ вещества растворяется в 100 г (или 100 мл) воды. Используя кривую растворимости, ответьте на следующие вопросы: 100 90 80 NaNO3 70 K, Cr, 02 60 CacІ, KNO3 Растворимость (г соли в 100 г h3O) 50 Pb (NO3) 2 KCI 40 NaCl 30 20 KCIO, 10 Ce2 ( SO4) 3 0 0 10 20 30 40 50 60 70 80 Температура (° C) a. Решено: 1. Используя кривую растворимости, ответьте на следующие вопросы…
Используя кривую растворимости, ответьте на следующие вопросы…
Кривые растворимости 100 o o 90 80 70 60 50 40 30 20 10 o насыщенные ненасыщенные перенасыщенные 100 Nac 10 Ce2 (S04) 30 40 50 60 70 80 90 Температура CC) 20. 9. При какой температуре хлорат калия (KClO3) и хлорид калия (KCl) имеют одинаковую растворимость в воде? 10. При 50ºC 100 см3 воды насыщается сульфатом церия (Ce2 (SO4) 3). Сколько граммов сульфата церия необходимо добавить, чтобы насыщать раствор при 0ºC? 11. При 50ºC 100 см3 воды насыщается нитратом калия (KNO3).Сульфат церия | Ce2 (SO4) 3 или Ce2O12S3 | CID 159674 — структура, химические названия, физические и химические свойства, классификация, патенты, литература, биологические … Предположим, что кривая растворимости для газа, такого как аммиак, при давлении в одну атмосферу, была нанесена на график кривой растворимости. Если читать слева направо, будет ли эта кривая _____ a. наклон вверх b. наклон вниз c. идти прямо. Ответы: 1) KClO3, 2) KNO3, 3) NaCl 4) 14 г, 5) 72 (2oC, 6) KNO3 и KCl, 7) 210 г, 8) 55 (2g, Проблемы обзора кривой растворимости. Вот пример того, как читать график. Найдите кривую для KClO3. При 30 ° C примерно 10 г KClO3 растворяется в 100 г воды. Если температура повышается до 80 ° C, примерно _____ вещества растворяется в 100 г (или 100 мл) воды. Каковы обычные единицы растворимости на кривых растворимости? … б. 10 г Ce2 (SO4) 3 при 10 ° C. c. 90 г KNO3 при 60oC. d. 65 г K2Cr2O7 при 80 ° C. Представлена низкотемпературная термохимическая модель системы Na-K-Ca-Mg-Cl-S04-Hz0. Водные виды и стандартные химические потенциалы реакций твердого раствора моделируются на основе опубликованных данных для бинарных и тройных растворов.Подчеркнут диапазон температур ниже 25 ° C (почти до -60 ° C), хотя параметры модели адаптированы для плавного слияния с параметрами более высоких температур … 3. a. Какова растворимость KCl при 5 (C? _____ b. Какова растворимость KCl при 25 (C? _____ c. Какова растворимость Ce2 (SO4) 3 при 10 (C? _____ d. Какова растворимость) Ce2 (SO4) 3 при 50 (C? _____ 4. При 90 (C) вы растворили 10 г KCl в 100 г воды.
Вот пример того, как читать график. Найдите кривую для KClO3. При 30 ° C примерно 10 г KClO3 растворяется в 100 г воды. Если температура повышается до 80 ° C, примерно _____ вещества растворяется в 100 г (или 100 мл) воды. Каковы обычные единицы растворимости на кривых растворимости? … б. 10 г Ce2 (SO4) 3 при 10 ° C. c. 90 г KNO3 при 60oC. d. 65 г K2Cr2O7 при 80 ° C. Представлена низкотемпературная термохимическая модель системы Na-K-Ca-Mg-Cl-S04-Hz0. Водные виды и стандартные химические потенциалы реакций твердого раствора моделируются на основе опубликованных данных для бинарных и тройных растворов.Подчеркнут диапазон температур ниже 25 ° C (почти до -60 ° C), хотя параметры модели адаптированы для плавного слияния с параметрами более высоких температур … 3. a. Какова растворимость KCl при 5 (C? _____ b. Какова растворимость KCl при 25 (C? _____ c. Какова растворимость Ce2 (SO4) 3 при 10 (C? _____ d. Какова растворимость) Ce2 (SO4) 3 при 50 (C? _____ 4. При 90 (C) вы растворили 10 г KCl в 100 г воды. Насыщенный или ненасыщенный раствор? 5. Масса 100 г NaNO3 равна. ..
Насыщенный или ненасыщенный раствор? 5. Масса 100 г NaNO3 равна. ..
ПРАВИЛА РАСТВОРИМОСТИ ДЛЯ ИОННЫХ СОЕДИНЕНИЙ Ион, содержащийся в соединениях Исключения по растворимости Группа IA растворимый Nh5 + растворимый C2h4O2 — растворимый NO3 — растворимый Cl-, Br- и I- растворимый Ag +, Pb2 +, Hg2 2+ SO4 2- растворимый Ca2 +, Sr2 + , Ba2 +, Pb2 + CO3 2-, PO4 3-, CrO4 2- нерастворимая группа IA и Nh5 + S2- нерастворимая группа IA, IIA и Nh5 + Растворимость бикарбоната натрия в воде составляет 11,1 г NaHCO3 / 10O г h3O при 30 °. C и 16,4 г NaHCO3 / 100 г ч30 при 60 ° C. Если насыщенный раствор NaHCO3 при 60 ° C охлаждается и приходит в равновесие при 30 ° C, какой процент растворенной соли… Как показано на рисунке 3, A, M, D, C и W обозначают твердый NaBr, твердый MgBr 2 · 6H 2 O, твердый MgBr 2, твердый NaBr · 2H 2 O и H 2 O, соответственно; точка Q, инвариантная точка, отражает пересыщенный раствор MgBr 2 · 6H 2 O и NaBr · 2H 2 O при 313,15 К, с (NaBr) = 0,0418 и (MgBr 2) = 0,4781; N и H представляют растворимость MgBr 2 и NaBr в воде при 313,15 К соответственно. NH 3 и Ce2 (SO4) 2 5. Какое вещество меньше всего подвержено изменениям температуры? NaCl, 6. Сколько граммов хлорида аммония (NH 4 Cl) при 50 ° C? 50 г 7.NaCl и KClO 3 имеют одинаковую растворимость примерно при 78 o C. 8. Какое соединение наименее растворимо в воде при 10 ° C? KClO 3 9. Сколько граммов KNO 3 можно растворить при 50 o C? 80г 10. КРИВЫЕ РАСТВОРИМОСТИ. 1. Большинство веществ на этом графике показывают повышенную растворимость при повышении температуры. Какие файлы. исключения? Nh4 и Ce2 (SO4) 3. 2. Каждая кривая показывает, как изменяется растворимость этого вещества при изменении _ температуры _____. 3. Растворимость веществ, кривая которых показывает больший (более крутой) наклон, составляет (больше / меньше…
NH 3 и Ce2 (SO4) 2 5. Какое вещество меньше всего подвержено изменениям температуры? NaCl, 6. Сколько граммов хлорида аммония (NH 4 Cl) при 50 ° C? 50 г 7.NaCl и KClO 3 имеют одинаковую растворимость примерно при 78 o C. 8. Какое соединение наименее растворимо в воде при 10 ° C? KClO 3 9. Сколько граммов KNO 3 можно растворить при 50 o C? 80г 10. КРИВЫЕ РАСТВОРИМОСТИ. 1. Большинство веществ на этом графике показывают повышенную растворимость при повышении температуры. Какие файлы. исключения? Nh4 и Ce2 (SO4) 3. 2. Каждая кривая показывает, как изменяется растворимость этого вещества при изменении _ температуры _____. 3. Растворимость веществ, кривая которых показывает больший (более крутой) наклон, составляет (больше / меньше…
9) При какой температуре хлорат калия (KClO3) и хлорид калия (KCl) имеют одинаковую растворимость в? воды? 10) При 50ºC 100 см3 воды. НАСЫЩЕННЫЙ. с сульфатом церия (Ce2 (SO4) 3). Сколько грамм сульфата церия. необходимо добавить для насыщения раствора при 0ºC? (ПОДСКАЗКА: сначала определите, сколько граммов уже было в исходном
% PDF-1. 2
%
1269 0 объект
>
endobj
xref
1269 74
0000000016 00000 н.
0000001835 00000 н.
0000004977 00000 н.
0000005207 00000 н.
0000005350 00000 н.
0000005619 00000 н.
0000005897 00000 н.
0000006109 00000 п.
0000006413 00000 н.
0000006682 00000 н.
0000006935 00000 п.
0000007151 00000 п.
0000007375 00000 н.
0000007641 00000 п.
0000007878 00000 п.
0000008051 00000 н.
0000008220 00000 н.
0000008490 00000 н.
0000008651 00000 п.
0000008819 00000 н.
0000009107 00000 н.
0000009406 00000 п.
0000009658 00000 н.
0000009806 00000 н.
0000010118 00000 п.
0000010287 00000 п.
0000010514 00000 п.
0000010780 00000 п.
0000011082 00000 п.
0000011341 00000 п.
0000011394 00000 п.
0000011652 00000 п.
0000011942 00000 п.
0000012205 00000 п.
0000012465 00000 п.
0000012740 00000 п.
0000012943 00000 п.
0000013193 00000 п.
0000013600 00000 п.
0000013790 00000 п.
0000014070 00000 п.
0000014231 00000 п.
0000014443 00000 п.
0000014730 00000 п.
2
%
1269 0 объект
>
endobj
xref
1269 74
0000000016 00000 н.
0000001835 00000 н.
0000004977 00000 н.
0000005207 00000 н.
0000005350 00000 н.
0000005619 00000 н.
0000005897 00000 н.
0000006109 00000 п.
0000006413 00000 н.
0000006682 00000 н.
0000006935 00000 п.
0000007151 00000 п.
0000007375 00000 н.
0000007641 00000 п.
0000007878 00000 п.
0000008051 00000 н.
0000008220 00000 н.
0000008490 00000 н.
0000008651 00000 п.
0000008819 00000 н.
0000009107 00000 н.
0000009406 00000 п.
0000009658 00000 н.
0000009806 00000 н.
0000010118 00000 п.
0000010287 00000 п.
0000010514 00000 п.
0000010780 00000 п.
0000011082 00000 п.
0000011341 00000 п.
0000011394 00000 п.
0000011652 00000 п.
0000011942 00000 п.
0000012205 00000 п.
0000012465 00000 п.
0000012740 00000 п.
0000012943 00000 п.
0000013193 00000 п.
0000013600 00000 п.
0000013790 00000 п.
0000014070 00000 п.
0000014231 00000 п.
0000014443 00000 п.
0000014730 00000 п.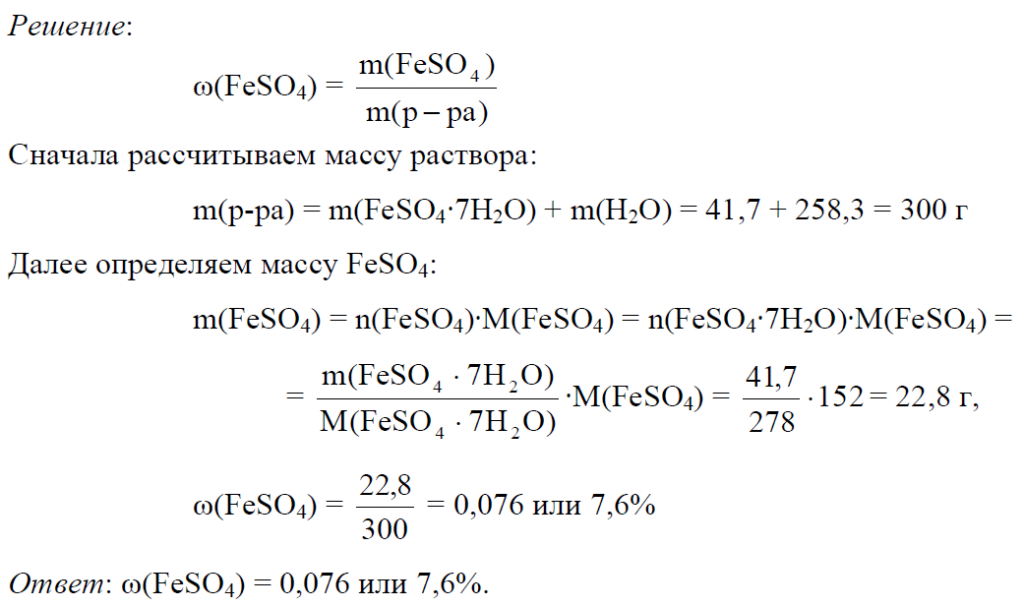

 у.) хлороводорода в 1 л воды. (Запишите число с точностью до десятых.)
у.) хлороводорода в 1 л воды. (Запишите число с точностью до десятых.) Массовая доля соли в полученном растворе равна ____%. (Запишите число с точностью до целых.)
Массовая доля соли в полученном растворе равна ____%. (Запишите число с точностью до целых.) Вычислите массовую долю соли (в процентах) в полученном растворе. (Запишите число с точностью до десятых.)
Вычислите массовую долю соли (в процентах) в полученном растворе. (Запишите число с точностью до десятых.) (Запишите число с точностью до десятых.)
(Запишите число с точностью до десятых.) Вычислите массовую долю (%) соли в полученном растворе. (Запишите число с точностью до десятых.)
Вычислите массовую долю (%) соли в полученном растворе. (Запишите число с точностью до десятых.) Вычислите массовую долю нитрата магния (в процентах) в полученном растворе. (Запишите число с точностью до целых.)
Вычислите массовую долю нитрата магния (в процентах) в полученном растворе. (Запишите число с точностью до целых.)
 Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора. ) + 5Na 2 SO 4 (вод.) + 10CO 2 (г) + 8H 2 O ()
) + 5Na 2 SO 4 (вод.) + 10CO 2 (г) + 8H 2 O ()
 995342 г / 9,62 г = 20,7416%
995342 г / 9,62 г = 20,7416%
 ) + Ce 4+ (водн.) —> Fe 3+ (водн.) + Ce 3+ (водн.)
) + Ce 4+ (водн.) —> Fe 3+ (водн.) + Ce 3+ (водн.) 00103214 моль / 0,03655 L = 0,02824 M (для четырех сигнатур)
00103214 моль / 0,03655 L = 0,02824 M (для четырех сигнатур) ) + Mo 3+ (водн.) —> Mn 2+ (водн.) + MoO 2 2+ (водн.)
) + Mo 3+ (водн.) —> Mn 2+ (водн.) + MoO 2 2+ (водн.) 00161792 моль перманганатных раз (5 моль железа (II) / 1 моль перманганата) = 0,0080896 моль железа (II)
00161792 моль перманганатных раз (5 моль железа (II) / 1 моль перманганата) = 0,0080896 моль железа (II) 025 моль / л) (0,0100 л) = 0,00025 моль
025 моль / л) (0,0100 л) = 0,00025 моль
Leave A Comment