Как изменяется радиус атома в периодической системе?
Как изменяется радиус атома в периодической системе?
Радиусы атомов уменьшаются в периодической таблице, потому что с увеличением атомного номера увеличивается число протонов в атоме, а дополнительные электроны добавляются в одну и ту же квантовую оболочку.
Как растет радиус атома?
Видно, что в пределах группы атомный радиус увеличивается сверху вниз. Это объясняется тем, что элементы одной группы отличаются числом электронных слоёв, а чем их больше, тем больше размер атома. С другой стороны, в пределах периода атомный радиус уменьшается слева направо.
Как можно оценить размеры ядра атома?
Самый стандартный способ — это улучшенная разновидность классического опыта Резерфорда: размер ядра можно узнать по тому, как на нем рассеиваются заряженные частицы. Но тут есть любопытный момент: оказывается, у ядра может быть несколько разных размеров: протонный радиус, материальный радиус, зарядовый радиус и т. д.
д.
Как увеличивается радиус атома в таблице?
С увеличением порядкового номера в группе радиусы атомов увеличиваются. В каждой группе самые большие радиусы у элементов седьмого периода. У элементов одного периода число энергетических уровней в атомах одинаково. Увеличиваются заряд ядра и число внешних электронов.
Каков примерно диаметр атома в СМ и М?
Атомное ядро — тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома. Размеры ядра: диаметр порядка 10-12—10-13 см (у разных ядер диаметры различны). Размер атома: примерно 10-8 см, т. е.
Что такое атом из каких частиц он состоит?
Атомы состоят из ядра и электронов (точнее, электронного «облака»). Ядро атома состоит из протонов и нейтронов. Количество нейтронов в ядре может быть разным: от нуля до нескольких десятков. Если число электронов совпадает с числом протонов в ядре, то атом в целом оказывается электрически нейтральным.
Как атомы соединяются в молекулы?
Атомы соединяются в молекулу за счет химических связей, основанных на электрическом взаимодействии. Число атомов в молекуле может быть разным. Молекула может состоять из одного атома, из двух, трех и даже нескольких сотен атомов. … Между молекулами любого тела существуют силы взаимодействия – притяжения и отталкивания.
В чем разница между атомами и молекулами?
Атом является элементарной частицей вещества. … Они связываются друг с другом и образуют молекулы, благодаря электрическим зарядам частиц, из которых они состоят. Молекула — это то, из чего состоит вещество. В состав молекул могут входить два и более атомов, которые между собой связаны межатомными связями.
Чем отличается атом?
Атомы различных химических элеменов отличаютя друг от друга количеством протонов в ядре и количеством электронов. Т. к. атомы электрически нейтральны, количество протонов в атоме равно количеству электронов и определяет порядковый номер элемента, а соответственно, и его свойства.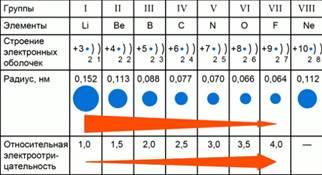
Что такое ион чем он отличается от атома?
Ионы (от греч. «идущий») образуются из обычных, электрически нейтральных атомов. Атомы вещества состоят из положительно заряженных протонов, отрицательно заряженных электронов и нейтронов, единственной значимой характеристикой которых является масса.
Что называют атомным ядром?
А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом.
Атомный радиус, как он измеряется, как он изменяется в периодической таблице, примеры / химия | Thpanorama
атомный радиус это важный параметр для периодических свойств элементов таблицы Менделеева. Это напрямую связано с размером атомов, поскольку на большем радиусе они больше или громоздче. Кроме того, это связано с электронными характеристиками того же.
Пока атом имеет больше электронов, тем больше его размер и атомный радиус. Оба определяются электронами валентной оболочки, потому что на расстояниях за пределами их орбит вероятность обнаружения электрона приближается к нулю. В окрестности ядра происходит обратное: увеличивается вероятность нахождения электрона.
Оба определяются электронами валентной оболочки, потому что на расстояниях за пределами их орбит вероятность обнаружения электрона приближается к нулю. В окрестности ядра происходит обратное: увеличивается вероятность нахождения электрона.
Верхнее изображение представляет собой упаковку ватных шариков. Обратите внимание, что каждый из них окружен шестью соседями, не считая другого возможного верхнего или нижнего ряда. Способ уплотнения ватных шариков будет определять их размеры и, следовательно, их радиусы; как это происходит с атомами.
Элементы в соответствии с их химической природой так или иначе взаимодействуют со своими собственными атомами. Следовательно, величина атомного радиуса варьируется в зависимости от типа присутствующей связи и твердой упаковки ее атомов..
индекс
- 1 Как измеряется атомный радиус?
- 1.1 Определение межъядерного расстояния
- 1.2 Единицы
- 2 Как это меняется в периодической таблице?
- 2.1 За период
- 2.
 2 По убыванию по группе
2 По убыванию по группе - 2.3 Сокращение лантаноидов
- 3 примера
- 4 Ссылки
На основном изображении можно легко измерить диаметр ватных шариков, а затем разделить его на два. Однако сфера атома не полностью определена. Почему? Потому что электроны циркулируют и диффундируют в определенных областях пространства: орбитали.
Поэтому атом можно рассматривать как сферу с неощутимыми краями, о которых невозможно точно сказать, в какой степени они заканчиваются. Например, на верхнем изображении центральная область около ядра выглядит более интенсивной, а ее края размыты.
Изображение представляет двухатомную молекулу E2 (как Cl2, H2, О2, и т.д.). Предполагая, что атомы являются сферическими телами, если расстояние было определено d что разделяет оба ядра в ковалентной связи, то было бы достаточно разделить его на две половины (d/ 2) получить атомный радиус; точнее, ковалентный радиус E для E2.
А если Е не образует с собой ковалентных связей, но это металлический элемент? то d это будет указано числом соседей, которые окружают Е в его металлической структуре; то есть по координационному числу (N.C) атома в упаковке (помните ватные шарики основного изображения).
Определение межъядерного расстоянияОпределить d, это межъядерное расстояние для двух атомов в молекуле или упаковке, это требует методов физического анализа.
Одной из наиболее часто используемых является дифракция рентгеновских лучей, в которой пучок света облучается через кристалл, и изучается дифракционная картина, возникающая в результате взаимодействия электронов с электромагнитным излучением. В зависимости от упаковки могут быть получены различные дифракционные картины и, следовательно, другие значения d.
Если атомы «плотно» в кристаллической решетке, они будут представлять разные значения d по сравнению с тем, что они имели бы, если бы они были «удобными». Кроме того, эти межъядерные расстояния могут колебаться в значениях, поэтому атомный радиус фактически состоит из среднего значения таких измерений.
Кроме того, эти межъядерные расстояния могут колебаться в значениях, поэтому атомный радиус фактически состоит из среднего значения таких измерений.
Как связаны атомный радиус и координационное число? В. Гольдшмидт установил взаимосвязь между ними, в которой для N.C. из 12 относительное значение равно 1; от 0,97 для упаковки, где атом имеет N.C, равный 8; 0,96 для N.C, равного 6; и 0,88 для N.C. из 4.
единицыИз значений для N.C, равных 12, было построено много таблиц, сравнивающих атомные радиусы всех элементов периодической таблицы..
Поскольку не все элементы образуют такие компактные структуры (N.C меньше 12), соотношение В. Гольдшмидта используется для расчета их атомных радиусов и выражения для одной и той же упаковки. Таким образом, измерения атомных радиусов стандартизированы.
Но в каких единицах они выражают себя? при условии d имеет очень малую величину, следует прибегнуть к единицам ангстрем Å (10 ∙ 10-10м) или также широко используемый, пикометр (10 ∙ 10-12м).
Атомные радиусы, определенные для металлических элементов, имеют название металлических радиусов, а для неметаллических элементов — ковалентные радиусы (такие как фосфор, P4, или сера, S8). Однако между обоими типами радиостанций существует более заметное различие, чем название.
Слева направо в тот же период, ядро добавляет протоны и электроны, но последние ограничены тем же уровнем энергии (главное квантовое число). Как следствие, ядро оказывает увеличивающийся эффективный заряд ядра на валентные электроны, который сжимает атомный радиус..
Таким образом, неметаллические элементы в тот же период имеют тенденцию иметь атомные (ковалентные) радиусы меньше, чем металлы (металлические радиусы).
По убыванию группойПри спуске по группе включаются новые уровни энергии, которые позволяют электронам иметь больше места. Таким образом, электронное облако преодолевает большие расстояния, его размытая периферия все больше отдаляется от ядра, и, следовательно, радиус атома расширяется.
Таким образом, электронное облако преодолевает большие расстояния, его размытая периферия все больше отдаляется от ядра, и, следовательно, радиус атома расширяется.
Электроны внутреннего слоя помогают экранировать эффективный заряд ядра на валентных электронах. Когда орбитали, составляющие внутренние слои, имеют много «дырок» (узлов), как и в случае f-орбиталей, ядро сильно сжимает атомный радиус из-за плохого экранирующего эффекта орбиталей..
Этот факт подтверждается сокращением лантаноидов в период 6 периодической таблицы. От La до Hf происходит значительное сжатие атомного радиуса, создаваемого орбиталями f, которые «заполняются» при прохождении через блок f: у лантаноидов и актиноидов.
Аналогичный эффект можно наблюдать и с элементами блока p периода 4. На этот раз произведение слабого экранирующего эффекта орбиталей d, которые заполняются при пересечении периодов переходных металлов..
примеровДля периода 2 периодической таблицы атомные радиусы ее элементов:
-Li: 257 вечера
-Быть: 112 вечера
-B: 88 вечера
-C: 77 вечера
-N: 74 вечера
-O: 66 вечера
-F: 64 вечера
Обратите внимание, что металлический литий имеет наибольший атомный радиус (257 мкм), в то время как фтор, расположенный в крайней правой части периода, является наименьшим из них (64 мкм). Атомный радиус уменьшается слева направо за тот же период, и перечисленные значения показывают его.
Атомный радиус уменьшается слева направо за тот же период, и перечисленные значения показывают его.
Литий, образуя металлические связи, его радиус металлический; и фтор, поскольку он образует ковалентные связи (F-F), его радиус является ковалентным.
А если вы хотите выразить атомные радиостанции в единицах ангстрема? Просто разделите их на 100: (257/100) = 2,57Å. И так далее с остальными ценностями.
ссылки- Химия 301. Атомные радиусы. Получено из: ch401.cm.utexas.edu
- Фонд СК-12. (28 июня 2016 г.) Атомный Радиус. Получено от: chem.libretexts.org
- Тенденции в атомной радиии. Взято из: intro.chem.okstate.edu
- Общественный Колледж Клакамас. (2002). Атомный Размер. Получено от: dl.clackamas.edu
- Кларк Дж. (Август 2012). Атомный и ионный радиус. Получено от: chemguide.co.uk
- Дрожь и Аткинс. (2008). Неорганическая химия (Четвертое издание. С. 23, 24, 80, 169). Mc Graw Hill.
Атомные Радиусы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 610
Атомные радиусы полезны для определения многих аспектов химии, таких как различные физические и химические свойства.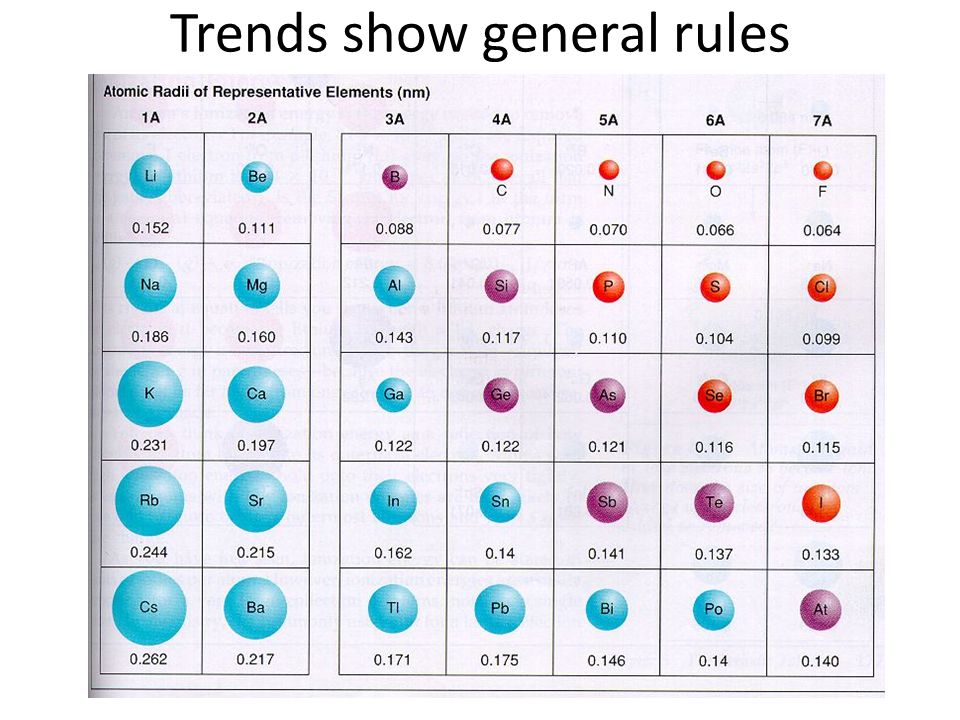 Периодическая таблица очень помогает в определении атомного радиуса и представляет ряд тенденций.
Периодическая таблица очень помогает в определении атомного радиуса и представляет ряд тенденций.
Определение
Радиус атома обычно определяется как общее расстояние от ядра атома до самой внешней орбиты электрона. Проще говоря, его можно определить как что-то похожее на радиус круга, где центр круга — это ядро, а внешний край круга — самая внешняя орбиталь электрона. По мере того, как вы начинаете перемещаться по таблице Менделеева или вниз, появляются тенденции, которые помогают объяснить, как изменяются атомные радиусы.
Эффективный заряд ядра (\(Z_{eff}\)) атома представляет собой суммарный положительный заряд, ощущаемый валентным электроном. Некоторый положительный заряд экранирован остовными электронами, поэтому общий положительный заряд не ощущается валентным электроном. Подробное описание экранирования и эффективного ядерного заряда можно найти здесь. \(Z_{eff}\) сильно влияет на атомный размер атома. Таким образом, по мере уменьшения \(Z_{eff}\) атомный радиус будет увеличиваться в результате, потому что электроны больше экранируются от ядра, что уменьшает притяжение между ядром и электроном. Так как \(Z_{eff}\)убывает вниз по группе и справа налево по таблице Менделеева, атомный радиус будет увеличение вниз по группе и справа налево по таблице Менделеева.
Так как \(Z_{eff}\)убывает вниз по группе и справа налево по таблице Менделеева, атомный радиус будет увеличение вниз по группе и справа налево по таблице Менделеева.
Типы радиусов по отношению к типам связей
Определение атомных радиусов довольно сложно, потому что существует неопределенность в положении самого удаленного электрона — мы не знаем точно, где находится электрон. Это явление можно объяснить принципом неопределенности Гейзенберга. Чтобы получить точное измерение радиуса, но все же не совсем правильное измерение, мы определяем радиус, исходя из расстояния между ядрами двух связанных атомов. Следовательно, радиусы атомов определяются связями, которые они образуют. Атом будет иметь разные радиусы в зависимости от связи, которую он образует; поэтому нет фиксированного радиуса атома.
Ковалентный радиус
Когда между двумя атомами присутствует ковалентная связь, можно определить ковалентный радиус. Когда два атома одного и того же элемента связаны ковалентной связью, радиус каждого атома будет составлять половину расстояния между двумя ядрами, потому что они одинаково притягивают электроны.
Ковалентные радиусы будут увеличиваться по той же схеме, что и атомные радиусы. Причина этой тенденции в том, что чем больше радиусы, тем больше расстояние между двумя ядрами. См. объяснение для \(Z_{eff}\) для более подробной информации.
Ковалентный радиус, показанный ниже на рисунке 1, будет одинаковым для обоих атомов, потому что они принадлежат к одному и тому же элементу, как показано X. образуя ионную связь или ион. Радиус каждого атома в ионной связи будет отличаться от радиуса в ковалентной связи. Это важная концепция. Причина изменчивости радиуса связана с тем, что атомы в ионной связи сильно различаются по размеру. Один из атомов представляет собой катион, который меньше по размеру, а другой атом представляет собой анион, который намного больше по размеру. Таким образом, чтобы учесть эту разницу, нужно получить общее расстояние между двумя ядрами и разделить это расстояние в соответствии с размером атома.
Пример 1: Сульфид кадмия
Если бы мы могли определить атомный радиус атома из экспериментов, скажем, Se, который имел атомный радиус 178 пм, тогда мы могли бы определить атомный радиус любого другого атома, связанного с Se, путем вычитания размера атомного радиуса Se из общего расстояния между двумя ядрами. Так, если бы мы имели соединение CaSe, имеющее общее расстояние 278 пм между ядром атома Са и атомом Se, то атомный радиус атома Са будет 278 пм (общее расстояние) — 178 пм (расстояние Se), или 100 часов вечера. Этот процесс можно применить к другим примерам ионного радиуса.
Подробное объяснение приведено ниже:
- Катион, представляющий собой ион с положительным зарядом, по определению имеет меньше электронов, чем протонов. Следовательно, потеря электрона приведет к изменению атомных радиусов по сравнению с интересующим нейтральным атомом (без заряда).
- Потеря электрона означает, что теперь в атоме больше протонов, чем электронов, что указано выше. Это вызовет
- Аналогией этому может быть магнит и металлический предмет. Если десять магнитов и десять металлических предметов представляют нейтральный атом, где магниты — протоны, а металлические предметы — электроны, то удаление одного металлического предмета, что подобно удалению электрона, заставит магнит притягивать металлические предметы ближе из-за уменьшения по количеству металлических предметов.

На рис. 3 ниже показан этот процесс. Здесь показано, что нейтральный атом X имеет длину связи 180 пм, а затем катион X + меньше с длиной связи 100 пм.
Рис. 3: Ионный радиус уменьшается при образовании положительных ионов. Анион , с другой стороны, будет больше по размеру, чем размер атома, из которого он был сделан, из-за прироста электрона. Это можно увидеть на Рисунке 4 ниже. Прирост электрона добавляет больше электронов к самой внешней оболочке, которая
Металлический радиус
Металлический радиус — это радиус атома, соединенного металлической связью. Металлический радиус равен половине общего расстояния между ядрами двух соседних атомов в металлическом кластере. Поскольку металл будет группой атомов одного и того же элемента, расстояние между каждым атомом будет одинаковым (рис. 5).
Металлический радиус равен половине общего расстояния между ядрами двух соседних атомов в металлическом кластере. Поскольку металл будет группой атомов одного и того же элемента, расстояние между каждым атомом будет одинаковым (рис. 5).
Периодические тренды атомного радиуса
- Атом становится больше по мере увеличения количества электронных оболочек; поэтому радиус атомов увеличивается по мере того, как вы спускаетесь на определенную группу в периодической таблице элементов.
- Как правило, размер атома будет уменьшаться при движении слева направо в течение определенного периода.
Вертикальный тренд
Радиус атомов увеличивается по мере продвижения вниз по определенной группе.
Горизонтальный тренд
Размер атома будет уменьшаться при движении слева направо по периоду.
ИСКЛЮЧЕНИЯ: Поскольку электроны, добавленные в переходных элементах, добавляются во внутреннюю электронную оболочку, и в то же время внешняя оболочка остается постоянной, ядро притягивает электроны внутрь. Электронная конфигурация переходных металлов объясняет это явление. Вот почему Ga имеет тот же размер, что и его предыдущий атом, и почему Sb немного больше, чем Sn.
Электронная конфигурация переходных металлов объясняет это явление. Вот почему Ga имеет тот же размер, что и его предыдущий атом, и почему Sb немного больше, чем Sn.
Ссылки
- Полинг, Линус. Атомные радиусы и межатомные расстояния в металле, Журнал Американского химического общества 1947 69 (3), 542-553
- Петруччи, Ральф Х., Уильям С. Харвуд, Джеффри Ф. Херринг и Джеффри Д. Мадура. Общая химия . 9-е изд. Нью-Джерси: Пирсин Прентис Холл, 2007 г. .
Задачи
- Какой атом больше: K или Br?
- Какой атом больше: Na или Cl?
- Какой атом меньше: Be или Ba?
- Какой атом больше: К + или К?
- Расположите в порядке от большего к меньшему: F, Ar, Sr, Cs.
- Если ионный радиус Br составляет 100 пм, а общее расстояние между K и Br в KBr составляет 150 пм, то каков ионный радиус K?
- У которого меньший атомный радиус: Cs + или Хе?
- Если расстояние между ядрами двух атомов в металлической связи составляет 180 пм, каков атомный радиус одного атома?
- Если Z эффективное увеличивается, увеличивается ли атомный радиус?
*Подсказка* При решении задачи о связи радиуса сначала определите связь, а затем используйте стандартный метод определения радиуса для этой конкретной связи.
Ответы
- К
- На
- Быть
- К
- Cs, Sr, Ar, F
- Se 2 —
- 17:00
- Cs +
- 90 вечера
- №
Atomic Radii распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- атомные радиусы
- ковалентный атомный радиус
- эффективный ядерный заряд
- экран
Понимание трендов атомного радиуса: 2 ключевых принципа
Нужна информация о трендах атомного радиуса? Какова тенденция атомного радиуса? В этом руководстве мы четко объясним тренды атомного радиуса и то, как они работают. Мы также обсудим исключения из тенденций и то, как вы можете использовать эту информацию как часть более широкого понимания химии.
Прежде чем мы углубимся в тенденции атомного радиуса, давайте рассмотрим некоторые основные термины. Атом — это основная единица химического элемента, такого как водород, гелий, калий и т. д. Радиус — это расстояние между центром объекта и его внешним краем.
д. Радиус — это расстояние между центром объекта и его внешним краем.
Атомный радиус равен половине расстояния между ядрами двух атомов. Атомные радиусы измеряются в пикометрах (один пикометр равен одной триллионной части метра). Водород (H) имеет наименьший средний атомный радиус около 25 часов, в то время как цезий (Cs) имеет самый большой средний радиус около 260 часов.
Каковы тренды атомного радиуса? Что их вызывает?
Существуют две основные тенденции атомного радиуса. Одна тенденция атомного радиуса возникает при перемещении слева направо по периодической таблице (движение в пределах периода), а другая тенденция возникает при движении сверху вниз по периодической таблице (движение внутри группы). Ниже приведена периодическая таблица со стрелками, показывающая, как изменяются атомные радиусы , чтобы помочь вам понять и визуализировать каждую тенденцию атомного радиуса. В конце этого раздела находится диаграмма с расчетным эмпирическим атомным радиусом для каждого элемента.
Тенденция атомного радиуса 1: атомные радиусы уменьшаются слева направо по периоду
Первая периодическая тенденция атомного радиуса заключается в том, что размер атома уменьшается по мере движения слева направо по периоду. В периоде элементов каждый новый электрон добавляется к одной и той же оболочке. Когда добавляется электрон, к ядру также добавляется новый протон, что придает ядру более сильный положительный заряд и большее ядерное притяжение.
Это означает, что по мере добавления протонов ядро получает более сильный положительный заряд, который сильнее притягивает электроны и притягивает их ближе к ядру атома. Электроны притягиваются ближе к ядру, уменьшая радиус атома.
Сравнивая углерод (C) с атомным номером 6 и фтор (F) с атомным номером 9, мы можем сказать, что, основываясь на трендах атомного радиуса, атом углерода будет иметь больший радиус, чем атом фтора. , так как три дополнительных протона, которые есть у фтора, притягивают его электроны ближе к ядру и уменьшают радиус фтора. И это правда; углерод имеет средний атомный радиус около 70 пм, а фтор — около 50 пм.
И это правда; углерод имеет средний атомный радиус около 70 пм, а фтор — около 50 пм.
Тенденция 2 атомного радиуса: атомные радиусы увеличиваются по мере продвижения вниз по группе
Вторая периодическая тенденция атомного радиуса заключается в том, что атомных радиусов увеличиваются по мере того, как вы перемещаетесь вниз по группе в периодической таблице. Для каждой группы, которую вы перемещаете вниз, атом получает дополнительную электронную оболочку. Каждая новая оболочка находится дальше от ядра атома, что увеличивает атомный радиус.
Хотя вы можете подумать, что валентные электроны (находящиеся во внешней оболочке) будут притягиваться к ядру, экранирование электронов предотвращает это. Экранирование электронов относится к уменьшению притяжения между внешними электронами и ядром атома всякий раз, когда атом имеет более одной электронной оболочки. Итак, из-за электронного экранирования валентные электроны не подходят особенно близко к центру атома, и поскольку они не могут подобраться так близко, атом имеет больший радиус.
Например, калий (K) имеет больший средний атомный радиус (220 пм), чем натрий (Na) (180 пм). Атом калия имеет дополнительную электронную оболочку по сравнению с атомом натрия, что означает, что его валентные электроны находятся дальше от ядра, что дает калию больший атомный радиус.
Эмпирические атомные радиусы
| Атомный номер | Символ | Имя элемента 903:30 | Эмпирический атомный радиус (пм) |
| 1 | Х | Водород | 25 |
| 2 | Он | Гелий | Нет данных |
| 3 | Ли | Литий | 145 |
| 4 | Быть | Бериллий | 105 |
| 5 | Б | Бор | 85 |
| 6 | С | Углерод | 70 |
| 7 | Н | Азот | 65 |
| 8 | О | Кислород | 60 |
| 9 | Ф | Фтор | 50 |
| 10 | Не | Неон | Нет данных |
| 11 | На | Натрий | 180 903:30 |
| 12 | Мг | Магний | 150 |
| 13 | Ал | Алюминий | 125 |
| 14 | Си | Кремний | 110 |
| 15 | Р | Фосфор | 100 |
| 16 | С | Сера | 100 |
| 17 | Кл | Хлор 903:30 | 100 |
| 18 | Ар | Аргон | Нет данных |
| 19 | К | Калий | 220 |
| 20 | Са | Кальций | 180 |
| 21 | Sc | Скандий | 160 |
| 22 | Ти | Титан | 140 |
| 23 | В | Ванадий | 135 |
| 24 | Кр | Хром | 140 |
| 25 | Мн | Марганец | 140 |
| 26 | Фе | Железо | 140 |
| 27 | Со | Кобальт | 135 |
| 28 | Ni | Никель | 135 |
| 29 | Медь | Медь | 135 |
| 30 | Цинк | Цинк | 135 |
| 31 | Га | Галлий | 130 |
| 32 | Гэ | Германий | 125 |
| 33 | Как | Мышьяк | 115 |
| 34 | Se | Селен | 115 |
| 35 | Бр | Бром | 115 |
| 36 | Кр | Криптон | Нет данных |
| 37 | руб | Рубидий | 235 |
| 38 | Старший | Стронций | 200 |
| 39 | Д | Иттрий | 180 |
| 40 | Цр 903:30 | Цирконий | 155 |
| 41 | № | Ниобий | 145 |
| 42 | Пн | Молибден | 145 |
| 43 | Тк | Технеций | 135 |
| 44 | Ру | Рутений | 130 |
| 45 | Rh | Родий | 135 |
| 46 | Pd | Палладий | 140 |
| 47 | Аг | Серебро | 160 |
| 48 | CD | Кадмий | 155 |
| 49 | В | Индий | 155 |
| 50 | Сн | Олово | 145 |
| 51 | Сб | Сурьма | 145 903:30 |
| 52 | Те | Теллур | 140 |
| 53 | я | Йод | 140 |
| 54 | Хе | Ксенон | Нет данных |
| 55 | цезий | Цезий | 260 |
| 56 | Ба | Барий | 215 |
| 57 | Ла | Лантан 903:30 | 195 |
| 58 | Се | Церий | 185 |
| 59 | Пр | Празеодим | 185 |
| 60 | Нд | Неодим | 185 |
| 61 | вечера | Прометий | 185 |
| 62 | См | Самарий | 185 |
| 63 | ЕС | Европий | 185 |
| 64 | Гд | Гадолиний | 180 |
| 65 | Тб | Тербий | 175 |
| 66 | Дай | Диспрозий | 175 |
| 67 | Хо | Гольмий | 175 |
| 68 | Er | Эрбий | 175 |
| 69 | Тм | Тулий | 175 |
| 70 | Ыб | Иттербий | 175 |
| 71 | Лу | Лютеций | 175 |
| 72 | Хф | Гафний | 155 |
| 73 | Та | Тантал | 145 |
| 74 | Вт | Вольфрам 903:30 | 135 |
| 75 | Ре | Рений | 135 |
| 76 | ОС | Осмий | 130 |
| 77 | Ир | Иридий | 135 |
| 78 | Пт | Платина | 135 |
| 79 | Золото | Золото | 135 |
| 80 | рт. ст. 903:30 ст. 903:30 | Меркурий | 150 |
| 81 | Тл | Таллий | 190 |
| 82 | Пб | Свинец | 180 |
| 83 | Би | Висмут | 160 |
| 84 | ПО | Полоний | 190 |
| 85 | В | Астатин | Нет данных |
| 86 | РН | Радон | Нет данных |
| 87 | Пт | Франций | Нет данных |
| 88 | Ра | Радий | 215 |
| 89 | Ас | Актиний | 195 |
| 90 | Т | Торий | 180 |
| 91 | Па | Протактиний | 180 |
| 92 | У | Уран | 175 |
| 93 | Нп | Нептуний | 175 |
| 94 | Пу | Плутоний | 175 |
| 95 | утра | Америций | 175 |
| 96 | См | Кюриум | Нет данных |
| 97 | К. 903:30 903:30 | Берклиум | Нет данных |
| 98 | См. | Калифорния | Нет данных |
| 99 | Эс | Эйнштейний | Нет данных |
| 100 | FM | Фермиум | Нет данных |
| 101 | Мд | Менделевий | Нет данных |
| 102 | № | Нобелий | Нет данных |
| 103 | Лр | Лоуренсиум | Нет данных |
| 104 | Рф | Резерфордий | Нет данных |
| 105 | Дб | Дубниум | Нет данных |
| 106 | Сг | Сиборгиум | Нет данных |
| 107 | Бх | Борий | Нет данных |
| 108 | Гс | Хассиум | Нет данных |
| 109 | Мт | Мейтнерий | Нет данных |
| 110 | Дс | Дармштадтиум | Нет данных |
| 111 | Рг | рентгений | Нет данных |
| 112 | Сп | Коперниций | Нет данных |
| 113 | Нх | Нихоний | Нет данных |
| 114 | Фл | Флеровиум | Нет данных |
| 115 | Мк | Московиум | Нет данных |
| 116 | ур. | Ливермориум | Нет данных |
| 117 | Ц | Теннесси | Нет данных |
| 118 | Ог | Оганессон 903:30 | Нет данных |
Источник: Webelements
3 Исключения из трендов атомного радиуса
Два тренда атомного радиуса, которые мы обсуждали выше, верны для большинства элементов Периодической таблицы элементов. Однако есть несколько исключений из этих тенденций.
Единственным исключением являются инертные газы. Шесть благородных газов в группе 18 периодической таблицы: гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). Благородные газы являются исключением, потому что они связываются иначе, чем другие атомы, и атомы благородных газов не становятся так близко друг к другу, когда они связываются. Поскольку атомный радиус составляет половину расстояния между ядрами двух атомов , то, насколько близко эти атомы друг к другу, влияет на атомный радиус.
У каждого из благородных газов внешняя электронная оболочка полностью заполнена, что означает, что атомов благородных газов удерживаются вместе силами Ван-дер-Ваальса, а не посредством связей. Силы Ван-дер-Ваальса не так сильны, как ковалентные связи, поэтому два атома, соединенные силами Ван-дер-Ваальса, не подходят друг к другу так близко, как два атома, соединенных ковалентной связью. Это означает, что радиусы благородных газов будут завышены, если мы попытаемся найти их эмпирические радиусы, поэтому ни один из благородных газов не имеет эмпирического радиуса и, таким образом, не следует тенденциям атомного радиуса.
Ниже приведена очень упрощенная схема четырех атомов примерно одинакового размера. Два верхних атома связаны ковалентной связью, что приводит к некоторому перекрытию между атомами. Два нижних атома — это атомы благородных газов, и они связаны силами Ван-дер-Ваальса, которые не позволяют атомам сблизиться друг с другом.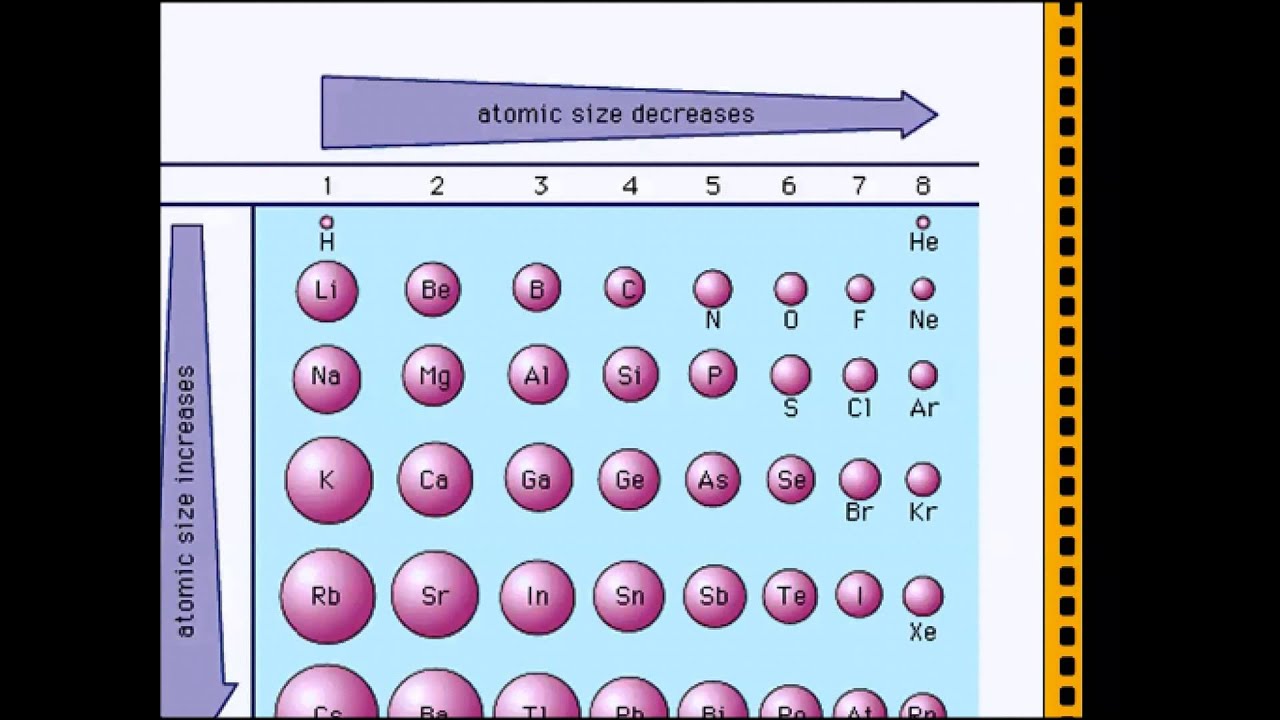 Красные стрелки обозначают расстояние между ядрами. Половина этого расстояния равна радиусу атома. Как видите, хотя все четыре атома имеют примерно одинаковый размер, радиус инертного газа намного больше, чем радиус других атомов. При сравнении двух радиусов атомы инертных газов кажутся больше, хотя это не так. Включение радиусов благородных газов дало бы людям неточное представление о том, насколько велики атомы благородных газов. Поскольку атомы благородных газов связываются по-разному, их радиусы нельзя сравнивать с радиусами других атомов, поэтому они не следуют тенденциям атомного радиуса.
Красные стрелки обозначают расстояние между ядрами. Половина этого расстояния равна радиусу атома. Как видите, хотя все четыре атома имеют примерно одинаковый размер, радиус инертного газа намного больше, чем радиус других атомов. При сравнении двух радиусов атомы инертных газов кажутся больше, хотя это не так. Включение радиусов благородных газов дало бы людям неточное представление о том, насколько велики атомы благородных газов. Поскольку атомы благородных газов связываются по-разному, их радиусы нельзя сравнивать с радиусами других атомов, поэтому они не следуют тенденциям атомного радиуса.
Другие исключения включают ряды лантанидов и актиноидов в нижней части периодической таблицы. Эти группы элементов отличаются от большей части остальной части таблицы Менделеева и не следуют многим тенденциям, как другие элементы. Ни один из рядов не имеет четкой тенденции атомного радиуса.
Как вы можете использовать эту информацию?
Хотя вам, вероятно, не понадобится знать атомный радиус различных элементов в повседневной жизни, эта информация все же может быть полезна, если вы изучаете химию или другую смежную область. Как только вы поймете каждую ключевую тенденцию периода атомного радиуса, вам будет легче понять другую информацию об элементах.
Как только вы поймете каждую ключевую тенденцию периода атомного радиуса, вам будет легче понять другую информацию об элементах.
Например, вы можете помнить, что благородные газы являются исключением из тенденций атомного радиуса, поскольку они имеют полную внешнюю электронную оболочку. Эти внешние электронные оболочки также делают благородные газы инертными и стабильными. Эта стабильность может быть удобной. Например, воздушные шары обычно наполняют гелием, а не водородом, потому что гелий гораздо более стабилен и, следовательно, менее воспламеняем и безопаснее в использовании.
Вы также можете использовать атомные радиусы, чтобы оценить, насколько реактивными будут различные элементы. Атомы с меньшим радиусом более реакционноспособны, чем атомы с большим радиусом. Галогены (в группе 17) имеют наименьшие средние радиусы в периодической таблице. Фтор имеет наименьший атомный радиус галогенов (что имеет смысл, исходя из тенденций), и это делает его очень реакционноспособным. Простое добавление фтора в воду вызовет пламя, поскольку фтор превращается в газ.
Простое добавление фтора в воду вызовет пламя, поскольку фтор превращается в газ.
Резюме: Периодические тренды Атомный радиус
Существуют два основных тренда атомного радиуса. Первая периодическая тенденция атомного радиуса заключается в том, что атомные радиусы увеличиваются по мере того, как вы двигаетесь вниз в группе. Это происходит из-за электронного экранирования. Когда добавляется дополнительная оболочка, эти новые электроны оказываются дальше от ядра атома, что увеличивает радиус атома. Вторая периодическая тенденция атомного радиуса заключается в том, что размер атома уменьшается слева направо в течение периода , потому что более сильный положительный заряд атома из-за большего количества протонов сильнее притягивает электроны и притягивает их ближе к ядру, уменьшая размер атома.
Есть несколько исключений из этих тенденций, в частности благородные газы, которые не образуют связей, как это делают большинство других атомов, а также ряды лантанидов и актинидов. Вы можете использовать эту информацию, чтобы лучше понять периодическую таблицу, как связаны атомы и почему одни элементы более реакционноспособны, чем другие.
Вы можете использовать эту информацию, чтобы лучше понять периодическую таблицу, как связаны атомы и почему одни элементы более реакционноспособны, чем другие.
Что дальше?
Хотите освежить знания по молекулярной химии? Рассмотрите различные виды гидратов, как работает электроотрицательность, а также использование (и ограничения) атомной модели Бора.
Изучаете химию и нуждаетесь в помощи? У нас есть учебные пособия для AP Chem и IB Chemistry, а также общий обзор Regents Chemistry для учащихся средних школ Нью-Йорка.
Погружаетесь в удивительный мир биохимии? Узнайте о шести типах ферментов и химическом составе нуклеотидов.
Нужна дополнительная помощь по этой теме? Проверьте Tutorbase!
Наша проверенная база данных репетиторов включает ряд опытных преподавателей, которые могут помочь вам отшлифовать эссе по английскому языку или объяснить, как производные работают в исчислении. Вы можете использовать десятки фильтров и критериев поиска, чтобы найти идеального человека для ваших нужд.

 2 По убыванию по группе
2 По убыванию по группе

Leave A Comment