Химическая связь и строение вещества. Глава iii.химическая связь и строение молекул В хлориде аммония все химические связи ионные
Задание №1
Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
- 1. Ca(ClO 2) 2
- 2. HClO 3
- 3. NH 4 Cl
- 4. HClO 4
- 5. Cl 2 O 7
Ответ: 13
Определить наличие ионного типа связи в соединении в подавляющем большинстве случаев можно по тому, что в состав его структурных единиц одновременно входят атомы типичного металла и атомы неметалла.
По этому признаку мы устанавливаем, что ионная связь имеется в соединении под номером 1 — Ca(ClO 2) 2 , т.к. в его формуле можно увидеть атомы типичного металла кальция и атомы неметаллов — кислорода и хлора.
Однако, больше соединений, содержащих одновременно атомы металла и неметалла, в указанном списке нет.
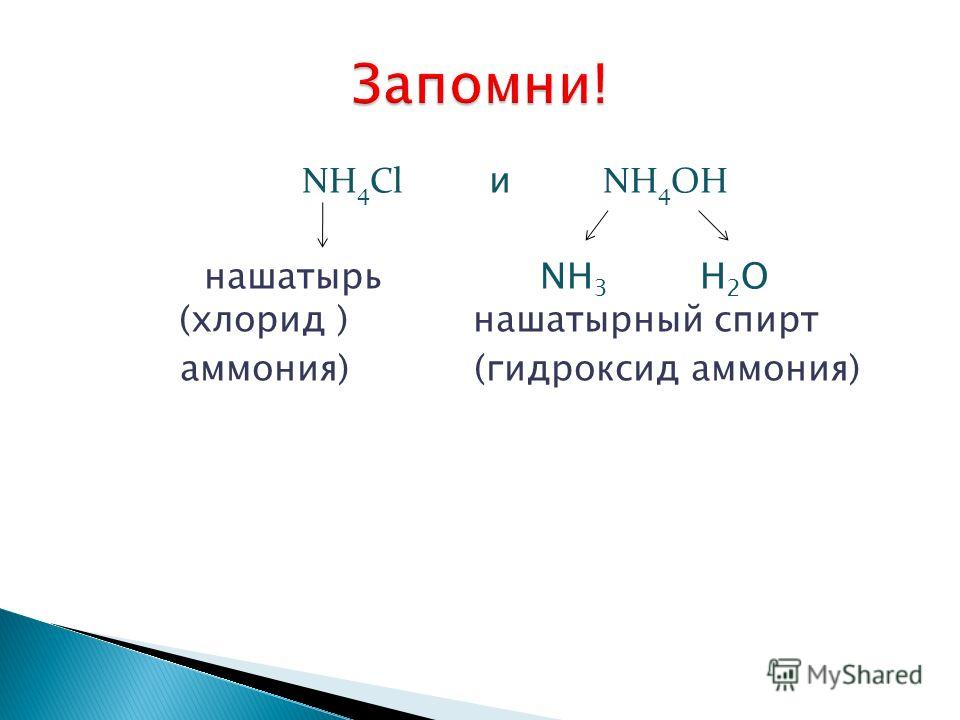
Среди указанных в задании соединений есть хлорид аммония, в нем ионная связь реализуется между катионом аммония NH 4 + и хлорид-ионом Cl − .
Задание №2
Из предложенного перечня выберите два соединения, в которых тип химической связи такой же, как в молекуле фтора.
1) кислород
2) оксид азота (II)
3) бромоводород
4) иодид натрия
Запишите в поле ответа номера выбранных соединений.
Ответ: 15
Молекула фтора (F 2) состоит из двух атомов одного химического элемента неметалла, поэтому химическая связь в данной молекуле ковалентная неполярная.
Ковалентная неполярная связь может быть реализована только между атомами одного и того же химического элемента неметалла.
Из предложенных вариантов ковалентный неполярный тип связи имеют только кислород и алмаз. Молекула кислорода является двухатомной, состоит из атомов одного химического элемента неметалла. Алмаз имеет атомное строение и в его структуре каждый атом углерода, являющегося неметаллом, связан с 4-мя другими атомами углерода.
Оксид азота (II) — вещество состоящее из молекул, образованных атомами двух разных неметаллов. Поскольку электроотрицательности разных атомов всегда различны, общая электронная пара в молекуле смещена к более электроотрицательному элементу, в данном случае к кислороду. Таким образом, связь в молекуле NO является ковалентной полярной.
Поскольку электроотрицательности разных атомов всегда различны, общая электронная пара в молекуле смещена к более электроотрицательному элементу, в данном случае к кислороду. Таким образом, связь в молекуле NO является ковалентной полярной.
Бромоводород также состоит из двухатомных молекул, состоящих из атомов водорода и брома. Общая электронная пара, образующая связь H-Br, смещена к более электроотрицательному атому брома. Химическая связь в молекуле HBr также является ковалентной полярной.
Иодид натрия — вещество ионного строения, образованное катионом металла и иодид-анионом. Связь в молекуле NaI образована за счет перехода электрона с 3s -орбитали атома натрия (атом натрия превращается в катион) на недозаполненную 5p -орбиталь атома иода (атом иода превращается в анион). Такая химическая связь называется ионной.
Задание №3
Из предложенного перечня выберите два вещества, между молекулами которых образуются водородные связи.
- 1. C 2 H 6
- 2.

- 3. H 2 O
- 4. CH 3 OCH 3
- 5. CH 3 COCH 3
Запишите в поле ответа номера выбранных соединений.
Ответ: 23
Пояснение:
Водородные связи имеют место в веществах молекулярного строения, в которых присутствуют ковалетные связи H-O, H-N, H-F. Т.е. ковалентные связи атома водорода с атомами трех химических элементов с наивысшей электроотрицательностью.
Таким образом, очевидно, водородные связи есть между молекулами:
2) спиртов
3) фенолов
4) карбоновых кислот
5) аммиака
6) первичных и вторичных аминов
7) плавиковой кислоты
Задание №4
Из предложенного перечня выберите два соединения с ионной химической связью.
- 1. PCl 3
- 2. CO 2
- 3. NaCl
- 4. H 2 S
- 5. MgO
Запишите в поле ответа номера выбранных соединений.
Ответ: 35
Пояснение:
Сделать вывод о наличии ионного типа связи в соединении в подавляющем большинстве случаев можно по тому, что в состав структурных единиц вещества одновременно входят атомы типичного металла и атомы неметалла.
По этому признаку мы устанавливаем, что ионная связь имеется в соединении под номером 3 (NaCl) и 5 (MgO).
Примечание*
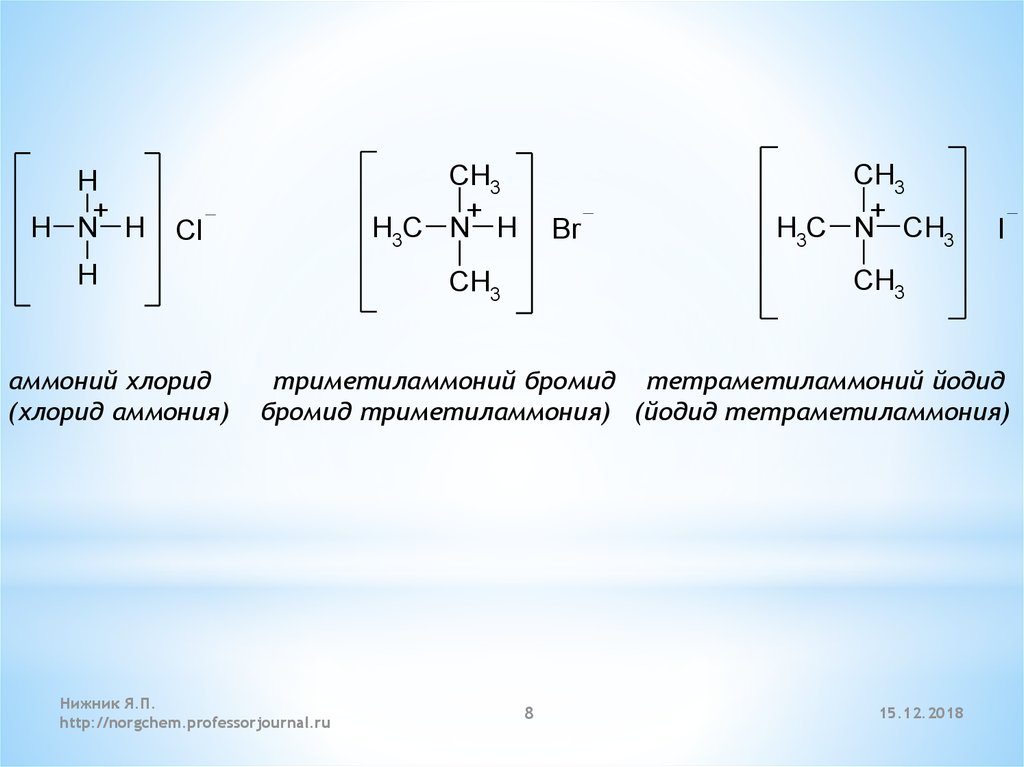
Помимо указанного выше признака, о наличии ионной связи в соединении можно говорить, если в составе его структурной единицы содержится катион аммония (NH 4 +) или его органические аналоги — катионы алкиламмония RNH 3 + , диалкиламония R 2 NH 2 + , триалкиламмония R 3 NH + или тетраалкиламмония R 4 N + , где R — некоторый углеводородный радикал. Например, ионный тип связи имеет место в соединении (CH 3) 4 NCl между катионом (CH 3) 4 + и хлорид-ионом Cl − .
Задание №5
Из предложенного перечня выберите два вещества с одинаковым типом строения.
4) поваренная соль
Запишите в поле ответа номера выбранных соединений.
Ответ: 23
Задание №8
2) кислород
3) белый фосфор
5) кремний
Запишите в поле ответа номера выбранных соединений.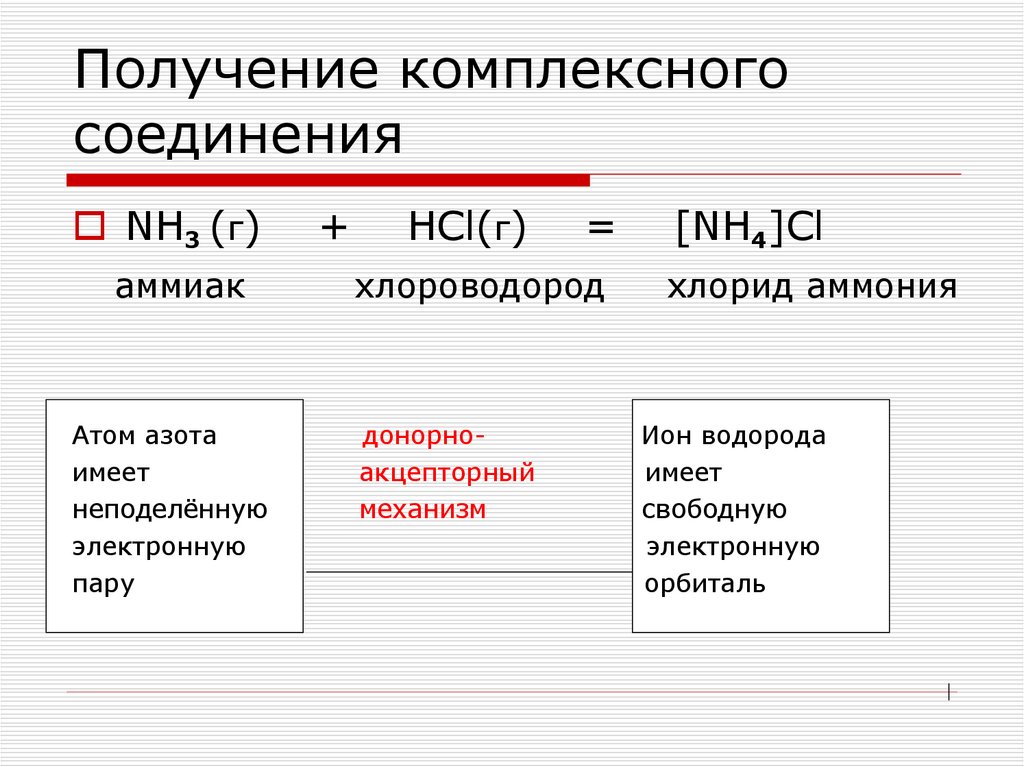
Ответ: 45
Задание №11
Из предложенного перечня выберите два вещества, в молекулах которых присутствует двойная связь между атомами углерода и кислорода.
3) формальдегид
4) уксусная кислота
5) глицерин
Запишите в поле ответа номера выбранных соединений.
Ответ: 34
Задание №14
Из предложенного перечня выберите два вещества с ионной связью.
1) кислород
3) оксид углерода (IV)
4) хлорид натрия
5) оксид кальция
Запишите в поле ответа номера выбранных соединений.
Ответ: 45
Задание №15
Из предложенного перечня выберите два вещества с таким же типом кристаллической решетки, как у алмаза.
1) кремнезем SiO 2
2) оксид натрия Na 2 O
3) угарный газ CO
4) белый фосфор P 4
5) кремний Si
Запишите в поле ответа номера выбранных соединений.
Ответ: 15
Задание №20
Из предложенного перечня выберите два вещества, в молекулах которых есть одна тройная связь.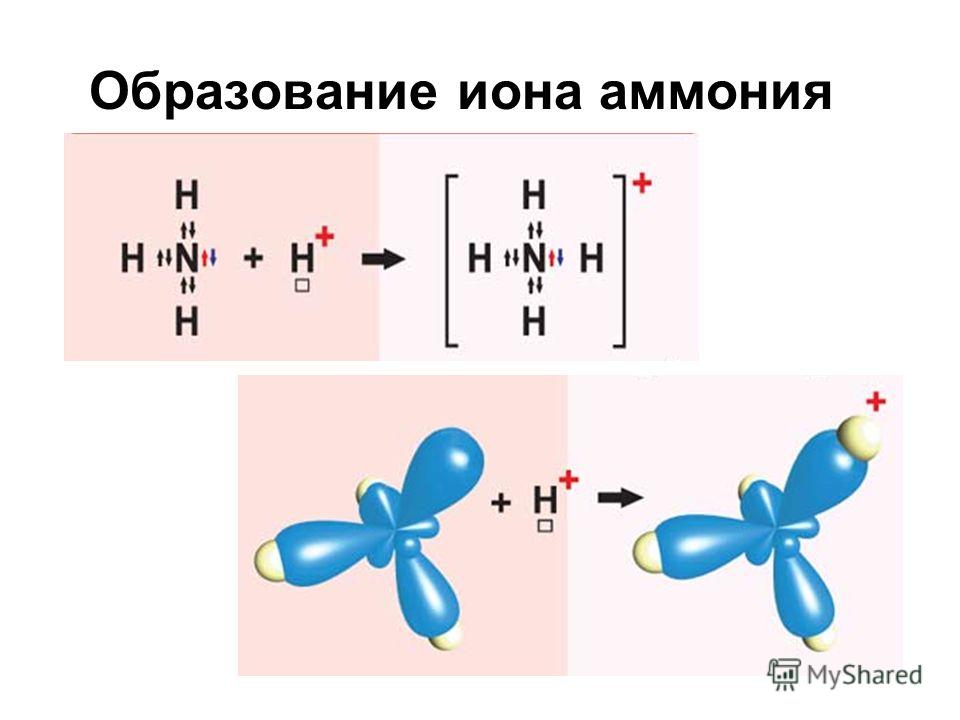
- 1. HCOOH
- 2. HCOH
- 3. C 2 H 4
- 4. N 2
- 5. C 2 H 2
Запишите в поле ответа номера выбранных соединений.
Ответ: 45
Пояснение:
Для того, чтобы найти правильный ответ, нарисуем структурные формулы соединений из представленного списка:
Таким образом, мы видим, что тройная связь имеется в молекулах азота и ацетилена. Т.е. правильные ответы 45
Задание №21
Из предложенного перечня выберите два вещества, в молекулах которых есть ковалентная неполярная связь.
Запишите сначала номер задания (30, 31 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции:
KIO 3 + KI + … → I 2 + K 2 SO 4 + …
Определите окислитель и восстановитель.
Показать ответ
Элементы ответа:
1) Составлен электронный баланс:
2) Указано, что иодид калия (за счет иода в степени окисления -1) является восстановителем, а иодат калия (за счет иода в степени окисления +5) — окислителем. \circ}CH\equiv CH+3H_2 (возможно образование С и H 2)
\circ}CH\equiv CH+3H_2 (возможно образование С и H 2)
При сливании 160 г 10%-ного раствора нитрата бария и 50 г 11%-ного раствора хромата калия выпал осадок. Рассчитайте массовую долю нитрата бария в образовавшемся растворе.
Показать ответ
Элементы ответа:
1) Записано уравнение реакции:
Ba(NO 3) 2 + K 2 CrO 4 = BaCrO 4 ↓ + 2KNO 3
2) Рассчитаны количество вещества реагентов, и определено вещество, взятое в избытке:
n(Ba(NO 3) 2) = 160 x 0,1 / 261 = 0,061 моль
n(K 2 CrO 4) = 50 x 0,11 / 194 = 0,028 моль
Ba(NO 3) 2 — в избытке
3) Рассчитаны масса выпавшего осадка и масса образовавшегося при этом раствора:
n(BaCrO 4) = n(K 2 CrO 4) = 0,028 моль
m(BaCrO 4) = 0,028 моль х 253 г/моль = 7,08 г
m(раствора) = 160 + 50 — 7,08 = 202,92 г
4) Рассчитаны масса нитрата бария и его массовая доля в растворе:
n(Ba(NO 3) 2)изб = 0,061 — 0,028 = 0,033 моль
m(Ba(NO 3) 2) = 0,033 x 261 = 8,61 г
w(Ba(NO 3) 2) = m(Ba(NO 3) 2) / m(p-pa) = 8,61 / 202,92 = 0,042 или 4,2%
Некоторое органическое соединение содержит 40,0% углерода и 53,3% кислорода по массе. Известно, что это соединение реагирует с оксидом меди(II).
Известно, что это соединение реагирует с оксидом меди(II).
На основании данных условий задачи:
1. произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2. запишите молекулярную формулу органического вещества;
3. составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4. напишите уравнение реакции этого вещества с оксидом меди(II).
Показать ответ
Элементы ответа:
Общая формула вещества — C x H y O z
1) Найдено соотношение атомов углерода, водорода и кислорода в соединении:
w(H) = 100 — 40,0 -53,3 = 6,7%
x: y: z = 40 / 12: 6,7 / 1: 53,3 / 16 = 3,33: 6,7: 3,33 = 1: 2: 1
2) Определена молекулярная формула вещества.
Простейшая формула вещества — CH 2 O. Учитывая то, что вещество реагирует с оксидом меди (II), молекулярная формула вещества — C 2 H 4 O 2
1. Наиболее полярными являются связи в молекуле:
а)НС1 б)AsH 3 в)РН 3 r)H 2 S
2. Линейную форму имеет молекула:
Линейную форму имеет молекула:
а)Н 2 О б)H 2 S в)ВеС1 2 г) OF 2
3. Геометрическая форма молекулы метана СН 4:
а) угловая в) пирамидальная
б) треугольная г) тетраэдрическая
4. Пирамидальную форму имеет молекула:
а)ВС1 3 б)SiBr 4 в)А1Вг 3 г) РС1 3
5. Полярной молекулой является:
а)СО 2 б)СН 4 b)NH 3 r)N 2
6. Число σ-связей в три раза больше числа π-связей в молекуле:
а) хлористой кислоты
б) ортофосфорной кислоты
в) сернистой кислоты
г) хлорноватой кислоты
7. В каком ряду представлены формулы соединений только с ковалентной связью?
а) ВаС1 2 , CdC1 2 , LiF в) NaCl, CuSO 4 , Fe(OH) 3
б) H 2 O, SiO 2 , Ch4COOH г) N 2 , HNO 3 , NaNO 3
8. Химические связи какого типа отсутствуют в хлориде аммония?
а) ковалентные полярные
б) ковалентные неполярные
в) донорно-акцепторные
г) ионные
9. Химическая связь, образующаяся между атомами элементов с порядковыми номерами 3 и 9:
а) ковалентная полярная
б) металлическая
в) ковалентная неполярная
г) ионная
10. Сколько электронов, содержащихся в молекуле этилена, не участвуют в образовании химических связей?
Сколько электронов, содержащихся в молекуле этилена, не участвуют в образовании химических связей?
а) 4 б) 8 в) 12 г) 16
11. Число электронов, участвующих в образовании химических связей, наибольшее в молекуле:
а)Н 2 О б)С1 2 b)H 2 S r)N 2
12. Атомную кристаллическую решетку имеет:
а) гидроксид натрия в) железо
б) алмаз г) лед
13. Какой тип кристаллической решетки характерен для соединений s-металлов с р-элементами, имеющими большую электроотрицательность?
а) металлическая в) атомная
б) ионная г) молекулярная
14. В каком ряду перечислены вещества соответственно с атомной, молекулярной и ионной кристаллическими решетками в твердом состоянии?
а) алмаз, хлорид натрия, графит
б) белый фосфор, вода, мел
в) оксид кремния (IV), медь, азот
г) алмаз, углекислый газ, фторид калия
15. Что изменяется при образовании хлорида аммония из аммиака и хлороводорода?
а) степень окисления атома азота
б) степень окисления и валентность атома азота
в) валентность атома азота
г) степень окисления атома водорода
16. Какая из следующих частиц образовалась по донорно-акцепторному механизму?
Какая из следующих частиц образовалась по донорно-акцепторному механизму?
a)F 2 б)HF в)BF 4 – г)BF 3
17. В каком веществе степень окисления и валентность азота равны по абсолютной величине?
a)N 2 б)NH 3 b)HNO 3 г) NH 4 C1
18. Какая из молекул наименее устойчива?
а)Н 2 О 6)H 2 S B)H 2 Se г) Н 2 Те
19. Какая химическая связь наименее прочная?
а) металлическая в) водородная
б) ионная г) ковалентная
20. Атом какого элемента проявляет наибольшую склонность к образованию ионных связей?
а) С б) Si в)F г)P
21. Как изменяется полярность и прочность связи в ряду молекул
HF → НС1 → HI?
а) как полярность, так и прочность связи увеличиваются
б) полярность увеличивается, прочность уменьшается
в) как полярность, так и прочность связи уменьшаются
г) полярность уменьшается, прочность увеличивается
22. Орбитали какого типа атомов водорода и хлора соответственно перекрываются при образовании молекулы хлороводорода?
a) s и s б) s и р в) р и р г) p и s
23. В какой молекуле все связи являются ковалентными полярными?
В какой молекуле все связи являются ковалентными полярными?
а)Н 2 О 2 б)С 2 Н 4 в)С 2 Н 2 г)СО 2
24. Какой элемент имеет наибольшее алгебраическое значение высшей степени окисления?
а) фтор б) хром в) углерод г) хлор
25. Какой элемент имеет наименьшее алгебраическое значение низшей степени окисления?
а) азот б) сера в) водород г) бром
26. В каком соединении водород имеет отрицательную степень окисления?
a)NH 4 Cl б)СаН 2 в) Н 2 О 2 г) HF
27. В соединениях ВС1 3 , Ве1 2 и SiBr 4 валентные орбитали центральных атомов находятся соответственно в следующих гибридных состояниях:
a) sp, sp 2 , sp 3 в) sp, sp 3 , sp 2
б) sp 2 ,sp, sp 3 г) sp 3 , sp 2 ,sp
28. Валентность азота в следующих соединениях:
N 2 , NH 3 , NH 4 + , CH 3 NН 2, HNO 3 — равна соответственно:
а) 0, III, IV, V, V в) III, III, IV, III, IV
б) I, III, III, IV, IV r) III, III, III, IV, V
29.Правильной характеристикой ионной связи является:
б) направленная, ненасыщаемая
в) направленная, насыщаемая
г) ненаправленная, насыщаемая
30. Правильной характеристикой ковалентной связи является:
Правильной характеристикой ковалентной связи является:
а) ненаправленная, ненасыщаемая
б) направленная, ненасыщаемая
в) направленная, насыщаемая
г) ненаправленная, насыщаемая
31.Двойные связи между атомами существуют в каждом соединении, входящем в группу:
а) СО, СО 2 в) S 8 , C 2 H 4
б) С 2 Н 2 , SO 2 г) СО 2 , С 2 Н 4
32.Тройные связи между атомами существуют в каждом соединении, входящем в группу:
а) СО, N 2 б) N 2 , SO 2 в) S 8 , С 2 Н 2 г) СО 2 , С 2 Н 4
33.Для какого элемента высшая степень окисления больше номера группы, в которой он находится в периодической системе?
а) марганец б) золото в) бор г) азот
34.Количественная характеристика элементов, которая позволяет судить о типе химической связи между атомами этих элементов, — это:
а) радиус атомов в) электроотрицательность
б) заряд ядра г) атомная масса
35.Одинарная полярная, двойная неполярная, одинарная неполярная, тройная полярная связи существуют в молекулах соответственно следующих веществ:
а) HF, С 2 Н 4 , Вг 2 , СО в) Н 2 , СО 2 , НС1, N 2
б) HBr, SO 3 , N 2 , С 2 Н 2 г) С1 2 , О 2 , С 2 Н 6 , СО
36. Общее σ- числои π-связей в молекуле дихромовой кислоты равно соответственно:
Общее σ- числои π-связей в молекуле дихромовой кислоты равно соответственно:
а) 10 и 4 б) 4 и 10 в) 6 и 2 г) 2 и 6
37.Даны вещества: хлорид цезия, медь, алмаз, ромбическая сера, лед, оксид натрия, йод, «сухой лед» (твердый СО 2), графит, платина, гидрид калия. Среди них число веществ с атомной кристаллической решеткой равно:
а) 4 б)3 в) 2 г)1
38. Даны вещества: хлорид цезия, медь, алмаз, ромбическая сера, лед, оксид натрия, йод, «сухой лед» (твердый СО 2), графит, платина, гидрид калия. Среди них число веществ с молекулярной кристаллической решеткой равно:
а) 4 б) 3 в) 2 г) 1
39.Даны вещества: хлорид цезия, медь, алмаз, ромбическая сера, лед, оксид натрия, йод, «сухой лед» (твердый СО 2), графит, платина, гидрид калия. Среди них число веществ с ионной кристаллической решеткой равно:
а) 4 б) 3 в) 2 г) 1
40.Даны вещества: хлорид цезия, медь, алмаз, ромбическая сера, лед, оксид натрия, йод, «сухой лед» (твердый СО 2), графит, платина, гидрид калия. Среди них число веществ с металлической кристаллической решеткой равно:
Среди них число веществ с металлической кристаллической решеткой равно:
а) 4 б) 3 в) 2 г) 1
| № | Ответы | |||
| Задания | а | б | в | г |
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х | ||||
| х |
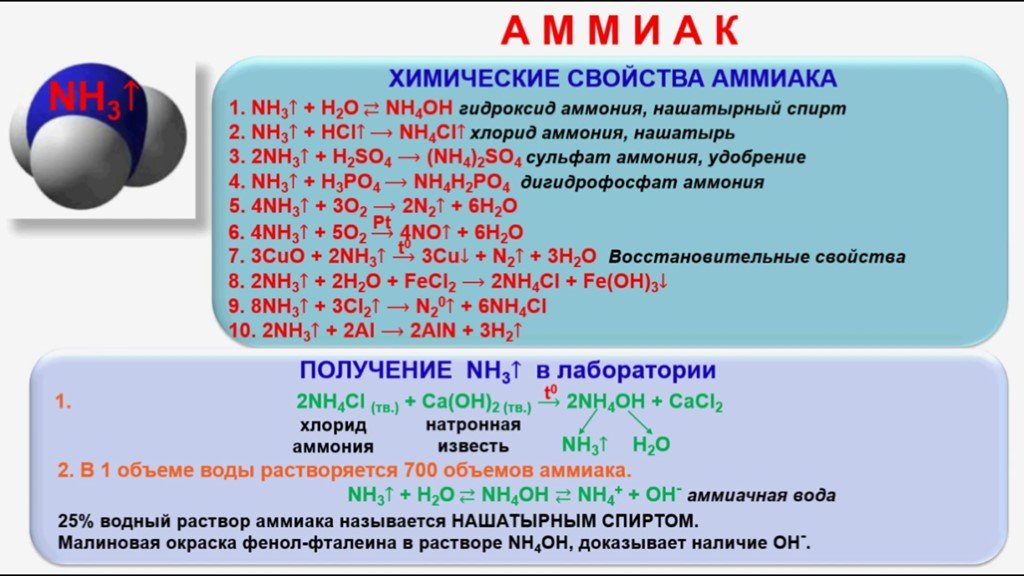
Хлористый аммоний (хлорид аммония, нашатырь) — неорганическое соединение, широко использующееся в самых разных областях. С химической точки зрения — соль аммония; формула NH 4 Cl.
С химической точки зрения — соль аммония; формула NH 4 Cl.
Хлорид аммония был известен уже в Древней Греции и Древнем Египте. Одно из его названий, «нашатырь» происходит от египетского «нушадир» — вещества, которое жрецы собирали на стенках пещер, чтобы вдыхать его пары перед церемонией и настраиваться на общение с божественными силами. «Аммоний» ведет историю названия от имени египетского бога Солнца Амона. В Древней Греции вещество добывали из сажи, которая образовывалась на стенках дымоходов в результате горения верблюжьего навоза, служившего грекам топливом (хлористый аммоний получается при разложении выделений животных и человека).
Хлорид аммония встречается в природе в вулканических пещерах и около трещин в земной коре, в виде налета или корочек.
Свойства
NH 4 Cl — белый кристаллический порошок (реактив технической чистоты может быть желтоватым или розовым), слегка гигроскопичный, без запаха, солоноватый на вкус. Хорошо растворяется в воде и жидком аммиаке, с ростом температуры водорастворимость увеличивается. Вступает в реакцию со щелочами с образованием соли, воды и аммиака. В гораздо меньшей степени реактив растворяется в этиловом и метиловом спиртах. Горит с выделением густого белого дыма. Полностью разлагается при температуре свыше 338 °С, а также под действием электрического тока. Горящий хлорид аммония выделяет аммиак, который раздражает органы дыхания.
Вступает в реакцию со щелочами с образованием соли, воды и аммиака. В гораздо меньшей степени реактив растворяется в этиловом и метиловом спиртах. Горит с выделением густого белого дыма. Полностью разлагается при температуре свыше 338 °С, а также под действием электрического тока. Горящий хлорид аммония выделяет аммиак, который раздражает органы дыхания.
Водный раствор реактива — это нашатырный спирт, жидкость с резким запахом, который возбуждающе действует на нервную систему. Реактив используется как лекарство, но лечение нашатырным спиртом должно проводиться строго по рекомендации врача, так как передозировка может привести к остановке дыхания и коме (в качестве антидота вводят щелочные растворы, например, натрия гидрокарбонат). К тому же это лекарство имеет противопоказания.
В промышленности хлористый аммоний получают как побочный продукт при производстве соды. В лаборатории соединение можно синтезировать из хлора и аммиака, или пропусканием аммиака с хлорводородом через раствор поваренной соли.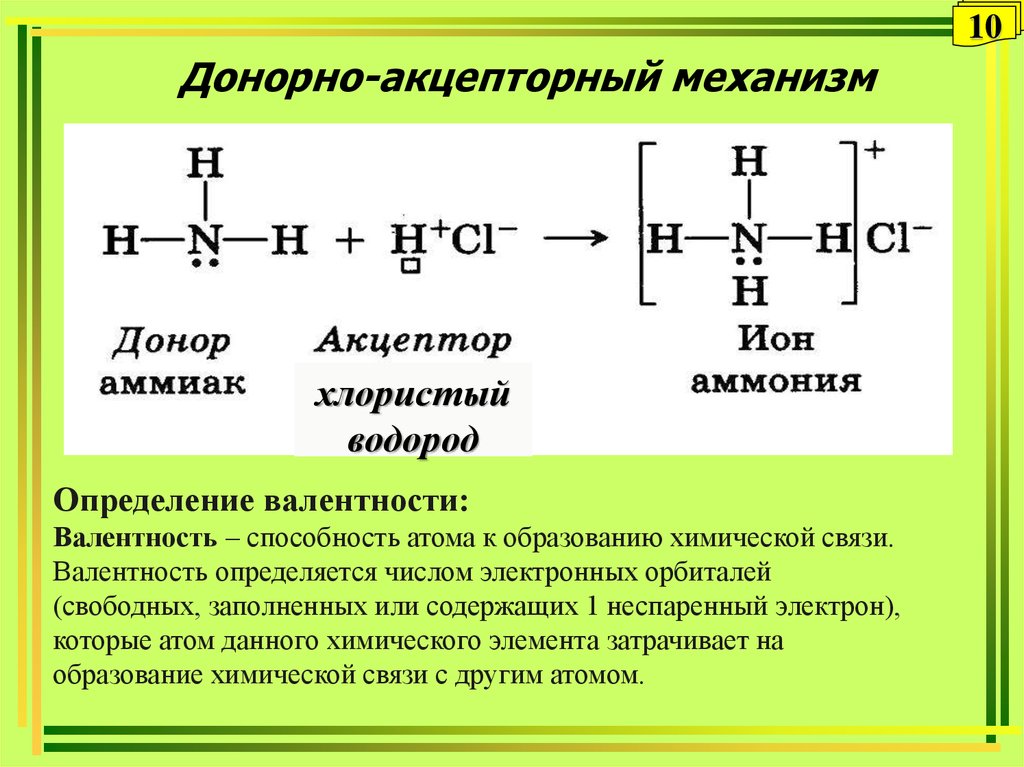
Хлористый аммоний относится к веществам умеренно опасным (класс 3), работать с ним следует в средствах защиты : резиновых перчатках, защитных очках и респираторе, в помещении с приточно-вытяжной вентиляцией. Нужно следить, чтобы реактив не попал на кожу и слизистые оболочки. Хранить хим. реактив нужно в герметично закрытых многослойных мешках, в крытых помещениях без доступа влаги. Соединение опасно для окружающей среды.
Применение
В цветной металлургии для травления металлов.
— Как составная часть электролитов в гальванике.
— Для удаления оксидной пленки при пайке и лужении стали, для производства сухих батарей в электротехнике.
— В текстильной индустрии — для отверждения клеев и лаков.
— Для получения нашатырного спирта, которым приводят в чувство при потере сознания. Также хлорид аммония является компонентом сердечных противоотечных средств, средств против кашля. Его используют для усиления некоторых мочегонных лекарств.
— В пищепроме это пищевая добавка E510, разрешенная в России и европейских странах.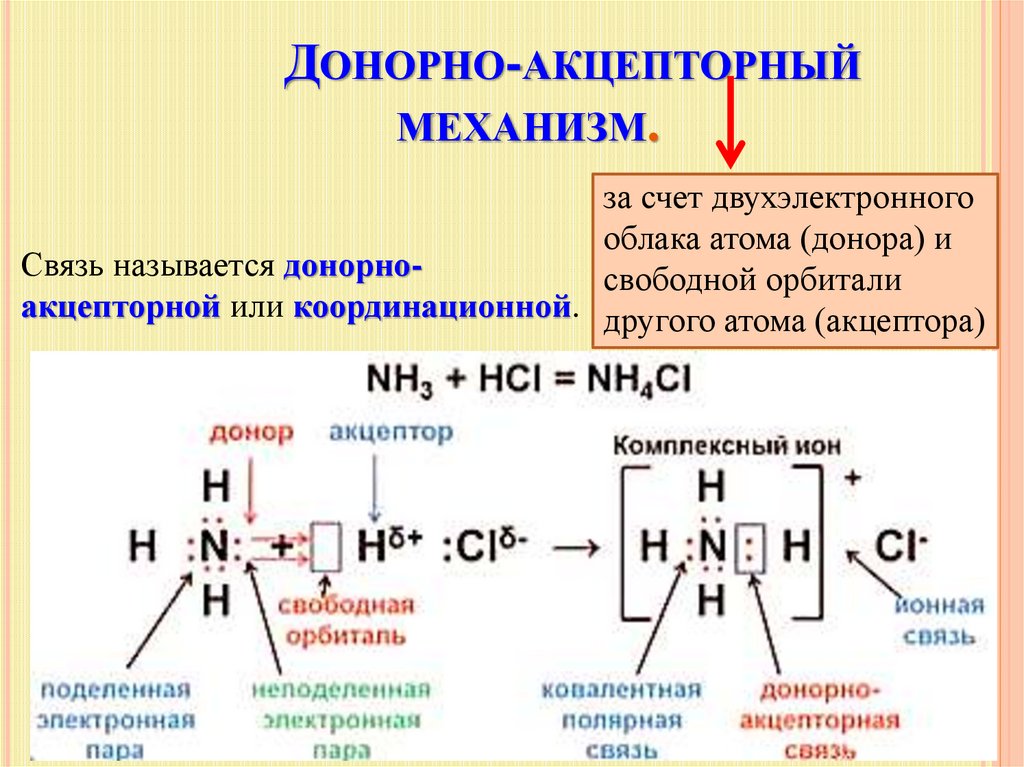 Его применяют для улучшения свойств муки, как загуститель и эмульгатор, для изготовления плодовых и ягодных вин, лакричных конфет, как приправу к рыбе. В последнее время добавка Е 510 применяется все реже из-за подозрений в ее вреде.
Его применяют для улучшения свойств муки, как загуститель и эмульгатор, для изготовления плодовых и ягодных вин, лакричных конфет, как приправу к рыбе. В последнее время добавка Е 510 применяется все реже из-за подозрений в ее вреде.
— При изготовлении сигнальных дымовых шашек, как дымообразователь.
— В сельском хозяйстве, при выращивании некоторых культур в качестве азотного удобрения на нейтральных и щелочных почвах.
— В аналитической химии и биологии в качестве фиксанала.
— Как составная часть быстрого фиксажа при проявке фотографий.
— При изготовлении фитилей для свечей.
— В быту в разведенном виде — для очистки различных поверхностей и украшений, при стирке.
В магазине «ПраймКемикалсГрупп» вы можете купить
§5. А для солей традиционная — связь ионная
Какой вид будет иметь химическая связь, если ее образуют атомы элементов, которые очень различны по электроотрицательности — например, щелочного металла натрия и галогена хлора ?
Электрон атома натрия Na , находящийся на внешнем валентном уровне, большой любитель погулять по окрестностям и часто даже забывает вернуться домой, к родному атомному ядру. И тогда атом натрия остается без своего непутевого электрона и превращается в катион Na + :
И тогда атом натрия остается без своего непутевого электрона и превращается в катион Na + :
Na 0 − 1 e − = Na +
Семь электронов атомахлора Cl , напротив, неисправимые домоседы, ходить в гости они не любят, зато с удовольствием гостей принимают. Если к ним завернет «на огонек» какой-нибудь соседский электрон, значит, атом хлора превратится в анион Cl¯ , который принято называть хлорид -ионом:
Cl 0 + 1 e − = Cl −
Разноименные по заряду ионы будут притягиваться; это образуется ионная связь Na + ~~~~ Cl − . Так получается хлорид натрия NaCl , всем известная поваренная соль .
Природная поваренная соль — это минерал .
В природе этот минерал образуется из соленой морской или озерной воды. При ее охлаждении под слоем раствора соли обнаруживаются ее кристаллы — прозрачные кубики хлорида натрия . Ионы, из которых состоит хлорид натрия , образуют ионный кристалл , состоящий из катионов натрия Na + и хлорид-анионов Cl − .
Когда из растворенных ионов образуется твердое вещество, катионы и анионы укладываются в кристалле не как попало, а таким образом, чтобы положительные и отрицательные заряды чередовались между собой. Тогда получится прочная кристаллическая решетка соли NaCl , состоящая из ионов.
Подобным образом построены и кристаллы других солей — карбоната натрия Na 2 CO 3 (соды ), хлорида аммония NH 4 Cl (нашатыря ), нитрата серебра AgNO 3 (ляписа ) и множества других.
Правда ли, что все соли построены из отдельных, существующих поодиночке ионов? Правда, но есть небольшое «но»…
У катиона соли остается некоторая часть электронного облака, потому что даже самый непослушный озорник-электрон время от времени возвращается домой. Но очень большая часть этого облака смещена в сторону аниона соли. Поэтому ионную связь считают предельным случаем ковалентной полярной связи .
Строение молекул.
 Химическая связь: ковалентная(полярная и неполярная), ионная, металлическая
Химическая связь: ковалентная(полярная и неполярная), ионная, металлическаяКовалентная химическая связь, ее разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Учение о химической связи составляет основу всей теоретической химии.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
Деление химических связей на типы носит условный характер, по скольку все они характеризуются определенным единством.
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи.
Металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
В веществах часто отсутствуют предельные случаи химической связи (или чистые химические связи).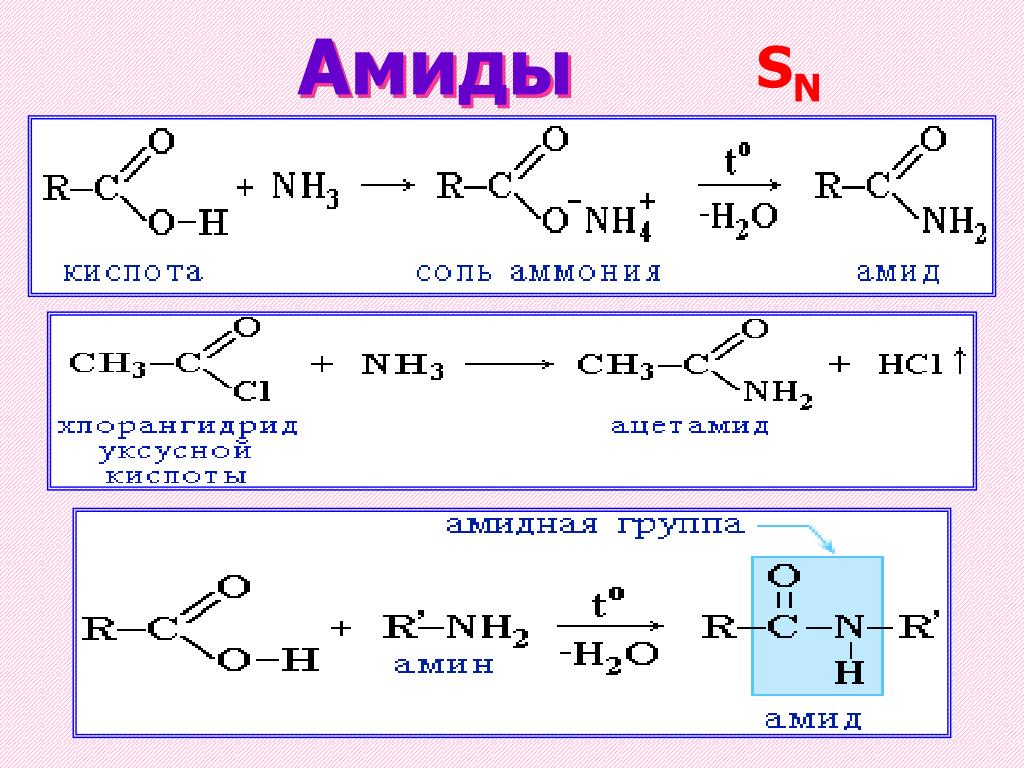
Например, фторид лития $LiF$ относят к ионным соединениям. Фактически же в нем связь на $80%$ ионная и на $20%$ ковалентная. Правильнее поэтому, очевидно, говорить о степени полярности (ионности) химической связи.
В ряду галогеноводородов $HF—HCl—HBr—HI—HАt$ степень полярности связи уменьшается, ибо уменьшается разность в значениях электроотрицательности атомов галогена и водорода, и в астатоводороде связь становится почти неполярной $(ЭО(Н) = 2.1; ЭО(At) = 2.2)$.
Различные типы связей могут содержаться в одних и тех же веществах, например:
- в основаниях: между атомами кислорода и водорода в гидроксогруппах связь полярная ковалентная, а между металлом и гидроксогруппой — ионная;
- в солях кислородсодержащих кислот: между атомом неметалла и кислородом кислотного остатка — ковалентная полярная, а между металлом и кислотным остатком — ионная;
- в солях аммония, метиламмония и т. д.: между атомами азота и водорода — ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком — ионная;
- в пероксидах металлов (например, $Na_2O_2$) связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом — ионная и т.
 д.
д.
Различные типы связей могут переходить одна в другую:
— при электролитической диссоциации в воде ковалентных соединений ковалентная полярная связь переходит в ионную;
— при испарении металлов металлическая связь превращается в ковалентную неполярную и т.д.
Причиной единства всех типов и видов химических связей служит их одинаковая химическая природа — электронно-ядерное взаимодействие. Образование химической связи в любом случае представляет собой результат электронно-ядерного взаимодействия атомов, сопровождающегося выделением энергии.
Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи
Ковалентная химическая связь — это связь, возникающая между атомами за счет образования общих электронных пар.
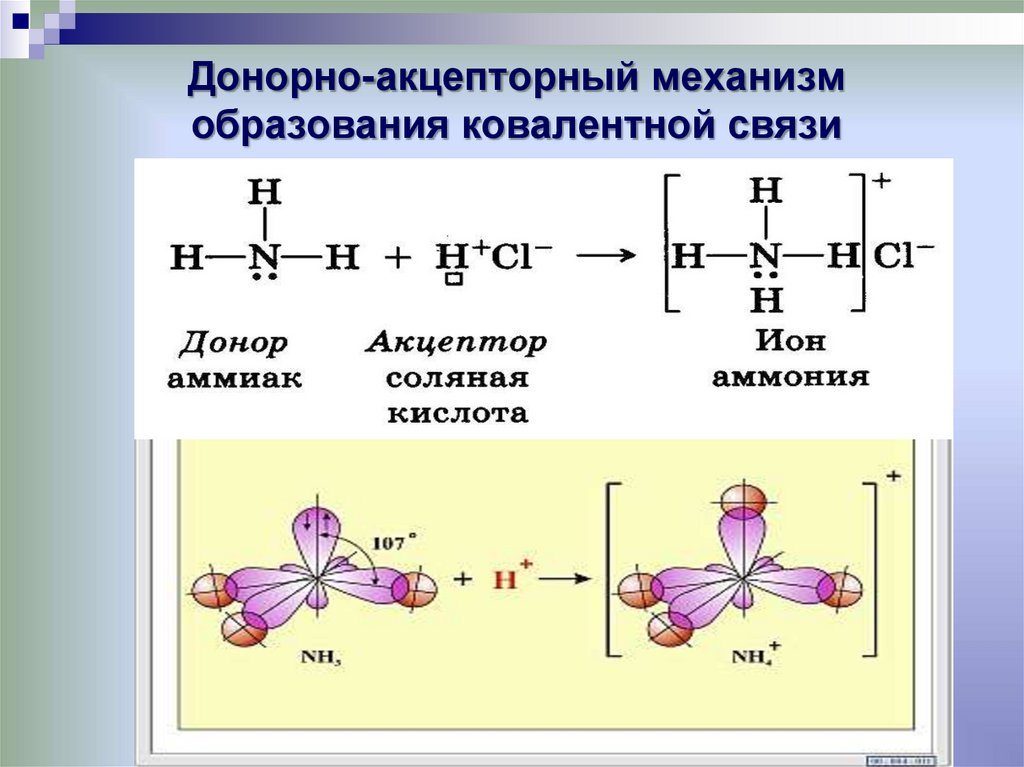
Механизм образования такой связи может быть обменным и донорно-акцепторным.
I. Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов.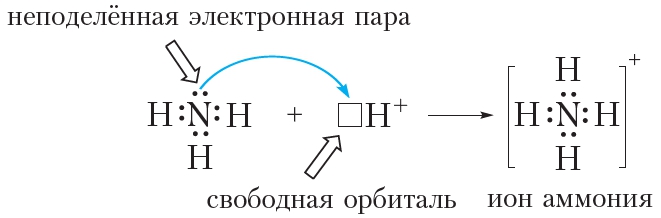 +$.
+$.
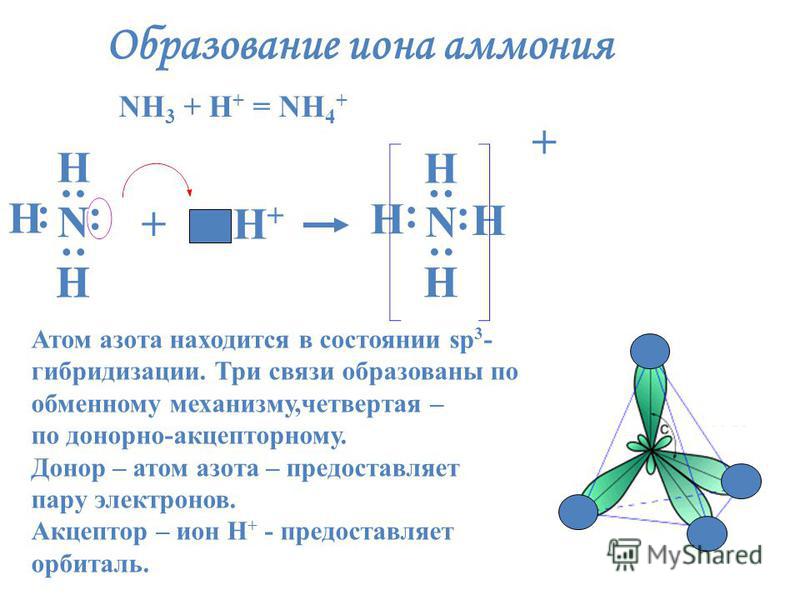
Донор имеет электронную пару, акцептор — свободную орбиталь, которую эта пара может занять. В ионе аммония все четыре связи с атомами водорода ковалентные: три образовались благодаря созданию общих электронных пар атомом азота и атомами водорода по обменному механизму, одна — по донорно-акцепторному механизму.
Ковалентные связи можно классифицировать по способу перекрывания электронных орбиталей, а также по смещению их к одному из связанных атомов.
Химические связи, образующиеся в результате перекрывания электронных орбиталей вдоль линии связи, называются $σ$-связями (сигма-связями). Сигма-связь очень прочная.
$p-$Орбитали могут перекрываться в двух областях, образуя ковалентную связь за счет бокового перекрывания:
Химические связи, образующиеся в результате «бокового» перекрывания электронных орбиталей вне линии связи, т.е. в двух областях, называются $π$-связями (пи-связями).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной. Электронные пары не смещены ни к одному из атомов, т.к. атомы имеют одинаковую ЭО — свойство оттягивать к себе валентные электроны от других атомов. Например:
т.е. посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов. Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной.
Длина и энергия ковалентной связи.
Характерные свойства ковалентной связи — ее длина и энергия. Длина связи — это расстояние между ядрами атомов. Химическая связь тем прочнее, чем меньше ее длина. Однако мерой прочности связи является энергия связи, которая определяется количеством энергии, необходимой для разрыва связи. Обычно она измеряется в кДж/моль. Так, согласно опытным данным, длины связи молекул $H_2, Cl_2$ и $N_2$ соответственно составляют $0. 074, 0.198$ и $0.109$ нм, а энергии связи соответственно равны $436, 242$ и $946$ кДж/моль.
074, 0.198$ и $0.109$ нм, а энергии связи соответственно равны $436, 242$ и $946$ кДж/моль.
Ионы. Ионная связь
Представим себе, что «встречаются» два атома: атом металла I группы и атом неметалла VII группы. У атома металла на внешнем энергетическом уровне находится единственный электрон, а атому неметалла как раз не хватает именно одного электрона, чтобы его внешний уровень оказался завершенным.
Первый атом легко отдаст второму свой далекий от ядра и слабо связанный с ним электрон, а второй предоставит ему свободное место на своем внешнем электронном уровне.
Тогда атом, лишенный одного своего отрицательного заряда, станет положительно заряженной частицей, а второй превратится в отрицательно заряженную частицу благодаря полученному электрону. Такие частицы называются ионами.
Химическая связь, возникающая между ионами, называется ионной.
Рассмотрим образование этой связи на примере хорошо всем знакомого соединения хлорида натрия (поваренная соль):
Процесс превращения атомов в ионы изображен на схеме:
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов. {-}↙{ион}$.
{-}↙{ион}$.
Цифры, показывающие число атомов или молекул, называются коэффициентами, а цифры, показывающие число атомов или ионов в молекуле, называют индексами.
Металлическая связь
Ознакомимся с тем, как взаимодействуют между собой атомы элементов-металлов. Металлы обычно существуют не в виде изолированных атомов, а в форме куска, слитка или металлического изделия. Что удерживает атомы металла в едином объеме?
Атомы большинства металлов на внешнем уровне содержат небольшое число электронов — $1, 2, 3$. Эти электроны легко отрываются, и атомы при этом превращаются в положительные ионы. Оторвавшиеся электроны перемещаются от одного иона к другому, связывая их в единое целое. Соединяясь с ионами, эти электроны образуют временно атомы, потом снова отрываются и соединяются уже с другим ионом и т.д. Следовательно, в объеме металла атомы непрерывно превращаются в ионы и наоборот.
Эти электроны легко отрываются, и атомы при этом превращаются в положительные ионы. Оторвавшиеся электроны перемещаются от одного иона к другому, связывая их в единое целое. Соединяясь с ионами, эти электроны образуют временно атомы, потом снова отрываются и соединяются уже с другим ионом и т.д. Следовательно, в объеме металла атомы непрерывно превращаются в ионы и наоборот.
Связь в металлах между ионами посредством обобществленных электронов называется металлической.
На рисунке схематически изображено строение фрагмента металла натрия.
При этом небольшое число обобществленных электронов связывает большое число ионов и атомов.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобществлении внеш них электронов. Однако при ковалентной связи обобществлены внешние непарные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, пластичны, электропроводны и имеют металлический блеск.
Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов — сплавов, находящихся в твердом и жидком состояниях.
Водородная связь
Химическую связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары ($F, O, N$ и реже $S$ и $Cl$), другой молекулы (или ее части) называют водородной.
Механизм образования водородной связи имеет частично электростатический, частично донорно- акцепторный характер.
Примеры межмолекулярной водородной связи:
При наличии такой связи даже низкомолекулярные вещества могут быть при обычных условиях жидкостями (спирт, вода) или легко сжижающимися газами (аммиак, фтороводород).
Вещества с водородной связью имеют молекулярные кристаллические решетки.
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки.
 Зависимость свойств веществ от их состава и строения
Зависимость свойств веществ от их состава и строенияМолекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Вещество при заданных условиях может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Свойства вещества зависят также от характера химической связи между образующими его частицами — молекулами, атомами или ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы.
К молекулярным веществам относятся вещества с атомной структурой ($C, Si, Li, Na, K, Cu, Fe, W$), среди них есть металлы и неметаллы.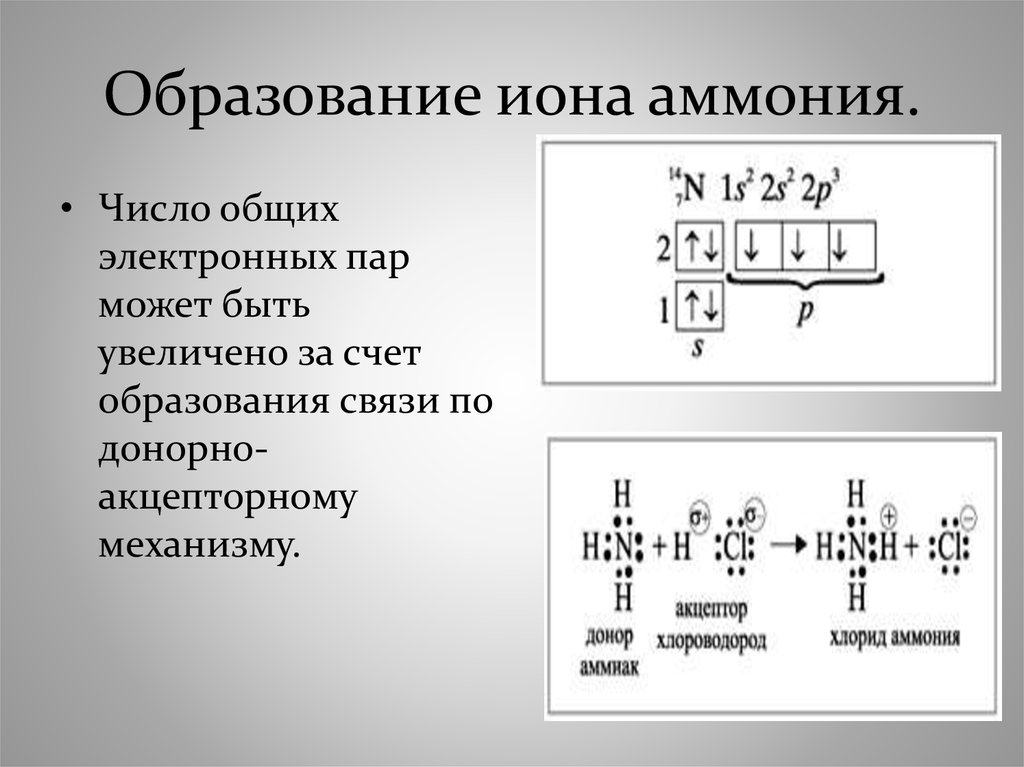
Рассмотрим физические свойства щелочных металлов. Относительно малая прочность связи между атомами обуславливает низкую механическую прочность: щелочные металлы мягкие, легко режутся ножом.
Большие размеры атомов приводят к малой плотности щелочных металлов: литий, натрий и калий даже легче воды. В группе щелочных металлов температуры кипения и плавления понижаются с увеличением порядкового номера элемента, т.к. размеры атомов увеличиваются, и ослабевают связи.
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли ($NaCl, K_2SO_4$), некоторые гидриды ($LiH$) и оксиды ($CaO, MgO, FeO$), основания ($NaOH, KOH$). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Кристаллические решетки
Вещество, как известно, может существовать в трех агрегатных состояниях: газообразном, жидком и твердом.
Твердые вещества: аморфные и кристаллические.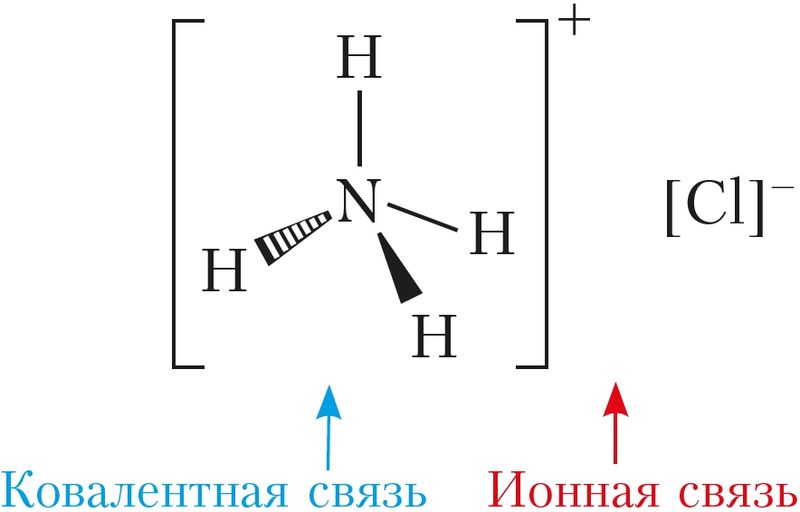
Рассмотрим, как влияют особенности химических связей на свойства твердых веществ. Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионные кристаллические решетки.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. –$, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
–$, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомные кристаллические решетки.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она выше $3500°С$), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решетки.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными ($HCl, H_2O$), и неполярными ($N_2, O_2$). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Металлические кристаллические решетки.
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Состоит из четырех ковалентных азот-водородных связей и электровалентной связи между молекулой аммиака и атомом хлора между атомных центров участвующих атомов и зависит от электростатического притяжения между протонами в ядрах обоих атомов и электронами на их орбиталях.
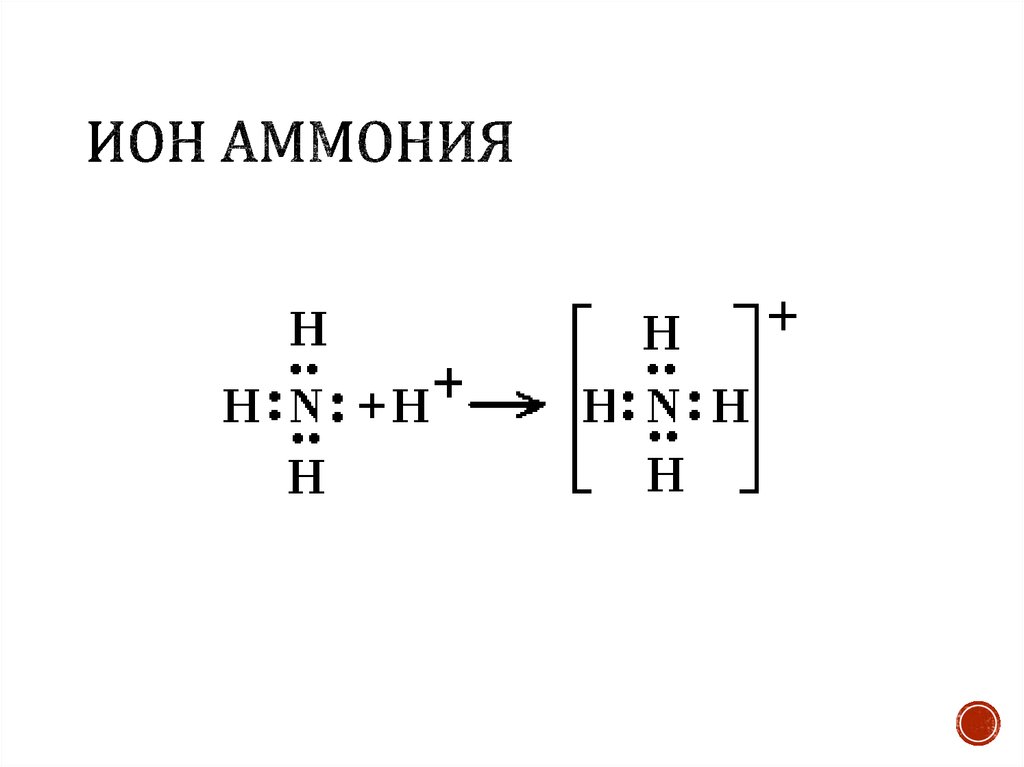 Это сила, которая удерживает атомы вместе в молекулах.
Это сила, которая удерживает атомы вместе в молекулах. Полный пошаговый ответ:
Хлорид аммония с химической формулой $N{H_4}Cl$ является органическим соединением. Это белая кристаллическая соль, хорошо растворимая в воде, в то время как ее собственные растворы слабокислые. Мы знаем, что хлорид аммония образуется при реакции соляной кислоты HCl с аммиаком $N{H_3}$ Эта реакция может быть записана как:
$N{H_3} + HCl \to N{H_4}Cl$
Структура хлорида аммония показан ниже:
9- }$. Но неверно, что хлорид аммония содержит только электровалентные связи. Так что этот вариант тоже не верен.
Из структуры хлорида аммония ясно видно, что между атомом азота и четырьмя атомами водорода существуют четыре ковалентные связи. Более того, между ионом аммония и ионом хлорида существует электровалентная связь, которой нет между молекулой аммония и ионом хлора. Так что этот вариант тоже не верен.
Как мы говорили до сих пор, в структуре хлорида аммония можно увидеть четыре ковалентные связи и одну электровалентную связь между атомами азота и водорода и между ионом аммония и ионом хлорида соответственно.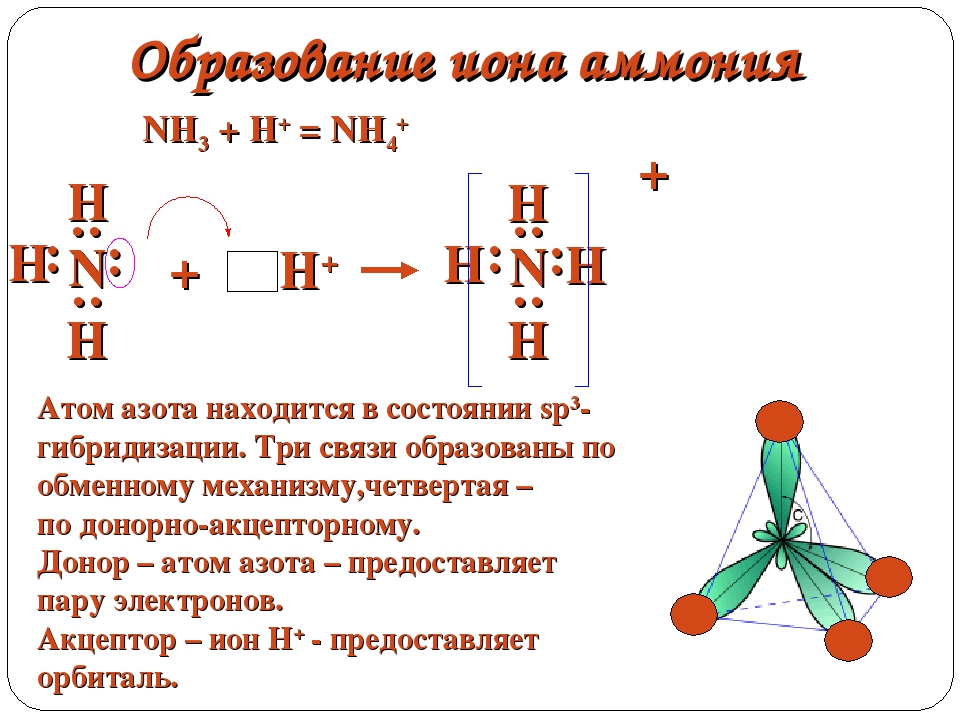
Таким образом, правильный ответ — вариант D.
Примечание: В ковалентной связи электроны взаимно распределяются между атомами, участвующими в связи, тогда как в электровалентной связи связь возникает благодаря силе электростатического притяжения. .
Дата последнего обновления: 26 апр 2023
•
Всего просмотров: 255,3 тыс. 0003
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Актуальные сомнения
Какие связи присутствуют в хлориде аммония?
- Курс
- NCERT
- Класс 12
- Класс 11
- Класс 10
- Класс 9
- Класс 8 900 79 Класс 7
- Класс 6
- NCERT
- IIT JEE
- Экзамен
- JEE MAINS
- JEE ADVANCED
- X BOARDS
- XII BOARDS
- NEET
- Neet Предыдущий год (по годам)
- Физика Предыдущий год
- Химия Предыдущий год
- Биология Предыдущий год
- Нет Все образцы работ
- Образцы работ Биология
- Образцы работ Физика
- Образцы работ Химия 900 84
- Скачать PDF-файлы
- Класс 12
- Класс 11
- Класс 10
- Класс 9
- Класс 8
- Класс 7
- Класс 6
- Экзаменационный уголок
- Онлайн-класс
- Викторина
- Задать вопрос в Whatsapp
- Поиск Doubtnut
- Английский словарь
- Toppers Talk
- Блог
- О нас Us
- Карьера
- Скачать
- Получить приложение
Вопрос
Обновлено: 26/04/202 3
СЕРИЯ AAKASH-ХИМИЧЕСКОЕ СОЕДИНЕНИЕ-ЦЕЛЬ УПРАЖНЕНИЯ -3 (ПОСЛЕДНИЕ ВОПРОСЫ AIPMT/NEET)
21 видеоРЕКЛАМА
Текстовое решение
Проверено экспертами
Был ли этот ответ полезен?
760
Ab Padhai каро бина объявления ке
Khareedo DN Про и дехо сари видео бина киси объявление ки rukaavat ке!
Похожие видео
Тип связи, присутствующей в хлориде аммония:
12004062
01:22
Какие типы связей присутствуют в хлороводороде и кислороде?
31588431
01:35
अमोनियम क्लोराइड में कौन-क ौन से बन्ध होते है ?
94845356
01:53
थित तत्वों के नाम लिखें ।
95016289
02:04
Назовите элементы, входящие в состав хлорида аммония.
112945969
03:27
निम्नलिखित को पृथक करने क े लिए आप किन विधियों को अपनाएंगे ?
. नियम क्लोराइड के मिश्रण से पृथक करना |
121336358
02:58
Связь, присутствующая в бензолдиазонийхлориде: арная аммониевая соль
131207279
04:47
Какие различные типы связей в молекуле бромида аммония?
160818574
04:35
Типы связей в хлориде аммония:
417337714
03:32
Какие связи присутствуют в хлориде аммония?
630388620
00:55
Типы связей, присутствующих в хлориде аммония: хлорид ия
634119957
01:06
Тип связей, присутствующих в хлорид аммония
639792995
01:18
Наличие связи в хлориде натрия
639811735
04:18
सोडियम क्लोराइड में किस प्रक ार का बन्ध उपस्थित है?
643180073
01:50
РЕКЛАМА
СЕРИЯ AAKASH-ХИМИЧЕСКАЯ СВЯЗКА-ЦЕЛЬ УПРАЖНЕНИЯ -3 (ПОСЛЕДНИЕ ВОПРОСЫ AIPMT/NEET )
Какие связи присутствуют в хлориде аммония?
00:55
В какой из следующих пар два вида изоструктурны?
02:39
Правильный порядок увеличения валентных углов в следующих трехатомных.


 д.
д.
Leave A Comment