Этиленгликоль: химические свойства и получение
Этиленгликоль C2H4(OH)2 или CH2(OH)CH2OH, этандиол-1,2 – это органическое вещество, предельный двухатомный спирт.
Общая формула предельных нециклических двухатомных спиртов: CnH2n+2O2 или CnH2n(OН)2
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атом кислорода в спиртах находится в состоянии sp3-гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этиленгликоль – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
1.1. Взаимодействие с раствором щелочей
При взаимодействии этиленгликоля с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этиленгликоль не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этиленгликоль взаимодействует с активными металлами (щелочными и щелочноземельными).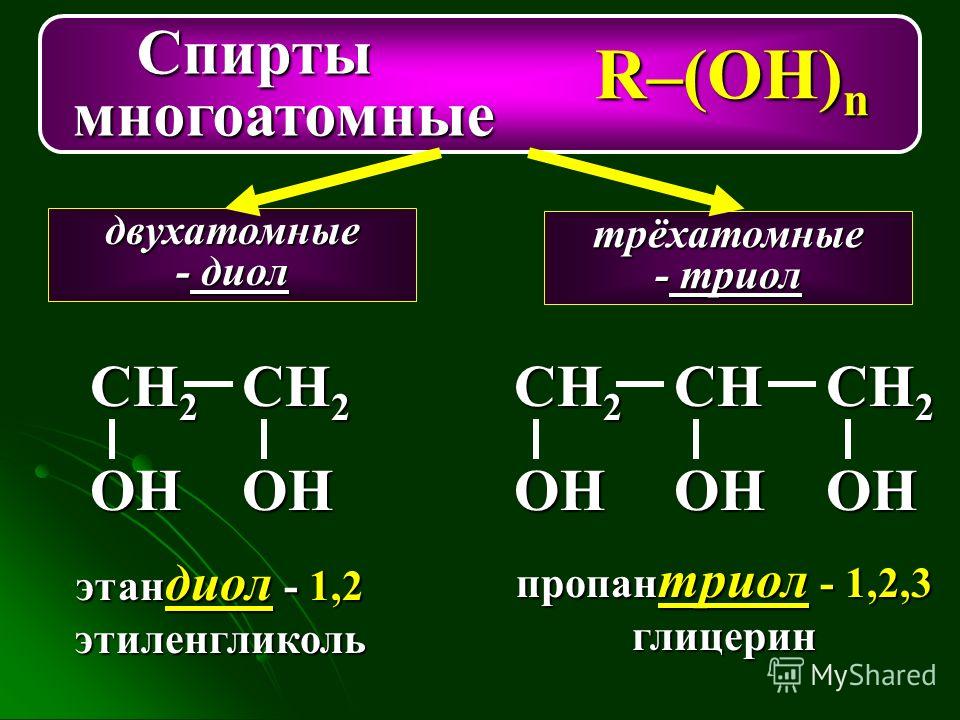
| Например, этиленгликоль взаимодействует с калием с образованием гликолята калия и водорода. |
CH2(OH)-CH2OH + 2K → CH2(OK)-CH2OK + H2
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии этиленгликоля с галогеноводородами группы ОН замещаются на галоген и образуются дигалогеналкан.
| Например, этиленгликоль реагирует с бромоводородом. |
CH2(OH)-CH2OH + 2HBr → CH2Br-CH2Br + 2H2O
2.2. Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием эфира: |
2.4. Взаимодействие с кислотами-гидроксидами
Этиленгликоль взаимодействует и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этиленгликоля с азотной кислотой образуется нитроэтиленгликоль: |
3. Дегидратация
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. При высокой температуре (180оС) протекает внутримолекулярная дегидратация этиленгликоля и образуется соответствующий ацетальдегид.
4. Окисление этиленгликоля
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Этиленгликоль можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
4.2. Окисление кислородом в присутствии катализатора
Этиленгликоль можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) этиленгликоль окисляется до щавелевой кислоты.
| Например, при взаимодействии этиленгликоля с перманганатом калия в серной кислоте образуется щавелевая кислота |
4.4. Горение этиленгликоля
При сгорании этиленгликоля образуется углекислый газ и вода и выделяется большое количество теплоты.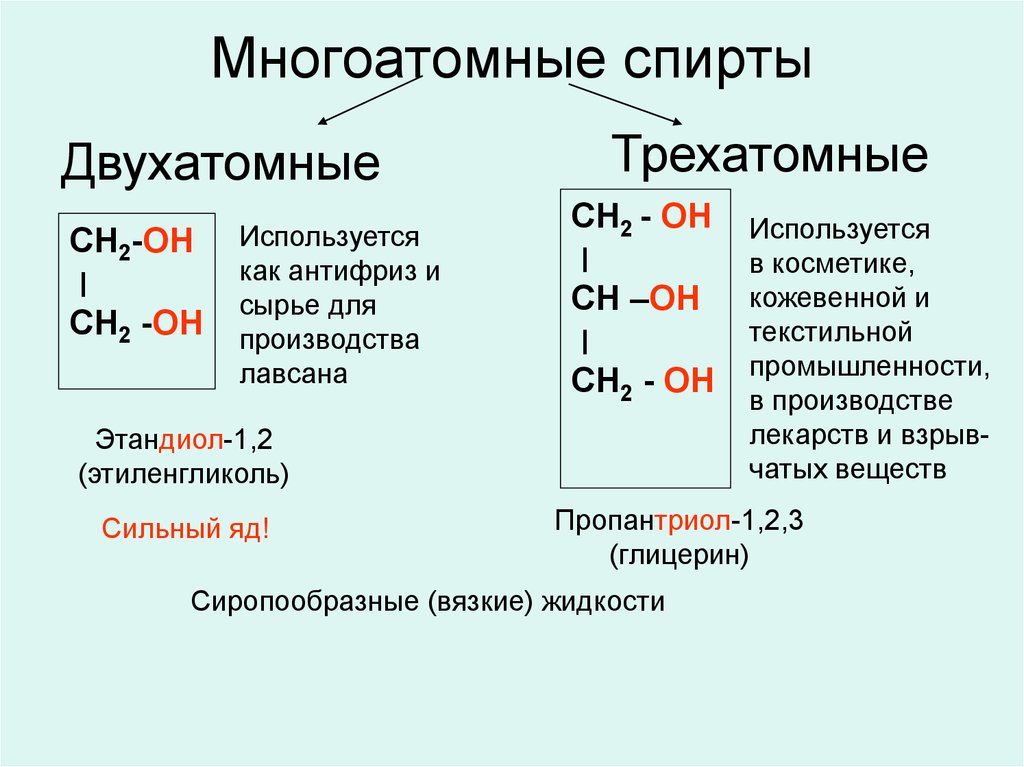
2C2H4(OH)2 + 5O2 = 4CO2 + 6H2O
5. Дегидрирование этаниленгликоля
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этиленгликоля образуется этандиаль |
CH2(OH)-CH2OH → CHO-CHO + 2H2
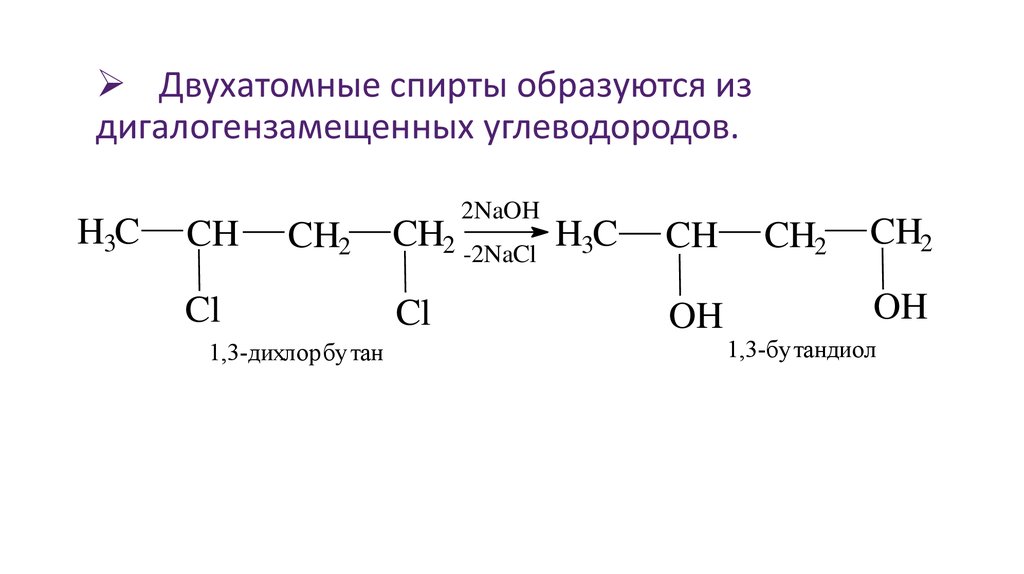
1. Щелочной гидролиз дигалогеналканов
При взаимодействии дигалогеналканов с водным раствором щелочей образуются двухатомные спирты. Атомы галогенов в дигалогеналканах замещаются на гидроксогруппы.
| Например, при нагревании 1,2-дихлорэтана с водным раствором гидроксида натрия образуется этиленгликоль |
CH2Cl-CH2Cl + 2NaOH → CH2OH-CH2OH + 2NaCl
2. Гидрирование карбонильных соединений
Гидрирование карбонильных соединений
| Например, при гидрировании этандиаля образуется этиленгликоль |
О=CН-CH=O + 2H2→ CH2(OH)-CH2OH
3. Гидролиз сложных эфировПри гидролизе сложных эфиров этиленгликоля и карбоновых кислот образуются этиленгликоль и карбоновая кислота.
4. Мягкое окисление алкенов
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
Понравилось это:
Нравится Загрузка. ..
..
Строение, изомерия и гомологический ряд спиртов
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
По числу гидроксильных групп:
- одноатомные спирты — содержат одну группу -ОН. Общая формула CnH2n+1OH или CnH2n+2O.
- двухатомные — содержат две группы ОН. Общая формула CnH2n(OH)2 или CnH2n+2O2.
- трехатомные спирты — содержат три группы ОН. Общая формула CnH2n-1(OH)3 или CnH2n+2O3.
Двухатомные спирты с двумя и тремя гидроксогруппами у одного атома углерода R‒CH(OH)2
- Первичные спирты – группа ОН соединена с первичным атомом углерода.
 Например, этанол СН3–СН2–ОН.
Например, этанол СН3–СН2–ОН. - Вторичные спирты – группа ОН соединена с вторичным атомом углерода. Например, пропанол-2: СН3–СН(СН3)–ОН.
- Третичные спирты – группа ОН соединена с третичным атомом углерода. Например, 2-метилпропанол-2: (СН3)3С–ОН.
- Метанол не относится ни к первичным, ни к вторичным, ни к третичным спиртам.
- Предельные спирты – группа ОН соединена с предельным радикалом. Например, пропанол-1: СН3–СН2–СН2–ОН.
- Непредельные спирты – группа ОН соединена с непредельным радикалом. Например, алкенолы: СН2=СН–СН2–ОН.
Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения.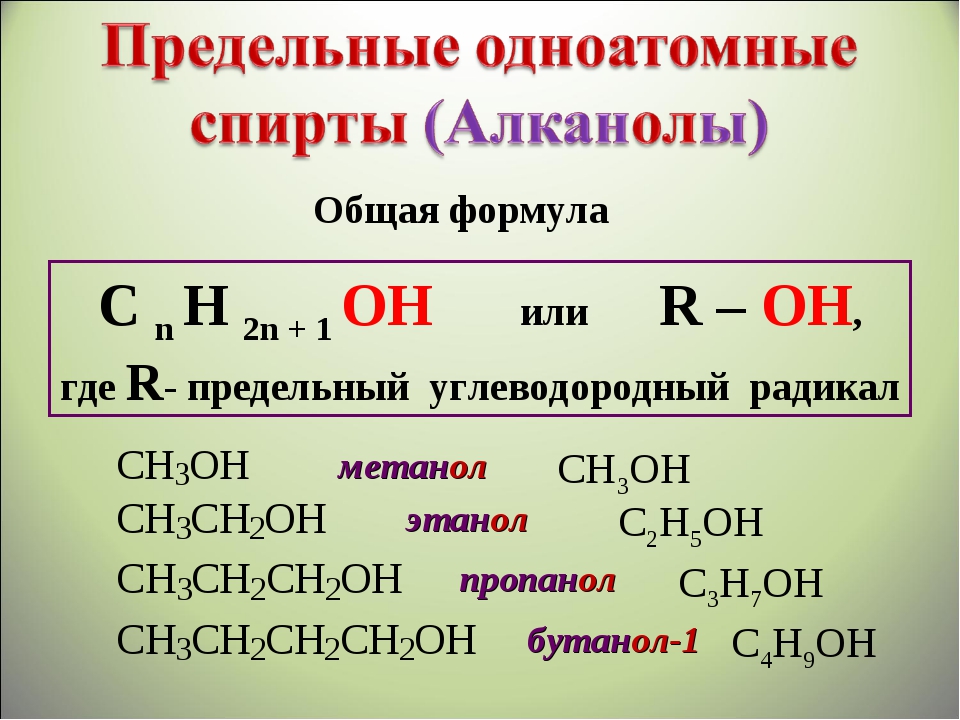
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp3-гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства спиртовСпирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола +64,5оС). Температуры кипения многоатомных спиртов и фенолов значительно выше.
Таблица. Температуры кипения некоторых спиртов и фенола.
| Название вещества | Температура кипения |
| Метанол | 64 |
| Этанол | 78 |
| Пропанол-1 | 92 |
| Бутанол-1 | 118 |
| Этиленгликоль | 196 |
| Фенол | 181,8 |
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
Чем больше углеводородный радикал, тем меньше растворимость спирта в воде.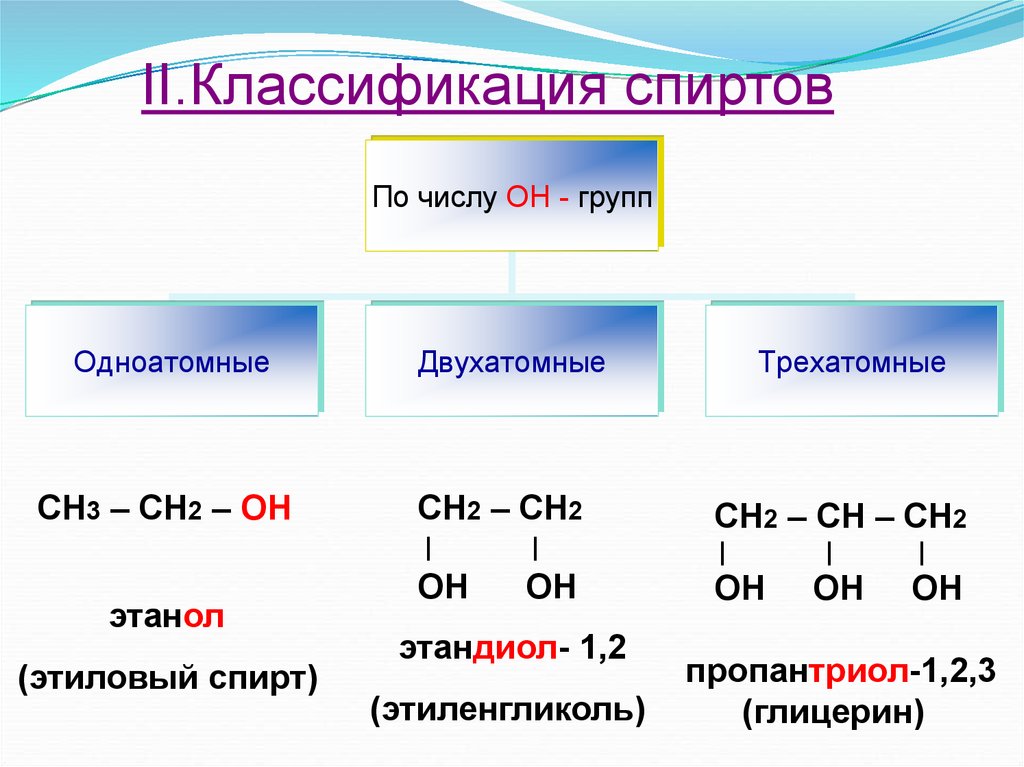 Чем больше ОН-групп в спирте, тем больше растворимость в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-ОЛ» и цифру, указывающую номер атома углерода, к которому присоединена гидроксильная группа.
Нумерация ведется от ближайшего к ОН-группе конца цепи.
- По радикально-функциональной номенклатуре названия спиртов составляют от названий углеводородных радикалов, соединенных с группой ОН, с добавлением слова «спирт».
Например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т.д.
- В названиях многоатомных спиртов количество групп ОН указывают суффиксами -диол в при наличии двух ОН-групп, -триол при наличии трех ОН-групп и т.
 д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.
д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.
Например, пропандиол-1,2 (пропиленгликоль):
Структурная изомерияДля спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода.
| Например. Формуле С4Н9ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета |
| Бутанол-1 | 2-Метилпропанол-1 |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О: этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
Понравилось это:
Нравится Загрузка. ..
..
УтверждениеЭтиленгликоль представляет собой двухатомный спирт. ПричинаОбщая формула для двухатомного спирта: ${C_n}{H_{2n}}{(OH)_2}$ A. И утверждение, и причина верны, а причина — правильное объяснение утверждения. Б. И утверждение, и причина верны, но причина не в правильном объяснении утверждения. Утверждение верно, но причина неверна. D. Утверждение неверно, но причина верна.
Ответить
Проверено
267,3 тыс.+ просмотров
Подсказка: В этиленгликоле две гидроксильные группы присоединены к соседнему атому углерода. Молекулярная формула этиленгликоля: \[{C_2}{H_6}{O_2}\]. Значение n равно 2.
Полный ответ: Двухатомные спирты классифицируются как любая группа спиртов, которая содержит две гидроксильные группы, присоединенные к двум молекулам сигма-связью. Примером двухатомного спирта является катехол, который содержит две гидроксильные группы, присоединенные к двум атомам углерода бензольного кольца.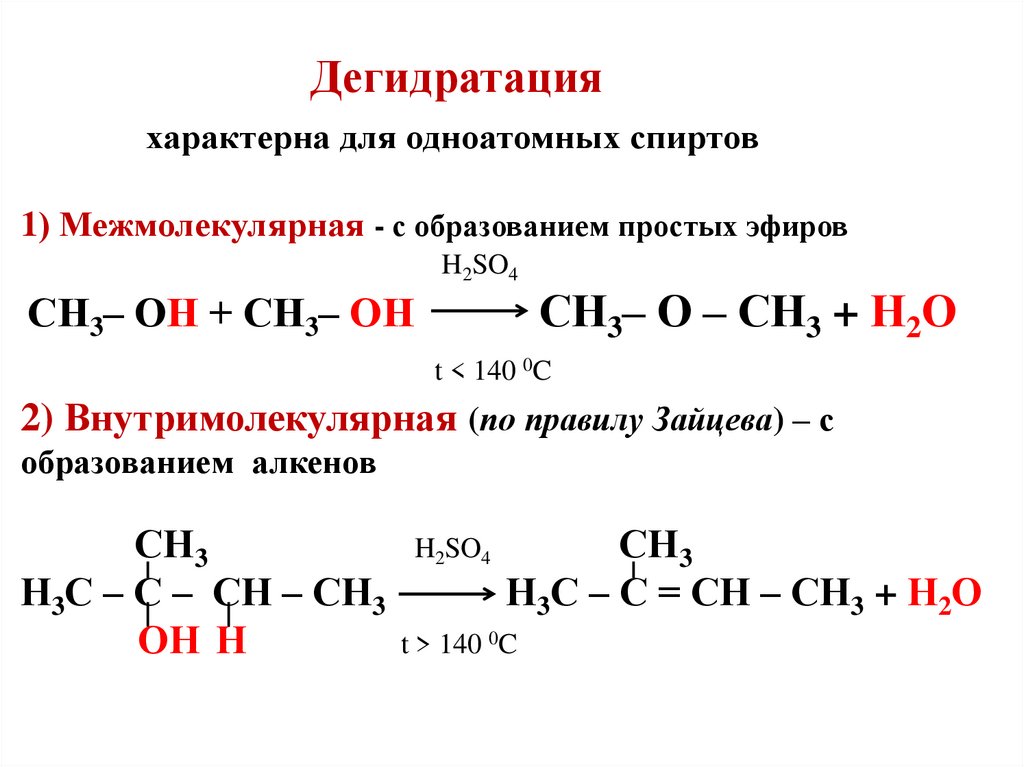 Другим важным примером двухатомного спирта является этиленгликоль. Это вицинальный диол, что означает, что две гидроксильные группы присоединены к соседнему атому углерода. Этиленгликоль по классификации ИЮПАК называется этан-1,2-диол. Поскольку этиленгликоль имеет обширные водородные связи, он вязкий по своей природе и обычно имеет более высокую температуру кипения, чем другие спирты.
Другим важным примером двухатомного спирта является этиленгликоль. Это вицинальный диол, что означает, что две гидроксильные группы присоединены к соседнему атому углерода. Этиленгликоль по классификации ИЮПАК называется этан-1,2-диол. Поскольку этиленгликоль имеет обширные водородные связи, он вязкий по своей природе и обычно имеет более высокую температуру кипения, чем другие спирты.
Общая формула двухатомного спирта: ${C_n}{H_{2n}}{(OH)_2}$
Молекулярная формула этиленгликоля: ${C_2}{H_6}{O_2}$. Он содержит два атома углерода, шесть атомов водорода и два атома кислорода.
Значение n равно 2.
Формула этиленгликоля: ${C_n}{H_{2n}}{(OH)_2}$= ${C_2}{H_{2(2)}}{(OH) _2} = {C_2}{H_4}{(OH)_2}$
Таким образом, и утверждение, и причина верны, и причина является правильным объяснением утверждения.
Следовательно, правильный вариант А.
Примечание: Этиленгликоль получают из этилена взаимодействием с перманганатом калия в щелочной среде. Реагент перманганат калия является окислителем.
Дата последнего обновления: 22 апреля 2023 г.
•
Всего просмотров: 267,3 тыс. 0003
Большинство эубактериальных антибиотиков получают из биологии Rhizobium класса 12 NEET_UG
биоинсектицида Саламин были извлечены из биологии класса А 12 NEET_UG
Какое из следующих утверждений относительно бакуловирусов 12-го класса биологии NEET_UG
Канализационные или городские канализационные трубы не должны быть непосредственно 12-го класса биологии NEET_UG
Очистка сточных вод осуществляется микробами A. B Удобрения 12-го класса биологии NEET_UG
9000 2 Иммобилизация ферментов – это конверсия активный фермент класса 12 биологии NEET_UGБольшинство эубактериальных антибиотиков получают из биологии класса 12 ризобий NEET_UG
Саламиновые биоинсектициды были извлечены из биологии класса А 12 NEET_UG
Какое из следующих утверждений относительно бакуловирусов 12-го класса биологии NEET_UG
Канализационные или городские канализационные трубы не должны быть непосредственно 12-го класса биологии NEET_UG
Очистка сточных вод осуществляется микробами A. B Удобрения 12-го класса биологии NEET_UG
B Удобрения 12-го класса биологии NEET_UG
Тенденции сомнений
Типы, определение, классификация, примеры, использование
Виды спирта в химии
Виды спирта используют для изготовления напитков или пива, водки и бренди, это этиловый спирт или этанол. Многие одноатомные, многоатомные, ароматические и алифатические спирты используются с различным содержанием спирта, например, в пищевых напитках и при приготовлении лекарств.
Спирт представляет собой изомеры эфира или гидроксильного производного углеводорода, полученные из алкена с удельной теплоемкостью и разбавленной серной кислоты под давлением.
Свойства спирта
Низшие члены спирта являются жидкостями и менее летучими из-за ассоциации через водородные связи, простирающиеся по цепочке молекул. Высшие члены тверды и почти беспорядочны.
Низшие спирты очень хорошо растворимы в воде, и растворимость уменьшается по мере увеличения молекулярной массы, поскольку атом кислорода гидроксильной группы образует водородную связь с молекулами воды.
Исследования гидроксильных групп спирта в инфракрасном спектре показывают, что они поглощают излучение электромагнитного спектра с частотой от 3650 до 3580 см −1 . Это верно только в том случае, если нет водородной связи. Межмолекулярная водородная связь в спиртах дает поглощение в области от 3550 до 3230 см -1 .
Кислотная природа спирта
Отнятие атома водорода спиртом под действием металлов проявляет кислотные свойства. Они не влияют на шкалу pH водного раствора, потому что являются более слабыми кислотами, чем вода.
Алкоксиды, гидролизуемые водой. По этой причине этоксид является более сильным основанием, чем гидроксид-ион.
Классификация спирта
По количеству функциональных или спиртовых групп эти органические соединения в химии классифицируют,
- Одноатомный спирт
- Двухатомный спирт
- Трехатомный спирт
- многоатомный спирт
Но и другие виды классификации спиртов даны в соответствии с присоединенной спиртовой группой к ароматическим или алифатическим соединениям или углеводородам.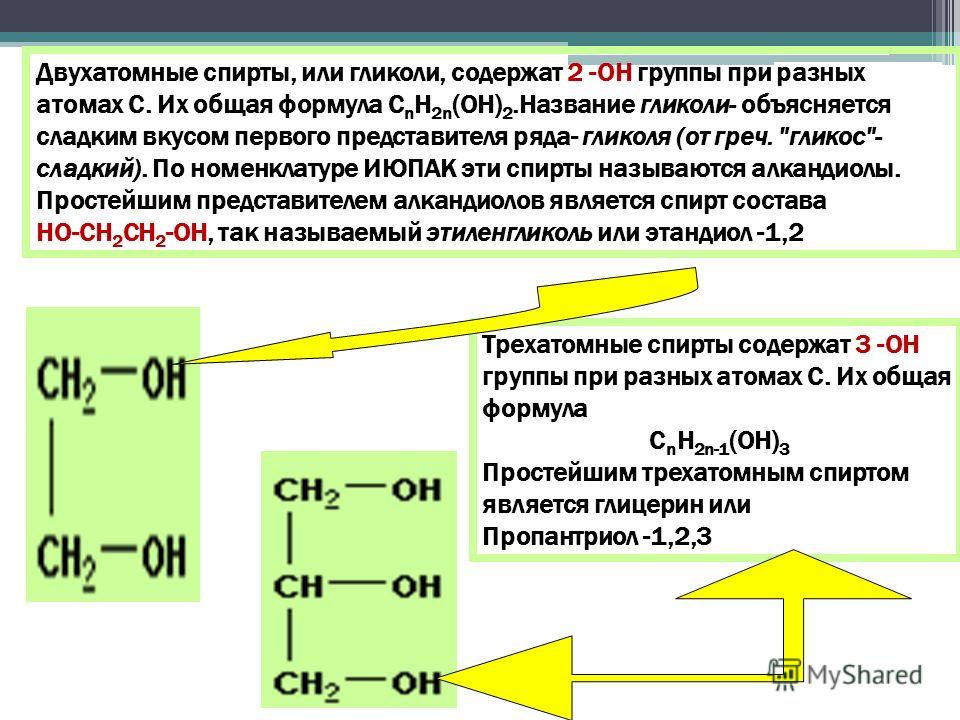
Одноатомный спирт
Одноатомные спирты представляют собой органические соединения, содержащие одну спиртовую или гидроксильную группу.
Метанол, этанол, пропанол, изопропанол, бутанол, изобутанол и фенол являются примерами таких типов спирта. Обычно они бывают двух типов:
- Ароматические спирты
- Спирты алифатические
Формула одноатомного спирта
Одноатомные спирты являются простейшими с общей молекулярной формулой C n H 2n+2 O или C н Н 2н+1 ОН. Одноатомные спирты дополнительно классифицируются в соответствии со спиртовой группой, присоединенной к алкилу.
- Первичный спирт : Спиртовая группа присоединена к альфа- атому углерода .
- Вторичный спирт : Алкогольная группа присоединена к бета-атому углерода.
- Третичный спирт : Спиртовая группа присоединена к гамма-атому углерода.

Многоатомный спирт
Двухатомный и трехатомный спирт содержат две или три спиртовые или гидроксильные группы. Но спирты содержат четыре или более спиртовых групп, называемых многоатомными спиртами. Такие виды спирта могут включать:
- Этиленгликоль
- Триметиленгликоль
- Пентаметиленгликоль
- Изобутенгликоль
Ароматические спирты
Ароматические спирты представляют собой класс органических соединений, содержащих спиртовую или гидроксильную группу в боковой цепи или непосредственно в углеводороде. Его можно рассматривать как арильное производное алифатических спиртов.
Ароматические спирты можно классифицировать как первичные, вторичные и третичные спирты. Способы получения этого вида спирта аналогичны алифатическим спиртам.
Типы ароматических спиртов
Ароматические спирты также классифицируются как одноатомные, двухатомные, трехатомные и многоатомные фенолы в зависимости от гидроксильной группы, присоединенной к бензольному кольцу.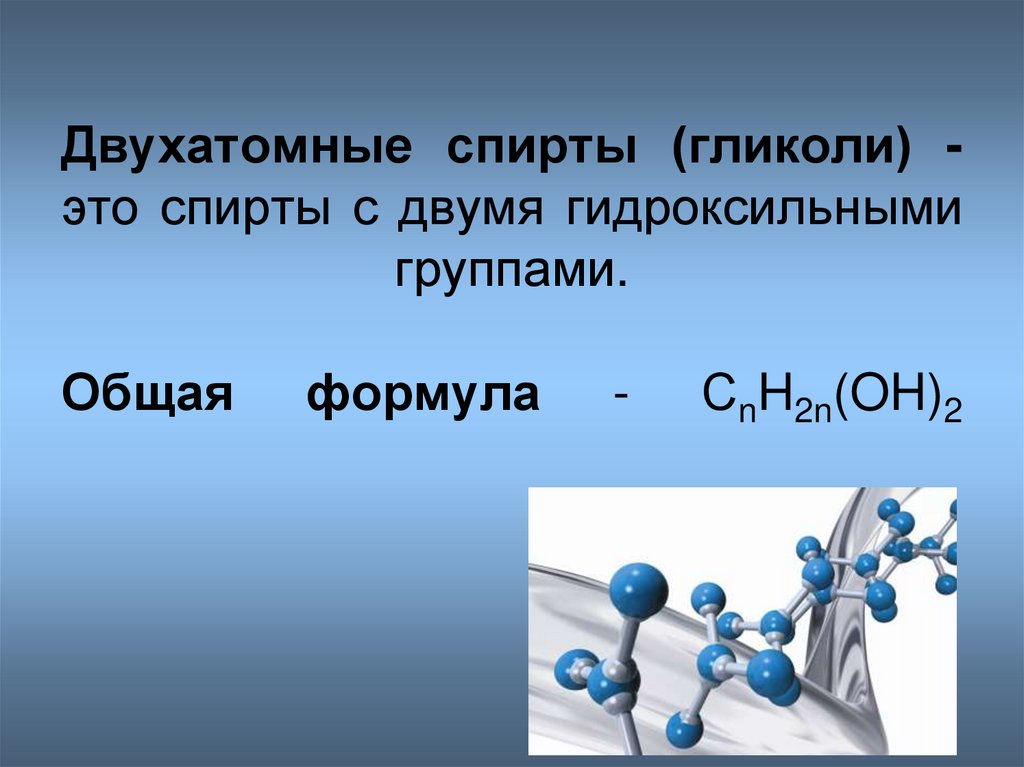 Типичными примерами этого типа спирта являются:
Типичными примерами этого типа спирта являются:
- Фенол
- Катехол (о-дигидроксибензол)
- Резорцин (м-дигидроксибензол)
- Хинол (п-дигидроксибензол)
Алифатические спирты
Классификация спиртов дана в соответствии со спиртовой группой, присоединенной к ароматическому или алифатическому углеводороду. Поэтому эти органические соединения называются алифатическими и ароматическими спиртами. Алифатические спирты представляют собой соединения, содержащие гидроксильные группы в боковой цепи алкильной группы.
Типы алифатических спиртов
- Одноатомные алифатические спирты : Эти химические вещества содержат одну спиртовую группу. Метанол, этанол, пропанол, изопропиловый спирт, бутанол и изобутанол являются примерами одноатомных спиртовых соединений.
- Двухатомные алифатические спирты : Эти химические вещества содержат две спиртовые группы. Этиленгликоль, триметиленгликоль, пентаметиленгликоль и изобутенгликоль являются двухатомными типами спиртовых соединений.

- Трехатомные алифатические спирты : Эти химические вещества содержат три спиртовые группы. Единственным важным трехатомным алифатическим органическим соединением является глицерин или пропан-1-2-2-триол. Глицерин встречается почти во всех животных и растительных маслах.
- Многоатомные алифатические спирты : D-сорбит, D-маннит и дульцит представляют собой многоатомные алифатические спирты, которые естественным образом содержат более трех гидроксильных групп.
Химические названия и формулы
Различные типы более простых одноатомных спиртов известны своими тривиальными названиями для изучения химии. Этот тип именования получен от химического производного алканов или парафинов, таких как метан, этан и пропан, присоединенных к гидроксильной или спиртовой группе.
| Примеры спирта | |
| Имена | Формула |
| метанол | CH 3 OH |
| н-пропанол | СН 3 СН 2 СН 2 ОН |
| изопропанол | СН 3 СН(ОН)СН 3 |
| трет-бутанол | (CH 3 ) 3 СО |
Другие типы наименований, рассматривая спирты как производные метанола.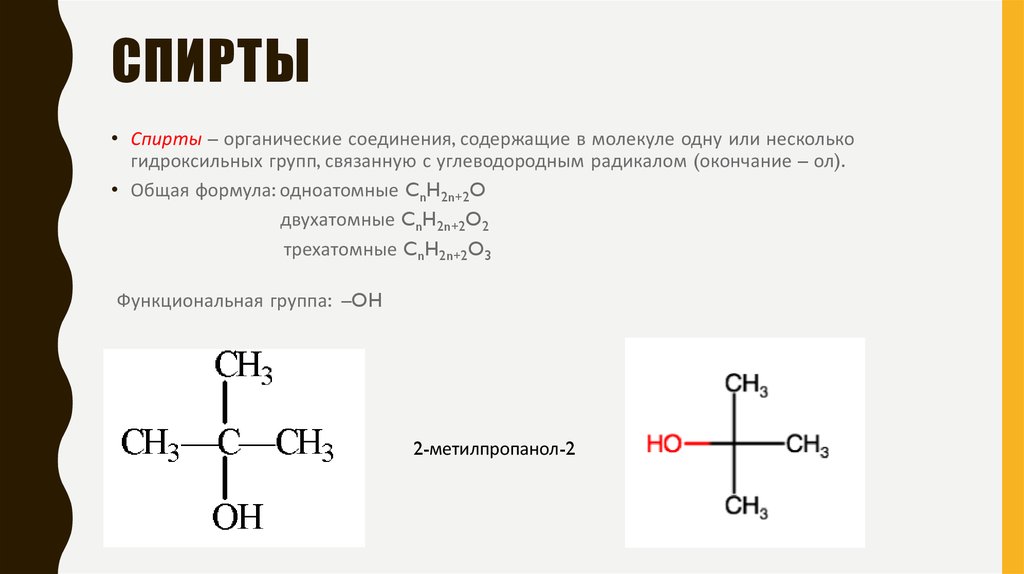 Например,
Например,
- CH 3 CH 2 CH 3 OH, именуемый как этилметанол
- CH 3 CH 2 CH(OH)CH 3 название метилэтилметанол
Использование спирта
- Это коммерчески важные органические химические соединения. Они используются в основном в алкогольных винах или напитках, таких как водка, пиво, виски и т. д.
- Применяются в качестве растворителя красок, лаков, шеллака, целлулоида и цементных заводов.
- При смешивании этанола с небольшим количеством метанола образуется метиловый спирт. Используется для приготовления автомобильной антифризной смеси и удаления чернил с различных поверхностей.
- Спирт используется для производства красителей и антибиотиков, лекарств, парфюмерии и т. д.
- Этанол используется в качестве альтернативного топлива для автомобилей или производства энергии (возобновляемых источников энергии).
- Обычные спирты, такие как фенол, метанол, этанол, используются в качестве антисептика, дезинфицирующего средства для рук на спиртовой основе и для приготовления антибиотиков или бакелита.

Способы получения спиртов
Общие способы получения спиртов приведены ниже на рисунке,
Гидролиз алкилгалогенидов
Спирты могут быть получены путем гидролиза алкилгалогенидов оксидом серебра, взвешенным в воде.
Также получают гидролизом сложных эфиров щелочью. Этот метод важен для получения третичных спиртов.
Восстановление Bouveault Blanc
Восстановление альдегидов, кетонов или сложных эфиров избытком натрия в этаноле или н-бутаноле дает спирты. Этот процесс называется восстановлением по Буво Блан.
Нагревающие эфиры
Может быть получен нагреванием эфиров с разбавленной серной кислотой под давлением. Например, диэтиловый эфир образует этанол.
Гидратация алкенов
Алкены могут быть гидратированы до спиртов путем абсорбции концентрированной серной кислотой с последующим гидролизом алкилсульфата водой.
Гидроборирование алкенов
Алкены быстро реагируют с дибораном (B 2 H 6 ) в эфире или ТГФ при комнатной температуре с образованием триалкилборанов.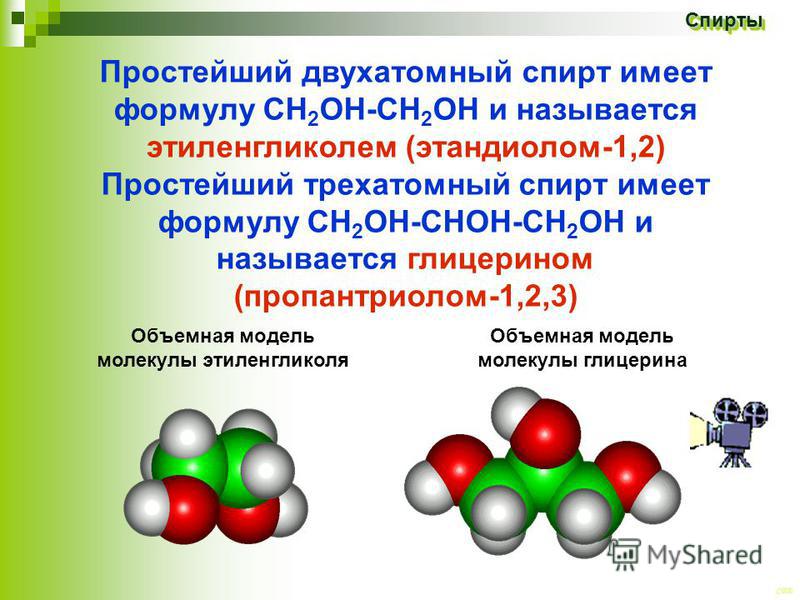 Триалкилбораны при окислении щелочной перекисью водорода образуют первичные спирты.
Триалкилбораны при окислении щелочной перекисью водорода образуют первичные спирты.
Спирты из реактива Гриньяра
Первичные, вторичные и третичные спирты могут быть получены из соответствующих карбонильных соединений действием реактива Гриньяра.
Процесс дрожжевого брожения
Ферментация в окружающей среде является самым ранним методом получения этанола с помощью химического катализатора и используется для производства напитков различных марок, таких как пиво, вино, виски и бренди.
- Обычно для этих реакций химического равновесия используются пшеница, ячмень или картофель.
- Пюре кипятят при температуре 50°С в течение одного часа. Расплав содержит фермент диастазы, воздействующий на крахмал для превращения мальтозы и сахара путем гидролиза,
2 (C 6 H 10 O 5 ) n + n H 2 O → n C 12 H 22 901 35 О 11 - Жидкость охлаждают до 300°С и ферментируют дрожжами в течение 1-3 дней.


 Например, этанол СН3–СН2–ОН.
Например, этанол СН3–СН2–ОН.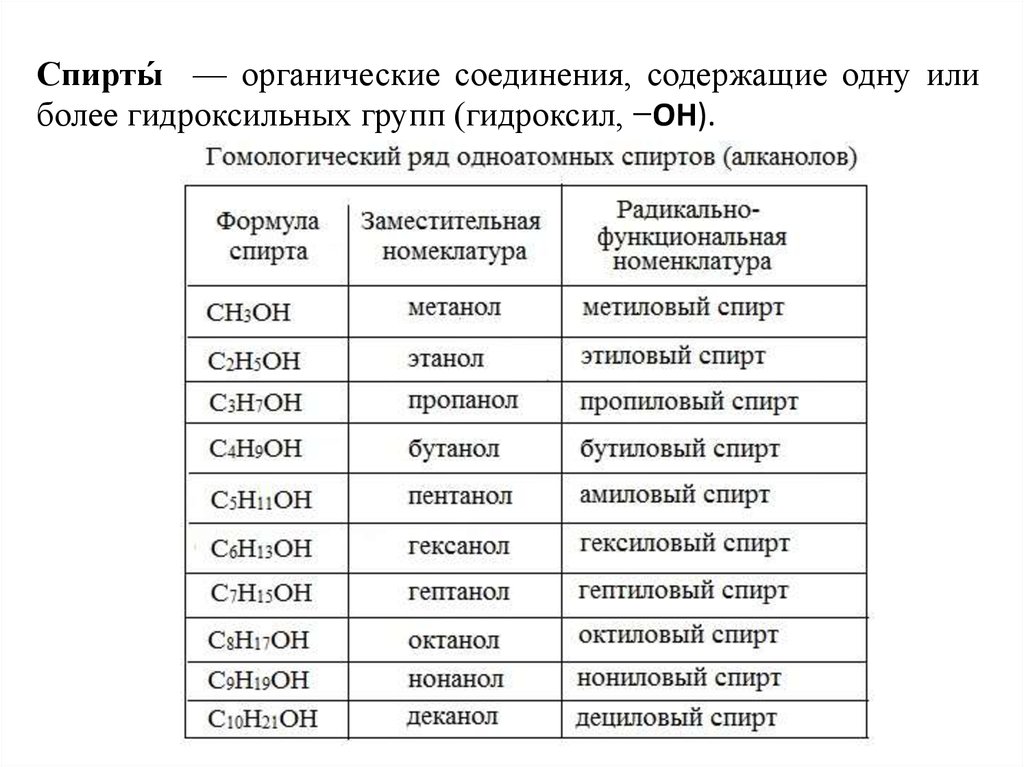 д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.
д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.


Leave A Comment