Тройная связь | это… Что такое Тройная связь?
Рис.1.Тройная связь в рамках теории валентных связей
Тройная связь — ковалентная связь двух атомов в молекуле посредством трёх общих связывающих электронных пар.
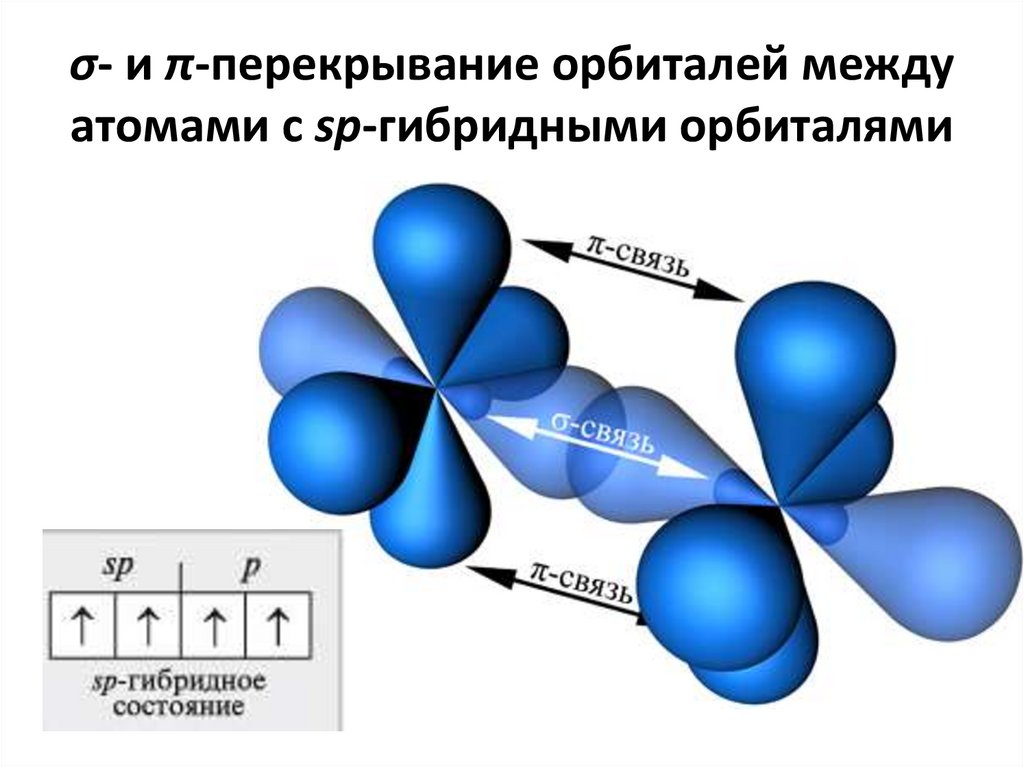
Первая картина наглядного строения тройной связи была дана в теории валентных связей. Тройная связь в рамках теории валентных связей образуется путём перекрытия двух p-атомных орбиталей атомов в двух перпендикулярных плоскостях и одной s-атомной орбитали атома в состоянии sp-гибридизации по оси, соединяющей атомы (рис.1).
Позднее (1958 г.) Л.Полинг предложил другой путь описания тройной связи, включающей комбинацию трёх равноценных изогнутых простых ковалентных связей[1]. Изгиб ковалентной связи имеет место за счёт электростатического отталкивания электронных пар (кулоновской электронной корреляции).
Дальнейшее развитие этих представлений нашло отражение в работах Гиллеспи-Найхолма. Идея учёта отталкивания электронных пар получила заслуженное признание и распространение под названием теории отталкивания электронных пар.
В основу теории положена модель жёстких сфер. Согласно этой модели, длина простой ковалентной связи d равна сумме радиусов двух атомных остовов и диаметра совместно используемой электронной пары (2re):
d = rAостов + rBостов + 2re
Для гомоядерной двухатомной молекулы ковалентный радиус атома rков = 1/2d, поэтому справедливо следующее соотношение:
rков = rостов + re
или re = rков — rостов.
Из этого соотношения можно рассчитать радиусы электронных пар для большинства элементов, используя значения ковалентных радиусов и ионных радиусов по Полингу, которые соответствуют размерам атомных остовов.
Для атома углерода ковалентный радиус равен 0,77 Å, радиус атомного остова — 0,15 Å, радиус связывающей электронной пары — 0,62 Å, длина химической связи углерод-углерод — 1,54 Å.[2]
| Кратность связи | Число связывающих электронных пар | Длина химической связи, Å | Энергия разрыва химической связи, кДж/моль |
|---|---|---|---|
| Одинарная (C-C) | одна | 1,54 | 348 |
| двойная (C=C) | две | 1,34 | 614 |
| тройная (C≡C) | три | 1,20 | 839 |
Соединения с кратными химическими связями легко вступают в реакции присоединения и получили название непредельных соединений.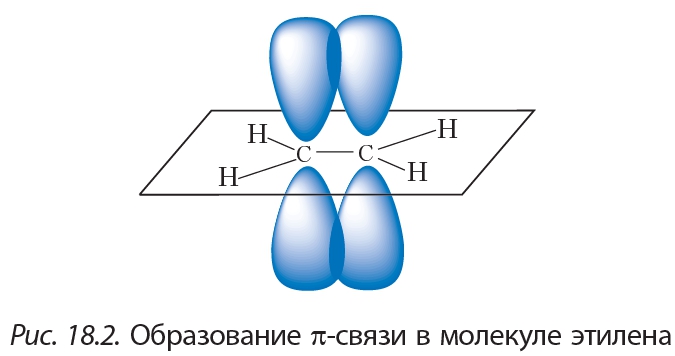
Примечания
- ↑ Полинг Л. Кекуле и химическая связь (книга «Теоретическая органическая химия») / под. ред. Р.Х.Фрейдлиной. — М.: Издательство иностранной литературы, 1963. — С. 7-16. — 366 с.
- ↑ 1 2 Гиллеспи Р. Геометрия молекул. — М.: Мир, 1975. — С. 47-48. — 280 с.
См. также
- Химическая связь
- Ковалентная связь
- Двойная связь (химия)
- Сигма-связь
- Пи-связь
- Гибридизация (химия)
- Теория изогнутой химической связи
- Кулоновская электронная корреляция
подробная информация и факты —
Мы собираемся изучить химию, участвующую в образовании тройной связи. Исследуйте, изучая соответствующие примеры тройных связей алкинов, функциональных групп и т. Д.
Давайте посмотрим на различные примеры триповых облигаций. :
Так что же такое тройная связь? Когда атомы разделяют три пары электронов и образуют связь, получается тройная связь.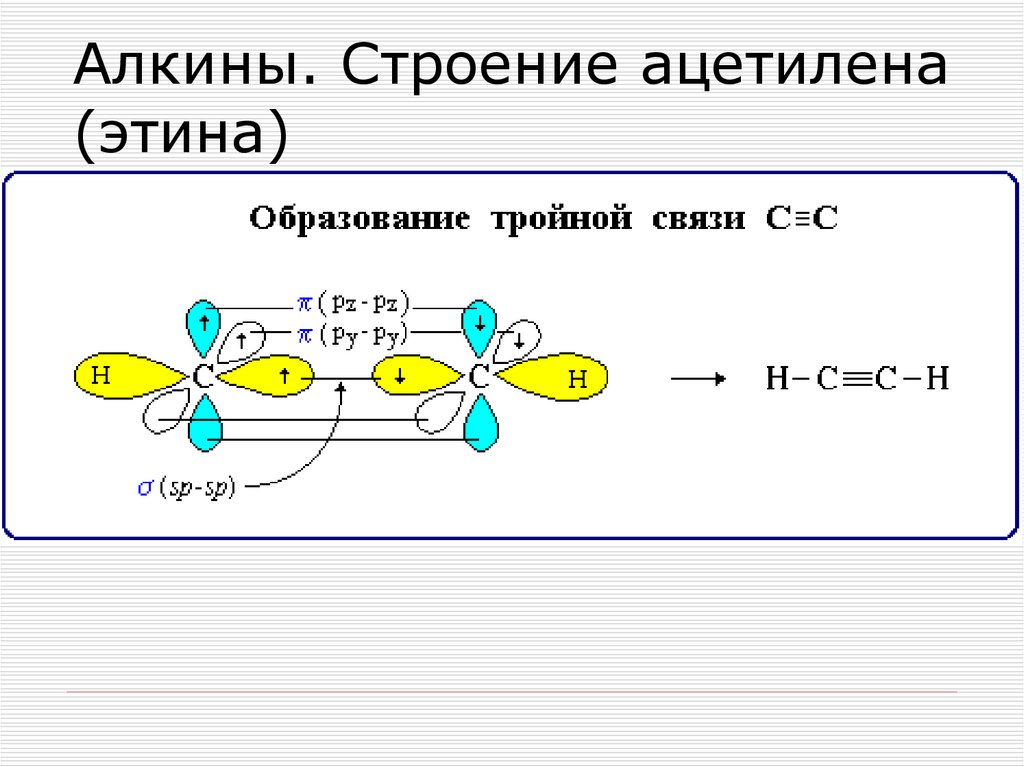 Считается, что он обладает высокой реакционной способностью с небольшой или более короткой длиной связи. Тройная связь представлена тремя параллельными штрихами (C≡C). У них низкая температура плавления и кипения..
Считается, что он обладает высокой реакционной способностью с небольшой или более короткой длиной связи. Тройная связь представлена тремя параллельными штрихами (C≡C). У них низкая температура плавления и кипения..
Также считается, что с увеличением количества углерода повышается и температура плавления и кипения; они растворимы в органических растворителях и нерастворимы в воде. Так у нас будет более близкий подход к формированию тройки связь, изучая молекулы различных примеров тройной связи.
Прочность связи: по мере увеличения прочности связи длина связи уменьшается. Тройной связи намного прочнее и короче, чем двойные связи между одними и теми же атомами. Длина связи составляет около 1.203 Å, а энергия, необходимая для разрыва связи, составляет -365 кДж/моль. Длина связи обратно пропорциональна прочности связи и энергии диссоциации связи.
Концепция гибридизация очень полезна для понимания концепции формы и молекулярная геометрия молекул. Таким образом, гибридизация — это смешение атомных орбиталей, ведущее к образованию желаемой новой гибридной орбитали.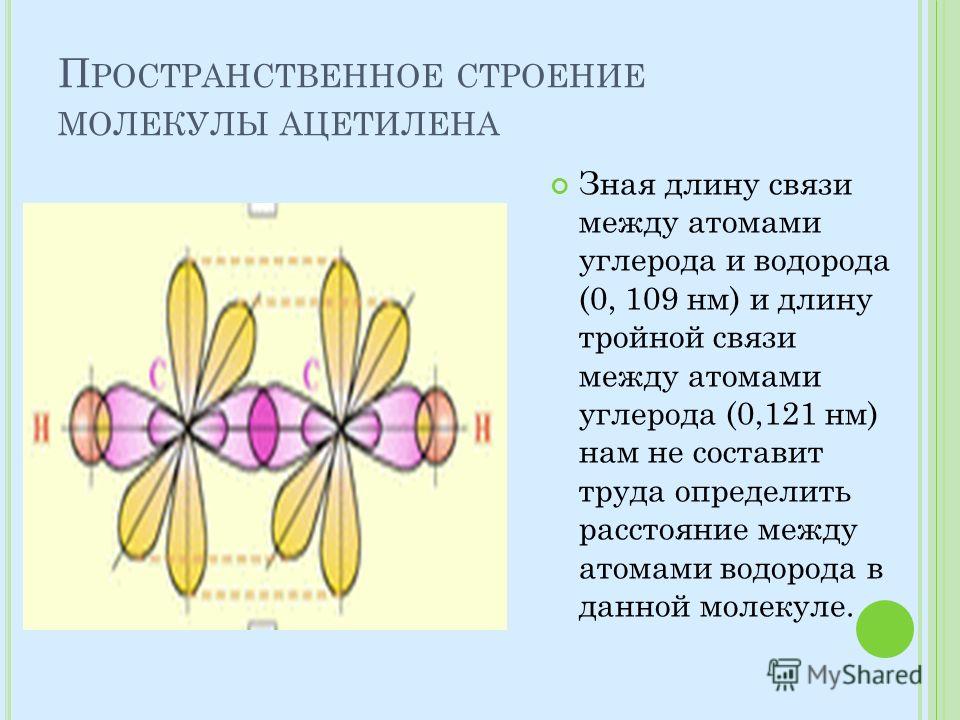 Сигма-связь образуется между sp-орбиталью одного углерода и sp-орбиталью другого углерода. Образование связи Pi происходит между p-орбиталями двух атомов углерода. Поэтому мы будем применять эту концепцию для понимания различных примеров тройной связи.
Сигма-связь образуется между sp-орбиталью одного углерода и sp-орбиталью другого углерода. Образование связи Pi происходит между p-орбиталями двух атомов углерода. Поэтому мы будем применять эту концепцию для понимания различных примеров тройной связи.
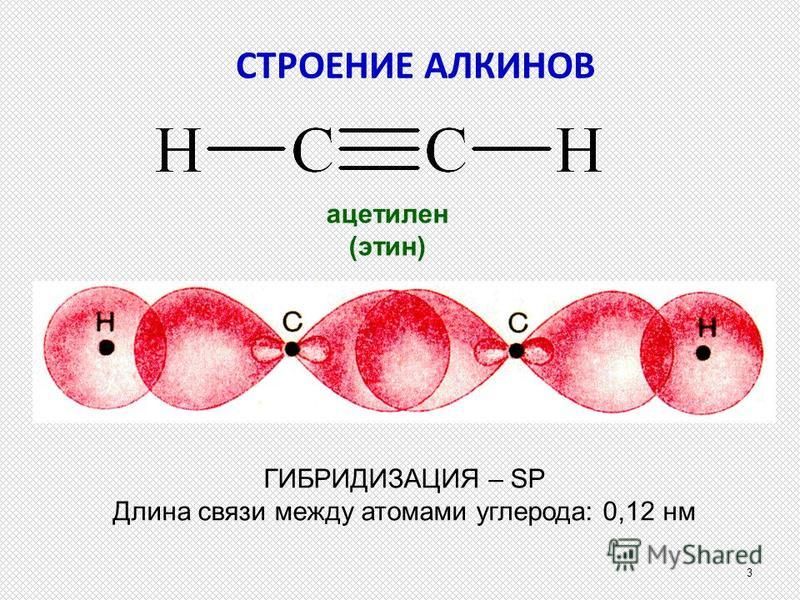
1. Ацетилен
Считается простейшим углеводородом, содержащим тройную связь CH≡CH, одна сигма + две пи-связи. Это четырехвалентное соединение с валентностью-4. Мы знаем, что углерод и водород участвуют в образовании ацетилена. Таким образом, атомный номер углерода равен 6, его валентность равна четырем, что означает количество электронов, доступных для образования связи. Это очень распространенные примеры тройной связи.
Ацетиленовая тройная связьКредит изображения: Википедия
Водород с атомным номером 1 может делиться своим электроном для образования связи. Итак, в молекуле ацетилена C2h3 два атома углерода и два атома водорода соединяются вместе.
Тип гибридизации, связанной с ацетиленом (этином), — sp, что означает, что он имеет половину s-символа и половину p-символа, имеет угол связи 180 градусов и обладает линейной геометрией. Замечено, что электронная конфигурация углерода в основном состоянии равна 1s2 2s2 2px1 2py1, поэтому есть только два несвязанных электрона, но валентность углерода равна 4.
Таким образом, для образования связи требуется 4 электрона. Поэтому 2 электрона с s-орбиталей переходят на 2pz-орбиталь, которая в возбужденном состоянии пуста. Итак, во время возбужденное состояние теперь углероды электронные конфигурация становится 1s2 2s1 2px1 2py1 2pz1.
Каждый атом углерода гибридизуется путем sp-гибридизации 2s- и 2p-орбиталей в возбужденном состоянии, давая две наполовину заполненные орбитали (sp), имеющие расположение лайнеров.
2. Монооксид углерода :
Тройная связь находится между атомом углерода и атомом кислорода. Он состоит из 1 сигма- и 2 пи-связей. Говорят, что угарный газ сильнее всего Ковалентная связь. Образование связи между углеродом и кислородом происходит за счет ковалентной связи, т. е. обмена электронами между двумя атомами (углерод, кислород).
Говорят, что угарный газ сильнее всего Ковалентная связь. Образование связи между углеродом и кислородом происходит за счет ковалентной связи, т. е. обмена электронами между двумя атомами (углерод, кислород).
Кредит изображения: Википедия
Когда атом углерода получает неподеленную пару от электрона кислорода, образующаяся связь является нековалентной. Таким образом, 2 — это ковалентные связи, а 1 — нековалентная связь. заказ облигаций оказывается 3.
Валентный электрон в углероде равен 4, а в кислороде — 6. Гибридизацию становится намного легче определить, если мы знать стерическое число молекулы (стерическое число – называется количеством пар неподеленных пар вокруг центрального атома). Замечено, что молекулы, у которых стерическое число равно 2, гибридизация называется sp.
Орбитальная диаграммаКредит изображения: Википедия
Сигма-связь CO возникает в результате перекрытия орбитали 2pz углерода и 2pz-орбитали кислорода.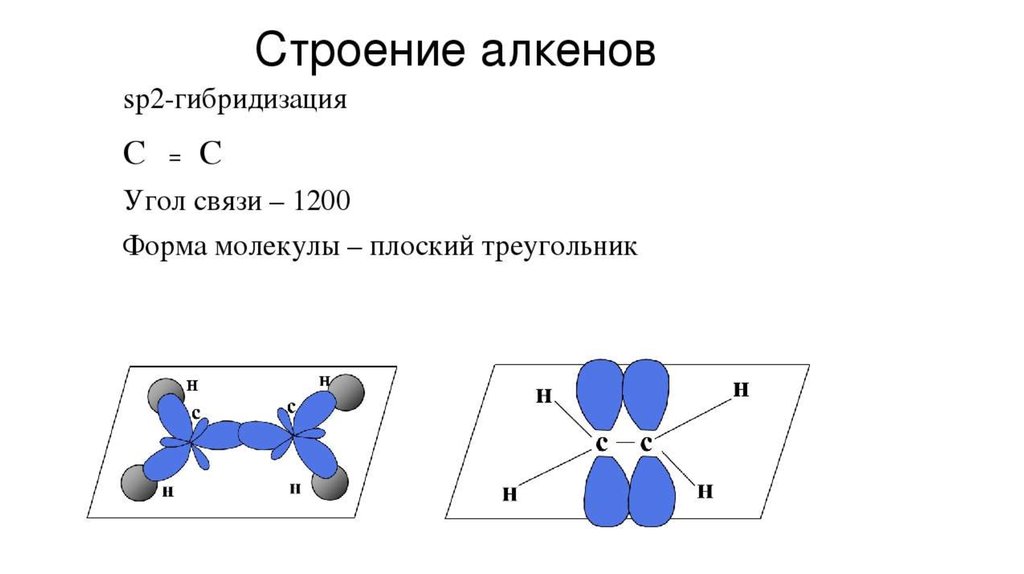 Из двух пи-связей одна пи-связь возникает в результате перекрытия орбитали 2px для углерода и 2-х пиксельной орбитали кислорода, а вторая пи-связь возникает в результате перекрытия 2py-орбитали углерода и 2py-орбитали кислорода.
Из двух пи-связей одна пи-связь возникает в результате перекрытия орбитали 2px для углерода и 2-х пиксельной орбитали кислорода, а вторая пи-связь возникает в результате перекрытия 2py-орбитали углерода и 2py-орбитали кислорода.
Прочитайте больше: SN2 Механизм
3. Пропин
Это молекула, в которой ковалентная связь находится между 2 атомами углерода. Итак, пропин состоит из 3 атомов углерода и 4 атомов водорода. Первый углерод связан с одним водородом одинарной связью и присоединен к следующему углероду тройной связью. И второй углерод присоединен к одному атому углерода тройной связью, а другой углерод — одинарной связью.
Структура пропинаКредит изображения: Википедия
Третья углеродная связь связана с 3 атомами водорода одинарной связью. Таким образом, он имеет 6 сигма и 2 пи-связи.. Температура плавления пропина составляет 104 градуса Цельсия, а температура кипения — 23.1 градуса Цельсия. Замечено, что он нерастворим в h3O, но, как было обнаружено, растворим в хлороформе, бензине и т. Д.
Д.
Как мы знаем, в структуре пропина 3 атома углерода; рассматривая первый углерод, к нему присоединены два атома, один из углерод а другой из водорода. Таким образом, вокруг первого атома углерода нет неподеленной пары. Следовательно, наблюдается его гибридизация sp.
ГибридизацияКредит изображения: Слайд-плеер
С учетом второго углерода, он присоединен к 2 атомам углерода с каждой стороны, и неподеленной пары не существует. Следовательно, его гибридизация sp. Теперь, что касается третьего атома углерода, он присоединен к 4 атомам, из которых три являются атомами водорода, а один — атомом углерода, и неподеленной пары нет, поэтому гибридизация углерода является sp3.
4. Бензин
Это пример связи арин-трипа. Это очень реактивный промежуточный продукт. Мы можем рассматривать это как исключение, потому что второе пи-связывание является результатом слабого взаимодействия sp2-орбиталей (гибридного), которое находится в плоскости колец.
Кредит изображения: Википедия
Обнаружено, что образованная тройная связь имеет нелинейную природу из-за деформации и реакционной способности (относительно высокой) 6-членного ароматического кольца. Он состоит из двух сигма-связей (sp-sp) и одной пи-связи (pp).
Гибридизация: было замечено, что атомы углерода, имеющие тройные связи, гибридизуются sp, а оставшиеся четыре связанных атома углерода, которые связаны одинарной связью, гибридизуются sp2. Бензины — это редкие примеры тройной связи.
Подробнее: Механизм SN1
5. 2-бутин
Его химическая формула — C4H6 с температурой плавления -32 градуса Цельсия и температурой плавления 27 градусов Цельсия. Его синоним — Диметилацетилен. В молекуле девять сигма-связей и две пи-связи. Первый и четвертый углерод имеют 4 сигма-связи, и, следовательно, он гибридизован sp3.
СтруктураКредит изображения: Википедия
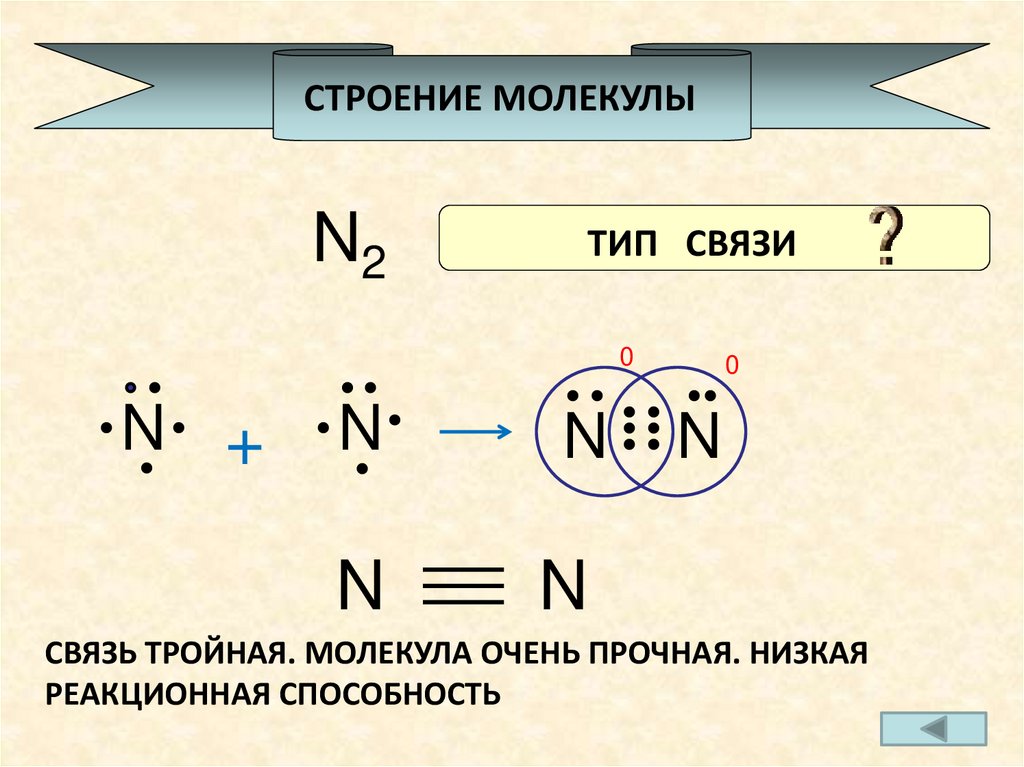
6. Азот.
Азот.
Его символ — N, а атомный номер равен 7 и принадлежит к группе 5. Он в основном находится в газообразном состоянии с температурой плавления -209.86 градусов по Цельсию и температурой кипения -195.795 градусов по Цельсию. Валентных электронов в азоте пять, поэтому для завершения своего октета требуется более трех электронов.
Состав азотаКредит изображения: Обмен химическим стеком
Следовательно, он разделяет свои три электрона с еще одним атомом азота, чтобы удовлетворить правилу октетов. В N2 есть одна сигма-связь и 2 пи-связи. На атоме N присутствует одна неподеленная пара. Говорят, что стерический фактор в азоте равен 1 + 1 = 2. Угол связи в N2 составляет 180 градусов при линейной геометрии молекулы, и его популярность наблюдается как неполярная.
Электронная конфигурация N2 — 1s2 2s2 2px 2py 2pz, 3 из 2p-орбиталей остаются пустыми. Итак, эти наполовину заполненные 2p-орбитали принимают участие в связывании. Таким образом, эти три наполовину заполненные орбитали от каждого атома азота перекрываются вдоль оси (межъядерной) для образования связи. Таким образом образуется тройная связь между двумя атомами азота. Этот N2 очень важен для организмов. Он также используется в различных отраслях промышленности для производства удобрений и т. Д.
Таким образом образуется тройная связь между двумя атомами азота. Этот N2 очень важен для организмов. Он также используется в различных отраслях промышленности для производства удобрений и т. Д.
1. Является ли F2 тройной связью?
Нет, фтор не имеет тройной связи.
Говорят, что F2 имеет чистую ковалентную связь. Считается, что атомный номер фтора равен 9, а его электронная конфигурация равна 1s2 2s2 2px2 2py2 2pz1.. Таким образом, количество валентных электронов равно 7. Для достижения полный октет, нужен еще один электрон.
Он соединяется с еще одним атомом фтора и завершает свой октет. Связывание происходит между 2pz одного атома фтора и 2pz 2-го атома фтора, и в результате образуется ковалентная связь. На атоме F3 (каждой) находятся 1 неподеленные пары электронов.
2. Является ли h3 тройной связью?Нет, у h3 нет тройной связи.
Он образует связь путем образования одинарной связи.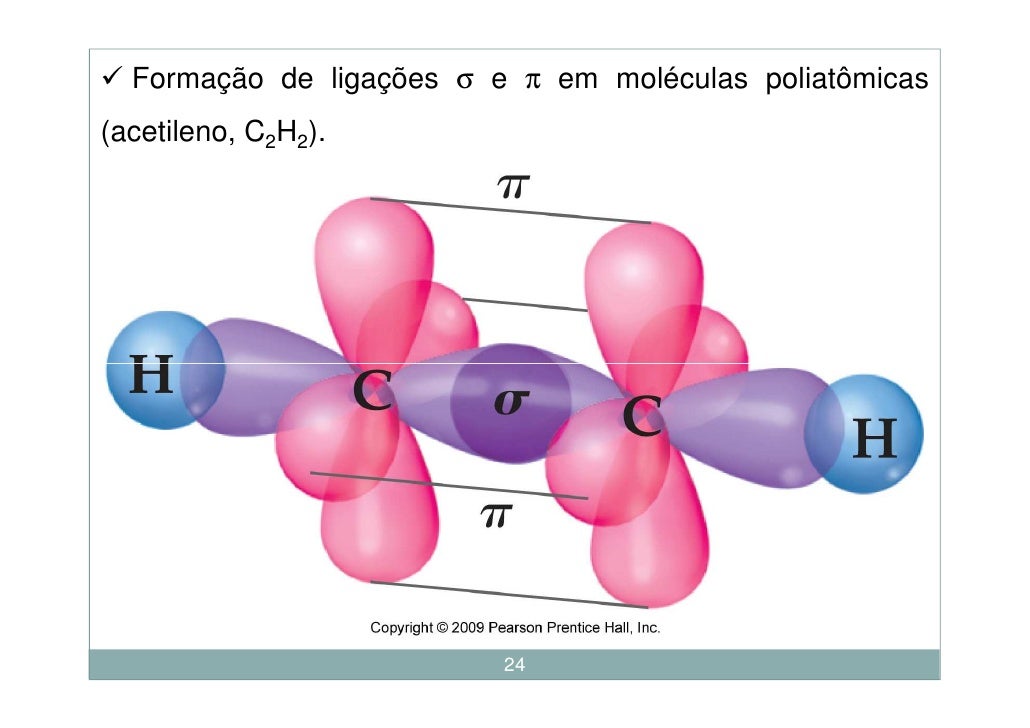 Поскольку мы знаем, что его атом не является металлом, образование связи h3 (молекулы) будет ковалентным. Также наблюдается неполярная (ковалентная) связь, поскольку образование связи происходит между одними и теми же атомами, поэтому нет никакой разницы в их электроотрицательности, другими словами, это означает, что атомы водорода и электроны являются разделены поровну.
Поскольку мы знаем, что его атом не является металлом, образование связи h3 (молекулы) будет ковалентным. Также наблюдается неполярная (ковалентная) связь, поскольку образование связи происходит между одними и теми же атомами, поэтому нет никакой разницы в их электроотрицательности, другими словами, это означает, что атомы водорода и электроны являются разделены поровну.
Его температура плавления составляет -259.9 градуса по Цельсию, а температура кипения составляет -252.8 градуса по Цельсию. Считается самым легким из всех элементов. Он довольно стабилен, но все же способен образовывать различные связи. В нем есть три изотопа: тритий, дейтерий и протий, и все три имеют различные свойства.
h3 считается легковоспламеняющимся (сильно) и может загореться в атмосфере при соблюдении требуемых условий.
Если мы говорим о гибридизации, то в водороде нет гибридизации, поскольку он имеет только один электрон, поэтому логически невозможно смешивать орбитали и образовывать гибридные орбитали.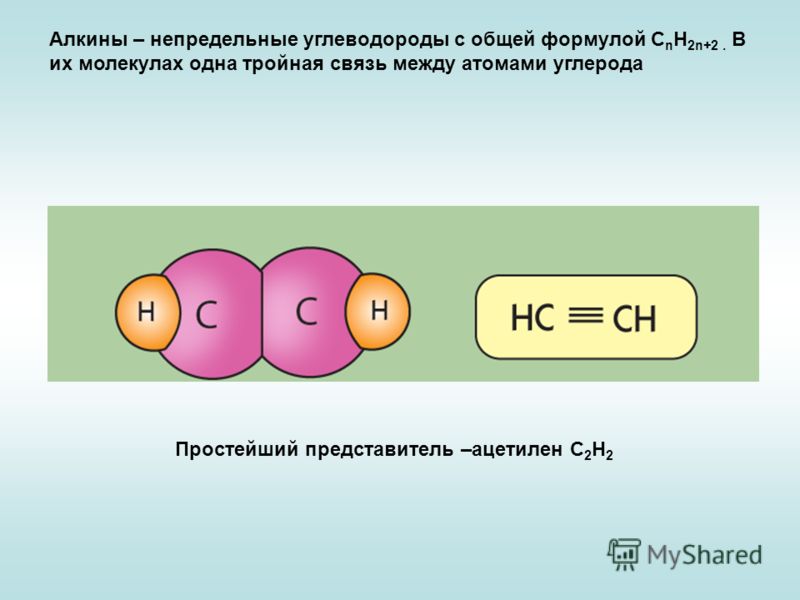
Да, HCN (цианистый водород) имеет тройную связь (между атомом углерода и азота).
Это опасно. Так что при работе с ним нужно быть очень осторожным. Он может существовать в жидкой или газообразной форме.
Температура плавления составляет -13.29 градусов по Цельсию, а температура кипения составляет 26 градусов по Цельсию. Молекула HC-N имеет линейную геометрию. Цианистый водород — слабая кислота; он может частично ионизироваться в присутствии воды, что приводит к образованию аниона CN-. Таким образом образуется синильная кислота. Он используется в горнодобывающей промышленности для добычи золота и серебра.
Кроме того, многие важные органические соединения получают с использованием HCN, такие как EDTA, адипонитрил (он является предшественником нейлона-6,6). Цианистый водород состоит из трех атомов (один водород, один углерод и один азот). Связь между углеродом и водородом одинарная, а связь между углеродом и азотом — тройная.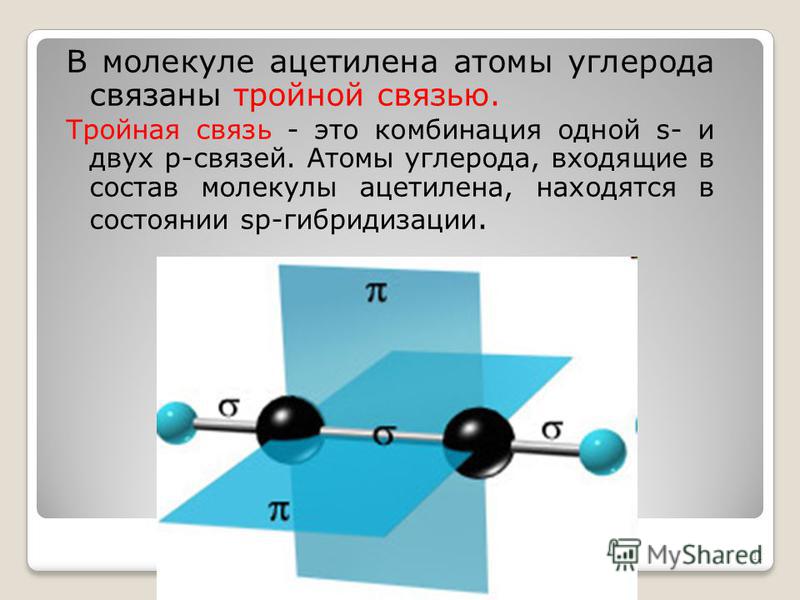 Оказалось, что стерическое число равно 2.
Оказалось, что стерическое число равно 2.
Водород в этой молекуле не имеет какой-либо гибридизации, поскольку один электрон водорода связан с одним электроном углерода, таким образом удовлетворяя его валентность. Гибридизация углерода в молекуле sp.
Пожалуйста, нажмите, чтобы узнать о SiCl2Br2 Структура Льюиса и Плотность дихлорметана.
Тройная связь | химическая связь
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica.- Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории.
- Студенческий портал
Britannica — это главный ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
- 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.
- Спасение Земли
Британника представляет список дел Земли на 21 век. Узнайте об основных экологических проблемах, стоящих перед нашей планетой, и о том, что с ними можно сделать! - SpaceNext50
Britannica представляет SpaceNext50. От полета на Луну до управления космосом — мы изучаем широкий спектр тем, которые питают наше любопытство к космосу!
Содержание
- Введение
Краткие факты
- Связанный контент
Примеры тройной связи – StudiousGuy
Концепция химической связи в химии позволяет нам понять несколько поведенческих аспектов материи, присутствующей вокруг нас.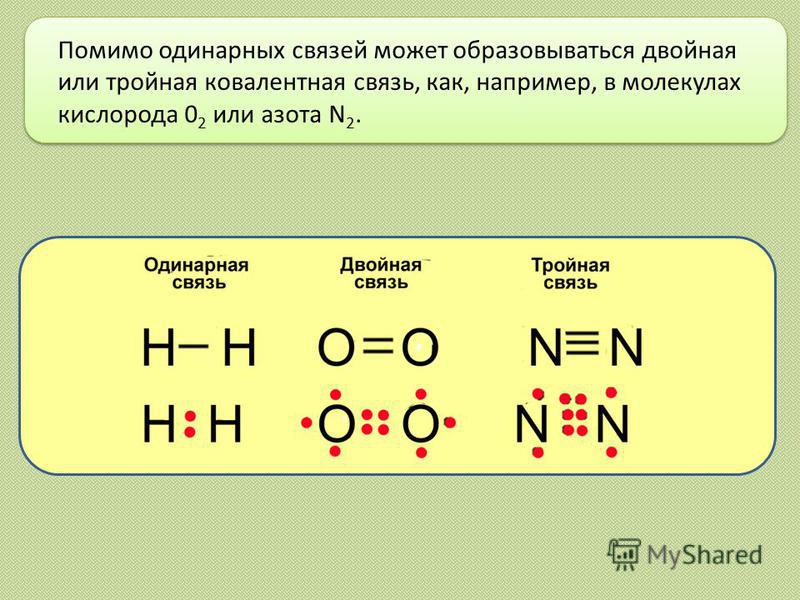 В самых фундаментальных терминах химическая связь — это не что иное, как модельное представление взаимодействия сил, существующих между атомами, точно так же, как музыкальные ноты представляют музыку на странице. Химики используют эти модели для понимания межатомных/молекулярных взаимодействий и их соответствующих эффектов в реальном мире. Хотя все атомы обычно электрически нейтральны, они все же нестабильны из-за своих пустых валентных оболочек. Для достижения стабильности атомы разделяют и отдают/принимают электроны от других атомов, тем самым развивая ковалентные и ионные связи между ними соответственно. Когда два атома разделяют три пары (шесть электронов) среди своих валентных оболочек, мы говорим, что между ними существует тройная связь. Тройная связь представлена на бумаге чем-то, называемым точечной структурой Льюиса, с тремя прямыми линиями (≡), проведенными между символами соответствующих химических элементов. Теоретические и экспериментальные данные показывают, что длина связи в случае тройных связей короче, чем у эквивалентных одинарных и двойных связей.
В самых фундаментальных терминах химическая связь — это не что иное, как модельное представление взаимодействия сил, существующих между атомами, точно так же, как музыкальные ноты представляют музыку на странице. Химики используют эти модели для понимания межатомных/молекулярных взаимодействий и их соответствующих эффектов в реальном мире. Хотя все атомы обычно электрически нейтральны, они все же нестабильны из-за своих пустых валентных оболочек. Для достижения стабильности атомы разделяют и отдают/принимают электроны от других атомов, тем самым развивая ковалентные и ионные связи между ними соответственно. Когда два атома разделяют три пары (шесть электронов) среди своих валентных оболочек, мы говорим, что между ними существует тройная связь. Тройная связь представлена на бумаге чем-то, называемым точечной структурой Льюиса, с тремя прямыми линиями (≡), проведенными между символами соответствующих химических элементов. Теоретические и экспериментальные данные показывают, что длина связи в случае тройных связей короче, чем у эквивалентных одинарных и двойных связей.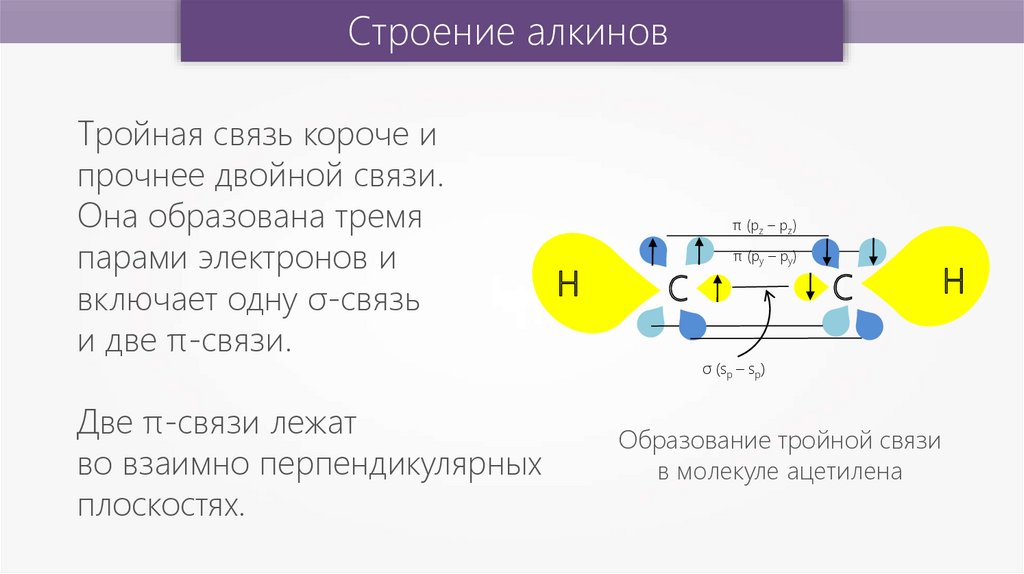 Следовательно, тройные связи обладают большей прочностью, чем одинарные или двойные связи, т. е. для разрыва тройной связи в {N}_{2} потребуется больше энергии по сравнению с двойной связью в {O}_{2}. Важно отметить, что множественные связи (двойные и тройные связи) возникают только между атомами, которым необходимо получить или потерять по крайней мере два валентных электрона за счет совместного использования. Давайте расширим рамки нашего понимания тройных связей с помощью следующих примеров:
Следовательно, тройные связи обладают большей прочностью, чем одинарные или двойные связи, т. е. для разрыва тройной связи в {N}_{2} потребуется больше энергии по сравнению с двойной связью в {O}_{2}. Важно отметить, что множественные связи (двойные и тройные связи) возникают только между атомами, которым необходимо получить или потерять по крайней мере два валентных электрона за счет совместного использования. Давайте расширим рамки нашего понимания тройных связей с помощью следующих примеров:
Указатель статей (щелкните, чтобы перейти)
1. Динитроген (N≡N) Самый распространенный элемент, присутствующий в земной атмосфере, азот, существует в основном в виде молекул диазота без запаха и цвета ( { N}_{2}), содержащий два атома азота, связанных между собой тройными связями, N≡N. Азот является естественным элементом, который необходим растениям и животным для их роста. Несмотря на обилие (составляющее 78% нашей атмосферы), азот в значительной степени недоступен для растений и организмов из-за его существования в виде диазота и наличия прочных тройных связей между его атомами, что делает его дефицитным ресурсом и часто ограничивает первичную продуктивность во многих экосистемы.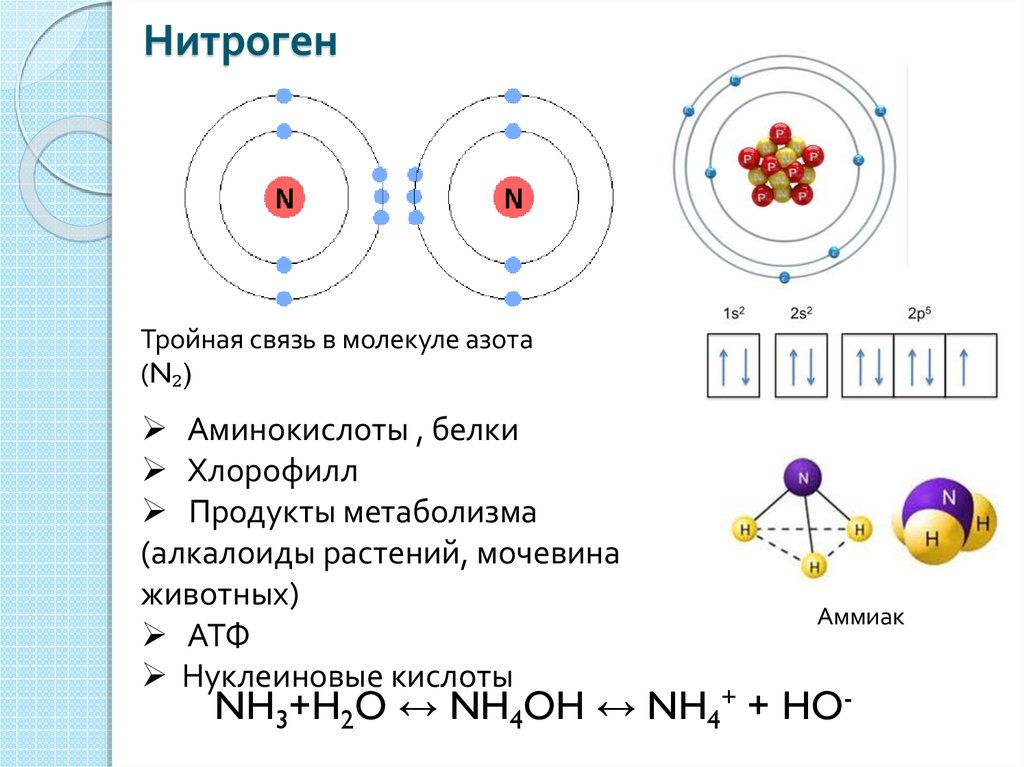 Чтобы азот был доступен для производства белков, ДНК и других биологически важных соединений, он должен сначала превратиться из {N}_{2} в аммиак {NH}_{3} в процессе фиксации азота. Наличие одной σ и двух π связей приводит к энергии связи 941 кДж на моль, что делает диазот крайне нереакционноспособным. Тем не менее, тройные связи, присутствующие в диазоте, могут разрываться с образованием нескольких соединений и координировать комплексы с металлами, такими как литий и другие переходные металлы. Долгое время исследователи считали, что тройная связь, присутствующая в диазоте, является основной причиной его инертности; однако новые исследования показывают, что π-связи между атомами азота не вносят большого вклада в стабильность диазота, поскольку их присутствие также объясняет реакционную способность в случае ацетилена. Эти открытия могут обеспечить более эффективные решения проблемы нехватки азота.
Чтобы азот был доступен для производства белков, ДНК и других биологически важных соединений, он должен сначала превратиться из {N}_{2} в аммиак {NH}_{3} в процессе фиксации азота. Наличие одной σ и двух π связей приводит к энергии связи 941 кДж на моль, что делает диазот крайне нереакционноспособным. Тем не менее, тройные связи, присутствующие в диазоте, могут разрываться с образованием нескольких соединений и координировать комплексы с металлами, такими как литий и другие переходные металлы. Долгое время исследователи считали, что тройная связь, присутствующая в диазоте, является основной причиной его инертности; однако новые исследования показывают, что π-связи между атомами азота не вносят большого вклада в стабильность диазота, поскольку их присутствие также объясняет реакционную способность в случае ацетилена. Эти открытия могут обеспечить более эффективные решения проблемы нехватки азота.
Окись углерода представляет собой газ без запаха, вкуса и цвета.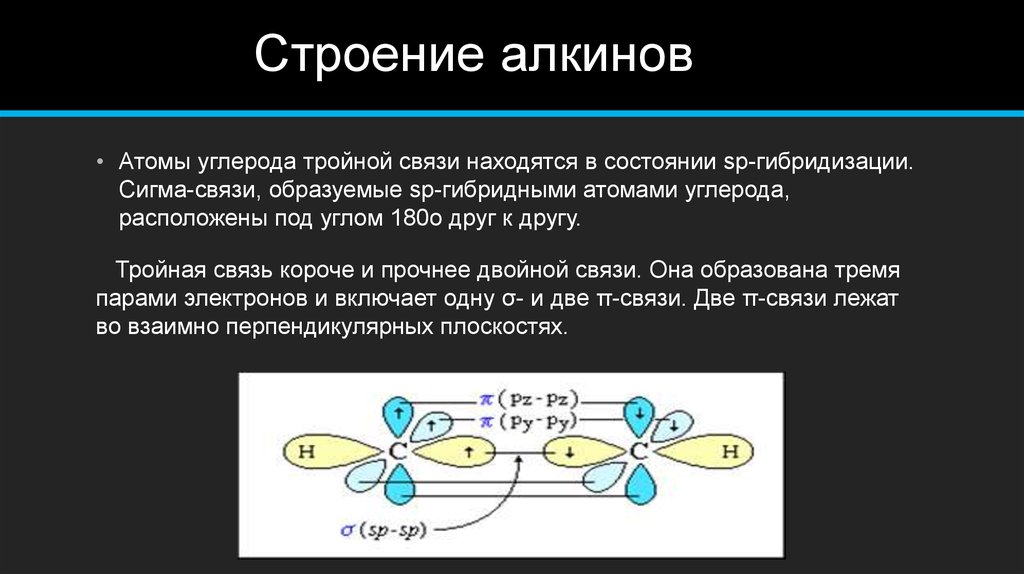 Каждая молекула моноксида углерода состоит из одного атома углерода, связанного с одним атомом кислорода через тройную связь, сопровождаемого неподеленной парой электронов на обоих атомах. В химии тройная связь между углеродом и кислородом в СО считается самой прочной связью с энергией связи 1072 кДж на моль. В нашем предыдущем примере мы обсуждали тройную связь, образованную между двумя одинаковыми атомами; однако в случае монооксида углерода две слабые π-связи слегка вырождены из-за присутствия более электроотрицательных атомов кислорода. Это вызывает поляризацию в молекуле и придает ей дипольный момент, которого нет у диазота. Полярный характер CO также способствует его более высокой реакционной способности, чем у азота, несмотря на то, что он имеет более высокую энергию диссоциации связи, чем последний. Кроме того, угарный газ является одним из самых распространенных загрязнителей воздуха в нашей атмосфере. Наиболее важные аспекты его химии возникают из-за его способности реагировать с переходными металлами с использованием особого типа химической связи (связь dp-pp).
Каждая молекула моноксида углерода состоит из одного атома углерода, связанного с одним атомом кислорода через тройную связь, сопровождаемого неподеленной парой электронов на обоих атомах. В химии тройная связь между углеродом и кислородом в СО считается самой прочной связью с энергией связи 1072 кДж на моль. В нашем предыдущем примере мы обсуждали тройную связь, образованную между двумя одинаковыми атомами; однако в случае монооксида углерода две слабые π-связи слегка вырождены из-за присутствия более электроотрицательных атомов кислорода. Это вызывает поляризацию в молекуле и придает ей дипольный момент, которого нет у диазота. Полярный характер CO также способствует его более высокой реакционной способности, чем у азота, несмотря на то, что он имеет более высокую энергию диссоциации связи, чем последний. Кроме того, угарный газ является одним из самых распространенных загрязнителей воздуха в нашей атмосфере. Наиболее важные аспекты его химии возникают из-за его способности реагировать с переходными металлами с использованием особого типа химической связи (связь dp-pp).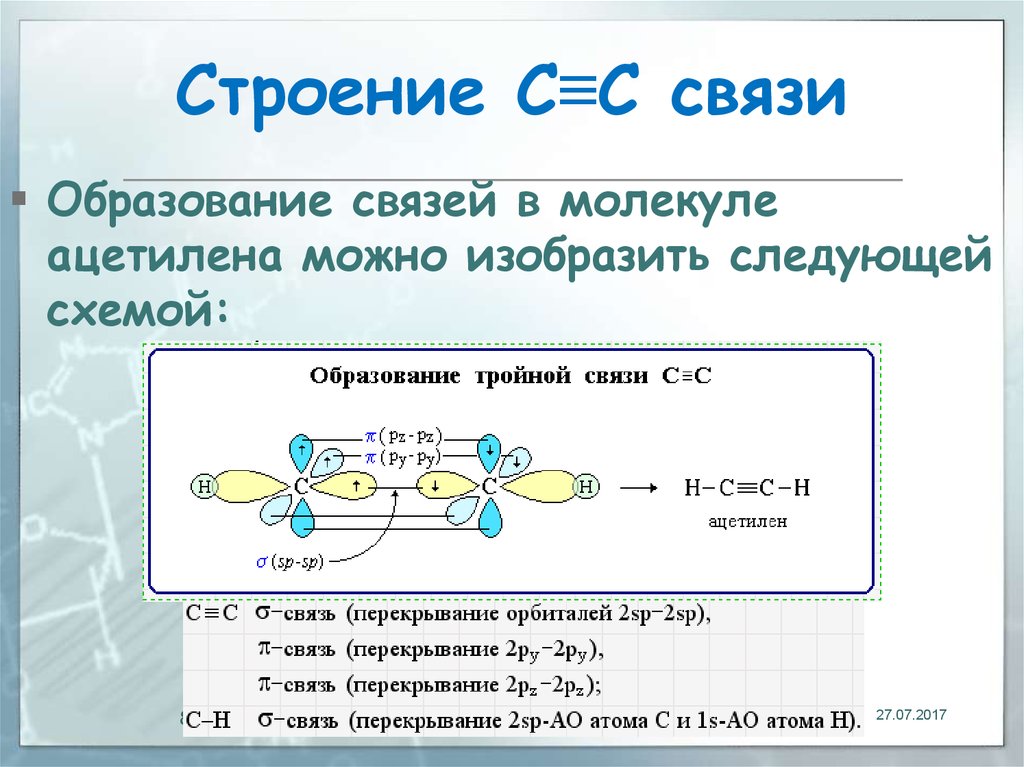 Угарный газ имеет большее сродство к содержанию железа в гемоглобине, чем кислород, из-за присутствия частично поляризованных π-связей. Это приводит к тому, что наша кровь легче связывается с угарным газом, чем с кислородом, что делает нашу дыхательную систему практически бесполезной во время заражения.
Угарный газ имеет большее сродство к содержанию железа в гемоглобине, чем кислород, из-за присутствия частично поляризованных π-связей. Это приводит к тому, что наша кровь легче связывается с угарным газом, чем с кислородом, что делает нашу дыхательную систему практически бесполезной во время заражения.
Ацетилен, также известный как этин, представляет собой простейший алкин, который содержит два атома углерода, связанные вместе тройной ковалентной связью. Это бесцветный газ, который широко используется в качестве топлива, в основном для промышленных целей сварки. С точки зрения теории валентных связей, тройная связь между атомами углерода образуется, когда электроны с sp-гибридизированных орбиталей распределяются между ними через сигма-ковалентную связь, в то время как две другие негибридизованные p-орбитали образуют слабые пи-связи. Эта структура приводит к длине связи между атомами углерода 120,3 пм, что в противном случае составляет 154 пм для атомов углерода с одинарной связью.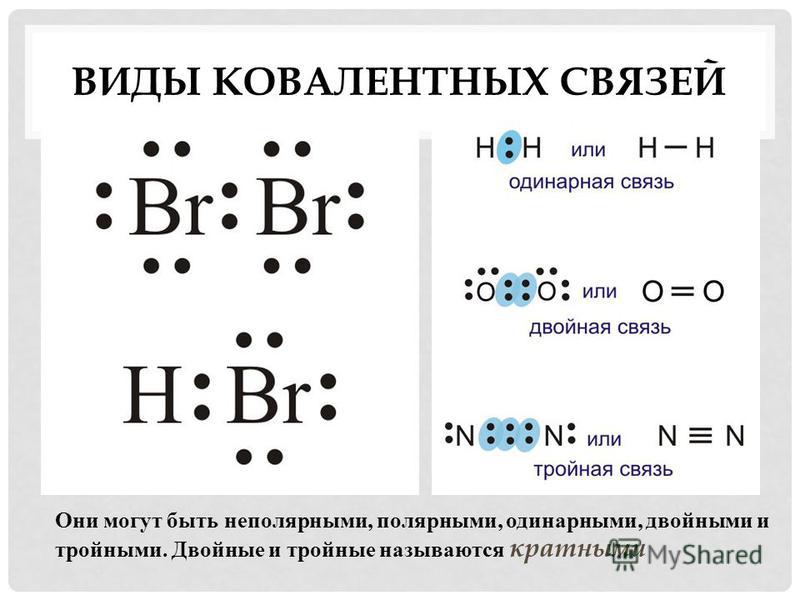 Тройная связь углерод-углерод помещает все четыре атома на одну прямую с углами связей С—СН, равными 180°. 9{-} группы, связанные вместе у атомов углерода одинарной ковалентной связью. Длина связи между углеродом и атомом азота составляет примерно 1,16 Å, тогда как между углерод-углеродными атомами она составляет 1,37 Å. Цианоген представляет собой бесцветный легковоспламеняющийся газ, который был впервые получен сэром Гей-Люссаком в 1815 году путем термического разложения цианида серебра. Из-за наличия тройных связей цианогены содержат почти такое же количество скрытой энергии, как и ацетилен, который может высвобождаться со взрывом, когда соединение подвергается воздействию окислителей, таких как фтор, монооксид углерода, озон, или когда смесь цианогена и воздуха подвергается воздействию искры. До недавнего времени цианоген представлял только химическое вещество, представляющее академический интерес. Несколько видов исследований пришли к выводу, что стехиометрическая смесь цианогена и кислорода может производить самое горячее пламя, что делает цианоген потенциальным конкурентом высокоэнергетического топлива.
Тройная связь углерод-углерод помещает все четыре атома на одну прямую с углами связей С—СН, равными 180°. 9{-} группы, связанные вместе у атомов углерода одинарной ковалентной связью. Длина связи между углеродом и атомом азота составляет примерно 1,16 Å, тогда как между углерод-углеродными атомами она составляет 1,37 Å. Цианоген представляет собой бесцветный легковоспламеняющийся газ, который был впервые получен сэром Гей-Люссаком в 1815 году путем термического разложения цианида серебра. Из-за наличия тройных связей цианогены содержат почти такое же количество скрытой энергии, как и ацетилен, который может высвобождаться со взрывом, когда соединение подвергается воздействию окислителей, таких как фтор, монооксид углерода, озон, или когда смесь цианогена и воздуха подвергается воздействию искры. До недавнего времени цианоген представлял только химическое вещество, представляющее академический интерес. Несколько видов исследований пришли к выводу, что стехиометрическая смесь цианогена и кислорода может производить самое горячее пламя, что делает цианоген потенциальным конкурентом высокоэнергетического топлива.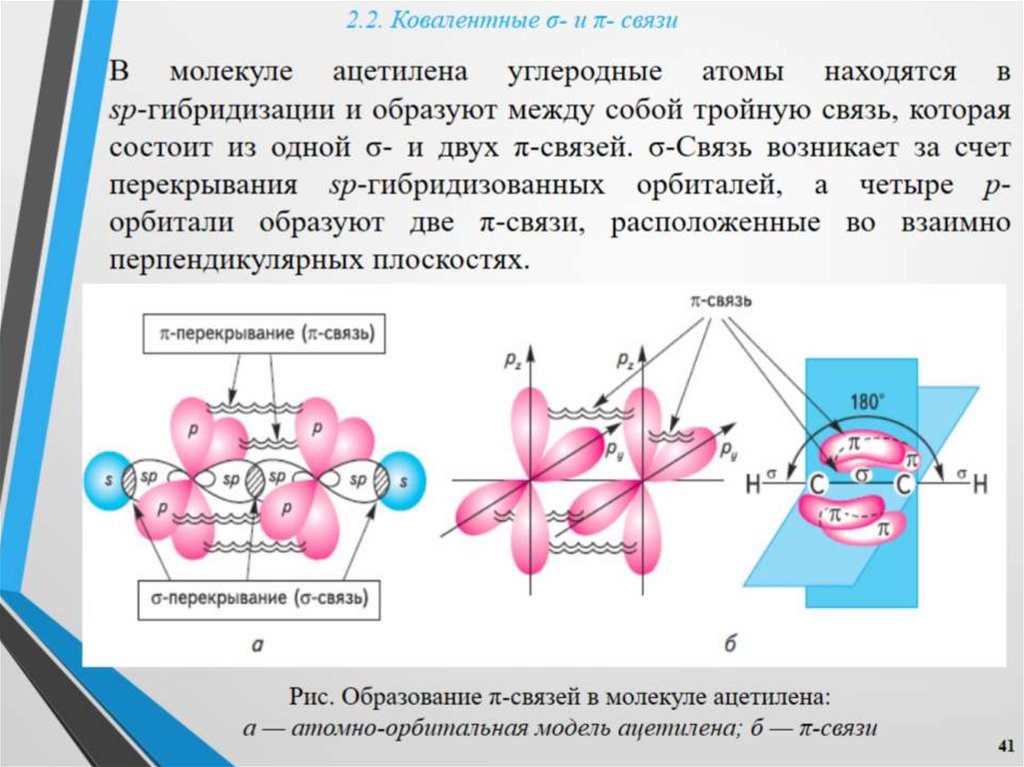
В органической химии алкины представляют собой ненасыщенные углеводородные соединения, содержащие как минимум одну тройную связь, связывающую два атома углерода. По номенклатурной системе ИЮПАК суффикс -ин используется для обозначения наличия тройной связи в углеводородной цепи. В высших алкинах (содержащих четыре или более атомов углерода), если в цепи присутствует более одной тройной связи, цепь нумеруется таким образом, чтобы все атомы углерода с тройной связью получали наименьшее количество позиций. Если тройная связь присутствует на любом конце цепи, алкины называются терминальными; в противном случае их называют внутренними алкинами. Простейшие ациклические алкины только с одной тройной связью и без других функциональных групп образуют гомологический ряд с общей химической формулой {C}_{n}{H}_{2n-2}. Говоря языком теории валентных связей, атомы углерода в алкиновой связи находятся в состоянии sp-гибридизации. В частности, каждая из них имеет две негибридные p-орбитали и две sp-гибридные орбитали. Перекрывание sp-орбитали от каждого атома образует одну sp-sp σ-связь. Каждая p-орбиталь одного атома перекрывается одной с другим атомом, образуя две π-связи, что в сумме дает три связи. Оставшаяся sp-орбиталь каждого атома может образовывать сигма-связь с другим атомом, например с атомами водорода в случае ацетилена. Почти все алкины не имеют запаха и цвета, за исключением этилена, который имеет слегка характерный запах. Наличие тройных связей в алкинах способствует их кислотности, высокой температуре кипения, прочности неполярных связей и структурной линейности. Первые три алкина — газы, следующие восемь — жидкости, а все алкины выше этих одиннадцати — твердые вещества.
Перекрывание sp-орбитали от каждого атома образует одну sp-sp σ-связь. Каждая p-орбиталь одного атома перекрывается одной с другим атомом, образуя две π-связи, что в сумме дает три связи. Оставшаяся sp-орбиталь каждого атома может образовывать сигма-связь с другим атомом, например с атомами водорода в случае ацетилена. Почти все алкины не имеют запаха и цвета, за исключением этилена, который имеет слегка характерный запах. Наличие тройных связей в алкинах способствует их кислотности, высокой температуре кипения, прочности неполярных связей и структурной линейности. Первые три алкина — газы, следующие восемь — жидкости, а все алкины выше этих одиннадцати — твердые вещества.
Не так давно углерод и азот были единственными двумя элементами в таблице Менделеева, которые могли образовывать между собой стабильное соединение с тройными связями. С 2012 года к этому благородству присоединился и бор, образуя стабильный диборин при комнатной температуре с присоединенными к нему двумя N-гетеролитическими карбеновыми звеньями.

Leave A Comment