Таблица менделеева — Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 — K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Строение атома алюминия — Ektpol
Алюминий (Al) — легкий металл, третий по распространенности химический элемент в земной коре. Структура атома алюминия позволяет легко обрабатывать металл: он поддается литью, формовке, механическим воздействиям.
Содержание
- 1 Строение
- 2 Свойства
Строение
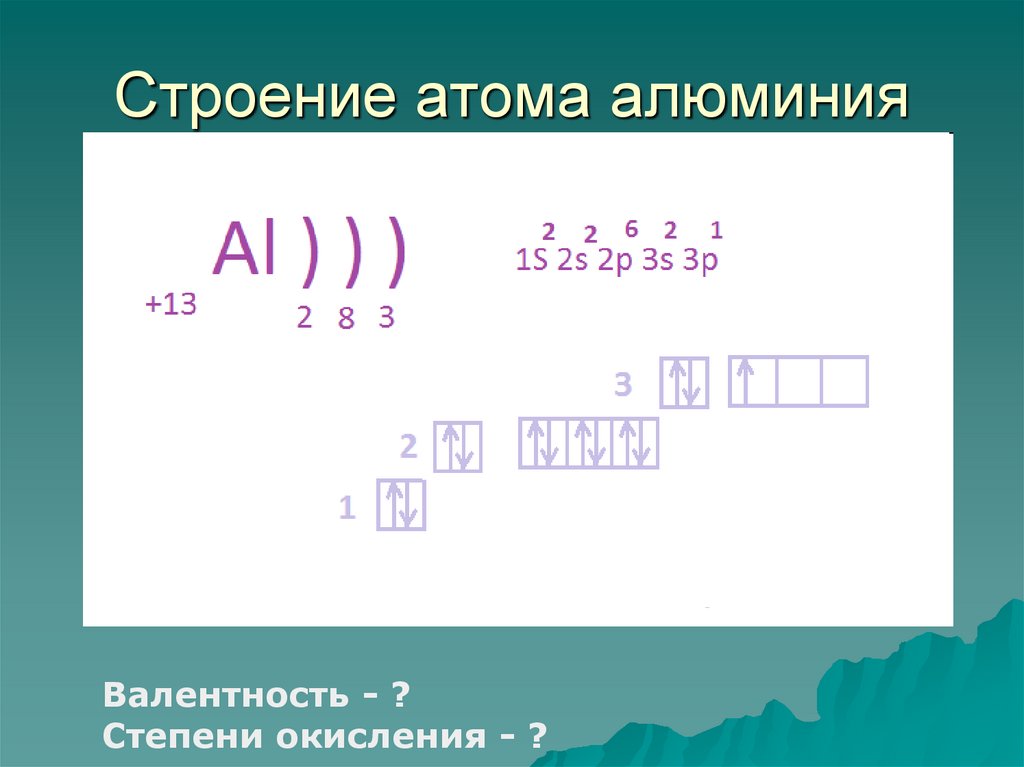
Электронное строение атома элемента алюминия связано с его положением в периодической таблице Менделеева. Алюминий имеет атомный номер 13 и находится в третьем периоде, в группе IIIa. Относительная атомная масса алюминия 27. Электронная конфигурация атома алюминия 1s22s22p63s23p1, характер распределения электронов +13Al)2)8)3.
Алюминий имеет атомный номер 13 и находится в третьем периоде, в группе IIIa. Относительная атомная масса алюминия 27. Электронная конфигурация атома алюминия 1s22s22p63s23p1, характер распределения электронов +13Al)2)8)3.
Рис. 1. Алюминий в периодической таблице.
Атом элемента состоит из положительно заряженного ядра +13 (13 протонов и 14 нейронов) и трех электронных оболочек с 13 электронами. На внешнем энергетическом уровне всего три электрона. В возбужденном состоянии атом может отдавать все три электрона, демонстрируя степень окисления +3, или образовывать три ковалентные связи. Следовательно, алюминий имеет третью валентность.
Рис. 2. Строение атома алюминия.
В природе алюминий встречается только в составе соединений – глины, слюды, корунда. Этот металл ценился больше, чем золото, до открытия промышленного способа его производства.
Свойства
Алюминий — серебристый металл с высокой электропроводностью и пластичностью. Элемент легко соединяется с кислородом при комнатной температуре, образуя на поверхности оксидную пленку, защищающую металл от коррозии.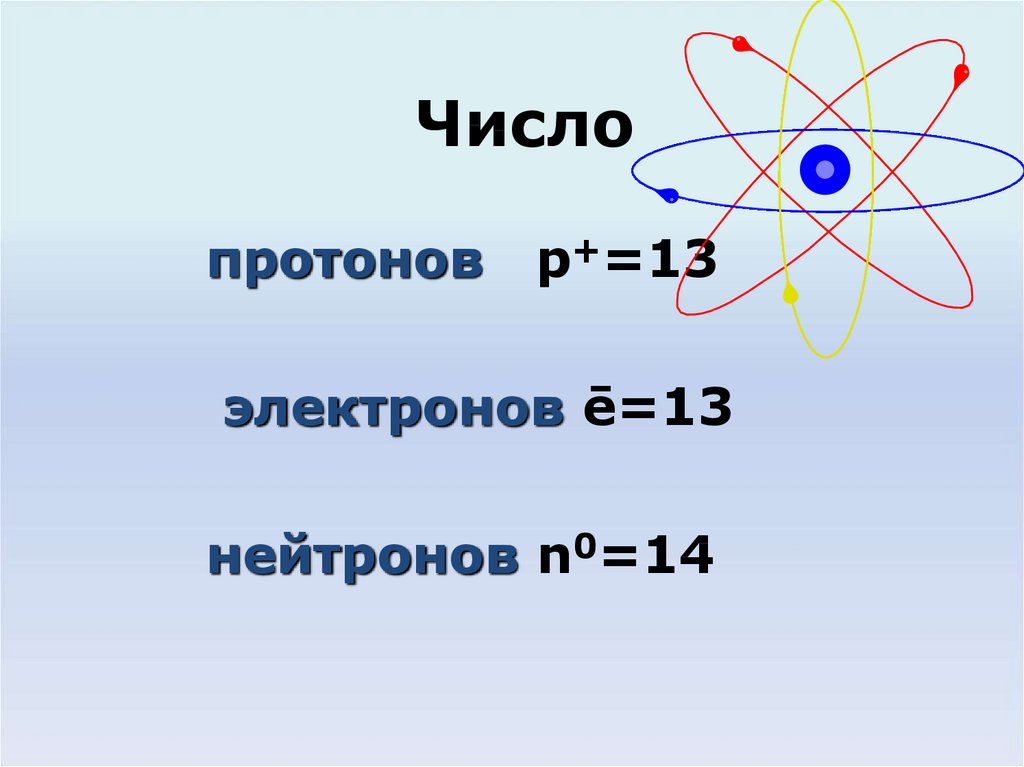 Образование пленки препятствует реакции с водой, концентрированными азотной и серной кислотами, что делает алюминиевые контейнеры пригодными для перевозки этих кислот.
Образование пленки препятствует реакции с водой, концентрированными азотной и серной кислотами, что делает алюминиевые контейнеры пригодными для перевозки этих кислот.
Рис. 3. Оксид алюминия.
Для удаления оксидной пленки применяют соли аммония, горячие щелочи и сплавы ртути. После разрушения оксидной пленки алюминий вступает в реакцию со многими соединениями и неметаллами. Основные химические свойства элемента описаны в таблице.
Взаимодействие | Ход реакции | Пример |
С водой | Только при отсутствии оксидной пленки образуется гидроксид алюминия | 2Al + 6h3O → 2Al(OH)3 + 3h3 |
С кислородом | Образуется оксид алюминия | 4Al + 3O2 → 2Al2O3 + Q |
С галогенами | При комнатной температуре. С йодом — в присутствии катализатора | 2Al + 3Cl2 → 2AlCl3 |
При температуре выше 200°С образуется сульфид алюминия | 2Al + 3S → Al2S3 | |
С фосфором | При температуре 500°С образуется фосфид алюминия | Al + P → AlP |
С азотом | При температуре 800°С образуется нитрид алюминия | 2Al + N2 → 2AlN |
С углеродом | При температуре 2000°С образуется карбид алюминия | 4Al + 3C → Al4C3 |
С кислотами | Реагирует с разбавленными кислотами при комнатной температуре и с концентрированными кислотами при нагревании образуются соли | – 2Al + 3h3SO4 → Al2(SO4)3 + 3h3; – 2Al + 6HCl → 2AlCl3 + 3h3; – Al + 6HNO3(конц. |
Со щелочами | Реакционные растворы и сплавы | – 2Al + 2NaOH + 10h3O → 2Na[Al(h3O)2(OH)4] + 3h3; – 2Al + 6KOH → 2KAlO2 + 2K2O + 3h3 |
С оксидами | Вытесняет металлы | 2Al + Cr2O3 = 2Cr + Al2O3 |
Алюминий не взаимодействует с водородом.
Химия алюминия (Z=13) — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 549
Алюминий (также называемый алюминием) является третьим наиболее распространенным элементом в земной коре. Он обычно используется в домашнем хозяйстве в качестве алюминиевой фольги, в таких ремеслах, как крашение и гончарное дело, а также в строительстве для изготовления сплавов.
Факты
- Символ: Al
- Атомный номер: 13
- Атомный вес: 26,98154 а.е.м.
- Цвет: серебристый
- Температура плавления: 933,4 К
- Температура кипения: 2792 К
- Плотность: 2,70 г/см 3
- Количество степеней окисления: 3
- Отличный восстановитель
- Имеет 13 электронов, 13 протонов и 14 нейтронов
- Металл
- Хороший проводник
- Устойчив к коррозии
- Немагнитный
- Стабильный ион
- Формы димеров
- Номер группы: 13
История алюминия
Алюминий занимает третье место в списке десяти самых распространенных элементов в земной коре, а его оксид — четвертое место среди десяти самых распространенных соединений в земной коре.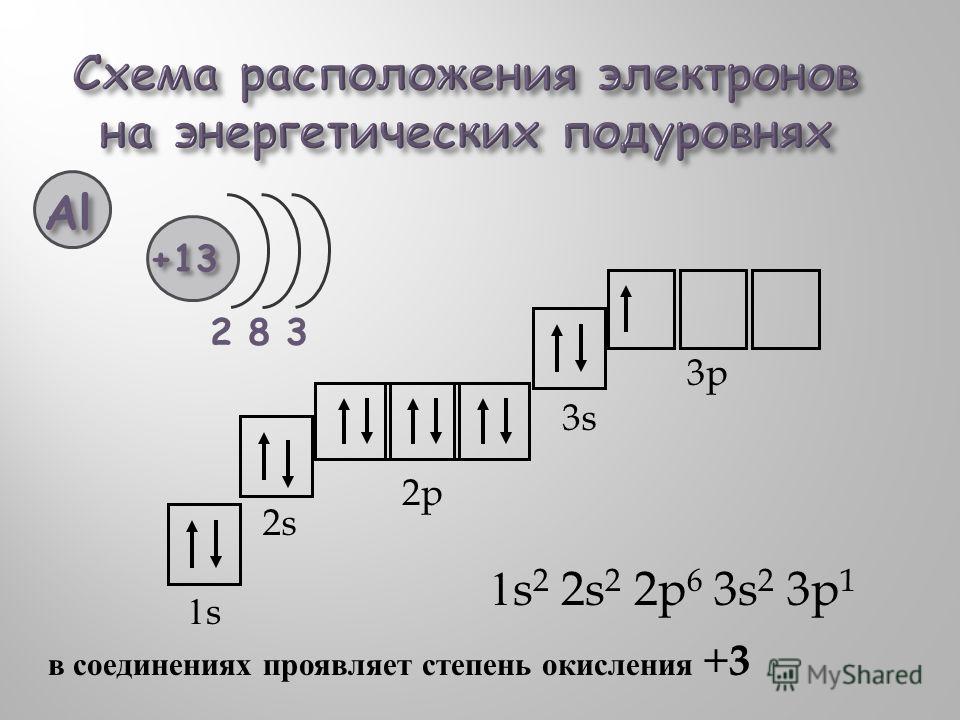 Это самый распространенный металл на планете. Его название взято от латинского alumen для квасцов. Мягкий, легкий и серебристый, его существование было предложено Лавуазье в 1787 году, названо Дэви в 1807 году и окончательно выделено Эрстедом в 1825 году. установите краску на ткань. В то время он был известен как очень дорогой металл. В конце 1800-х годов два ученых, Чарльз Мартин Холл и Пол Л. Т. Эрулт, обнаружили, что они могут производить алюминий из оксида алюминия посредством электролиза и криолита (расплавленного минерального растворителя). Это позволило снизить цену и сделать алюминий доступным для коммерческого использования.
Это самый распространенный металл на планете. Его название взято от латинского alumen для квасцов. Мягкий, легкий и серебристый, его существование было предложено Лавуазье в 1787 году, названо Дэви в 1807 году и окончательно выделено Эрстедом в 1825 году. установите краску на ткань. В то время он был известен как очень дорогой металл. В конце 1800-х годов два ученых, Чарльз Мартин Холл и Пол Л. Т. Эрулт, обнаружили, что они могут производить алюминий из оксида алюминия посредством электролиза и криолита (расплавленного минерального растворителя). Это позволило снизить цену и сделать алюминий доступным для коммерческого использования.
Алюминий на Земле
Алюминий — третий по распространенности элемент на Земле и самый распространенный металл. Он составляет 8,1% земной коры по массе, после кислорода и кремния. Естественно, он встречается в химических соединениях с другими элементами, такими как бокситы. Его нелегко удалить из природных руд, поскольку его необходимо сначала восстановить. Чтобы увидеть, как глинозем, который используется для производства алюминия, извлекается из бокситов, прочитайте процесс Байера в разделе «Очистка алюминия».
Чтобы увидеть, как глинозем, который используется для производства алюминия, извлекается из бокситов, прочитайте процесс Байера в разделе «Очистка алюминия».
Электронная конфигурация алюминия
Чтобы найти электронную конфигурацию атома, вам сначала нужно узнать количество электронов, которые он имеет. Поскольку атомный номер алюминия равен тринадцати, у него тринадцать электронов. Затем вы разделяете электроны между разными орбиталями. Первые два электрона алюминия попадают на 1s-орбиталь, а следующие два электрона идут на 2s-орбиталь. Следующие шесть электронов заполняют 2p-орбиталь во второй оболочке (это пока десять электронов, осталось еще три). Затем электроны 11 и 12 заполняют 3s-орбиталь. Наконец, последний электрон занимает 3р-орбиталь.
Электронная конфигурация алюминия: 1s 2 2s 2 2p 6 3s 2 3p 1 . Электронная конфигурация основного состояния: [Ne]3s 2 3p 1 .
Степени окисления
Алюминий имеет три степени окисления.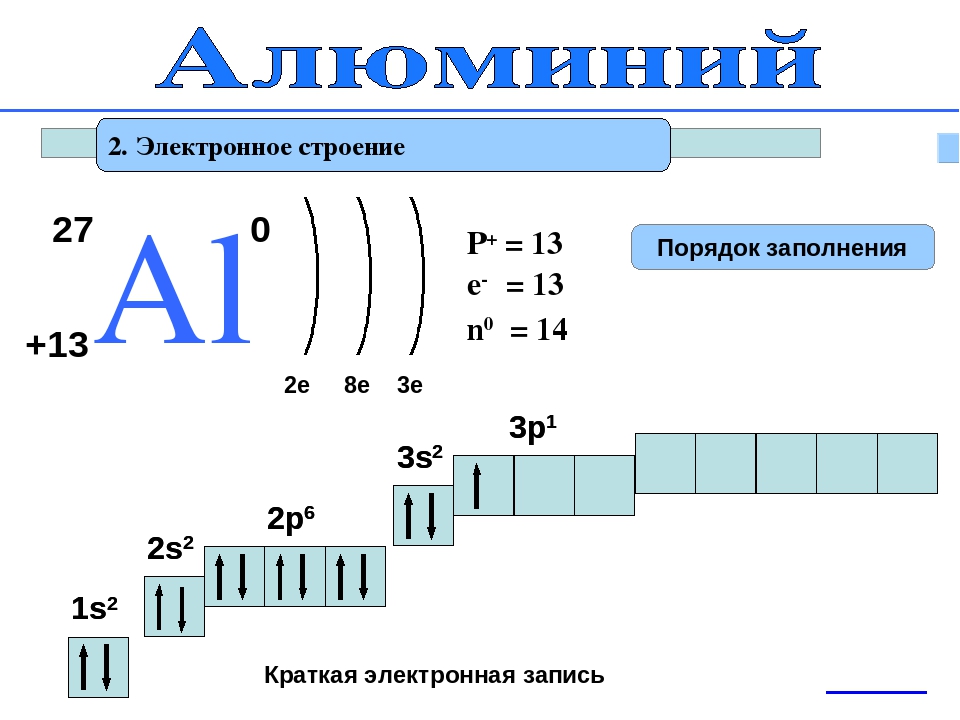 Чаще всего это +3. Два других +1 и +2. Одна степень окисления +3 для алюминия может быть найдена в составном оксиде алюминия, Al 2 O 3 . В AlO, монооксиде алюминия, он имеет степень окисления +2, а AlH имеет степень окисления +1.
Чаще всего это +3. Два других +1 и +2. Одна степень окисления +3 для алюминия может быть найдена в составном оксиде алюминия, Al 2 O 3 . В AlO, монооксиде алюминия, он имеет степень окисления +2, а AlH имеет степень окисления +1.
Соединения алюминия
Хотя алюминий не кажется особенно реактивным, он считается активным металлом. Его поведение обманчиво, потому что он быстро реагирует с кислородом воздуха с образованием оксида алюминия (\(Al_2O_3\)), или оксида алюминия, который прочно связан с металлом и существует в виде плотного покрытия (в отличие от оксидов железа). Это покрытие защищает его от дальнейшей реакции. Однако очевидно, что это покрытие не является полностью надежным, поскольку алюминий не существует в самородном виде.
Глинозем — это тугоплавкий оксид алюминия, который содержится в бокситах и корундах (сапфирах и рубинах). Он имеет очень высокую температуру плавления. Одним из применений этого соединения является получение света разного цвета, который можно использовать в качестве лазерного луча.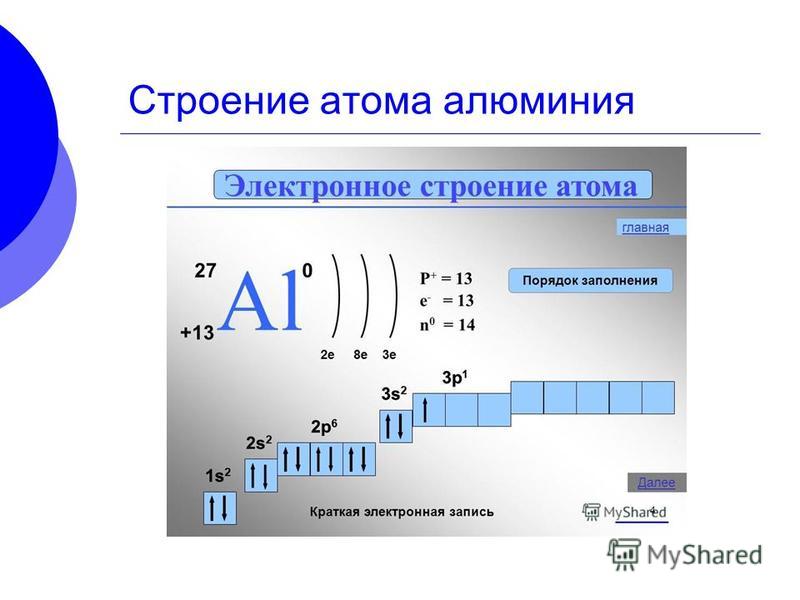 Он также используется в гончарном деле, крашении, антацидных лекарствах и в производстве химикатов.
Он также используется в гончарном деле, крашении, антацидных лекарствах и в производстве химикатов.
Другим соединением, содержащим алюминий, является Al(OH) 3 , которое обычно образуется в виде желеобразного осадка при гидролизе соединений алюминия в воде. 9{3+} +3H_{2(г)}\]
При сварке крупногабаритных изделий используется термитная реакция:
\[2Al_{(тв)} + Fe_2O_{3(тв)} \rightarrow Al_2O_ {3(s)} + Fe_{(s)}\]
Реакции с галогенами
Галогениды алюминия, как и галогениды бора, являются реактивными кислотами Льюиса, что означает, что они легко принимают пару электронов. Например, важным галогенидным комплексом для производства алюминия является криолит NaAlF 6.
\[6 HF +Al(OH)_3 + 3NaOH \rightarrow Na_3AlF_6 +6 H_2O\]
Оксид и гидроксид алюминия
Оксид алюминия часто называют оксидом алюминия, а при кристаллизации – корундом. Оксид алюминия относительно неактивен, потому что небольшие ионы Al 3 + и O 2+ образуют очень стабильную ионную решетку в кубической закрытой структуре с ионами, занимающими небольшие октаэдрические отверстия. Алюминий защищен от коррозии благодаря тонкому покрытию Al 2 O 3 , которое предотвращает дальнейшее окисление металлического алюминия. 9-_{ (aq)}\]
Алюминий защищен от коррозии благодаря тонкому покрытию Al 2 O 3 , которое предотвращает дальнейшее окисление металлического алюминия. 9-_{ (aq)}\]
Рафинирование алюминия
Сегодня большая часть алюминия производится методом Холла, в котором используется значительное количество энергии в виде электричества для электролиза металлического алюминия из смеси расплавленных солей. Большие первоначальные затраты энергии являются одной из важных причин, по которой переработка алюминия является такой хорошей и рентабельной идеей.
Поскольку алюминий встречается в соединениях с другими элементами, его содержание необходимо сокращать. Процесс Байера был изобретен Карлом Байером в 1887 году. По сути, он относится к переработке бокситов, самой важной алюминиевой руды, для получения глинозем . Отсюда промежуточный оксид алюминия должен быть переплавлен в металлический алюминий с помощью процесса Холла-Эру.
Ссылки
- Гарнизон Спозито.
 Экологическая химия алюминия. стр 57-72. 1 декабря 2008 г.
Экологическая химия алюминия. стр 57-72. 1 декабря 2008 г. - Химия окружающей среды и токсикология химии. 2 декабря 2008 г.
- Петруччи, Общая химия, принципы и современные приложения, издательства Macmillan Publishing Company, девятое издание, стр. 891-893.
- «Алюминий».
- «Глинозем». Колумбийская энциклопедия . 6-е изд. Нью-Йорк: Columbia UP, 2009. .
Задачи
- Напишите конфигурацию алюминия, предполагая, что он потерял свои валентные электроны.
- Что происходит с алюминием при взаимодействии с хлором?
- Сбалансируйте эти уравнения: a) 2Al(s) → Al 3 + (водн.) + e —
b) Al(s) + Pb + (водн.)→ Al 3 + (водн.)+ Pb(s) - Какова электронная конфигурация алюминия?
- Каким способом из бокситов извлекают глинозем?
- Завершите и сбалансируйте следующие реакции.

- Al(OH) 3 (т) + OH — (водн.) →
- Al(OH) 3 (т) + H + (водн.) →
Растворы
1. 1s 2 2s 2 2p 6 , или [Ne]
2. Образует димер.
3. a) 2Al(s) → Al 3 + (водн.) + 3 e —
b) 2 Al(s) + 90b 4 90b + 3 042 (водный ) → 2 Al 3 + (водн.) + 3 Pb(s)
4. 1s 2 2s 2 2s 2 2p 6 2 3 п 1
5. Процесс Байера
6.1 Al(OH) 3 (т) +OH — (водн.) → [Al(OH) 4 ] — (водн.)
6,2 Al(OH) 3( с) + 3 H + (водн.) → Al(H 2 O) 3 ] 3+ (водн.)
Авторы и ссылки 9a D’Angel
- 66 о, Ханна Башни, Даниэль Аренс
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- Алюминий
- Алюминий
- Алюминиевые соединения
- оксид алюминия
- амфотерный
- Галогены
- гидроксид
- степени окисления
Стивен Р.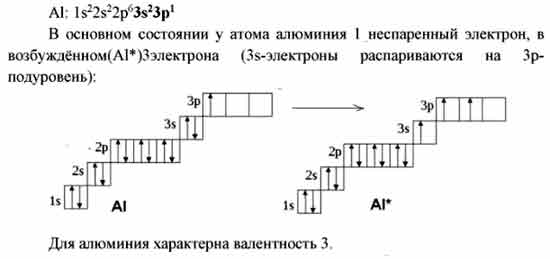 Марсден
Марсден
Chemistry of Aluminium (Z=13) распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
Видео-вопрос: чтение числа электронов, протонов и нейтронов по атомному номеру и массовому числу
Атом алюминия имеет атомный номер 13 и массовое число 27. а) Сколько протонов содержится в атоме алюминия? б) Сколько нейтронов содержится в атоме алюминия? в) Сколько электронов в атоме алюминия?
а) Сколько протонов содержится в атоме алюминия? б) Сколько нейтронов содержится в атоме алюминия? в) Сколько электронов в атоме алюминия?
Стенограмма видео
Атом алюминия имеет атомный номер 13 и массовое число 27. Сколько протонов в атоме алюминия?
Алюминий является элементом. Атом алюминия состоит из положительно заряженного ядра, окруженного отрицательно заряженным электронным облаком. Внутри ядра находятся положительно заряженные протоны и нейтральные нейтроны. Наш первый вопрос: сколько протонов в атоме алюминия? Как я только что сказал, эти протоны находятся в ядре. Этот вопрос дал нам два свойства атома алюминия, которые могут помочь: атомный номер и массовое число.
Атомный номер атома — это число протонов в ядре этого атома. Для этого атома алюминия и вообще для всех атомов алюминия атомный номер равен 13. Следовательно, количество протонов в атоме алюминия равно 13. Я просто сохраню это значение, потому что оно пригодится позже.
Сколько нейтронов в атоме алюминия?
Как и протоны, нейтроны можно найти в ядре атома алюминия. Чтобы ответить на эту часть вопроса, нам понадобится массовое число. Массовое число – это количество протонов и нейтронов в ядре атома. Для этого конкретного атома алюминия массовое число равно 27. Следовательно, в этом конкретном атоме алюминия количество протонов и нейтронов равно 27. Таким образом, мы можем рассчитать количество нейтронов, отняв количество протонов от числа протоны и нейтроны. Следовательно, количество нейтронов равно 27 протонов и нейтронов минус 13 протонов, что мы можем упростить до 27 минус 13, что дает нам 14 нейтронов. Это то же самое число, которое мы получили бы, если бы убрали атомный номер из массового числа. Итак, этот конкретный атом алюминия имеет 14 нейтронов.
Теперь последняя часть этого вопроса.
Сколько электронов в атоме алюминия?
Электроны атома алюминия находятся в пространстве вокруг его ядра. Чтобы ответить на этот вопрос, нам нужны три бита информации.

 ) → Al(NO3)3 + 3NO2 + 3h3O
) → Al(NO3)3 + 3NO2 + 3h3O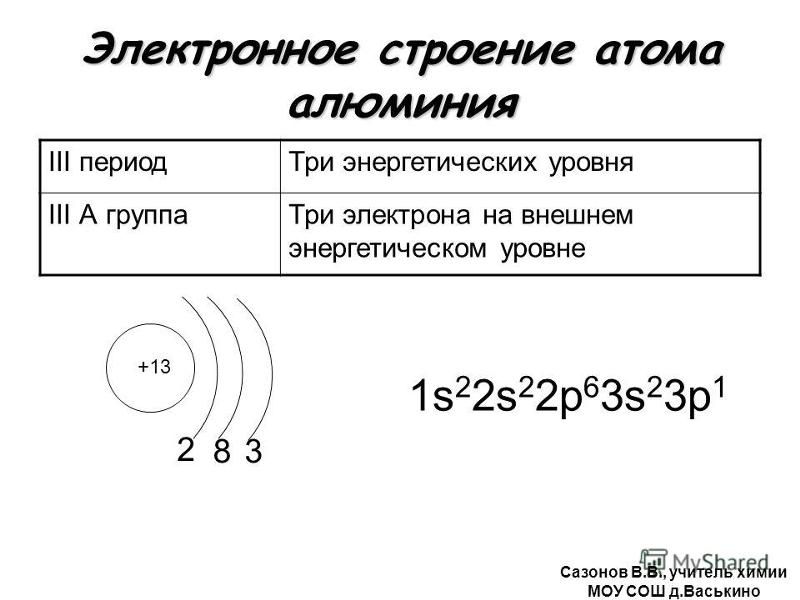 Экологическая химия алюминия. стр 57-72. 1 декабря 2008 г.
Экологическая химия алюминия. стр 57-72. 1 декабря 2008 г.
Leave A Comment