Соли — классификация, получение и свойства » HimEge.ru
 Общая формула соли МnAcm, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла.
Общая формула соли МnAcm, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла.
Средними солями называют продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Например, H3PO4 – Na3PO4;
Cu(OH)2 – CuSO4.
Кислыми солями называют продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла.
Например, H2SO4 – NaHSO4,
H3PO4 – Na2HPO4 – NaH2PO4.
Основными солями называют продукты неполного замещения гидроксогрупп в многокислотных основаниях кислотными остатками.
Fe(OH)3 – Fe(OH)2Cl – FeOHCl2.
Кислые соли вступают в реакции с щелочами с образованием средних солей.
KHCO3 + KOH = K2CO3 + H2O
Некоторые кислые соли, например, угольной кислоты разлагаются под действием более сильных кислот:
KHCO3 + HCl = KCl + CO2 + H2O
Основные соли вступают в реакции с кислотами:
Свойства комплексных солей (способы разрушения комплексных солей)
1) Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами. При действии избытка сильной кислоты получается две средних соли и вода. При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода, например:
K3[Al(OH)6] + 3HCl = 3KCl + Al(OH)3↓ + 3H2O
K3[Al(OH)6] + 6HClизб = 3KCl + AlCl3 + 6H2O
K2[Zn(OH)4] + 2HBr = 2KBr + Zn(OH)2↓ + 2H2O
K3[Cr(OH)6] + 6HNO3 изб. = 3KNO3 + Cr(NO3)3 + 6H2O
2) При нагревании комплексные соли теряют воду:
K[Al(OH)4] = KAlO2 + 2H2O
K3[Cr(OH)6] = KCrO2 + 2H2O + 2KOH
3) При действии углекислого газа, сернистого газа или сероводорода получается соль активного металла и амфотерный гидроксид:
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3↓
K3
Na[Al(OH)4] + H2S = NaHS + Al(OH)3↓+ H2O
4) При действии солей, образованных катионами Fe3+, Al3+ и Cr3+ происходит взаимное усиление гидролиза, получается два амфотерных гидроксида и соль активного металла:
3Na[Al(OH)4] + FeCl3 = 3Al(OH)3↓ + Fe(OH)3↓ + 3NaCl
K3[Cr(OH)6] + Al(NO3)3 = Al(OH)3↓ + Cr(OH)3↓+ 3KNO3
Соли: классификация и химические свойства
Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
 Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO3, KAl(SO4)2 и т.д.
4. Соли основные
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl3)2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
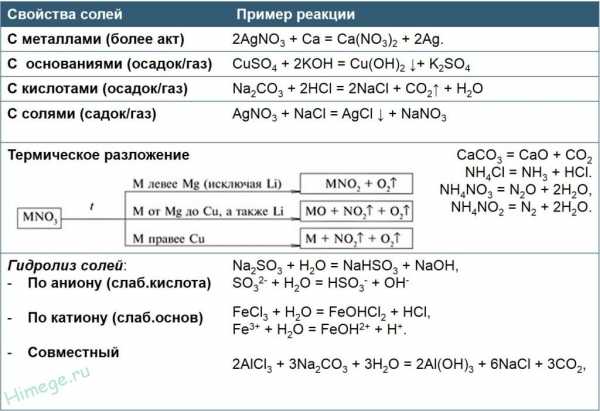
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
Остались вопросы? Хотите знать больше о солях?
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Химические свойства солей: средних, кислых, основных, комплексных.
Химические свойства средних солей
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
- • в предполагаемых продуктах должен быть обнаружен осадок или газ;
- • исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- • исходные соли растворимы;
- • в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония:
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
scienceforyou.ru
При прокаливании соли образовался карбонат металла углекислый газ и вода этой солью является что? По химии
Ответ есть во тут <a href=»/» rel=»nofollow» title=»53091789:##:photo_42223.html?0=41460″ target=»_blank» >[ссылка заблокирована по решению администрации проекта]</a>
Ответ еть вот тут <a href=»/» rel=»nofollow» title=»53091789:##:photo_42223.html?0=225439″ target=»_blank» >[ссылка заблокирована по решению администрации проекта]</a>
Ответ еть вот тут <a href=»/» rel=»nofollow» title=»53091789:##:photo_42223.html?0=33669″ target=»_blank» >[ссылка заблокирована по решению администрации проекта]</a>
Ответ есь вот тут <a href=»/» rel=»nofollow» title=»53091789:##:photo_42223.html?0=357497″ target=»_blank» >[ссылка заблокирована по решению администрации проекта]</a>
Отвт есть вот тут <a href=»/» rel=»nofollow» title=»53091789:##:photo_42223.html?0=99412″ target=»_blank» >[ссылка заблокирована по решению администрации проекта]</a>
Отет есть вот тут <a href=»/» rel=»nofollow» title=»53091789:##:photo_42223.html?0=403377″ target=»_blank» >[ссылка заблокирована по решению администрации проекта]</a>
Ответ есть вт тут <a href=»/» rel=»nofollow» title=»53091789:##:photo_42223.html?0=399122″ target=»_blank» >[ссылка заблокирована по решению администрации проекта]</a>
Овет есть вот тут <a href=»/» rel=»nofollow» title=»53091789:##:photo_42223.html?0=363309″ target=»_blank» >[ссылка заблокирована по решению администрации проекта]</a>
Это может быть гидрокарбонат какого-либо металла, например: Mg(HCO3)2(t) = MgCO3 + CO2 + h3O такой процесс каждый день происходит в чайнике, когда вы кипятите воду, от этого и образуется накипь
touch.otvet.mail.ru
Способы получения кислых, основных и комплексных солей — урок. Химия, 8–9 класс.
Способы получения кислых солей
1. Кислые соли образуются при взаимодействии средних солей с кислотами.
Например, если к раствору сульфата натрия добавить раствор серной кислоты, из полученного раствора можно выкристаллизовать гидросульфат натрия:
Na2SO4+h3SO4→2NaHSO4.
Нерастворимые в воде природные карбонаты (известняк и другие) в присутствии воды и углекислого газа (угольной кислоты) превращаются в растворимые гидрокарбонаты.
Например, карбонат кальция превращается в гидрокарбонат:
CaCO3+h3O+CO2⏟h3CO3→CaHCO32.
В результате этой химической реакции возрастает жёсткость природной воды, обусловленная присутствием растворимых солей кальция и магния, образуются карстовые пещеры, а также происходит разрушение коралловых рифов.
Видеофрагмент:
Взаимопревращение карбонатов и гидрокарбонатов |
2. Кислые соли образуются при неполной нейтрализации многоосновных кислот.
Например, при взаимодействии гидроксида натрия с серной кислотой в соотношении количества вещества \(1 : 1\) образуется гидросульфат натрия:
NaOH+h3SO4→NaHSO4+h3O.
Если гидроксид кальция взаимодействует с фосфорной (ортофосфорной) кислотой в
соотношении количества вещества \(1 : 2\), образуется дигидрофосфат кальция:
CaOh3+2h4PO4→Cah3PO42+2h3O.
3. Кислые соли образуются при действии избытка кислотного оксида на основание.
Например, если гидроксид натрия реагирует с оксидом углерода(\(IV\)) в соотношении количества вещества \(1 : 1\), образуется гидрокарбонат натрия:
NaOH+CO2→NaHCO3.
Способы получения основных солей
1. Основные соли образуются при взаимодействии щелочей с растворимыми в воде солями.Например, если смешать растворы хлорида кальция и гидроксида кальция, из полученного раствора можно выкристаллизовать гидроксохлорид кальция:
CaOh3+CaCl2→2CaOHCl.
2. Основные соли образуются при взаимодействии избытка основания с кислотой.
CaOh3+HCl→CaOHCl+h3O.
3. Гидроксокарбонат меди(\(II\)), свинца(\(II\)), цинка и некоторых других металлов образуется при взаимодействии растворов солей этих металлов с растворами карбонатов.
Например, при взаимодействии раствора сульфата меди(\(II\)) (медного купороса) с раствором карбоната натрия (соды) образуется осадок гидроксокарбоната меди:
2CuSO4+2Na2CO3+h3O→CuOh3CO3↓+CO2↑+2Na2SO4.
Видеофрагмент:
Получение основного карбоната меди |
Получение комплексных солей
1. Комплексные соли образуются при действии растворов щелочей на амфотерные гидроксиды.Например, при действии раствора гидроксида калия на гидроксид цинка образуется тетрагидроксоцинкат калия:
2KOH+ZnOh3→K2ZnOh5.
При действии разбавленного раствора гидроксида натрия на гидроксид алюминия образуется тетрагидроксоалюминат натрия:
NaOH+AlOh4→NaAlOh5.
2. Ещё один способ получения комплексных солей — действие растворов щелочей на амфотерные оксиды.
Например, при действии раствора гидроксида натрия на оксид цинка образуется тетрагидроксоцинкат натрия:
2NaOH+ZnO+h3O→Na2ZnOh5.
Комплексные соли образуются также при растворении в щёлочи цинка или алюминия.
Одним из продуктов реакции в этом случае является водород:
2NaOH+Zn+2h3O→Na2ZnOh5+h3↑,
2NaOH+2Al+6h3O→2NaAlOh5+3h3↑.
www.yaklass.ru
Химические свойства солей — урок. Химия, 8–9 класс.
1. Соли являются электролитами.
В водных растворах соли диссоциируют на положительно заряженные ионы (катионы) металлов и отрицательно заряженные ионы (анионы) кислотных остатков.
Например, при растворении кристаллов хлорида натрия в воде положительно заряженные ионы натрия и отрицательно заряженные ионы хлора, из которых образована кристаллическая решётка этого вещества, переходят в раствор:
NaCl→Na++Cl−.При электролитической диссоциации сульфата алюминия образуются положительно заряженные ионы алюминия и отрицательно заряженные сульфат-ионы:
Al2SO43→2Al3++3SO42−.2. Соли могут взаимодействовать с металлами.
В ходе реакции замещения, протекающей в водном растворе, химически более активный металл вытесняет менее активный.
Например, если кусочек железа поместить в раствор сульфата меди, он покрывается красно-бурым осадком меди. Раствор постепенно меняет цвет с синего на бледно-зелёный, поскольку образуется соль железа(\(II\)):
Fe+CuSO4→FeSO4+Cu↓.
Видеофрагмент:
взаимодействие сульфата меди(\(II\)) с железом |
При взаимодействии хлорида меди(\(II\)) с алюминием образуются хлорид алюминия и медь:
2Al+3CuCl2→2AlCl3+3Cu↓.
3. Соли могут взаимодействовать с кислотами.
Протекает реакция обмена, в ходе которой химически более активная кислота вытесняет менее активную.
Например, при взаимодействии раствора хлорида бария с серной кислотой образуется осадок сульфата бария, а в растворе остаётся соляная кислота:
BaCl2+h3SO4→BaSO4↓+2HCl.
При взаимодействии карбоната кальция с соляной кислотой образуются хлорид кальция и угольная кислота, которая тут же разлагается на углекислый газ и воду:
CaCO3+2HCl→CaCl2+h3O+CO2↑⏟h3CO3.
Видеофрагмент:
Взаимодействие кислот с солями |
4. Растворимые в воде соли могут взаимодействовать со щелочами.
Реакция обмена возможна в том случае, если в результате хотя бы один из продуктов является практически нерастворимым (выпадает в осадок).
Например, при взаимодействии нитрата никеля(\(II\)) с гидроксидом натрия образуются нитрат натрия и практически нерастворимый гидроксид никеля(\(II\)):
NiNO32+2NaOH→NiOh3↓+2NaNO3.
Видеофрагмент:
Взаимодействие нитрата никеля(\(II\)) с гидроксидом натрия |
При взаимодействии карбоната натрия (соды) с гидроксидом кальция (гашёной известью) образуются гидроксид натрия и практически нерастворимый карбонат кальция:
Na2CO3+CaOh3→2NaOH+CaCO3↓.
5. Растворимые в воде соли могут вступать в реакцию обмена с другими растворимыми в воде солями, если в результате образуется хотя бы одно практически нерастворимое вещество.
Например, при взаимодействии сульфида натрия с нитратом серебра образуются нитрат натрия и практически нерастворимый сульфид серебра:
Na2S+2AgNO3→NaNO3+Ag2S↓.
Видеофрагмент:
Взаимодействие сульфида натрия с нитратом серебра |
При взаимодействии нитрата бария с сульфатом калия образуются нитрат калия и практически нерастворимый сульфат бария:
BaNO32+K2SO4→2KNO3+BaSO4↓.
6. Некоторые соли при нагревании разлагаются.
Причём химические реакции, которые протекают при этом, можно условно разделить на две группы:
- реакции, в ходе которых элементы не изменяют степень окисления,
- окислительно-восстановительные реакции.
A. Реакции разложения солей, протекающие без изменения степени окисления элементов.
В качестве примеров таких химических реакций рассмотрим, как протекает разложение карбонатов.
При сильном нагревании карбонат кальция (мел, известняк, мрамор) разлагается, образуя оксид кальция (жжёную известь) и углекислый газ:
CaCO3⇄t°CaO+CO2↑.
Видеофрагмент:
| Разложение мела при нагревании |
Гидрокарбонат натрия (пищевая сода) при небольшом нагревании разлагается на карбонат натрия (соду), воду и углекислый газ:
2NaHCO3⇄t°Na2CO3+h3O+CO2↑.
Видеофрагмент:
| Разложение гидрокарбоната натрия |
Кристаллогидраты солей при нагревании теряют воду. Например, пентагидрат сульфата меди(\(II\)) (медный купорос), постепенно теряя воду, превращается в безводный сульфат меди(\(II\)):
CuSO4⋅5h3O→t°CuSO4+5h3O.
При обычных условиях образовавшийся безводный сульфат меди можно превратить в кристаллогидрат:
CuSO4+5h3O→CuSO4⋅5h3O
Видеофрагмент:
| Разрушение и образование медного купороса |
Аналогичная химическая реакция протекает, когда к гемигидрату сульфата кальция (жжёному гипсу) при помешивании добавляют воду. Получившаяся кашица быстро застывает в результате образования дигидрата сульфата кальция (гипса):
CaSO4⋅0,5h3O+1,5h3O→CaSO4⋅2h3O
Видеофрагмент:
| Застывание гипса |
Б. Окислительно-восстановительные реакции разложения солей.
Окислительно-восстановительные процессы протекают при разложении нитратов.
Например, при термическом разложении нитрата калия образуются нитрит этого металла и кислород:
2KN+5O−23⟶t°2KN+3O2+O2↑0
Видеофрагмент:
Разложение нитрата калия |
Разложение перманганата калия в лабораторных условиях можно использовать для получения кислорода. При разложении этой соли, кроме кислорода, образуются манганат калия и оксид марганца(\(IV\)):
2KMn+7O−24⟶t°K2Mn+6O4+Mn+4O2+O2↑0
www.yaklass.ru
Прокаливание
Прокаливанием называют операцию нагревания твердых веществ до высокой температуры (выше 400° С) с целью: а) освобождения от летучих примесей; б) достижения постоянной массы; в) проведения реакций, протекающих при высоких температурах; г) озоления после предварительного сжигания -органических веществ. Нагревание до высокой температуры проводят в печах (муфельных или тигельных). Очень часто в лабораториях приходится прокаливать такие вещества, как СаСl2*бН2О, Na2SO4*10h3О и др., с целью обезвоживания. Прокаливание обычно ведут на газовых плитках, вещество помещают на стальные сковороды. Если нельзя допускать загрязнения препарата железом, то прокаливать нужно в шамотных тарелках или сковородах. Никогда не нужно помещать на сковороду большое количество соли, так как при обезвоживании соль разлетается, что вызывает значительные ее потери.
Если приходится что-либо прокаливать в фарфоровом или шамотном тигле, то тигель нагревают постепенно: вначале на небольшом пламени, потом пламя понемногу увеличивают. Во избежание потерь при прокаливании тигли обычно закрывают крышками. Если в таком тигле приходится что-либо озолять, то сначала при слабом нагревании сжигают вещество в открытом тигле и уже после этого закрывают тигель крышкой.
Если фарфоровый тигель после работы загрязнен внутри, то для очистки в него наливают концентрированную азотную кислоту или дымящую соляную кислоту и осторожно нагревают. Если ни азотная, ни соляная кислоты не удаляют загрязнение, то берут смесь их в пропорции: азотная кислота — 1 объем и соляная кислота — 3 объема. Иногда загрязненные тиглн обрабатывают или концентрированным раствором KHSO4 при нагревании, или плавлением этой соли в тигле с последующей промывкой его водой. Бывают, однако, случаи, когда все указанные приемы не помогают; такой не поддающийся очистке тигель рекомендуется применять для каких-» нибудь неответственных работ.
В практике аналитических работ», когда приходится прокаливать окислы металлов, например РегОз, нужно заботиться о том, чтобы пламя горелки не соприкасалось с прокаливаемым веществом (во избежание восстановления) . В таких случаях применяют платиновые пластинки с отверстием в центре, в которое вставляют тигель. . Эти пластинки можно укрепить в асбестовом картоне. Вместо платины можно применять также не окисляющиеся и не разрушающиеся при прокаливании глиняные или шамотные пластинки с круглым отверстием в центре.
При прокаливании осадка в тигле Гуча последний вставляют в обыкновенный, несколько больших размеров фарфоровый тигель так, чтобы стенки обоих тиглей не соприкасались. Для этого тигель Гуча обвертывают полоской увлажненного асбеста и, нажимая, вдавливают в предохранительный тигель так, чтобы расстояние между дном того и другого равнялось нескольким миллиметрам. Сначала все вместе высушивают при 100° С, затем тигель Гуча вынимают, а предохранительный тигель вместе с асбестовым кольцом перед первым употреблением сильно прокаливают.
Очень осторожного обращения требуют платиновые тигли, которые неопытные работники часто прожигают. Во избежание этого нагревание платиновой посуды на ‘ голом пламени нужно вести так, чтобы внутренний конус пламени горелки не касался платины. При соприкосновении же этого конуса с платиной образуется карбид платины. Сильные разрушения платины происходят при температуре, близкой к ее температуре плавления.
Незначительные разрушения поверхности устраняют путем накаливания в окислительной среде. Сильно поврежденный тигель вместе с образовавшимся порошком карбида платины (который обязательно следует собирать) сдают для переплавки.
Если платиновый тигель загрязнился, его следует очистить, нагревая в нем чистую азотпую кислоту (без следов соляной кислоты). Если это не помогает, в тигле плавят KHSO4 или NaHS04. Когда и этим не достигают цели, стенки тигля протирают тончайшим кварцевым (белым) песком или тонким наждаком (№ ООО).
Очень удобны кварцевые тигли, обладающие многими ценными свойствами, как-то: большая термическая прочность, химическая индиферентность к большинству веществ и пр. Однако нужно помнить, что кварц сплавляется с щелочами или щелочными солями.
В некоторых случаях прокаливание или нагревание необходимо проводить или в окислительной, или в восстановительной, или в нейтральной среде. Чаще всего для этих целей применяют трубчатые либо специальные печи, через которые во время прокаливания пропускают соответствующий газ из баллона. Для создания окислительной среды пропускают кислород, для создания восстановительной среды — водород или окись углерода. Нейтральную атмосферу создают пропусканием аргона
Рис. 231. Разъемная печь для нагревания до высокой температуры.
и иногда азота. При решении вопроса, какой газ следует применять в каждом отдельном случае, нужно знать, не будет ли выбранный газ при высокой температуре реагировать с данным веществом. Даже такой казалось бы инертный газ, как азот, в известных условиях может образовывать соединения типа нитридов.
Для прокаливания при помощи газовых горелок очень удобна разъемная печь (рис. 231). Ее изготовляют из двух шамотных или диатомитовых кирпичей, выдалбливая в них одинакового размера выемки так, чтобы при наложении кирпичей друг иа друга внутри образовалась камера. В центре верхнего кирпича просверливают отверстие диаметром 15 мм, а в центре нижнего — 25 мм. В плоскости касания кирпичей делают желобки для укрепления фарфорового треугольника, в который ставят тигель.
Нагревая эту печь горелкой Теклю или Меккера, можно достичь температуры до 1100° С. Температуру регулируют, изменяя расстояние печи от горелки.
Когда прокаливать в платиновом тигле нельзя, можно применять так называемые «содовые» тигли. Тонко , измельченный и предварительно прокаленный углекислый натрий насыпают в фарфоровый тигель, например № 4, до половины его высоты. Затем тигель меньшего размера вдавливают в соль.
Рис. 232 Формование содовых тиглей
Помещают на ночь в выключенную после нагревания муфельную печь. К утру содовый тигель готов и в нем можно проводить щелочное плавление, например некоторых руд или минералов. Na2CO3 плавится при температуре 870° С; следовательно, «содовый» тигель можно нагревать до 600° С.
К оглавлению
- Нагревательные приборы
- Электронагревательные приборы
- Газовые нагревательные приборы
- Жидкостные горелки
- Другие средства нагревания
- Нагревание (1 2)
- Нагревание в атмосфере инертных или других газов
- Нагревание полупроводниковыми пленками
- Нагревание в посуде из электропроводящего стекла
- Нагревание газов и паров.
- Нагревание при микро- и полумикрохимических работах
- Прокаливание
- Несколько замечаний о работах, связанных с нагреванием и прокаливанием
www.himikatus.ru

Leave A Comment