Оксид кальция – формула, реакции получения, тип химической связи
4.7
Средняя оценка: 4.7
Всего получено оценок: 158.
4.7
Средняя оценка: 4.7
Всего получено оценок: 158.
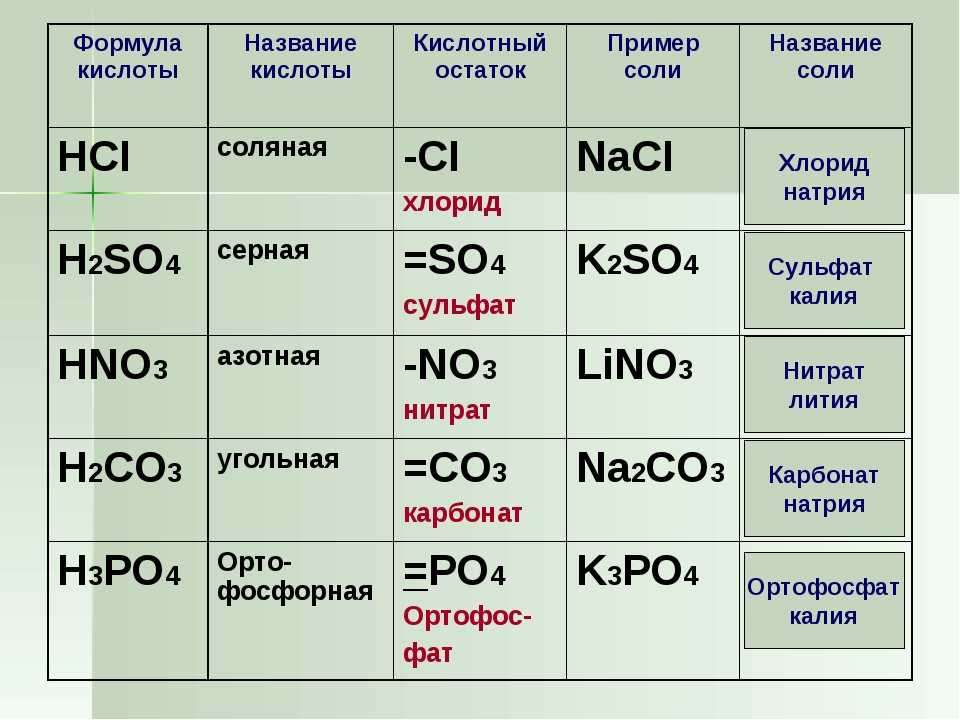
Негашёная известь – это оксид кальция. Его получают в лабораториях и промышленным путём из природных материалов. Вещество активно используется в строительстве и промышленности.
Физические свойства
Оксид кальция – неорганическое кристаллическое вещество в виде белого или серо-белого порошка без запаха и вкуса. Твёрдое вещество кристаллизуется в кубические гранецентрированные кристаллические решётки по типу хлорида натрия (NaCl).
Рис. 1. Кубические гранецентрированные кристаллические решётки.Общее описание вещества представлено в таблице.
Признак | Значение |
Формула соединения оксид кальция | CaO |
Температура плавления | 2627°C |
Температура кипения | 2850°C |
Растворимость | В глицерине. |
Молярная масса | 56,077 г/моль |
Плотность | 3,37 г/см3 |
Химическая связь в кристалле | Ионная |
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.
Рис. 2. Порошок оксида кальция.Получение
Оксид кальция также называют жжёной известью из-за способа получения. Получают негашёную известь путём нагревания и разложения известняка – карбоната кальция (CaCO
Реакция получения оксида кальция из известняка выглядит следующим образом:
CaCO3 → CaO + CO2.
Кроме того, негашёную известь можно получить двумя способами:
Реакции протекают при высоких температурах. Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и максимально проявляет окислительные свойства. Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
Реакции | Что образуется | Молекулярное уравнение |
С водой | Образуется гидроксид (гашёная известь). Реакция протекает бурно с выделением тепла | CaO + H |
С кислотами | Растворяется, образуя соли | CaO + 2HCl → CaCl2 +H2O |
С оксидами неметаллов (кислотными остатками) | Образуются соли | CaO + SO2 → CaSO3 |
С углеродом при нагревании | Образуется карбид кальция | CaO + 3С → СаС2 + CO |
С алюминием | Восстанавливает кальций. | 3CaO + 2Al → Са + Al2O3 |
Применение
Оксид используется в пищевой промышленности в качестве:
- улучшителя муки и хлеба;
- пищевой добавки Е529;
- регулятора кислотности;
- питательной среды для дрожжей;
- катализатора гидрогенизации (присоединения водорода) жиров.
Кроме того, негашёная известь применяется в химической и строительной промышленности для производства различных веществ:
- масел;
- стеарата кальция;
- солидола;
- огнеупорных материалов;
- гипса;
- высокоглиноземистого цемента;
- силикатного кирпича.
Что мы узнали?
 Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.
Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Владимир Комаров
10/10
Сергей Ефремов
4/10
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 158.
А какая ваша оценка?
формула вещества, его физические и химические свойства, реакции получения негашеной извести
Химия
12.11.21
10 мин.
Кальций — элемент второй группы периодической системы Менделеева. В нее входят щелочноземельные металлы (то есть те, чьи окислы при взаимодействии с водой дают щелочные растворы).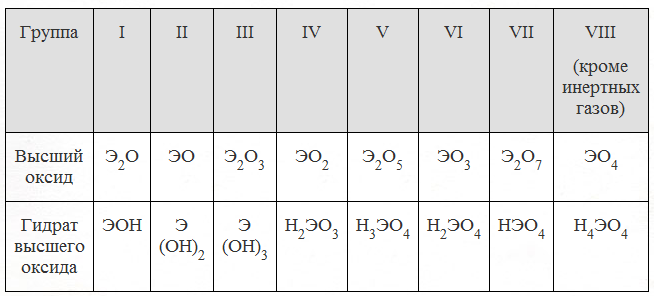 Оксид кальция (формула соединения — CaO) — белое вещество, устойчивое к горению (плавится при температуре порядка 3000°C), имеет ярко выраженные основные свойства.
Оксид кальция (формула соединения — CaO) — белое вещество, устойчивое к горению (плавится при температуре порядка 3000°C), имеет ярко выраженные основные свойства.
Оглавление:
- Получение и основные характеристики
- Химические свойства
- Практическое использование
- Меры предосторожности при работе
Кальций — элемент второй группы периодической системы Менделеева. В нее входят щелочноземельные металлы (то есть те, чьи окислы при взаимодействии с водой дают щелочные растворы). Оксид кальция (формула соединения — CaO) — белое вещество, устойчивое к горению (плавится при температуре порядка 3000°C), имеет ярко выраженные основные свойства.
Получение и основные характеристики
В лабораторных условиях жженую известь получают окислением металлического кальция. Второй вариант — термическое разложение его карбоната (известняка):
- CaCO3 → CaO + CO2;
- 2Ca + O2 → 2CaO.

Получить это соединение можно и разложением пероксида кальция (CaO2) при температуре 250°C:
CaO2 → 2CaO + O2.
В промышленности оксид кальция «добывают» путем обжига известняка (CaCO3). Температура, при которой протекает реакция, составляет 1000−1100°C. Сам технологический процесс проходит в шахтных или во вращающихся трубчатых печах.
- Разложение гашеной извести. Процесс протекает при повышенных температурах (520−580°C): Ca (OH)2 → CaO + h3O.
- Разложение кальциевых кислотосодержащих солей: 2Ca (NO3)2 → 2CaO + 4NO2 + O2. Эта реакция возможна только при высоких температурах (600°C).
Примечание: именно благодаря высокотемпературным способам получения CaO стали называть жженой (негашеной) известью.
CaO (простое вещество) — порошок, не имеющий запаха, по внешнему виду напоминает обычную поваренную соль. Вид химической связи — ионная: металл плюс неметалл.
Справка: негашеная известь относится к веществам второго класса опасности.
Химические свойства
Это химически активное соединение, которому присущи все свойства основных оксидов металлов. К ним относятся:
- Взаимодействие с кислотами: CaO + 2HCl → CaCL2 + h3O; CaO + h3SO4 → CaSO4 + h3O.
- С окислами неметаллов: CaO + SO2 → CaSO3; CaO + SO3 → CaSO4.
- С кремнием (при нагревании до 1300°C): 2CaO + 5Si → 2CaSi2 + SiO2.
- С углекислым газом (диоксидом углерода): CaO + CO2 → CaCO3.
- С амфотерными оксидами, то есть теми, что обладают свойствами как кислот, так и оснований. Уравнения реакций будут выглядеть так: CaO + Al2O3 → Ca (AlO2)2; CaO + MnO2 → CaMnO3.

Взаимодействием с углеродом получают карбид и угарный (углекислый) газ — все будет зависеть от условий проведения реакции:
- CaO + 3C→ CaC2 + CO (t° = 1900 — 1950°C).
- 2CaO + 5C → 2CaC2 + CO2 (t° = 700°C).
А вот в воде жженая известь не растворяется, а реагирует с ней, образуя сильную щелочь:
CaO + h3O → Ca (OH)2 — процесс характеризуется выработкой существенного количества тепловой энергии.
Интересный факт: у жженой извести есть еще одно название — кипелка. Именно этот термин обычно используют строители. Наименование появилось благодаря процессу взаимодействия оксида кальция с водой, при котором из-за выделяющегося тепла смесь «кипит».
Практическое использование
Основное применение — пищевая промышленность. При добавлении «E529» (номенклатурное название оксида кальция) улучшаются качества муки и хлебобулочных изделий. Кроме того, эта добавка является питательной средой при дрожжевом брожении. А еще она поддерживает нужный уровень кислотности. Другие варианты:
А еще она поддерживает нужный уровень кислотности. Другие варианты:
- Производство сахара — там эта добавка выполняет функции осветлителя, сорбента и фильтрующего материала.
- Изготовление пищевых масел — катализатор процесса гидрогенизации (присоединение водорода к органическому веществу).
- Обработка воды, используемой для изготовления алкогольсодержащих напитков.
- Производство соли (пищевой, технической, фармакопейной) — в качестве реагента, необходимого для очистки рассола от солей кальция и магния.
Примечание: вещество безопасно для человека в продуктах питания, но только при соблюдении дозировок.
Свойства соединения позволяют использовать его и в качестве наполнителя, химического реагента: например, для нейтрализации кислоты (в кожевенной индустрии, а также при сбросе стоков любых химпроизводств), при получении стеарата кальция — вещества, необходимого для изготовления загустителя смазочных материалов, матирующих добавок в лакокрасочных материалах, эмульгаторов (косметические продукты), и прочего.
Негашеная известь нужна и в строительстве — из нее производят известковый цемент, который быстро застывает на воздухе. Однако из-за его «специфической» адсорбционной способности (слишком сильно поглощает влагу, из-за чего на стенах зданий, построенных с использованием этого материала иногда образовывался грибок) в последнее время от него стали отказываться. Но CaO по-прежнему остается незаменимым при изготовлении штукатурок, силикатных кирпичей, шлакобетона.
В агрохимической отрасли оксид кальция используют для обработки кислых почв, а также в качестве средства, применяющегося для борьбы с сельскохозяйственными вредителями. А в нефтехимии жженая известь незаменима при изготовлении тормозных колодок, солидолов.
Меры предосторожности при работе
Так как известь — вещество ядовитое, при работе с ней на производстве и в быту необходимо соблюдать строгие меры безопасности. Самое основное — использовать перчатки, так как даже без попадания воды оксид кальция будет действовать на кожу и вызовет химический ожог. Обязательно использовать и защитную одежду, очки, респиратор.
Самое основное — использовать перчатки, так как даже без попадания воды оксид кальция будет действовать на кожу и вызовет химический ожог. Обязательно использовать и защитную одежду, очки, респиратор.
Примечание: на предприятиях, где в техпроцессах задействована жженая известь, обязательно контролируют ПДК (максимально допустимую безопасную концентрацию) этого вещества в воздухе. Рабочие места всегда располагаются в помещениях с дополнительно принудительной вентиляцией. А если есть риск высокого пыления, еще и оснащаются локальными вытяжками. В лабораториях реакции с участием жженой извести проводятся исключительно в вытяжных шкафах.
Хранят известковые смеси в герметичных упаковках (специальных бумажных многослойных пакетах), куда нет доступа влаге. Все они должны быть оснащены специальной маркировкой, предупреждающей о возможной опасности. При этом важно, чтобы и само помещение, где лежат пачки с кипелкой, хорошо проветривалось.
Редкоземельный элемент | Использование, свойства и факты
электронные вероятности для гадолиния
Просмотреть все СМИ
- Ключевые люди:
- Фрэнк Гарольд Спеддинг Карл Густав Мосандер
- Похожие темы:
- переходный металл гадолиний церий лантан самарий
Просмотреть весь связанный контент →
редкоземельный элемент , любой член группы химических элементов, состоящей из трех элементов группы 3 (скандий [Sc], иттрий [Y] и лантан [La]) и первого расширенного ряда элементов ниже основная часть периодической таблицы (от церия [Ce] до лютеция [Lu]). Элементы от церия до лютеция называются лантаноидами, но многие ученые также, хотя и неправильно, называют эти элементы редкоземельными элементами.
Элементы от церия до лютеция называются лантаноидами, но многие ученые также, хотя и неправильно, называют эти элементы редкоземельными элементами.
Редкоземельные элементы обычно являются трехвалентными элементами, но некоторые из них имеют другие валентности. Церий, празеодим и тербий могут быть четырехвалентными; самарий, европий и иттербий, с другой стороны, могут быть двухвалентными. Во многих вводных научных книгах редкоземельные элементы рассматриваются как настолько химически похожие друг на друга, что в совокупности их можно рассматривать как один элемент. В определенной степени это правильно — около 25 процентов их использования основано на этом близком сходстве, — но остальные 75 процентов использования редкоземельных элементов основаны на уникальных свойствах отдельных элементов. Более того, внимательное изучение этих элементов обнаруживает огромные различия в их поведении и свойствах; например, температура плавления лантана, элемента-прототипа ряда лантаноидов (918 ° C, или 1684 ° F), намного ниже температуры плавления лютеция, последнего элемента в ряду (1663 ° C, или 3025 ° F). Эта разница намного больше, чем во многих группах периодической таблицы; например, температуры плавления меди, серебра и золота различаются всего примерно на 100 ° C (180 ° F).
Эта разница намного больше, чем во многих группах периодической таблицы; например, температуры плавления меди, серебра и золота различаются всего примерно на 100 ° C (180 ° F).
Само название редкоземельных элементов является неправильным. Во время их открытия в 18 веке они оказались компонентом сложных оксидов, которые в то время назывались «землями». Кроме того, этих минералов оказалось мало, и поэтому эти недавно открытые элементы были названы «редкими землями». На самом деле эти элементы довольно распространены и присутствуют во многих пригодных для разработки месторождениях по всему миру. 16 встречающихся в природе редкоземельных элементов попадают в 50-й процентиль содержания элементов. К началу 21 века Китай стал крупнейшим в мире производителем редкоземельных элементов. Австралия, Бразилия, Индия, Казахстан, Малайзия, Россия, Южная Африка и США также добывают и перерабатывают значительные количества этих материалов.
Многие люди не осознают огромного влияния редкоземельных элементов на их повседневную жизнь, но почти невозможно избежать использования современной технологии, которая их не содержит. Даже такой простой продукт, как кремень для зажигалок, содержит редкоземельные элементы. Примером их повсеместного распространения является современный автомобиль, один из крупнейших потребителей редкоземельных продуктов. В десятках электродвигателей типичного автомобиля, а также в динамиках его звуковой системы используются постоянные магниты из неодима, железа и бора. В электрических датчиках используется оксид циркония, стабилизированный оксидом иттрия, для измерения и контроля содержания кислорода в топливе. Трехкомпонентный каталитический нейтрализатор использует оксиды церия для восстановления оксидов азота до газообразного азота и окисления монооксида углерода до диоксида углерода и несгоревших углеводородов до диоксида углерода и воды в продуктах выхлопа. Люминофоры в оптических дисплеях содержат оксиды иттрия, европия и тербия. Лобовое стекло, зеркала и линзы отполированы с использованием оксидов церия. Даже бензин или дизельное топливо, приводящее в движение автомобиль, очищали с использованием редкоземельных катализаторов крекинга, содержащих оксиды лантана, церия или смеси редкоземельных элементов.
Даже такой простой продукт, как кремень для зажигалок, содержит редкоземельные элементы. Примером их повсеместного распространения является современный автомобиль, один из крупнейших потребителей редкоземельных продуктов. В десятках электродвигателей типичного автомобиля, а также в динамиках его звуковой системы используются постоянные магниты из неодима, железа и бора. В электрических датчиках используется оксид циркония, стабилизированный оксидом иттрия, для измерения и контроля содержания кислорода в топливе. Трехкомпонентный каталитический нейтрализатор использует оксиды церия для восстановления оксидов азота до газообразного азота и окисления монооксида углерода до диоксида углерода и несгоревших углеводородов до диоксида углерода и воды в продуктах выхлопа. Люминофоры в оптических дисплеях содержат оксиды иттрия, европия и тербия. Лобовое стекло, зеркала и линзы отполированы с использованием оксидов церия. Даже бензин или дизельное топливо, приводящее в движение автомобиль, очищали с использованием редкоземельных катализаторов крекинга, содержащих оксиды лантана, церия или смеси редкоземельных элементов. Гибридные автомобили питаются от никель-лантан-металлогидридной аккумуляторной батареи и электрического тягового двигателя с постоянными магнитами, содержащими редкоземельные элементы. Кроме того, современные средства массовой информации и коммуникационные устройства — сотовые телефоны, телевизоры и компьютеры — используют редкоземельные элементы в качестве магнитов для динамиков и жестких дисков и люминофоров для оптических дисплеев. Используемые количества редкоземельных элементов довольно малы (0,1–5 процентов по весу, за исключением постоянных магнитов, которые содержат около 25 процентов неодима), но они критически важны, и любое из этих устройств не будет работать так же хорошо или будет значительно тяжелее, если бы не редкие земли.
Гибридные автомобили питаются от никель-лантан-металлогидридной аккумуляторной батареи и электрического тягового двигателя с постоянными магнитами, содержащими редкоземельные элементы. Кроме того, современные средства массовой информации и коммуникационные устройства — сотовые телефоны, телевизоры и компьютеры — используют редкоземельные элементы в качестве магнитов для динамиков и жестких дисков и люминофоров для оптических дисплеев. Используемые количества редкоземельных элементов довольно малы (0,1–5 процентов по весу, за исключением постоянных магнитов, которые содержат около 25 процентов неодима), но они критически важны, и любое из этих устройств не будет работать так же хорошо или будет значительно тяжелее, если бы не редкие земли.
Викторина по Британике
Факты, которые вы должны знать: Викторина по периодической таблице
Хотя редкоземельные элементы существуют с момента образования Земли, об их существовании стало известно только в конце 18 века. В 1787 году лейтенант шведской армии Карл Аксель Аррениус обнаружил в небольшой каменоломне в Иттербю (небольшой городок недалеко от Стокгольма) уникальный черный минерал. Этот минерал представлял собой смесь редкоземельных элементов, а первым отдельным элементом, выделенным в 1803 г., был церий.0003
В 1787 году лейтенант шведской армии Карл Аксель Аррениус обнаружил в небольшой каменоломне в Иттербю (небольшой городок недалеко от Стокгольма) уникальный черный минерал. Этот минерал представлял собой смесь редкоземельных элементов, а первым отдельным элементом, выделенным в 1803 г., был церий.0003
История отдельных редкоземельных элементов сложна и запутана, в основном из-за их химического сходства. Многие «недавно открытые элементы» были не одним элементом, а смесью целых шести различных редкоземельных элементов. Кроме того, поступали заявления об открытии большого количества других «элементов», которые должны были принадлежать к ряду редкоземельных элементов, но таковыми не являлись.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Последний встречающийся в природе редкоземельный элемент (лютеций) был открыт в 1907 году, но исследование химии этих элементов было затруднено, потому что никто не знал, сколько существует настоящих редкоземельных элементов. К счастью, в 1913–1914 годах исследования датского физика Нильса Бора и английского физика Генри Гвина Джеффриса Мозли разрешили эту ситуацию. Боровская теория атома водорода позволила теоретикам показать, что существует только 14 лантаноидов. Экспериментальные исследования Мозли подтвердили существование 13 из этих элементов и показали, что 14-й лантаноид должен быть элементом 61 и находиться между неодимом и самарием.
К счастью, в 1913–1914 годах исследования датского физика Нильса Бора и английского физика Генри Гвина Джеффриса Мозли разрешили эту ситуацию. Боровская теория атома водорода позволила теоретикам показать, что существует только 14 лантаноидов. Экспериментальные исследования Мозли подтвердили существование 13 из этих элементов и показали, что 14-й лантаноид должен быть элементом 61 и находиться между неодимом и самарием.
В 1920-х годах поиски элемента 61 были интенсивными. В 1926 году группы ученых из Университета Флоренции, Италия, и из Университета Иллинойса заявили, что открыли элемент 61 и назвали его флорентием и иллинием соответственно, но их утверждения не могли быть подтверждены независимо. Шум от этих претензий и встречных претензий в конце концов стих к 1930 году. Только в 1947 году, после деления урана, 61-й элемент определенно был выделен и назван прометием учеными из Национальной лаборатории Ок-Риджа Комиссии США по атомной энергии в Теннесси. (Более подробную информацию об открытии отдельных элементов можно найти в статьях об этих элементах.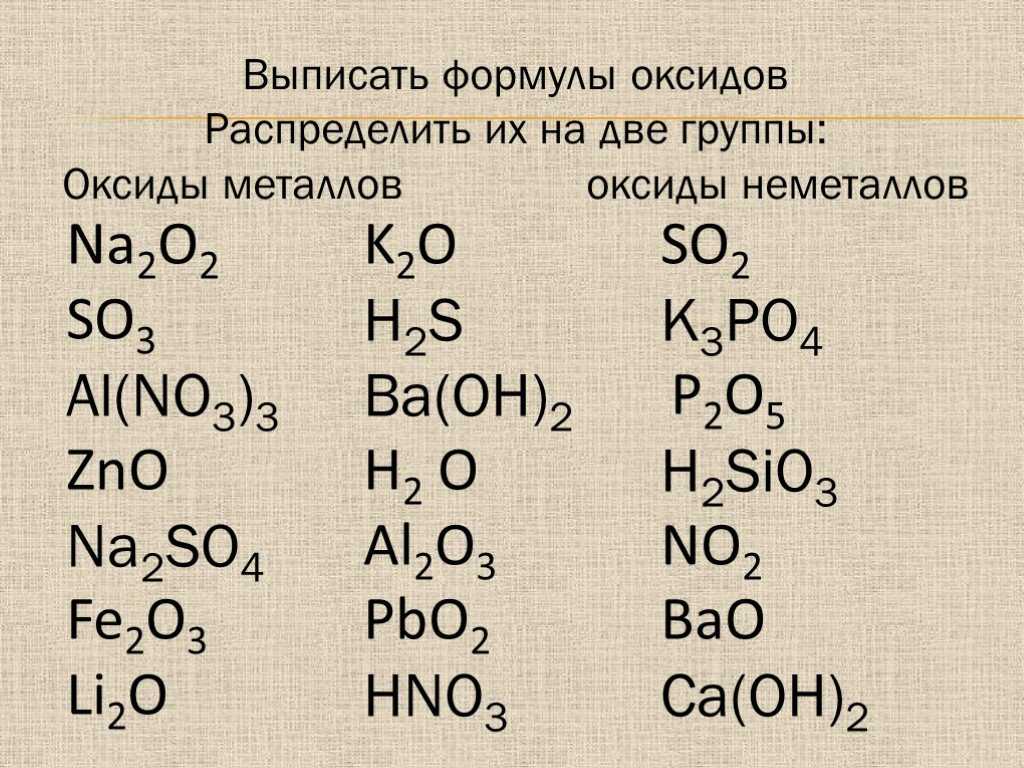 )
)
За 160 лет открытий (1787–1947) выделение и очистка редкоземельных элементов было трудным и трудоемким процессом. Многие ученые всю свою жизнь пытались получить 99-процентную чистоту редкоземельных элементов, обычно путем фракционной кристаллизации, которая использует небольшие различия в растворимости соли редкоземельного элемента в водном растворе по сравнению с растворимостью соседнего лантанидного элемента.
Поскольку было обнаружено, что редкоземельные элементы являются продуктами деления при расщеплении атома урана, Комиссия по атомной энергии США приложила огромные усилия для разработки новых методов разделения редкоземельных элементов. Однако в 1947 Джеральд Э. Бойд и его коллеги из Окриджской национальной лаборатории, а также Фрэнк Гарольд Спеддинг и его коллеги из лаборатории Эймса в Айове одновременно опубликовали результаты, показавшие, что ионообменные процессы предлагают гораздо лучший способ разделения редкоземельных элементов.
Окисление и восстановление
Окисление и сокращение
| Окислительно-восстановительный Реакции | Роль окисления Числа в окислительно-восстановительных реакциях | Число окисления против. Истинный заряд ионов Истинный заряд ионов |
| Окислители и Восстановители | Окисление конъюгата Пары агент/восстановитель | Родственник Сильные стороны металлов как восстановителей |
Окислительно-восстановительный Реакции
Термин окисление первоначально использовался для описания реакции, в которых элемент соединяется с кислородом.
Пример: Реакция между металлическим магнием и кислородом с образованием образование оксида магния включает окисление магния.
Термин сокращение происходит от латинской основы, означающей «вернуть назад». Все, что ведет обратно к поэтому металлический магний включает восстановление.
Реакция между оксидом магния и углеродом при 200°С до
из металлического магния и монооксида углерода является примером
восстановление оксида магния до металлического магния.
После открытия электронов химики убедились что окислительно-восстановительные реакции связаны с переносом электронов от одного атома к другому. С этой точки зрения, реакция между магнием и кислородом записывается следующим образом.
2 Mg + O 2 2 [Mg 2+ ][O 2- ]
В ходе этой реакции каждый атом магния теряет два электронов с образованием иона Mg 2+ .
Mg Mg 2+ + 2 e —
Каждая молекула O 2 получает четыре электрона, образуя пара ионов O 2-.
O 2 + 4 e — 2 O 2-
Поскольку электроны не создаются и не
разрушается в результате химической реакции окисления и восстановления.
связаны. Одно без другого невозможно, как показано
на рисунке ниже.
Роль окисления Числа в окислительно-восстановительных реакциях
Химики со временем расширили идею окисления и сведение к реакциям, формально не связанным с переносом электронов.
Рассмотрим следующую реакцию.
CO( г ) + H 2 O( г ) CO 2 ( г ) + H 2 ( г )
Как видно из рисунка ниже, общее количество электронов на валентной оболочке каждого атома остается постоянным в эта реакция.
В этой реакции изменяется степень окисления этих атомы. Степень окисления углерода увеличивается с +2 до +4, в то время как степень окисления водорода уменьшается с +1 до 0.
Поэтому лучше всего подходят окисление и восстановление
определяется следующим образом. Окисление происходит, когда
степень окисления атома становится больше. Переходник происходит, когда степень окисления атома становится меньше.
Окисление происходит, когда
степень окисления атома становится больше. Переходник происходит, когда степень окисления атома становится меньше.
| Интерактивный
учебник по присвоению степеней окисления от требует Макромедиа Шоквейв |
Числа окисления по сравнению с Истинный заряд ионов
Термины ионный и ковалентный описывают крайности континуума связи. есть какая-то ковалентная характер даже в самых ионных соединениях и наоборот.
Полезно подумать о соединениях основной группы
металлов, как если бы они содержали положительные и отрицательные ионы.
химия оксида магния, например, легко понять
если предположить, что MgO содержит Mg 2+ и О 2- ионы. Но никакие соединения не являются на 100% ионными. Есть экспериментальный
доказательства, например, что истинный заряд магния и
атомов кислорода в MgO +1,5 и -1,5.
Но никакие соединения не являются на 100% ионными. Есть экспериментальный
доказательства, например, что истинный заряд магния и
атомов кислорода в MgO +1,5 и -1,5.
Степени окисления обеспечивают компромисс между мощной моделью окислительно-восстановительных реакций, основанных на предположении, что эти соединения содержат ионы и наши знания о том, что истинные заряд ионов в этих соединениях не так велик, как этот модель предсказывает. По определению, степень окисления атома заряд, который нес бы атом, если бы соединение было чисто ионный.
Для активных металлов групп IA и IIA разница
между степенью окисления атома металла и зарядом на
этот атом достаточно мал, чтобы им можно было пренебречь. Металлы основной группы в
Однако группы IIIA и IVA образуют соединения, которые имеют
значительное количество ковалентного характера. Это заблуждение, ибо
например, предположить, что бромид алюминия содержит Al 3+ ионы Br — . На самом деле существует как Al 2 Br 6 молекулы.
Эта проблема становится еще более серьезной, когда мы обращаемся к химия переходных металлов. MnO, например, является ионным достаточно, чтобы считаться солью, содержащей Mn 2+ и O 2- ионы. Мн 2 О 7 , с другой стороны, представляет собой ковалентное соединение, которое кипит при комнатной температуре. Это Поэтому полезнее думать об этом соединении так, как если бы оно содержал марганец в степени окисления +7, а не Mn 7+ ионы.
Окислители и Восстановители
Рассмотрим роль каждого элемента в реакция, в которой определенный элемент приобретает или теряет электроны.
Когда магний реагирует с кислородом, атомы магния отдают электронов на молекулы O 2 и тем самым уменьшить кислород. Таким образом, магний действует как восстановитель в эта реакция.
| 2 мг | + О 2 | 2 MgO | |
| восстановитель агент |
Молекулы O 2 , с другой
стороны, получить электроны от атомов магния и тем самым окислить
магний. Кислород, следовательно, окислитель .
Кислород, следовательно, окислитель .
| 2 мг + | О 2 | 2 MgO | |
| окислитель агент |
Окислители и восстановители могут быть определены как следует. Окислители получить электроны. Сокращение агенты теряют электроны.
В таблице ниже указаны восстановитель и окислитель для некоторых реакций, обсуждаемых в этой сети страница. Сразу бросается в глаза одна тенденция: Металлы основной группы действуют как восстановители во всех своих химических реакциях.
Типичные реакции металлов основной группы
| Реакция | Сокращение Агент | Окислитель Агент | ||
| 2 Na + Cl 2 2 NaCl | На | Класс 2 | ||
| 2 К + Н 2 2 КН | К | Н 2 | ||
| 4 Li + O 2 2 Li 2 O | Ли | О 2 | ||
| 2 Na + O 2 Na 2 O 2 | На | О 2 | ||
| 2 Na + 2 H 2 O 2 Na + + 2 OH — + H 2 | На | Н 2 О | ||
| 2 K + 2 NH 3 2 K + + 2 NH 2 — + Н 2 | К | НХ 3 | ||
| 2 Mg + O 2 2 MgO | мг | О 2 | ||
| 3 Мг + Н 2 Мг 3 Н 2 | мг | Н 2 | ||
| Ca + 2 H 2 O Ca 2+ + 2 OH — + H 2 | Са | Н 2 О | ||
| 2 Al + 3 Br 2 Al 2 Br 6 | Ал | Бр 2 | ||
| Мг + 2 Н + Мг 2+ + Н 2 | мг | Н + | ||
| Mg + H 2 O MgO + H 2 | мг | Н 2 О |
Конъюгат окисляющий Пары агент/восстановитель
Металлы действуют как восстановители в своих химических реакциях. Например, при нагревании меди над пламенем поверхность
медленно чернеет, так как металлическая медь восстанавливает кислород в
атмосфере с образованием оксида меди(II).
Например, при нагревании меди над пламенем поверхность
медленно чернеет, так как металлическая медь восстанавливает кислород в
атмосфере с образованием оксида меди(II).
Если мы выключим пламя и продуем H 2 газом над поверхность горячего металла, черный CuO, образовавшийся на поверхности металл медленно превращается обратно в металлическую медь. В ходе этой реакции CuO восстанавливается до металлической меди. Таким образом, Н 2 является восстановителем в этой реакции, а CuO действует как окислитель.
Важной особенностью окислительно-восстановительных реакций может быть
определяется путем изучения того, что происходит с медью в этой паре
реакций. Первая реакция превращает металлическую медь в CuO,
тем самым превращая восстановитель (Cu) в окислитель
агент (CuO). Вторая реакция превращает окислитель
(CuO) в восстановитель (Cu). Каждый восстановитель
следовательно, связанный или связанный с сопряженным окислителем, и
наоборот.
Каждый раз, когда восстановитель теряет электроны, он образует окислитель, который мог бы получить электроны, если бы реакция была перевернутый.
И наоборот, каждый раз, когда окислитель получает электроны, он образует восстановитель, который может потерять электроны, если реакция пошел в обратном направлении.
Идея о том, что окислители и восстановители связаны, или спаренные, поэтому их называют сопряженными окисляющими агенты и восстановители. Сопряжение происходит от латинского основа, означающая «соединяться вместе». Поэтому используется для описания вещей, которые связаны или связаны, например, окисление агенты и восстановители.
Все металлы основной группы являются восстановителями. Они, как правило, «сильные» восстановители. Активные металлы в группе ИА, например, лучше любых других элементов отдают электроны в периодической таблице.
Тот факт, что активный металл, такой как натрий, является сильным
восстановитель должен рассказать нам что-то об относительном
сила Na 9Ион 0110 + в качестве окислителя.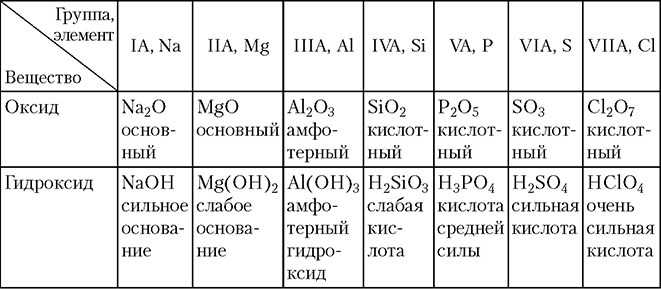 Если
металлический натрий относительно хорошо отдает электроны, Na + ионы должны быть необычно плохо улавливают электроны. Если На является
сильным восстановителем, ион Na + должен быть слабым
окислитель.
Если
металлический натрий относительно хорошо отдает электроны, Na + ионы должны быть необычно плохо улавливают электроны. Если На является
сильным восстановителем, ион Na + должен быть слабым
окислитель.
И наоборот, если O 2 имеет такое высокое сродство к электронов, что он необычайно хорошо принимает их от других элементы, он должен иметь возможность цепляться за эти электроны, как только он подбирает их. Другими словами, если O 2 сильный окислителем, то ион O 2- должен быть слабым Восстановитель.
В целом взаимосвязь между сопряженным окислением и
восстановители можно описать следующим образом. Каждый сильный
восстановитель (например, Na) имеет слабый сопряженный окислитель
(например, ион Na + ). Каждый сильный
окислитель (такой как O 2 ) имеет слабую
сопряженный восстанавливающий агент (такой как O 2- ион).
Относительная сила металлов как восстановителей
Мы можем определить относительную силу пары металлов как восстановители, определяя, происходит ли реакция, когда один одного из этих металлов смешивается с солью другого. Рассмотрим относительная прочность железа и алюминия, например. Ничего происходит, когда мы смешиваем порошкообразный металлический алюминий с оксидом железа (III). Однако если мы поместим эту смесь в тигель и получим реакция начинается с приложения небольшого количества тепла, бурная реакция происходит с образованием оксида алюминия и расплавленного металлического железа.
2 Al( s ) + Fe 2 O 3 ( s ) Al 2 O 3 ( s ) + 2 Fe( l )
Присвоив степени окисления, мы можем определить окисление и восстановление половин реакции.
Алюминий окисляется до Al 2 O 3 в этом
реакции, а это значит, что Fe 2 O 3 должен быть
окислитель.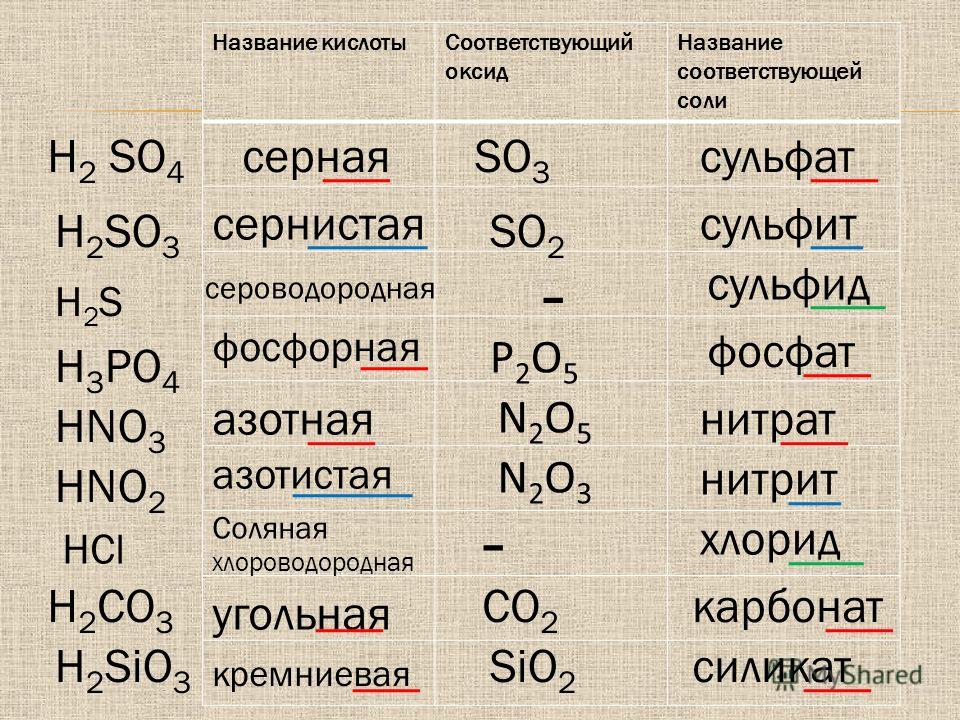 И наоборот, Fe 2 О 3 есть
восстанавливается до металлического железа, а это означает, что алюминий должен быть
Восстановитель. Потому что восстановитель всегда превращается
в сопряженный с ним окислитель в окислительно-восстановительной
реакция, продукты этой реакции включают новый окислитель
агент (Al 2 O 3 ) и новый восстановитель
(Фе).
И наоборот, Fe 2 О 3 есть
восстанавливается до металлического железа, а это означает, что алюминий должен быть
Восстановитель. Потому что восстановитель всегда превращается
в сопряженный с ним окислитель в окислительно-восстановительной
реакция, продукты этой реакции включают новый окислитель
агент (Al 2 O 3 ) и новый восстановитель
(Фе).
Поскольку реакция идет в этом направлении, кажется разумно предположить, что исходные материалы содержат более сильный восстановитель и более сильный окислитель.
Другими словами, если алюминий восстанавливает Fe 2 O 3 для формирования Al 2 O 3 и металлического железа, алюминий должен быть более сильным восстановителем, чем железо.
Из того факта, что алюминий не может восстанавливать
хлорид натрия с образованием металлического натрия, который исходные материалы
в этой реакции более слабый окислитель и более слабый
Восстановитель.
Мы можем проверить эту гипотезу, спросив: что происходит, когда мы попробовать запустить реакцию в обратном направлении? (Натрий достаточно прочный металл, чтобы восстановить соль алюминия до алюминия металл?) При проведении этой реакции мы обнаруживаем, что металлический натрий может, фактически восстанавливают хлорид алюминия до металлического алюминия и натрия хлорида, когда реакцию проводят при температурах, достаточно высоких для расплавить реагенты.
3 Na( l ) + AlCl 3 ( l ) 3 NaCl( l ) + Al( l )
Если натрий достаточно силен, чтобы восстановить Al 3+ соли к металлическому алюминию, а алюминий достаточно прочен, чтобы восстановить солей Fe 3+ к металлическому железу, относительная сила эти восстановители можно резюмировать следующим образом.
Na > Al > Fe
| Практическая задача 4: Использование
следующие уравнения для определения относительного
сильные стороны натрия, магния, алюминия и кальция
металл как восстановитель. |

 В этаноле не растворяется, с водой образует гидроксид
В этаноле не растворяется, с водой образует гидроксид Образуется оксид алюминия
Образуется оксид алюминия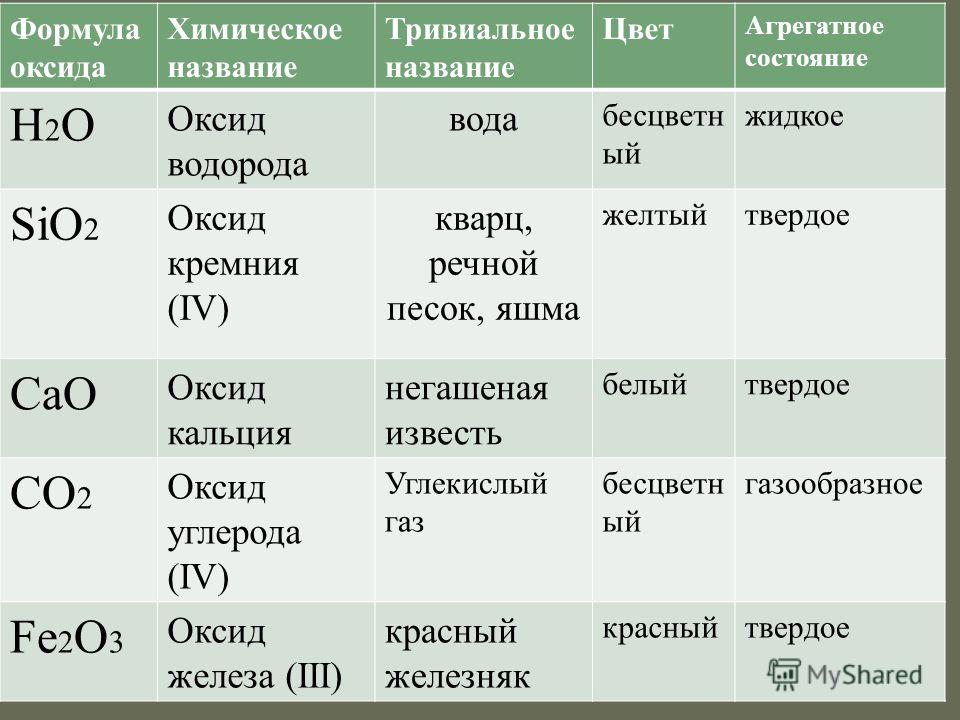

Leave A Comment