|
|
Задания №7 с решениями
Главная \ Подготовка к ОГЭ \ Химия \ Задания №7 с решениями
Задания №7 с решениями.
Разберем задания №7 из ОГЭ за 2016 год.
Перед решением рекомендуем повторить темы: «Диссоциация веществ», «Электролиты».
Задания с решениями.
Задание №1.
Только катионы калия и фосфат-анионы образуются при диссоциации вещества, формула которого
1. KHPO4
2. Ca3(PO4)2
3. Kh3PO4
4. K3PO4
Объяснение: если при диссоциации образуются только катионы калия и фосфат-ионы, значит только эти ионы и входят в состав нужного вещества. Подтвердим уравнением диссоциации:
K3PO4 → 3K+ + PO4³‾
Правильный ответ — 4.
Задание №2.
К электролитам относится каждое из веществ, формулы которых
1. N2O, KOH, Na2CO3
2. Cu(NO3)2, HCl, Na2SO4
3. Ba(OH)2, Nh4xh3O, h3SiO3
4. CaCl2, Cu(OH)2, SO2
Объяснение: электролиты — вещества, проводящие электрический ток вследствие диссоциации на ионы в растворах и расплавах. Следовательно, электролиты — растворимые вещества.
Следовательно, электролиты — растворимые вещества.
Правильный ответ — 2.
Задания №3.
При полной диссоциации сульфида натрия образуются ионы
1. Na+ и HS‾
2. Na+ и SO3²‾
3. Na+ и S²‾
4. Na+ и SO4²‾
Объяснение: напишем уравнение диссоциации сульфида натрия
Na2S → 2Na+ + S²‾
Следовательно, правильный ответ — 3.
Задания №4.
В перечне ионов
А. Нитрат-ион
Б. Ион аммония
В. Гидроксид-ион
Г. Ион водорода
Д. Фосфат-ион
Е. Ион магния
катионами являются:
1. БГД 2. БГЕ 3. АГЕ 4. ВГЕ
Объяснение: катионы-положительные частицы, например, ионы металлов или ион водорода. Из перечисленных — это ион аммония, ион водорода и магния. Правильный ответ — 2.
Задания №5.
Верны ли следующие суждения об электролитической диссоциации солей?
А. Все соли при диссоциации образуют катионы металлов, катионы водорода и анионы кислотных остатков
Б. Соли в процессе диссоциации образуют катионы металлов и анионы кислотных остатков
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: только кислые соли при диссоциации образуют катионы водорода, следовательно, А-неверно, а вот Б — верно. Приведем пример:
NaCl → Na+ + Cl‾
Правильный ответ — 2.
Задания №6.
Одинаковое число молей катионов и анионов образуется при полной диссоциации в водном растворе 1 моль
1. KNO3
2. CaCl2
3. Ba(NO3)2
4. Al2(SO4)3
Объяснение: в этом уравнении мы можем либо написать уравнения диссоциации и посмотреть на полученные коэффициенты, либо посмотреть на индексы в формулах данных солей. Одинаковое число молей есть только у молекулы KNO3:
Одинаковое число молей есть только у молекулы KNO3:
KNO3 → K+ + NO3‾
Правильный ответ — 1.
Задание №7.
Хлорид-ионы образуются в процессе диссоциации вещества, формула которого
1. KClO3
2. AlCl3
3. NaClO
4. Cl2O7
Объяснение: среди приведенных веществ хлорид-ионы есть только в молекуле хлорида алюминия — AlCl3. Приведем уравнение диссоциации этой соли:
AlCl3 → Al3+ + 3Cl‾
Правильный ответ — 2.
Задание №8.
Ионы водорода образуются при диссоциации вещества, формула которого
1. h3SiO3
2. Nh4xh3O
3. HBr
4. NaOH
Объяснение: ионы водорода входят, среди перечисленных, только в HBr: HBr → H+ + Br‾
(h3SiO3 в растворе диссоциирует на Н2О и SiO2)
Правильный ответ — 3.
Задание №9.
В перечне веществ:
А. Серная кислота
Б. Кислород
В. Гидроксид калия
Г. Глюкоза
Д. Сульфат натрия
Е. Этиловый спирт
к электролитам относятся:
1. ГДЕ 2. АБГ 3. ВДЕ 4. АВД
Объяснение: электролиты — это сильные кислоты, основания или соли. Среди перечисленных — это серная кислота (h3SO4), гидроксид калия (KOH), сульфат натрия (Na2SO4). Правильный ответ — 4.
Задание №10.
В процессе диссоциации фосфат-ионы образуют каждое из веществ, формулы которых
1. h4PO4, (Nh5)3PO4, Cu3(PO4)2
2. Mg3(PO4)2, Na3PO4, AlPO4
3. Na3PO4, Ca3(PO4)2, FePO4
4. K3PO4, h4PO4, Na3PO4
Объяснение: как и в предыдущем задании, здесь нам нужно знать, что электролиты — это сильные кислоты или растворимые соли, как, например, в №4:
K3PO4 → 3K+ + PO4³‾
h4PO4 → 3H+ + PO4³‾
Na3PO4 → 3Na+ + PO4³‾
Правильный ответ — 4.
Автор решения: Лунькова Е.Ю.
Задания для самостоятельного решения.
1. Ионы водорода и кислотного остатка образуются в процессе электролитической диссоциации:
1. Воды
2. Азотной кислоты
3. Кремниевой кислоты
4. Нитрата калия
2. Электролитами является каждое из веществ, формулы которых:
1. KOH, h3O(дист), CaCl2
2. BaSO4, Al(NO3)3, h3SO4
3. BaCl2, h3SO4, LiOH
4. h3SiO3, AgCl, HCl
3. Верны ли следующие суждения об электролитах?
А. Азотная и серная кислоты являются сильными электролитами
Б. Сероводород в водном растворе полностью распадается на ионы
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
4. Электролитом является каждое из двух веществ
1. Сульфид меди (II) и этанол
2. Соляная кислота и сульфат калия
3. Оксид ртути (II)и сульфат кальция
4. Карбонат магния и оксид азота (I)
5. В водном растворе ступенчато диссоциирует
В водном растворе ступенчато диссоциирует
1. Нитрат меди (II)
2. Азотная кислота
3. Серная кислота
4. Гидроксид натрия
6. Верны ли следующие суждения об электролитах
А. Гидроксид бериллия и гидроксид железа (III) являются сильными электролитами
Б. Нитрат серебра в водном растворе полностью распадается на ионы
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
7. Сульфат-ионы образуются в процессе диссоциации
1. Сульфида калия
2. Сероводородной кислоты
3. Сульфида меди
4. Сульфата бария
8. Общие химические свойства гидроксида натрия и гидроксида бария обусловлены
1. Наличием в их растворах ионов натрия и бария
2. Их хорошей растворимостью в воде
3. Наличием в их составе трех элементов
4. Наличием в их растворах гидроксид-ионов
9. Катионом является
1. Сульфат-ион
2. Ион натрия
3. Сульфид-ион
Сульфид-ион
4. Сульфит-ион
10. Анионом является
1. Ион кальция
2. Силикат-ион
3. Ион магния
4. Ион аммония
Предоставленные задания были взяты из сборника для подготовки к ОГЭ по химии авторов: Корощенко А.С. и Купцовой А.А.
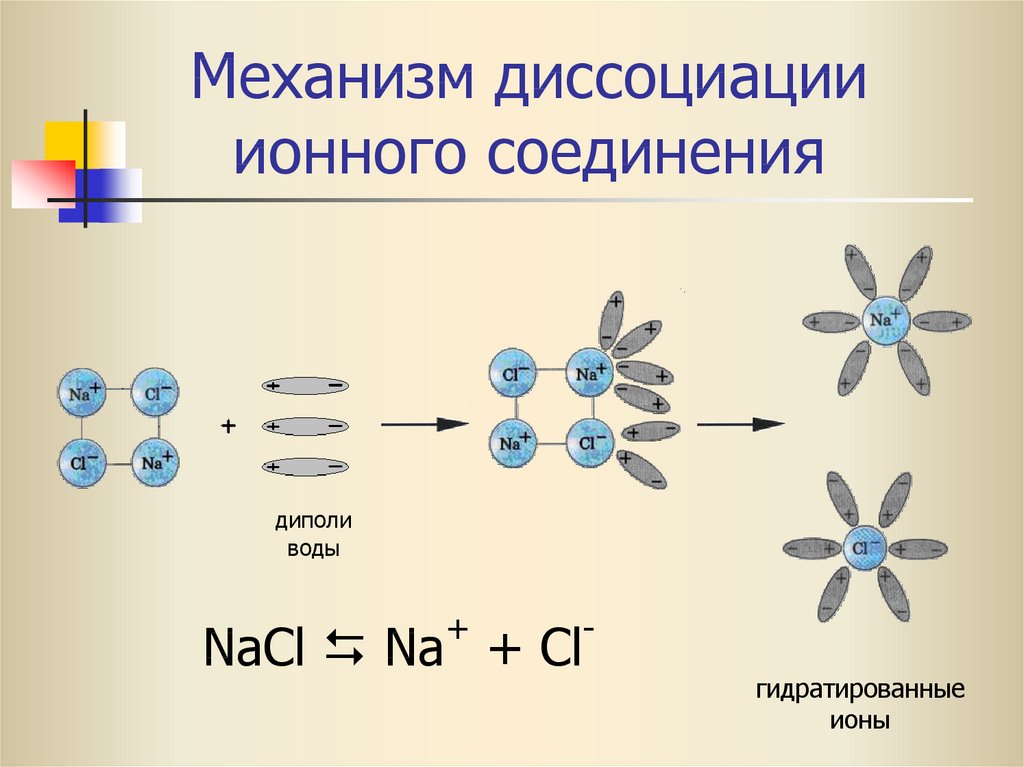
14.4 Гидролиз солей – Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Предсказывать, будет ли раствор соли кислым, щелочным или нейтральным
- Расчет концентрации различных видов в солевом растворе
- Описать кислотную ионизацию гидратированных ионов металлов
Соли с кислыми ионами
Соли представляют собой ионные соединения, состоящие из катионов и анионов, каждый из которых может вступать в реакцию ионизации кислотой или основанием с водой. Таким образом, водные растворы солей могут быть кислыми, щелочными или нейтральными, в зависимости от относительной кислотно-основной силы ионов, составляющих соль. Например, растворение хлорида аммония в воде приводит к его диссоциации, что описывается уравнением
Например, растворение хлорида аммония в воде приводит к его диссоциации, что описывается уравнением
Nh5Cl(т)⇌Nh5+(водн.)+Cl-(водн.)Nh5Cl(тв)⇌Nh5+(водн.)+Cl-(водн.)
Ион аммония представляет собой сопряженную кислоту основания аммиака, NH
Nh5+(водн.)+h3O(ж)⇌h4O+(водн.)+Nh4(водн.)Ka=Kw/KbNh5+(водн.)+h3O(ж)⇌h4O+(водн. )+Nh4(aq)Ka=Kw/Kb
Поскольку аммиак является слабым основанием, K b можно измерить, а K a > 0 (ион аммония является слабой кислотой).
Ион хлорида является сопряженным основанием соляной кислоты, поэтому его ионизация основанием (или гидролиз оснований ) реакция представлена
Cl-(водн.)+h3O(л)⇌HCl(водн.)+OH-(водн.)Kb=Kw/KaCl-(водн.)+h3O(л)⇌HCl(водн.)+OH-(водн.)Kb=Kw /Ка
Поскольку HCl — сильная кислота, K a неизмеримо велико, а K b ≈ 0 (хлорид-ионы не подвергаются заметному гидролизу).
Таким образом, растворение хлорида аммония в воде дает раствор слабых кислых катионов (Nh5+Nh5+) и инертных анионов (Cl — ), в результате чего получается кислый раствор.
Пример 14.15
Расчет рН кислого солевого раствора
C6H5Nh4+(вод)+h3O(ж)⇌h4O+(вод)+C6H5Nh3(вод)C6H5Nh4+(вод)+h3O(ж)⇌h4O+(вод)+ C6H5Nh3(водн.)
Раствор
K a для иона анилина является производным от K b для его сопряженного основания, анилина (см. Приложение H):
Ka=KwKb=1,0×10−144,3×10−10=2,3×10−5Ka=KwKb=1,0×10−144,3×10−10=2,3×10−5
Используя предоставленную информацию, таблица ICE для получена эта система:
Подстановка этих условий равновесной концентрации в выражение K a дает
Ka=[C6H5Nh3][h4O+]/[C6H5Nh4+]2,3×10-5=(x)(x)/0,233 −x)Ka=[C6H5Nh3][h4O+]/[C6H5Nh4+]2,3×10−5=(x)(x)/0,233−x)
Предполагая x << 0,233, уравнение упрощается и решается для x :
2,3×10-5=x2/0,233x=0,0023M2,3×10-5=x2/0,233x=0,0023M
Таблица ICE определяет x как молярность иона гидроксония, поэтому pH рассчитывается как =2,64
Проверьте свои знания
 NO3-. Какая кислота сильнее C6H5Nh4+C6H5Nh4+ или Nh5+?Nh5+?
NO3-. Какая кислота сильнее C6H5Nh4+C6H5Nh4+ или Nh5+?Nh5+?Отвечать:
[H 3 O + ] = 7,5 × × 10 −6 M ; C6H5Nh4+C6H5Nh4+ — более сильная кислота.
Соли с основными ионами
В качестве другого примера рассмотрим растворение ацетата натрия в воде:
NaCh4CO2(т)⇋Na+(водн.)+Ch4CO2-(водн.)NaCh4CO2(т)⇋Na+(водн.)+Ch4CO2-(водн.)
Ион натрия не подвергается заметной кислотной или щелочной ионизации и не влияет на рН раствора. Это может показаться очевидным из формулы иона, которая не указывает на атомы водорода или кислорода, но некоторые растворенные ионы металлов действуют как слабые кислоты, как будет рассмотрено далее в этом разделе.
Ацетат-ион, Ch4CO2-,Ch4CO2-, является сопряженным основанием уксусной кислоты, CH 3 CO 2 H, поэтому его реакция ионизации основанием (или гидролизом основания ) представлена как
Ch4CO2-(водн. )+h3O(л)⇌Ch4CO2H(водн.)+OH-(водн.)Kb=Kw/KaCh4CO2-(водн.)+h3O(л)⇌Ch4CO2H(водн.)+OH-(водн.)Kb=Kw /Ка
)+h3O(л)⇌Ch4CO2H(водн.)+OH-(водн.)Kb=Kw/KaCh4CO2-(водн.)+h3O(л)⇌Ch4CO2H(водн.)+OH-(водн.)Kb=Kw /Ка
Поскольку уксусная кислота является слабой кислотой, ее K a можно измерить, а K b > 0 (ацетат-ион является слабым основанием).
Растворение ацетата натрия в воде дает раствор инертных катионов (Na + ) и анионы слабых оснований (Ch4CO2-),(Ch4CO2-), получается основное решение.
Пример 14.16
Равновесие в растворе соли слабой кислоты и сильного основания
Определить концентрацию уксусной кислоты в растворе с [Ch4CO2-]=0,050M[Ch4CO2-]=0,050M и [OH — ] = 2,5 ×× 10 -6 M при равновесии. Реакция:
Ch4CO2-(водн.)+h3O(ж)⇌Ch4CO2H(водн.)+OH-(водн.)Ch4CO2-(водн.)+h3O(ж)⇌Ch4CO2H(водн.)+OH-(водн.)
Решение
Предоставленные равновесные концентрации и значение константы равновесия позволят рассчитать отсутствующую равновесную концентрацию. Рассматриваемый процесс представляет собой базовую ионизацию ацетат-иона, для которой
Рассматриваемый процесс представляет собой базовую ионизацию ацетат-иона, для которой
Kb(для Ch4CO2-)=KwKa(для Ch4CO2H)=1,0×10-141,8×10-5=5,6×10-10Kb(для Ch4CO2-)=KwKa(для Ch4CO2H)=1,0×10-141,8×10-5=5,6× 10−10
Подстановка имеющихся значений в выражение K b дает
Kb=[Ch4CO2H][OH-][Ch4CO2-]=5,6×10-10Kb=[Ch4CO2H][OH-][Ch4CO2 −]=5,6×10−10
=[Ch4CO2H](2,5×10-6)(0,050)=5,6×10-10=[Ch4CO2H](2,5×10-6)(0,050)=5,6×10-10
Решение приведенного выше уравнения для молярные выходы уксусной кислоты [CH 3 CO 2 H] = 1,1 × × 10 -5 M .
Проверьте свои знания
Каков рН 0,083- М раствора NaCN?
Отвечать:
11.11
Соли с кислотными и основными ионами
Некоторые соли состоят как из кислых, так и из основных ионов, поэтому рН их растворов будет зависеть от относительной силы этих двух соединений. Точно так же некоторые соли содержат один амфипротонный ион, поэтому относительная сила кислотного и основного характера этого иона будет определять его влияние на рН раствора. Для обоих типов солей сравнение 9Значения 0027 K
Точно так же некоторые соли содержат один амфипротонный ион, поэтому относительная сила кислотного и основного характера этого иона будет определять его влияние на рН раствора. Для обоих типов солей сравнение 9Значения 0027 K
Пример 14.17
Определение кислотной или основной природы солей
Определите, являются ли водные растворы следующих солей кислыми, основными или нейтральными:
(a) KBr
(b) NaHCO 3
(c) Na 2 HPO 4
(d) NH 4 F
Раствор
Рассмотрим каждый из ионов отдельно с точки зрения его влияния на рН раствора, как показано здесь:
(a) Катион K + инертен и не влияет на pH. Ион брома является сопряженным основанием сильной кислоты, поэтому он имеет незначительную силу основания (отсутствие заметной ионизации основания). Раствор нейтрален.
Ион брома является сопряженным основанием сильной кислоты, поэтому он имеет незначительную силу основания (отсутствие заметной ионизации основания). Раствор нейтрален.
(б) Катион Na + инертен и не влияет на рН раствора; в то время как анион HCO3-HCO3- является амфипротным. K a HCO3-HCO3- равно 4,7 × × 10 −11 , а его K b равно 1,0 × 10–144,3 × 10–7 = 2,3 × 10–8,1,0 × 10– 144,3×10-7=2,3×10-8.
Поскольку K b >> K a , решение простое.
(c) Катион Na + инертен и не будет влиять на рН раствора, тогда как анион HPO42-HPO42- является амфипротным. K a HPO42-HPO42- составляет 4,2 × × 10 −13 ,
и его K b равно 1,0×10-146,2×10-8=1,6×10-7,1,0×10-146,2×10-8=1,6×10-7. Поскольку K b >> K a , решение простое.
Поскольку K b >> K a , решение простое.
(d) Ион Nh5+Nh5+ является кислотным (см. обсуждение выше), а ион F − является основным (сопряженное основание слабокислого HF). Сравнивая две константы ионизации: K a Nh5+Nh5+ составляет 5,6 × × 10 −10 , а K b F − равно 1,6 × × 10 −11 , поэтому раствор кислый, поскольку K a > K b .
Проверьте свои знания
Определите, являются ли водные растворы следующих солей кислыми, основными или нейтральными:
(a) K 2 CO 3
(b) CaCl 2
(c) KH 2 PO 4 NH 90 (
4 900) 21 4 ) 2 СО 3Отвечать:
(а) базовый; (б) нейтральный; (в) кислый; (г) базовый
Ионизация гидратированных ионов металлов
В отличие от ионов металлов групп 1 и 2 из предыдущих примеров (Na + , Ca 2+ и т. д.), некоторые ионы металлов действуют как кислоты в водных растворах. Эти ионы не просто свободно сольватируются молекулами воды при растворении, вместо этого они ковалентно связаны с фиксированным числом молекул воды, образуя комплексный ион (см. главу о координационной химии). Например, растворение нитрата алюминия в воде обычно представляется как
д.), некоторые ионы металлов действуют как кислоты в водных растворах. Эти ионы не просто свободно сольватируются молекулами воды при растворении, вместо этого они ковалентно связаны с фиксированным числом молекул воды, образуя комплексный ион (см. главу о координационной химии). Например, растворение нитрата алюминия в воде обычно представляется как
Al(NO3)3(т)⇌Al3+(водн.)+3NO3-(водн.)Al(NO3)3(тв)⇌Al3+(водн.)+3NO3-(водн.)
Однако на самом деле ион алюминия (III) реагирует с шестью молекулами воды, образуя стабильный комплексный ион, поэтому более точное представление процесса растворения
Al(NO3)3(т)+6h3O(ж)⇌Al(h3O)63+(водн.)+3NO3−(водн.)Al(NO3)3(т)+6h3O(ж)⇌Al(h3O)63+ (водн.)+3NO3-(водн.)
Как показано на рис. 14.13, Al(h3O)63+Al(h3O)63+ ионы включают связи между центральным атомом Al и атомами O шести молекул воды. Следовательно, связи O–H в связанных молекулах воды более полярны, чем в несвязанных молекулах воды, что делает связанные молекулы более склонными к донорству иона водорода:
Al(h3O)63+(водн. )+h3O(ж)⇌h4O+(водн.)+Al(h3O)5(OH)2+(водн.)Ka=1,4×10-5Al(h3O)63+(водн.)+ h3O(ж)⇌h4O+(водн.)+Al(h3O)5(OH)2+(водн.)Ka=1,4×10-5
)+h3O(ж)⇌h4O+(водн.)+Al(h3O)5(OH)2+(водн.)Ka=1,4×10-5Al(h3O)63+(водн.)+ h3O(ж)⇌h4O+(водн.)+Al(h3O)5(OH)2+(водн.)Ka=1,4×10-5
Сопряженное основание, полученное в результате этого процесса, содержит пять других связанных молекул воды, способных действовать как кислоты, поэтому возможна последовательная или ступенчатая передача протонов, как показано в нескольких уравнениях ниже:
Al(h3O)63+(aq )+h3O(ж)⇌h4O+(водн.)+Al(h3O)5(OH)2+(водн.)Al(h3O)63+(водн.)+h3O(ж)⇌h4O+(водн.)+Al(h3O)5 (ОН)2+(водн.)
Al(h3O)5(OH)2+(водн.)+h3O(л)⇌h4O+(водн.)+Al(h3O)4(OH)2+(водн.)Al(h3O)5(OH)2+(водн. )+h3O(ж)⇌h4O+(водн.)+Al(h3O)4(OH)2+(водн.)
Al(h3O)4(OH)2+(водн.)+h3O(ж)⇌h4O+(водн.)+Al(h3O)3(OH)3(водн.)Al(h3O)4(OH)2+(водн.) +h3O(ж)⇌h4O+(водн.)+Al(h3O)3(OH)3(водн.)
Это пример полипротонной кислоты, предмет обсуждения в следующем разделе этой главы.
Рисунок
14.13
Когда ион алюминия реагирует с водой, гидратированный ион алюминия становится слабой кислотой.
Помимо щелочных металлов (группа 1) и некоторых щелочноземельных металлов (группа 2), ионы большинства других металлов в той или иной степени подвергаются кислотной ионизации при растворении в воде. Кислотная сила этих сложных ионов обычно увеличивается с увеличением заряда и уменьшением размера ионов металла. Уравнения кислотной ионизации первой ступени для нескольких других кислых ионов металлов показаны ниже:
Fe(h3O)63+(водн.)+h3O(ж)⇌h4O+(водн.)+Fe(h3O)5(OH)2+(водн.)pKa=2,74Fe(h3O)63+(водн.)+h3O( л)⇌h4O+(водн.)+Fe(h3O)5(OH)2+(водн.)pKa=2,74
Cu(h3O)62+(водн.)+h3O(ж)⇌h4O+(водн.)+Cu(h3O) 5(OH)+(водн.)pKa=~6,3Cu(h3O)62+(водн.)+h3O(ж)⇌h4O+(водн.)+Cu(h3O)5(OH)+(водн.)pKa=~6,3
Zn(h3O)42+(водн.)+h3O(ж)⇌h4O+(водн.)+Zn(h3O)3(OH)+(водн.)pKa=9,6Zn(h3O)42+(водн.)+h3O(ж)⇌ h4O+(водн.)+Zn(h3O)3(OH)+(водн.)pKa=9,6
Пример 14.18
Гидролиз [Al(H
2 O) 6 ] 3+ Рассчитайте рН раствора хлорида алюминия 0,10- М , который полностью растворяется с образованием гидратированного иона алюминия [Al(h3O)6]3+[Al(h3O)6]3+ в растворе.
Раствор
Уравнение реакции и K a : =1,4×10−5Al(h3O)63+(водн.)+h3O(ж)⇌h4O+(водн.)+Al(h3O)5(OH)2+(водн.)Ka=1,4×10−5
ДВС таблица с предоставленной информацией
Подставляя выражения для равновесных концентраций в уравнение для константы ионизации, получаем:
Ka=[h4O+][Al(h3O)5(OH)2+][Al(h3O)63+]Ka=[h4O+ ][Al(h3O)5(OH)2+][Al(h3O)63+]
=(x)(x)0,10−x=1,4×10−5=(x)(x)0,10−x= 1,4×10−5
Предположим, что x << 0,10, и решение упрощенного уравнения дает:
x=1,2×10−3Mx=1,2×10−3M
Таблица ICE определена как равная
7 x к концентрации ионов гидроксония, и, таким образом, pH рассчитывается равным
[h4O+]=0+x=1,2×10-3M[h4O+]=0+x=1,2×10-3M
pH=-log[h4O+]=2,92(кислый раствор)pH=-log[ h4O+]=2,92 (кислый раствор)
Проверьте свои знания
Что такое [Al(h3O)5(OH)2+][Al(h3O)5(OH)2+] в 0,15- М растворе Al(NO 3 ) 3 , который содержит достаточное количество сильной кислоты HNO 3 , чтобы довести [H 3 O + ] до 0,10 M ?
Отвечать:
2,1 ×× 10 −5 М
18.
 3: Эффект общего иона в равновесии растворимости
3: Эффект общего иона в равновесии растворимости- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 24307
Цели обучения
- Распознавать общие ионы различных солей, кислот и оснований.
- Расчет концентраций обычных ионов.
- Расчет концентрации ионов с учетом химического равновесия.
Эффект общего иона используется для описания влияния на равновесие вещества, которое добавляет ион, являющийся частью равновесия.
Введение
Произведения растворимости K sp являются константами равновесия в гетерогенных равновесиях (т. е. между двумя разными фазами). Если в системе присутствует несколько солей, то все они ионизируются в растворе. Если соли содержат общий катион или анион, то эти соли способствуют концентрации общего иона. Вклады всех солей должны быть включены в расчет концентрации общего иона. Например, в растворе, содержащем хлорид натрия и хлорид калия, соотношение будет следующим: 9-]} \label{1}\]
Если соли содержат общий катион или анион, то эти соли способствуют концентрации общего иона. Вклады всех солей должны быть включены в расчет концентрации общего иона. Например, в растворе, содержащем хлорид натрия и хлорид калия, соотношение будет следующим: 9-]} \label{1}\]
Рассмотрение баланса заряда или баланса массы или обоих приводит к одному и тому же выводу. Выражение произведения растворимости говорит нам, что равновесные концентрации катиона и аниона обратно пропорциональны. То есть по мере увеличения концентрации аниона максимальная концентрация катиона, необходимая для осаждения, уменьшается, и наоборот, так что K sp остается постоянным. Следовательно, растворимость ионного соединения зависит от концентрации других солей, содержащих те же ионы. Добавление общего катиона или аниона сдвигает равновесие растворимости в направлении, предсказываемом принципом Ле Шателье. В результате растворимость любой труднорастворимой соли почти всегда снижается из-за присутствия растворимой соли, содержащей обычный ион. Исключения обычно связаны с образованием комплексных ионов, что обсуждается позже. 9+] = 0,10\: \ce M}\nonumber.\]
Исключения обычно связаны с образованием комплексных ионов, что обсуждается позже. 9+] = 0,10\: \ce M}\nonumber.\]
но
\[\begin{alignat}{3}
&\ce{[Cl- ]} &&= && && \:\textrm{0,10 (из-за NaCl)}\nonumber \\
& && && + &&\mathrm{\:0.20\: (из-за\: to\: CaCl_2)}\nonumber\\
& && && + &&\mathrm{\:0.10 \: (должно\: to\: HCl)}\nonumber\\
& &&= && &&\mathrm{\:0.40\: M}\nonumber
\end{alignat}\]
Упражнение \(\PageIndex{ 1}\) 9-] = \dfrac{0,1\: M\умножить на 10\: мл+0,2\: M\умножить на 5,0\: мл}{100,0\: мл} = 0,020\: M}\номер\]
Принцип Ле Шателье утверждает что если равновесие нарушается, реакция смещается, чтобы восстановить равновесие. Если к равновесию слабой кислоты или слабого основания добавить обычный ион, то равновесие сместится в сторону реагентов, в данном случае слабой кислоты или основания.
Пример \(\PageIndex{2}\)
Рассмотрим концентрацию ионов свинца(II) в этом насыщенном 9- \; (aq)\nonumber \]
Что произойдет с этим равновесием, если добавить дополнительные ионы хлорида? Согласно Le Châtelier , , положение равновесия сместится, чтобы противостоять изменению, в данном случае за счет удаления ионов хлорида путем получения дополнительного твердого хлорида свинца (II).
Конечно, концентрация ионов свинца(II) в растворе настолько мала, что лишь незначительная часть дополнительных ионов хлорида может быть преобразована в твердый хлорид свинца(II). Хлорид свинца (II) становится даже менее растворим , а концентрация ионов свинца(II) в растворе снижается . Этот тип реакции возникает с любым труднорастворимым веществом: оно менее растворимо в растворе, содержащем какой-либо общий для него ион. Это обычный ионный эффект.
Простой пример
Если попытаться растворить некоторое количество хлорида свинца(II) в каком-нибудь 0,100 М растворе хлорида натрия, а не в воде, какова будет на этот раз равновесная концентрация ионов свинца(II)? Как и прежде, определим s как концентрацию ионов свинца(II). 9{2+}] = s \label{2}\]
Вычисления отличаются от предыдущих. На этот раз концентрация ионов хлорида определяется концентрацией раствора хлорида натрия. Количество ионов, поступающих из хлорида свинца (II), будет крошечным по сравнению с 0,100 М, поступающими из раствора хлорида натрия. При подобных расчетах можно предположить, что концентрация общего иона полностью обусловлена другим раствором. Это упрощает расчет.
При подобных расчетах можно предположить, что концентрация общего иона полностью обусловлена другим раствором. Это упрощает расчет.
Концентрация ионов свинца(II) уменьшилась примерно в 10 раз. При использовании более концентрированных растворов хлорида натрия растворимость уменьшается дальше.
Добавление обычного иона в равновесную систему влияет на равновесный состав, но не на константу ионизации.
Эффект общего иона со слабыми кислотами и основаниями
Добавление общего иона предотвращает ионизацию слабой кислоты или слабого основания в той же степени, что и без добавления общего иона. Эффект общего иона подавляет ионизацию слабой кислоты за счет добавления большего количества иона, который является продуктом этого равновесия.
Пример \(\PageIndex{3}\)
Эффект обычного иона H 3 O + на ионизацию уксусной кислоты
Эффект обычного иона подавляет ионизацию слабого основания путем добавления больше иона, который является продуктом этого равновесия. {-5}\) не меняется. Реакция выведена из равновесия или равновесия. 9-]}{[NH_3]}\nonumber \]
{-5}\) не меняется. Реакция выведена из равновесия или равновесия. 9-]}{[NH_3]}\nonumber \]
Сначала, когда добавляется больше гидроксида, частное больше константы равновесия. Затем реакция сдвигается вправо, вызывая увеличение знаменателя, уменьшение отношения реакции и приближение к равновесию, вызывая уменьшение \(Q\) в направлении \(K\).
Влияние общего иона на растворимость
Рассмотрим, например, эффект добавления растворимой соли, такой как CaCl 2 , к насыщенному раствору фосфата кальция [Ca 9{3-}}\]
в соответствии со стехиометрией, показанной в уравнении \(\ref{Eq1}\) (пренебрегая гидролизом с образованием HPO 4 2 — ). Если CaCl 2 добавить к насыщенному раствору Ca 3 (PO 4 ) 2 , концентрация ионов Ca 2 + увеличится так, что 3,42 × 10 −7 M, что делает Q > K sp . Единственный способ, которым система может вернуться к равновесию, — это чтобы реакция в уравнении \(\ref{Eq1}\) протекала влево, что приводило к осаждению \(\ce{Ca3(PO4)2}\). Это снизит концентрацию как Ca 2 + и PO 4 3 − до Q = K sp .
Это снизит концентрацию как Ca 2 + и PO 4 3 − до Q = K sp .
Добавление общего иона снижает растворимость, так как реакция смещается влево, чтобы снять напряжение избытка продукта. Добавление общего иона к реакции диссоциации вызывает сдвиг равновесия влево, в сторону реагентов, вызывая осаждение.
Пример \(\PageIndex{5}\)
Рассмотрим реакцию:
9{-5}\nonumber\]Идентифицируйте общий ион: Cl -
Примечание: Q sp > K sp Добавление NaCl вызвало смещение реакции из равновесия, поскольку имеется больше диссоциированные ионы. Как правило, для определения молярности требуется допущение, что растворимость PbCl 2 эквивалентна полученной концентрации Pb 2 + , поскольку они находятся в соотношении 1:1.
Поскольку K sp для реакции составляет 1,7×10 -5 , общая реакция будет (s)(2s) 2 = 1,7×10 -5 . Решение уравнения для s дает s= 1,62×10 -2 M. Коэффициент при Cl — равен 2, поэтому предполагается, что Cl — производится в два раза больше, чем Pb 2 + , отсюда и «2s». Константу равновесия растворимости можно использовать для определения молярности ионов в состоянии равновесия.
Решение уравнения для s дает s= 1,62×10 -2 M. Коэффициент при Cl — равен 2, поэтому предполагается, что Cl — производится в два раза больше, чем Pb 2 + , отсюда и «2s». Константу равновесия растворимости можно использовать для определения молярности ионов в состоянии равновесия.
Молярность добавленных Cl — будет 0,1 М, поскольку Na 9-]\номер\\ &\приблизительно & 0,1 М \end{eqnarray} \]
Обратите внимание, что молярность Pb 2 + ниже при добавлении NaCl. Константа равновесия остается неизменной из-за увеличения концентрации иона хлора. Для упрощения реакции можно предположить, что [Cl — ] составляет примерно 0,1 М, так как образование хлорид-иона при диссоциации хлорида свинца очень мало. Коэффициент реакции для PbCl 2 больше константы равновесия из-за добавленного Cl — . Следовательно, это сдвигает реакцию влево к равновесию, вызывая осаждение и снижая текущую растворимость реакции. В целом растворимость реакционной смеси снижается при добавлении хлорида натрия.
В целом растворимость реакционной смеси снижается при добавлении хлорида натрия.
Эффект общего иона обычно снижает растворимость труднорастворимой соли.
Пример \(\PageIndex{6}\)
Рассчитать растворимость фосфата кальция [Ca 3 (PO 4 ) 2 ] в 0,20 М CaCl 2 .
Дано: концентрация CaCl 2 раствор
Запрошено: растворимость Ca 3 (PO 4 ) 2 902 раствор 1 CaCl 0005
Стратегия:
- Напишите сбалансированное уравнение равновесия для растворения Ca 3 (PO 4 ) 2 . Занесите в таблицу концентрации всех видов, образовавшихся в растворе.
- Подставьте соответствующие значения в выражение для произведения растворимости и рассчитайте растворимость Ca 3 (ПО 4 ) 2 .
Решение
A Сбалансированное уравнение равновесия приведено в следующей таблице. Если мы примем x равным растворимости Ca 3 (PO 4 ) 2 в молях на литр, то изменение [Ca 2 + ] снова будет +3 x . и изменение в [PO 4 3 − ] равно +2 x . Мы можем вставить эти значения в таблицу ICE. 9{3−}_{4(водн.)}\]
Если мы примем x равным растворимости Ca 3 (PO 4 ) 2 в молях на литр, то изменение [Ca 2 + ] снова будет +3 x . и изменение в [PO 4 3 − ] равно +2 x . Мы можем вставить эти значения в таблицу ICE. 9{3−}_{4(водн.)}\]
| Ca 3 (PO 4 ) 2 | [Ca 2 + ] | [ПО 4 3 − ] | |
| начальный | чистое твердое вещество | 0,20 | 0 |
| смена | — | +3 x | +2 x |
| окончательная | чистое твердое вещество | 0,20 + 3 х | 2 x |
B Выражение K sp выглядит следующим образом:
K sp = [Ca 2 4 + 90] 3 3 [ПО 4 9{-16}\textrm{ M}\end{align*}\]
Это значение представляет собой растворимость Ca 3 (PO 4 ) 2 в 0,20 М CaCl 2 при 25°C. Это примерно на девять порядков меньше, чем его растворимость в чистой воде, как и следовало ожидать, исходя из принципа Ле Шателье. За одним исключением, этот пример идентичен примеру \(\PageIndex{2}\) — здесь исходное значение [Ca 2 + ] равно 0,20 М, а не 0.
Это примерно на девять порядков меньше, чем его растворимость в чистой воде, как и следовало ожидать, исходя из принципа Ле Шателье. За одним исключением, этот пример идентичен примеру \(\PageIndex{2}\) — здесь исходное значение [Ca 2 + ] равно 0,20 М, а не 0.
Упражнение \(\PageIndex{4}\ )
Рассчитайте растворимость карбоната серебра в 0,25 М растворе карбоната натрия. Растворимость карбоната серебра в чистой воде составляет 8,45·10 -12 при 25°С.
- Ответить
2,9 × 10 −6 M (по сравнению с 1,3 × 10 −4 M в чистой воде)
Эффект общего иона в продуктах растворимости: https://youtu.be/_P3wozLs0Tc
Резюме
Добавление общего катиона или общего аниона к раствору малорастворимой соли сдвигает равновесие растворимости в направлении, предсказанном Принцип Ле Шателье.

 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав
Leave A Comment