Амфотерные неорганические и органические соединения МОУ «Гатчинская СОШ №2» Учитель химии: Г.Г.Павлова Учитель инфор
Содержание ▲
- Амфотерные неорганические и органические…
- 1. Верное утверждение о значении понятия…
- 2. Некоторый элемент образует три типа оксидов…
- 3. В щелочном растворе аминоуксусная кислота…
- 4. Какое из утверждений неверно? 1) Амфотерные…
- 5. Лишняя формула: 1) h3ZnO2;…
- 6. К амфотерным гидроксидам не относят вещество,…
- 7. При добавлении избытка раствора гидроксида…
- 8. При взаимодействии свежеприготовленного осадка…
- 9. Свойство аминокислот, обусловленное наличием в…
- 10. Химическое свойство аминокислот, которое не…
- 11. Синтетические полиамидные волокна являются…
- 12. Антраниловая кислота широко применяется в…
- 13. Поликонденсация приводит к образованию…
- 14. Молекула воды может являться как донором, так…
- 15. Ионное уравнение реакции [Zn(OH)4]2- + 2Н+ =…
- 16.
 При пропускании постоянного электрического…
При пропускании постоянного электрического… - 17. Элемент, для которого справедливо…
- 18. Органическое вещество лизин имеет следующую…
- 19. В растворе с рН<7…
- 20. При взаимодействии 1 моль гидроксида алюминия…
- 21. Минерал, не содержащий амфотерного оксида: 1)…
- 22. Амфотерные свойства проявляет вещество,…
- 23. Гидроксид меди (II) растворяется в растворе…
- Ответы …
- Скачать
- Похожие презентации
Вы можете ознакомиться и скачать
Амфотерные неорганические и органические соединения МОУ «Гатчинская СОШ №2» Учитель химии: Г.Г.Павлова Учитель инфор.
Презентация содержит 25 слайдов.
Презентации для любого
класса можно скачать бесплатно. Если материал и наш сайт презентаций Вам
понравились
–
поделитесь им с друзьями с помощью социальных кнопок и добавьте в закладки в
своем
браузере.
Слайд 1
Описание слайда:
Амфотерные неорганические и органические соединения МОУ «Гатчинская СОШ №2» Учитель химии: Г.Г.Павлова Учитель информатики: Д.П.Панасюк
Слайд 2
Описание слайда:
1. Верное утверждение о значении понятия «амфотерность»:
1) преобладание кислотных свойств вещества над основными;
2) проявление веществом как кислотных, так и основных свойств;
3) способность вещества диссоциировать с отщеплением как катиона водорода, так и гидроксид-аниона;
4) способность амфотерных веществ взаимодействовать друг с другом.
Слайд 3
Описание слайда:
2. Некоторый элемент образует три типа оксидов (основный, амфотерный и кислотный). Степень окисления элемента в амфотерном оксиде будет: 1) минимальной; 3) промежуточной между минимальной и максимальной; 2) максимальной; 4) нулевой. Схема строения атома химического элемента хрома: Cr +24 ) ) ) ) 2 8 13 1 +2 СrO – основный оксид +3 Сr2O3-2 — амфотерный оксид +6 СrO3 — кислотный оксид Ответ: 3
Слайд 4
Описание слайда:
3. В щелочном растворе аминоуксусная кислота существует в виде частиц:
1) h4N+ – Ch3 – COOH; 3) h4N+ – Ch3 – COO-;
2) h3N – Ch3 – COO-; 4) h3N – Ch3– COOH.
+ H+ OH-
Nh4 – Ch3 – COOH ↔ Nh4 – Ch3 – COOH ↔ Nh4 – Ch3 – COOH
Ответ: 2
В щелочном растворе аминоуксусная кислота существует в виде частиц:
1) h4N+ – Ch3 – COOH; 3) h4N+ – Ch3 – COO-;
2) h3N – Ch3 – COO-; 4) h3N – Ch3– COOH.
+ H+ OH-
Nh4 – Ch3 – COOH ↔ Nh4 – Ch3 – COOH ↔ Nh4 – Ch3 – COOH
Ответ: 2
Слайд 5
Описание слайда:
4. Какое из утверждений неверно?
1) Амфотерные оксиды взаимодействуют с растворами щелочей;
2) амфотерные гидроксиды реагируют с растворами сильных кислот;
3) органических амфотерных соединений не существует;
4) амфотерным оксидам соответствуют амфотерные гидроксиды.
Аминокислоты – амфотерные органические соединения. Карбоксильная группа (- СООН)
обуславливает кислотные свойства, аминогруппа (- Nh3) – основные (см.
Слайд 6
Описание слайда:
5. Лишняя формула: 1) h3ZnO2; 2) ZnCI2; 3) ZnO; 4) Zn(OH)2. h3ZnO2 и Zn(OH)2 – соответственно кислотная и основная формы гидроксида цинка и соответствующий гидроксиду цинка – оксид цинка ZnO, ZnCI2 – соль. Ответ: 2
Слайд 7
Описание слайда:
6. К амфотерным гидроксидам не относят вещество, имеющее формулу:
1) Be(OH)2; 3) K2[Zn(OH)4];
2) Pb(OH)2; 4)Cu(OH)2. K2[Zn(OH)4] – тетрагидроксоцинкат калия – комплексная соль.
Ответ: 3
K2[Zn(OH)4] – тетрагидроксоцинкат калия – комплексная соль.
Ответ: 3
Слайд 8
Описание слайда:
7. При добавлении избытка раствора гидроксида калия к раствору хлорида алюминия происходят следующие превращения: 1) вначале образуется осадок гидроксида алюминия, который затем растворяется с образованием комплексной соли – тетрагидроксоалюмината калия; 2) образуется осадок гидроксида алюминия; 3) сначала видимых изменений не наблюдается, затем образуется осадок гидроксида алюминия; 4) вначале образуется осадок гидроксида алюминия, который затем растворяется с образованием соли – метаалюмината калия. AICI3 + KOH → AI(OH)3↓ + 3HCI гидроксид алюминия AI3+ + 3OH- = AI(OH)3 AI(OH)3 + KOH → K[AI(OH)4] гидроксоалюминат калия образуется при растворении осадка AI(OH)3 в растворе KOH AI(OH)3 + OH- = [AI(OH)4] Ответ: 1
Слайд 9
Описание слайда:
8.
Слайд 10
Описание слайда:
9. Свойство аминокислот, обусловленное наличием в их молекуле аминогруппы: 1) Образованием сложных эфиров; 3) взаимодействие со щелочами; 2) взаимодействие с неорганическими кислотами; 4) способность к отщеплению катиона водорода. Nh3 – Ch3 – COOH + HCI → [Nh4 – Ch3 – COOH]- CI- Ответ: 2
Слайд 11
Описание слайда:
10. Химическое свойство аминокислот, которое не обусловлено наличием в их молекуле карбоксильной группы:
1) Взаимодействие со спиртами; 3) взаимодействие со щелочами;
2) взаимодействие с неорганическими кислотами; 4) способность к отщеплению катиона водорода.
Ответ: 2
Химическое свойство аминокислот, которое не обусловлено наличием в их молекуле карбоксильной группы:
1) Взаимодействие со спиртами; 3) взаимодействие со щелочами;
2) взаимодействие с неорганическими кислотами; 4) способность к отщеплению катиона водорода.
Ответ: 2
Слайд 12
Описание слайда:
11. Синтетические полиамидные волокна являются производными аминокислот со следующим расположением функциональных групп – аминогруппы – Nh3 и карбоксильной группы – СООН: 1) непосредственно связанными друг с другом; 3) разделёнными несколькими атомами углерода; 2) находящимися у одного атома углерода; 4) расположенными на концах углеродной цепи. O ξ δ γ β α || Nh3 – Ch3 – Ch3 – Ch3 – Ch3 – Ch3 — C – OH → (- Nh3 – Ch3 – Ch3 – Ch3 – Ch3 – Ch3 — CO — )n ξ – аминокапроновая кислота Ответ: 4
Слайд 13
Описание слайда:
12. Антраниловая кислота широко применяется в производстве красителей, душистых и лекарственных веществ и по своей химической природе является амфотерным соединением. Найдите формулу этой кислоты среди приведённых ниже:
1) СООН 2) СООН 3) СООН 4)СООН
Nh3 NO2 Ch4
СООН
СООН
Nh3
Данная формула соответствует антраниловой кислоте, которая по своей природе является
амфотерным соединением, так как содержит карбоксильную (- СООН) и амино (- Nh3)
группы.
Антраниловая кислота широко применяется в производстве красителей, душистых и лекарственных веществ и по своей химической природе является амфотерным соединением. Найдите формулу этой кислоты среди приведённых ниже:
1) СООН 2) СООН 3) СООН 4)СООН
Nh3 NO2 Ch4
СООН
СООН
Nh3
Данная формула соответствует антраниловой кислоте, которая по своей природе является
амфотерным соединением, так как содержит карбоксильную (- СООН) и амино (- Nh3)
группы. Ответ: 1
Ответ: 1
Слайд 14
Описание слайда:
13. Поликонденсация приводит к образованию полипептидов. Обратную реакцию называют: 1) деполиконденсация; 3) гидролиз; 2) деполимеризация; 4) гидратация. n Nh3 — CH – COOH → — NH – CH – CO — и nh3O | | R R Реакция поликонденсации, обратная реакция – деполиконденсация. Ответ: 1
Слайд 15
Описание слайда:
14. Молекула воды может являться как донором, так и акцептором протона, превращаясь при этом соответственно в ионы:
1) гидроксид-анион и катион гидроксония;
2) катион гидроксония и гидроксид-анион;
3) катион водорода и гидроксид-анион;
4) гидроксид-анион и катион водорода.
Nh4 + h3O ↔ Nh5+ + OH-
донор протона
HCI + h3O ↔ h4O+ + CI-
акцептор протона
Ответ: 1
Молекула воды может являться как донором, так и акцептором протона, превращаясь при этом соответственно в ионы:
1) гидроксид-анион и катион гидроксония;
2) катион гидроксония и гидроксид-анион;
3) катион водорода и гидроксид-анион;
4) гидроксид-анион и катион водорода.
Nh4 + h3O ↔ Nh5+ + OH-
донор протона
HCI + h3O ↔ h4O+ + CI-
акцептор протона
Ответ: 1
Слайд 16
Описание слайда:
15. Ионное уравнение реакции [Zn(OH)4]2- + 2Н+ = Zn(OH)2 + 2Н2О соответствует взаимодействию между: 1) гидроксидом цинка и соляной кислотой; 2) тетрагидроксоцинкатом натрия и азотистой кислотой; 3) тетрагидроксоцинкатом калия и серной кислотой; 4) оксидом цинка и азотной кислотой. Zn(OH)2 + НСI→ ZnСI2 + 2h3O Zn(OH)2 + Н+ → Zn2+ + 2h3O Na[Zn(OH)4] + 2HNO2 → Zn(OH)2 + 2NaNO2 + 2h3O слабый электролит [Zn(OH)4]2- + 2HNO2 → Zn(OH)2 + 2NO2- + 2h3O Na2[Zn(OH)4] + 2h3SO4 → Zn(OH)2 + 2Na2SO4 + 2h3O [Zn(OH)4]2- + 2H+ → Zn(OH)2 + 2h3O ZnO + 2HNO3 → Zn(Oh4)2 + h3O ZnO + + 2H+ → Zn2+ + 2h3O Ответ: 3
Слайд 17
Описание слайда:
16. При пропускании постоянного электрического тока через водный раствор (аланина) частицы растворённого вещества:
1) движутся к катоду; 3) движутся и к катоду, и к аноду;
2) движутся к аноду; 4) не движутся ни к катоду, ни к аноду.
+ —
Nh3 – Ch3 – COOH ↔ Nh4 – Ch3 – COO
В растворе аминоуксусной кислоты существует биполярный ион.
Ответ: 4
При пропускании постоянного электрического тока через водный раствор (аланина) частицы растворённого вещества:
1) движутся к катоду; 3) движутся и к катоду, и к аноду;
2) движутся к аноду; 4) не движутся ни к катоду, ни к аноду.
+ —
Nh3 – Ch3 – COOH ↔ Nh4 – Ch3 – COO
В растворе аминоуксусной кислоты существует биполярный ион.
Ответ: 4
Слайд 18
Описание слайда:
17. Элемент, для которого справедливо утверждение: «С увеличением степени окисления элемента в оксиде его характер изменяется от основного через амфотерный к кислотному»:
1) Хлора; 2) серы; 3) хрома; 4) алюминия. +2 +3 +6
СrO → Cr2O3 → CrO3
основный амфотерный кислотный
оксид оксид оксид
Ответ: 3
+2 +3 +6
СrO → Cr2O3 → CrO3
основный амфотерный кислотный
оксид оксид оксид
Ответ: 3
Слайд 19
Описание слайда:
18. Органическое вещество лизин имеет следующую формулу: h3N – Сh3 — Ch3 – Ch3 – Ch3 – CH – COOH.
|
Nh3
Какое из утверждений верно?
1) Лизин не проявляет амфотерных свойств;
2) лизин проявляет амфотерные свойства с преобладанием основных;
3) лизин проявляет амфотерные свойства с преобладанием кислотных;
4) лизин не является аминокислотой. Аминокислота лизин, содержит одну карбоксильную группу (кислотные свойства) и две
аминогруппы (основные свойства). Лизин проявляет амфотерные свойства с
преобладанием основных.
Ответ: 2
Аминокислота лизин, содержит одну карбоксильную группу (кислотные свойства) и две
аминогруппы (основные свойства). Лизин проявляет амфотерные свойства с
преобладанием основных.
Ответ: 2
Слайд 20
Описание слайда:
19. В растворе с рН<7 α-аминопропионовая кислота существует в виде: 1) катиона; 3) биполярного иона; 2) аниона; 4) молекулы. + Nh3 – Ch3 – COOH + H+ ↔ Nh4 – Ch3 COOH | | Ch4 Ch4 Ответ: 1
Слайд 21
Описание слайда:
20. При взаимодействии 1 моль гидроксида алюминия с раствором, содержащим 1 моль серной кислоты, образуется:
1) кислая соль; 2) средняя соль; 3) основная соль; 4) комплексная соль.
2AI(OH)3 + h3SO4 → [AI(OH)2]2SO4 + 2h3O
2 моль 1 моль дигидроксосульфат алюминия
Ответ: 3
При взаимодействии 1 моль гидроксида алюминия с раствором, содержащим 1 моль серной кислоты, образуется:
1) кислая соль; 2) средняя соль; 3) основная соль; 4) комплексная соль.
2AI(OH)3 + h3SO4 → [AI(OH)2]2SO4 + 2h3O
2 моль 1 моль дигидроксосульфат алюминия
Ответ: 3
Слайд 22
Описание слайда:
21. Минерал, не содержащий амфотерного оксида: 1) корунд; 3) сапфир; 2) рубин; 4) криолит. Криолит — 3NaF∙ AIF3 или Na3[AIF6]. Корунд, рубин, сапфир в качестве основного компонента содержат AI2O3. Ответ: 4
Слайд 23
Описание слайда:
22. Амфотерные свойства проявляет вещество, формула которого:
1) h3N – (Ch3)6 – Nh3; 3) O2N – Ch3 – COOH;
2) h3N – CH – COOH; 4) C6H5 – Ch3 — Nh3.
|
Ch3 – C6H5
Вещество, формула которого h3N – CH – COOH, проявляет амфотерные свойства, так как в
|
Ch3 – C6H5
его молекуле присутствует карбоксильная группа – СООН (кислотные свойства) и
аминогруппа – Nh3 (основные свойства).
Ответ: 2
Амфотерные свойства проявляет вещество, формула которого:
1) h3N – (Ch3)6 – Nh3; 3) O2N – Ch3 – COOH;
2) h3N – CH – COOH; 4) C6H5 – Ch3 — Nh3.
|
Ch3 – C6H5
Вещество, формула которого h3N – CH – COOH, проявляет амфотерные свойства, так как в
|
Ch3 – C6H5
его молекуле присутствует карбоксильная группа – СООН (кислотные свойства) и
аминогруппа – Nh3 (основные свойства).
Ответ: 2
Слайд 24
Описание слайда:
23. Гидроксид меди (II) растворяется в растворе вещества, формула которого:
1) KOH; 3) Nh4;
2) h3SO4; 4) все приведённые ответы верны. Cu(OH)2 обладает слабыми амфотерными свойствами (реагирует с кислотами и щелочами):
сплавление
1. Cu(OH)2 + h3SO4 ——————→ CuSO4 + 2h3O
2. Cu(OH)2 + 2KOH → K2[Cu(OH)4]+ 2h3O
тетрагидроксокупрат калия
Cu(OH)2 растворяется в водном растворе аммиака
Cu(OH)2 + 4Nh4 ∙ h3O → [Cu(Nh4)4](OH)2 + 4h3O
гидроксид тетраамминмеди (II)
Ответ: 4
Cu(OH)2 обладает слабыми амфотерными свойствами (реагирует с кислотами и щелочами):
сплавление
1. Cu(OH)2 + h3SO4 ——————→ CuSO4 + 2h3O
2. Cu(OH)2 + 2KOH → K2[Cu(OH)4]+ 2h3O
тетрагидроксокупрат калия
Cu(OH)2 растворяется в водном растворе аммиака
Cu(OH)2 + 4Nh4 ∙ h3O → [Cu(Nh4)4](OH)2 + 4h3O
гидроксид тетраамминмеди (II)
Ответ: 4
Слайд 25
Описание слайда:
Ответы
404 Cтраница не найдена
Мы используем файлы cookies для улучшения работы сайта МГТУ и большего удобства его использования. Более подробную информацию об использовании файлов cookies можно найти здесь.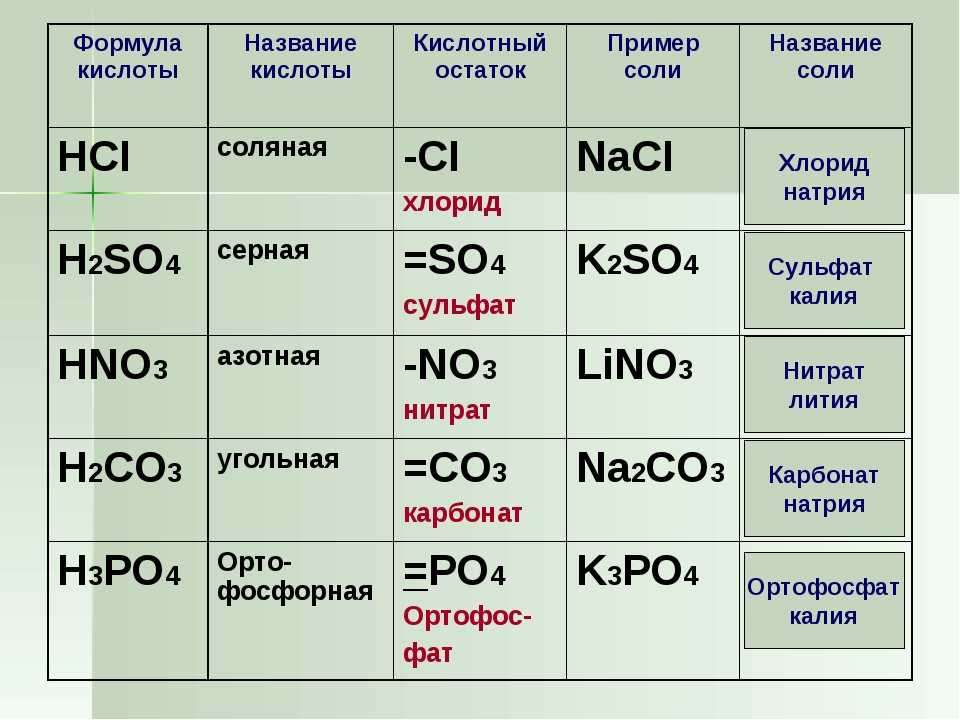 Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Разница между кислотой и основанием (со сравнительной таблицей)
Такие вещества, которые отдают свой ион водорода (H + ) (донор протонов) и принимают электрон другому, называются кислотами .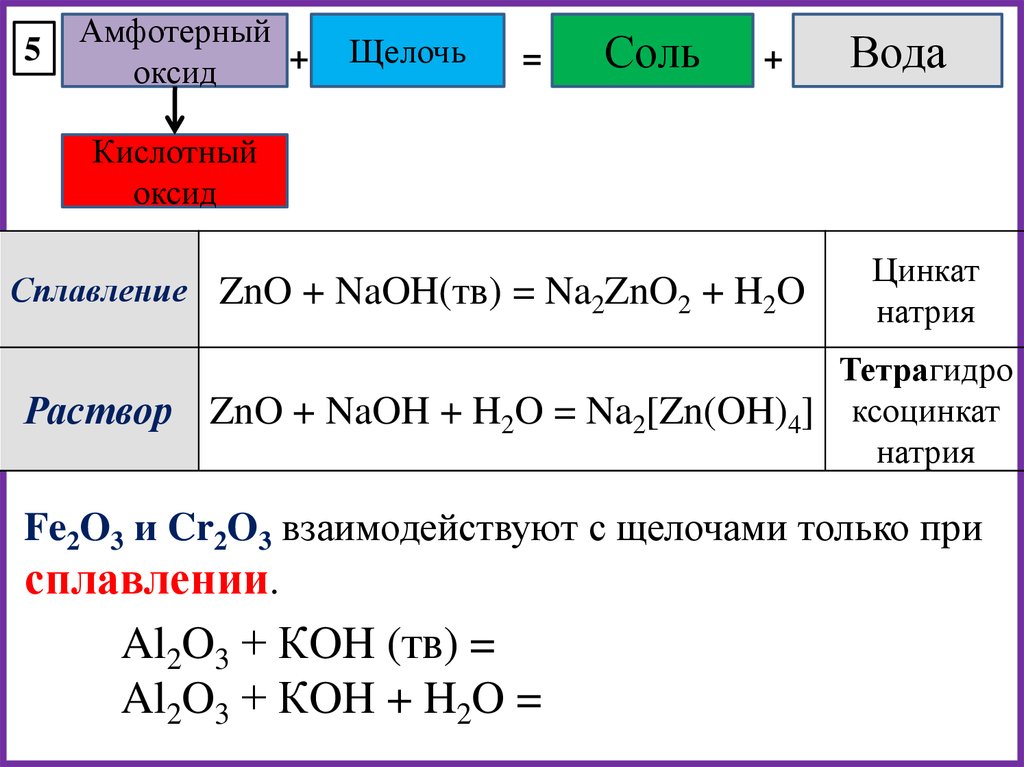 Они имеют рН менее 7,0 . Но такие вещества, которые принимают протон и отдают электрон, называются основанием . Они имеют рН более 7,0 . Кислоты кислые, а основания горькие.
Они имеют рН менее 7,0 . Но такие вещества, которые принимают протон и отдают электрон, называются основанием . Они имеют рН более 7,0 . Кислоты кислые, а основания горькие.
Кислоты и основания являются одной из важнейших частей химии, но также играют важную роль в другой области науки. Существует много определений, которые различают вещества как кислоты и основания, но наиболее общепринятыми являются теория Аррениуса, теория Бренстеда-Лоури и теория кислоты/основания Льюиса. Вместе кислоты и основания реагируют с образованием солей.
Кислоты и щелочи повсюду, от мыла, используемого во время душа, до лимонной кислоты или уксуса на кухне. Хотя иногда бывает трудно различить их и, таким образом, проверить, были предоставлены определенные теории, которые обсуждаются ниже вместе с кратким описанием.
Содержимое: кислота против основания
- Сравнительная таблица
- Определение
- Ключевые отличия
- Заключение
Сравнительная таблица
| Основа для сравнения | Кислоты | Основания |
|---|---|---|
| Arrhenius Concept | Кислота – это вещество, которое при растворении в воде увеличивает концентрацию ионов Н+. | Основание – это вещество, при растворении в воде повышающее концентрацию ионов ОН-. |
| Концепция Bronsted-Lowry | Кислоты являются донорами протонов. | Основания являются акцепторами протонов. |
| Концепция Льюиса | Такие вещества, которые принимают пару электронов (электрофилы) и имеют вакантные орбитали, известны как кислоты Льюиса. | Такие частицы, которые отдают пару электронов (нуклеофилы) и имеют неподеленную пару электронов, известны как основания Льюиса. |
| Химическая формула | Такое соединение, химическая формула которого начинается с H, например HCl (соляная кислота), h4BO3 (борная кислота), Ch3O3 (угольная кислота ). Хотя Ch4COOH (уксусная кислота) является исключением. | Такие соединения, химическая формула которых заканчивается на ОН, например КОН (гидроксид калия), NaOH (гидроксид натрия). |
| Шкала pH (концентрация ионов водорода в растворе) | Менее 7. | Более 7. |
| Физические характеристики | Кислый вкус. | Горький на вкус. |
| Вызывает жжение. | Без запаха (кроме аммиака). | |
| Кислоты обычно липкие. | Основания скользкие. | |
| Реагирует с металлами с образованием газообразного водорода. | Реагирует с жирами и маслами. | |
| Фенолфталеин Индикатор | Остается бесцветным. | Придает розовый цвет. |
| Лакмусовая бумажка | Превращает синюю лакмусовую бумажку в красную. | Превращает красную лакмусовую бумажку в синюю. |
| Прочность | Зависит от концентрации ионов гидроксония. | Зависит от концентрации гидроксид-ионов. |
| Диссоциация при смешивании с водой | Кислоты диссоциируют с образованием свободных ионов водорода (H+) после смешивания с водой. | Основания диссоциируют с образованием свободных ионов гидроксида (ОН-) после смешивания с водой. |
| Примеры | Соляная кислота (HCl), Серная кислота (h3SO4), Азотная кислота (HNO3), Угольная кислота (h3CO3). | Гидроксид аммония (Nh5OH), Гидроксид кальция (Ca(OH)2), Гидроксид натрия (NaOH). |
| Применение | Используется в качестве консервантов, удобрений, в качестве консервантов, в качестве газированных напитков, при обработке кожи, бытовой химии, производстве газированных напитков, ароматизаторов пищевых продуктов и т. д. | Используется в желудочной медицине (антациды), мыло, моющие средства, чистящие средства , дезодорант-антиперспирант для подмышек, неопасная щелочь для нейтрализации кислых сточных вод, нейтрализует кислотность почвы. |
Определение кислоты
Слово кислота происходит от латинского слова «кислоты» или «acere», что означает «кислый». Кислота — это химическое вещество, которое принимает электроны и отдает ионы водорода или протоны. Большинство кислот, содержащих атомы, связанные водородной связью, в воде диссоциируют с образованием катионов и анионов.
Кислотность измеряется присутствием некоторого количества ионов водорода, поэтому чем выше концентрация ионов водорода, тем выше кислотность и ниже рН растворов. Измеряется по шкале между 1-7 (7 — нейтральный) по шкале рН-метра .
Некоторые кислоты сильные, а некоторые слабые. К сильным кислотам относятся те, которые полностью диссоциируют в воде, например, соляная кислота, которая при растворении в воде полностью диссоциирует на ионы. Такие кислоты, которые частично диссоциируют в воде и, следовательно, раствор содержит воду, кислоту и ионы, называются слабыми кислотами , например уксусная кислота.
В основном кислоты определяются разными способами, но допустимы кислоты Аррениуса или Бренстеда-Лоури. Хотя кислота Льюиса называется «кислотой Льюиса», поскольку эти определения не включают один и тот же набор молекул.
Arrhenius Concept – можно определить как вещество, которое при добавлении в воду увеличивает концентрацию иона водорода (H + ) и называется кислотой.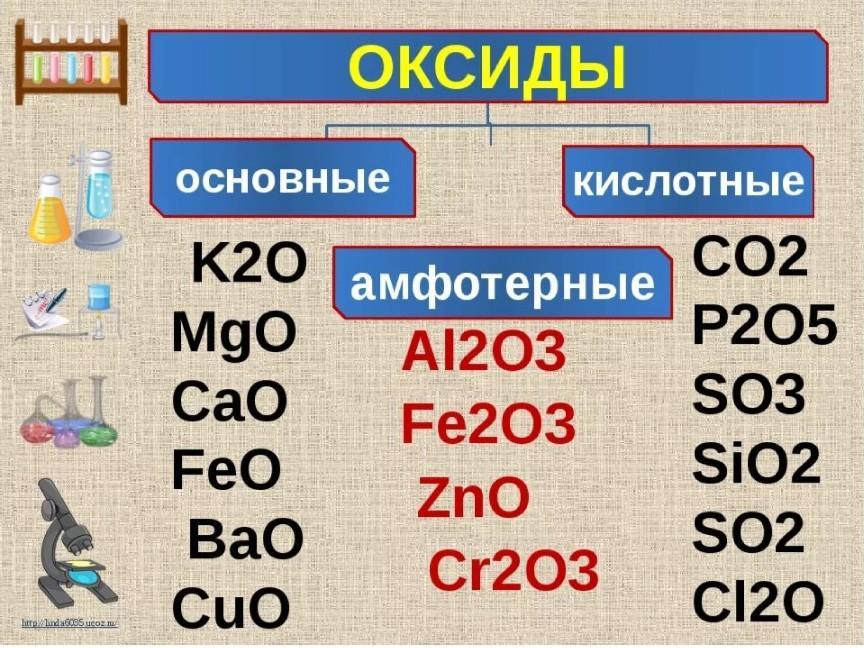
Концепция Bronsted-Lowry – В этом случае кислота выступает в качестве донора протонов. Эта теория определяет вещества, не растворяющиеся в воде, поэтому она широко используется и принимается.
Кислота Льюиса – Существуют определенные соединения, которые не содержат атома водорода, но квалифицируются как кислоты, такие как трифторид бора, трихлорид алюминия. Таким образом, такое соединение, которое принимает пару электронов для образования ковалентной связи, называется кислотой Льюиса.
Свойства кислот
- Едкий («обжигает» кожу).
- Имеет рН менее 7.
- Превращает синюю лакмусовую бумагу в красный цвет.
- Реагирует с металлами с образованием газообразного водорода.
- Реагирует с основаниями с образованием соли и воды.
- Реагирует с карбонатами с образованием двуокиси углерода, воды и соли.
- Кислый вкус.
- Диссоциирует ионы водорода (H + ) при растворении в воде.

Важность
Биологически нуклеиновые кислоты, такие как ДНК (дезоксирибонуклеиновые кислоты) и РНК (рибонуклеиновые кислоты), содержат генетическую информацию, а другие являются наследственным материалом, который передается от одного поколения к другому. Даже аминокислоты имеют большое значение, поскольку они помогают в создании белков. Жирные кислоты и их производные группы карбоновых кислот также играют значительную роль.
Даже соляная кислота, входящая в состав желудочного сока, выделяемого в желудке животных, способствует гидролизу белков и полисахаридов. Кислоты также полезны, действуя в защитном механизме, как у муравьев, которые производят муравьиную кислоту, в то время как осьминоги производят черную кислоту, называемую меланином.
Другие кислоты, такие как молочная кислота, уксус, серная кислота, лимонная кислота, встречающиеся в природе, известны своим различным и важным применением.
Определение основания
Основания отдают электроны и принимают ионы водорода или протоны. Основания можно назвать химическими веществами, прямо противоположными действию кислоты, так как в воде роль основания заключается в снижении концентрации иона гидроксония (H 3 O + ), в то время как действие кислоты увеличивает концентрацию. Хотя видно, что основаниями служат и некоторые сильные кислоты. Основания измеряются между 7-14 диапазон по шкале рН-метра.
Основания можно назвать химическими веществами, прямо противоположными действию кислоты, так как в воде роль основания заключается в снижении концентрации иона гидроксония (H 3 O + ), в то время как действие кислоты увеличивает концентрацию. Хотя видно, что основаниями служат и некоторые сильные кислоты. Основания измеряются между 7-14 диапазон по шкале рН-метра.
Однако существует много путаницы между основаниями и щелочами. Многие основания не растворяются в воде, но если основание растворяется в воде, оно называется щелочью . Когда в водном растворе основание реагирует с кислотой и раствор становится нейтральным, это называется реакцией нейтрализации .
Например, гидроксид натрия является основанием, а также щелочью, поскольку он нейтрализует кислоты в любой кислотно-щелочной реакции; во-вторых, он растворим в воде. С другой стороны, оксид меди является основанием, но не щелочью, поскольку он нейтрализует кислоту в водном растворе, но не растворяется в воде.
Сильное основание представляет собой химическое соединение, которое депротонируется или удаляет протон (H + ) из молекулы очень слабой кислоты в кислотно-щелочной реакции. Гидроксиды щелочных металлов и щелочноземельных металлов, такие как гидроксид натрия и гидроксид кальция соответственно, являются примерами сильного основания. Слабые основания — это вещества, которые не полностью ионизуются в водном растворе, либо их протонирование происходит не полностью.
Аррениус Концепт – Вещество, образующее гидроксид-ионы (ОН – ) в водном растворе, называется основанием. Например, гидроксид натрия (NaOH) диссоциирует в воде с образованием ионов Na + и OH – . Такие вещества, как LiOH, Ba(OH)2, NaOH, можно назвать основанием Аррениуса. Но эта теория ограничивалась веществами, содержащими гидроксид в своей формуле, и применима только к водным растворам. В связи с этим возникла другая концепция, называемая теорией Бренстеда-Лоури.
Концепция Bronsted-Lowry . Согласно этой теории, вещество, способное принимать ионы водорода (H + ) или протоны, известно как основание.
Основание Льюиса – одна из наиболее широко распространенных концепций после концепции кислот и оснований Бренстеда-Лоури. Атом, молекула или ион с неподеленной парой электронов можно назвать основанием Льюиса, поскольку эти основания являются нуклеофильными. Это означает, что с помощью неподеленной пары они атакуют положительный заряд молекулы. Кh4 является базой Льюиса. Другими словами, мы можем сказать, что вещество типа ОН 9Ион 0005–, который может отдавать пару несвязывающих электронов, называется основанием Льюиса или донором электронной пары.
Свойства основания
- Разъедающее («обжигает» кожу).
- Имеет рН более 7.
- Превращает красную лакмусовую бумагу в синий цвет.
- Мыльный на ощупь или скользкий на ощупь.
- Реагирует с кислотами с образованием соли и воды.

- Многие растворимые основания содержат гидроксильные ионы (ОН – ).
Важность
Основания (гидроксид натрия) используются в производстве бумаги, мыла и волокна, называемого вискозой. Гидроксид кальция используется в качестве отбеливающего порошка. Гидроксид магния используется в качестве «антацида», который используется во время расстройства желудка и для уменьшения эффекта доступа к желудку. Такие основания, как карбонат натрия, используются в качестве стиральной соды и для смягчения жесткой воды. Водородный натрий также используется в приготовлении разрыхлителей, в качестве пищевой соды, а также в огнетушителе.
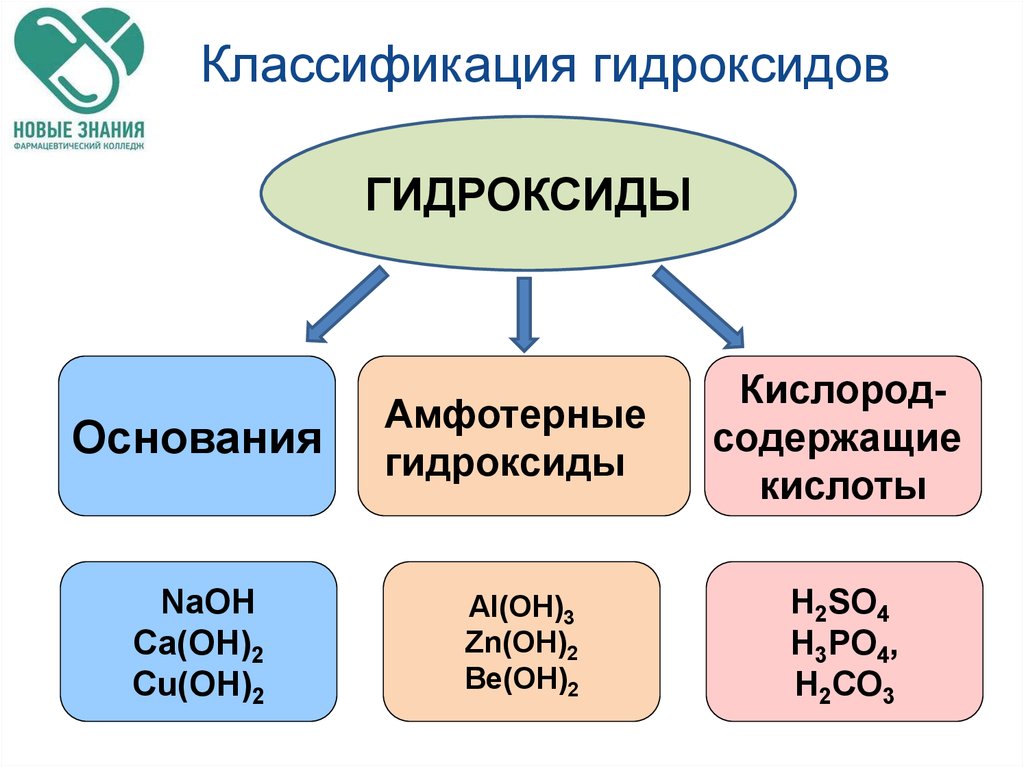
Амфотерные вещества – вещества, обладающие свойствами кислоты и основания; даже они способны принимать и отдавать протон, как вода.
Ключевые различия между кислотой и основанием
Ниже приведены важные моменты, которые отличают кислоты от оснований:
- Согласно концепции Аррениуса : Кислота – это вещество, которое при растворении в воде увеличивает концентрацию H + ионов, тогда как основание является веществом, при растворении в воде увеличивают концентрацию ОН – ионов.

- С другой стороны, концепция Бренстеда-Лоури гласит, что кислоты являются донорами протонов, а основания — акцепторами протонов.
- Теория Льюиса объясняет их тем, что такие виды, которые принимают пару электронов (электрофилы) и будут иметь вакантные орбитали, известны как кислоты Льюиса, в то время как такие виды, которые отдают пару электронов (нуклеофилы) и будут иметь неподеленную пару электронов называют основанием Льюиса.
- Химическая формула кислоты начинается с Н, например, HCl (Соляная кислота), h4BO3 (Борная кислота), Ch3O3 (Углекислота). Хотя
Ch4COOH (уксусная кислота) является исключением, тогда как такие соединения, химическая формула которых заканчивается на OH, например, KOH (гидроксид калия
), NaOH (гидроксид натрия), известны как основание. Шкала pH (концентрация ионов водорода в растворе) меньше семи, тогда как в основании больше семи. - Кислоты кислые, дают ощущение жжения, обычно липкие, реагируют с металлами с образованием газообразного водорода.
 Хотя основания противоположны, так как они горькие, обычно без запаха (кроме аммиака), они скользкие; основания реагируют с жирами и маслами.
Хотя основания противоположны, так как они горькие, обычно без запаха (кроме аммиака), они скользкие; основания реагируют с жирами и маслами. - В фенолфталеине индикаторные кислоты остаются бесцветными , а основания дают розовую окраску . Хотя в тесте на лакмусовую бумагу кислоты превращают синюю лакмусовую бумажку в красную, а красную лакмусовую бумажку в синюю.
- Сила кислот зависит от концентрации ионов гидроксония, а сила зависит от концентрации ионов гидроксида.
- Кислоты диссоциируют с образованием свободных ионов водорода (H + ) при смешивании с водой, тогда как основания диссоциируют с образованием свободных ионов гидроксида (OH – ) при смешивании с водой.
- Несколько примеров кислот: соляная кислота (HCl), серная кислота (h3SO4), азотная кислота (HNO3), угольная кислота (h3CO3).
 Примерами оснований являются гидроксид аммония (Nh5OH), гидроксид кальция (Ca(OH)2), гидроксид натрия (NaOH).
Примерами оснований являются гидроксид аммония (Nh5OH), гидроксид кальция (Ca(OH)2), гидроксид натрия (NaOH).
Заключение
Стоит иметь краткое представление о некоторых основных физических и химических принципах, прямо или косвенно связанных с жизнью. Кислоты и основания являются одними из них. В приведенном выше содержании мы обсудили их вместе с их свойствами. Мы также обсудим три важные теории с некоторыми примерами. Мы пришли к выводу, что это важная часть жизни, и мы часто используем их не только в химической лаборатории, но и в повседневной работе.
ОБЩАЯ ИНФОРМАЦИЯ О ГИДРОКСИДАХ (Технический отчет)
ОБЩАЯ ИНФОРМАЦИЯ О ГИДРОКСИДАХ (Технический отчет) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другое связанное исследование
- Авторов:
- Ли, М.
 Э.
Э.
- Дата публикации:
- Исследовательская организация:
- Национальная лаборатория Ок-Ридж. (ORNL), Ок-Ридж, Теннесси (США)
- Идентификатор ОСТИ:
- 4401547
- Номер(а) отчета:
- ОРНЛ-1291
- Номер АНБ:
- НСА-06-004397
- Тип ресурса:
- Технический отчет
- Отношение ресурсов:
- Прочая информация: ориг. Дата получения: 31-DEC-52
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- ХИМИЯ; ГИДРОКСИДЫ БАРИЯ; БИБЛИОГРАФИЯ; ГИДРОКСИДЫ КАЛЬЦИЯ; ГИДРОКСИДЫ ЦЕЗИЯ; ГИДРОКСИДЫ; ГИДРОКСИДЫ ЛИТИЯ; ГИДРОКСИДЫ МАГНИЯ; КАЛИЯ ГИДРОКСИДЫ; ОБЗОР; ГИДРОКСИДЫ РУБИДИЯ; ГИДРОКСИДЫ НАТРИЯ; ГИДРОКСИДЫ СТРОНЦИЯ
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Lee, M.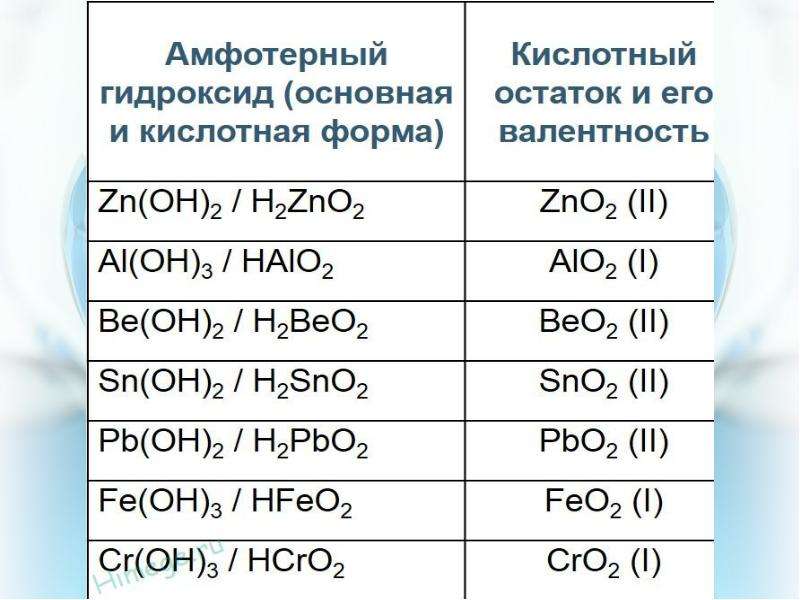 E.. ОБЩАЯ ИНФОРМАЦИЯ О ГИДРОКСИДАХ . США: Н. П., 1952.
Веб. дои: 10.2172/4401547.
E.. ОБЩАЯ ИНФОРМАЦИЯ О ГИДРОКСИДАХ . США: Н. П., 1952.
Веб. дои: 10.2172/4401547.
Копировать в буфер обмена
Lee, M.E.. ОБЩАЯ ИНФОРМАЦИЯ О ГИДРОКСИДАХ . Соединенные Штаты. https://doi.org/10.2172/4401547
Копировать в буфер обмена
Ли, Мэн, 1952.
«ОБЩАЯ ИНФОРМАЦИЯ О ГИДРОКСИДАХ». Соединенные Штаты. https://doi.org/10.2172/4401547. https://www.osti.gov/servlets/purl/4401547.
Копировать в буфер обмена
@статья{osti_4401547,
title = {ОБЩАЯ ИНФОРМАЦИЯ О ГИДРОКСИДАХ},
автор = {Ли, М.Э.},
abstractNote = {},
дои = {10.2172/4401547},
URL = {https://www.osti.gov/biblio/4401547},
журнал = {},
номер =,
объем = ,
место = {США},
год = {1952},
месяц = {4}
}
Копировать в буфер обмена
Посмотреть технический отчет (5.

 При пропускании постоянного электрического…
При пропускании постоянного электрического… Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав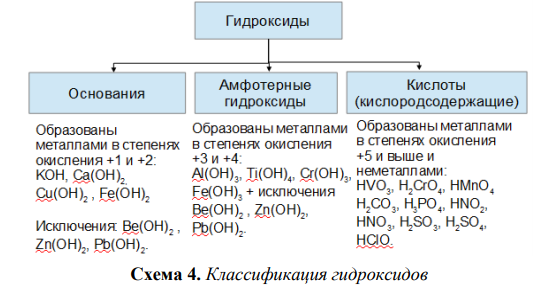


 Хотя основания противоположны, так как они горькие, обычно без запаха (кроме аммиака), они скользкие; основания реагируют с жирами и маслами.
Хотя основания противоположны, так как они горькие, обычно без запаха (кроме аммиака), они скользкие; основания реагируют с жирами и маслами. Примерами оснований являются гидроксид аммония (Nh5OH), гидроксид кальция (Ca(OH)2), гидроксид натрия (NaOH).
Примерами оснований являются гидроксид аммония (Nh5OH), гидроксид кальция (Ca(OH)2), гидроксид натрия (NaOH). Э.
Э.
Leave A Comment