Разложение перманганата калия. Свойства солей марганцевой кислоты
Окислительно-восстановительные процессы лежат в основе важнейших явлений живой и неживой природы: горения, разложения сложных веществ, синтеза органических соединений. Перманганат калия, свойства которого мы изучим в нашей статье, относится к наиболее сильным окислителям, применяемым в лабораторных и промышленных условиях. Его окислительные способности зависят от степени окисления атома, которая меняется в ходе реакции. Рассмотрим это на конкретных примерах химических процессов, происходящих с участием молекул KMnO4.
Характеристика вещества
Рассматриваемое нами соединение (перманганат калия) является одним из наиболее применяемых в промышленности веществ – соединений марганца. Соль представлена кристаллами в виде правильных призм темно-фиолетового цвета. Она хорошо растворяется в воде и образует раствор малинового цвета, обладающий прекрасными бактерицидными характеристиками. Поэтому вещество нашло широкое применение как в медицине, так и в быту в качестве бактерицидного средства. Как и другие соединения семивалентного марганца, соль способна окислять многие соединения органической и неорганической природы. К разложению перманганата калия прибегают в химических лабораториях для получения небольших объемов чистого кислорода. Соединение окисляет сульфитную кислоту в сульфатную. В промышленности KMnO4 применяется для выделения газообразного хлора из соляной кислоты. Оно также окисляет большинство органических веществ, способно переводить соли двухвалентного железа в форму его трехвалентных соединений.
Как и другие соединения семивалентного марганца, соль способна окислять многие соединения органической и неорганической природы. К разложению перманганата калия прибегают в химических лабораториях для получения небольших объемов чистого кислорода. Соединение окисляет сульфитную кислоту в сульфатную. В промышленности KMnO4 применяется для выделения газообразного хлора из соляной кислоты. Оно также окисляет большинство органических веществ, способно переводить соли двухвалентного железа в форму его трехвалентных соединений.
Марганец (химический элемент): свойства, применение,…
Марганец — химический элемент: электронное строение, история открытия. Физические и химические…
Опыты с марганцовкой
Вещество, в быту называемое марганцовкой, при нагревании разлагается. В продуктах реакции обнаруживается свободный кислород, двуокись марганца и новая соль – K2MnO4. В лаборатории этот процесс проводят для получения чистого кислорода. Химическое уравнение разложения перманганата калия можно представить так:
Химическое уравнение разложения перманганата калия можно представить так:
2KMnO4 = K2MnO4 + MnO2 + O2.
Сухое вещество, представляющее собой фиолетовые кристаллы в виде правильных призм, нагревают до температуры +200 °C. Катион марганца, находящийся в составе соли, имеет степень окисления, равную +7. Она снижается в продуктах реакции до величин +6 и +4 соответственно.
Окисление этилена
Газообразные углеводороды, относящиеся к различным классам органических соединений, имеют как одинарные, так и кратные связи между атомами углерода в составе своих молекул. Как определить присутствие пи-связей, лежащих в основе непредельного характера органического соединения? Для этого проводят химические опыты, пропуская исследуемое вещество (например, этен или ацетилен) через фиолетовый раствор перманганата калия. Наблюдается его обесцвечивание, так как непредельная связь разрушается. Молекула этилена окисляется и из непредельного углеводорода превращается в двухатомный предельный спирт – этиленгликоль.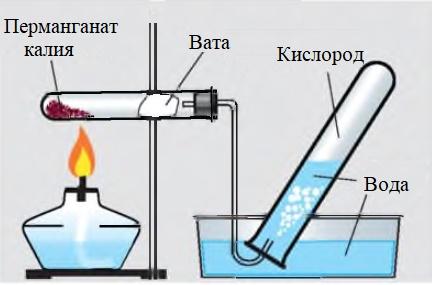 Данная реакция является качественной на наличие двойных или тройных связей.
Данная реакция является качественной на наличие двойных или тройных связей.
Реакция соединения: примеры и формула расчета
Проанализируем основные типы реакций, подробнее разберем реакции соединения, а также приведем…
Особенности химических проявлений KMnO4
Если степени окисления реагентов и продуктов реакции изменяются, значит происходит реакция окисления-восстановления. В ее основе лежит явление перемещения электронов от одних атомов к другим. Как и в случае с разложением перманганата калия, так и в других реакциях, вещество проявляет ярко выраженные свойства окислителя. Например, в подкисленном растворе сернистокислого натрия и перманганата калия образуется сульфаты натрия, калия и марганца, а также вода:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H20.
В этом случае ион серы является восстановителем, а марганец, входящий в сложный анион MnO4—, проявляет свойства окислителя. Он принимает пять электронов, поэтому степень его окисления снижается с +7 до +2.
Он принимает пять электронов, поэтому степень его окисления снижается с +7 до +2.
Несколько способов сделать воронение в домашних условиях
Воронение, или оксидирование, стало известно очень давно. Раньше такую обработку применяли с целью…
Влияние среды на протекание химической реакции
В зависимости от концентрации ионов водорода или гидроксильных групп различают кислый, щелочной или нейтральный характер раствора, в котором происходит окислительно-восстановительная реакция. Например, при избыточном содержании катионов водорода, ион марганца со степенью окисления +7 в перманганате калия понижает ее до +2. В щелочной среде, при высокой концентрации гидроксильных групп, сульфит натрия, взаимодействуя с перманганатом калия, окисляется до сульфата. Ион марганца со степенью окисления +7 переходит в катион с зарядом +6, находящийся в составе K2MnO4, раствор которого имеет зеленую окраску. В нейтральной среде сульфит натрия и перманганат калия реагируют между собой, при этом осаждается двуокись марганца. Степень окисления катиона марганца уменьшается с +7 до +4. В продуктах реакции также обнаруживаются сульфат натрия и щелочь – гидроксид натрия.
Степень окисления катиона марганца уменьшается с +7 до +4. В продуктах реакции также обнаруживаются сульфат натрия и щелочь – гидроксид натрия.
Применение солей марганцевой кислоты
Реакция разложения перманганата калия при нагревании и другие окислительно-восстановительные процессы, проходящие с участием солей марганцевой кислоты, часто используются в промышленности. Например, окисление многих органических соединений, выделение газообразного хлора из соляной кислоты, превращение солей двухвалентного железа в трехвалентное. В сельском хозяйстве раствор KMnO4 применяют для предпосевной обработки семян и почвы, в медицине им обрабатывают поверхность ран, дезинфицируют воспаленные слизистые оболочки носовой полости, используют для обеззараживания предметов личной гигиены.
В нашей статье мы не только подробно изучили процесс разложения перманганата калия, но также рассмотрели его окислительные свойства и применение в быту и промышленности.
Получение кислорода в лаборатории разложением перманганата калия (опыт) | Химия.
 Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книгаЗагрузка…
Тебе выданы лабораторный штатив, штатив с пробирками, пробка с газоотводной трубкой, горелка, кристаллизатор с водой, клочок ваты, лучинка; перманганат калия, известковая вода.
Выполняя эту работу, ты применишь знания о реакциях разложения и соединения, физических и химических свойствах кислорода для получения, собирания и изучения свойств этого газа.
Собери по рисункам 1, 2 из выданных деталей прибор для получения кислорода и проверь его на герметичность (рис. 3).
Помести в сухую пробирку выданный перманганат калия. Возле отверстия пробирки расположи неплотный клочок ваты для улавливания твердых частиц. Пробирку закрой газоотводной трубкой и закрепи ее в лапке штатива. Конец газоотводной трубки погрузи в сосуд с водой. Туда же положи пробирку, которая должна заполниться водой, и пробку к ней. Осторожно прогрей всю пробирку с перманганатом калия, а затем нагревай то место, где находится вещество.
| Рис. 1. Составляющие прибора для получения и собирания кислорода |
| Рис. 2. Получение кислорода термическим разложением перманганата калия |
| Рис. 3. Проверка прибора на герметичность |
Сначала вынь из воды газоотводную трубку, и только после этого прекрати нагревание. Если сделать наоборот, холодную воду засосет в горячую пробирку.
Загрузка…
Внеси в пробирку с кислородом тлеющую лучинку. Вынь лучинку из пробирки и долей туда немного известковой воды.
Вынь лучинку из пробирки и долей туда немного известковой воды.
На этой странице материал по темам:
Собирание кислорода вытеснением воды уравнение
Получение калия йодида в лабораторных условиях
Для чего в пробирку, где разлагается перманганат калия, вкладывают вату
Перманганат калия в лаборатории применяют для
Лабораторная работа по химии получение кислорода вывод
Опиши ход работы и наблюдения.
Почему кислород можно собрать вытеснением воды?
О чем свидетельствуют изменения которые произошли с известковой водой?
Запиши уравнение реакции разложения перманганата калия, укажи условия ее прохождения.
Материал с сайта http://WorldOfSchool. ru
ru
механизм реакции — Разложение перманганата калия при длительном нагревании
спросил
Изменено 5 лет, 1 месяц назад
Просмотрено 47 тысяч раз
При нагревании перманганата калия уравнение его разложения выглядит так: $$\ce{2KMnO4 ->[\Delta] K2MnO4 + MnO2 + O2}$$
Так что же произойдет с манганатом калия ($\ce{K2MnO4}$), если мы продолжим нагревание?
- механизм реакции
$\endgroup$
1
$\begingroup$
Манганат калия получают реакцией диоксида марганца с гидроксидом калия и газообразным кислородом:
$\ce{2 MnO2 + 4 KOH + O2 → 2 K2MnO4 + 2 h3O}$
Так что я подозреваю, что произойдет обратный процесс при дальнейшем нагреве.
$\endgroup$
1
$\begingroup$
Здесь приведена реакция.
$$\ce{3K2MnO4 ->[\Delta] 2K3MnO4 + MnO2 + O2}$$
Термическое разложение манганата калия с образованием калия гипоманганат, оксид марганца(IV) и кислород. Эта реакция занимает место при температуре 190-500°С.
1
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Воздействие тепла на перманганат калия при \\[746K\\] приводит к образованию
Дата последнего обновления: 16 апреля 2023 г.
•
Всего просмотров: 199,2 тыс.
Проверено
199,2 тыс.+ просмотров
Подсказка: При такой высокой температуре перманганат калия разлагается. При разложении образуются три продукта. Одним из которых является газообразный кислород, который высвобождается. Два других продукта представляют собой марганцевые продукты со степенью окисления марганца \[+6\] и \[+4\].
Полный ответ:
Когда перманганат калия подвергается более высокой температуре \[746K\], это приводит к его термическому разложению. При разложении образуется манганат калия и диоксид марганца с выделением газообразного кислорода. Реакция протекает следующим образом:
Во время этой реакции перманганат калия находится в твердой форме.
 И продукты получаются тоже твердые кроме кислорода.
И продукты получаются тоже твердые кроме кислорода. Перманганат калия представляет собой неорганическую пурпурно-черную кристаллическую соль. Растворяется в воде с образованием розовых или фиолетовых растворов. Он производится в промышленности из диоксида марганца, который также встречается в виде минерального пиролюзита. Это очень сильный окислитель, поэтому его используют в лаборатории в различных экспериментах по титрованию. Разбавленный раствор перманганата калия используется для проверки наличия ненасыщенности. Его основное применение — синтез органических соединений, таких как аскорбиновая кислота, хлорамфеникол, сахарин и т. Д. Перманганат калия добавляют в «диспенсеры с пластиковыми сферами» для создания обратных воспламенений, выгорания и контролируемых ожогов. Перманганат задерживает созревание фруктов, увеличивая срок их хранения до \[4\] недель без необходимости охлаждения. Перманганат калия является одним из основных химических веществ, используемых в кино- и телеиндустрии для «состаривания» реквизита и декораций, поскольку его преобразование в коричневый MnO2 создает «столетний» или «древний» вид.


Leave A Comment