Функции белков в организме – биологические, каталитиеские, транспортные
4.6
Средняя оценка: 4.6
Всего получено оценок: 2027.
4.6
Средняя оценка: 4.6
Всего получено оценок: 2027.
Белки являются строительным материалом организма и играют важную роль в обмене веществ. Функции белков разнообразны и имеют огромное значение для поддержания процесса жизнедеятельности.
Материал подготовлен совместно с учителем высшей категории Макшаковой Натальей Алексеевной.
Опыт работы учителем биологии — 23 лет.
Строение
Белки – биополимеры, состоящие из отдельных звеньев – мономеров, которые называются аминокислотами. Аминокислоты состоят из карбоксильной (-СООН), аминной (-Nh3) группы и радикала. Аминокислоты в белке связываются между собой с помощью ковалентной пептидной связи, образуя полипептидную цепь. Пептидная связь образуется между карбоксильной и аминогруппой соседних аминокислот.
Обязательные химические элементы аминокислот:
- углерод;
- азот;
- кислород.

Радикал может включать серу и другие элементы.
В соответствии с возможностью синтезироваться внутри организма выделяют два вида аминокислот:
- заменимые – синтезируются в организме;
- незаменимые – не синтезируются в организме и должны поступать из внешней среды.
Известно около 200 аминокислот. Однако в построении белков участвуют только 20.
Синтез
Биосинтез белков происходит в цитоплазме клетки на рибосомах. Это сложный процесс, состоящий из трех стадий:
- транскрипция – образование на участке ДНК информационной (матричной) РНК с информацией о последовательности аминокислот в белковой молекуле;
- трансляция – синтез на основе матричной РНК полипептидной цепи из аминокислот;
- модификация белка.
Синтез полипептидной цепи происходит на рибосоме с помощью матричной и транспортной РНК. Матричная РНК содержит информацию о последовательности аминокислот в белковой молекуле. Транспортные РНК доставляют на рибосому аминокислоты и осуществляют сверку их с информацией на матричной РНК. Этот процесс называется трансляцией. Модификация белка включает «работу над ошибками».
Транспортные РНК доставляют на рибосому аминокислоты и осуществляют сверку их с информацией на матричной РНК. Этот процесс называется трансляцией. Модификация белка включает «работу над ошибками».
Функции
Функция | Описание | Примеры |
Транспортная | Переносят вещества (малые молекулы) через клеточную мембрану, а также участвуют в их транспорте кровью и другими жидкостями по организму. | Гемоглобин переносит кислород и углекислый газ, транскортин – транспортные белки, встроенные в мембраны клеток, участвуют в поступлении в клетку глюкозы, аминокислот. |
Двигательная | Обеспечивают сокращение мышечных клеток многоклеточных животных, участвуют в движении жгутиков и ресничек | Актин, миозин |
Структурная (строительная) | Участвуют в образовании цитоскелета, органоидов клетки, межклеточного вещества. | Коллаген и эластин в хрящевой ткани, кератин волос и ногтей |
Сигнальная | Передают информацию между клетками, тканями, органами | Цитокины |
Ферментативная или каталитическая | Большинство ферментов в живых организмах имеют белковое происхождение. Они являются катализаторами, ускоряя биохимические реакции | Пепсин, каталаза, рибонуклеаза |
Регуляторная или гормональная | Гормоны белкового происхождения контролируют и регулируют процессы метаболизма | Инсулин, тиротропин |
Генно-регуляторная | Регулируют функции нуклеиновых кислот при переносе генетической информации | Гистоны регулируют репликацию и транскрипцию ДНК |
Энергетическая | Используется как дополнительный источник энергии. | В качестве источника энергии белки используются организмом после углеводов и липидов. |
Защитная | Специфичные белки – антитела – предохраняют организм, уничтожая чужеродные частицы. Особые белки участвуют в свертывании крови, останавливая кровотечения | Иммуноглобулины, фибриноген, тромбин |
Запасающая | Запасаются для питания клеток. Удерживают необходимые организму вещества | Ферритин удерживает железо, казеин, глютен, альбумин запасаются в организме |
Рецепторная | Удерживают различные регуляторы (гормоны, медиаторы) на поверхности или внутри клетки | Глюкагоновый рецептор, протеинкиназа |
Белки могут оказывать отравляющее и обезвреживающее действие. Например, палочка ботулизма выделяет токсин белкового происхождения, а белок альбумин связывает тяжёлые металлы.
Ферменты
Стоит сказать кратко о каталитической функции белков. Ферменты или энзимы выделяют в особую группу белков. Они осуществляют катализ – ускорение протекания химической реакции.
- простыми – содержат только аминокислотные остатки;
- сложными – помимо белкового остатка включают небелковые структуры, которые называются кофактором (витамины, катионы, анионы).
Молекулы ферментов имеют активную часть (активный центр), связывающую белок с веществом – субстратом. Каждый фермент «узнаёт» определённый субстрат и связывается именно с ним как “ключ с замком”. Активный центр обычно представляет собой «карман», в который попадает субстрат.
Связывание активного центра и субстрата описывается моделью индуцированного соответствия (модель «рука-перчатка»). Модель показывает, что фермент «подстраивается» под субстрат. Благодаря изменению структуры снижается энергия активации реакции.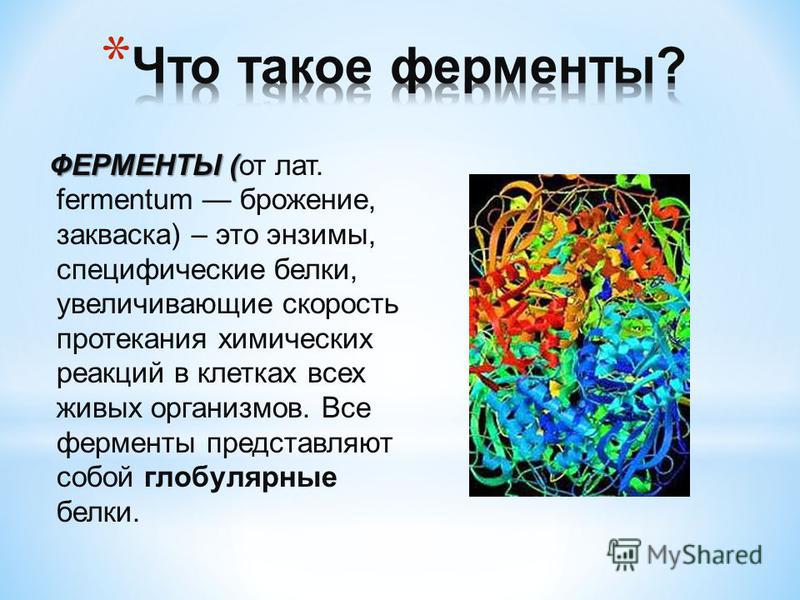
Активность ферментов зависит от нескольких факторов:
- температуры;
- концентрации фермента и субстрата;
- кислотности.
Различают 6 классов ферментов, каждый из которых взаимодействует с определёнными веществами. Например, трансферазы переносят фосфатную группу от одного вещества к другому.
Ферменты могут ускорять реакцию в 1000 раз.
Что мы узнали?
Выяснили, какие функции выполняют белки в клетке, как они устроены и как синтезируются. Белки представляют собой полимерные цепочки, состоящие из аминокислот. Всего известно 200 аминокислот, но белки могут образовывать только 20. Белковые полимеры синтезируются на рибосомах. Белки выполняют важные функции в организме: переносят вещества, ускоряют биохимические реакции, регулируют процессы, происходящие в организме.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.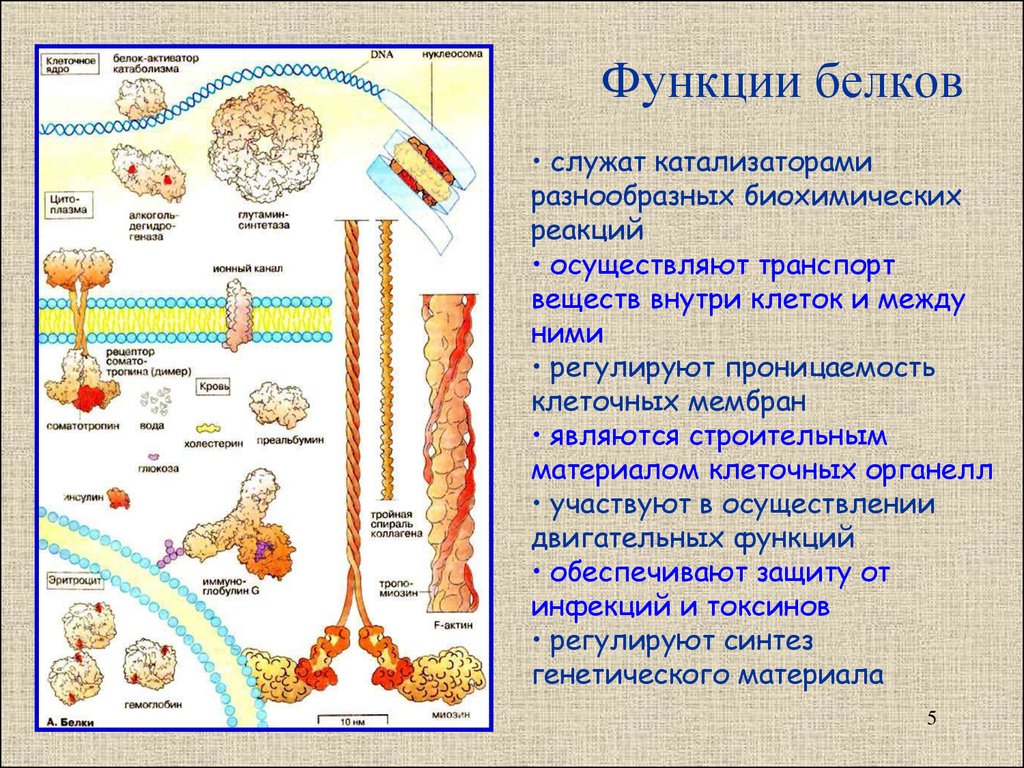
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 2027.
А какая ваша оценка?
О происхождении жизни и РНК.
Происхождение жизни — один из центральных вопросов биологии. Науки о жизни развиваются с головокружительной быстротой, но, несмотря на успехи, главный вопрос — как появилась жизнь — так пока и не нашел окончательного и точного ответа.
Среди современных концепций зарождения жизни одно из доминирующих положений занимает теория РНК-мира. Попробуем разобраться, что же это такое.
Открытия в молекулярной биологии прошлого столетия привели человечество к пониманию устройства жизни на химическом уровне. Выяснилось, что основу жизнедеятельности любого организма составляют две группы веществ-биополимеров: белки и нуклеиновые кислоты.
Белки, чьи длинные, хитроумно свернутые цепи состоят из десятков и сотен последовательно связанных аминокислот, выполняют в клетке роль рабочих инструментов и универсального строительного материала.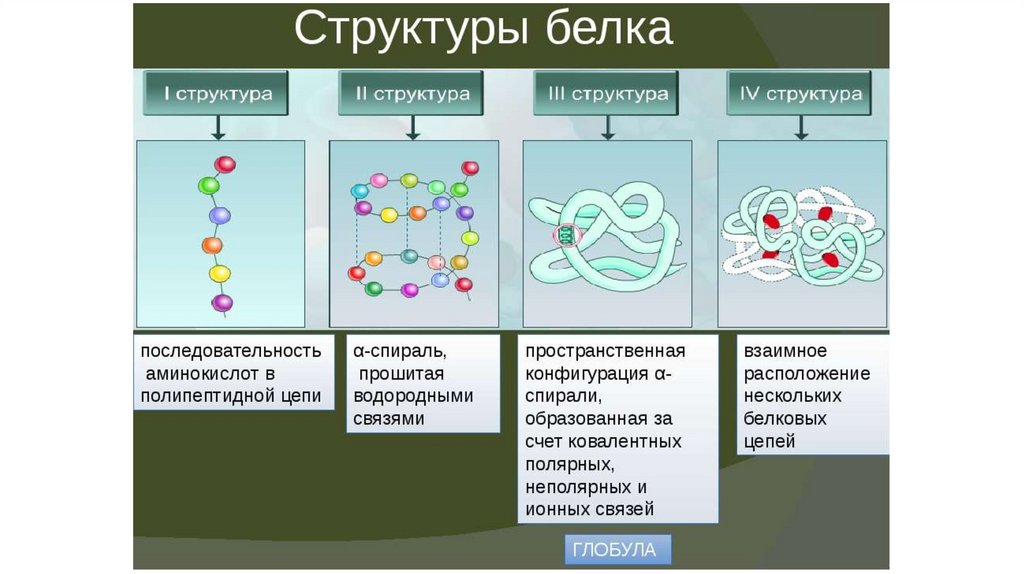 Белки-ферменты ускоряют и направляют все химические реакции, протекающие в клетке, формируя ее облик.
Белки-ферменты ускоряют и направляют все химические реакции, протекающие в клетке, формируя ее облик.
Но белки — временные инструменты, потребность в которых постоянно изменяется по ходу жизни организма. Для хранения же информации о белках, а значит, и о строении самого организма природа использует нуклеиновые кислоты — ДНК (дезоксирибонуклеиновую кислоту) и РНК (рибонуклеиновую кислоту). Эти длинные молекулы, построенные из сцепленных между собой четырех видов нуклеотидов, очень похожи по строению, но обладают разными свойствами. Две направленные в разные стороны цепи ДНК формируют жесткую и стабильную двойную спираль длиной в миллионы пар нуклеотидов. РНК же образует сравнительно короткие цепи, подверженные разнообразным химическим реакциям и заплетенные петлями сами на себя.
Столь различная структура объяснила ученым принципиально разные функции ДНК и РНК. ДНК оказалась надежным, долговременным хранилищем информации о белках организма, а РНК — мобильным, коротко живущим переносчиком информации.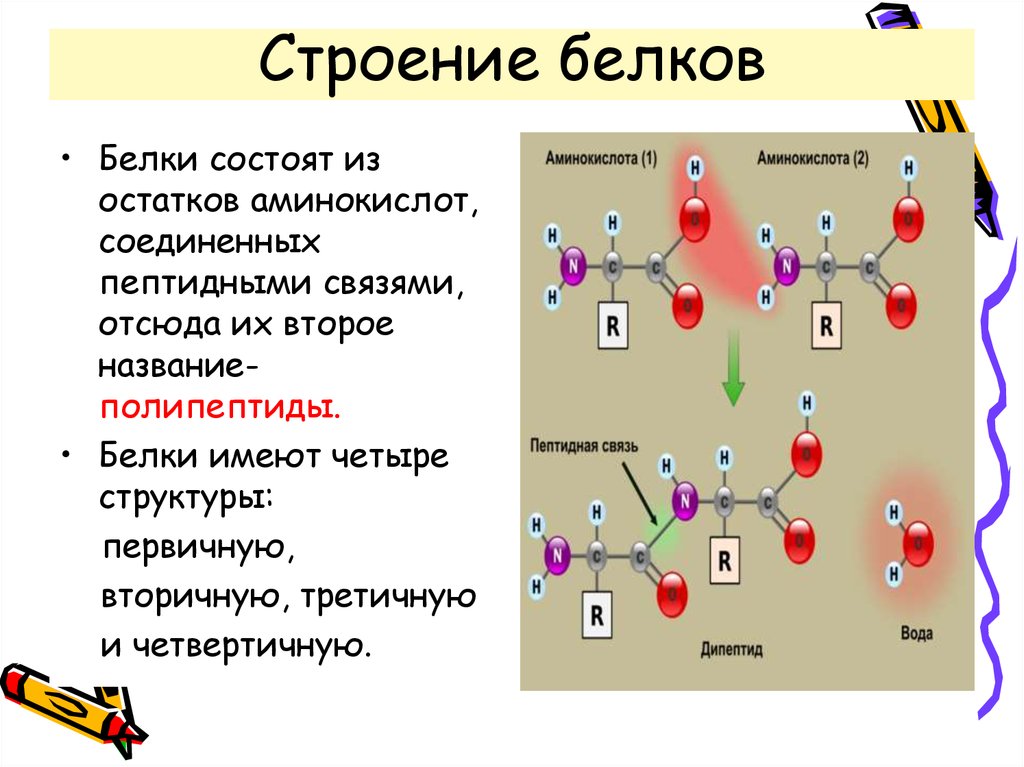 Она синтезируется белками-полимеразами по ДНК-матрице и отвечает за расшифровку информации, записанной в ДНК, а также за сборку белков по ДНК-чертежу.
Она синтезируется белками-полимеразами по ДНК-матрице и отвечает за расшифровку информации, записанной в ДНК, а также за сборку белков по ДНК-чертежу.
Весь этот ворох знаний был накоплен учеными к середине 60-х годов прошлого столетия, став предтечей настоящей биотехнологической революции. Но одновременно он поставил ученых, мучающихся над проблемой зарождения жизни, перед парадоксом.
Для существования первых «живых», то есть способных к размножению и самоподдержанию биохимических систем, достаточно ДНК, РНК и белка. С ролью РНК все вроде бы понятно — типичная молекула на побегушках, которая ничего толком не умеет и не решает, но необходима для переноса информации из ДНК и работы механизмов сборки белка. А вот белки и ДНК явно должны были занимать центральное место в картине доисторического мира.
Информация о структуре белков-катализаторов, умеющих все на свете, способна сохраняться, только будучи записанной в структуре ДНК. Одновременно стабильная ДНК, отлично сохраняя информацию, не способна на самостоятельные химические превращения, кроме, разве что, медленного распада. Что же появилось в эволюции раньше — умелые, короткоживущие белки или надежная, но беспомощная ДНК? Одно никак не может появиться без другого, а случайное одномоментное зарождение сложной ДНК-РНК-белковой самовоспроизводящейся системы казалось невероятным.
Что же появилось в эволюции раньше — умелые, короткоживущие белки или надежная, но беспомощная ДНК? Одно никак не может появиться без другого, а случайное одномоментное зарождение сложной ДНК-РНК-белковой самовоспроизводящейся системы казалось невероятным.
Тут взгляды ученых и обратились на РНК. РНК не стабильна и ужасно плохо хранит информацию, но все же хранит ее. А что если допустить, что заплетенные в витиеватые петли цепи РНК смогут работать наподобие белков-ферментов, катализируя, то есть ускоряя, биохимические реакции? Пусть они бы справлялись с этой задачей в сотни раз хуже белков, но гипотетически такие РНК-катализаторы могли бы устойчиво существовать и размножаться на поверхности древней Земли еще до появления белков и ДНК. А их химическая нестабильность была бы даже плюсом, приводя к бешеному темпу эволюции первобытной РНК-фауны.
Структура молекулы предшественника матричной РНК. Изображение: Vossman / WikimediaСмелая гипотеза оказалась пророческой, в начале 80-х были найдены первые рибозимы — биокатализаторы на основе РНК. Чуть позже ученые получили аптамеры — молекулы РНК, способные избирательно связывать определенные вещества. Оказалось, что РНК может выполнять работу как по биокатализу, так и по молекулярному распознаванию. Да, у нее это получается хуже, чем у белков, но все же получается.
Чуть позже ученые получили аптамеры — молекулы РНК, способные избирательно связывать определенные вещества. Оказалось, что РНК может выполнять работу как по биокатализу, так и по молекулярному распознаванию. Да, у нее это получается хуже, чем у белков, но все же получается.
С тех пор ученые не оставляют настойчивых попыток получить в лаборатории рибозим, способный к устойчивому копированию (репликации) молекул РНК любой структуры. Появившись на заре эволюции, аналогичный рибозим стал бы настоящим «ядром» гипотетического РНК-мира, а его получение было бы осязаемым подтверждением пока еще умозрительной гипотезы.
За годы исследований были получены рибозимы-лигазы, способные сшивать молекулы РНК между собой, и даже рибозимы-полимеразы, копирующие небольшие, однородные по своему нуклеотидному составу фрагменты РНК. Но на всех сложных, способных к биокатализу и молекулярному распознаванию последовательностях они упрямо буксовали, отказываясь работать.
И вот недавно в авторитетном журнале PNAS была опубликована статья о получении первого рибозима, уверенно копирующего РНК-матрицы любого нуклеотидного состава. В ходе экспериментов ученые подменили собой эволюцию: путем искусственного отбора в пробирке им удалось создать рибозим, копирующий РНК с недоступной ранее точностью.
В ходе экспериментов ученые подменили собой эволюцию: путем искусственного отбора в пробирке им удалось создать рибозим, копирующий РНК с недоступной ранее точностью.
Каждый из 24 раундов мутации-отбора начинался с копирования уже существующего фермента в биохимическом процессе, получившем название рибоПЦР. Эта реакция — аналог хорошо известной полимеразной цепной реакции (ПЦР), позволяющей за несколько часов синтезировать миллионы копий нужного фрагмента ДНК. Для того чтобы в системе появился материал для искусственного отбора, реакция была модифицирована в сторону уменьшения точности копирования. Частота ошибок достигала 10% в пересчете на отдельный нуклеотид. Благодаря этому запланированному случайному мутагенезу ученым удалось получить 1014 (100 триллионов!) различных вариантов исходного рибозима. После завершения реакции мутантные рибозимы придирчиво отбирались учеными: в следующий раунд мутации проходили только самые быстрые и точные рибозимы, способные к наилучшему копированию матрицы.
После завершения этой кропотливой работы исследователи получили рибозим, названный 24-3 полимераза. Впервые в руки ученых попал рибозим, способный реплицировать небольшие цепи РНК любой последовательности. С его помощью удалось реплицировать несколько аптамеров. Затем неутомимой полимеразой был копирован каталитически активный рибозим-лигаза. Но настоящим достижением стало то, что с помощью 24-3 полимеразы удалось реплицировать одну из транспортных РНК. Эти крупные, хитро заплетенные в фигуру наподобие клеверного листа молекулы РНК переносят звенья-аминокислоты к месту сборки белковых цепей и являются важнейшим компонентом аппарата синтеза белка.
Скорость работы полученного рибозима оказалась крайне мала, а производительность несравнима с природными белками-полимеразами, но главное — он был получен, и он работает. Теперь для доказательства возможности существования древнего РНК-мира ученым остался последний шаг — создать рибозим, способный устойчиво реплицировать сам себя. Сделав его, человечество получит в пробирке колонию самокопирующихся молекул РНК — потенциальный аналог первой формы жизни на нашей планете.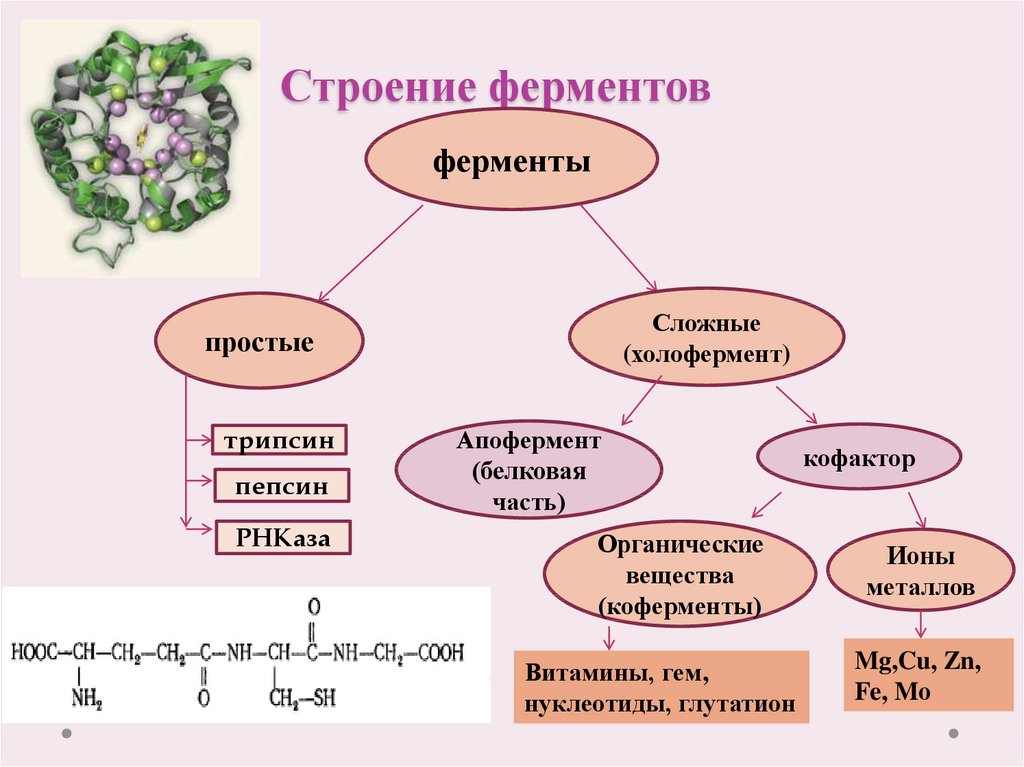
Несколько месяцев работы позволили исследователям вплотную приблизиться к созданию искусственного прототипа первобытной жизни. Что же могло получится у естественного отбора за сотни миллионов лет? Еще никогда мы не были так близки к ответу на этот вопрос.
Дмитрий Лебедев
Центральная роль ферментов как биологических катализаторов — клетка
Основная задача белков — действовать как ферменты — катализаторы, которые увеличивают скорость практически всех химических реакций внутри клетки. Хотя РНК способны катализировать некоторые реакции, большинство биологических реакций катализируются белками. В отсутствие ферментативного катализа большинство биохимических реакций протекают настолько медленно, что не могли бы протекать в мягких условиях температуры и давления, совместимых с жизнью. Ферменты ускоряют скорость таких реакций более чем в миллион раз, поэтому реакции, которые без катализа заняли бы годы, могут протекать за доли секунд, если их катализирует соответствующий фермент. Клетки содержат тысячи различных ферментов, и их активность определяет, какие из многих возможных химических реакций действительно происходят внутри клетки.
Клетки содержат тысячи различных ферментов, и их активность определяет, какие из многих возможных химических реакций действительно происходят внутри клетки.
Каталитическая активность ферментов
Как и все другие катализаторы, ферменты характеризуются двумя фундаментальными свойствами. Во-первых, они увеличивают скорость химических реакций, но сами не поглощаются и не изменяются в результате реакции. Во-вторых, они увеличивают скорость реакции, не нарушая химического равновесия между реагентами и продуктами.
Эти принципы ферментативного катализа проиллюстрированы в следующем примере, в котором молекула, на которую действует фермент (называемая субстратом [ S ]) в результате реакции превращается в продукт ( P ). В отсутствие фермента реакция может быть записана следующим образом:
Химическое равновесие между S и P определяется законами термодинамики (как обсуждается далее в следующем разделе этой главы) и представлено отношением скоростей прямой и обратной реакции ( S → P и P → S соответственно).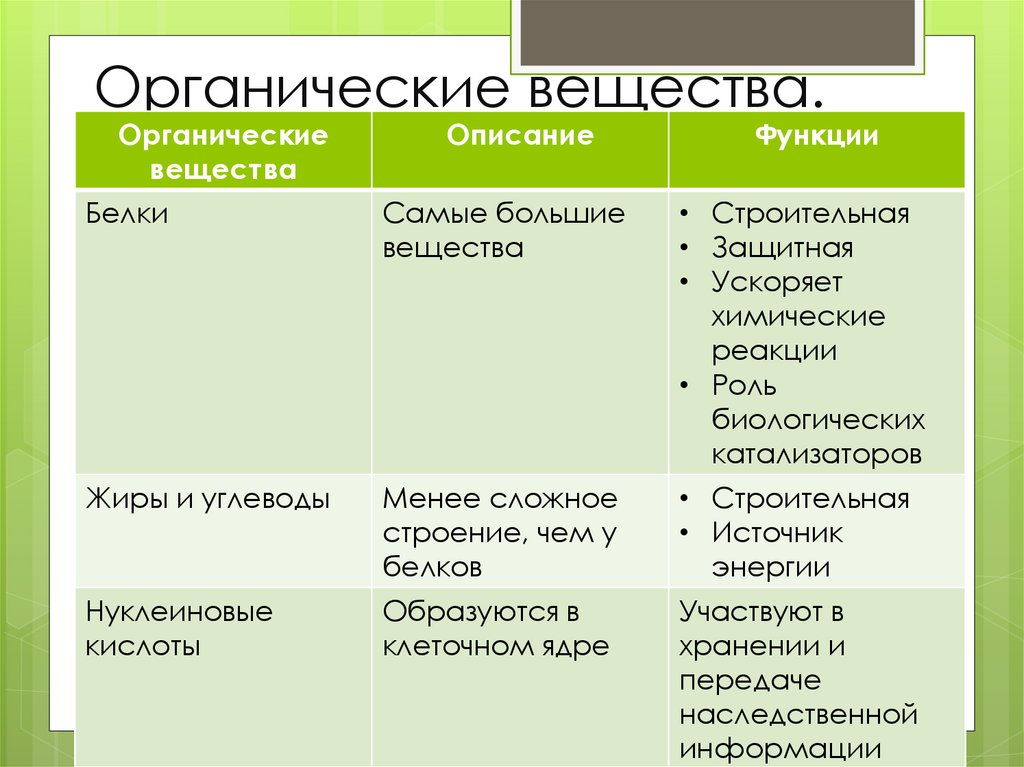 В присутствии соответствующего фермента превращение S до P ускоряется, но равновесие между S и P не изменяется. Следовательно, фермент должен одинаково ускорять и прямую, и обратную реакции. Реакция может быть записана следующим образом:
В присутствии соответствующего фермента превращение S до P ускоряется, но равновесие между S и P не изменяется. Следовательно, фермент должен одинаково ускорять и прямую, и обратную реакции. Реакция может быть записана следующим образом:
Обратите внимание, что фермент ( E ) не изменяется в результате реакции, поэтому химическое равновесие остается неизменным, определяемым исключительно термодинамическими свойствами S и P .
Влияние фермента на такую реакцию лучше всего иллюстрируется изменениями энергии, которые должны происходить при превращении 9от 0009 S до P (). Равновесие реакции определяется конечными энергетическими состояниями S и P , на которые не влияет ферментативный катализ. Однако для того, чтобы реакция продолжалась, субстрат должен сначала быть преобразован в более высокое энергетическое состояние, называемое переходным состоянием . Энергия, необходимая для достижения переходного состояния (энергия активации), представляет собой барьер для протекания реакции, ограничивая скорость реакции. Ферменты (и другие катализаторы) действуют, уменьшая энергию активации, тем самым увеличивая скорость реакции. Повышенная скорость одинакова как в прямом, так и в обратном направлении, поскольку оба должны пройти через одно и то же переходное состояние.
Ферменты (и другие катализаторы) действуют, уменьшая энергию активации, тем самым увеличивая скорость реакции. Повышенная скорость одинакова как в прямом, так и в обратном направлении, поскольку оба должны пройти через одно и то же переходное состояние.
Рисунок 2.22
Энергетические диаграммы для катализируемых и некаталитических реакций. Проиллюстрированная реакция представляет собой простое превращение субстрата S в продукт P. Поскольку конечное энергетическое состояние P ниже, чем у S , реакция протекает слева направо. Для (подробнее…)
Каталитическая активность ферментов заключается в связывании их субстратов с образованием комплекса фермент-субстрат ( ES ). Субстрат связывается с определенной областью фермента, называемой активным центром. Связанный с активным центром субстрат превращается в продукт реакции, который затем высвобождается из фермента. Таким образом, катализируемая ферментом реакция может быть записана следующим образом:
Обратите внимание, что E не меняется в обеих частях уравнения, поэтому равновесие не изменяется. Однако фермент обеспечивает поверхность, на которой реакции превращения S в P могут протекать более легко. Это результат взаимодействий между ферментом и субстратом, которые снижают энергию активации и способствуют образованию переходного состояния.
Однако фермент обеспечивает поверхность, на которой реакции превращения S в P могут протекать более легко. Это результат взаимодействий между ферментом и субстратом, которые снижают энергию активации и способствуют образованию переходного состояния.
Механизмы ферментативного катализа
Связывание субстрата с активным центром фермента представляет собой очень специфическое взаимодействие. Активные центры представляют собой щели или бороздки на поверхности фермента, обычно состоящие из аминокислот из разных частей полипептидной цепи, объединенных в третичную структуру свернутого белка. Субстраты первоначально связываются с активным центром посредством нековалентных взаимодействий, включая водородные связи, ионные связи и гидрофобные взаимодействия. Как только субстрат связывается с активным центром фермента, несколько механизмов могут ускорить его превращение в продукт реакции.
Хотя в простом примере, описанном в предыдущем разделе, использовалась только одна молекула субстрата, большинство биохимических реакций включают взаимодействие между двумя или более различными субстратами.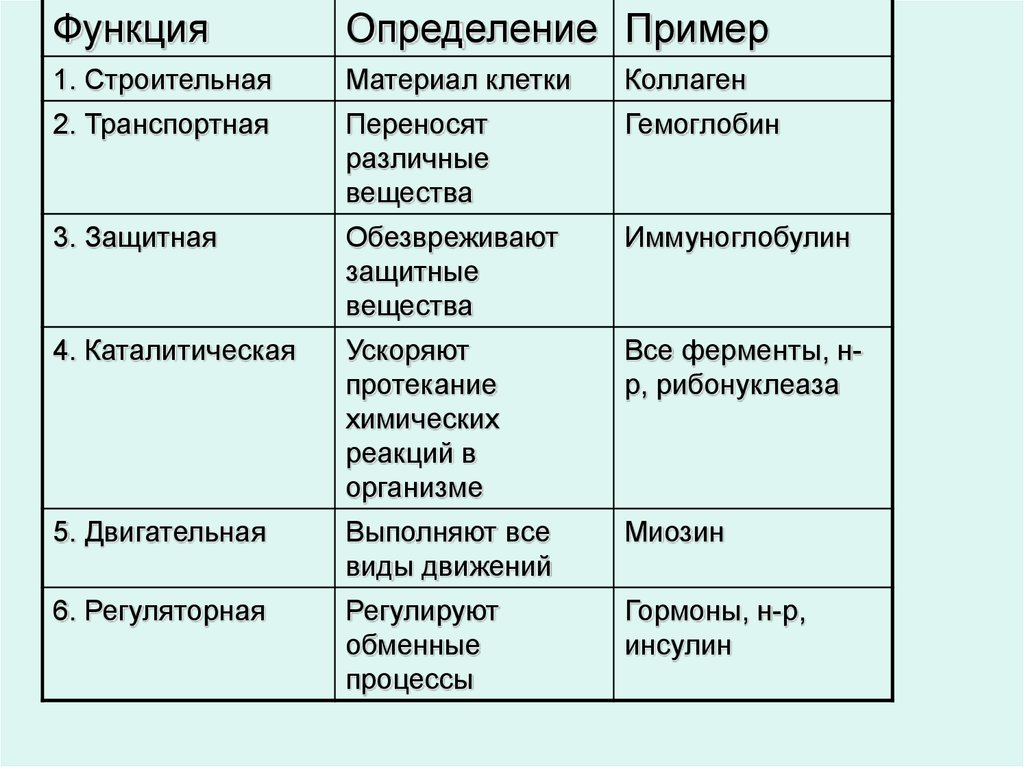 Например, образование пептидной связи предполагает соединение двух аминокислот. Для таких реакций связывание двух или более субстратов с активным центром в правильном положении и ориентации ускоряет реакцию (1). Фермент обеспечивает матрицу, на которой реагенты собираются вместе и должным образом ориентируются, чтобы способствовать образованию переходного состояния, в котором они взаимодействуют.
Например, образование пептидной связи предполагает соединение двух аминокислот. Для таких реакций связывание двух или более субстратов с активным центром в правильном положении и ориентации ускоряет реакцию (1). Фермент обеспечивает матрицу, на которой реагенты собираются вместе и должным образом ориентируются, чтобы способствовать образованию переходного состояния, в котором они взаимодействуют.
Рисунок 2.23
Ферментативный катализ реакции между двумя субстратами. Фермент обеспечивает матрицу, на которой два субстрата соединяются вместе в правильном положении и ориентации для взаимодействия друг с другом.
Ферменты ускоряют реакции также путем изменения конформации их субстратов, приближая их к конформации переходного состояния. Простейшей моделью взаимодействия фермент-субстрат является модель «замок-ключ» , в которой субстрат точно помещается в активный центр (). Однако во многих случаях конфигурация как фермента, так и субстрата модифицируется за счет связывания субстрата — процесс, называемый индуцированная посадка . В таких случаях конформация субстрата изменяется так, что она больше напоминает переходное состояние. Напряжение, создаваемое таким искажением подложки, может дополнительно способствовать ее переходу в переходное состояние за счет ослабления критических связей. Более того, переходное состояние стабилизируется его прочным связыванием с ферментом, что снижает необходимую энергию активации.
В таких случаях конформация субстрата изменяется так, что она больше напоминает переходное состояние. Напряжение, создаваемое таким искажением подложки, может дополнительно способствовать ее переходу в переходное состояние за счет ослабления критических связей. Более того, переходное состояние стабилизируется его прочным связыванием с ферментом, что снижает необходимую энергию активации.
Рисунок 2.24
Модели фермент-субстратного взаимодействия. (A) В модели «замок-ключ» субстрат точно соответствует активному центру фермента. (B) В модели индуцированного соответствия связывание субстрата искажает конформации как субстрата, так и фермента. Это искажение (далее…)
В дополнение к объединению нескольких субстратов и искажению конформации субстратов для приближения к переходному состоянию многие ферменты непосредственно участвуют в каталитическом процессе. В таких случаях специфические боковые цепи аминокислот в активном центре могут реагировать с субстратом и образовывать связи с промежуточными продуктами реакции. Кислотные и основные аминокислоты часто участвуют в этих каталитических механизмах, как показано в последующем обсуждении химотрипсина как примера ферментативного катализа.
Кислотные и основные аминокислоты часто участвуют в этих каталитических механизмах, как показано в последующем обсуждении химотрипсина как примера ферментативного катализа.
Химотрипсин является членом семейства ферментов (сериновых протеаз), которые расщепляют белки, катализируя гидролиз пептидных связей. Реакция может быть записана следующим образом:
Различные представители семейства сериновых протеаз (включая химотрипсин, трипсин, эластазу и тромбин) обладают различной субстратной специфичностью; они преимущественно расщепляют пептидные связи, расположенные рядом с разными аминокислотами. Например, в то время как химотрипсин расщепляет связи рядом с гидрофобными аминокислотами, такими как триптофан и фенилаланин, трипсин расщепляет связи рядом с основными аминокислотами, такими как лизин и аргинин. Однако все сериновые протеазы сходны по структуре и используют один и тот же механизм катализа. Активные центры этих ферментов содержат три критически важные аминокислоты — серин, гистидин и аспартат, — которые управляют гидролизом пептидной связи. Действительно, эти ферменты называются сериновыми протеазами из-за центральной роли остатка серина.
Действительно, эти ферменты называются сериновыми протеазами из-за центральной роли остатка серина.
Субстраты связываются с сериновыми протеазами путем встраивания аминокислоты, примыкающей к сайту расщепления, в карман в активном центре фермента (). Природа этого кармана определяет субстратную специфичность различных членов семейства сериновых протеаз. Например, связывающий карман химотрипсина содержит гидрофобные аминокислоты, которые взаимодействуют с гидрофобными боковыми цепями его предпочтительных субстратов. Напротив, связывающий карман трипсина содержит отрицательно заряженную кислую аминокислоту (аспартат), которая способна образовывать ионную связь с остатками лизина или аргинина своих субстратов.
Рисунок 2.25
Связывание субстрата сериновыми протеазами. Аминокислота, примыкающая к расщепляемой пептидной связи, вставляется в карман в активном центре фермента. У химотрипсина карман связывает гидрофобные аминокислоты; связывающий карман трипсина содержит (подробнее. ..)
..)
Связывание субстрата позиционирует расщепляемую пептидную связь рядом с активным центром серина (). Затем протон этого серина переносится в активный центр гистидина. Конформация активного центра способствует переносу протона, поскольку гистидин взаимодействует с отрицательно заряженным аспартатным остатком. Серин реагирует с субстратом, образуя тетраэдрическое переходное состояние. Затем пептидная связь расщепляется, и С-концевая часть субстрата высвобождается из фермента. Однако N-концевой пептид остается связанным с серином. Эта ситуация разрешается, когда молекула воды (второй субстрат) входит в активный центр и обращает предшествующие реакции. Протон молекулы воды переносится на гистидин, а его гидроксильная группа – на пептид, образуя второе тетраэдрическое переходное состояние. Затем протон переносится с гистидина обратно на серин, а пептид высвобождается из фермента, завершая реакцию.
Рисунок 2.26
Каталитический механизм химотрипсина. Три аминокислоты в активном центре (Ser-195, His-57 и Asp-102) играют решающую роль в катализе.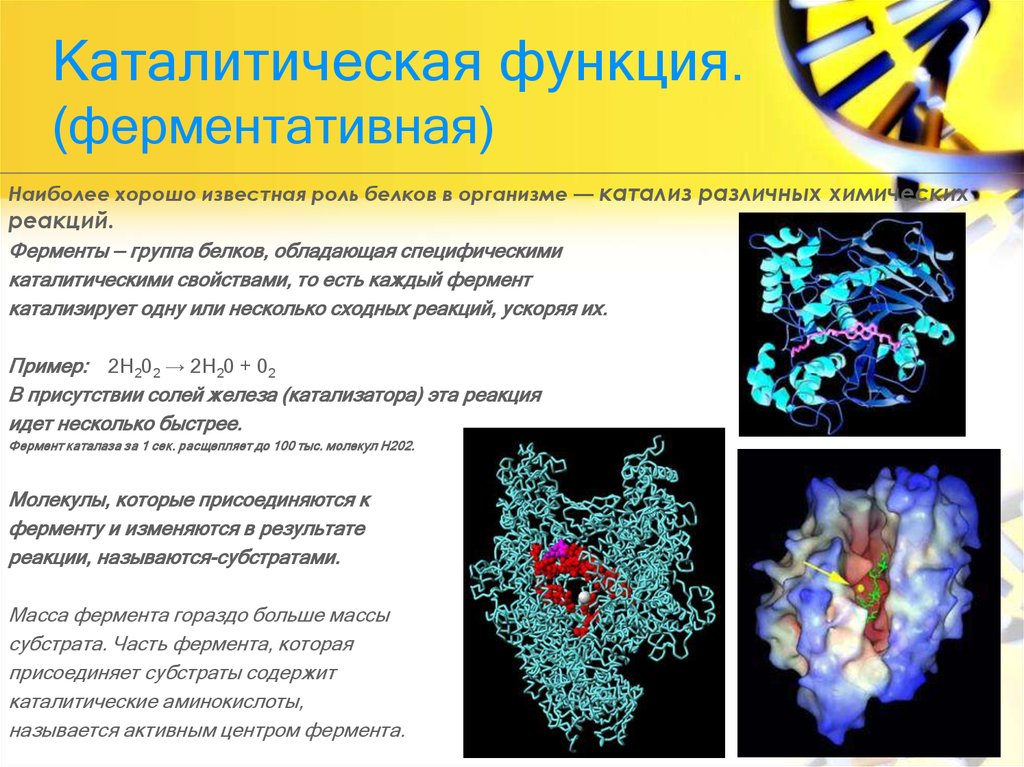
Этот пример иллюстрирует некоторые особенности ферментативного катализа; специфичность фермент-субстратных взаимодействий, расположение различных молекул субстрата в активном центре и участие остатков активного центра в формировании и стабилизации переходного состояния. Хотя тысячи ферментов в клетках катализируют множество различных типов химических реакций, в их работе применяются одни и те же основные принципы.
Коэнзимы
Помимо связывания своих субстратов, активные центры многих ферментов связывают другие малые молекулы, участвующие в катализе. Простетические группы представляют собой небольшие молекулы, связанные с белками, в которых они играют важную функциональную роль. Например, кислород, переносимый миоглобином и гемоглобином, связан с гемом, простетической группой этих белков. Во многих случаях ионы металлов (например, цинка или железа) связаны с ферментами и играют центральную роль в каталитическом процессе. Кроме того, различные низкомолекулярные органические молекулы участвуют в специфических типах ферментативных реакций.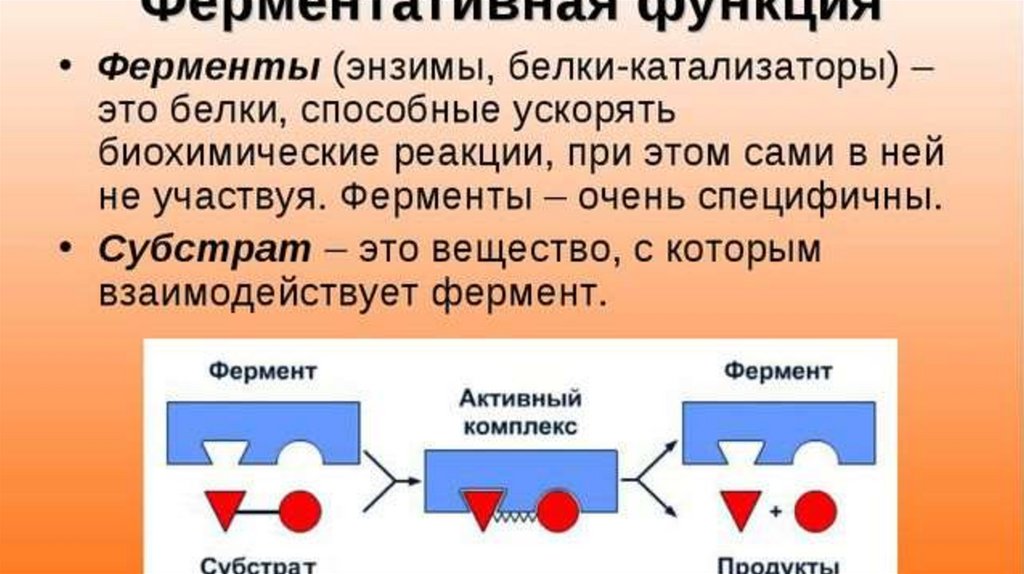 Эти молекулы называются коферментами, потому что они работают вместе с ферментами, увеличивая скорость реакции. В отличие от субстратов коферменты не изменяются необратимо в результате реакций, в которых они участвуют. Скорее, они перерабатываются и могут участвовать во множестве ферментативных реакций.
Эти молекулы называются коферментами, потому что они работают вместе с ферментами, увеличивая скорость реакции. В отличие от субстратов коферменты не изменяются необратимо в результате реакций, в которых они участвуют. Скорее, они перерабатываются и могут участвовать во множестве ферментативных реакций.
Коэнзимы служат переносчиками нескольких типов химических групп. Ярким примером кофермента является никотинамидадениндинуклеотид ( НАД + ), который функционирует как переносчик электронов в окислительно-восстановительных реакциях (). НАД + может принять ион водорода (Н + ) и два электрона (е — ) с одного субстрата, образуя НАДН. Затем НАДН может отдавать эти электроны второму субстрату, повторно образуя НАД + . Таким образом, НАД + переносит электроны с первого субстрата (который окисляется) на второй (который восстанавливается).
Рис. 2.27
Роль НАД + в окислительно-восстановительных реакциях.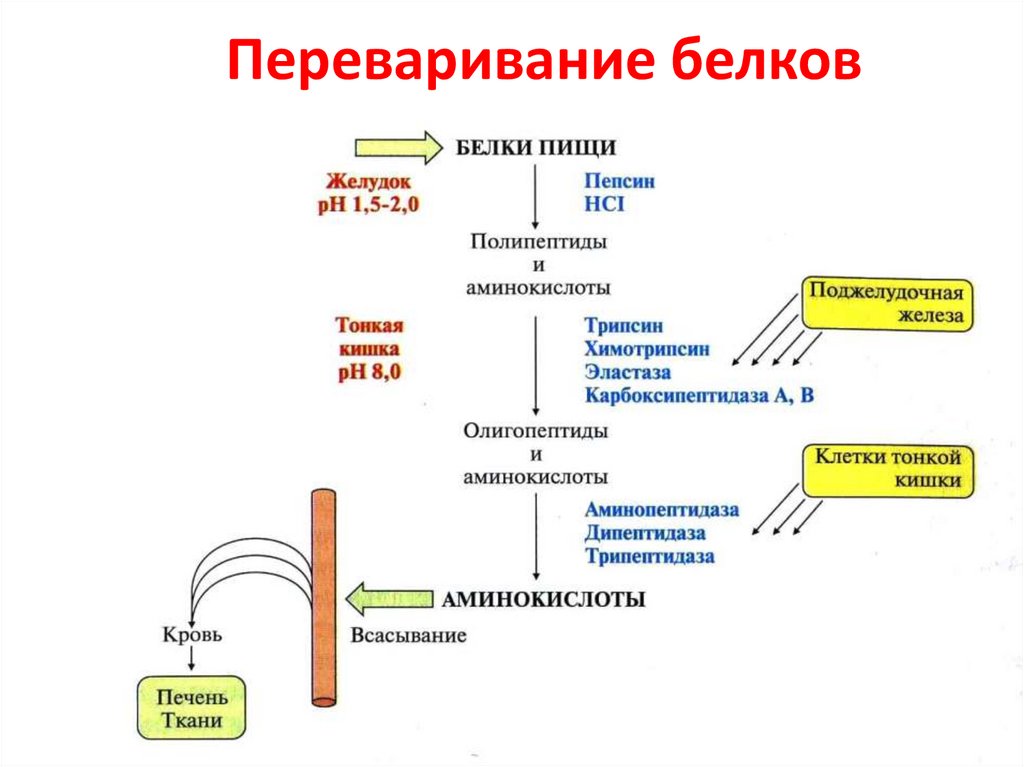 (A) Никотинамидадениндинуклеотид (НАД + ) действует как переносчик электронов в окислительно-восстановительных реакциях, принимая электроны (е — ) с образованием НАДН. (B) Например, NAD + может принимать электроны от одного субстрата (подробнее…)
(A) Никотинамидадениндинуклеотид (НАД + ) действует как переносчик электронов в окислительно-восстановительных реакциях, принимая электроны (е — ) с образованием НАДН. (B) Например, NAD + может принимать электроны от одного субстрата (подробнее…)
Несколько других коферментов также действуют как переносчики электронов, а третьи участвуют в переносе множества дополнительных химических групп (например, , карбоксильные группы и ацильные группы; ). Одни и те же коферменты действуют вместе с множеством различных ферментов, катализируя перенос определенных химических групп между широким спектром субстратов. Многие коферменты тесно связаны с витаминами, которые частично или полностью составляют структуру кофермента. Витамины не требуются бактериям, таким как E. coli , но являются необходимыми компонентами рациона человека и других высших животных, утративших способность синтезировать эти соединения.
Таблица 2.1
Примеры коферментов и витаминов.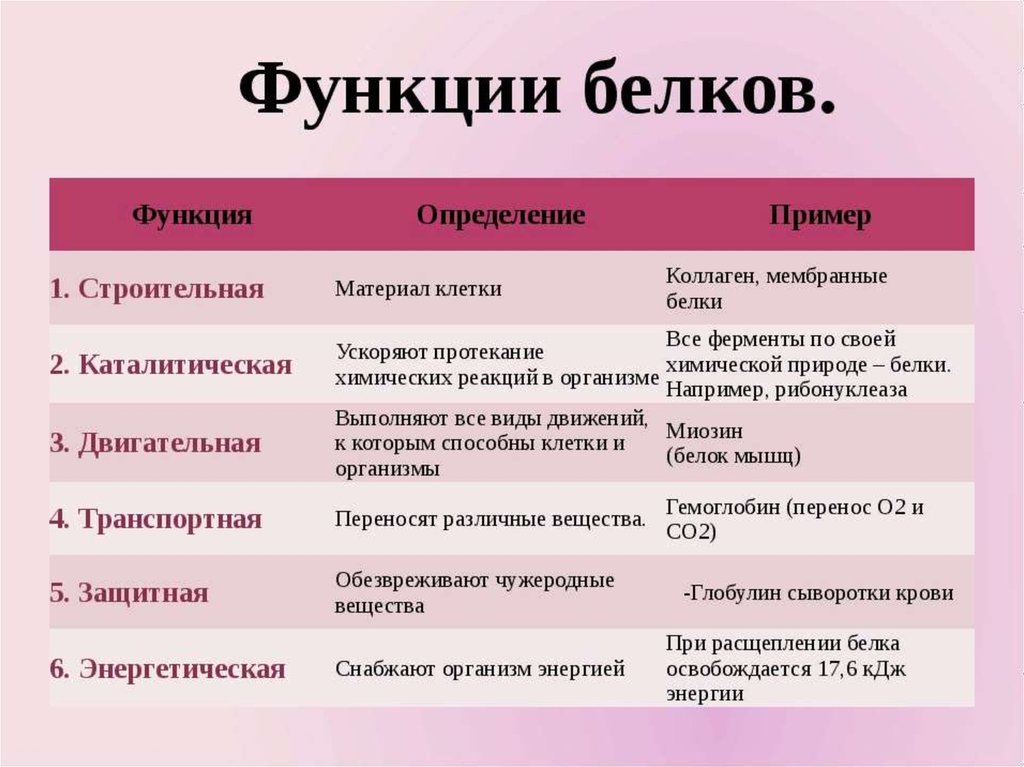
Регулирование активности ферментов
Важной особенностью большинства ферментов является то, что их активность не постоянна, а может модулироваться. То есть активность ферментов можно регулировать так, чтобы они функционировали надлежащим образом для удовлетворения различных физиологических потребностей, которые могут возникнуть в течение жизни клетки.
Одним из распространенных типов регуляции ферментов является ингибирование по принципу обратной связи, при котором продукт метаболического пути ингибирует активность фермента, участвующего в его синтезе. Например, аминокислота изолейцин синтезируется серией реакций, начиная с аминокислоты треонина (). Первый этап пути катализируется ферментом треониндезаминазой, которая ингибируется изолейцином, конечным продуктом пути. Таким образом, достаточное количество изолейцина в клетке ингибирует треониндезаминазу, блокируя дальнейший синтез изолейцина. Если концентрация изолейцина снижается, ингибирование по принципу обратной связи снимается, треониндезаминаза больше не ингибируется и синтезируется дополнительный изолейцин.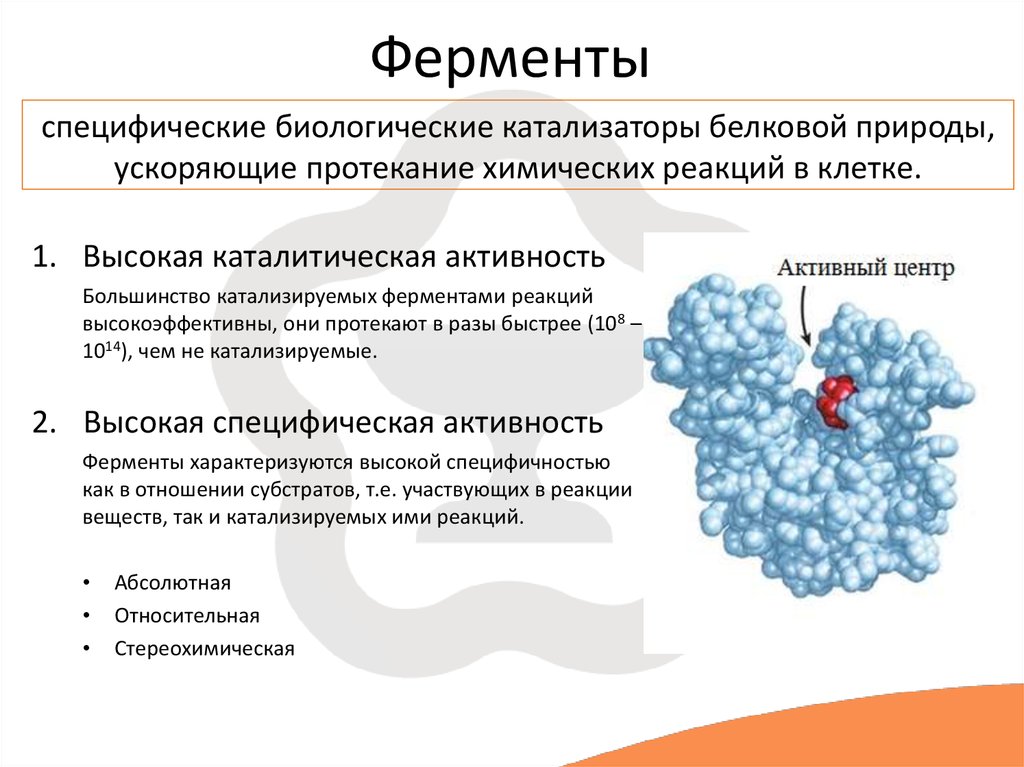 Регулируя таким образом активность треониндезаминазы, клетка синтезирует необходимое количество изолейцина, но избегает затрат энергии на синтез большего количества изолейцина, чем необходимо.
Регулируя таким образом активность треониндезаминазы, клетка синтезирует необходимое количество изолейцина, но избегает затрат энергии на синтез большего количества изолейцина, чем необходимо.
Рисунок 2.28
Подавление обратной связи. Первый этап превращения треонина в изолейцин катализируется ферментом треониндезаминазой. Активность этого фермента ингибируется изолейцином, конечным продуктом пути.
Ингибирование по принципу обратной связи является одним из примеров аллостерической регуляции, при которой активность фермента контролируется путем связывания небольших молекул с регуляторными участками фермента (). Термин «аллостерическая регуляция» происходит от того факта, что регуляторные молекулы связываются не с каталитическим участком, а с отдельным участком на белке (9).0009 алло = «другое» и steric = «сайт»). Связывание регуляторной молекулы изменяет конформацию белка, что, в свою очередь, изменяет форму активного центра и каталитическую активность фермента.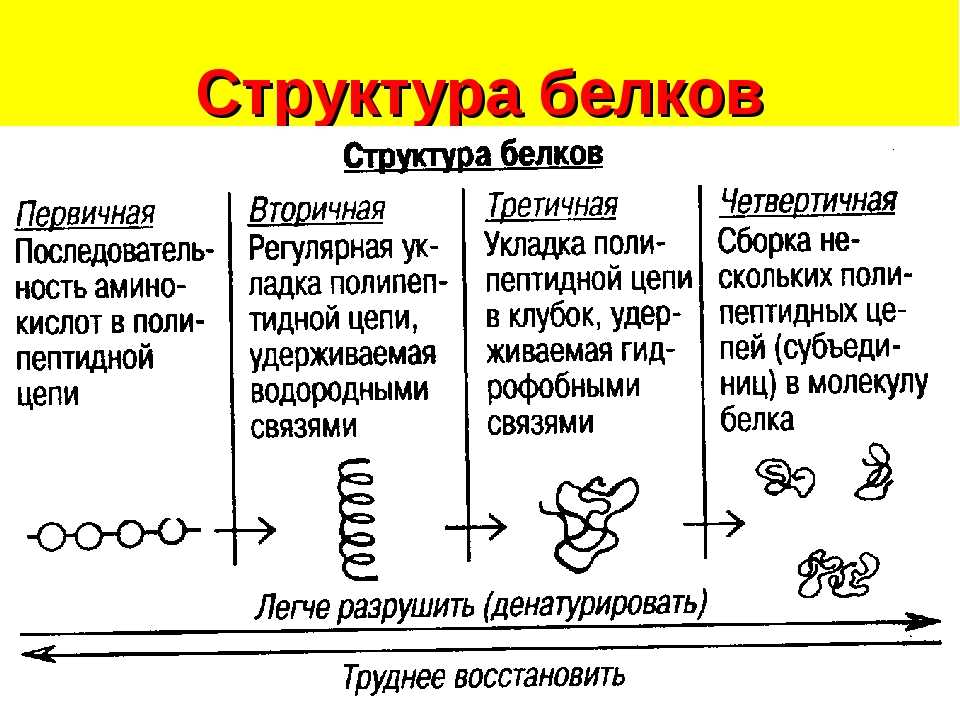 В случае треониндезаминазы связывание регуляторной молекулы (изолейцина) ингибирует ферментативную активность. В других случаях регуляторные молекулы служат активаторами, стимулируя, а не ингибируя ферменты-мишени.
В случае треониндезаминазы связывание регуляторной молекулы (изолейцина) ингибирует ферментативную активность. В других случаях регуляторные молекулы служат активаторами, стимулируя, а не ингибируя ферменты-мишени.
Рис. 2.29
Аллостерическая регуляция. В этом примере активность фермента ингибируется связыванием регуляторной молекулы с аллостерическим сайтом. В отсутствие ингибитора субстрат связывается с активным центром фермента, и реакция протекает. Переплет (далее…)
Активность ферментов можно также регулировать путем их взаимодействия с другими белками и ковалентными модификациями, такими как добавление фосфатных групп к остаткам серина, треонина или тирозина. Фосфорилирование является особенно распространенным механизмом регуляции активности ферментов; добавление фосфатных групп либо стимулирует, либо ингибирует активность многих различных ферментов (). Например, мышечные клетки реагируют на эпинефрин (адреналин), расщепляя гликоген на глюкозу, тем самым обеспечивая источник энергии для повышения мышечной активности.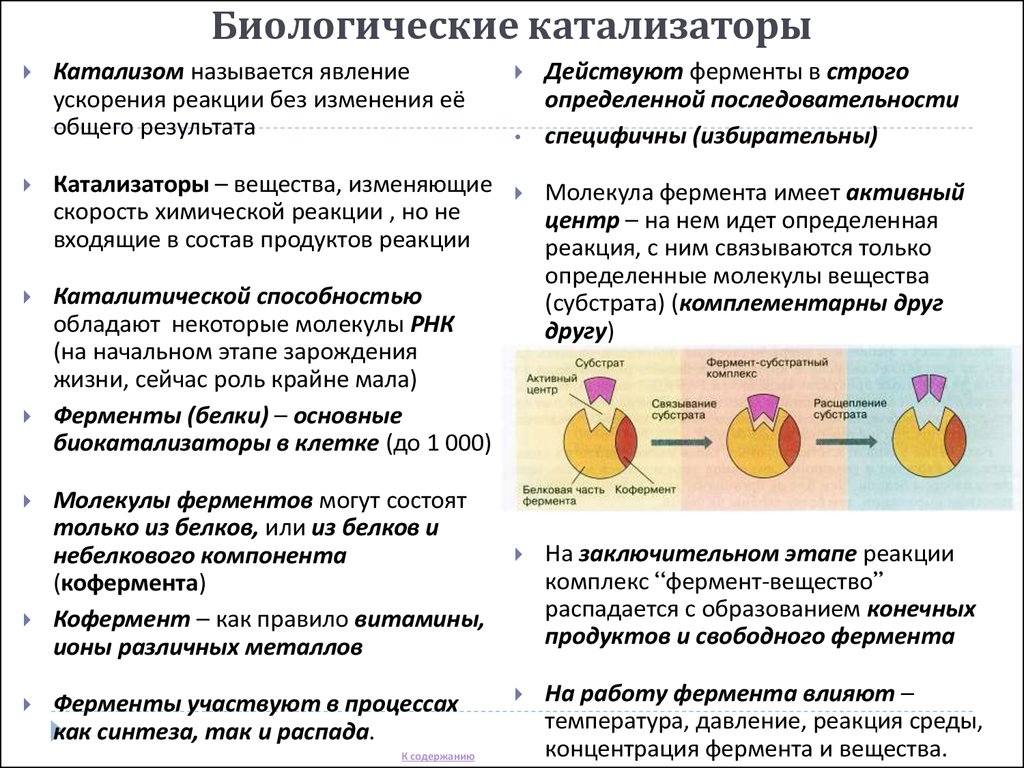 Расщепление гликогена катализируется ферментом гликогенфосфорилазой, который активируется путем фосфорилирования в ответ на связывание адреналина с рецептором на поверхности мышечной клетки. Фосфорилирование белков играет центральную роль в контроле не только метаболических реакций, но и многих других клеточных функций, включая рост и дифференцировку клеток.
Расщепление гликогена катализируется ферментом гликогенфосфорилазой, который активируется путем фосфорилирования в ответ на связывание адреналина с рецептором на поверхности мышечной клетки. Фосфорилирование белков играет центральную роль в контроле не только метаболических реакций, но и многих других клеточных функций, включая рост и дифференцировку клеток.
Рис. 2.30
Фосфорилирование белков. Некоторые ферменты регулируются добавлением фосфатных групп к ОН-группам боковых цепей остатков серина (как показано здесь), треонина или тирозина. Например, фермент гликогенфосфорилаза, катализирующий превращение (подробнее…)
Как ферменты ускоряют химическую реакцию?
X
Главная
Войти
Корзина
Информация для заказа
Продукты
Услуги
Tools
Resources
About Us
Careers
Contact Us
Distributors
Terms of Use
Terms of Sales
Privacy
AAT Bioquest
AAT Bioquest | Contact us
Информация для заказа
| ||||||||||||||||||||||||||
.0003
Физиологические зонды
Метаболизм клеток
Ответ
Ферменты ускоряют химическую реакцию, снижая энергию активации, необходимую для соединения реагентов и реакции. Энергия активации относится к энергии, необходимой для запуска химической реакции между двумя или более реагентами. Некоторые реакции требуют большого количества энергии активации, которая действует как энергетический барьер, затрудняющий объединение реагентов и реакцию. Ферменты уменьшают энергию, необходимую для соединения реагентов, увеличивая скорость химической реакции. Ферменты могут ускорять химические реакции тремя различными способами:
Энергия активации относится к энергии, необходимой для запуска химической реакции между двумя или более реагентами. Некоторые реакции требуют большого количества энергии активации, которая действует как энергетический барьер, затрудняющий объединение реагентов и реакцию. Ферменты уменьшают энергию, необходимую для соединения реагентов, увеличивая скорость химической реакции. Ферменты могут ускорять химические реакции тремя различными способами:
- Они могут сближать реагенты, облегчая их взаимодействие друг с другом, вместо того, чтобы тратить энергию на перемещение до тех пор, пока они случайно не столкнутся.
- Они могут направлять реакцию по другому пути, требующему меньшей энергии активации.
- Они могут правильно позиционировать реагенты, связывая их в активном центре. Это позволяет реагентам взаимодействовать с меньшей энергией, поскольку им не нужно будет преодолевать межмолекулярные силы, которые в противном случае раздвинули бы их.
Скорость, с которой фермент ускоряет химическую реакцию, может зависеть от температуры, ионных условий и рН окружающей среды.


 Обеспечивают прочность тканей и клеточных структур.
Обеспечивают прочность тканей и клеточных структур.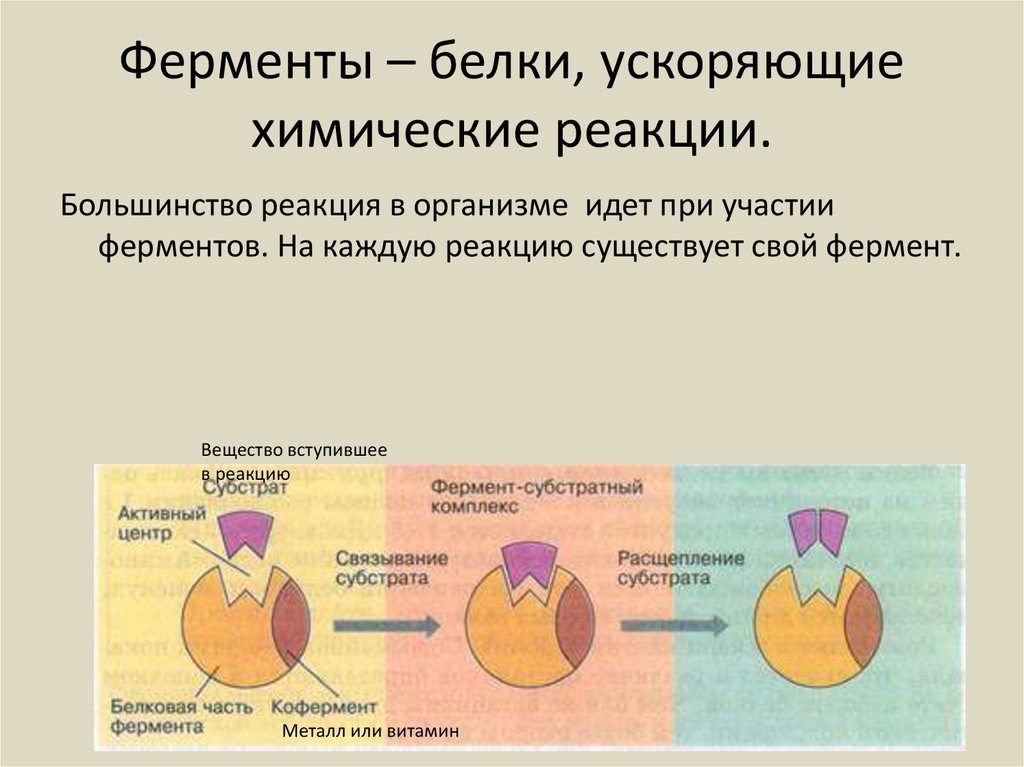
Leave A Comment