1.5 Проскок (провал) электронов
Проскок электрона — отступления от общей для большинства элементов последовательности заполнения электронных оболочек, связанные с тем, что эти “нарушения правил” обеспечивают атомам некоторых элементов меньшую энергию по сравнению с заполнением электронных оболочек “по правилам”.
Объясняется это тем, что энергетически более выгодно, когда в атоме имеется наполовину или полностью заполненный подуровень (р3 ; р6 ; d5 ; d10 ; f7; f14). Поэтому в атомах элементов, у которых строение электронной оболочки близко к вышеуказанному, может наблюдаться преждевременное заполнение d– подуровня за счёт проскока ( или повала) электрона с внешнего s– подуровня на нижележащий (предвнешний) d– подуровень.
Для ряда элементов закономерные проскоки приведены в таблице 1.
Таблица 1– Проскоки электронов
Элемент | Атомная валентная зона | |
теоретическая | практическая | |
Cu | 3d9 4s2 | 3d10 4s1 |
Ag | 4d9 5s2 | 4d10 5s1 |
Au | 5d | 5d10 6s1 |
Cr | 3d4 4s2 | 3d5 4s1 |
Mo | 4d45s2 | 4d5 5s1 |
Согласно
приведенным электронным конфигурациям
медь одновалентна, так как в атоме
только один неспаренный электрон.
На практике оказывается, что Cu проявляет валентность, равную двум. Следовательно, возможен, вопреки правилу, переход одного проскочившего электрона с предпоследнего 3d- подуровня на внешний 4р- подуровень. На рисунке 5 показано расширение атомной валентной зоны атома меди.
3d 4s 4p 3d 4s 4p
Рисунок 5– Расширение атомной валентной зоны атома меди
В этом случае максимальная валентность меди будет равна трем. На практике медь проявляет валетность (В) равную единице и двум.
Для золота характерна валентность В = 1; 2; 3. Расширение валентной зоны происходит таким же образом, как у меди. На практике золото обычно имеет валентность, равную трем, поскольку оно стоит в шестом периоде и электроны ядром удерживаются слабее.
Серебро же, хотя и имеет сходную структуру АВЗ,
проявляет единственную валентность,
равную единице.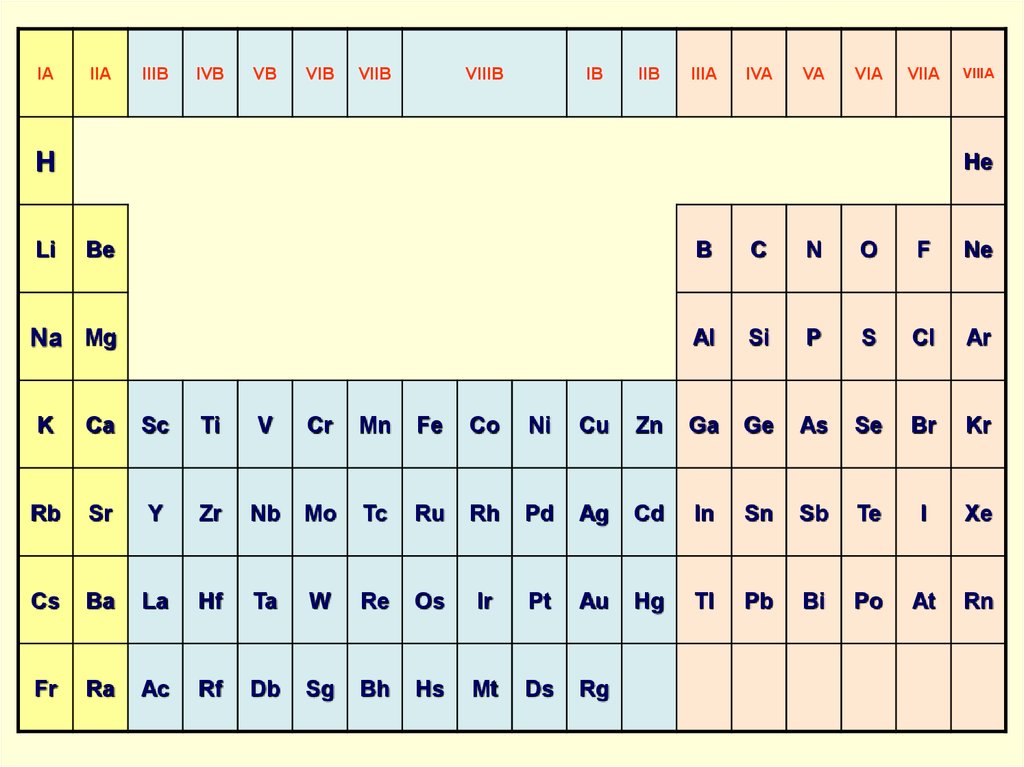
Хром и молибдена имеют одинаковое строение АВЗ и проявляют одинаковую валентность от двух до шести.
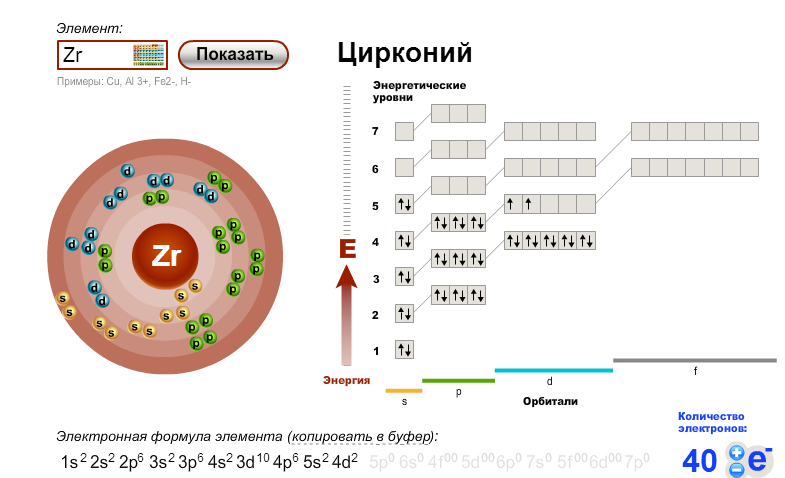
В современной формулировке периодический закон звучит так: свойства химических элементов, а также свойства и форма образуемых ими соединений находятся в периодической зависимости от заряда их атомов
Периодическая система состоит из периодов и групп.
Периодом называется последовательный ряд элементов, расположенных в порядке возрастания заряда ядра их атомов, электронная конфигурация которых изменяется от ns1 до ns2np6 (или до ns2 у первого периода).
Все
периоды начинаются с s-элемента
и заканчиваются p-элементом
(у первого периода s-элементом).
Малые периоды содержат 2 и 8 элементов,
большие периоды – 18 и 32 элемента, седьмой
период остается незавершенным.
По вертикали в таблице расположено 8 групп, в которых один под другим размещены элементы, имеющие сходные свойства. Атомы элементов одной и той же группы имеют одинаковое число валентных электронов.
Количество валентных электронов в оболочке атома, как правило, равно номеру группы, в которой находится элемент.
Группы делятся на подгруппы – главные и побочные. Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы-аналоги).
В главных подгруппах расположены s–элементы (I, II групп) и p–элементы (III-VIII групп). В атомах элементов главных подгрупп валентные электроны находятся на s– и р–подуровнях внешнего энергетического уровня и общее их число равно номеру группы.
В
побочных подгруппах располагаются d— и f—элементы.
Валентные электроны в атомах d—элементов
находятся на s—подуровне
внешнего и d—подуровне
предпоследнего энергетических уровней.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
Подготовка к выполнению задания ЕГЭ по химии №1 в формате 2020. Разбор заданий и отработка навыка выполнения.
Вопрос №1 «Строение атома»
Подготовка к ЕГЭ, алгоритмы выполнения
1 тип заданий
Определите, атомы каких из указанных элементов в основном состоянии содержат одинаковое число электронов на внешнем уровне
Необходимая теория:
Основное состояние атома – это наиболее устойчивое состояние атома, в котором энергия его электронной оболочки минимальная (обычное состояние)
Электроны на внешнем уровне – определяем по номеру группы (для элементов главных подгрупп), равно 2 ( для элементов побочных подгрупп, кроме Cr, Cu,Mo,Ru,Rh,Pd) Cr, Cu,Mo,Ru,Rh,Pd (для них =1) — у атомов этих элементов происходит «провал» электронов внешнего уровня с 4 s на 3 d подуровень, что объясняется большей энергетической устойчивостью, образующейся конфигурации.
Определите , атомы каких из указанных элементов в основном состоянии содержат одинаковое число электронов на внешнем уровне 1) Na; 2)Cl; 3)Si; 4)Mn; 5)Cr
Ответ 1,5
Na – элемент 1 группы главной подгруппы; Cr – элемент побочной подгруппы с провалом электрона.
2 тип заданий
Определите, атомы каких из указанных элементов в основном состоянии во внешнем слое содержат один неспаренный электрон
Необходимая теория: можно составлять электронно-графические формулы и считать.
Можно запомнить и использовать информацию, что у элементов главных подгрупп 1,3,7групп – 1 неспаренный электрон; у элементов 4,6 групп – 2 неспаренных электрона; у элементов 5 группы – 3 неспаренных электрона; у элементов 2 и 8 групп неспаренных электронов нет.
У элементов побочных подгрупп : у всех 2 спаренных электрона, кроме Cr, Cu,Mo,Ru,Rh по причине «провала» электронов.
Определите, атомы каких из указанных элементов в основном состоянии во внешнем слое содержат один неспаренный электрон : 1) Li; 2)C; 3)Cu; 4) Mn; 5)O
Ответ: 1,3
Li – элемент 1 группы главной подгруппы; Cu – элемент побочной подгруппы с провалом электрона.
3 тип задания
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns
Необходимая теория : конфигурации основного состояния
ns 1
Элементы 1 группы
ns 2
Элементы 2 группы и He
ns 2 n p 1
ns 2 n p 2
Элементы 3 группы
Элементы 4 группы
ns 2 n p 3
Элементы 5 группы
ns 2 n p 4
Элементы 6 группы
ns 2 n p 5
Элементы 7 группы
ns 2 n p 6
Элементы 8 группы
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня
Ответ: 1,3
Li и Cs – элементы первой группы
Второй вариант заданий данного типа
Определите, атомы каких из указанных в ряду элементов в возбужденном состоянии имеют электронную конфигурацию внешнего энергетического уровня ns 1 n p 3
1 ) Al; 2)B; 3) C; 4) N; 5)Si
Ответ: 3,5
Необходимая теория: возбужденное состояние могут приобретать атомы элементов, которые в своем строении имеют «вакантные» пустые электронные орбитали
4 тип заданий
Определите, атомы каких из указанных элементов в основном состоянии содержат одинаковое число валентных электронов
Необходимая теория: количество валентных электронов (максимальная валентность) равна номеру групп в таблице Менделеева.
Валентность определяется:
- Числом неспаренных электронов;
- Числом вакантных орбиталей на валентном слое атомов элемента.
Определите, атомы каких из указанных элементов в основном состоянии содержат одинаковое число валентных электронов 1) Na; 2) Cl; 3) Si; 4) Mn; 5)Cr
Ответ: 2,4 – это элементы 7 группы
5 тип заданий
либо s – электроны и т.д.
Необходимая теория:
S
У элементов 1 и 2 группы, а также у гелия
P
У элементов 3,4,5,6,7,8 групп, главных подгрупп
d
У элементов побочных подгрупп, предыдущего энергетического уровня, начиная с 3 энергетического уровня
f
У элементов побочных подгрупп, предпредыдущего энергетического уровня начиная с 4 энергетического уровня
Встречающиеся задания
- По изменениям в атоме
Необходимая теория и алгоритм выполнения
п1.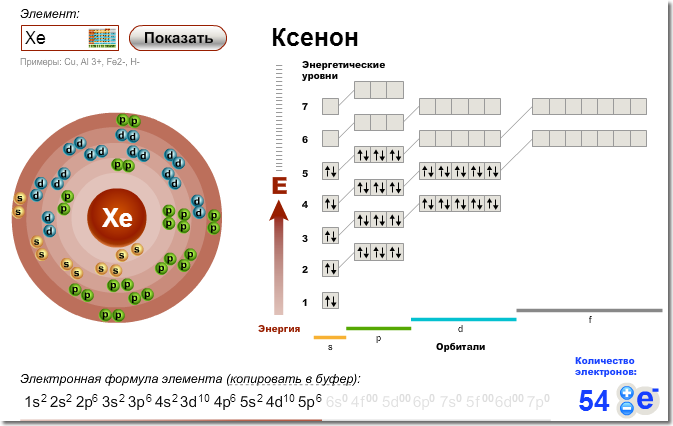 Для подсчета количества электронов в частицах пользуемся таблицей Менделеева. Находим по порядковому номеру общее количество электронов в атоме и, если частица превращена в анион , к общему количеству электронов атома прибавляем число заряда с минусом ; если частица превращена в катион , от общего количества электронов атома отнимаем число заряда с плюсом.
Для подсчета количества электронов в частицах пользуемся таблицей Менделеева. Находим по порядковому номеру общее количество электронов в атоме и, если частица превращена в анион , к общему количеству электронов атома прибавляем число заряда с минусом ; если частица превращена в катион , от общего количества электронов атома отнимаем число заряда с плюсом.
п2.Если в задании дана конфигурация, тогда общее количество электронов считаем, складывая степенные значения в конфигурации, затем выполняем так же,
как в п. 1.
По строению атома, изотопам или ядра атома
Нарушение правила октета
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1994
Можно построить три случая, которые не следуют правилу октетов, и поэтому они известны как исключения из правила октетов. Следование правилу октетов для точечных структур Льюиса приводит к наиболее точному изображению стабильных молекулярных и атомных структур, и поэтому мы всегда хотим использовать правило октетов при рисовании точечных структур Льюиса. Однако трудно представить, чтобы все молекулы могли следовать одному правилу. Всегда есть исключение, и в данном случае три исключения. Правило октета нарушается в следующих трех сценариях:
Следование правилу октетов для точечных структур Льюиса приводит к наиболее точному изображению стабильных молекулярных и атомных структур, и поэтому мы всегда хотим использовать правило октетов при рисовании точечных структур Льюиса. Однако трудно представить, чтобы все молекулы могли следовать одному правилу. Всегда есть исключение, и в данном случае три исключения. Правило октета нарушается в следующих трех сценариях:
- При нечетном числе валентных электронов
- Когда валентных электронов слишком мало
- Когда слишком много валентных электронов
Напоминание: всегда используйте правило октета при рисовании точечных структур Льюиса, эти исключения будут возникать только при необходимости.
Исключение 1: Виды с нечетным числом электронов
Первое исключение из правила октета — когда имеется нечетное число валентных электронов. Примером этого может быть молекула оксида азота (II) (\(NO\)). Атом азота имеет 5 валентных электронов, а атом кислорода имеет 6 электронов. Всего будет использовано 11 валентных электронов. Правило октета для этой молекулы выполняется в приведенном выше примере, однако это с 10 валентными электронами. Последний не знает, куда идти. Одинокий электрон называется неспаренным электроном. Но куда деваться неспаренному электрону? Неспаренный электрон обычно помещают в точечную структуру Льюиса, так что каждый элемент в структуре будет иметь самая низкая возможная формальная плата. Формальный заряд равен воспринимаемому заряду отдельного атома в молекуле, когда атомы не вносят равное количество электронов в связи, в которых они участвуют . Формула для нахождения формального заряда:
Всего будет использовано 11 валентных электронов. Правило октета для этой молекулы выполняется в приведенном выше примере, однако это с 10 валентными электронами. Последний не знает, куда идти. Одинокий электрон называется неспаренным электроном. Но куда деваться неспаренному электрону? Неспаренный электрон обычно помещают в точечную структуру Льюиса, так что каждый элемент в структуре будет иметь самая низкая возможная формальная плата. Формальный заряд равен воспринимаемому заряду отдельного атома в молекуле, когда атомы не вносят равное количество электронов в связи, в которых они участвуют . Формула для нахождения формального заряда:
Формальный заряд = [количество валентностей e — атом будет иметь сам по себе] — [количество электронов неподеленной пары на этом атоме] — [число валентностей облигации, в которых участвует атом]
Идеальная ситуация – отсутствие формального обвинения. +\) с десятью валентными электронами, то была бы построена следующая структура Льюиса: 9+\) ион с десятью валентными электронами.
+\) с десятью валентными электронами, то была бы построена следующая структура Льюиса: 9+\) ион с десятью валентными электронами.
Азот обычно имеет пять валентных электронов. На рисунке 1 у него есть две неподеленные пары электронов, и он участвует в двух связях (двойная связь) с кислородом. В результате азот имеет формальный заряд +1. Кислород обычно имеет шесть валентных электронов. На рисунке 1 кислород имеет четыре неподеленные пары электронов и участвует в двух связях с азотом. Следовательно, кислород имеет формальный заряд 0. Общая молекула здесь имеет формальный заряд +1 (+1 для азота, 0 для кислорода. +1 + 0 = +1). Однако если мы добавим одиннадцатый электрон к азоту (потому что мы хотим, чтобы молекула имела наименьший общий формальный заряд), он сведет как азот, так и общий заряд молекулы к нулю, что является наиболее идеальной ситуацией с формальным зарядом. Именно это и делается, чтобы получить правильную структуру Льюиса для монооксида азота:
Рисунок 2. Правильная структура Льюиса для молекулы \(NO\) с 11 валентными электронамиСвободные радикалы
На самом деле очень мало стабильных молекул с нечетными номерами существующих электронов, поскольку этот неспаренный электрон готов реагировать с другими неспаренными электронами. Большинство нечетных видов электронов обладают высокой реакционной способностью, которую мы называем Свободные радикалы . Из-за своей нестабильности свободные радикалы связываются с атомами, у которых они могут взять электрон, чтобы стать стабильными, что делает их очень химически реактивными. Радикалы встречаются как в виде реагентов, так и в виде продуктов, но обычно реагируют с образованием более стабильных молекул, как только могут. Чтобы подчеркнуть существование неспаренного электрона, радикалы обозначаются точкой перед их химическим символом, например \({\cdot}OH\), гидроксильным радикалом. Примером радикала, с которым вы, возможно, уже знакомы, является газообразный атом хлора, обозначаемый \({\cdot}Cl\). Интересно, что молекулы с нечетным числом валентных электронов будут всегда быть парамагнитным.
Большинство нечетных видов электронов обладают высокой реакционной способностью, которую мы называем Свободные радикалы . Из-за своей нестабильности свободные радикалы связываются с атомами, у которых они могут взять электрон, чтобы стать стабильными, что делает их очень химически реактивными. Радикалы встречаются как в виде реагентов, так и в виде продуктов, но обычно реагируют с образованием более стабильных молекул, как только могут. Чтобы подчеркнуть существование неспаренного электрона, радикалы обозначаются точкой перед их химическим символом, например \({\cdot}OH\), гидроксильным радикалом. Примером радикала, с которым вы, возможно, уже знакомы, является газообразный атом хлора, обозначаемый \({\cdot}Cl\). Интересно, что молекулы с нечетным числом валентных электронов будут всегда быть парамагнитным.
Исключение 2: неполные октеты
Второе исключение из правила октетов возникает, когда слишком мало валентных электронов приводит к неполному октету. Есть еще больше случаев, когда правило октетов не дает наиболее точного описания молекулы или иона. Это также относится к неполным октетам. Виды с неполными октетами довольно редки и обычно встречаются только в некоторых соединениях бериллия, алюминия и бора, включая гидриды бора. Давайте взглянем на один из таких гидридов, \(BH_3\) (боран).
Есть еще больше случаев, когда правило октетов не дает наиболее точного описания молекулы или иона. Это также относится к неполным октетам. Виды с неполными октетами довольно редки и обычно встречаются только в некоторых соединениях бериллия, алюминия и бора, включая гидриды бора. Давайте взглянем на один из таких гидридов, \(BH_3\) (боран).
Если бы кто-то создал структуру Льюиса для \(BH_3\), следуя основным стратегиям рисования структур Льюиса, вероятно, получилась бы следующая структура (Рисунок 3):
Рисунок 3: Структура молекулы борана. Проблема с этой структурой в том, что у бора есть неполный октет; у него только шесть электронов вокруг него. Атомы водорода, естественно, могут иметь только 2 электрона на своей внешней оболочке (их версия октета), и поэтому у них нет запасных электронов для образования двойной связи с бором. Можно предположить, что неспособность этой структуры сформировать полные октеты должна означать, что эта связь должна быть ионной, а не ковалентной.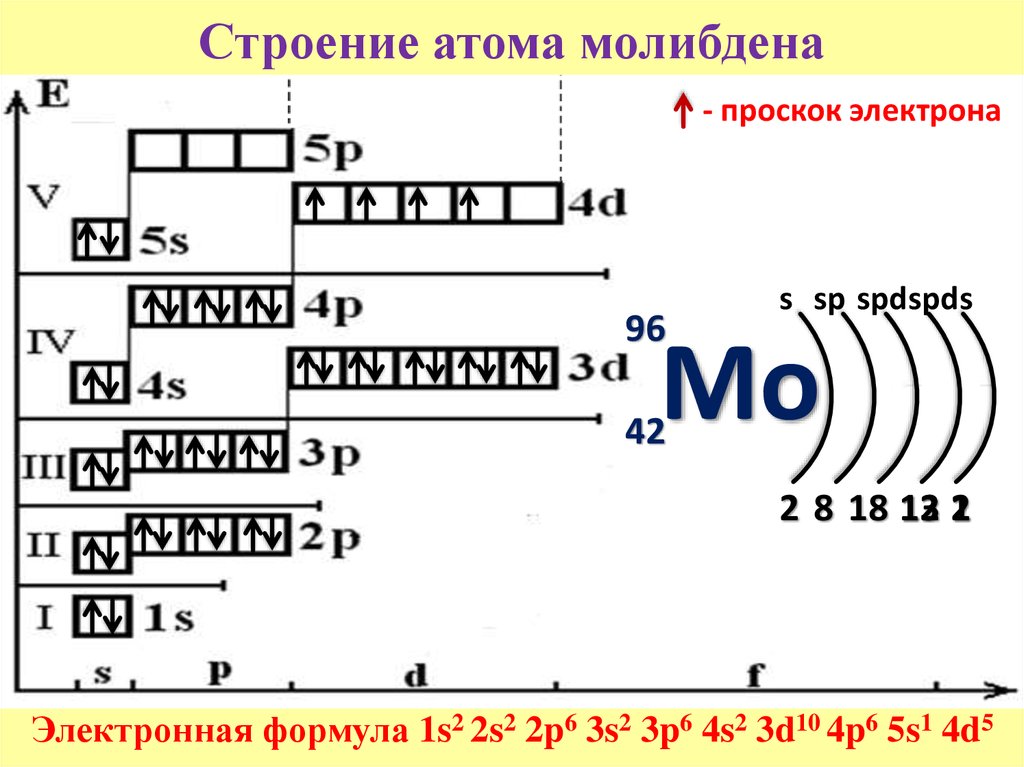 Однако бор имеет электроотрицательность, очень похожую на водород, а это означает, что в связях водорода и бора, вероятно, очень мало ионного характера, и поэтому эта структура Льюиса, хотя и не соответствует правилу октета, вероятно, является наилучшей возможной структурой. для изображения ЧД 3 с теорией Льюиса. Одна из вещей, которая может объяснить неполный октет BH 3 , заключается в том, что это обычно переходный вид, временно формирующийся в реакциях, которые включают несколько этапов.
Однако бор имеет электроотрицательность, очень похожую на водород, а это означает, что в связях водорода и бора, вероятно, очень мало ионного характера, и поэтому эта структура Льюиса, хотя и не соответствует правилу октета, вероятно, является наилучшей возможной структурой. для изображения ЧД 3 с теорией Льюиса. Одна из вещей, которая может объяснить неполный октет BH 3 , заключается в том, что это обычно переходный вид, временно формирующийся в реакциях, которые включают несколько этапов.
Давайте взглянем на другую ситуацию с неполным октетом, имеющую отношение к бору, BF 3 (бор трехфтористый). Как и в случае с BH 3 , первоначальный рисунок структуры Льюиса BF 3 сформирует структуру, в которой бор имеет только шесть электронов вокруг себя (рис. 4).
Рисунок 4 Если вы посмотрите на рисунок 4, вы увидите, что атомы фтора обладают дополнительными неподеленными парами, которые они могут использовать для образования дополнительных связей с бором, и вы можете подумать, что все, что вам нужно сделать, это превратить одну неподеленную пару в связь и структура будет правильной. Если мы добавим одну двойную связь между бором и одним из атомов фтора, мы получим следующую структуру Льюиса (рис. 5):
Если мы добавим одну двойную связь между бором и одним из атомов фтора, мы получим следующую структуру Льюиса (рис. 5):
У каждого фтора восемь электронов, и у атома бора их тоже восемь! У каждого атома есть идеальный октет, верно? Не так быстро. Мы должны рассмотреть формальные обвинения этой структуры. Фтор, имеющий двойную связь с бором, имеет вокруг себя шесть электронов (четыре от двух неподеленных пар электронов и по одному от двух связей с бором). Это на один электрон меньше, чем естественное количество валентных электронов (у элементов седьмой группы семь валентных электронов), поэтому он имеет формальный заряд +1. Два фторина, которые имеют общие одинарные связи с бором, имеют вокруг себя семь электронов (шесть от их трех неподеленных пар и один от их одинарных связей с бором). Это столько же, сколько валентных электронов они имели бы сами по себе, поэтому они оба имеют формальный нулевой заряд. Наконец, бор имеет четыре электрона вокруг себя (по одному от каждой из его четырех связей, общих с фтором).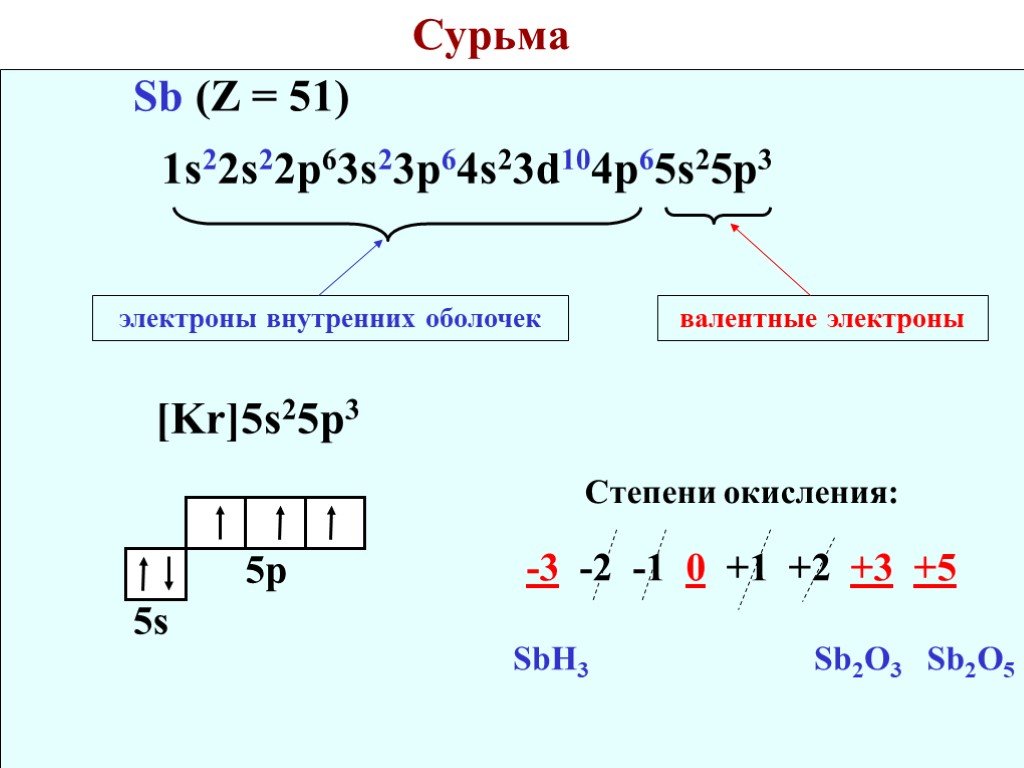 Это на один электрон больше, чем количество валентных электронов, которое бор имел бы сам по себе, и поэтому бор имеет формальный заряд -1.
Это на один электрон больше, чем количество валентных электронов, которое бор имел бы сам по себе, и поэтому бор имеет формальный заряд -1.
Эта структура подтверждается тем фактом, что экспериментально определенная длина связи бора и фтора в BF 3 меньше, чем типичная для одинарной связи (см. Порядок связи и длины). Однако эта структура противоречит одному из основных правил формальных зарядов: предполагается, что отрицательные формальные заряды находятся на более электроотрицательных атомах в связи, но в структуре, изображенной на рисунке 5, положительных формальных зарядов обнаружен на фторе, который является не только самым электроотрицательным элементом в структуре, но и самым электроотрицательным элементом во всей таблице Менделеева (\(\chi=4.0\)). С другой стороны, бор с гораздо более низкой электроотрицательностью 2,0 имеет отрицательный формальный заряд в этой структуре. Это формальное несоответствие заряда и электроотрицательности делает эту структуру с двойной связью невозможной.
Однако большая разница в электроотрицательности здесь, в отличие от BH 3 , означает значительные полярные связи между бором и фтором, что означает, что эта молекула имеет высокий ионный характер. Это предполагает возможность полуионной структуры, как показано на рисунке 6:
Рисунок 6Ни одна из этих трех структур не является «правильной» структурой в данном случае. Наиболее «правильная» структура – это, скорее всего, резонанс всех трех структур: с неполным октетом (рис. 4), с двойной связью (рис. 5) и с ионной связью (рис. 6). Наиболее важной структурой, вероятно, является неполная структура октетов (из-за того, что рисунок 5 в принципе невозможен, а рисунок 6 не соответствует поведению и свойствам BF 9).0080 3 ). Как видите, даже при наличии других возможностей неполные октеты лучше всего отображают молекулярную структуру.
В качестве примечания важно отметить, что BF 3 часто связывается с ионом F — , чтобы сформировать BF 4 — , а не оставаться в виде BF 3 .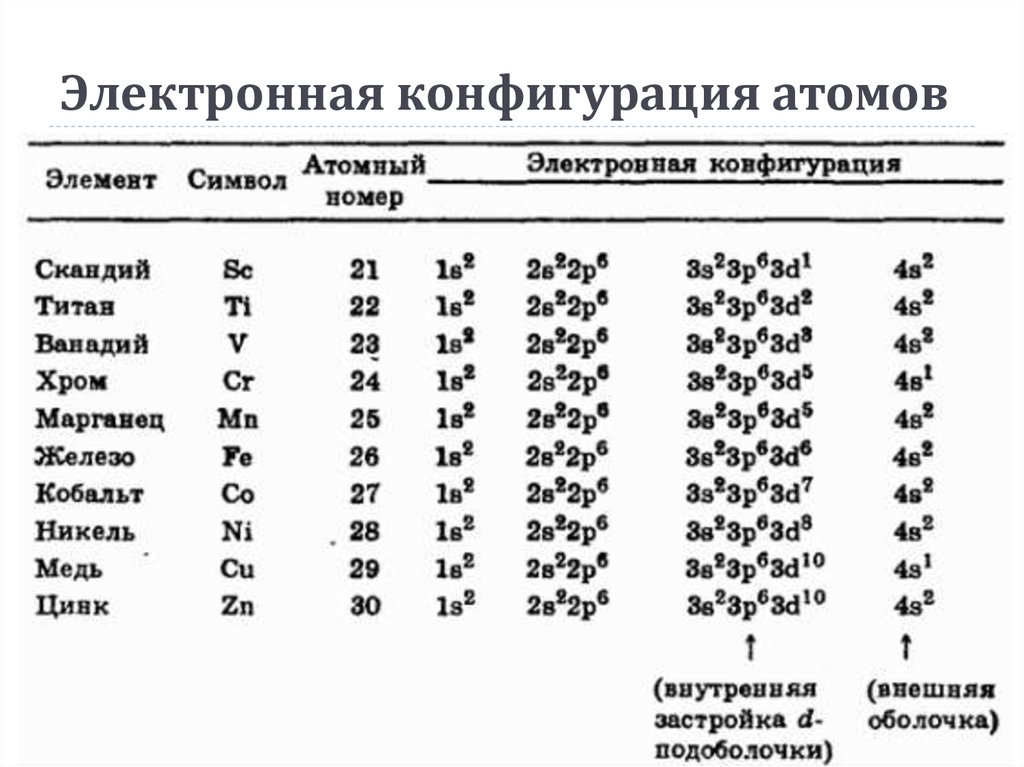 Эта структура завершает октет бора и более распространена в природе. Это иллюстрирует тот факт, что неполные октеты встречаются редко, а другие конфигурации обычно более благоприятны, включая связывание с дополнительными ионами, как в случае BF 9.0080 3 .
Эта структура завершает октет бора и более распространена в природе. Это иллюстрирует тот факт, что неполные октеты встречаются редко, а другие конфигурации обычно более благоприятны, включая связывание с дополнительными ионами, как в случае BF 9.0080 3 .
Пример: \(BF_3\)
Нарисуйте структуру Льюиса для трифторида бора (BF 3 ).
Решение
1. Добавить электроны (3*7) + 3 = 24
2. Начертить связи:
3. Добавить октеты к внешним атомам:
4.2 Добавить дополнительные электроны
4 -24=0) к центральному атому:
5. Имеет ли центральный электрон октет?
- №. Он имеет 6 электронов
- Добавьте кратную связь (двойную связь), чтобы увидеть, может ли центральный атом достичь октета:
6. Центральный бор теперь имеет октет (было бы три резонансных структуры Льюиса)
Однако… бор. Более распространенными, чем неполные октеты, являются расширенные октеты, в которых центральный атом в структуре Льюиса имеет более восьми электронов в своей валентной оболочке. В расширенных октетах центральный атом может иметь десять или даже двенадцать электронов. Молекулы с расширенными октетами включают концевые атомы с высокой электроотрицательностью и центральный атом неметалла, находящийся в третьем периоде или ниже , с которым связаны эти концевые атомы. Например, \(PCl_5\) является законным соединением (тогда как \(NCl_5\)) не является: Правило октета основано на доступных n s и n p орбиталях для валентных электронов (2 электрона в s орбиталей и 6 в p орбиталей). Следовательно, элементы третьего периода иногда нарушают правило октета, используя свои пустые d-орбитали для размещения дополнительных электронов. Размер также является важным фактором: В настоящее время проводится много научных исследований и исследований причин, по которым обнаруживаются расширенные валентные оболочки. Основная область интереса — выяснить, где находятся дополнительные пары электронов. Многие химики считают, что между 3p- и 3d-орбиталями нет очень большой разницы в энергии, и поэтому вполне вероятно, что дополнительные электроны легко заполняют 3d-орбиталь, когда расширенный октет более благоприятен, чем полный октет. Одной из ситуаций, когда расширенные октетные структуры считаются более благоприятными, чем структуры Льюиса, соответствующие правилу октетов, является ситуация, когда формальные издержки в расширенной октетной структуре меньше, чем в структуре, соответствующей правилу октетов, или когда меньше формальных обвинений в расширенном октете, чем в структуре, которая придерживается правила октета. Сульфат-ион, SO 4 -2 . является ионом, который предпочитает расширенную структуру октета. Строгое соблюдение правила октета формирует следующую структуру Льюиса: Если мы посмотрим на формальные заряды этой молекулы, то увидим, что все атомы кислорода имеют вокруг себя семь электронов (шесть от трех неподеленных пар и один от связи с серой). Если вместо этого мы создадим структуру для сульфат-иона с расширенным октетом, она будет выглядеть так: Глядя на формальные заряды этой структуры, ион серы имеет вокруг себя шесть электронов (по одному от каждой из его связей). Это то же количество, что и естественное количество валентных электронов. Это оставляет серу с формальным нулевым зарядом. Два атома кислорода, имеющие двойные связи с серой, имеют вокруг себя по шесть электронов (четыре от двух неподеленных пар и по одному от двух связей с серой). Это то же количество электронов, что и количество валентных электронов, которые атомы кислорода имеют сами по себе, и поэтому оба этих атома кислорода имеют формальный нулевой заряд. 1. Подсчитайте валентные электроны: 7+(4*7)+1 = 36 электронов 2. Нарисуйте связи: 3. Добавьте октет электронов к внешним атомам24: 4. 5. Таким образом, ион ICl 4 — имеет 12 d 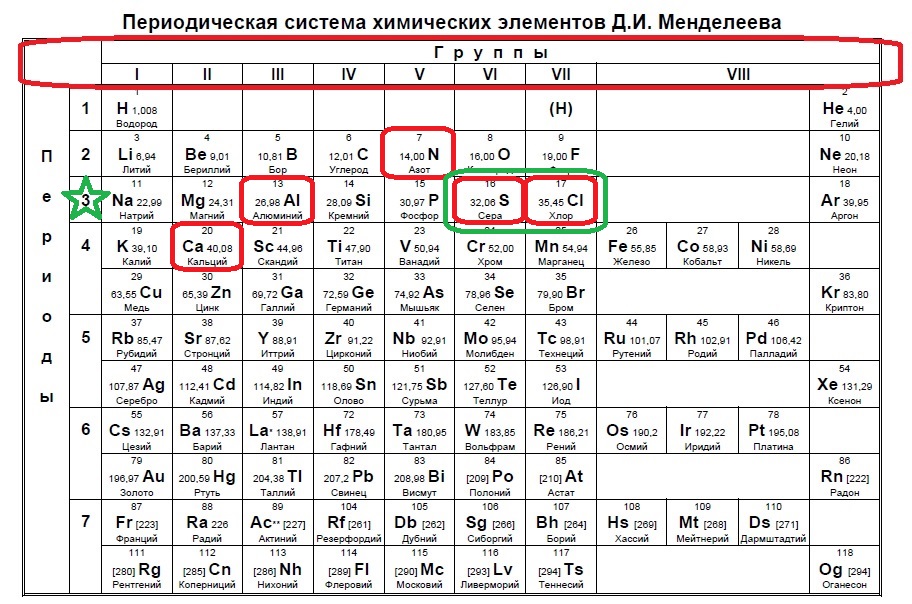
Исключение 3: Расширенные валентные оболочки
 Начиная с главного квантового числа n=3 становятся доступными d-орбитали ( l =2). Орбитальная диаграмма валентной оболочки фосфора:
Начиная с главного квантового числа n=3 становятся доступными d-орбитали ( l =2). Орбитальная диаграмма валентной оболочки фосфора: Тем не менее, этот вопрос все еще является предметом горячих споров, и даже ведутся споры о том, что делает расширенный октет более предпочтительным, чем конфигурация, следующая правилу октета.
Тем не менее, этот вопрос все еще является предметом горячих споров, и даже ведутся споры о том, что делает расширенный октет более предпочтительным, чем конфигурация, следующая правилу октета.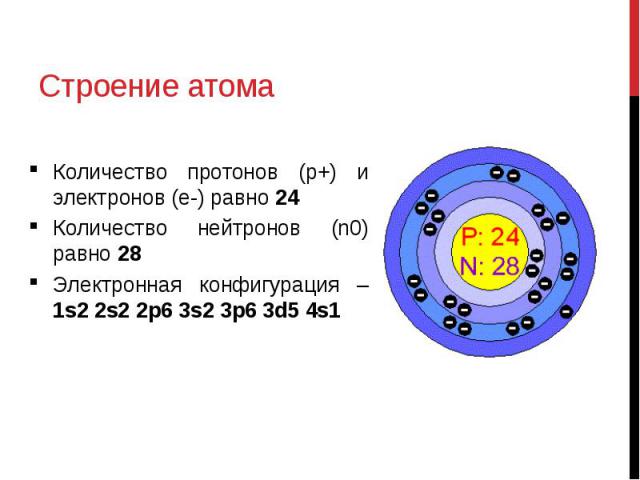 Это на один электрон больше, чем обычное количество валентных электронов, и поэтому каждый из атомов кислорода в этой структуре имеет формальный заряд -1. Сера имеет вокруг себя четыре электрона в этой структуре (по одному от каждой из ее четырех связей), что на два электрона меньше, чем количество валентных электронов, которое у нее было бы обычно, и поэтому она несет формальный заряд +2.
Это на один электрон больше, чем обычное количество валентных электронов, и поэтому каждый из атомов кислорода в этой структуре имеет формальный заряд -1. Сера имеет вокруг себя четыре электрона в этой структуре (по одному от каждой из ее четырех связей), что на два электрона меньше, чем количество валентных электронов, которое у нее было бы обычно, и поэтому она несет формальный заряд +2. Два атома кислорода с одинарными связями с серой имеют в этой структуре семь электронов вокруг себя (шесть от трех неподеленных пар и один от связи с серой). Это на один электрон больше, чем число валентных электронов, которое кислород имел бы сам по себе, и поэтому эти два атома кислорода несут формальный заряд -1. Помните, что с формальными зарядами цель состоит в том, чтобы формальные заряды (или разница между формальными зарядами каждого атома) были как можно меньше. Количество и значения формальных зарядов на этой структуре (-1 и 0 (разность 1) на рис. 12, в отличие от +2 и -1 (разность 3) на рис. 12) значительно ниже, чем на структуре это следует правилу октета, и поэтому расширенный октет правдоподобен и даже предпочтительнее обычного октета в этом случае. 9-\) ион.
Два атома кислорода с одинарными связями с серой имеют в этой структуре семь электронов вокруг себя (шесть от трех неподеленных пар и один от связи с серой). Это на один электрон больше, чем число валентных электронов, которое кислород имел бы сам по себе, и поэтому эти два атома кислорода несут формальный заряд -1. Помните, что с формальными зарядами цель состоит в том, чтобы формальные заряды (или разница между формальными зарядами каждого атома) были как можно меньше. Количество и значения формальных зарядов на этой структуре (-1 и 0 (разность 1) на рис. 12, в отличие от +2 и -1 (разность 3) на рис. 12) значительно ниже, чем на структуре это следует правилу октета, и поэтому расширенный октет правдоподобен и даже предпочтительнее обычного октета в этом случае. 9-\) ион. Решение
 Добавить дополнительные электроны (36-32= 4 ) к центральному атому:
Добавить дополнительные электроны (36-32= 4 ) к центральному атому:
Расширенные структуры Льюиса также являются правдоподобными изображениями молекул, когда экспериментально определенные длины связей предполагают частичные характеры двойных связей, даже когда одинарные связи уже полностью заполняют октет центрального атома. Несмотря на случаи расширенных октетов, как упоминалось для неполных октетов, важно помнить, что в целом применяется правило октетов.
Практические задачи
- Изобразите структуру Льюиса для молекулы I 3 — .
- Нарисуйте молекулу ClF 3 .
- Центральный атом расширенного октета должен иметь атомный номер больше, чем какой?
- Нарисуйте структуру Льюиса для молекулы NO 2 .
- Какая структура Льюиса более вероятна?
или
Ответы
1.
2.
3. 10 (натрий и выше)
4.
5.
- Петруччи, Ральф Х.; Харвуд, Уильям С.; Херринг, Ф.Г.; Мадура, Джеффри Д. Общая химия: принципы и современные приложения . 9-е изд. Нью-Джерси. Pearson Education, Inc. 2007.
- Мур, Джон В.; Станицкий, Конрад Л.; Юрс, Питер С. Химия; Молекулярная наука . 2-е изд. 2004.
Ссылки
Авторы и ссылки
Майк Блабер (Университет штата Флорида)
Violations of the Octet Rule распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- Свободный радикал Правило
- октетов
SEM как инструмент анализа отказов
Статья
20.10.22
Привлеченный эксперт Даниэль Кедровски
Другие материалы от этого автора
Узнайте о наших привлеченных экспертах
Что такое СЭМ?
Сканирующая электронная микроскопия (СЭМ) является бесценным инструментом для проведения анализа отказов металлических и неметаллических компонентов и используется в той или иной степени в большом проценте исследований, проводимых Element. СЭМ является мощным инструментом для определения источника (происхождений), вида и направления распространения трещин или разломов. SEM используется в сочетании с подробным документированием с помощью макрофотографии и стереомикроскопа, чтобы дать полное представление об исследуемых функциях или компонентах.
SEM используется в сочетании с подробным документированием с помощью макрофотографии и стереомикроскопа, чтобы дать полное представление об исследуемых функциях или компонентах.
РЭМ также активно используется для оценки мусора, частиц, остатков, продуктов коррозии и других признаков, требующих исследования с большим увеличением. Необходимость и универсальность этих инструментов подтверждается их наличием во многих лабораториях компании Element.
Как работает SEM?
РЭМ работает путем бомбардировки поверхности образца сфокусированным пучком электронов. Электронный пучок возбуждает электроны материала, что приводит к высвобождению дополнительных, вторичных электронов. В качестве альтернативы электронный пучок может быть рассеян обратно образцом и снова выйти из поверхности образца. Как вторичные, так и обратно рассеянные электроны могут быть собраны и отображены для получения изображения оцениваемой поверхности. Первый обеспечивает более высокое разрешение элементов поверхности, а второй позволяет получить более подробную информацию о топографической поверхности и информацию об атомном весе оцениваемой поверхности. Каждый тип электрона играет определенную роль в анализе с помощью SEM в зависимости от целей оценки.
Каждый тип электрона играет определенную роль в анализе с помощью SEM в зависимости от целей оценки.
Подходит ли вам SEM?
Главное преимущество РЭМ при анализе отказов заключается в том, что результирующее изображение в целом похоже на оптическое фотографическое, но со значительно большей глубиной резкости. СЭМ также позволяет проводить исследования с увеличением примерно от 5 до более чем 50 000 крат, что позволяет документировать большие области образца и микроскопические особенности без замены инструментов или линз. Основным недостатком SEM является отсутствие цветного изображения, что усиливает важность документирования образцов с помощью стандартных методов оптической фотографии в сочетании с SEM. Исследуемые образцы также должны быть электропроводными, хотя проводящие поверхностные покрытия и использование СЭМ со специальной камерой для образцов с переменным давлением и детекторами электронов смягчают многие из этих проблем.
Чрезвычайно полезным побочным эффектом бомбардировки поверхности электронами является генерация характеристического рентгеновского излучения атомами материала вследствие возбуждения электронным лучом.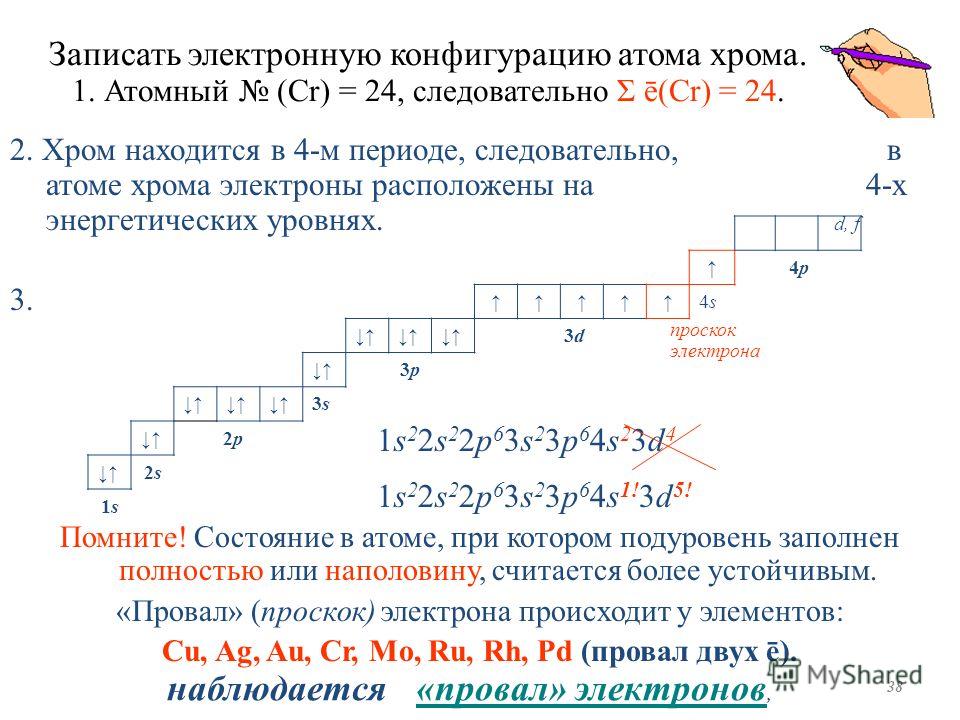 Эти рентгеновские лучи могут быть обнаружены и количественно оценены с помощью энергодисперсионного рентгеновского спектрометра (EDS), прикрепленного к SEM. EDS обеспечивает относительный химический состав поверхностей и особенностей, исследуемых с помощью СЭМ. Эта информация может быть чрезвычайно полезна для идентификации продуктов коррозии, поверхностных остатков или загрязнений, включений материалов, продуктов износа и множества других признаков, которые не поддаются другим традиционным методам химического анализа. Результаты EDS также можно комбинировать с изображениями SEM для формирования элементарных карт EDS, которые обеспечивают графическое представление распределения элементов на исследуемой поверхности или объекте.
Эти рентгеновские лучи могут быть обнаружены и количественно оценены с помощью энергодисперсионного рентгеновского спектрометра (EDS), прикрепленного к SEM. EDS обеспечивает относительный химический состав поверхностей и особенностей, исследуемых с помощью СЭМ. Эта информация может быть чрезвычайно полезна для идентификации продуктов коррозии, поверхностных остатков или загрязнений, включений материалов, продуктов износа и множества других признаков, которые не поддаются другим традиционным методам химического анализа. Результаты EDS также можно комбинировать с изображениями SEM для формирования элементарных карт EDS, которые обеспечивают графическое представление распределения элементов на исследуемой поверхности или объекте.
Чтобы узнать больше о сканирующей электронной микроскопии (СЭМ) или если у вас есть какие-либо вопросы, свяжитесь с нашей командой сегодня.
Найти связанные ресурсы
Уверенность в течение почти 190 лет
Анализ отказов
Узнайте, как глобальная команда экспертов Element по анализу отказов извлекает уроки из прошлого, чтобы помочь предотвратить будущие отказы в обслуживании.


Leave A Comment