скорость химических реакций — вопрос №49072 — Учеба и наука
СРОЧНО!!! ПОЖАЛУЙСТА ПОМОГИТЕ! БОЛЬШОЕ ВАМ СПАСИБО!!!
только химические реакции записаны чуть-чуть не так, как надо… но я думаю всё равно понятно…
1-12
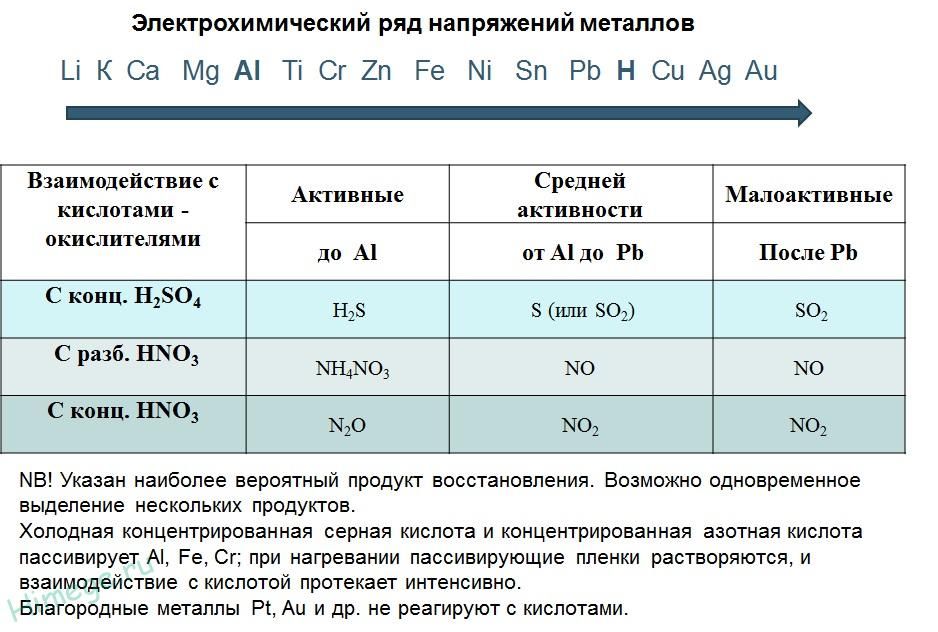
1.При повышении давления в 3 раза скорость простой реакции 2NO(г)+O2(г)=2NO2(г) возрастёт
1)в 3 раза 2)в 9 раз 3)в 27 раз 4)в18 раз
2.На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния
1)концентрация кислоты 2)измельчение железа 3)температура реакции 4)повышение давления
3.Для уменьшения скорости реакции Mg+2H =Mg+h3(г)+Q необходимо
1)добавить несколько кусочков магния 2)увеличить концентрацию ионов водорода 3)уменьшить температуру 4)увеличить концентрацию ионов магния
4.С большей скоростью протекает реакция соляной кислоты с
1)медью 2)железом 3)магнием 4)цинком
5.С наибольшей скоростью при обычных условиях протекает реакция
1)2Ba+O2=BaO 2)Ba+CO3=BaCO3 3)Ba+2H = Ba+h3 4)Ba+S=BaS
6. Для увеличения скорости реакции 2CO(г)+O2(г)=2CO2(г)+Q необходимо
Для увеличения скорости реакции 2CO(г)+O2(г)=2CO2(г)+Q необходимо
1)увеличить концентрацию CO 2)уменьшить концентрацию O2 3)понизить давление 4)повысить температуру
7.Скорость химической реакции между медью и азотной кислотой зависит от
1)массы меди 2)объёма кислоты 3)концентрации кислоты 4)увеличение давления
8.Для уменьшения скорости эндотермической химической реакции необходимо
1)увеличить концентрацию реагирующих веществ 2)ввести в систему катализатор 3)повысить температуру 4)понизить температуру
9.Для увеличения скорости реакции Mg(тв)+2H = Mg+h3(г) необходимо
1)уменьшить концентрацию ионов водорода 2)увеличить концентрацию ионов водорода 3)понизить температуру 4)повысить давление
10.С наибольшей скоростью при комнатной температуре протекает реакция
1)углерода с кислородом 2)железа с раствором уксусной кислоты 3)железа с соляной кислотой 4)растворов гидроксида натрия и серной кислотой
11.Скорость гомогенной реакции пропорциональна изменению
1)концентрации вещества в единицу времени 2)количества вещества в единицу объёма 3)массы вещества в единице объёма 4)объёма вещества в ходе реакции
12. Для увеличения скорости реакции Zn+2H = Zn+h3(г) необходимо
Для увеличения скорости реакции Zn+2H = Zn+h3(г) необходимо
1)уменьшить концентрацию ионов цинка 2)увеличить концентрацию ионов водорода 3)уменьшить температуру 4)увеличить концентрацию ионов цинка
2-4
1.Во сколько раз увеличится скорость реакции N2+3h3 = 2Nh4, если концентрацию водорода увеличить в 2 раза, а азота в 4 раза?
2.Как изменится скорость химической реакции h3+Br2 = 2HBr, если
1)увеличить общее давление в системе в 2 раза?
2)увеличить объём в 2 раза?
3)увеличить концентрацию брома?
3.Температурный коэффициент некоторой химической реакции равен 3, как изменится скорость реакции при увеличении температуры от 20 градусов до 50 градусов?
4.Скорость химической реакции при 50 градусах равна 5 моль/л*с, вычислить скорость этой реакции при 100 градусах, если температурный коэффициент 2.
декабрь 21, 2010 г.
Сообщить о нарушении
Всего ответов: 0
«Скорость химической реакции» | Тест по химии (9, 11 класс) по теме:
Опубликовано 24. 12.2014 — 18:57 — Бородина Наталья Евгеньевна
12.2014 — 18:57 — Бородина Наталья Евгеньевна
Тест по химии на тему » Скорость химической реакции»
Скачать:
Предварительный просмотр:
Тест по теме « Скорость химической реакции»
- Какой из факторов не оказывает влияния на скорость химической реакции в растворах:
- концентрация веществ
- использование катализатора
- использование ингибитора
- объём реакционного сосуда
- На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния:
- концентрация кислоты
- измельчение железа
- температура реакционной смеси
- увеличение давления
- Во сколько раз изменится скорость элементарной реакции
2А + В = А2В, если концентрацию вещества В уменьшить в 2 раза:
- увеличится в 4 раза
- уменьшится в 2 раза
- уменьшится в 4 раза
- увеличится в 2 раза
- Как повлияет на скорость элементарной реакции А + В = АВ увеличение концентрации вещества А в 3 раза:
- скорость увеличится в 3 раза
- скорость уменьшится в 9 раз
- скорость уменьшится в 3 раза
- скорость не изменится
- Быстрее при комнатной температуре будет протекать реакция между 10% раствором соляной кислоты и:
- цинком в гранулах
- большим куском цинка
- цинком, покрытым медью
- цинком в порошке
- В течение одной минуты выделится больше водорода, если для реакции использовать:
- Zn(гранулы) и Ch4COOH (10% раствор)
- Zn(порошок) и HCl (10% раствор)
- Zn(гранулы) и HCl (10% раствор)
- Zn(порошок) и Ch4COOH (10% раствор)
- При увеличении температуры от 10° до 30° С скорость реакции, температурный коэффициент которой γ = 3:
- возрастёт в 3 раза
- возрастёт в 9 раз
- уменьшится в 3 раза
- уменьшится в 9 раз
- Для уменьшения скорости химической реакции необходимо:
- увеличить концентрацию реагирующих веществ
- ввести в систему катализатор
- повысить температуру
- понизить температуру
- Скорость химической реакции между медью и азотной кислотой зависит от:
- массы меди
- объёма кислоты
- концентрации кислоты
- объёма колбы
- Для увеличения скорости реакции 2CO + O2 = 2CO2 + Q необходимо
1) увеличить концентрацию CO
2) уменьшить концентрацию О2
3) понизить давление
4) понизить температуру
По теме: методические разработки, презентации и конспекты
«Скорость химической реакции и факторы, влияющие на скорость химической реакции»
Урок химии в 11 классе на тему: «Скорость химической реакции и факторы, влияющие на скорость химической реакции»Цели: дать понятие о скорости химической реакции;показать влияние на скорость. ..
..
Скорость химической реакции.Условия влияющие на скорость химической реакции.
Урок химии в 9 классе.Тема : «Скорость химической реакции. Условия влияющие на скорость химической реакции»Тип урока: урок- исследование.Цели урока: — расширить знания учащихся по теме: «Законом…
Открытый урок. Тема: Скорость химической реакции. Факторы, влияющие на скорость. Химическое равновесие. Смещение химического равновесия. Для СПО.
Дано понятие скорости химической реакции. Экспериментальное изучение факторов , влияющих на скорость. Понятие химического равновесия. Принцип Ле-Шателье. Урок проводится с применением презентации этой…
Урок химии в 11 классе на тему: «Скорость химической реакции и факторы, влияющие на скорость химической реакции»
Урок химии в 11 классе на тему: «Скорость химической реакции и факторы, влияющие на скорость химической реакции»Цели:дать понятие о скорости химической реакции;показать влияние на скорость химической …
«Скорость химических реакций и факторы, влияющие на скорость химических реакций.
 «
«разработка и презентация урока с элементами ФГОС…
Разработка урока по теме «Скорость. химической реакции. Факторы, влияющие на скорость химической реакции»
Данная методическая разработка предназначена для учащихся общеобразовательных школ 11 класса. Изучение темы «Учение о скорости химической реакции….
Самостоятельная работа по теме «Скорость химической реакции. Химическое равновесие. Классификация химических реакций»
Самостоятельная работа по теме «Скорость химической реакции. Химическое равновесие. Классификация химических реакций»…
Поделиться:
Реакция меди и азотной кислоты
Медь реагирует с азотной кислотой двумя способами. Но эта реакция отличается от типичной реакции металл-кислота. потому что азотная кислота окисляющая кислота.
Cu + HNO
3 реагирует по-разному и дает разные продукты другой.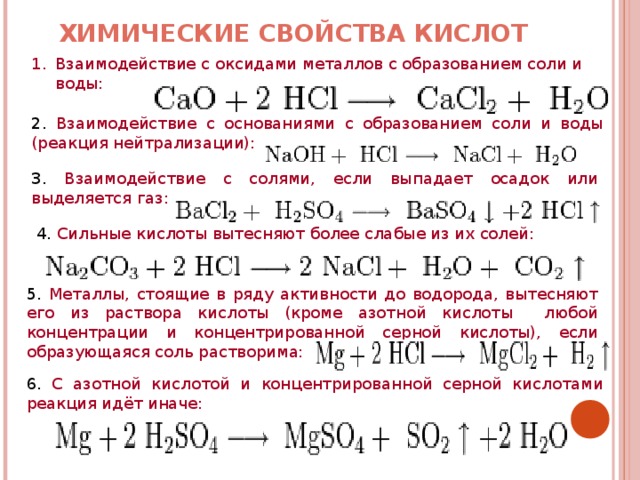 В этом уроке мы обсудим следующие темы.
В этом уроке мы обсудим следующие темы.Реакция меди с разбавленной азотной кислотой
Реакция меди с концентрированной азотной кислотой
Как сбалансировать эти реакции
Вопросы и безопасность
Обе реакции являются окислительно-восстановительными реакциями, и при уравновешивании реакций необходимо учитывать их степени окисления.
Реагенты — Cu и HNO
3Теперь мы кратко рассмотрим реагенты, медь и HNO 3 .
Медь (Cu)
Медь — металл красновато-коричневого цвета, менее реакционноспособный, чем другие металлы, такие как щелочные металлы и щелочноземельные металлы.
Азотная кислота — HNO
3HNO 3 представляет собой оксокислоту азота и сильную одноосновную кислоту. HNO 3 может вести себя как окисляющая кислота.
Реакция разбавленной азотной кислоты и меди | Cu + HNO
3 = Cu(NO 3 ) 2 + NO + H 2 O Разбавленная азотная кислота реагирует с медью с образованием нитрата меди ( Cu(NO 3 ) 2 ),
оксид азота (NO) и вода
как продукты. В этой реакции медь окисляется, а азотная кислота восстанавливается до оксида азота.
В этой реакции медь окисляется, а азотная кислота восстанавливается до оксида азота.
После реакции раствор, содержащий Cu(NO 3 ) 2 , имеет синий цвет. Сбалансированное уравнение 4H 2 O (l)
Оксид азота — бесцветный газ, степень окисления азота +2. Так степень окисления азота снижается с +5 до +2, а степень окисления азота медь увеличена с 0 до +2 .
Оксид азота – нейтральный газ.
Реакция концентрированной азотной кислоты и меди | Cu + HNO
3 = Cu(NO 3 ) 2 + NO 2 + H 2 OКонцентрированная азотная кислота реагирует с медью с образованием нитрата меди ( Cu(NO 3 ) 2 ), диоксид азота (NO 2 ) газ и вода как продукты. В этой реакции медь окисляется до степени окисления +2, а азотная кислота восстанавливается до диоксида азота.
После реакции раствор, содержащий Cu(NO 3 ) 2 , имеет синий цвет. Сбалансированное уравнение
2H 2 O
Сбалансированное уравнение
2H 2 O
В этой реакции медь также окисляется до степени окисления +2. Но азот в азотной кислоте восстанавливается от +5 до +4 за производство азота диоксид коричневого цвета и кислый газ.
Безопасность людей и инструментов во время реакции
Перед выполнением этого эксперимента рекомендуется прочитать паспорта безопасности материалов (MSDS) Cu, HNO 3 , NO, NO 2 .
Когда Cu реагирует с азотной кислотой, NO или NO 2 могут быть получены как продукты в зависимости от температуры и концентрации кислотный раствор. Однако в результате превращения кислорода образуется NO в NO 2 .
NO 2 является очень токсичным газом и может вызвать множество проблем со здоровьем, включая смерть, при вдыхании больших количеств. Вы можете определить NO 
Так что постарайтесь не подвергать себя воздействию этого опасного газа в ходе этого эксперимента и везде, где вы работаете.
Как сбалансировать реакции Cu + HNO
3Теперь мы узнаем, как сбалансировать две реакции меди и азотной кислоты. Мы уже определили, какие атомы окисляются и восстанавливаются в реакциях. Возьмем реакцию меди с разбавленной азотной кислотой.
Как сбалансировать реакцию Cu и разбавленной HNO
3 кислота- Запишите степени окисления атомов, которые изменились в реакции (медь и азот). Идентифицировать различия степеней окисления в реакции окисления (медь в ион меди +2) и реакции восстановления (азот от +5 до +2). Степень окисления азота нитрат-ионом в правой части реакции равна +5 и не изменилось.
- Разница степеней окисления реакции окисления 2 и реакции восстановления 3. Обменять разницу между двумя реакциями. (см. рисунок)
- Затем сбалансируйте другие атомы обычными методами балансировки.

Вопросы о реакции HNO
3 и CuЧто происходит, когда азотную кислоту смешивают с металлом?
Азотная кислота может вести себя как кислота или окисляющая кислота. Это зависит от концентрации и температуры раствора азотной кислоты. Если очень разбавленную азотную кислоту смешать с металлом, она может продемонстрировать типичную кислотно-основную реакцию с выделением газообразного водорода. Но если концентрация и температура азотной кислоты высоки, азотная кислота может вести себя как окисляющая кислота и образовывать диоксид азота или оксид азота.
При взаимодействии меди с разбавленной азотной кислотой выделяются красновато-коричневые пары двуокиси азота?
Да. Газообразный диоксид азота может выделяться. Но, вы должны использовать концентрированную азотную кислоту. В противном случае выделяется газообразный оксид азота.
Почему и как вы говорите, что азотная кислота является окисляющей кислотой в результате реакции меди и азотной кислоты?
При типичной реакции кислотных металлов выделяется газообразный водород.
Почему медь не реагирует с разбавленной кислотой HCl, как разбавленная кислота HNO
3 ?Кислота HCl не является окисляющей кислотой, поскольку атом хлора в HCl находится в степени окисления -1. Следовательно, этот атом хлора не восстанавливается, проявляя характеристики окислительной кислоты. Но в HNO 3 азот находится при +5 и его можно восстановить до более низких степеней окисления.
Каковы физические изменения, такие как изменение цвета при окислении меди азотной кислотой?
Азотная кислота представляет собой бесцветный раствор. (но если азотная кислота разлагалась, может быть желтая окраска). Когда медь
реагирует с раствором азотной кислоты, приобретая синюю окраску. Также высококонцентрированные и высокотемпературные азотные
была использована кислота, вы можете видеть, что во время реакции выделяется газ коричневого цвета.
Какие другие металлы, такие как медь, реагируют с азотной кислотой и выделяют диоксид азота?
Серебро реагирует с азотной кислотой с выделением диоксида азота и образованием нитрата серебра и воды.
Ag (т) + 2HNO 3(водн.) → AgNO 3 (водн.) + NO (г) + H 2 O (l)
Связанные руководства
HNO 3 кислотные реакции
Оствальдский процесс —
HNO 3 производство
Характеристики газообразного азота и подготовка
Получение оксидов азота
HNO 3 и HNO 2 кислоты
Подготовка азотной кислоты
какой оксид азота является нейтральным, NO или NO
Медь и азотная кислота | Chemdemos
Когда концентрированную азотную кислоту капают на медный диск на дне стеклянного цилиндра, быстро выделяется красновато-коричневое облако газообразного диоксида азота.
Учебные заметки
Эта демонстрация иллюстрирует сильную окислительную способность азотной кислоты. Его можно использовать при введении окислительно-восстановительных реакций или позже, когда учащиеся пытаются предсказать продукты реакции. Это показывает, что азотная кислота не только реагирует по «кислотному» пути, но также может действовать как окислитель. Некоторым преподавателям нравится использовать эту демонстрацию вместе с сопровождающим рассказом Иры Ремсен во время первой лекции, которая сопровождает курс общей химии, чтобы проиллюстрировать природу химических экспериментов. Позвольте около 5 минут для этой демонстрации.
Его можно использовать при введении окислительно-восстановительных реакций или позже, когда учащиеся пытаются предсказать продукты реакции. Это показывает, что азотная кислота не только реагирует по «кислотному» пути, но также может действовать как окислитель. Некоторым преподавателям нравится использовать эту демонстрацию вместе с сопровождающим рассказом Иры Ремсен во время первой лекции, которая сопровождает курс общей химии, чтобы проиллюстрировать природу химических экспериментов. Позвольте около 5 минут для этой демонстрации.
Время выполнения
Для этого проекта требуется один день выполнения.
Обсуждение
азотная кислота реагирует с медью в соответствии с реакцией:
4 HNO 3 ( L ) + CU ( S ) ==> CU (№ 3 ) 2 ( S (№ 3 ) 2 ( S (№ 3 ) и водный ) + 2 NO 2 ( г ) + 2 H 2 O( l ) Образующаяся соль нитрата меди имеет темно-синий цвет.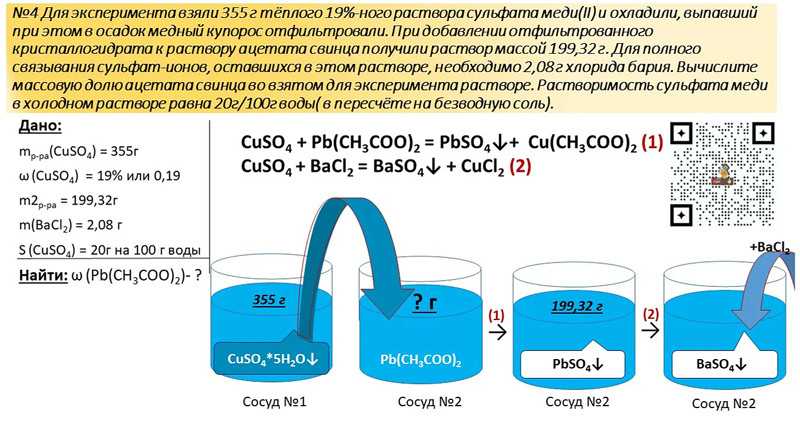 Диоксид азота представляет собой темно-бордовый пар.
Диоксид азота представляет собой темно-бордовый пар.
Материалы
- стеклянный цилиндр
- медный диск
- флакон-капельница концентрированной азотной кислоты
- 100 мм часовое стекло
Процедура
Поместите стеклянный диск на дно медного цилиндра. Аккуратно капните на диск несколько капель азотной кислоты. Накройте цилиндр часовым стеклом, чтобы предотвратить утечку газообразного диоксида азота.
Меры предосторожности
«Концентрированная азотная кислота является сильной кислотой и сильно окисляющей кислотой. Проглатывание вызывает жжение и коррозию внутренних тканей». 1 Если концентрированная азотная кислота попала на кожу, немедленно смойте ее большим количеством воды. «Двуокись азота образует кислоту при контакте с влагой и является ядовитым, удушающим газом. Воздействие двуокиси азота может вызвать лишь легкую боль или даже пройти незаметно, но через несколько дней может привести к отеку и смерти». 1
1
Потренируйтесь в этой демонстрации под вытяжным колпаком, прежде чем выполнять ее перед классом. Если добавить слишком много азотной кислоты, пары диоксида азота попадут в класс.
Обязательно поместите часовое стекло на стеклянный цилиндр после добавления азотной кислоты, чтобы предотвратить утечку газообразного диоксида азота.
1 Отдел химического образования, Inc., Американское химическое общество, «Медный пенни с концентрированной азотной кислотой — Демонстрационные заметки, предупреждения, информация о безопасности» Chemistry Comes Alive , 1999, 6 июля 2005 г.,
Подготов. Примечания Будьте осторожны, чтобы не вдыхать пары диоксида азота при разборе этой демонстрации. Тщательно подготовьте бутылку-капельницу для каждой демонстрации и аккуратно верните неиспользованную азотную кислоту в бутылку после демонстрации. Концентрированную азотную кислоту нельзя хранить в бутылке-капельнице в течение длительного времени, так как она разъедает резиновые части капельницы.


Leave A Comment