Гидроксид бария: способы получения и химические свойства
Гидроксид бария Ba(OH)2 — неорганическое соединение. Белый, плавится без разложения. При дальнейшем нагревании разлагается. Хорошо растворяется в воде. Проявляет основные свойства.
Относительная молекулярная масса Mr = 171,34; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 408º C.
1. Гидроксид бария получают в результате взаимодействия твердого сульфида бария и паров воды при 450º С, на выходе образуется гидроксид бария и сероводородная кислота:
BaS + 2H2O = Ba(OH)2 + H2S
2. При взаимодействии бария с водой при комнатной температуре образуется гидроксид бария и водород:
Ba + 2H2O = Ba(OH)2↓ + H2↑
3. Оксид бария при взаимодействии с водой образует гидроксид бария:
Оксид бария при взаимодействии с водой образует гидроксид бария:
BaO + H2O = Ba(OH)2
Качественная реакция на гидроксид бария — окрашивание фенолфталеина в малиновый цвет.
1. Гидроксид бария взаимодействует со сложными веществами:
1.1. Гидроксид бария реагирует с кислотами:
1.1.1. В результате реакции между гидроксидом бария и разбавленной соляной кислотой образуется хлорид бария и вода:
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
1.1.2. Гидроксид бария взаимодействует с разбавленной серной кислотой, образуя сульфат бария и воду:
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
1. 1.3. В результате взаимодействия гидроксида бария и разбавленной фосфорной кислоты образуется фосфат бария и вода:
1.3. В результате взаимодействия гидроксида бария и разбавленной фосфорной кислоты образуется фосфат бария и вода:
3Ba(OH)2 + 2H3PO4 = Ba3(PO4)2↓ + 6H2O,
если с гидроксидом бария будет взаимодействовать концентрированная фосфорная кислота, то в результате реакции возможно образование гидрофосфата бария и воды:
Ba(OH)2 + H3PO4 = BaHPO4↓ + 2H2O
1.1.4. С насыщенным и холодным гидроксидом бария реагирует разбавленная сероводородная кислота, образуя сульфид бария и воду:
Ba(OH)2 + H2S = BaS↓ + 2H2O,
если сероводородная кислота будет насыщенной на выходе образуются гидросульфид бария и вода:
Ba(OH)2 + 2H2S = Ba(HS)2 + 2H2O
1. 1.5. Гидроксид бария вступает во взаимодействие с концентрированной плавиковой кислотой с образованием фторида бария и воды:
1.5. Гидроксид бария вступает во взаимодействие с концентрированной плавиковой кислотой с образованием фторида бария и воды:
Ba(OH)2 + 2HF = BaF2↓ + 2H2O
1.2. Гидроксид бария взаимодействует с оксидами:
1.2.1. В результате взаимодействия гидроксида бария и углекислого газа образуется карбонат бария и вода:
Ba(OH)2 + СO2 = BaСO3 + H2O,
если с углекислым газом реагирует карбонат бария в виде суспензии, то образуется гидрокарбонат бария в растворе:
Ba(OH)2 + 2СO2 = Ba(HСO3)2
1.2.2. Гидроксид бария вступает в реакцию с оксидом серы (IV), образуя на выходе сульфит бария и воду:
Ba(OH)2 + SO2 = BaSO3 + H2O,
если с оксидом серы (IV) взаимодействует гидроксид бария в виде суспензии, то на выходе происходит образование гидросульфита бария в растворе:
Ba(OH)2 + 2SO2 = Ba(HSO3)2
1. 3. Гидроксид бария вступает в взаимодействие с солями:
3. Гидроксид бария вступает в взаимодействие с солями:
1.3.1. Гидроксид бария вступает в реакцию с хроматом калия и образует хромат бария и гидроксид калия:
Ba(OH)2 + K2CrO4 = BaCrO4↓ + 2KOH
1.3.2. Насыщенный гидроксид бария взаимодействует при кипении с концентрированным раствором хлората аммония. При этом образуются хлорат бария, газ аммиак и воды:
Ba(OH)2 + 2NH4ClO3 = Ba(ClO3)2 + 2NH3↑ + H2O
2. Гидроксид бария разлагается при температуре 780 — 800º С, образуя на выходе оксид бария и воду:
Ba(OH)2 = BaO + H2O
Понравилось это:
Нравится Загрузка. ..
..
Facts You Should Know —
By Пратам Шах
Гидроксид бария с химической формулой Ba(OH)2. Обычно он представляет собой белый гранулированный моногидрат. Давайте изучим различные области применения гидроксида бария.
Давайте посмотрим на различные области применения гидроксида бария. (Ва(ОН)2).
- Промышленная переработка
- Лабораторное использование
- Органический синтез
- Химия
- Разное Использование
Давайте подробно обсудим применение гидроксида бария в широком диапазоне секторов в этой статье.
Промышленная переработка
Гидроксид бария является важным промышленным товаром и имеет множество применений в промышленной переработке.
Разнообразие приложений обсуждается здесь.
- Моногидрат используется для удаления и дигидрат сульфат из различных продуктов.

- Гидроксид бария используется в производстве сахара..
- Он служит добавкой в искусственный шелки термопластыc для улучшения пластических свойств.
- Гидроксид бария используется для сплавления силикаты, жир омыление и производство мыла.
- Гидроксид бария является ключевым элементом при обработке высокотемпературных сверхпроводников.
- Материал гидроксида бария служит универсальным реагентом для смазочных материалов и смазок.
- Гидроксид бария служит в качестве агента для удаления серы при удалении накипи в котлах и рассоле.
- Гидроксид бария используется в качестве агента, контролирующего сульфаты, в агенте для карбонизации стали, очищающем агенте для каустической соды, стекла, керамики и вулканизации эластомеров.
- Гидроксид бария используется на нефтеперерабатывающих заводах для синтеза барий смазывать.

- Гидроксид бария используется в качестве стабилизатора. усилить пластику собственноty в производстве пластиков ПВХ.
- В сахарной промышленности гидроксид бария используется как очиститель котлов.
Лабораторное использование
- В аналитической химии слабые кислоты титруют гидроксидом бария, особенно органические кислоты.
- Гидроксид бария используется для синтеза d-глюонового γ-лактона, диацетонового спирта и циклопентанона.
- Гидроксид бария используется в декарбоксилирование аминокислот, который используется для высвобождения карбоната бария во время процесса.
- Гидроксид бария является важным лабораторным катализатором окислительного сочетания метана для синтеза углеводородов с более высокой молекулярной массой.
Органический синтез
- Гидроксид бария, являющийся сильноосновным соединением, используется при гидролизе сложные эфиры и нитрилы.

- Гидроксид бария гидролизует любую из двух подобных сложноэфирных групп в диметилэндекандиоате.
- Гидроксид бария является важной добавкой в химическом синтезе соединений бария и органических соединений.
- Гидроксиды бария служат пластической добавкой для производства фенольных смол.
Химия
- Гидроксид бария реагирует с водным раствором с образованием сильного едкого основания, что расширяет его применение в пестицидов и как тест на сульфиды.
- Гидроксид бария служит альтернативой натронной извести при высокой температуре абсорбента, высокой концентрации севофлурана и для использования в свежем абсорбенте.
- Гидроксид бария используется во время демонстрации эндотермические реакции, при реакции с солью аммония тепло поглощается из окружающей среды, что делает его холодным.
- Гидроксид бария используется в качестве упрочняющего агента для различных монументальных камней.

- Он используется для фильтрации и очистки растительных и животных масел.
Удаление сточных вод
- Гидроксид бария используется для удаления сульфатов из сточных вод.
- Гидроксид бария является важной добавкой при очистке сточных вод.
Разное Использование
- Гидроксид бария используется в гомеопатических средствах под названием бхартья.
- Гидроксид бария служит реагентом для очистки разливов кислоты.
- Гидроксид бария под названием барит используется в производстве фотобумаги для печати.
Заключение
Гидроксид бария состоит из оксида бария и воды. Усиливает реакцию нейтрализации с такими кислотами, как фосфорная кислота, соляная кислота и серная кислота. Гидроксид бария широко используется для производства присадок к маслам. Спрос на химикаты бария увеличивается в течение прогнозируемого периода, что предполагает увеличение потребности рынка гидроксида бария.
Формула гидроксида бария, молярная масса, октагидрат, применение, MSDS
- Что такое гидроксид бария?
- Химическая формула
- Молярная масса
- Растворим ли гидроксид бария в воде?
- Свойства гидроксида бария
- Гидроксида бария
- Гидроксид бария использует
- Гидроксид бария
- Гидроксид и гидрохловой кислоты
- 9000 -й.0004
- Гидроксид бария и тиоцианат аммония
- Моногидрат гидроксида бария
- Является ли гидроксид бария сильным или слабым основанием?
- Barium Hydroxide and Nitric Acid
- Barium Hydroxide and Carbon Dioxide
- Perchloric Acid and Barium Hydroxide
- Acetic Acid and Barium Hydroxide
- Barium Hydroxide and Phosphoric Acid
- Barium Hydroxide and Ammonium Nitrate
- Barium Hydroxide and Ammonium Chloride
- Октагидрат гидроксида бария и тиоцианат аммония
Что такое гидроксид бария?
Это химическое вещество, также известное как «барит». Это соединение бария, мягкого серебристого металла щелочноземельной группы.
Это соединение бария, мягкого серебристого металла щелочноземельной группы.
Его можно получить путем растворения оксида бария (представленного как BaO) в воде. Это выражается следующей химической реакцией:
BaO + 9h3O → Ba(OH)2·8h3O
Химическая формула
Химическая формула гидроксида бария: Ba(OH)2.
Молярная масса
Молярная масса гидроксида бария
171,34 г/моль (в безводных растворах)
189,355 г/моль (моногидрат)
315,46 г/моль (октагидрат)
Isle In Water Hydroxide?
Растворимость гидроксида бария в воде умеренная. Однако это соединение нерастворимо в ацетоне. При комнатной температуре он может образовывать раствор. Установлено, что раствор гидроксида бария имеет приблизительную концентрацию 0,1 моль дм-3. 9Рисунок 1 Это стабильное соединение. Он несовместим с углекислым газом, кислотами и влагой. Необходимо избегать контакта этого вещества с несовместимыми материалами.
Внешний вид
Это кристаллическое вещество, цвет которого может варьироваться от белого до прозрачного.
Удельный вес
Удельный вес этого вещества составляет 2,18.
Температура плавления
Вещество плавится при температуре 408 °C.
Температура кипения
Материал кипит при температуре 780 °C.
Значение pH
Значение pH гидроксида бария фактически зависит от его концентрации. Тем не менее, pH этого соединения составляет около -2. Это указывает на то, что он является очень основным по своей природе.
Плотность
Имеет плотность 2,18 на г см-3
Молекулярная формула
Молекулярная формула октагидрата гидроксида бария: Bah28O10.
Октагидрат гидроксида бария
Это химическое соединение в виде белого кристаллического порошка. Он твердый и растворяется в воде. Он имеет температуру плавления 78 ° C.
Он также известен под другими названиями, такими как
- Гидрат бария
- Бария гидроксид
- 8-гидрат
Гидроксид бария Применение
Он используется для ряда целей, таких как
- При производстве щелочи
- В строительном стекле
- При вулканизации синтетического каучука
- В ингибиторах коррозии
- В качестве буровых растворов, пестицидов и смазочных материалов
- Для средства от накипи
- Для рафинации растительных и животных масел
- Для фресковой живописи
- В воде для умягчения
- В составе гомеопатических средств
- Для очистки разливов кислоты
Также используется в сахарной промышленности для приготовления свекловичного сахара.
Гидроксид бария MSDS
Паспорт безопасности материала (MSDS) для гидроксида бария:
Меры безопасности
Это вещество может быть вредным при вдыхании, проглатывании или даже контакте с ним. Прямое воздействие на кожу, глаза или одежду может быть опасным. Руки должны быть тщательно вымыты после работы с этим материалом. При попадании на одежду этого вещества ее следует немедленно снять. Любой участок кожи, подвергшийся воздействию этого соединения, следует немедленно промыть холодной водой с легким мылом.
Токсикология
Длительное воздействие этого вещества может вызвать раздражение кожи. Пыль этого материала может раздражать легкие и дыхательные пути. Проглатывание может вызвать ряд неприятных симптомов, таких как
- Тошнота
- Рвота
- Головная боль
- Головокружение
- Раздражение желудочно-кишечного тракта
Лица с ранее существовавшими заболеваниями дыхательной системы, кожи или глаз могут стать более восприимчивыми к одному или нескольким из вышеупомянутых симптомов.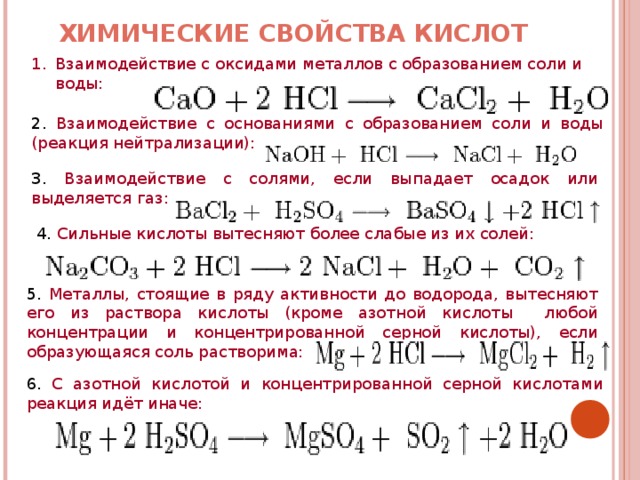
Личная безопасность
Необходимо безопасно хранить этот материал, чтобы избежать утечки и пожара. Любой пожар, возникший из-за этого вещества, можно потушить с помощью огнетушителей. Лица, использующие это соединение, должны носить защитную одежду и использовать автономный дыхательный аппарат для предотвращения контакта этого материала с глазами, одеждой или кожей.
Гидроксид бария и соляная кислота
Гидроксид бария используется для нейтрализации соляной кислоты. Химическая реакция между двумя соединениями представлена как:
Ba(OH)2 (водный) + 2HCl (водный) -> BaCl2 (водный) + 2h3O (жидкий)
Гидроксид бария и серная кислота
Гидроксид бария часто используется для нейтрализации серной кислоты. Реакция выражается следующим представлением:
Ba(OH)2(твердый) + h3SO4(водный) → BaSO4(твердый) + 2h3O(жидкий)
Небольшое количество BaSO4, получаемое из умеренно растворимого Ba(OH )2 покрывает и осаждает Ba(OH)2. В результате реакция между h3SO4 и Ba(OH)2 останавливается.
Гидроксид бария и хлорид аммония
Реакция нейтрализации твердого гидратированного гидроксида бария твердым хлоридом аммония носит эндотермический характер. В результате реакции образуется жидкость, сопровождающаяся падением температуры примерно до -20°С. Он представлен как:
Ba(OH)2 (водный) + 2Nh5Cl (водный) → BaCl2 (водный) + 2Nh4 (газовый) + HOH (жидкий).
Гидроксид бария и тиоцианат аммония
Это эндотермическая реакция, в результате которой образуется тиоцианат бария. Это выражается через эту химическую реакцию:
Ba(OH)2.8h3O (твердое) + 2 Nh5SCN (твердое) → Ba(SCN)2 (твердое) + 10h3O (жидкое) + 2 Nh4 (газообразное).
Моногидрат гидроксида бария
Это химическое соединение выглядит как белый порошок. Он также известен под другими названиями, такими как
- Сухой гидроксид бария .
- Едкий барит моногидрат
- Гидроксид бария 1-гидрат
Состав используется для различных целей, таких как
- Очистка воды
- Производство присадок к маслам
- Изготовление смазочных материалов
- Производство химикатов с высоким содержанием бария
Контакт с кожей, вдыхание или проглатывание этого материала может представлять опасность для здоровья.
Является ли гидроксид бария сильным или слабым основанием?
Это соединение хорошо растворяется в воде. Он считается единственным двухосновным сильным основанием. Он способен окрашивать лакмусовую бумагу в синий цвет и может образовывать соль и воду при взаимодействии с кислотой.
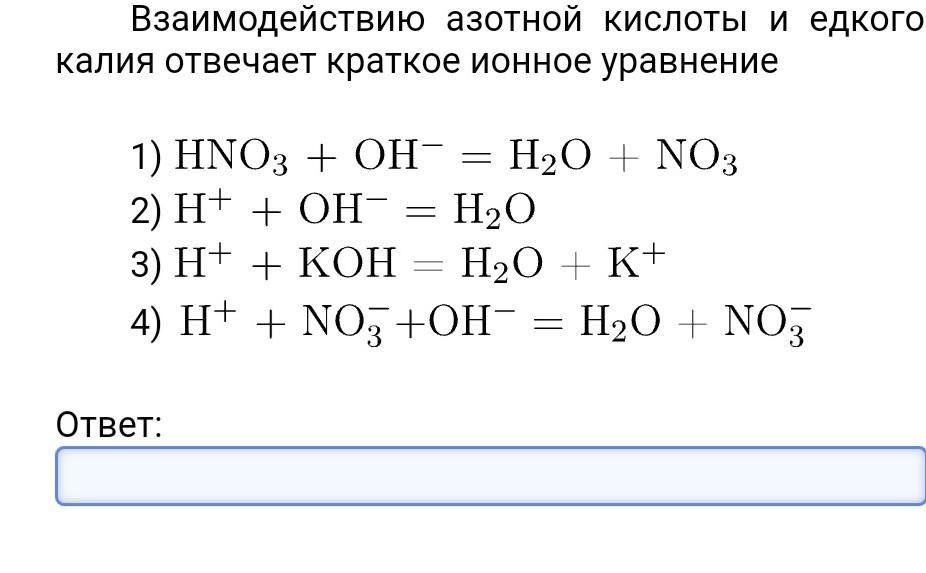
Гидроксид бария и азотная кислота
Гидроксид бария реагирует с азотной кислотой с образованием соли (нитрата бария) и воды, как и в случае классических кислотно-щелочных реакций. Химическая реакция выражается следующим образом:
2HNO3(водная азотная кислота) + Ba(OH)2(водный раствор гидроксида бария) → Ba(NO3)2(водный раствор нитрата бария) + 2h3O(вода)
Гидроксид бария и двуокись углерода
Ba(OH)2 реагирует с двуокисью углерода с образованием карбоната бария. Это выражается следующей химической реакцией:
Это выражается следующей химической реакцией:
Ba(OH)2 + CO2 → BaCO3 + h3O.
Хлорная кислота и гидроксид бария
Две молекулы хлорной кислоты реагируют с одной молекулой гидроксида бария с образованием двух молекул воды и одной молекулы перхлората бария (также известного как хлорат бария). Реакция выражается как
Ba(OH)2 + 2 HClO4 (водный) → Ba(ClO4)2 (водный) + 2 h3O (жидкий).
Гидроксид бария, используемый в этой реакции, представляет собой либо твердое вещество, либо сильно разбавленный водный раствор.
Уксусная кислота и гидроксид бария
Две молекулы уксусной кислоты реагируют с одной молекулой гидроксида бария с образованием соли (нитрата бария) вместе с водой, как и любая другая кислотно-щелочная реакция. Это выражается как:
2 Ch4COOH + Ba(OH)2 → Ba(C2h4O2)2 + 2h3O
Реакцию можно облегчить, заменив C2h4O2 на Ac. Заменив таким образом, химическая реакция может быть представлена в виде:
2 HAc + Ba(OH)2 → Ba(Ac)2 + 2h3O
Гидроксид бария и фосфорная кислота
В этой кислотно-основной реакции нейтрализации участвуют три молекулы гидроксида бария и две молекулы фосфорной кислоты. Формула этой химической реакции выглядит следующим образом:
Формула этой химической реакции выглядит следующим образом:
3 Ba(OH)2 + 2 h4PO4 → Ba3(PO4)2 + 6h3O
Она приводит к осаждению фосфата бария. Это можно рассматривать как реакцию «двойного замещения», в которой барий замещает водород, который, в свою очередь, заменяет барий.
3 Ba(OH)2 + 2 h4PO4 → Ba3(PO4)2 + 6HOH
Гидроксид бария и нитрат аммония
Две молекулы водного раствора гидроксида бария реагируют с водным раствором нитрата аммония с образованием водных растворов нитрата бария, вода. Химическая реакция представлена в виде:
Ba(OH)2 (водный) + 2 Nh5NO3 (водный) → Ba(NO3)2 (водный) + 2 Nh4 (водный) + 2 h3O (жидкий).
Аммиак может растворяться в растворе до насыщения. Затем он может превратиться в газ, тем самым завершив химическое изменение.
Гидроксид бария и хлорид аммония
Твердый хлорид аммония смешивают с твердым гидратированным гидроксидом бария в химическом стакане с образованием хлорида бария. Другими продуктами этой эндотермической реакции являются газообразный аммиак и гидроксид водорода (вода).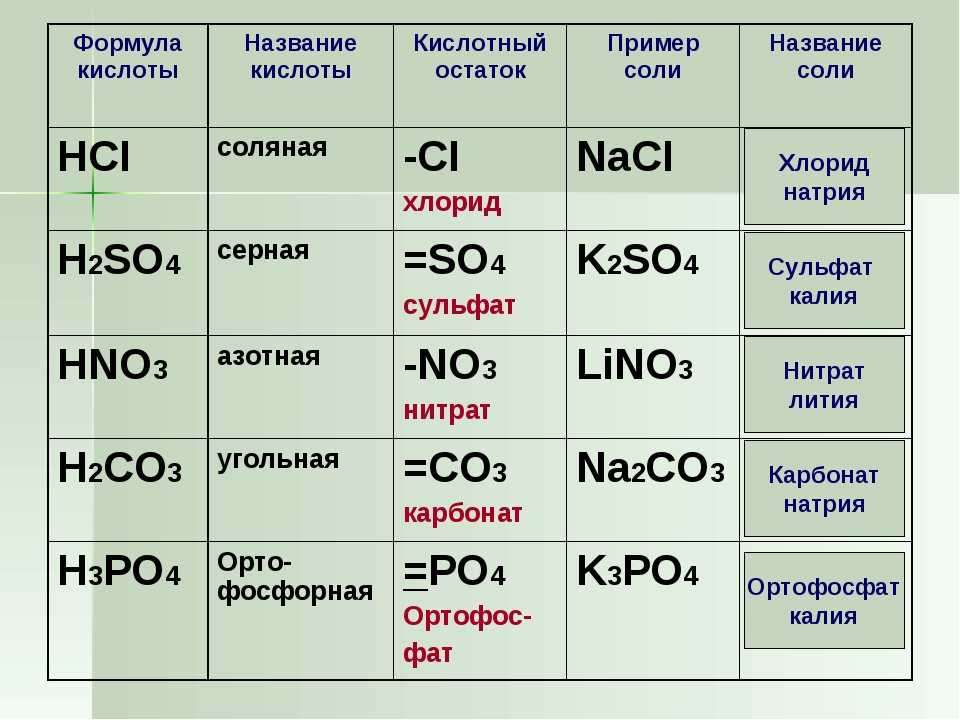 В ходе этой холодной реакции температура резко падает примерно до -20 °C.
В ходе этой холодной реакции температура резко падает примерно до -20 °C.
Формула этой реакции выглядит следующим образом:
Ba(OH)2 (водный) + 2Nh5Cl (водный) → BaCl2 (водный) + 2Nh4 (газообразный) + HOH (жидкий)
Октагидрат гидроксида бария и тиоцианат аммония
Тиоцианат аммония (Nh5SCN) смешивают с твердым октагидратом гидроксида бария (Ba(OH)2.8h3O) для получения тиоцианата бария. В результате кислотно-щелочной реакции образуется щелочной газ, который можно определить с помощью индикаторной бумаги.
Уравнение этой эндотермической реакции имеет следующий вид:
Ba(OH)2,8h3O(твердое) + 2 Nh5SCN(твердое) → Ba(SCN)2(т) + 10h3O(жидкое) + 2 Nh4(газообразное) .
Это эндотермическая реакция, при которой происходит поглощение тепла из окружающей среды. Это приводит к быстрому падению температуры этой реакции, которую можно измерить с помощью цифрового термометра. Это заставляет стакан примерзнуть к деревянной доске. По этой причине стакан следует поставить на маленькую доску, на которую налито несколько капель воды.
Гидроксид бария является одним из основных соединений бария. Коммерчески он чаще всего доступен в виде белого гранулированного моногидрата.
. -solid-reactions,277,EX.html
http://www.chem.umn.edu/outreach/endoexo.html
http://www.chemicalbook.com/ChemicalProductProperty_EN_CB4318493.htm
Эндотермические реакции между твердыми телами | Эксперимент
- Пять из пяти
В этом демонстрационном или классном эксперименте учащиеся наблюдают эндотермическую реакцию между твердым гидратированным гидроксидом бария и твердым хлоридом аммония. В результате реакции образуется жидкость, которая превращается в газообразный аммиак при резком падении температуры примерно до –20 °C 9.0051
 Поэтому рекомендуется как более подходящая демонстрация для учителя. Ученикам можно было позволить ощупать внешний вид очень холодного контейнера.
Поэтому рекомендуется как более подходящая демонстрация для учителя. Ученикам можно было позволить ощупать внешний вид очень холодного контейнера.Оборудование
Аппарат
- Защита глаз (очки)
- Стакан, 100 см 3
- Стекло для часов
- Термометр для измерения до –30 °C (примечание 3)
- Верхние весы
- Вытяжной шкаф (дополнительно)
Химические вещества
- Гидроксид бария-8-вода (КОРРОЗИОННОЕ ВЕЩЕСТВО), 32 г
- Хлорид аммония (ВРЕДЕН), 10 г
- Кислота соляная концентрированная (КОРРОЗИОННАЯ)
- Универсальная индикаторная (или лакмусовая) бумага, 1 полоска
Здоровье, безопасность и технические примечания
- Всегда используйте защитные очки (очки).
- Работать в вытяжном шкафу, если помещение хорошо не проветривается.
- Рассмотрите возможность использования термометра термопарного типа, который можно подключить к большому дисплею или компьютерному монитору.

- Гидроксид бария-8-вода, Ba(OH) 2 .8H 2 O(s), (КОРРОЗИОННОЕ ВЕЩЕСТВО) – см. карточку опасности CLEAPSS HC010B. По возможности избегайте образования комков при взвешивании необходимого количества.
- Хлорид аммония, NH 4 Cl(s), (ВРЕДЕН) – см. карточку опасности CLEAPSS HC009a. По возможности избегайте образования комков при взвешивании необходимого количества.
- Концентрированная соляная кислота, HCl (водн.), (КОРРОЗИОННОЕ) – см. карточку опасности CLEAPSS HC047a. Используйте небольшую бутылку с запасом, чтобы обеспечить пары для теста с аммиаком.
Процедура
- Поставьте химический стакан на часовое стекло с несколькими каплями воды так, чтобы дно стакана касалось воды.
- Обратите внимание на температуру в помещении.
- Смешайте два твердых вещества в стакане и перемешайте термометром. Смесь становится мутной, так как образуется жидкость вместе с белой суспензией.

- Наличие аммиака можно обнаружить по запаху и подтвердить, продув пары из бутыли с соляной кислотой через горлышко стакана и используя влажную индикаторную бумагу.
- Наблюдают падение температуры, что подтверждается тем фактом, что мензурка примерзает к часовому стеклу.
Учебные заметки
Удобно использовать большой дисплей термометра. Холодный стакан можно раздать по классу, как только выделение аммиака прекратится.
Невозможно легко определить точное соединение или соединения бария, образующиеся в этой реакции, но уравнение обычно представляется в виде: Cl(т) → 2NH 3 (г) + 10H 2 O(ж) + BaCl 2 (т)
или
Ba(OH) 2 .8H
Учащихся уровня A можно попросить рассчитать значение энтальпии и изменений энтропии для реакции, используя стандартные изменения энтальпии образования и стандартные значения энтропии, полученные из справочника или из таблицу ниже.
Соединение | DH f ⦵ / кДж моль -1 | S ⦵ / Дж моль |
Ba(OH) 2 .8H 2 O(s) | -3345 | 427 |
NH 4 Cl(s) | -314 | 95 |
NH 3 (г) | -46 | 192 |
Н 2 О(л) | -286 | 70 |
BaCl 2 (с) | -859 | 124 |
BaCl 2 .2H 2 O(s) | -1460 | 203 |
Изменение энтальпии +164 кДж моль –1 получено, если предположить, что продукт представляет собой BaCl 2 (с) и +135 кДж моль –1 если предполагается, что это BaCl 2 . 2H 2 O(s). Студенты должны быть в состоянии качественно предсказать, что изменение энтропии для системы имеет положительное значение, поскольку газ и жидкость образуются из двух твердых тел. Из приведенных выше значений их также можно попросить рассчитать фактическое изменение энтропии для системы и окружающей среды и, следовательно, ∆S в сумме или ∆G для реакции и подтвердить, что процесс является самопроизвольным. Значение ∆S
2H 2 O(s). Студенты должны быть в состоянии качественно предсказать, что изменение энтропии для системы имеет положительное значение, поскольку газ и жидкость образуются из двух твердых тел. Из приведенных выше значений их также можно попросить рассчитать фактическое изменение энтропии для системы и окружающей среды и, следовательно, ∆S в сумме или ∆G для реакции и подтвердить, что процесс является самопроизвольным. Значение ∆S
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов.






Leave A Comment