Центросома — клеточный концертмейстер
Р. Э. Узбеков, И. Б. Алиева,
НИИ физико-химической биологии им. А.Н. Белозерского (МГУ им. М.В. Ломоносова)
«Природа» №5, 2007
Она из тех, в кого влюбляются с первого взгляда, кому хранят верность всю жизнь и кого не понять до конца. Эта так и не разгаданная за 130 лет исследований тайна скрыта в центросоме — крошечной точке в геометрическом центре клетки, куда радиально сходятся микротрубочки (своеобразные рельсы для внутриклеточного транспорта).
Центросому сравнивают с улыбкой Моны Лизы, называют мерцающей звездочкой, центром цитоплазматической вселенной, клеточным концертмейстером и, наконец, центральной загадкой клеточной биологии. Едва ли найдется в живой клетке другая структура, которую исследователи наделили таким количеством романтических эпитетов; и это не удивительно! Одного взгляда в электронный микроскоп достаточно, чтобы заметить, как сильно центросома выделяется на фоне остальных клеточных структур. Особый интерес любого наблюдателя вызывают главные компоненты этой сложно организованной органеллы — центриоли, по форме напоминающие фрагмент античной колонны.
Особый интерес любого наблюдателя вызывают главные компоненты этой сложно организованной органеллы — центриоли, по форме напоминающие фрагмент античной колонны.
Однако первые исследователи процесса клеточного деления B. Флемминг, O. Гертвиг и Э. ван Бенеден, почти одновременно описавшие центросому в середине 70-х годов XIX в., увидели лишь темные гранулы в обоих полюсах митотического веретена (рис. 1). Да иначе и быть не могло, ведь размер этой органеллы находится на пределе разрешения светового микроскопа. В связи с этим в делящихся клетках сначала были описаны две симметрично располагающиеся структуры, имевшие вид «лучистого сияния», — центросферы. Гранулы в фокусах каждой центросферы первоначально были названы полярными корпускулами.
В 1887 г. ван Бенеден вместе с А. Нейтом и независимо от них Т. Бовери, установили, что полярные корпускулы полностью не исчезают после деления клетки (митоза). Они сохраняются в течение всего времени между последовательными делениями (этот период жизни клетки теперь называется интерфазой) и при этом часто располагаются вблизи геометрического центра клетки. Ван Бенеден предложил переименовать полярные корпускулы в центральные корпускулы, или центральные тельца, а Бовери — в центросому, он же позднее предложил и термин «центриоль» [1].
Ван Бенеден предложил переименовать полярные корпускулы в центральные корпускулы, или центральные тельца, а Бовери — в центросому, он же позднее предложил и термин «центриоль» [1].
Наряду с центросомами, также в конце XIX в., были описаны органеллы, лежащие у основания специализированных клеточных образований — ресничек и жгутиков; эти органеллы получили название кинетосом, или базальных телец [2, 3]. Авторы, Л. Хеннеги и М. Легоссек, наблюдали взаимный переход базальных телец и центросом и в 1898 г. выдвинули гипотезу о гомологии этих клеточных органелл, которая впоследствии получила экспериментальное подтверждение (рис. 2).
С момента открытия центросомы основное внимание исследователей было приковано к ее роли в организации клеточного деления. После того как Р. Вирхов в 1855 г. сформулировал знаменитый постулат: «Omnis cellula e cellula» («Каждая клетка от клетки»), исследователи второй половины XIX в. в общих чертах описали картину клеточного деления [4]. Принципиальным для понимания механизма передачи наследственных свойств от клетки к клетке было выяснение роли хромосом. Однако хромосомы сами по себе выглядели пассивными участниками событий митоза, что позволило одному из классиков клеточной биологии, Д. Мезия, сравнить их роль с ролью покойника на похоронах — все происходит ради него, но сам он никакого активного участия в общем действии не принимает. Действительно, при наблюдении митоза в световой микроскоп исследователи видели, как некие нити захватывают хромосомы за их центральные участки и тянут в противоположные стороны клетки. Эти нити были названы нитями веретена (позднее — микротрубочками), а структура, ими образуемая, веретеном деления, поскольку она имела соответствующую форму (рис. 2). Оказалось, что нити веретена тянут хромосомы не произвольно, а в направлении строго определенных участков цитоплазмы — полюсов митотического веретена, а в фокусе каждого веретена и располагается главная героиня нашего повествования — центросома!
Принципиальным для понимания механизма передачи наследственных свойств от клетки к клетке было выяснение роли хромосом. Однако хромосомы сами по себе выглядели пассивными участниками событий митоза, что позволило одному из классиков клеточной биологии, Д. Мезия, сравнить их роль с ролью покойника на похоронах — все происходит ради него, но сам он никакого активного участия в общем действии не принимает. Действительно, при наблюдении митоза в световой микроскоп исследователи видели, как некие нити захватывают хромосомы за их центральные участки и тянут в противоположные стороны клетки. Эти нити были названы нитями веретена (позднее — микротрубочками), а структура, ими образуемая, веретеном деления, поскольку она имела соответствующую форму (рис. 2). Оказалось, что нити веретена тянут хромосомы не произвольно, а в направлении строго определенных участков цитоплазмы — полюсов митотического веретена, а в фокусе каждого веретена и располагается главная героиня нашего повествования — центросома!
Хотя центросома с момента ее открытия постоянно находилась в центре внимания биологов, она и более века спустя оставалась, по выражению известного шотландского ученого Д.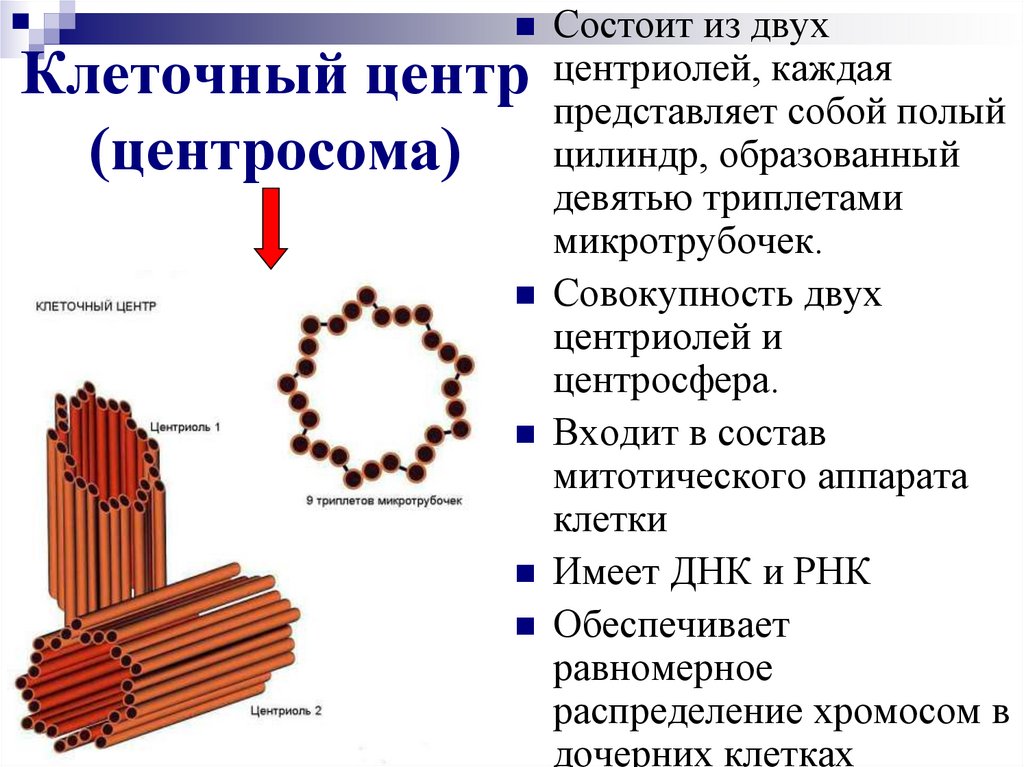 Уитли, центральной загадкой клеточной биологии [5]. Каким же образом эта едва различимая (занимающая не более 0.1% от общего объема клетки) органелла может выполнять столь важную для жизнедеятельности клетки и организма в целом функцию как равномерное распределение по дочерним клеткам генетического материала хромосом? Биологи начала ХХ в. предвидели, что центросома, несмотря на малые размеры, устроена не так просто, как кажется на первый взгляд; они надеялись со временем расшифровать ее структуру и тем самым получить ключ к пониманию ее функций. Действительность, как это часто случается, превзошла все, даже самые смелые, предположения первооткрывателей.
Уитли, центральной загадкой клеточной биологии [5]. Каким же образом эта едва различимая (занимающая не более 0.1% от общего объема клетки) органелла может выполнять столь важную для жизнедеятельности клетки и организма в целом функцию как равномерное распределение по дочерним клеткам генетического материала хромосом? Биологи начала ХХ в. предвидели, что центросома, несмотря на малые размеры, устроена не так просто, как кажется на первый взгляд; они надеялись со временем расшифровать ее структуру и тем самым получить ключ к пониманию ее функций. Действительность, как это часто случается, превзошла все, даже самые смелые, предположения первооткрывателей.
Самая обаятельная и привлекательная
Прорыв в исследовании строения центросомы произошел после появления в середине XX в. нового метода исследования — электронной микроскопии. Использование электронного пучка вместо светового луча традиционного микроскопа невероятно расширило возможности морфологического анализа чрезвычайно мелких по величине объектов.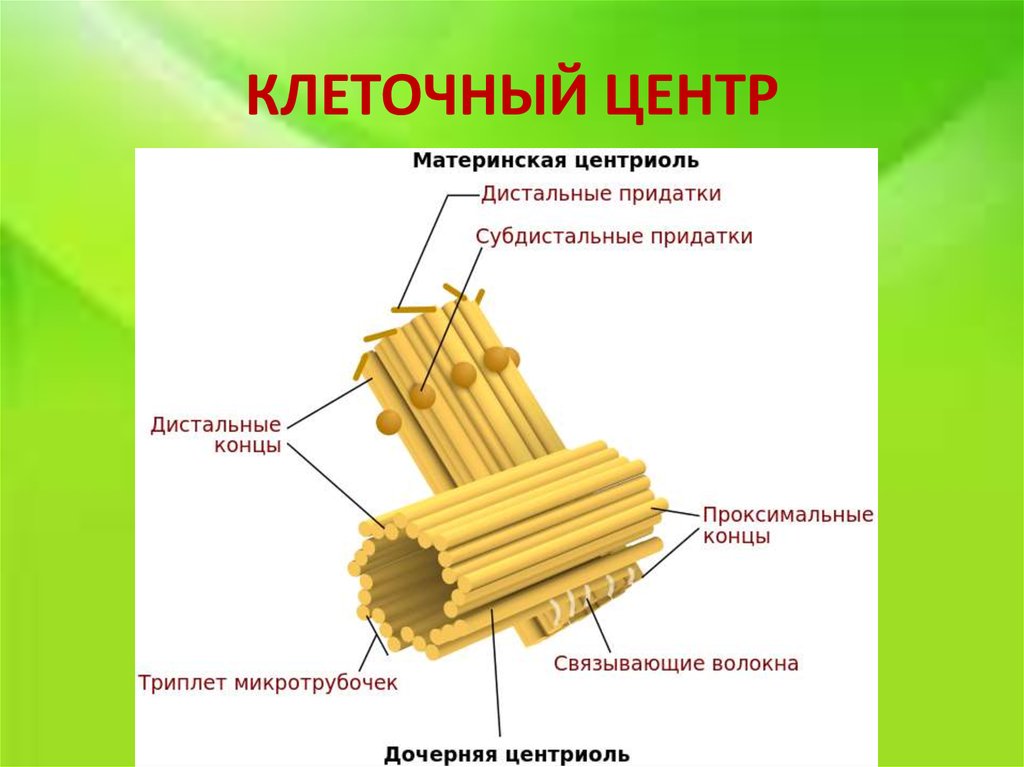
Примечательно, что первое такое исследование центриолей, выполненное С. Селби, оказалось неудачным [6]. Хотя на отдельных микрофотографиях митотических клеток видны косые срезы центриолей, автор не смогла их идентифицировать, а за центриоли приняла осмиофильные гранулы вблизи митотических полюсов. И вот тут весьма кстати оказалась уже упомянутая гомология центриолей и базальных телец, поскольку первые описания ультраструктуры центриолярных цилиндров были сделаны именно на объектах, имеющих жгутики и реснички — на клетках ресничного эпителия и на сперматозоидах [7, 8]. Сразу после этого была описана и ультраструктура митотических и интерфазных центриолей [9, 10].
К настоящему времени ультраструктура центриолей и ассоциированных с ними структур детально исследована. Выяснилось, что в состав центросомы входит пара центриолей, окруженных перицентриолярным материалом (рис. 3). Центриоли в паре не одинаковы, одна них (зрелая, или материнская), в отличие от второй (незрелой, или дочерней), несет на себе дополнительные структуры (рис. 3, 4). Оказалось, что созревание центриоли занимает более одного клеточного цикла; в течение первого цикла формирующийся цилиндр, называемый в это время процентриолью, дорастает до нормального размера (см. рис. 3, 4).
3, 4). Оказалось, что созревание центриоли занимает более одного клеточного цикла; в течение первого цикла формирующийся цилиндр, называемый в это время процентриолью, дорастает до нормального размера (см. рис. 3, 4).
Длина центриолярных цилиндров составляет 0.3–0.5 мкм, диаметр около 0.2 мкм, при этом стенки их состоят из девяти симметрично расположенных тяжей [7], каждый из которых составлен из трех латерально связанных друг с другом микротрубочек (внутренней — А, средней — B и внешней — С), называемых вместе триплетом [11].
Центриолярный цилиндр — полярная структура. Поскольку в базальном тельце конец цилиндра, от которого растет ресничка, обращен к внешней поверхности клетки, он был назван дистальным, а противоположный конец, обращенный внутрь клетки, — проксимальным. В центриолях придатки и перицентриолярные сателлиты располагаются ближе к дистальному концу, и от него же может расти первичная ресничка (рис. 5). В то же время как процентриоль (вновь формирующаяся центриоль) всегда образуется ближе к проксимальному концу (см. рис. 4). Именно здесь, на проксимальном конце, располагается структура, характерная только для молодых (незрелых) центриолей, — так называемая «ось со спицами», или «тележное колесо» (см. рис. 4).
рис. 4). Именно здесь, на проксимальном конце, располагается структура, характерная только для молодых (незрелых) центриолей, — так называемая «ось со спицами», или «тележное колесо» (см. рис. 4).
Триплеты микротрубочек лежат под углом к радиусу центриолярного цилиндра, причем закручены они в центриолях всех исследованных объектов одинаково — против часовой стрелки, если смотреть на центриоль с проксимального конца.
Микротрубочки (также полярные биополимеры) в составе центриолярных триплетов всегда ориентированы одинаково — их минус конец находится на проксимальном конце центриолярного цилиндра, а плюс конец — на дистальном.
С поверхностью материнской центриоли связаны структуры двух типов. Во-первых, это перицентриолярные сателлиты (образования, напоминающие по форме фишку детской игры), состоящие из конической ножки длиной около 0.1 мкм, на вершине которой находится округлая головка (см. рис. 4). Число их варьирует в норме от одной до четырех на центриоль, но может достигать девяти и более, либо они вовсе отсутствуют в клетках некоторых типов. С головками перицентриолярных сателлитов часто связаны отходящие от центросомы микротрубочки, причем от сателлитов их может отходить значительно больше, чем от стенки центриоли. Перицентриолярные сателлиты — структуры, характерные исключительно для интерфазной центросомы. За несколько часов до митоза они исчезают, и их материал включается в состав так называемого митотического гало — аморфной тонкофибриллярной структуры диаметром около 1 мкм, окружающей центросому в митозе.
С головками перицентриолярных сателлитов часто связаны отходящие от центросомы микротрубочки, причем от сателлитов их может отходить значительно больше, чем от стенки центриоли. Перицентриолярные сателлиты — структуры, характерные исключительно для интерфазной центросомы. За несколько часов до митоза они исчезают, и их материал включается в состав так называемого митотического гало — аморфной тонкофибриллярной структуры диаметром около 1 мкм, окружающей центросому в митозе.
Второй тип выростов на поверхности центриолярных цилиндров — придатки, они расположены на дистальном конце каждого триплета, а потому их количество всегда равно девяти (см. рис. 4). В отличие от перицентриолярных сателлитов, придатки не исчезают при переходе клетки из интерфазы в митоз, и по их наличию всегда можно определить более зрелую материнскую центриоль.
У материнской центриоли есть еще одна особенность: она способна формировать рудиментарную (первичную) ресничку — структуру, которая выступает над поверхностью клетки подобно реснице над глазом (см. рис. 5). Первичные реснички появляются в клетках вскоре после завершения деления и исчезают перед митозом или в самом его начале. С центриолями, формирующими первичную ресничку, часто ассоциированы исчерченные корешки (см. рис. 5). Назвали их по предполагаемой функции — первоначально считалось, что они заякоривают ресничку, подобно корням дерева. Однако исчерченные корешки могут наблюдаться и в отсутствии реснички [12].
рис. 5). Первичные реснички появляются в клетках вскоре после завершения деления и исчезают перед митозом или в самом его начале. С центриолями, формирующими первичную ресничку, часто ассоциированы исчерченные корешки (см. рис. 5). Назвали их по предполагаемой функции — первоначально считалось, что они заякоривают ресничку, подобно корням дерева. Однако исчерченные корешки могут наблюдаться и в отсутствии реснички [12].
Строение интерфазной центросомы постепенно меняется в зависимости от стадии клеточного цикла. В конце интерфазы или в профазе митоза две пары центриолей начинают расходиться и формируют два равнозначных центра полимеризации микротрубочек — профазные звезды, при этом интерфазные микротрубочки полностью разрушаются. Каждый полюс веретена в митозе содержит две взаимно перпендикулярных центриоли — диплосому (рис. 6). Материнскую центриоль легко отличить от дочерней, поскольку она имеет два свободных конца и окружена митотическим гало.
Во всех ты, душечка, нарядах хороша!
По биохимическому составу центросома оказалась мультибелковым комплексом. Первыми, естественно, были охарактеризованы белки, составляющие основу триплетов центриолярных цилиндров — α- и β-тубулины, а впоследствии семейство пополнилось еще пятью белками — γ-, δ-, ε-, ζ- и η-тубулины. Отсутствие любого из них в большей или меньшей степени приводит к нарушению структуры и функций центросомы.
Первыми, естественно, были охарактеризованы белки, составляющие основу триплетов центриолярных цилиндров — α- и β-тубулины, а впоследствии семейство пополнилось еще пятью белками — γ-, δ-, ε-, ζ- и η-тубулины. Отсутствие любого из них в большей или меньшей степени приводит к нарушению структуры и функций центросомы.
К настоящему времени охарактеризовано уже более сотни ассоциированных с центросомой белков. Поскольку трудно дать единую универсальную классификацию всех этих белков, существует несколько вариантов их систематизации в зависимости от выбранного параметра. По локализации в центросоме различают белки, непосредственно входящие в состав центриолей (как уже упомянутые тубулины), и белки ассоциированных структур и перицентриолярного материала (например, перицентрин). По продолжительности нахождения в центросоме белки разделяют на постоянно присутствующие и появляющиеся в ней только в специфические моменты клеточного цикла. По функциям выделяют несколько групп центросомальных белков: структурные, белки-моторы, регуляторы (в первую очередь киназы и фосфатазы), а также белки, связанные с нуклеацией микротрубочек (образованием затравки, с которой начинается их рост) и удержанием микротрубочек на центросоме.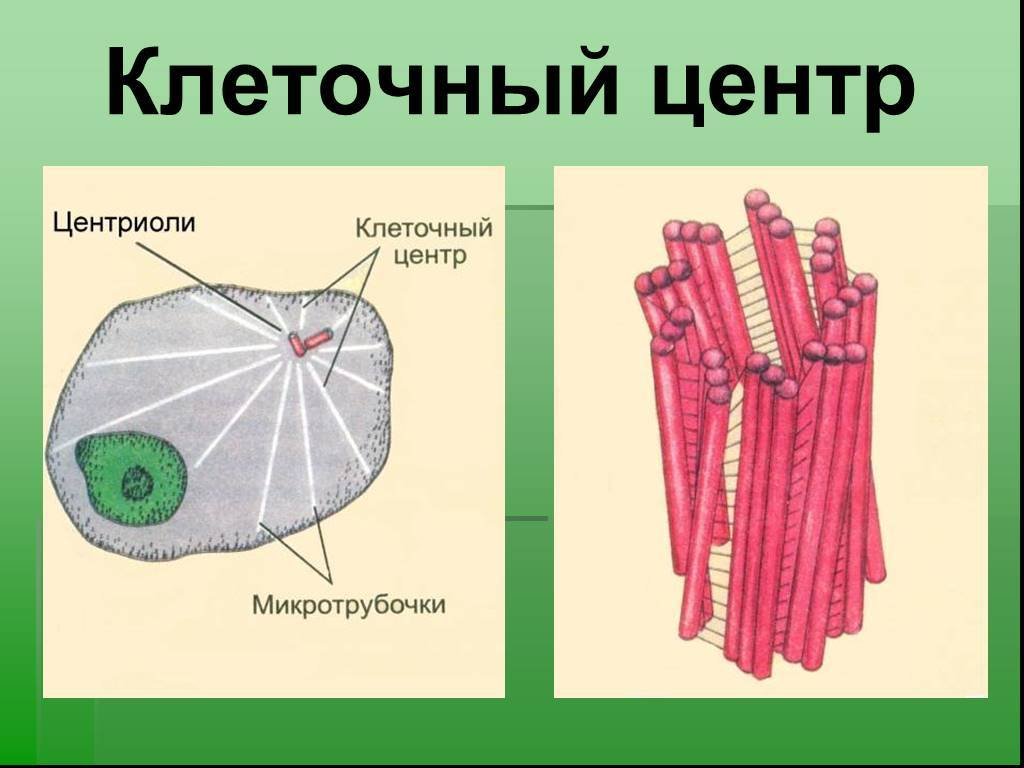
Белки-моторы, ассоциированные с микротрубочками, участвуют в формировании митотического веретена и осуществляют направленный транспорт вдоль микротрубочек интерфазной сети. При этом микротрубочки выступают в качестве своеобразных рельсов, по которым органеллы и белковые комплексы перемещаются в обоих направлениях — центробежно (от центра клетки к периферии) при участии белков суперсемейства кинезинов, и центрипетально (от периферии клетки к центру) при участии белков суперсемейства динеинов. Необходимо отметить, что центросома часто тесно связана с комплексом Гольджи (рис. 7), что обеспечивает доставку созревающих в нем белков по отходящим от центросомы микротрубочкам во все части клетки (рис. 8). Регуляторные белки клеточного цикла представлены разнообразными по функциям киназами (осуществляющими специфическое фосфорилирование других белков) — например, киназами CDK1 (p34cdc2), управляющими ходом митоза, или киназами семейств Polo, Aurora, NIMA и др. Белки — компоненты комплекса нуклеации микротрубочек — также многочисленны, некоторые из них высоко консервативны (т. е. встречаются у всех групп эукариот), другие видоспецифичны. Таким образом, не удивительно, что при столь многообразном белковом составе центросома выполняет в клетке разнообразные функции, часть которых и до настоящего времени полностью не исследована.
е. встречаются у всех групп эукариот), другие видоспецифичны. Таким образом, не удивительно, что при столь многообразном белковом составе центросома выполняет в клетке разнообразные функции, часть которых и до настоящего времени полностью не исследована.
На все руки мастерица
Вспомним, что еще первооткрыватели центросомы связывали ее роль в клетке с функционированием митотического веретена, а значит и с микротрубочками. Дальнейшие исследования показали, что на центриоли, действительно, происходит образование (полимеризация) микротрубочек (рис. 9), и долгое время полагали, что именно в этом основная функция центросомы. Впоследствии оказалось, что такое представление в значительной степени ограничено, и правы были те исследователи, которые уже в начале XX в. поняли, что эта органелла играет в клетке совершенно особую роль. Однако разберемся с функциями центросомы по порядку.
Центросома как центр организации микротрубочек. Это представление о центросоме окончательно оформилось ко второй половине ХХ в.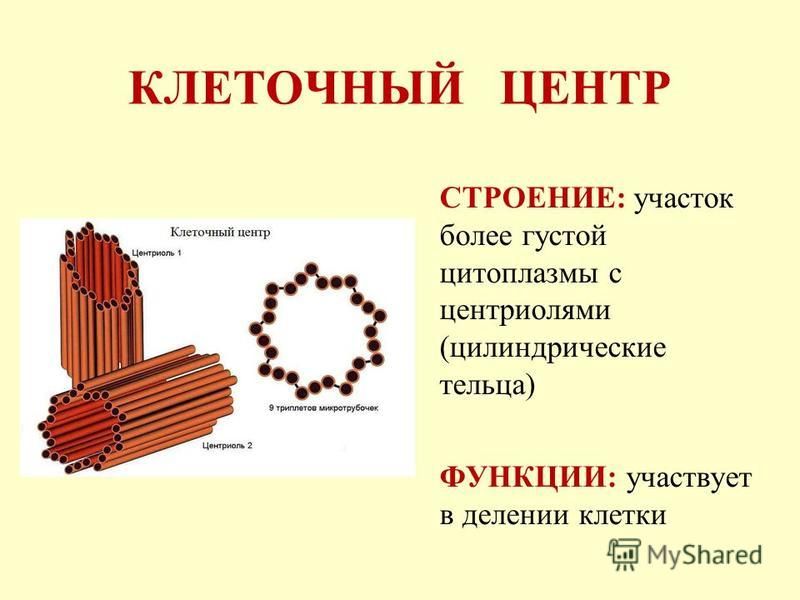 Как было отмечено в обзоре К. Фултон, центросома может организовывать микротрубочки четырьмя различными способами: образует процентриоли, формирует микротрубочки митотического веретена, организует радиальную систему интерфазных микротрубочек, инициирует рост первичной реснички [13]. Созревание центриоли — это и есть не что иное, как приобретение способности к полимеризации микротрубочек [14]. Интересно проследить последовательные стадии, проходя которые центриоль обретает эту способность.
Как было отмечено в обзоре К. Фултон, центросома может организовывать микротрубочки четырьмя различными способами: образует процентриоли, формирует микротрубочки митотического веретена, организует радиальную систему интерфазных микротрубочек, инициирует рост первичной реснички [13]. Созревание центриоли — это и есть не что иное, как приобретение способности к полимеризации микротрубочек [14]. Интересно проследить последовательные стадии, проходя которые центриоль обретает эту способность.
Как мы уже упоминали, окончательное созревание центриоли занимает более одного клеточного цикла. Процентриоли (две на клетку, по одной на каждую уже существующую центриоль) появляются в конце начальной (G1) фазы клеточного цикла и растут на протяжении двух следующих за ней фаз — синтетической (S) и предмитотической (G2). В этом первом для себя клеточном цикле молодые процентриоли не участвуют в нуклеации микротрубочек. Основную роль в формировании их интерфазной системы играет самая старая из четырех центриолей в клетке — «мать» для одной из процентриолей и «бабушка» для другой процентриоли, формирующейся вблизи второй по возрасту центриоли в клетке (см.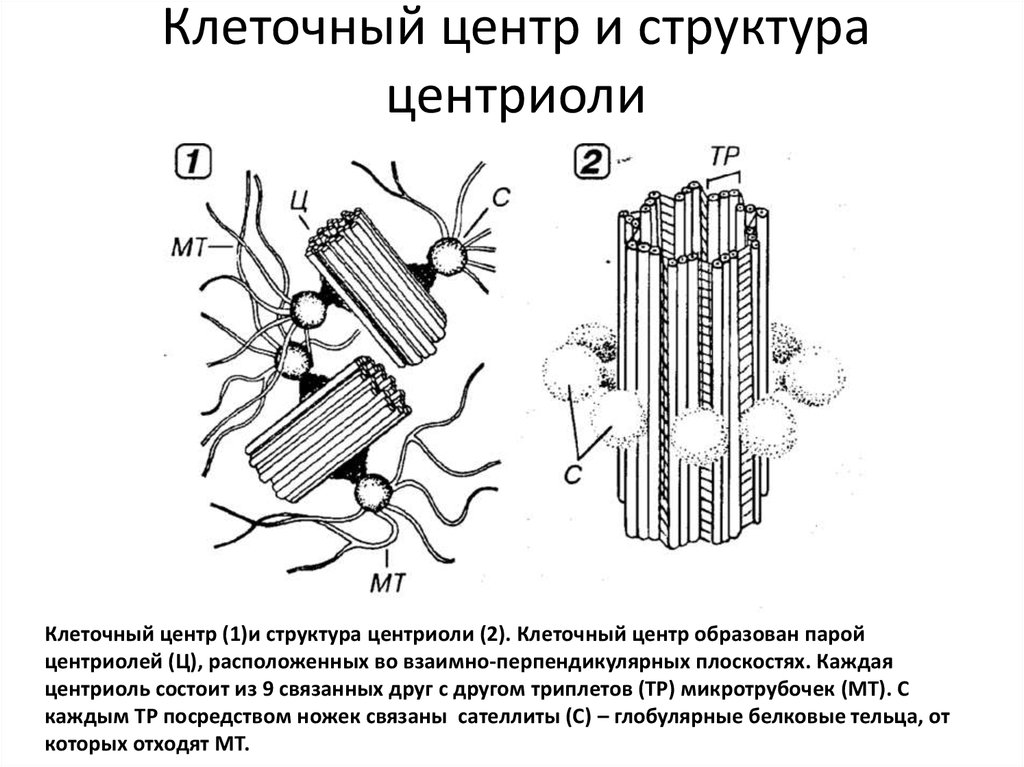 рис. 4).
рис. 4).
Далее, в начале митоза, в процессе формирования профазных звезд, центрами нуклеации становятся два митотических гало, в середине которых располагаются диплосомы — структуры, состоящие из ориентированных перпендикулярно друг другу двух центриолей, по одной старой и по одной новообразованной (те самые темные гранулы, наличие которых обнаружили исследователи XIX в.). После окончания митоза дочерняя центриоль оказывается во вновь сформированной клетке в паре с материнской, от которой уже неотличима по размерам. Дочерняя центриоль все еще (в начале G1-фазы второго в своей жизни клеточного цикла) не стала центром организации интерфазных микротрубочек и по-прежнему не может образовывать первичную ресничку (на это тоже способна пока только ее «мать»).
Однако в это время молодая дочерняя центриоль впервые отделяется от материнской, и ровно через один цикл после возникновения (в конце G1-фазы второго в своей жизни клеточного цикла) впервые выступает центром организации микротрубочек, формируя новую процентриоль.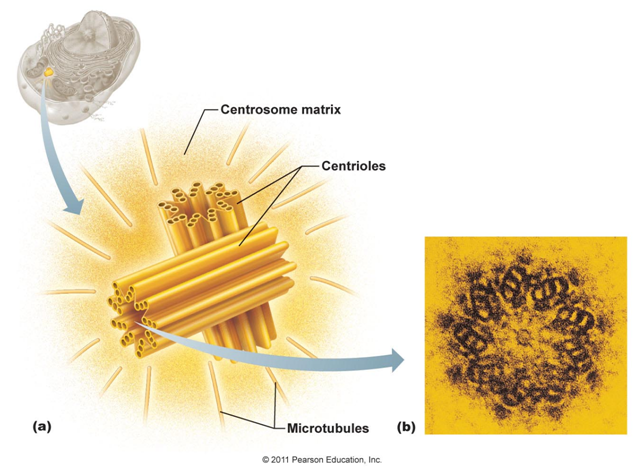
В этой связи как нельзя лучше подходит высказанное еще в 1961 г. Д. Мезия предположение: «…когда происходит очередное деление, подготовка к следующему делению уже началась». Более того, можно сказать, что в клетке с закладкой процентриолей началась подготовка не только к ближайшему, но и следующему за ним делению.
При завершении второго клеточного цикла (в профазе митоза) эта центриоль уже может организовывать микротрубочки вторым способом — формировать один из полюсов веретена деления. Одновременно на центриоли появляется ценексин. И только прожив в клетке почти два полных цикла, эта центриоль становится, наконец, «старшей» в клетке, центром организации интерфазных микротрубочек и способна формировать первичную ресничку.
Описанный нами сложнейший процесс протекает при участии многочисленных центросомальных белков, многие из которых только ждут своего исследователя. Однако уже понятно, что функции некоторых исследованных белков являются жизненно важными. Так, в начале интерфазы на материнской центриоли формируются перицентриолярные сателлиты.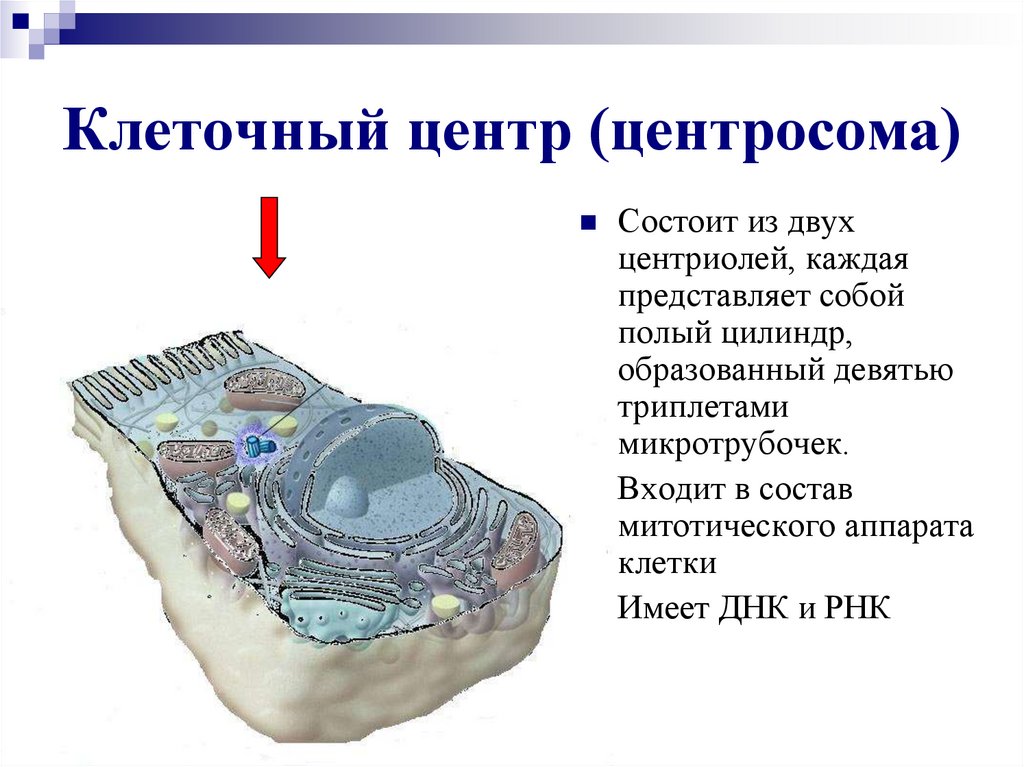 В составе этих органелл обнаружен белок δ-тубулин, в отсутствие которого нарушается структура центриолярного цилиндра — происходит потеря микротрубочки «С» и центриоли содержат лишь дуплеты микротрубочек. Без белка центрина невозможно удвоение центриолей. А белок протеинкиназа Аврора А, появляющийся в составе центросомы во второй половине интерфазы, отвечает за регуляцию расхождения центросом (что происходит при участии клеточного белка-мотора Eg5) — будущих полюсов веретена деления.
В составе этих органелл обнаружен белок δ-тубулин, в отсутствие которого нарушается структура центриолярного цилиндра — происходит потеря микротрубочки «С» и центриоли содержат лишь дуплеты микротрубочек. Без белка центрина невозможно удвоение центриолей. А белок протеинкиназа Аврора А, появляющийся в составе центросомы во второй половине интерфазы, отвечает за регуляцию расхождения центросом (что происходит при участии клеточного белка-мотора Eg5) — будущих полюсов веретена деления.
Мы привели лишь несколько примеров, но и этого достаточно, чтобы понять, насколько значимую роль может играть один-единственный белок в нормальном протекании, тонкой регуляции и филигранно точном исполнении конечного результата столь сложных процессов, в основе которых лежит нуклеация микротрубочек.
Нуклеирующая и заякоривающая функции — две отдельные активности центросомы. Согласно данным последних лет, центросома ответственна не только за нуклеацию микротрубочек, но и за их заякоривание (т.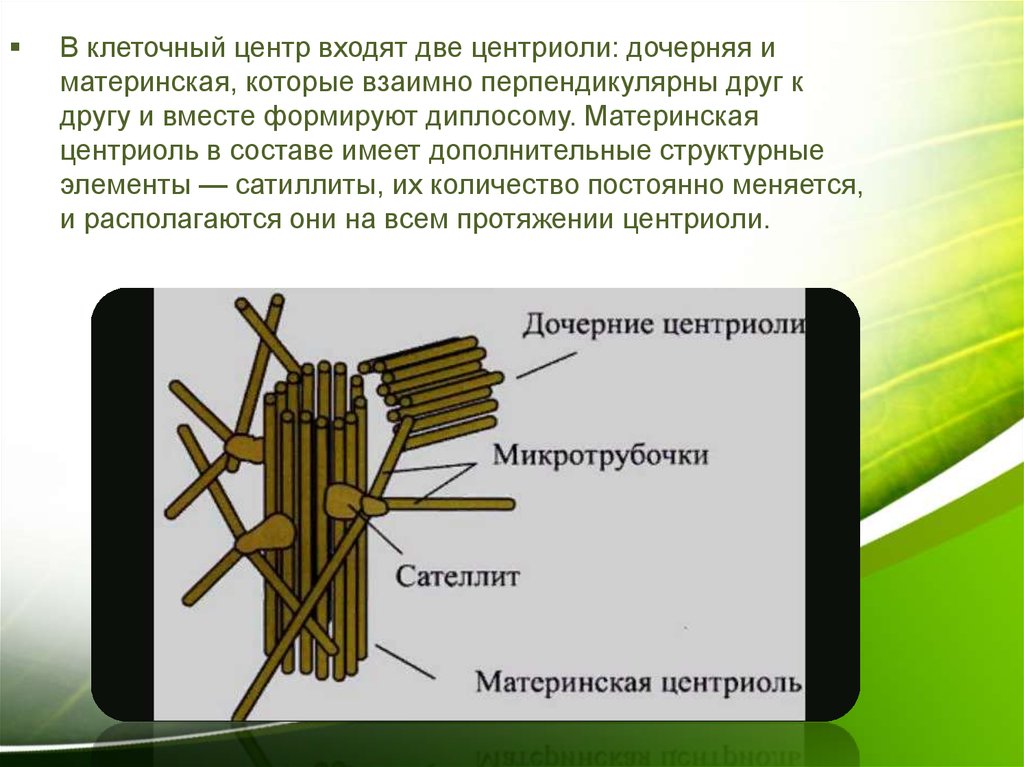 е. закрепление и удержание на центросоме), причем обе функции контролируются разными белковыми комплексами (γ-тубулиновым и нинеиновым соответственно) [15]. В клетках культуры ткани оба комплекса расположены в одной локальной области — на центросоме, и это определяет радиальность существующей в них системы микротрубочек. У высокодифференцированных клеток комплексы могут быть сосредоточены в разных участках клетки, что определяет специфическую организацию системы микротрубочек в целом. Например, в эпителиальных клетках, выстилающих орган равновесия (кортиев орган), наряду с расходящимися от центросомы короткими микротрубочками существует множество длинных, ориентированных вдоль длинной оси клетки. Очевидно, что для формирования такой системы микротрубочек необходимо, чтобы заякоривающий комплекс располагался на краю клетки. По-видимому, зародившись на центросоме, короткие микротрубочки перемещаются в направлении клеточной мембраны, откуда дорастают до противоположного конца клетки. Такая специализированная система микротрубочек обеспечивает не только эффективное распределение мембранных компонентов и перемещение везикул, но и выполнение главной специальной функции этих клеток — передачу механических вибраций.
е. закрепление и удержание на центросоме), причем обе функции контролируются разными белковыми комплексами (γ-тубулиновым и нинеиновым соответственно) [15]. В клетках культуры ткани оба комплекса расположены в одной локальной области — на центросоме, и это определяет радиальность существующей в них системы микротрубочек. У высокодифференцированных клеток комплексы могут быть сосредоточены в разных участках клетки, что определяет специфическую организацию системы микротрубочек в целом. Например, в эпителиальных клетках, выстилающих орган равновесия (кортиев орган), наряду с расходящимися от центросомы короткими микротрубочками существует множество длинных, ориентированных вдоль длинной оси клетки. Очевидно, что для формирования такой системы микротрубочек необходимо, чтобы заякоривающий комплекс располагался на краю клетки. По-видимому, зародившись на центросоме, короткие микротрубочки перемещаются в направлении клеточной мембраны, откуда дорастают до противоположного конца клетки. Такая специализированная система микротрубочек обеспечивает не только эффективное распределение мембранных компонентов и перемещение везикул, но и выполнение главной специальной функции этих клеток — передачу механических вибраций.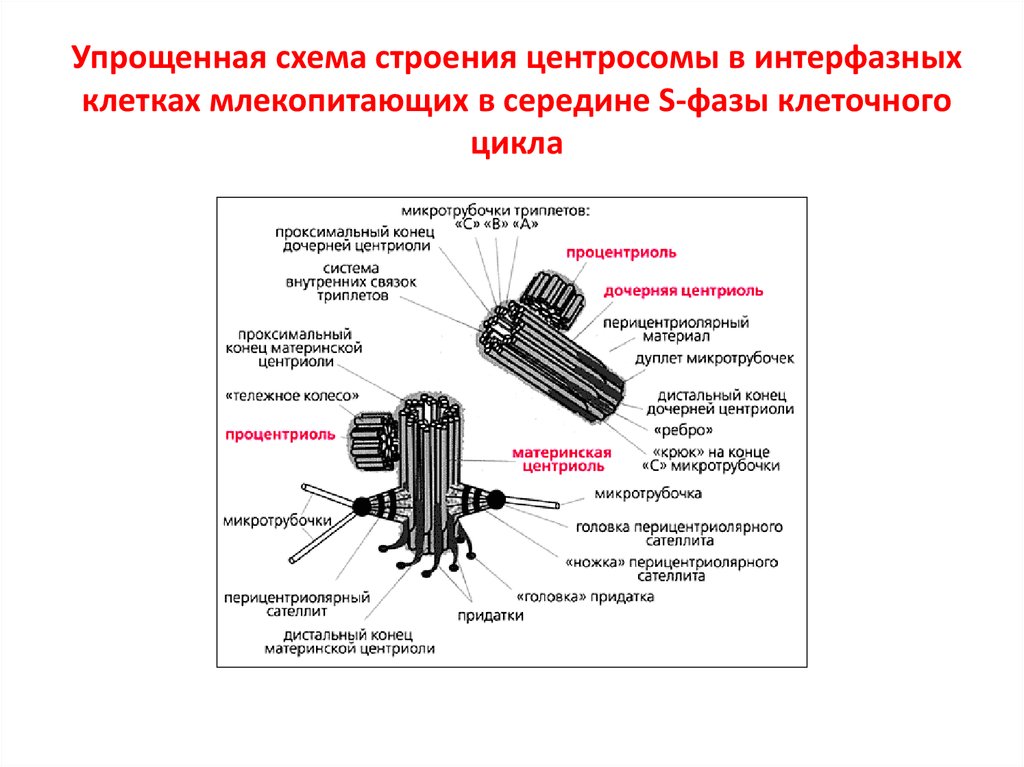
Какие молекулярные механизмы приводят к реорганизации радиальной системы микротрубочек в продольно-ориентированную, до конца неясно. Однако из приведенного примера следует, что радиальная организация сети микротрубочек не универсальна, а центросома не всегда выполняет роль основной структурой, ответственной за пространственную организацию цитоплазматической сети микротрубочек.
Центросома — регуляторный центр клетки. Для этого утверждения есть много оснований, о некоторых их них мы уже говорили, но существуют и другие. Центросома обычно располагается в геометрическом центре клетки, в непосредственной близости от аппарата Гольджи, от нее на периферию клетки радиально расходятся микротрубочки — своеобразные клеточные «рельсы», по которым транспортные молекулы перемещают различные «грузы», а растущая от активной центриоли первичная ресничка выполняет в клетке сенсорную функцию. Считается, что ресничка — элемент пути, транслирующего внеклеточный сигнал на центросому и комплекс Гольджи с целью эффективной секреции новых синтезированных веществ внеклеточного матрикса. Ресничка выполняет роль антенны; на ее поверхности располагаются разнообразные специфические молекулярные комплексы — рецепторы для внешних сигналов. Например, полицистин-2 на поверхности ресничек клеток почечного эпителия участвует в формировании кальциевых каналов и инициации сигнала, контролирующего клеточную пролиферацию и дифференциацию. Одновременно в этих клетках ресничка выполняют и механосенсорную функцию. Рецепторы на мембране реснички могут быть видоспецифичными — например, реснички нейрона имеют характерные рецепторы для соматостатина и серотонина.
Ресничка выполняет роль антенны; на ее поверхности располагаются разнообразные специфические молекулярные комплексы — рецепторы для внешних сигналов. Например, полицистин-2 на поверхности ресничек клеток почечного эпителия участвует в формировании кальциевых каналов и инициации сигнала, контролирующего клеточную пролиферацию и дифференциацию. Одновременно в этих клетках ресничка выполняют и механосенсорную функцию. Рецепторы на мембране реснички могут быть видоспецифичными — например, реснички нейрона имеют характерные рецепторы для соматостатина и серотонина.
Таким образом, центросома оказывается центральным «узлом» в механизме сигнальной трансдукции: от первичной реснички центросома получает внеклеточный сигнал, в зависимости от которого «регулирует» транспортные процессы, осуществляемые по системе связанных с нею микротрубочек.
Центросома — структурная часть механизма, управляющего динамической морфологией клетки в целом. Живая клетка имеет определенную, характерную для данного типа форму. Форма эта не постоянна, она способна динамично меняться. Постоянство формы клетки поддерживает цитоскелет, и он же обеспечивает ее изменения при различных физиологических и патологических состояниях. Особенно значительные изменения происходят при движении клетки — сложно скоординированном процессе, в который напрямую вовлечены растущие от центросомы микротрубочки. При движении микротрубочки взаимодействуют с актиновым филаментами и клеточными контактами, регулируют натяжение клетки, а изменения их динамики вызывают изменение скорости движения. Выполнение этих функций напрямую связано с пространственной организацией системы микротрубочек, с ее способностью быстро перестраиваться. В настоящее время очевидна структурно-функциональная связь всех компонентов цитоскелета в клетке. Так, поддержание формы клетки зависит не только от системы микротрубочек, но и от системы промежуточных филаментов, центр схождения которых также может располагаться вблизи центросомы. Взаимодействие микротрубочек и актиновых микрофиламентов имеет принципиальное значение на различных стадиях построения митотического веретена.
Форма эта не постоянна, она способна динамично меняться. Постоянство формы клетки поддерживает цитоскелет, и он же обеспечивает ее изменения при различных физиологических и патологических состояниях. Особенно значительные изменения происходят при движении клетки — сложно скоординированном процессе, в который напрямую вовлечены растущие от центросомы микротрубочки. При движении микротрубочки взаимодействуют с актиновым филаментами и клеточными контактами, регулируют натяжение клетки, а изменения их динамики вызывают изменение скорости движения. Выполнение этих функций напрямую связано с пространственной организацией системы микротрубочек, с ее способностью быстро перестраиваться. В настоящее время очевидна структурно-функциональная связь всех компонентов цитоскелета в клетке. Так, поддержание формы клетки зависит не только от системы микротрубочек, но и от системы промежуточных филаментов, центр схождения которых также может располагаться вблизи центросомы. Взаимодействие микротрубочек и актиновых микрофиламентов имеет принципиальное значение на различных стадиях построения митотического веретена. Взаимодействие между микротрубочками, актиновыми микрофиламентами и адгезивными структурами является ключевым в регуляции клеточной подвижности (миграции, локомоции, цитокинеза и поляризации клеток). Это взаимодействие осуществляется в первую очередь на структурном уровне посредством белков-связок, которые соединяют микротрубочки и актиновые микрофиламенты [16].
Взаимодействие между микротрубочками, актиновыми микрофиламентами и адгезивными структурами является ключевым в регуляции клеточной подвижности (миграции, локомоции, цитокинеза и поляризации клеток). Это взаимодействие осуществляется в первую очередь на структурном уровне посредством белков-связок, которые соединяют микротрубочки и актиновые микрофиламенты [16].
В неспециализированных клетках центросома регулирует не только соотношение свободных и связанных с ней микротрубочек, но и длину радиальных микротрубочек, а, следовательно, и их способность дорасти до края клетки и взаимодействовать своими плюс-концами с фокальными контактами. Дело в том, что единичный растущий конец индивидуальной микротрубочки способен к специфической локальной регуляции контактов путем направленного к ним подрастания микротрубочек — таргетинга [17]. Это делает каждый плюс-конец центросомальной микротрубочки, достигший периферии клетки, потенциально уникальным. Однако способность центросомы сочетать нуклеирующую и заякоривающую функции выходит на первый план не только в связи с представлением о том, что индивидуальная микротрубочка — дискретный инструмент регуляции клеточных контактов, но и в связи с ее способностью закрепляться на специфических сайтах на периферии клетки с помощью комплекса плюс-концевых белков, а также динамически взаимодействовать с актиновыми филаментами [18].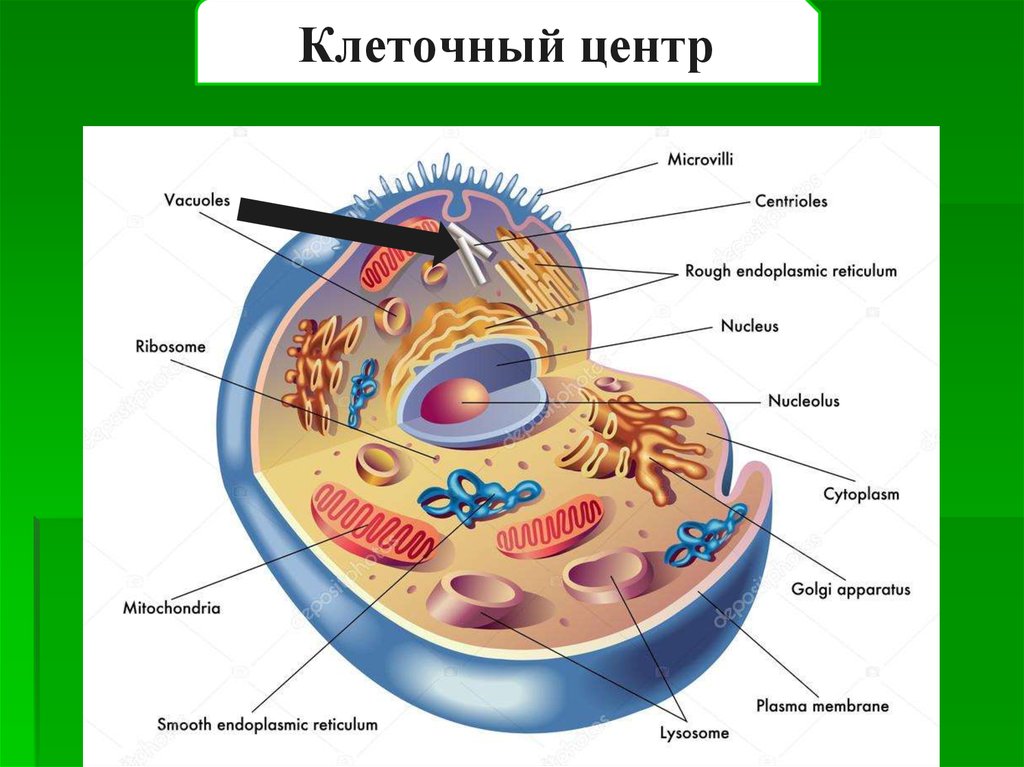 Эта способность плюс-концов очень важна и для митоза, поскольку позволяет радиально растущим от центросомы астральным микротрубочкам взаимодействовать с кортексом и обеспечивать правильное положение ядра, хромосомной пластинки и борозды дробления, а также генерировать силы, действующие на центросому и полюса веретена, с которыми связаны минус-концы микротрубочек. По окончании митоза плюс-концевые белки определяют и положение аппарата Гольджи, в норме локализованного рядом с центросомой; взаимодействие между центросомой и аппаратом Гольджи — необходимый элемент внутриклеточных сигнальных путей регуляции деления клетки и апоптоза.
Эта способность плюс-концов очень важна и для митоза, поскольку позволяет радиально растущим от центросомы астральным микротрубочкам взаимодействовать с кортексом и обеспечивать правильное положение ядра, хромосомной пластинки и борозды дробления, а также генерировать силы, действующие на центросому и полюса веретена, с которыми связаны минус-концы микротрубочек. По окончании митоза плюс-концевые белки определяют и положение аппарата Гольджи, в норме локализованного рядом с центросомой; взаимодействие между центросомой и аппаратом Гольджи — необходимый элемент внутриклеточных сигнальных путей регуляции деления клетки и апоптоза.
Мы понимаем, что непосвященному в тайны клеточной биологии трудно воспринять все вышесказанное. Придется поверить на слово: накопленные к настоящему моменту данные свидетельствуют, что центросома — не только центр организации микротрубочек, но и структурная часть механизма, управляющего динамической морфологией клетки в целом.
И вечный бой, покой нам только снится.
 ..
..Завершая свое краткое повествование о центросоме, попробуем определить, насколько далеко мы продвинулись по пути постижения ее роли в живой клетке. Уникальная центрально-симметричная структура всегда вызывала смелые, а порой и фантастические гипотезы о функциях центросомы. История исследований изобилует примерами (большая часть которых, ввиду ограниченности объема, не вошла в данную статью), когда категоричность утверждений исследователей опровергалась сюрпризами, преподносимыми этой клеточной органеллой. Согласно современным представлениям, центросома — важный интегральный элемент живой клетки, функции которой не ограничены ее способностью к полимеризации микротрубочек. В исследовании центросомы появились целые отдельные направления, посвященные ее участию в каком-то одном аспекте жизнедеятельности клетки: в поддержании и изменении формы клетки, в образовании клеточной полярности, в регуляции внутриклеточного транспорта, в формировании мультибелковых ансамблей, ответственных за регуляцию клеточного цикла, и в других клеточных процессах.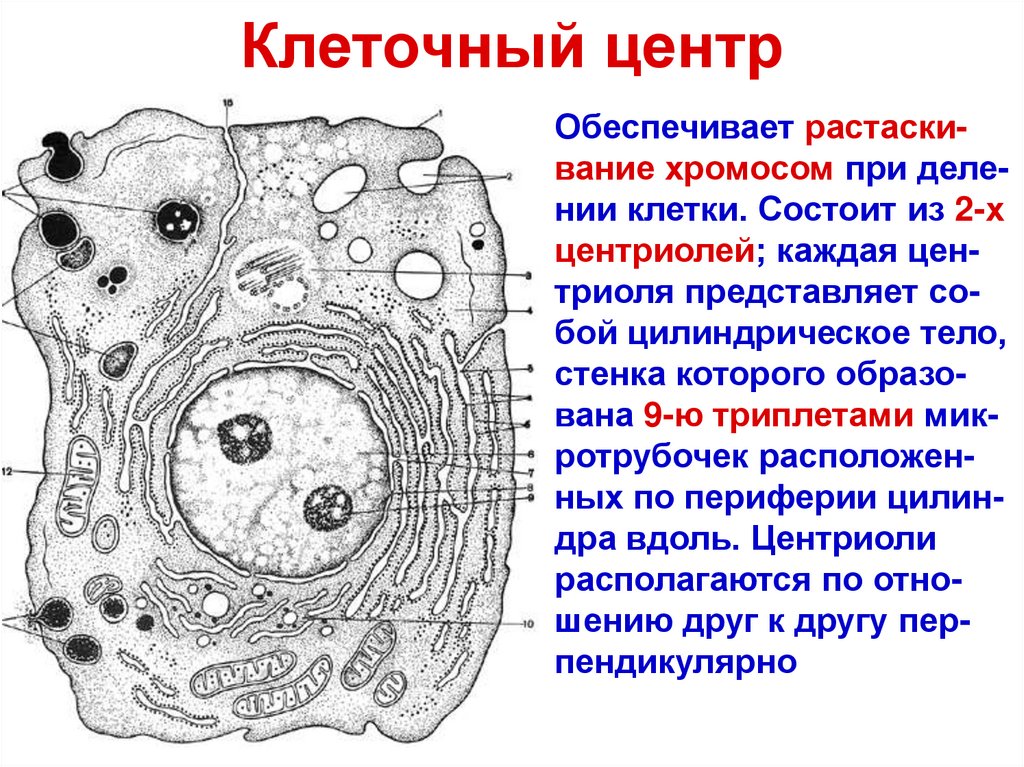
Уже на данном этапе развития клеточной биологии понятно, что центросома — ключевая структура в регуляторных процессах, и нарушение ее функций приводит к аномалиям клеточного цикла, дефектам в развитии живых тканей и организмов, к возникновению трофических и онкологических заболеваний. Однако бурное развитие новых экспериментальных подходов дает и, как мы надеемся, будет давать в будущем все новые возможности для исследования центросомы. Несмотря на большое количество описанных центросомальных белков, процесс изучения характера их взаимодействия друг с другом еще только начинается. На наших глазах мозаичность знаний о центросоме сменяется структурированностью, обнаруживаются функциональные связи между различными центросомальными белками. Мощный арсенал молекулярно-биологических и генетических методов в сочетании с детальным изучением морфологии позволяет накапливать огромное количество новых фактов, обработка и анализ которых становятся возможными благодаря современным информационным технологиям.
Работа выполнена при поддержке Российского фонда фундаментальный исследований. Проекты №95-04-12703, 00-04-48762, 00-15-99366, 03-04-48035, 06-04-49233.
Литература:
1. Boveri T. // Verhandl. Phys. Med. Ges. Wurzburg. 1895. V.XXIX. Цитируется по: [4].
2. Henneguy L.F. // Arch. Microsc. Morph. Exp. 1898. №1. P.481–496.
3. Lenhossék M.von. Uber Flimmerzellen. Kiel, 1898. V.12. P.106–128.
4. Wilson E.B. The Cell in Development and Inheritance. N.Y., 1900.
6. Selby C.C. // Exp. Cell Res. 1953. V.5. P.386–393.
7. Fawcett D.
 W., Porter K.R. // J. of Morphology. 1954. №94. P.221–282.
W., Porter K.R. // J. of Morphology. 1954. №94. P.221–282.8. Burgos M.H., Fawcett D.W. // J. Biophys. Biochem. Cytology. 1955. V.1. №4. P.287–300.
9. Bernhard W., Harven E.de // Comp. Rend. Acad. Sci. (Paris). 1956. V.242. P.288–290.
10. Yamada T. // Endocr. J. 1956. V.3. №3. P.203–210.
11. Afzelius B. // J. Biophysic. and Biochem. Cytol. 1959. V.5. №2. P.269–278.
13. Fulton C. Centrioles // Origin and continuity of cell organelles. N.Y., 1971. P.170–221.
14. Stubblefield E. // A collection of papers presented the 21 Annual Symposium on Fundamental Cancer Reseach, 1967. Baltimore, 1968. P.175–193.
15. Mogensen M. Microtubule organizing centers in polarized epithelial cells // Centrosomes in development and disease. Weinheim, 2004. P.299–320.
16. Jaffe A.B., Hall A. // Annu. Rev. Cell. Dev. Biol. 2005. №21.
17. Kaverina I., Krylyshkina O., Small J.V. // J. Cell. Biol. 1999. V.146. №5. P.1033–44.
18. Bershadsky A.D., Ballestrem C., Carramusa L. et al. // Eur. J. Cell. Biol. 2006. V.85. №3–4. P.165–73.
19. Uzbekov R., Prigent C. // FEBS Letters. 2007. P.
20. Alieva I.B., Vorobjev I.A. // Cell Biology International. 2003. V.28. Р.139–150.
Что такое клеточный центр? / Справочник :: Бингоскул
Клеточный центр: строение и функциидобавить в закладки удалить из закладок
Содержание:
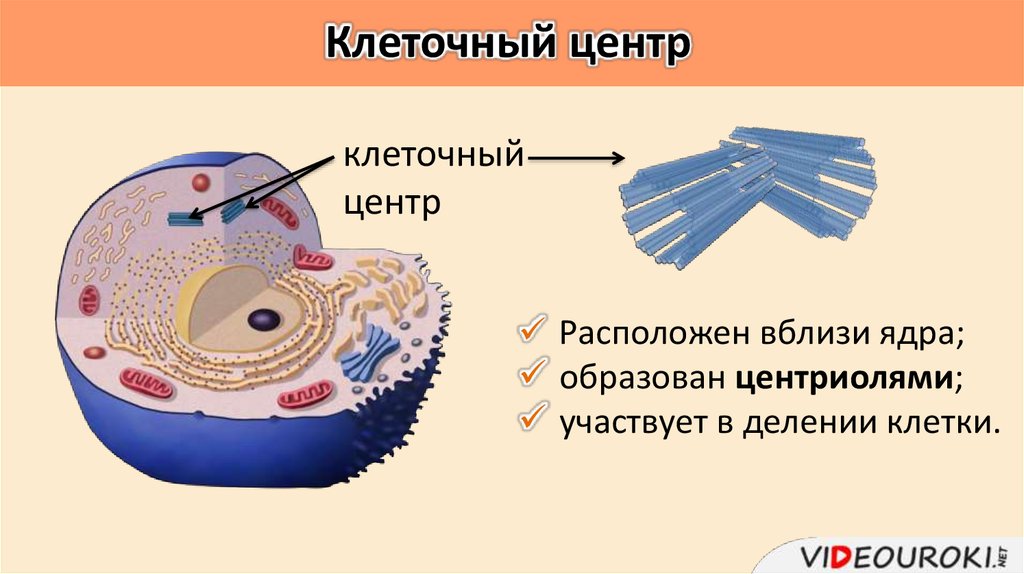
Среди органоидов в клетке присутствует немембранная органелла под названием клеточный центр (центросома). Он расположен рядом с ядром, за что и получил название. Это неприметный органоид, за которым «закреплены» определенные задачи.
Центросомы впервые заметили на веретенах деления во время митоза соматической клетки. Одновременно это увидели ученые-биологи В. Флеминг и О. Гертвиг и другие. Открытие произошло в 1870-х годах. Биологи обнаружили, что после деления центриоли не исчезают бесследно, а остаются в клетке.
Флеминг и О. Гертвиг и другие. Открытие произошло в 1870-х годах. Биологи обнаружили, что после деления центриоли не исчезают бесследно, а остаются в клетке.
Строение
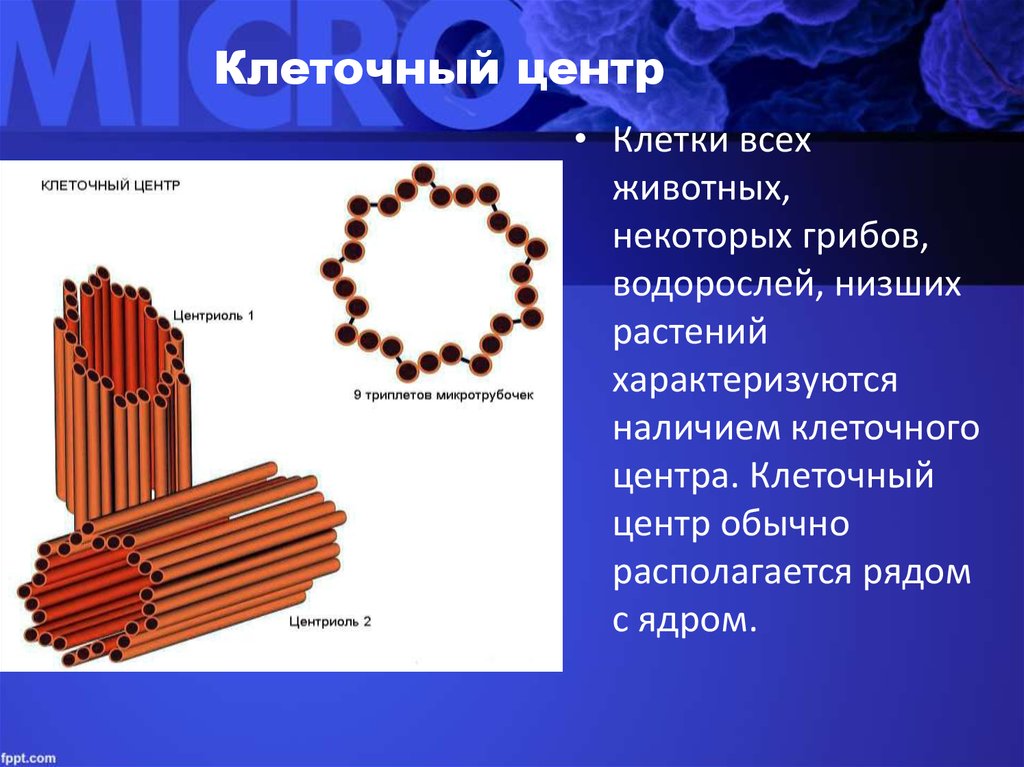
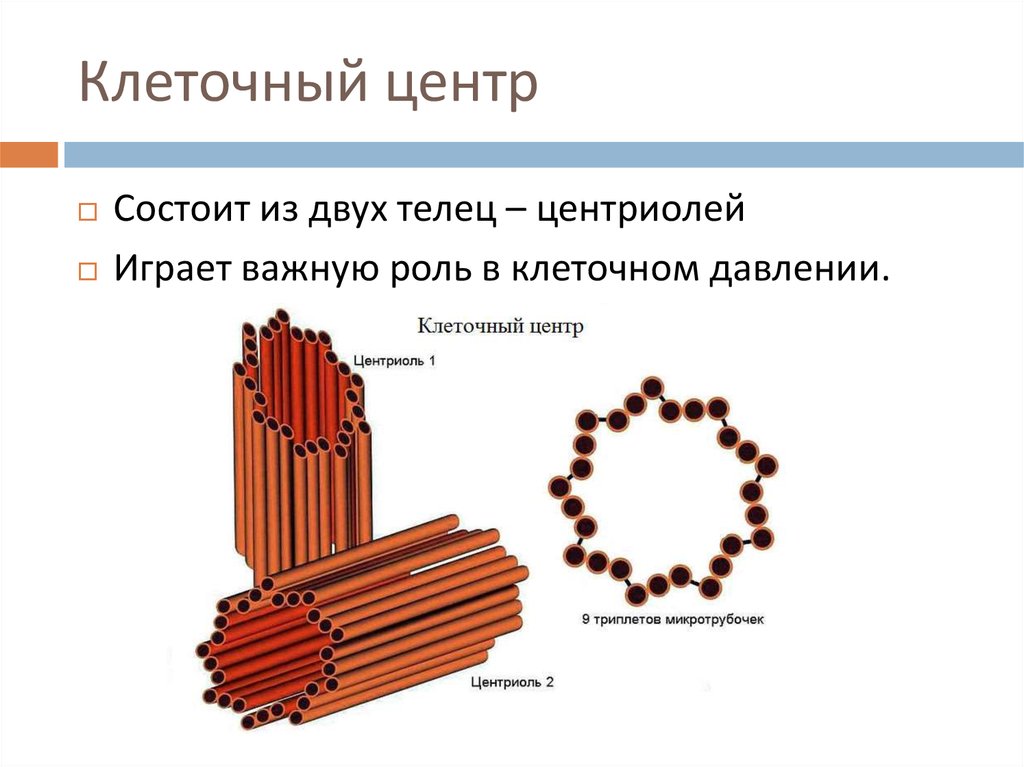
Плавающий в цитоплазме недалеко от ядра клеточный центр построен из двух центриолей или цилиндров (материнской и дочерней), находящихся под прямым углом по отношению друг к другу. Вместе центросомы образуют диплосому.
Центросома представляет собой трубочки длиной 0,1-3 мкм, которые найдены в клетках животных и низших растений. Строение отличает ряд особенностей:
- стенки построены из 9 комплексов микротрубочек;
- каждый комплекс – это триплет, состоящий из 3 микротрубочек;
- триплеты соединены между собой белковыми нитями;
- центриоли образованы белком – тубулином;
- каждая трубочка содержит внутри белковую ось и полость, заполненную однородной массой;
- центриоли окружены бесструктурным веществом – центриолярным матриксом, который участвует в создании микротрубочек.

Различают участок центриолей, находящихся в светлой зоне. Это центросфера, которая строится из фибриллярных белков. В светлой зоне расположены микротрубочки и микрофибриллы, которые соединяют клеточный центр с ядерной оболочкой.
На заметку: В клетках эукариот (ядерных) материнская и дочерняя центриоли расположены перпендикулярно. Для клеток простейших и нематод подобное строение не характерно. У высших растений и грибов центриолей нет.
Рис. 2. Центриоль: строение
Функции
Роль клеточного центра в деятельности клетки важна. Это органоид, который
- Образует органы движения простейших (жгутики), за счет которых одноклеточные простейшие перемещаются в водной среде.
- Формирует реснички на поверхности клеток эукариот, чтобы повысить чувствительность к внешним раздражителям (например, рецепция на поверхности кожи).
- Участвует в синтезе микротрубочек, расположенных в цитоплазме или являющихся компонентом опорно-двигательного аппарата.

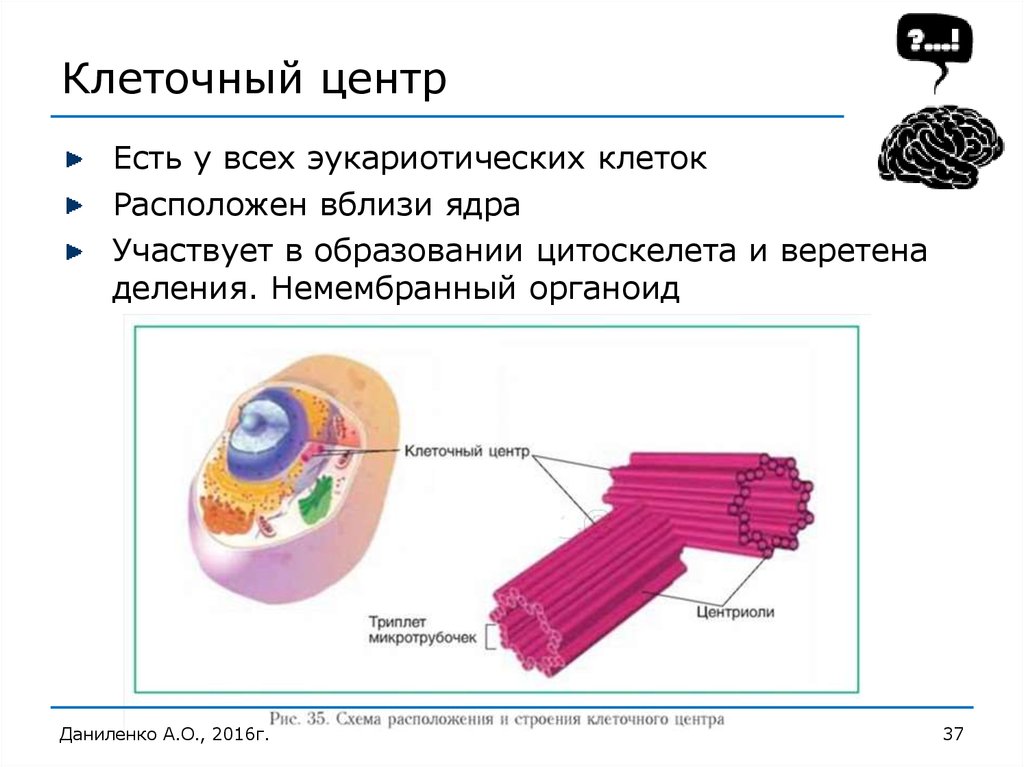
- Создает нити веретена деления в ходе непрямого, митотического деления клеток. При этом материнская и дочерняя хромосомы удваиваются и расходятся к полюсам клетки. Это дает возможность равномерно распределять генетическую информацию между дочерними клетками.
- Относится к структурам, которые отвечают за создание и распределение микротрубочек в клетке.
Рис. 3. Создание нитей веретена деления в процессе митоза
На заметку: Нити веретена деления обеспечивают расхождение гаплоидного (одинарного) набора хромосом к полюсам клетки. В аномальных, видоизмененных (раковых) клетках аномальное количество центриолей. Это говорит о том, что количество делений неограниченно. Идет разрастание клеток, претерпевших мутации.
Назначение клеточного центра, это создание микротрубочек, которые прикрепляются к центромерам (перетяжкам хромосом) и способность при сокращении оттягивать к полюсам хроматиды.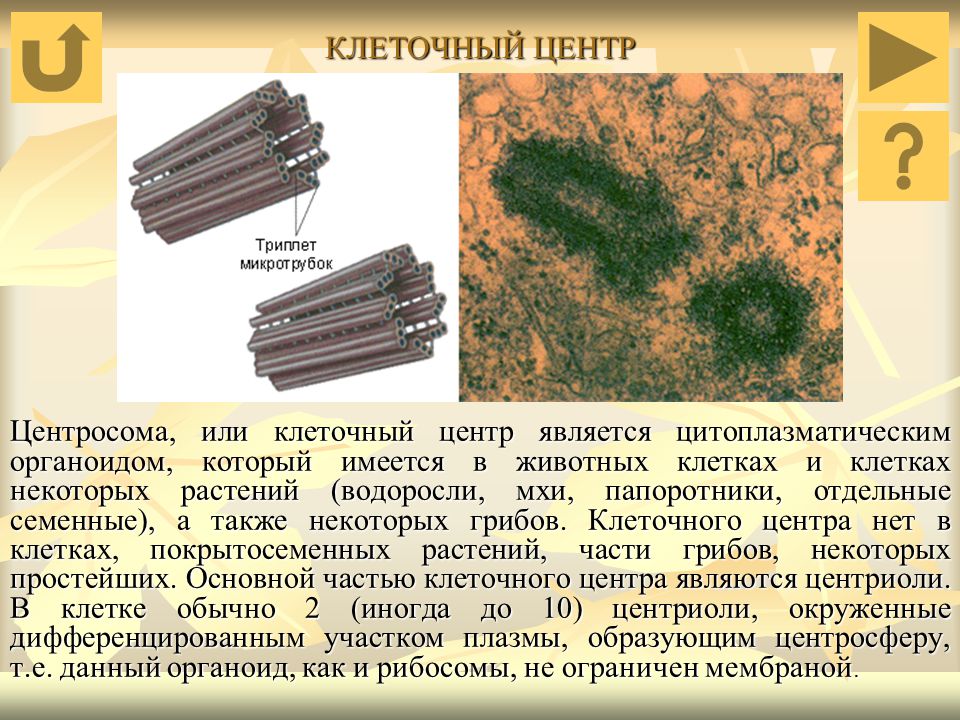 В дальнейшем хроматиды удваиваются, и новая клетка получает такой же набор хромосом, как материнская. Для клеток человека – это 46 хромосом.
В дальнейшем хроматиды удваиваются, и новая клетка получает такой же набор хромосом, как материнская. Для клеток человека – это 46 хромосом.
Источники изображений:
- Рис. 1. — en.ppt-online.org/176052
- Рис. 2. — www.winstein.org/publ/39-1-0-4820
- Рис. 3. — en.ppt-online.org/229124
Поделитесь в социальных сетях:
15 февраля 2021, 09:07
Could not load xLike class!
Cell Imaging Core
Фото Роберта А. Лисака
Джейкоб Гонсалес, Хайфан Лин и Том Ардито просматривают тестикулярные стволовые клетки плодовой мухи
Стоимость 23 финансового года составляет 16 долларов в час за конфокальный эндоскоп SP5 и 25 долларов за инвертированный флуоресцентный прибор DMI6000. объем.
За последнее десятилетие, с появлением новых мощных микроскопических систем и широкого спектра специальных флуоресцентных зондов, лазерная сканирующая конфокальная микроскопия стала незаменимым инструментом в клеточной биологии.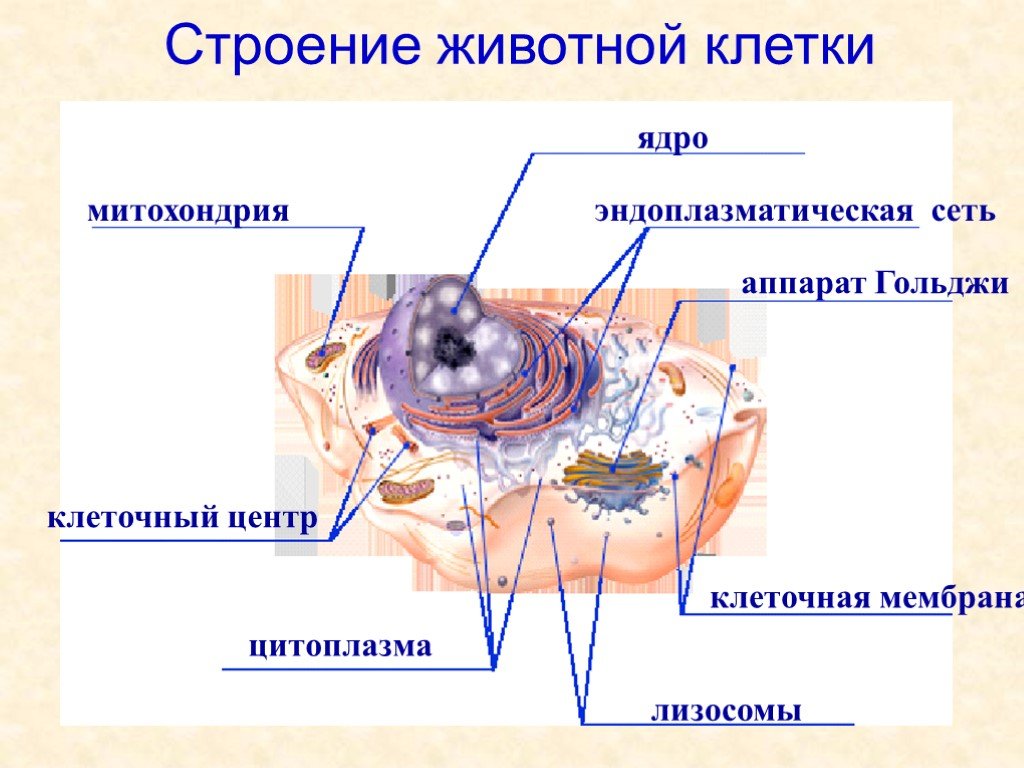 Это особенно верно в отношении стволовых клеток, где теперь можно визуализировать экспрессию и расположение ключевых молекул, регулирующих клеточную судьбу, и отслеживать дифференцировку клеток с очень высоким разрешением. По этой причине YSCC создал центр визуализации клеток. Научным руководителем центра клеточной визуализации YSCC является доктор Майкл Натансон, директор ядра конфокальной микроскопии Йельского центра клеточной и молекулярной визуализации с момента его основания в 1989. Г-н Томас Ардито руководит центром клеточной визуализации, и г-н Ардито на постоянной основе оказывает научную, техническую и административную помощь.
Это особенно верно в отношении стволовых клеток, где теперь можно визуализировать экспрессию и расположение ключевых молекул, регулирующих клеточную судьбу, и отслеживать дифференцировку клеток с очень высоким разрешением. По этой причине YSCC создал центр визуализации клеток. Научным руководителем центра клеточной визуализации YSCC является доктор Майкл Натансон, директор ядра конфокальной микроскопии Йельского центра клеточной и молекулярной визуализации с момента его основания в 1989. Г-н Томас Ардито руководит центром клеточной визуализации, и г-н Ардито на постоянной основе оказывает научную, техническую и административную помощь.
Центр визуализации клеток оснащен спектральным конфокальным микроскопом Leica TCS SP5, 405UV, который расположен в комнате 333 здания Amistad. В обычных конфокальных микроскопах используются дихроичные зеркала и фильтры для выбора лазерной линии (линий) для возбуждения и полосы излучения для используемых флуорофоров. Это означает, что для каждого отдельного флуорофора или комбинации флуорофоров необходимо вставлять отдельный набор фильтров.
- Акустооптический фильтр (AOTF) заменяет фильтр возбуждения.
 В типичной операции возбуждение осуществляется двумя лазерами. Аргоновый лазер имеет 4 линии синего цвета: 458, 476, 488, 514 нм, из которых линия 488 нм используется для возбуждения большинства флюоров. He/Ne лазер дает линии красного (633 нм) и зеленого (543 нм) цветов. AOTF может выбрать любую из этих линий или любую комбинацию из шести для одновременного возбуждения разных флуорофоров. AOTF может переключаться между спектральными линиями очень быстро, намного быстрее, чем скорость сканирования, что позволяет выполнять наложение сканирования с двумя длинами волн возбуждения. Также очень важно, что AOTF используется для ослабления лазера, чтобы свести к минимуму фотоповреждение во время визуализации, или открывается на полную мощность для фотообесцвечивания.
В типичной операции возбуждение осуществляется двумя лазерами. Аргоновый лазер имеет 4 линии синего цвета: 458, 476, 488, 514 нм, из которых линия 488 нм используется для возбуждения большинства флюоров. He/Ne лазер дает линии красного (633 нм) и зеленого (543 нм) цветов. AOTF может выбрать любую из этих линий или любую комбинацию из шести для одновременного возбуждения разных флуорофоров. AOTF может переключаться между спектральными линиями очень быстро, намного быстрее, чем скорость сканирования, что позволяет выполнять наложение сканирования с двумя длинами волн возбуждения. Также очень важно, что AOTF используется для ослабления лазера, чтобы свести к минимуму фотоповреждение во время визуализации, или открывается на полную мощность для фотообесцвечивания. - Акустооптический светоделитель (AOBS) заменяет дихроичное зеркало. Опять же, AOBS может быть настроен пользователем для отражения и пропускания различных длин волн и быстрого переключения между ними по желанию. Можно одновременно выбрать три или более линий возбуждения и передать излучение от всех из них в призменную систему детектирования.

- Призменная спектрофотометрическая система обнаружения Leica SP представляет собой мощную замену дихроичным эмиссионным фильтрам. Вместо использования фильтров для разделения излучения используется призма. Эмиссионная флуоресценция образца проходит через точечное отверстие, а затем через призму, которая разделяет ее на спектральные составляющие. Одновременно можно измерять до трех отдельных спектральных составляющих. Возможность просто выбрать нужную полосу излучения, которую нужно собрать, является огромным преимуществом по сравнению с предыдущими конфокальными линзами, которые для этого используют наборы дихроичных фильтров. Следует отметить, однако, что система регистрации ограничена сбором полос спектра, определяемого щелями, и не всегда будет возможно разделить спектры излучения, которые перекрываются.
дополнительный заголовок
Микроскоп также оснащен камерой для культивирования клеток с регулируемой средой, необходимой для продолжительной визуализации живых клеток в физиологических условиях.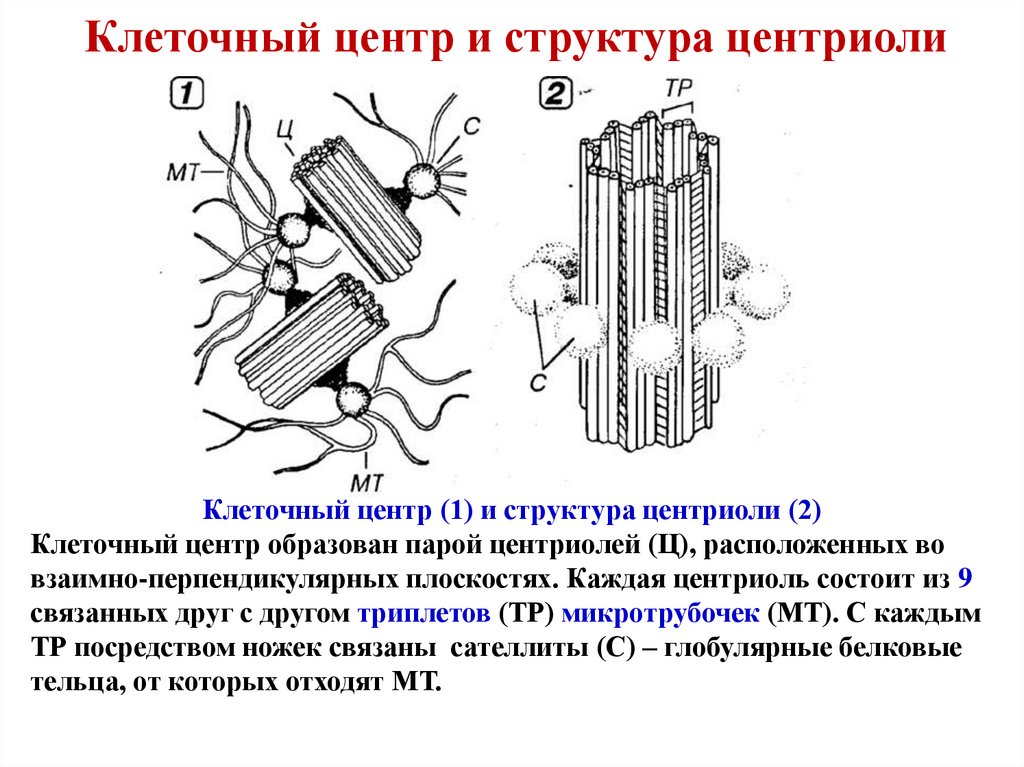 Это еще одна редкая особенность, которая принесет непосредственную пользу исследователям стволовых клеток.
Это еще одна редкая особенность, которая принесет непосредственную пользу исследователям стволовых клеток.
YSCC также имеет инвертированный флуоресцентный микроскоп Leica DMI6000 B с адаптивным управлением фокусировкой для фазового контраста, ДИК и эпифлуоресценции. Адаптивная система управления фокусом обеспечивает автоматическую фокусировку для визуализации живых клеток во время длительного культивирования, чтобы микроскоп мог оставаться в фокусе и не дрейфовал из-за изменений в клеточной культуре или комнатной температуре. Система программного обеспечения цифровой обработки изображений Leica AF6000 позволяет выполнять микроскопию в режиме реального времени и включает в себя компьютер и два монитора, а также цифровую камеру Cool Snap HQ2. Для поддержания живых клеток в течение долгого времени микроскоп оснащен присоединяемым инкубатором Tokai Hit Stage Top с контролем CO2 и температуры. Этот микроскоп Leica использует ту же базу микроскопа (DMI6000), что и наш конфокальный объектив Leica SP-5, а также то же программное обеспечение Leica Application Suite, что и конфокальный микроскоп, так что пользователям нужно только изучить одну программную платформу для использования на любом микроскопе.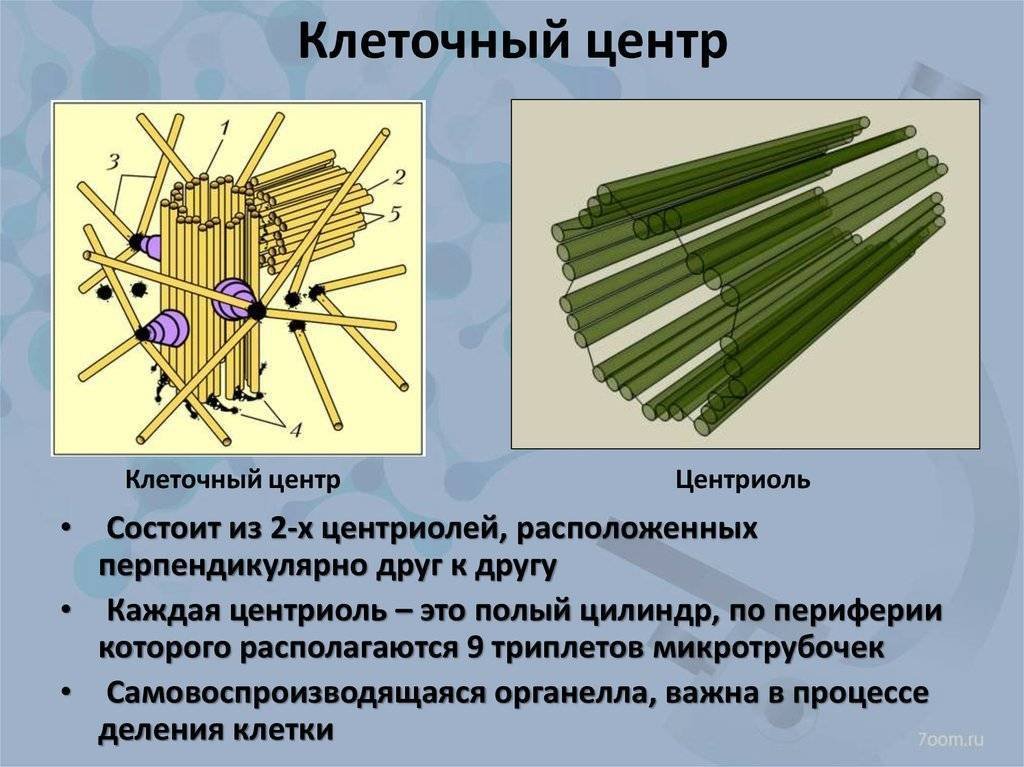 .
.
Центр стволовых клеток недавно приобрел рабочую станцию для обработки изображений, которая способна выполнять расширенную деконволюцию и/или трехмерную визуализацию изображений, полученных с помощью нашего конфокального микроскопа SP-5 или широкопольного инвертированного микроскопа DMI6000B.
Доступ: The Core стремится предоставить легкий доступ всем исследователям стволовых клеток в штате Коннектикут. Услуги предоставляются по принципу «первым пришел, первым обслужен». Если количество запросов превышает возможности ядра, запросы рассматриваются и приоритизируются г-ном Ардито. К пользователям применяются следующие принципы приоритизации: (1) исследования, финансируемые штатом Коннектикут, получают наивысший приоритет; (2) среди них исследования линий, не одобренных на федеральном уровне, будут иметь более высокий приоритет; и (3) среди поддерживаемых КТ исследований неутвержденных линий, пользователи, впервые использующие препарат, будут иметь наивысший приоритет. Цель YSCC — предоставить всем, кто работает над hESC, доступ к ядру. Доступ контролируется системой сканирования карт, и г-н Ардито разрешает доступ пользователям.
Цель YSCC — предоставить всем, кто работает над hESC, доступ к ядру. Доступ контролируется системой сканирования карт, и г-н Ардито разрешает доступ пользователям.
Планирование и оплата: Система бронирования через Интернет используется для того, чтобы исследователи могли планировать свое время в системе. Пользователи, заинтересованные в планировании времени в системе, должны получить доступ от г-на Ардито. Плата за использование рабочих станций и за обучение не взимается.
Научный руководитель:
Майкл Натансон, профессор
Телефон: 785-7312
Технический надзор:
Томас Ардито, научный сотрудник
Телефон: 737-1869
Центр серповидно-клеточной анемии – Methodist Le Bonheur Healthcare
Наш Центр серповидно-клеточной анемии – это профилактическая амбулаторная клиника и специальное отделение экстренной инфузии для пациентов с серповидно-клеточной анемией.
Прямо здесь, в Мемфисе, у нас одна из самых больших популяций взрослых пациентов с серповидно-клеточной анемией в стране. Для этих пациентов повседневная жизнь часто прерывается болью, которая может длиться несколько недель, угрожая их семейной жизни, карьере, образованию и социальной жизни.
Для этих пациентов повседневная жизнь часто прерывается болью, которая может длиться несколько недель, угрожая их семейной жизни, карьере, образованию и социальной жизни.
Именно для этих пациентов мы стремимся предоставлять инновационную комплексную помощь и разрабатывать новые методы лечения посредством исследований на местах. Мы стремимся помочь улучшить здоровье и качество жизни пациентов с серповидно-клеточной анемией на Среднем Юге.
Ваша поддержка поможет улучшить здоровье и качество жизни тех членов нашего сообщества, которые страдают от серповидно-клеточной анемии.
Дайте сейчас
Услуги, которые мы предоставляем
- Пожизненный уход за взрослыми 18 лет и старше с серповидноклеточной анемией
- Врач по вызову для ответов на вопросы в нерабочее время и в выходные дни
- Комплексная профилактическая помощь и индивидуальные планы лечения
- Быстрый доступ к инфузионным службам для кризисного управления
- Обучение пациентов
- Переход от педиатрической к взрослой помощи для пациентов в возрасте 18-25 лет
Наш центр предлагает
- Поликлиника профилактическая
- Инфузионный центр с удобными креслами с откидной спинкой, теплыми одеялами и закусками
- Штатный социальный работник для помощи в решении других проблем, которые могут повлиять на ваше общее самочувствие
- Транспортная помощь, при необходимости
- Удобное расположение
Мы можем вам помочь
- Доступ к профилактической медицине и образованию
- Быстрый доступ к нашему инфузионному центру для кризисного управления
- Переход от педиатрической ко взрослой помощи (для пациентов в возрасте от 18 до 25 лет)
- Избегайте длительного ожидания в отделениях неотложной помощи
- Избегайте госпитализации
- Возвращайся скорее домой
Исследования
Наш центр в сотрудничестве с Детской исследовательской больницей Св.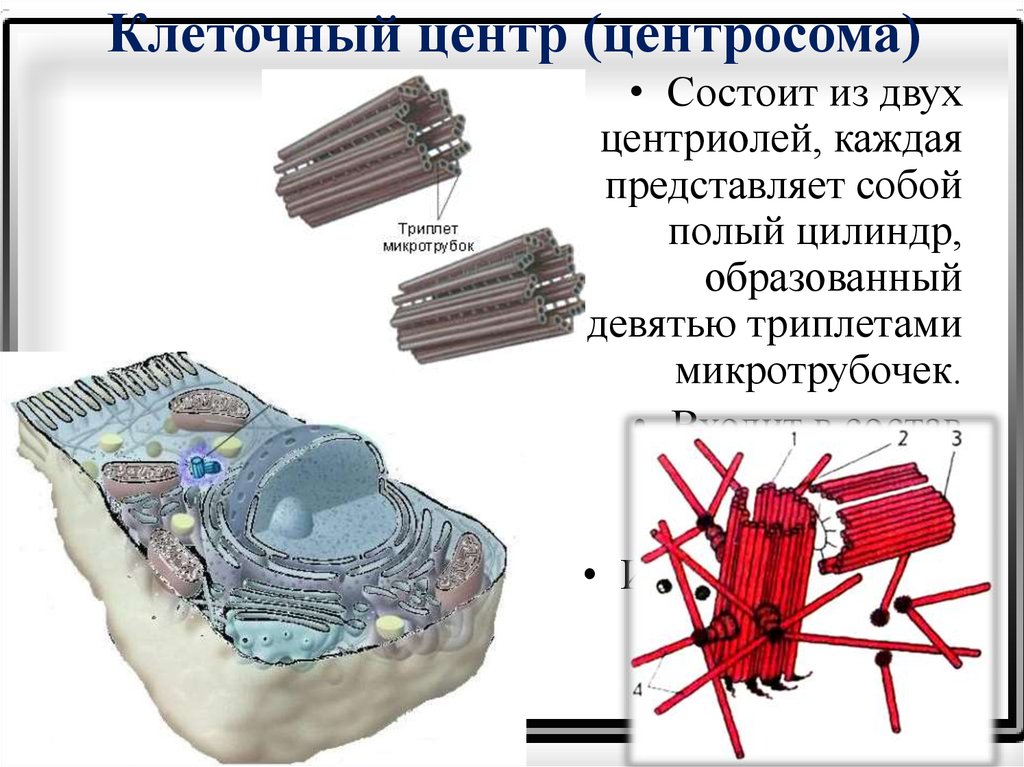

 В типичной операции возбуждение осуществляется двумя лазерами. Аргоновый лазер имеет 4 линии синего цвета: 458, 476, 488, 514 нм, из которых линия 488 нм используется для возбуждения большинства флюоров. He/Ne лазер дает линии красного (633 нм) и зеленого (543 нм) цветов. AOTF может выбрать любую из этих линий или любую комбинацию из шести для одновременного возбуждения разных флуорофоров. AOTF может переключаться между спектральными линиями очень быстро, намного быстрее, чем скорость сканирования, что позволяет выполнять наложение сканирования с двумя длинами волн возбуждения. Также очень важно, что AOTF используется для ослабления лазера, чтобы свести к минимуму фотоповреждение во время визуализации, или открывается на полную мощность для фотообесцвечивания.
В типичной операции возбуждение осуществляется двумя лазерами. Аргоновый лазер имеет 4 линии синего цвета: 458, 476, 488, 514 нм, из которых линия 488 нм используется для возбуждения большинства флюоров. He/Ne лазер дает линии красного (633 нм) и зеленого (543 нм) цветов. AOTF может выбрать любую из этих линий или любую комбинацию из шести для одновременного возбуждения разных флуорофоров. AOTF может переключаться между спектральными линиями очень быстро, намного быстрее, чем скорость сканирования, что позволяет выполнять наложение сканирования с двумя длинами волн возбуждения. Также очень важно, что AOTF используется для ослабления лазера, чтобы свести к минимуму фотоповреждение во время визуализации, или открывается на полную мощность для фотообесцвечивания.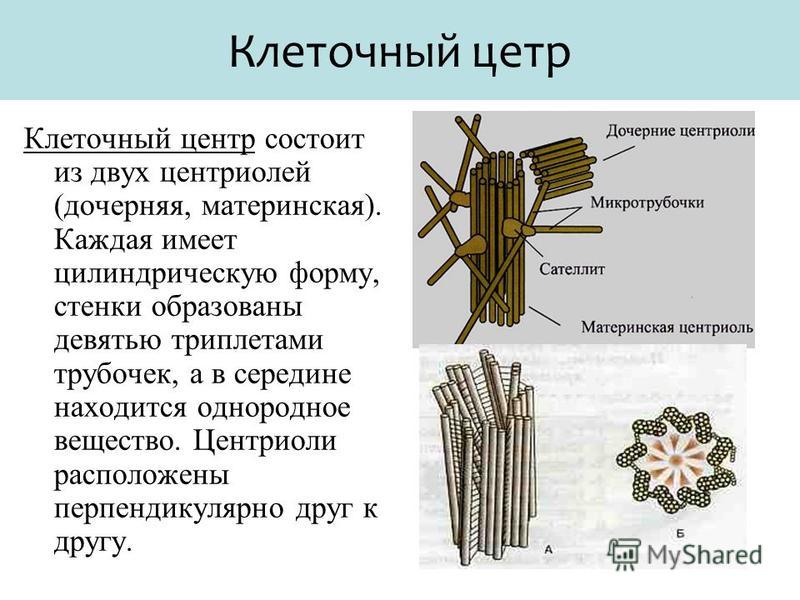
Leave A Comment