8 класс. Химия. Описание элемента по положению в Периодической системе — Описание элемента по положению в Периодической системе
Комментарии преподавателяОписание химического элемента по положению в Периодической системе
Для того чтобы определить состав ядра и распределение электронов по слоям в атоме химического элемента, нужно знать порядковый номер элемента, номер периода, номер группы и подгруппу в Периодической системе.
Рассмотрим конкретный пример. Определим строение атома калия. Порядковый номер калия равен 19. Порядковый номер определяет число протонов в ядре и общее число электронов в атоме. Число нейтронов в конкретном атоме можно определить по разнице между массовым числом и числом протонов. Для изотопа калия с массовым числом 39 число протонов равно 19, число нейтронов равно 39-19=20, число электронов – 19.
По номеру периода можно определить число электронных слоев в атоме. Калий – элемент 4 периода, значит, все его 19 электронов расположены на 4-х электронных слоях. При этом нужно помнить, что на 1-м слое может максимально находиться не более 2-х электронов, на втором – не более 8. Число электронов на последнем слое равно номеру группы (для элементов главных подгрупп). У калия всего 1 внешний электрон, он находится на 4-м слое. Оставшиеся электроны – на третьем слое. Таким образом, в атоме калия электроны распределяются по слоям в следующем количестве: 2, 8, 8, 1 (Рис. 1).
При этом нужно помнить, что на 1-м слое может максимально находиться не более 2-х электронов, на втором – не более 8. Число электронов на последнем слое равно номеру группы (для элементов главных подгрупп). У калия всего 1 внешний электрон, он находится на 4-м слое. Оставшиеся электроны – на третьем слое. Таким образом, в атоме калия электроны распределяются по слоям в следующем количестве: 2, 8, 8, 1 (Рис. 1).
Рис. 1. Схема строения атома калия
Номер группы определяет не только число внешних электронов, но высшую валентность элемента. Численное значение низшей валентности для элементов V-VII групп равно 8 — номер группы. Итак, высшая и единственная валентность калия равна I.
Свойства простого вещества, образованного элементом
По положению элемента в периодической системе можно определить его принадлежность к металлам или неметаллам, а также свойства образованных им высших оксида и гидроксида. Элементы главных подгрупп, лежащие выше диагонали Be-At, относятся к неметаллам. Остальные элементы – металлы. При этом металлические свойства слева направо по периоду ослабевают, а сверху вниз по группе усиливаются.
Остальные элементы – металлы. При этом металлические свойства слева направо по периоду ослабевают, а сверху вниз по группе усиливаются.
Таким образом, калий – металл. Его металлические свойства выражены сильнее, чем у натрия и кальция.
Если элемент образует простое вещество-металл, то его высший оксид и гидроксид будут основными. Если неметалл – то кислотными. Если переходный металл – то амфотерными (Рис. 2).
Рис. 2. Связь свойств элементов и образованных ими соединений
Так как калий – металл, его высший оксид и гидроксид будут проявлять основные свойства.
Составим формулы высшего оксида и гидроксида калия. Высшая валентность калия равна I, значит, формула высшего оксида – К2О, его характер – основный.
Основному оксиду соответствует основание – КОН.
Можно подтвердить основный характер оксида и гидроксида калия, записав уравнения реакций этих веществ с кислотой:
K2O + 2HCl = 2KCl + h3O
KOH + HCl = KCl + h3O
Элементы-неметаллы могут образовать летучие водородные соединения. Чтобы составить формулу летучего водородного соединения неметалла, нужно знать низшую валентность последнего. Например, летучее водородное соединение азота – Nh4 (низшая валентность азота равна III). Металлы летучих водородных соединений не образуют.
Чтобы составить формулу летучего водородного соединения неметалла, нужно знать низшую валентность последнего. Например, летучее водородное соединение азота – Nh4 (низшая валентность азота равна III). Металлы летучих водородных соединений не образуют.
Если сравнивать калий с соседними по подгруппе и периоду элементами, то можно сказать, что основные свойства его оксида и гидроксида будут ярче выражены, чем у оксидов и гидроксидов натрия и кальция. Рубидий – более активный металл, чем калий. Значит, основные свойства его оксида и гидроксида будут выражены сильнее, чем у оксида и гидроксида калия.
Характеристика элемента по плану
Охарактеризуем по плану химический элемент серу, учитывая ее положение в Периодической системе элементов Д.И. Менделеева:
1. Химический знак – S («Эс»)
2. Порядковый номер – 16, VI группа, А подгруппа, 3 период
3. Строение атома:
4. Свойства простого вещества: S – неметалл
5. Высшая и низшая валентность: VI и II
6. Высший оксид: SO3 (кислотный)
Высший оксид: SO3 (кислотный)
Высший гидроксид: h3SO4 (кислота)
7. Формула летучего водородного соединения: h3S
Источники
конспект http://interneturok.ru/ru/school/chemistry/8-klass/undefined/opisanie-elementa-po-polozheniyu-v-periodicheskoy-sisteme?seconds=0
http://www.youtube.com/watch?v=06FxSSR50tM
ФайлыНет дополнительных материалов для этого занятия.
Гидроксид кремния – формула
4.5
Средняя оценка: 4.5
Всего получено оценок: 278.
4.5
Средняя оценка: 4.5
Всего получено оценок: 278.
Гидратированный окисел кремния условно называют гидроксидом кремния. Это неустойчивое вещество, проявляющее слабые свойства кислот. О свойствах гидроксида кремния и его реакциях с другими элементами читайте в нашей статье.
Формула
Высшего гидроксида кремния в привычном понимании не существует. Аморфный кремний в реакции с водяным паром при температуре 400-500°C образует диоксид кремния и водород:
Аморфный кремний в реакции с водяным паром при температуре 400-500°C образует диоксид кремния и водород:
Si(аморфн.) + 2H2O(пар) → SiO2 + 2H2.
Рис. 1. Диоксид кремния.Диоксид кремния является слабым кислотным оксидом. При присоединении водорода оксид кремния (IV) способен образовывать кремниевые кислоты. Поэтому правильнее записать формулу гидроксида кремния как nSiO
Кремниевые кислоты
В зависимости от количества атомов водорода, кремния и кислорода выделяют несколько кремниевых кислот:
- метакремниевая – H2SiO3;
- ортокремниевая – H4SiO4;
- дикремниевые – H2Si2O5 и H10Si2O9;
- пирокремниевая – H6Si2O7;
- поликремниевые – nSiO2∙mH2O.
Соли кремниевых кислот называются силикатами.
Получить кремниевые кислоты непосредственным взаимодействием оксида кремния (IV) с водой невозможно, т.
SiO2 + 2Н2 → Si + 2H2O.
Поэтому в лабораториях кислоты получают двумя способами:
- воздействием сильных кислот на силикаты натрия или калия:
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl;
- гидролизом силанов:
SiH2Cl2 + 3H2O → H2SiO3↓ + 2HCl + 2H2.
Кремниевые кислоты самопроизвольно разлагаются на диоксид кремния и воду: H
Свойства
Кремниевые кислоты – слабые кислоты (слабее угольной кислоты), не имеющие кислого вкуса и плохо растворимые в воде. Кислоты кремния значительно отличаются от остальных органических кислот:
- при взаимодействии с водой образуют коллоидный раствор;
- не диссоциируют;
- не меняют окраску индикатора.

Кремниевые кислоты способны растворятся в расплавах и растворах щелочей с образованием силикатов:
H2SiO3 + 2KOH → K2SiO3 + 2H2O.
Как и все соединения, содержащие кремний, реагируют с плавиковой кислотой:
H2SiO3 + 6HF → H2SiF6 + 3H2O → SiF4 + 2HF + 3H2O.
Кремниевые кислоты используются в производстве керамики и керамических покрытий. Они содержатся в фотоматериалах, применяются для получения стекла, силикагеля, фильтров.
Силикаты
Соли кремниевой кислоты не растворимы в воде. Исключение составляют силикаты натрия и калия, которые называются жидким стеклом и входят в состав силикатного клея.
Рис. 3. Жидкое стекло.Na2O·CaO·6SiO2.
Стекло получают при сплавлении соды, известняка, песка:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2.
Структурной единицей силикатов является SiO4. Кремний легко замещается атомами алюминия. В результате образуются алюмосиликаты.
Силикаты широко распространены в природе. Некоторые из них (топаз, гранат, изумруд) используют в ювелирном деле.
Что мы узнали?
Гидроксидом кремния называются кремниевые кислоты. Это слабокислые соединения, легко разрушающиеся на диоксид кремния и воду. Кислоты кремния можно получить косвенно при реакции силикатов с сильными кислотами или при гидролизе силанов. Кремниевые кислоты не проявляют обычные свойства кислот: не меняют цвет индикатора, не реагируют с водой, не диссоциируют. Взаимодействуют только со щелочами и плавиковой кислотой. Используются при производстве фотоматериалов, керамики, силикагеля.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
5/5
Оценка доклада
4.
Средняя оценка: 4.5
Всего получено оценок: 278.
А какая ваша оценка?
Кислотно-основные характеристики оксидов и гидроксидов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 68247
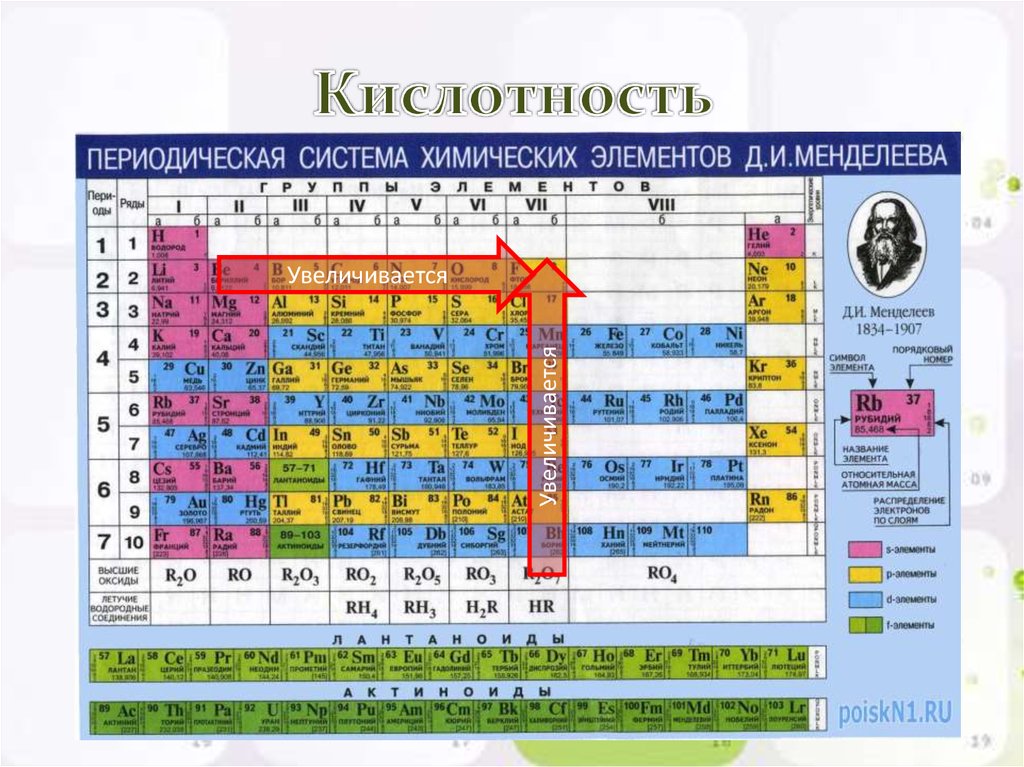
Слева направо по таблице Менделеева, кислотно-щелочной характер оксидов и гидроксидов переходят от основных к кислым.
- Увеличение заряда аниона увеличивает производство основных растворов.
- По мере увеличения электроотрицательности производство ионных катионов увеличивается, потому что элементы в большей степени способны принимать катион.
- По мере увеличения энергии ионизации увеличивается кислотность.

Оксиды металлов:
— Ионная связь: нет распределения электронной волновой функции
— Ионные оксиды обычно являются основными (элемент действует как основание при реакции с Н3О) 9(3+) (водный)
—(OH-)—> [Al(OH)4]-(водн.)
Оксиды неметаллов
— Ковалентная связь: почти полное распределение электронной волновой функции
— Ковалентные оксиды обычно кислые (элементы действуют как кислота при взаимодействии с h3O)
SO3 + h3O(ж) -> h3SO4(водн.) -> H+ + HSO4-
A. Оксид A Гидроксид
Ионные гидриды
Типы гидридов— Ионная связь: нет распределения волновой функции электронов
— Основные вещества Бренстеда, потому что они будут реагировать с протоном
— Основной Льюис, поскольку они могут быть лигандами
Cah3 + 2h3O -> 2h3 + Ca(OH)2
H- H+ h3
— В этом случае Cah3 является основным, потому что он реагирует с водой (в данном случае с кислотой) с образованием многих гидридов путем восстановления протона.
Ковалентные гидриды
— Ковалентная связь: почти полное распределение волновой функции электрона
HF + h3O -> F- + h4O+ ….также может быть записано как HF(aq) <--> H+(aq) + F-(водн.)
H+ H+ H+
— HF является слабой кислотой, которая является кислотой бронстеда, потому что она теряет протон. Следовательно, HF — это слабая кислота, где вода действует как тихая вода, а F- — это слабое сопряженное основание.
Участники
- Шаблон:ContribChem230
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- кислота
- база
- Ковалентные гидриды
- гидроксиды
- ионная связь
- Оксиды металлов
- Оксиды неметаллов
- Оксиды
- Оксиды полуметаллов
Шкала рН | Биология для специальностей I
Продемонстрировать знакомство со шкалой pH
В этом выпуске мы узнаем о шкале pH и важности кислот и оснований.
Цели обучения
- Определение характеристик кислот
- Определение характеристик баз
- Дайте определение «буферам» и обсудите их роль в биологии человека
Кислоты и основания
pH раствора указывает на его кислотность или щелочность. {-}\влево(aq\вправо)[/латекс]
{-}\влево(aq\вправо)[/латекс]
Лакмусовая бумага или рН-бумага — это фильтровальная бумага, обработанная натуральным водорастворимым красителем, поэтому ее можно использовать в качестве индикатора рН, чтобы проверить, сколько кислоты (кислотность) или основания (щелочность) существует в растворе. Возможно, вы даже использовали некоторые из них, чтобы проверить, правильно ли очищается вода в бассейне. В обоих случаях тест pH измеряет концентрацию ионов водорода в данном растворе.
Ионы водорода спонтанно образуются в чистой воде путем диссоциации (ионизации) небольшого процента молекул воды на равное количество водорода (H + ) ионов и гидроксид (ОН – ) ионов. В то время как ионы гидроксида удерживаются в растворе за счет водородных связей с другими молекулами воды, ионы водорода, состоящие из голых протонов, немедленно притягиваются к неионизированным молекулам воды, образуя ионы гидроксония (H 3 O + ).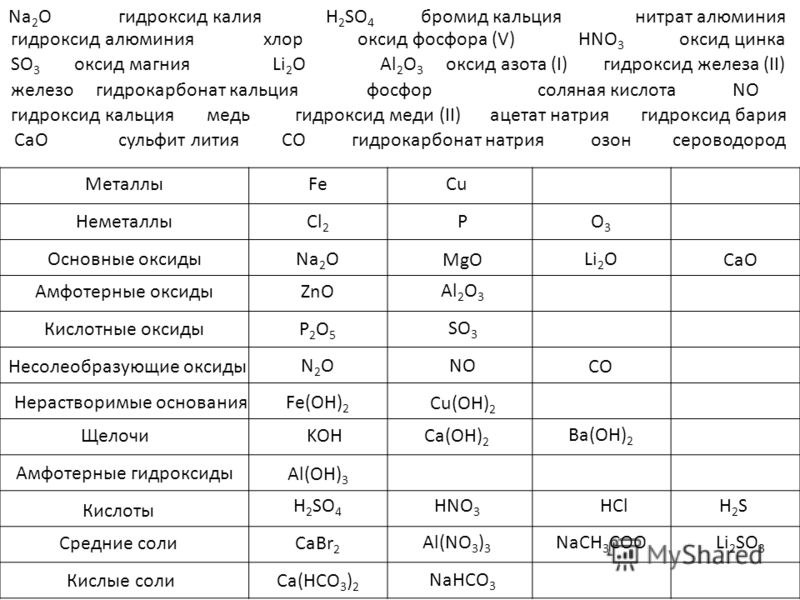 Тем не менее, условно ученые относятся к ионам водорода и их концентрации так, как если бы они находились в этом состоянии в жидкой воде в свободном состоянии.
Тем не менее, условно ученые относятся к ионам водорода и их концентрации так, как если бы они находились в этом состоянии в жидкой воде в свободном состоянии.
Концентрация ионов водорода, диссоциирующих из чистой воды, составляет 1 × 10 –7 молей H + ионов на литр воды. Моли (моль) — это способ выразить количество вещества (которым могут быть атомы, молекулы, ионы и т. д.), при этом один моль равен 6,02 х 1023 частиц вещества. Следовательно, 1 моль воды равен 6,02 х 10 23 молекул воды. pH рассчитывается как отрицательная величина логарифма по основанию 10 этой концентрации. Log10 1 × 10 –7 равен –7,0, и отрицательное значение этого числа (обозначаемое буквой «p» в слове «pH») дает значение pH 7,0, которое также известно как нейтральное значение pH. pH внутри человеческих клеток и крови являются примерами двух областей тела, где поддерживается почти нейтральный pH.
Ненейтральные показания рН возникают в результате растворения кислот или оснований в воде. Используя отрицательный логарифм для получения положительных целых чисел, высокие концентрации ионов водорода дают низкое число pH, тогда как низкие уровни ионов водорода приводят к высокому pH. кислота представляет собой вещество, которое увеличивает концентрацию ионов водорода (H + ) в растворе, обычно за счет диссоциации одного из его атомов водорода. Основание содержит либо ионы гидроксида (OH – ) или другие отрицательно заряженные ионы, которые соединяются с ионами водорода, уменьшая их концентрацию в растворе и тем самым повышая рН. В тех случаях, когда основание высвобождает ионы гидроксида, эти ионы связываются со свободными ионами водорода, образуя новые молекулы воды.
Используя отрицательный логарифм для получения положительных целых чисел, высокие концентрации ионов водорода дают низкое число pH, тогда как низкие уровни ионов водорода приводят к высокому pH. кислота представляет собой вещество, которое увеличивает концентрацию ионов водорода (H + ) в растворе, обычно за счет диссоциации одного из его атомов водорода. Основание содержит либо ионы гидроксида (OH – ) или другие отрицательно заряженные ионы, которые соединяются с ионами водорода, уменьшая их концентрацию в растворе и тем самым повышая рН. В тех случаях, когда основание высвобождает ионы гидроксида, эти ионы связываются со свободными ионами водорода, образуя новые молекулы воды.
Рисунок 1. Шкала pH измеряет концентрацию ионов водорода (H + ) в растворе.
Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота (HCl) полностью диссоциирует на ионы водорода и хлора и является очень кислой, тогда как кислоты в томатном соке или уксусе полностью не диссоциируют и считаются слабыми кислотами.
И наоборот, сильные основания – это вещества, которые легко отдают ОН – или поглощают ионы водорода. Гидроксид натрия (NaOH) и многие бытовые чистящие средства сильно щелочные и быстро выделяют OH – при попадании в воду, тем самым повышая pH. Примером слабощелочного раствора является морская вода с pH около 8,0, что достаточно близко к нейтральному pH, чтобы морские организмы, адаптированные к этой соленой среде, могли процветать в ней.
Шкала pH , как упоминалось ранее, является обратным логарифмом и может принимать значения от 0 до 14 (рис. 1). Все, что ниже 7,0 (от 0,0 до 6,9) является кислотным, а все, что выше 7,0 (от 7,1 до 14,0), является щелочным. Экстремальные значения pH в любом направлении от 7,0 обычно считаются негостеприимными для жизни. pH внутри клеток (6,8) и pH крови (7,4) очень близки к нейтральному.
Однако среда в желудке очень кислая, с pH от 1 до 2. Так как же клетки желудка выживают в такой кислой среде? Как они гомеостатически поддерживают внутри себя близкий к нейтральному рН? Ответ в том, что они не могут этого сделать и постоянно умирают. Новые клетки желудка постоянно производятся для замены мертвых клеток, которые перевариваются кислотами желудка. Подсчитано, что слизистая оболочка человеческого желудка полностью обновляется каждые семь-десять дней.
Новые клетки желудка постоянно производятся для замены мертвых клеток, которые перевариваются кислотами желудка. Подсчитано, что слизистая оболочка человеческого желудка полностью обновляется каждые семь-десять дней.
Посмотрите это видео, чтобы получить простое объяснение pH и его логарифмической шкалы.
Буферы
Так как же могут организмы, тела которых нуждаются в pH, близком к нейтральному, поглощать кислые и щелочные вещества (например, человек, пьющий апельсиновый сок) и выживать? Буферы
 Когда ионы бикарбоната объединяются со свободными ионами водорода и становятся угольной кислотой, ионы водорода удаляются, что замедляет изменения pH. Точно так же, как показано на рисунке 2, избыток угольной кислоты может быть преобразован в газообразный диоксид углерода и выдыхаться через легкие. Это предотвращает накопление слишком большого количества свободных ионов водорода в крови и опасное снижение pH крови. Аналогично, если слишком много OH – введен в систему, угольная кислота соединится с ним с образованием бикарбоната, понизив рН. Без этой буферной системы рН тела колебался бы достаточно, чтобы поставить под угрозу выживание.
Когда ионы бикарбоната объединяются со свободными ионами водорода и становятся угольной кислотой, ионы водорода удаляются, что замедляет изменения pH. Точно так же, как показано на рисунке 2, избыток угольной кислоты может быть преобразован в газообразный диоксид углерода и выдыхаться через легкие. Это предотвращает накопление слишком большого количества свободных ионов водорода в крови и опасное снижение pH крови. Аналогично, если слишком много OH – введен в систему, угольная кислота соединится с ним с образованием бикарбоната, понизив рН. Без этой буферной системы рН тела колебался бы достаточно, чтобы поставить под угрозу выживание.Рисунок 2. На этой диаграмме показана буферизация организмом уровней pH крови. Синие стрелки показывают процесс повышения pH по мере производства большего количества CO 2 . Фиолетовые стрелки указывают на обратный процесс: понижение pH по мере образования большего количества бикарбоната.
Другими примерами буферов являются антациды, используемые для борьбы с избытком желудочной кислоты.



Leave A Comment