404 Cтраница не найдена
Размер:
A
A
A
Цвет: CCC
Изображения Вкл.Выкл.
Обычная версия сайта
RU EN
Башкирский государственный медицинский университет
- Университет
- Руководство
- Ректорат
- Обращение к ректору
- Ученый совет
- Университету 90 лет
- Телефонный справочник
- Документы
- Структура
- СМИ о вузе
- Символика БГМУ
- Электронный ящик доверия
- Комплексная программа развития БГМУ
- Антитеррор
- Сведения об образовательной организации
- Абитуриенту
- Обращение граждан
- Карта сайта
- Видеогалерея
- Доступная среда
- Оплата банковской картой
- Реорганизация вуза
- Календарь мероприятий
- Образование
- Учебно-методическое управление
- Учебно-организационный отдел
- Центр практических навыков
- Факультеты
- Кафедры
- Институт дополнительного профессионального образования
- Приемная комиссия
- Медицинский колледж
- Управление международной деятельности
- Отдел ординатуры
- Расписание
- Менеджмент качества
- Федеральный аккредитационный центр
- Научно-образовательный медицинский кластер «Нижневолжский»
- Государственная итоговая аттестация
- Первичная аккредитация
- Первичная специализированная аккредитация
- Внутренняя оценка качества образования
- Информация для инвалидов и лиц с ограниченными возможностями здоровья
- Информация для студентов
- Я-профессионал
- Всероссийская студенческая олимпиада по хирургии с международным участием
- Онлайн обучение
- Социальная работа в системе здравоохранения
- Новые образовательные программы
- Электронная учебная библиотека
- Периодическая аккредитация
- Независимая оценка качества образования
- Наука и инновации
- Структура и документы
- Указ Президента Российской Федерации «О стратегии научно-технологического развития Российской Федерации»
- Стратегия развития медицинской науки до 2025 года
- Научно-исследовательские подразделения
- Клинические исследования и испытания, ЛЭК
- Диссертационные советы
- Докторантура
- Аспирантура
- Грантовая политика БГМУ
- Актуальные гранты, стипендии, конкурсы
- Конференции и форумы
- Гранты, премии, конкурсы, конференции для молодых ученых
- Полезные интернет-ссылки
- Научные издания
- Проблемные научные комиссии
- Патентная деятельность
- БГМУ в рейтингах университетов
- Публикационная активность
- НИИ кардиологии
- Биобанк
- Репозиторий БГМУ
- Евразийский НОЦ
- Лечебная работа
- Клиника БГМУ
- Всероссийский центр глазной и пластической хирургии
- Клиническая стоматологическая поликлиника
- Клинические базы
- Отчеты по лечебной работе
- Договорная работа с клиническими базами
- Отделения клиники БГМУ
- Лицензии
- Санаторий-профилакторий БГМУ
- Жизнь БГМУ
- Воспитательная и социальная работа
- Отдел по культурно-массовой работе
- Отдел по связям с общественностью
- Общественные объединения и органы самоуправления
- Отдел по воспитательной и социальной работе
- Творческая жизнь
- Спортивная жизнь
- Совет кураторов
- Ассоциация выпускников
- Работа музеев на кафедрах
- Выпускники БГМУ – ветераны ВОВ
- Золотой фонд БГМУ
- Медиа центр
- БГМУ — ВУЗ здорового образа жизни
- Юбиляры
- Университету 90 лет
- Университету 85 лет
- Празднование 75-летия Победы в Великой Отечественной войне
- Научная библиотека
- Приоритет 2030
- О программе
- Проектный офис
- Стратегические проекты
- Миссия и стратегия
- Цифровая кафедра
- Конкурсы для студентов
- Отчетность
- Публикации в СМИ
- Программа развития
- Научные семинары для студентов и ученых БГМУ
- Новости
- Главная
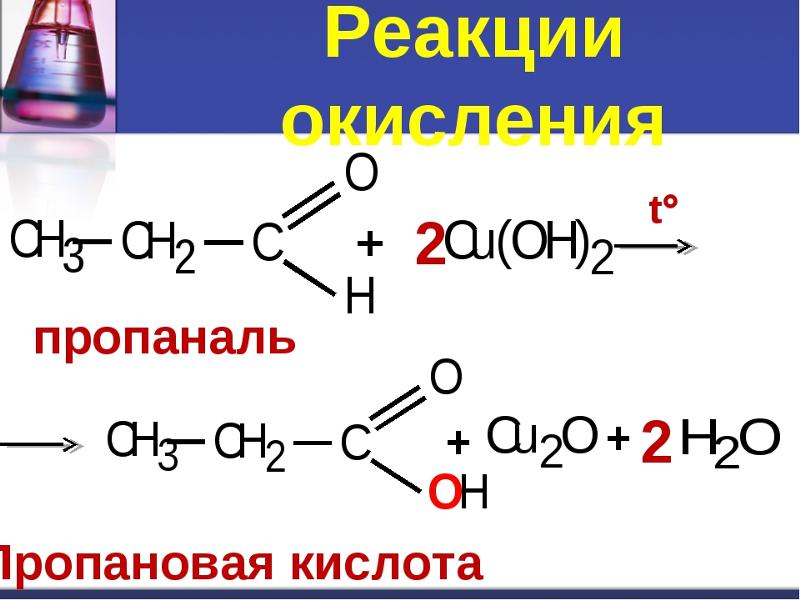
Кислородсодержащие производные углеводородов
Характерные химические свойства предельных одноатомных и многоатомных спиртов; фенола; альдегидов, предельных карбоновых кислот, сложных эфиров.
1. Метаналь может реагировать с
1) HBr
2) Ag[(NH3)2]OH
3) С6Н5ОН
4) С6Н5СН3
5) Na
6) Н2
2. Аммиачный раствор оксида серебра является реактивом на:
1) C2H5 — COOH
2) CH2O
3) HCOOH
4) C3H5(OH)3
5) C6H5OH
6) C3H7-CHO
3. Олеиновая кислота может вступать в реакции с
1) водородом
2) бромоводородом
3) медью
4) хлоридом хрома (III)
5) азотом
6) карбонатом натрия
4. Этандиол-1,2 может реагировать с
1) гидроксидом меди (II)
2) оксидом железа (II)
3) хлороводородом
4) водородом
5) калием
6) этаном
5. Продуктами гидролиза сложных эфиров состава С5Н10О2 могут быть
1) | пентаналь и метанол |
2) | пропановая кислота и этанол |
3) | этанол и бутаналь |
4) | бутановая кислота и метанол |
5) | этановая кислота и пропанол |
6) | формальдегид и пентанол |
6. Продуктами гидролиза сложных эфиров состава С6Н12О2 могут быть
Продуктами гидролиза сложных эфиров состава С6Н12О2 могут быть
1) | пропановая кислота и пропанол |
2) | этаналь и диметиловый эфир |
3) | бутан и метилацетат |
4) | этановая кислота и бутанол |
5) | пентановая кислота и метанол |
6) | пропаналь и этандиол |
7. Продуктами гидролиза сложных эфиров состава С7Н14О2 могут быть
1) | этанол и пропановая кислота |
2) | пропаналь и диметиловый эфир |
3) | метановая кислота и гексанол |
4) | бутановая кислота и пропаналь |
5) | гексановая кислота и бутанол |
6) | пентановая кислота и этанол |
8. Для предельных одноатомных спиртов характерны реакции
Для предельных одноатомных спиртов характерны реакции
1) | этерификации |
2) | поликонденсации |
3) | нейтрализации |
4) | окисления |
5) | дегидратации |
6) | гидратации |
9. Метаналь может реагировать с
1) НВг
2) Ag[(NH,)2]OH
3) С6Н5ОН
4) С6Н5СН3
5) Na
6) Н2
10. С муравьиной кислотой взаимодействуют:
С муравьиной кислотой взаимодействуют:
1) Na2CО3
2) HCI
3) [Ag(NH3)2]OH
4) HBr (р-р)
5) CuSO4
6) Cu(OH)2
11. Метанол взаимодействует с веществами:
1) хлороводород
2) карбонат натрия
3) глицин
4) гидроксид железа(Ш)
5) бензол
6) метановая кислота
12. Олеиновая кислота может вступать в реакции с
1) кислородом
2) хлором
3) медью
4) хлоридом цинка
5) азотом
6) гидроксидом натрия
13. Фенол реагирует с
1) кислородом
2) бензолом
3) гидроксидом натрия
4) хлороводородом
5) натрием
6) оксидом кремния(1V)
14. В каких рядах кислоты расположены в порядке увеличения кислотных свойств?
1) пропионовая —> уксусная —> муравьиная
2) хлоруксусная —> уксусная —> муравьиная
3) уксусная —> хлоруксусная —> дихлоруксусная
4) дихлоруксусная —> хлоруксусная —>уксусная
5) масляная —> уксусная—> муравьиная
6) муравьиная —>уксусная —> 2,2-диметилпропановая
15. Какие реакции спиртов происходят за счет разрыва связи С — О?
Какие реакции спиртов происходят за счет разрыва связи С — О?
16. К реакциям окисления, характеризующим свойства кислородсодержащих соединений, относятся
1) RCHO + Ag2О —>RCOOH + 2Ag
2) R-OH + HNО3—> RONO2 + H2О
3) 2ROH —> R-О-R + H20
4) RCH2OH + CuO —> RCHO + Cu + H2О
5) RCHO + H2 —>RCH2OH
6) 2RCHO + О2 —>2R-COOH
17. Окисление ацетальдегида происходит в результате реакций, уравнения которых:
18. Метановая кислота взаимодействует с:
1) пропанолом
2) оксидом серебра (NH3 р-р)
3) сульфатом меди (II)
4) оксидом магния
5) толуолом
6) бутаном
19. Этановая кислота взаимодействует с
1) гидроксидом меди (II)
2) толуолом
3) бромом
4) пропаном
5) нитратом железа (III)
6) этанолом
20. Фенол взаимодействует с веществами:
Фенол взаимодействует с веществами:
1) водород
2) бромная вода
3) гидроксид калия
4) хлороводород
5) метан
6) толуол
21. Пропионовая кислота взаимодействует с веществами:
1) пропанол
2) хлорид калия
3) аммиак
4) карбонат натрия
5) бензол
6) метан
22. Пропаналь взаимодействует с
1) гексаном
2) азотом
3) бензолом
4) гидроксидом меди (II)
5) метанолом
6) водородом
23. В отличие от метанола фенол
1) взаимодействует с гидроксидом натрия
2) вступает в реакции поликонденсации
3) взаимодействует с альдегидами
4) при окислении образует формальдегид
5) вступает в реакции этерификации
6) реагирует с хлоридом железа (III)
24. С разрывом связи О-Н у спиртов происходят реакции, уравнения которых
1) С2Н5ОН->С2Н4 + Н20
2) 2СН3ОН + 2К —>2СН3ОК + Н2
3) С2Н5ОН + СН3СООН —> СН3СООС2Н5 + Н20
4) C2H5OH + HBr —> C2H5Br + H20
5) 2C2H5OH + 2Na —>2C2H5ONa + H2
6) C2H5OH + NH3 —>C2H5NH2 + H20
25. В отличие от одноатомных предельных спиртов фенолы
В отличие от одноатомных предельных спиртов фенолы
1) взаимодействуют с бромной водой
2) не реагируют со щелочами
3) вступают в реакции с хлоридом железа (III)
4) подвергаются межмолекулярной дегидратации
5) образуют сложные эфиры с карбоновыми кислотами
6) вступают в реакции поликонденсации
26. В отличие от этилового спирта фенол
1) взаимодействует с гидроксидом кальция
2) легко окисляется даже кислородом воздуха
3) взаимодействует со щелочными металлами
4) вступает в реакции с галогеноводородами
5) образует простые эфиры
6) реагирует с бромной водой
27. Метанол взаимодействует с веществами:
1) | бромоводород |
2) | карбонат натрия |
3) | глицин |
4) | гидроксид железа (III) |
5) | бензол |
6) | метановая кислота |
28. В реакцию с раствором гидроксида натрия может вступать
В реакцию с раствором гидроксида натрия может вступать
1) тристеарат глицерина
2) диметиловый эфир
3) метилацетат
4) глюкоза
5) пропанол
6) этиловый эфир муравьиной кислоты
29. Метановая кислота реагирует с
1) метанолом
2) уксусной кислотой
3) карбонатом натрия
4) хлоридом натрия
5) аммиачным раствором оксида серебра
6) соляной кислотой
30. Этандиол-1,2 может реагировать с
1) гидроксидом меди (II)
2) гидроксидом кальция
3) хлороводородом
4) водородом
5) калием
6) карбонатом бария
31. Аммиачный раствор оксида серебра проявляет окислительные свойства в реакциях с
1) глюкозой
2) уксусной кислотой
3) этаналем
4) этанолом
5) муравьиной кислотой
6) фенолом
32. Фенол реагирует с
1) кислородом
2) бензолом
3) гидроксидом натрия
4) хлороводородом
5) натрием
6) оксидом углерода (IV)
33. При соответствующих условиях гидролизу подвергается
При соответствующих условиях гидролизу подвергается
1) глицерин
2) метилацетат
3) глюкоза
4) сахароза
5) стеарат кальция
6) этен
Ответы: 1-136, 2-236, 3-126, 4-135, 5-245, 6-145, 7-136, 8-145, 9-236, 10-126, 11-136, 12-126, 13-135, 14-135, 15-234, 16-146, 17-135, 18-124, 19-136, 20-123, 21-134, 22-456; 23-126, 24-146, 25-136, 26-126, 27-136., 28-136, 29-135, 30-135, 31-135, 32-135, 33-245.
неорганическая химия — Почему оксид серебра образует координационный комплекс при обработке аммиаком?
спросил
Изменено 4 года, 3 месяца назад
Просмотрено 5к раз
$\begingroup$
Часть приготовления реактива Толленса происходит по формуле:
$$\ce{Ag2O(s) + 4 Nh4 + 2 NaNO3 + h3O → 2 [Ag(Nh4)2]NO3 + 2 NaOH}$$
Интересно, как именно кислород «отлипает» от серебра под действием аммиака. Я читал о координационных комплексах, поэтому я понимаю, что такое $\ce{[Ag(Nh4)2]NO3}$, но я озадачен тем, что именно происходит, чтобы отделить этот кислород от $\ce{Ag2O}$
Я читал о координационных комплексах, поэтому я понимаю, что такое $\ce{[Ag(Nh4)2]NO3}$, но я озадачен тем, что именно происходит, чтобы отделить этот кислород от $\ce{Ag2O}$
Я очень мало исследовал проблему, так что это может быть слишком простой вопрос — в этом случае просто подскажите, что почитать.
Я нашел этот (теперь удаленный) комментарий:
$\ce{Nh4}$ растворяет оксид серебра, потому что у азота есть пара электронов, которые он может разделить с серебром, образуя диамминовый комплекс. Это не имеет ничего общего с регулировкой pH. – А.К. 20 янв.
Chemguide указывает это:
Изготовлен из раствора нитрата серебра(I). Вы добавляете каплю раствора гидроксида натрия, чтобы получить осадок оксида серебра (I), а затем добавляете ровно столько разбавленного раствора аммиака, чтобы повторно растворить осадок.
- неорганическая химия
- аналитическая химия
- координационные соединения
- переходные металлы
$\endgroup$
1
$\begingroup$
Это элементарно (наверное). Известно, что серебро (и золото) имеет в своих соединениях два основных координационных числа, а именно $2$ и $4$. Для начала мы можем считать $\ce{[Ag(OH)2]-}$ нашим исходным комплексом, поскольку в водных растворах можно считать, что он находится в равновесии с $\ce{Ag2O}$. См. сноску [1].
Известно, что серебро (и золото) имеет в своих соединениях два основных координационных числа, а именно $2$ и $4$. Для начала мы можем считать $\ce{[Ag(OH)2]-}$ нашим исходным комплексом, поскольку в водных растворах можно считать, что он находится в равновесии с $\ce{Ag2O}$. См. сноску [1].
Беглый взгляд на порядок силы лигандов говорит нам, что $\ce{Nh4}$ является более сильным лигандом, чем $\ce{OH-}$. Теперь я собираюсь сравнить термодинамическую стабильность $\ce{[Ag(OH)2]-}$ с термодинамической стабильностью комплекса диаммина $\ce{[Ag(Nh4)2]+}$.
Сила лигандов прямо пропорциональна термической стабильности комплекса, так что да, комплекс диаммина более стабилен .
Аналогичный случай наблюдается с медью(I). Цианидные комплексы меди(I) известны как чрезвычайно стабилен и, следовательно, предпочитает образовывать комплекс с цианидом по сравнению с другими лигандами.
[1] Тем не менее, заявление об этом может быть весьма спорным, поскольку диаграммы Эллингема говорят нам, что $\ce{Ag(OH)}$, будучи нестабильным, превращается в $\ce{Ag2O}$, который является гораздо более стабильным соединением. для серебра. Однако в водных растворах равновесие такого рода всегда может существовать.
для серебра. Однако в водных растворах равновесие такого рода всегда может существовать.
$\endgroup$
1
$\begingroup$
Некоторые мысли по этому вопросу, полученные по электронной почте от Джима Кларка, автора веб-сайта Chemguide . Я надеюсь, что эти мысли окажутся полезными для читателей, поэтому публикую их здесь (с разрешения автора).
Я не вижу здесь проблемы. Оксид серебра образуется в результате реакции присоединения ионов гидроксида к ионам серебра(I). Вместо того, чтобы осаждать гидроксид серебра (I), он дегидратирует (полностью или частично — я не знаю) до оксида серебра (I). Но, как и в случае с любым другим нерастворимым соединением, будет существовать равновесие между твердым соединением и его ионами в растворе, хотя и сильно в сторону твердого равновесия.
Когда вы добавляете раствор аммиака, он образует комплексы с ионами серебра (I) с образованием растворимых ионов диамминсеребра (I).
Положение равновесия этой реакции сильно смещено в сторону комплексов.
Таким образом, вы можете думать об этом двумя способами.
Аммиак реагирует с ионами серебра(I) в твердом оксиде серебра(I) и переходит в раствор. Ионы оксида реагируют с водой с образованием ионов гидроксида. Или…
Аммиак реагирует с небольшим количеством ионов серебра(I), уже находящихся в растворе, и равновесие осаждения смещается, чтобы заменить их. Таким образом, твердое вещество возвращается в раствор с образованием ионов гидроксида, которые были добавлены первоначально, но с ионами серебра, которые теперь в основном находятся в комплексе.
Первый способ не только проще, но и, конечно же, применим к любому твердому оксиду серебра(I), который у вас может быть – например, потускнение оксида серебра(I) на каком-либо предмете из серебра, которое можно удалить, протерев его салфеткой. раствор аммиака (источник как аммиака для комплексообразования ионов серебра, так и воды для реакции с ионами оксида.
$\endgroup$
$\begingroup$
На самом деле возможно оба комментария, цитируя:
«потому что диаграммы Эллингема говорят нам, что Ag(OH), будучи нестабильным, превращается в Ag2O, который является гораздо более стабильным соединением для серебра. Однако в водных растворах равновесие такой вид всегда может существовать»
«Nh4 является более сильным лигандом, чем OH-»
Предполагая исходное присутствие Ag2O в реакции, некоторые ионы Ag+ из-за ограниченной растворимости, и отмечая, что «появляется ppt AgOH и растворяется в избытке аммиака», см. https:/ /books.google.com/books?id=uwJbSFRIqyAC&pg=PA37&lpg=PA37&dq=radical+attack+on+silver+Ag+%2B+%E2%80%A2OH++—%3E+AgOH&source=bl&ots=jG9-2NG9x3&sig=V9nVefopAXXKP3lFnxQYnJriG14&hl= =X&ved=2ahUKEwjasar_g7ffAhWlhOAKHQEDA_4Q6AEwGHoECAcQAQ#v=onepage&q&f=false :
2 AgOH = Ag2O + h3O
оба комментария могут быть правильными.
Кроме того, в присутствии видимого света образуется фотокатализатор Ag2O/Ag, который, согласно исследованию, проведенному в КНР (опубликовано в 2011 г. в «Chemistry, a European Journal»), считается мощным стабильным фотокатализатором видимого света. способен генерировать электроны (e-) и дырки (h+) (см. https://onlinelibrary.wiley.com/doi/abs/10.1002/chem.201101032):
Ag2O/Ag + hv —> e− + h+
С электронами:
Ag+ + e- —> Ag
И, в присутствии активных электронных дырок, любые OH-, созданные посредством:
XOH = X+ + OH- (где X = H или Nh4 или Ag)
может быть преобразован в радикал •OH:
OH- (водн.) + h+ —> •OH (водн.)
, который может непосредственно атаковать серебряный металл (см. https://pubs.acs.org/doi/abs /10.1021/acs.jpca.7b08081?src=recsys&journalCode=jpcafh и окислительно-восстановительные пары, связанные со сверхкислотностью, на http://beta.chem.uw.edu.pl/people/WGrochala/Ag2+_mechanism.pdf, металлы в их более низких валентных состояниях на https://srd. nist.gov/NSRDS/NSRDS-NBS-65.pdf, где можно постулировать полуэлементные реакции: Ag = Ag+ + e- и •OH + e- = OH — с чистой реакцией ниже):
nist.gov/NSRDS/NSRDS-NBS-65.pdf, где можно постулировать полуэлементные реакции: Ag = Ag+ + e- и •OH + e- = OH — с чистой реакцией ниже):
Ag + •OH (водн.) —> AgOH (водн.)
2 AgOH = Ag2O + h3O
Или: AgOH (водн.) = Ag+ (водн.) + OH- (водн.) (на основе некоторой ограниченной растворимости Ag2O)
с образованием бескислородного иона серебра в комплексе с Nh4 (или OH-, в зависимости от концентрации соответствующих ионов) в фотоциклической реакции. Примечание: гидроксильный радикал может быть в значительной степени удален при высокой концентрации аммиака (с образованием •Nh3), поэтому этот путь чувствителен к pH.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Реакция серебряного зеркала — MEL Chemistry
Похоже, вы посещаете наш сайт из Германия . Пожалуйста, перейдите на наш региональный сайт для получения более актуальных цен, сведений о продуктах и специальных предложениях.
Выбрать другую страну
Научное описание удивительного эксперимента
Очень эффектно выглядит эксперимент с красивым эффектом формирования зеркальной поверхности на стекле. Проведение этой реакции требует опыта и терпения. В нашей статье вы можете прочитать о необходимых реагентах, о том, как подготовить оборудование, и узнать химические уравнения реакций.
Суть реакции серебряного зеркала заключается в образовании слоя металлического серебра в результате окислительно-восстановительной реакции, при взаимодействии аммиачного раствора оксида серебра в присутствии альдегидов.
Чтобы сделать прочный серебряный слой, вам понадобятся:
- Стеклянная колба 100 мл;
- 2,5-4% раствор аммиака;
- нитрат серебра 2%;
- раствор формальдегида (40%).
Вместо растворов аммиака и нитрата серебра можно также использовать реактив Толленса – аммиачный раствор оксида серебра. Добавьте 1 грамм азотнокислого серебра в 10 капель воды (если жидкость предполагается хранить длительное время, храните ее в темном месте или в склянке из темного стекла). Перед началом опыта смешайте раствор (около 3 мл) в пропорции 1/1 с 10%-ным раствором едкого натра. Может образоваться осадок серебра, который можно разбавить медленным добавлением раствора аммиака.
Реакция протекает при комнатной температуре. Для успешного результата стенки стеклянной колбы должны быть идеально чистыми и гладкими. При наличии на стенках мелких частиц грязи полученный осадок будет иметь вид рыхлого слоя черного или темно-серого цвета.
При наличии на стенках мелких частиц грязи полученный осадок будет иметь вид рыхлого слоя черного или темно-серого цвета.
Для очистки колбы используйте различные типы щелочных растворов. Сначала используют раствор едкого натра, а затем промывают колбу дистиллированной водой. Промойте колбу моющим средством много раз.
Почему так важно, чтобы сосуд был чистым
Коллоидные частицы серебра, образовавшиеся в конце эксперимента, должны прочно сцепляться с поверхностью стекла, на нем не должно быть жира или механических частиц. Дистиллированная вода не содержит солей и идеально подходит для окончательного ополаскивания колб. Его можно приготовить дома, но проще купить.
Уравнение, описывающее первую стадию реакции серебряного зеркала :
Ag₂O + 4NH3·Н₂О ⇄ 2[Ag(NН₃)₂]ОН + 3Н₂О
где [Ag(NН₃)₂]ОН – гидроксид диамина серебра, получают растворением оксида металла в растворе аммиака.
Шаростержневая модель комплекса диамминсеребра(I) [Википедия]NB Соблюдать требования по концентрации аммиака, реакция возможна при низких концентрациях!
Конечную стадию реакции можно исследовать по следующему уравнению:
R-CH=O + 2[Ag(NH3)₂]OH → 2Ag↓ + R-COONH₄ + 3NH3 + H₂O (реакция альдегида R -CH=O и раствор гидроксида диамина серебра образуют осадок серебра, амид угольной кислоты и раствор аммиака; где R представляет собой органическую функциональную группу)
Вторую стадию реакции лучше проводить, осторожно нагревая колбу на горелке, тогда процесс должен протекать без проблем.
Что может показать реакция с серебряным зеркалом
Эта интересная химическая реакция не только позволяет нам исследовать определенные состояния вещества, но также может дать точное определение альдегидов. Эта реакция отвечает на вопрос: есть в растворе альдегидная группа или нет?
Формула альдегидной группы [Википедия]Например, благодаря этому процессу мы можем узнать, какой компонент содержит раствор: глюкозу или фруктозу. Глюкоза дает положительный результат, образуется «серебряное зеркало», а фруктоза содержит кетоновую группу и не может образовывать осадок серебра. Для проведения анализа следует вместо формальдегида добавить 10% раствор глюкозы. Давайте посмотрим на уравнение, чтобы понять, почему и как растворенное серебро превращается в твердый осадок:
2[Ag(NH3)₂]OH + 3H2O + C6H12O₆ (глюкоза) = 2Ag↓+ 4NH3₃∙H2O + C6H1₂O₇ (формы глюконовой кислоты).

 Положение равновесия этой реакции сильно смещено в сторону комплексов.
Положение равновесия этой реакции сильно смещено в сторону комплексов.
Leave A Comment