| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | C_8H_18+O_2→CO_2+H_2O | ||
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | O | |
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | ||
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | K | |
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Химические свойства натрия: взаимодействие с неметаллами, водой
Билет № 22
1.
 Натрий: положение этого химического элемента в периодической системе, строение его атома, физические свойства. Химические свойства натрия: взаимодействие с неметаллами, водой
Натрий: положение этого химического элемента в периодической системе, строение его атома, физические свойства. Химические свойства натрия: взаимодействие с неметаллами, водойПоложение в периодической системе: натрий находится в 3 периоде, I группе, главной (А) подгруппе.
Атомный номер натрия 11, следовательно, заряд ядра атома натрия равен + 11, число электронов 11. Три электронных уровня (равно периоду), на внешнем уровне 1 электрон (равно номеру группы для главных подгрупп).
Схема расположения электронов по уровням:
11Na ) ) )
2 8 1
Ядро атома натрия 23Na содержит 11 протонов (равно заряду ядра) и 12 нейтронов (атомная масса минус число протонов: 23 − 11 = 12).
Простое вещество натрий — металл серебристо-белого цвета, легкий (плотность 0,97 г/см3 — легче воды), мягкий (легко режется ножом), легкоплавкий (температура плавления 98° C).
Натрий, как и все щелочные металлы, — сильный восстановитель. Он энергично реагирует с неметаллами:
Он энергично реагирует с неметаллами:
- При нагревании до 180° С в умеренном количестве кислорода образуется оксид натрия:
4Na + O2 = 2Na2O - Натрий горит на воздухе с образованием пероксида натрия:
2Na + O2 = Na2O2
Натрий хранят под слоем керосина. - Расплавленный натрий в хлоре сгорает с ослепительной вспышкой (можно говорить проще — реагирует с хлором при нагревании), на стенках сосуда образуется белый налет хлорида натрия:
2Na + Cl2 = 2NaClНатрий может взрываться при растирании с порошком серы (образуется сульфид натрия):
2Na + S = Na2SНатрий при нагревании восстанавливает водород, образуется гидрид натрия:
2Na + H2 = 2NaH
Если небольшой кусочек натрия поместить в воду, он бурно реагирует с водой. Металл плавится от выделяющейся теплоты и «бегает» по поверхности воды. Образуется раствор гидроксида натрия:
2Na + 2HOH = 2NaOH + H2↑
Натрий в природе содержится в различных минералах, в виде соли в морской воде. В человеческом организме соли натрия входят в состав
плазмы крови, лимфу.
В человеческом организме соли натрия входят в состав
плазмы крови, лимфу.
Применяется в атомной энергетике (в качестве теплоносителя) и в виде соединений (поваренной соли NaCl, соды Na2CO3 и др.)
2. Опыт. Осуществление превращения: соль → нерастворимое основание → оксид металла
Для получения нерастворимого основания, к раствору соли добавляем гидроксид натрия. Полученный осадок нагреваем на спиртовке, он разлагается с образованием оксида.
Лучше взять сульфат или хлорид меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Выпадает синий осадок гидроксида меди (II). При нагревании осадок чернеет в результате образования черного оксида меди (II):
Cu(OH)2 = CuO + H2O
автор: Владимир Соколов
Количество нейтронов в атоме натрия: A) 10B) 11C) 13D) 12
Дата последнего обновления: 23 марта 2023 г.
•
Ответ
Проверено
282,9 тыс.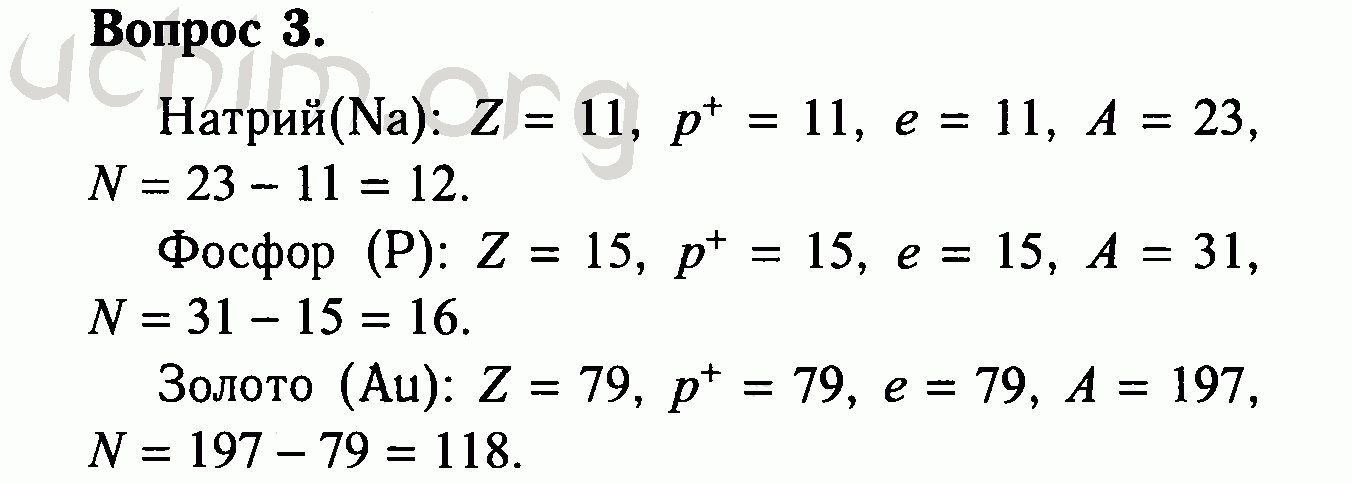 + просмотров
+ просмотров
Подсказка : Нейтроны и протоны вместе составляют ядро атома.
Количество протонов равно атомному номеру (Z) элемента.
Сумма числа протонов и числа нейтронов равна массовому числу (А) элемента.
Полный пошаговый ответ:
Нейтроны и протоны вместе находятся в ядре атома.
Атом натрия имеет атомный номер 11. По определению,
$\text{Число протонов = атомный номер элемента }\left( \text{Z} \right)$
Таким образом, число протонов в ядре натрия равно 11. —(1)
Кроме того, массовое число натрия равно 23. По определению,
$\text{Количество протонов + Количество нейтронов = Массовое число элемента }\left( \text{A } \right)$
$\следовательно \text{Количество протонов + Количество нейтронов = 23}$ —(2)
Теперь, используя (1) в (2),
$11+\text{ Количество нейтронов = 23}$
$\следовательно \text{Количество нейтронов = 23-11 = 12}$
Следовательно, имеется 12 нейтронов в атоме натрия.
Значит, правильный вариант Г) 12.
Дополнительная информация:
Периодическая таблица элементов расположена в порядке возрастания их атомных номеров. Раньше его располагали в порядке возрастания массовых чисел элементов. Однако эта система просуществовала недолго, поскольку она была непоследовательной и имела много недостатков. Расположение элементов в соответствии с их атомным номером формирует более организованные группы элементов, которые имеют схожие характеристики и, таким образом, правильно связаны друг с другом.
Некоторые элементы имеют разные атомные номера, но одинаковые массовые числа. Это происходит из-за количества нейтронов. Например, аргон (Ar, атомный номер 18) и кальций (Ca, атомный номер 20) имеют одинаковое массовое число 40. Такие частицы известны как изобары.
Некоторые элементы имеют одинаковый атомный номер, но разные массовые числа. Это происходит из-за разного количества нейтронов. Например, C-12 и C-14 представляют собой формы углерода с атомным номером 6, но с массовыми числами 12 и 14 соответственно. Такие виды известны как изотопы.
Такие виды известны как изотопы.
Примечание : Для решения таких вопросов учащиеся должны хорошо знать периодическую таблицу. Изучение периодической таблицы необходимо для получения хороших результатов по таким вопросам, особенно на конкурсных экзаменах.
Таблицу Менделеева можно изучать сериями и группами, используя умную мнемонику. Для серии галогенов, фтора, хлора, брома, йода и астата одной из таких мнемоник является «Первый классный бургер, который я съел», где первые буквы обозначают начальные буквы элементов в правильном порядке.
Недавно обновленные страницы
Рассчитать изменение энтропии, связанное с преобразованием 11 класса химии JEE_Main
Закон, сформулированный доктором Нернстом, является первым законом термодинамики класса 11 химии JEE_Main
Для реакции при rm0rm0rmC и нормальном давлении класса A 11 химия JEE_Main
Двигатель, работающий между rm15rm0rm0rmC и rm2rm5rm0rmC класс 11 химия JEE_Main
Для реакции rm2Clg в rmCrmlrm2rmg признаки 11 класса химии JEE_Main
Изменение энтальпии перехода жидкой воды в химический класс 11 JEE_Main
Рассчитайте изменение энтропии при переходе в химический класс 11 JEE_Main
Закон, сформулированный доктором Нернстом, представляет собой Первый закон термодинамики 11-го класса химии JEE_Main
Для реакция при rm0rm0rmC и нормальном давлении А химический класс 11 JEE_Main
Двигатель, работающий между rm15rm0rm0rmC и rm2rm5rm0rmC химический класс 11 JEE_Main
0003
Изменение энтальпии перехода жидкой воды класса 11 по химии JEE_Main
Актуальные сомнения


Leave A Comment