Пятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Режим работы и обучения
Студенту
Информация для студентов очной и заочной формы обученияЦентр дополнительного образования и профориентационной работы
Факультет последипломного образования
Информация о вузе
Информация о ПМФИВиртуальный кабинет психологической помощи
О приеме заявлений о зачислении в порядке перевода от граждан РФ, Украины, Донецкой и Луганской народных республик
Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВO ВолгГМУ Минздрава России осуществляет прием заявлений о зачислении в порядке перевода от граждан Российской Федерации, а также от граждан Украины, Донецкой и Луганской народных республик, вынужденно покинувших территорию республик и прибывших на территорию Российской Федерации, изъявивших желание перевестись для обучения в ПМФИ.
Перевод осуществляется на программы, реализуемые в ПМФИ, в соответствии с действующим законодательством, Положениями и Уставом ВолгГМУ.
Заявления о переводе принимаются ежедневно с 9:00 до 17:00 (выходные дни: суббота, воскресенье).
Ответственные сотрудники за прием заявлений о переводе:
ЧАХИРОВА Виктория Анатольевна, начальник учебного отдела
Тел. +7 (906) 460-09-80
e-mail: [email protected]
Дирекция ПМФИ
Центр дополнительного образования и профориентационной работы
Повышение квалификации
- Для педагогических работников
Профессиональная переподготовка
- Для педагогических работников
ПМФИ в: Youtube Instagram Вконтакте
Юбилей ПМФИ — 75
СЛОВО ДИРЕКТОРА
О ВУЗЕ
Пятигорский медико-фармацевтический институт, как правопреемник Пятигорской государственной фармацевтической академии, является признанным лидером фармацевтического образования России.
Ахвердова Ольга Альбертовна
Директор, доктор психологических наук, кандидат медицинских наук
Подробнее о вузе
Виртуальный кабинет психологической помощи
Очные психологические консультации (с использованием дистанционных технологий)
Время работы: пятница с 18:00 — 20:00 (платформа VooVMeeting)
Психолог invites you to a meeting on VooVMeeting
Meeting Topic: Психологическая служба
Meeting Time: 2022/3/18 17:00-19:00 (GMT+03:00) Moscow Standard Time — Moscow Recurrence:Every Fri
Click the link to join the meeting or to add it to your meeting list: https://voovmeeting.com/dm/9LrpICRwUcOT
#VooVMeeting: 818-0338-2767 Meeting Password: 12345
Attendees: Психолог
Заочные психологические консультации
e-mail: ovz@pmedpharm. ru
ru
Подробнее
Дополнительное профессиональное образование медицинских и фармацевтических специалистов
Все программы разработаны в соответствии с требованиями профессиональных стандартов, нормативной базой министерства здравоохранения и министерства образования Российской Федерации.
Для специалистов с высшим и средним профессиональным фармацевтическим и медицинским образованием:
- Провизоров;
- Фармацевтов;
- Врачей;
- Среднего медицинского персонала;
Больше информации
Новости
Читать все
Наши студенты вышли в финал Всероссийской олимпиады «Я – профессионал»
25 марта 2023
Каникулы с ПМФИ
24 марта 2023
Команда ПМФИ заняла 1-ое место во Всероссийских соревнованиях по дартсу
24 марта 2023
Круглый стол на тему: «Заслуженные ученые ПМФИ»
24 марта 2023
ИТОГИ VI НАУЧНО-ПРАКТИЧЕСКОЙ КОНФЕРЕНЦИИ СТУДЕНТОВ «МЕЖДИСЦИПЛИНАРНЫЕ ПРОБЛЕМЫ И ИННОВАЦИОННЫЕ ТЕХНОЛОГИИ МЕДИЦИНЫ 21 ВЕКА»
23 марта 2023
Студенты ПМФИ провели занятие для школьников Пятигорска
23 марта 2023
Расписание он-лайн
Уточните курс и группу для просмотра актуального расписания.
Посмотреть расписание
Материалы
Доступ к методическим,
консультационным и справочным
материалам, лекциям, тестовым
заданиям.
Узнать больше
Галерея Посмотреть фотографии
Кафедры и подразделения
Учебный процесс в вузе осуществляется на 27 кафедрах
и в 41 подразделении.
Узнать больше
Сайт олимпиады ЖМИ здесь и участвуй!
ПМФИ — Соорганизатор направления «Фармация», материалы
Главный корпус ПМФИ —
Пятигорского филиала ФГБОУ ВО ВолгГМУ
Минздрава России
Объявления
Важно
Летняя онлайн языковая школа в Центре мировых языков и культур
26 мая 2022
Важно
Летняя профильная школа Юного провизора Пятигорского медико-фармацевтического института начнет свою работу в июне
23 мая 2022
Важно
Собеседование на восстановление по специальности «Фармация», «Стоматология», «Лечебное дело», «Медицинская биохимия», будет проходить 30 августа 2021 г.
6 июля 2021
Читать все
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование: Пятигорский медико-фармацевтический институт — филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации»,
сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г.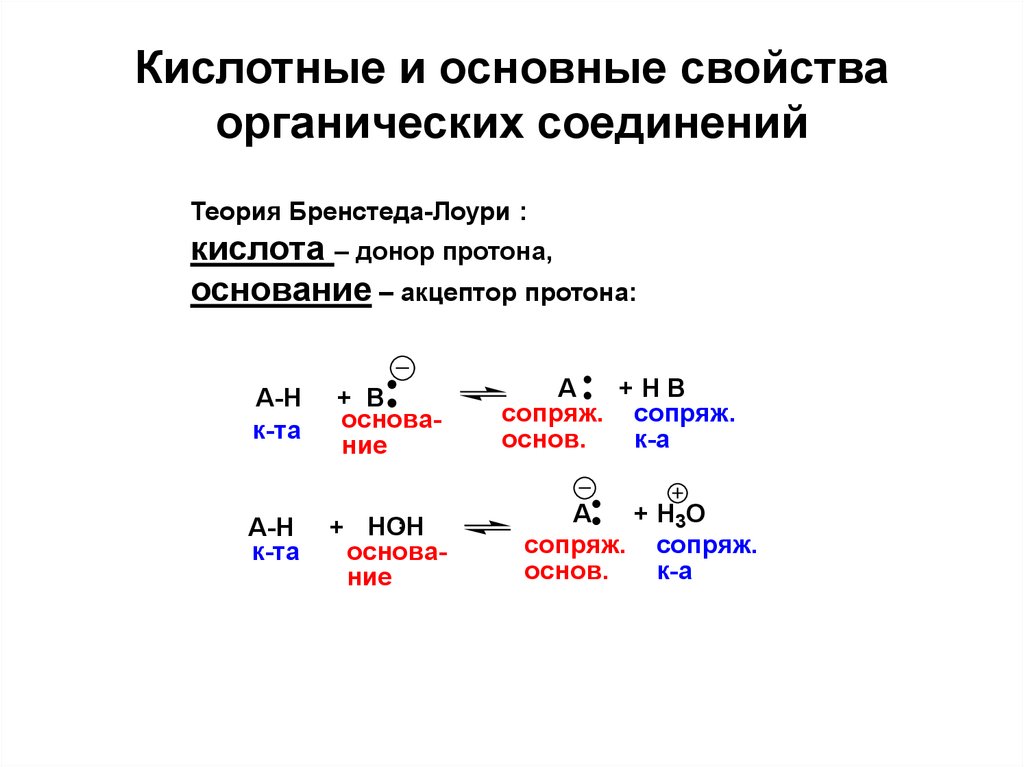
— полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
— полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13.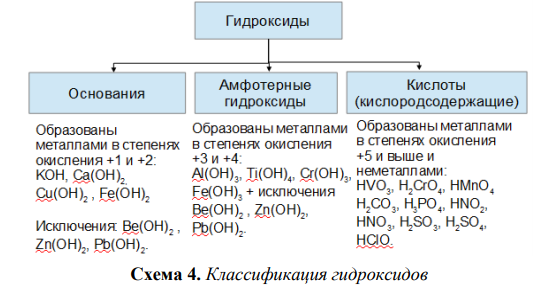 07.2016.
07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
Кремний. Химия кремния и его соединений
1. Положение кремния в периодической системе химических элементов
2. Электронное строение кремния
3. Физические свойства и нахождение в природе кремния
4. Качественные реакции на силикаты
5. Основные соединения кремния
6. Способы получения кремния
7. Химические свойства кремния
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и углеродом
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с щелочами
7.2.2. Взаимодействие с кислотами
7.2.3. Взаимодействие с азотной кислотой
Бинарные соединения кремния — силициды, силан и др.
Оксид кремния (IV)
1. Физические свойства и нахождение в природе
2. Химические свойства
2.1. Взаимодействие с щелочами и основными оксидами
2.2. Взаимодействие с водой
2.3. Взаимодействие с карбонатами
2.4. Взаимодействие с кислотами
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
Кремниевая кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
Силикаты
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии:
+14Si 1s22s22p63s23p2
Электронная конфигурация кремния в возбужденном состоянии:
+14Si* 1s22s22p63s13p3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см3. Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO32- — взаимодействие солей-силикатов с сильными кислотами. Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например, если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl
Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2 кремниевая кислота H2SiO3 силикаты MeSiO3 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4 силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г.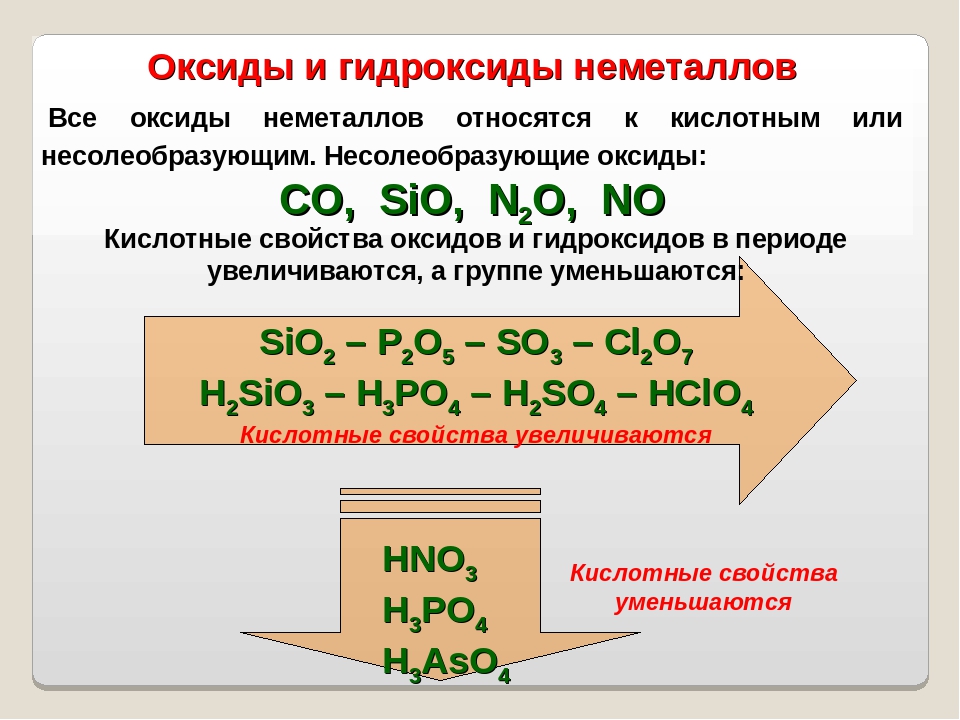 Его латинское название «силиций» произошло от латинского слова «sileх», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
Его латинское название «силиций» произошло от латинского слова «sileх», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
3SiO2 + 4Al → 3Si + 2Al2O3
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком:
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана:
SiH4 → Si + 2H2
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами, и с неметаллами.
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
Si + 2F2 → SiF4
При нагревании кремний реагирует с хлором, бромом, йодом:
Si + 2Cl2 → SiCl4
Si + 2Br2 → SiBr4
1.2. При сильном нагревании (около 2000оС) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом.
1.4. С азотом кремний реагирует в очень жестких условиях:
3Si + 2N2 → Si3N4
1. 5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом:
Si + O2 → SiO2
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Видеоопыт взаимодействия кремния с раствором щелочи можно посмотреть здесь.
2.2. Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
Si + 6HF → H2[SiF6] + 2H2
При обработке кремния безводным фтороводородом комплекс не образуется:
Si(тв. ) + 4HF(г.) = SiF4 + 2H2
) + 4HF(г.) = SiF4 + 2H2
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например, силицид магния разлагается водой на гидроксид магния и силан:
Mg2Si + 4H2O → 2Mg(OH)2 + SiH4
Соляная кислота легко разлагает силицид магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg2Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
SiH4 + 2O2 → SiO2 + 2H2O
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
SiH4 + 2H2O → SiO2 + 4H2
Силан разлагается (окисляется) щелочами:
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2
Силан при нагревании разлагается:
SiH4 → Si + 2H2
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si+4C-4. Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
SiC +2O2 → SiO2 + CO2
Карборунд окисляется кислородом в расплаве щелочи:
SiC + 2O2 + 4NaOH → Na2SiO3 + Na2CO3 + 2H2O
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем:
SiO2 + C + Cl2 → SiCl4 + CO
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
SiCl4 + 3H2O → H2SiO3↓ + 4HCl
Хлорид кремния (IV) восстанавливается водородом:
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой.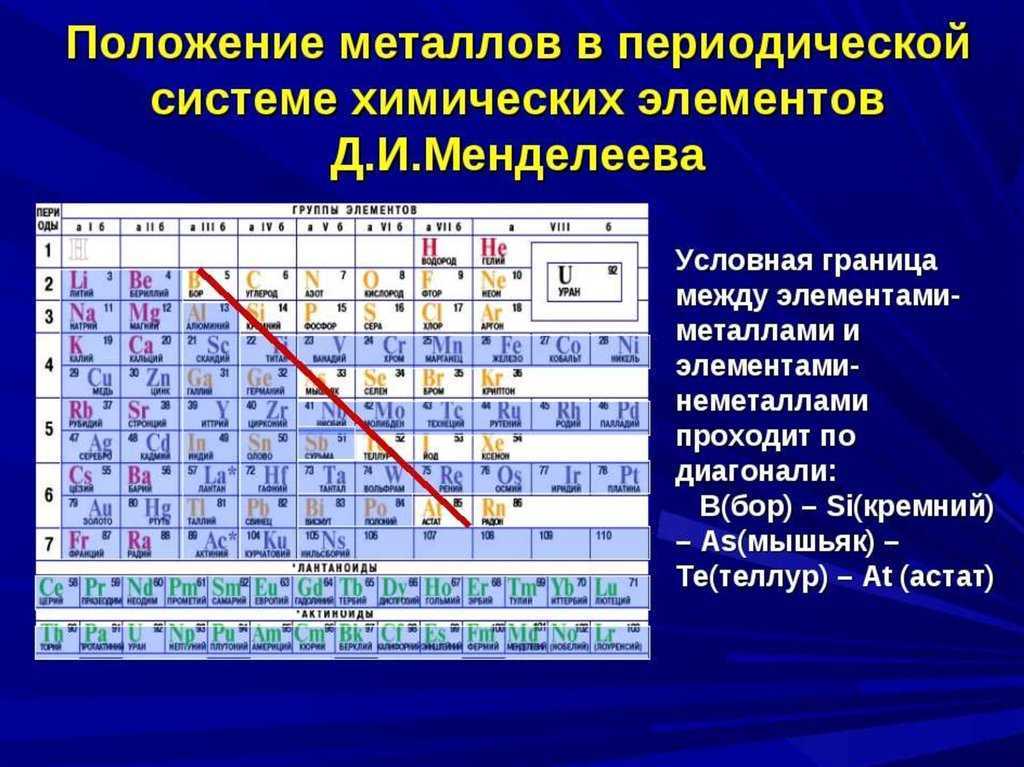 В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид. За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами. При этом образуются силикаты.
Например, диоксид кремния взаимодействует с гидроксидом калия:
SiO2 + 2KOH → K2SiO3 + H2O
Еще пример: диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой, т.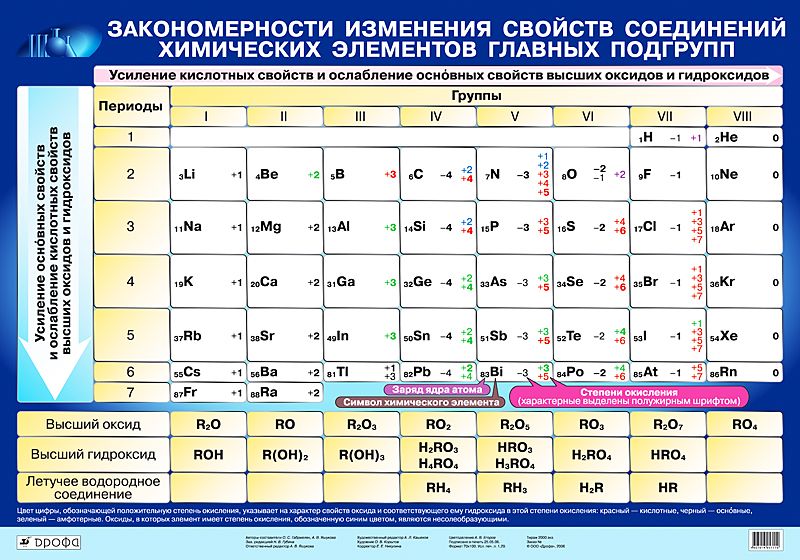 к. кремниевая кислота нерастворима.
к. кремниевая кислота нерастворима.
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов. При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например, оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
SiO2 + K2CO3 → K2SiO3 + CO2
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 4HF(г) = SiF4 + 2H2O
SiO2 + 6HF(р-р) → H2[SiF6] + 2H2O
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например, оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например, оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
SiO2 + 2Н2 → Si + 2Н2O
Еще пример: оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
3SiO2 + Ca3(PO4)2 + 5C → 3CaSiO3 + 5CO + 2P
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кислот на растворимые силикаты (силикаты щелочных металлов).
Например, при действии соляной кислоты на силикат натрия:
Na2SiO3 + 2HCl → H2SiO3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Na2SiO3 + 2Н2O + 2CO2 → 2NaHCO3 + H2SiO3
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Например, кремниевая кислота реагирует с концентрированным гидроксидом калия:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
2. При нагревании кремниевая кислота разлагается на оксид и воду:
H2SiO3 → SiO2 + H2O
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1. Растворение кремния, кремниевой кислоты или оксида в щелочи:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
Si + 2NaOH + H2O → Na2SiO3 + 2H2
SiO2 + 2KOH → K2SiO3 + H2O
2. Сплавление с основными оксидами:
Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
K2SiO3 + CaCl2 → CaSiO3 + 2KCl
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb2+ – хрусталь; Cr3+ – имеет зеленую окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – дает синий цвет, Mn2+ – красновато-лиловый.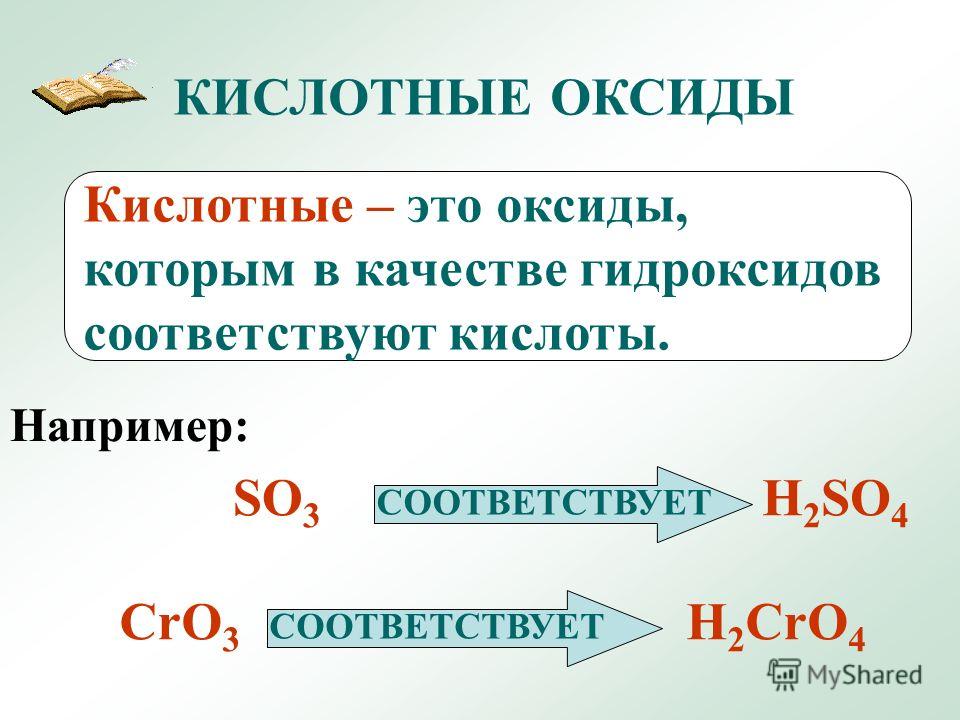
Понравилось это:
Нравится Загрузка…
неорганическая химия — Почему Cr2O3 амфотерный, а CrO нет?
спросил
Изменено 4 года, 10 месяцев назад
Просмотрено 19 тысяч раз
$\begingroup$
Столкнулся с вопросом, где среди заданных оксидов нужно найти амфотерные оксиды. Ключ ответа говорит, что $\ce{Cr2O3} $ является амфотерным, а $\ce{CrO}$ — нет. Но почему?
- неорганическая химия
- кислотно-основная
$\endgroup$
0
$\begingroup$
Основной оксид – это оксид, который растворяется в воде с образованием растворимого гидроксида. По этой причине основные оксиды очень хорошо растворимы. Кислотные оксиды – это оксиды, которые растворяются в воде с образованием сильных кислот. Как правило, ковалентные оксиды образуют кислотные оксиды, поскольку элемент, с которым связан кислород, является электроотрицательным. По мере увеличения заряда электроотрицательность увеличивается, и поэтому оксид становится кислым. Это также относится к элементам, имеющим несколько оксидов. По мере окисления нет. увеличивается, увеличивается заряд и, таким образом, оксиды становятся кислыми. Эта ссылка содержит хорошую информацию по этой теме:
По этой причине основные оксиды очень хорошо растворимы. Кислотные оксиды – это оксиды, которые растворяются в воде с образованием сильных кислот. Как правило, ковалентные оксиды образуют кислотные оксиды, поскольку элемент, с которым связан кислород, является электроотрицательным. По мере увеличения заряда электроотрицательность увеличивается, и поэтому оксид становится кислым. Это также относится к элементам, имеющим несколько оксидов. По мере окисления нет. увеличивается, увеличивается заряд и, таким образом, оксиды становятся кислыми. Эта ссылка содержит хорошую информацию по этой теме:
Поскольку кислотность катиона быстро возрастает с увеличением заряда, d-блок элементы, которые проявляют широкий спектр степеней окисления, могут иметь один или несколько оксидов, проявляющих только основные свойства, и один или несколько оксиды, проявляющие только кислотные свойства. Чем выше степень окисления номер тем более кислый соответствующий оксид. Хром как пример такого элемента.
6+}&\text{кислая}\\\hline \конец{массив} $$ 9{-}})$.
Итак, эмпирическое правило таково: чем больше степень окисления, тем больше заряд металла, тем больше кислотность. Кроме того, основной оксид растворим в воде, кислотный оксид не растворим в воде. Это можно использовать для различения кислотного и основного оксида.
$\endgroup$
2
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Кислоты и основания — свойства, определяющие силу кислоты
Самые горячие новые тенденции для кислот
До сих пор мы видели несколько определений кислоты, наиболее популярным из которых является определение Бренстеда-Лоури, которое говорит нам, что кислота переносит протон. . Мы также рассмотрели примеры сильных и слабых кислот и их равновесие в воде. До этого раздела мы могли определить относительную силу кислоты, зная ее константу кислотной диссоциации: чем больше константа кислотной диссоциации, тем сильнее кислота.
В духе того, чтобы все было по-настоящему и честно, наверное, лучше просто запомнить несколько кислот (и оснований), которые мы уже рассмотрели, и определить, сильные они или слабые. Если вы что-то забудете, мы поговорим о свойствах, определяющих силу кислоты, в этом разделе — это может помочь вам, если вы окажетесь в рассоле.
Периодическая таблица — это карта сокровищ химии. Возможно, в нем не спрятан горшок с золотом, но он может помочь вам пройти следующее испытание. Мы будем ссылаться на него в этом руководстве, чтобы помочь предсказать силу кислоты.
Возможно, в нем не спрятан горшок с золотом, но он может помочь вам пройти следующее испытание. Мы будем ссылаться на него в этом руководстве, чтобы помочь предсказать силу кислоты.
Двумя важными предикторами силы кислоты являются сила связи H-A и полярность связи H-A. Оба свойства могут быть сопоставлены с периодической таблицей и следовать определенным тенденциям.
Прочность связи и кислоты
Рассмотрим прочность галогена (группа 7), содержащего кислоты HF, HCl, HBr и HI.
Прочность связи кислоты обычно зависит от размера атома «А»: чем меньше атом «А», тем прочнее связь Н-А. При движении вниз по строке Периодической таблицы (см. рисунок ниже) атомы становятся больше, поэтому прочность связей ослабевает, а это означает, что кислоты становятся сильнее. Для галогенсодержащих кислот, указанных выше, HF имеет самую прочную связь и является самой слабой кислотой. Сильная связь между атомами «H» и «F» более похожего размера не хочет разрываться и позволяет «H» передаваться.
HI, с другой стороны, является очень сильной кислотой. Большой атом «I» подавляет беспомощный маленький «H», и связь H-I очень слаба. Следовательно, HI является отличным переносчиком протонов и чертовски кислотой ( K a ~ 10 9 M).
Полярность связи и кислоты
При сравнении кислот, имеющих атомы «А» в одном ряду, различия в полярности связи более важны для определения силы кислоты. Это связано с тем, что разница в силе связи между атомами, расположенными рядом друг с другом в одном ряду, намного меньше.
Полярность связи во многом определяется разницей электроотрицательностей между двумя атомами, участвующими в связи. Электроотрицательность — это в основном то, насколько атом хочет электронов. Думайте об электроотрицательности как о мере электронного сжатия атома. Да, мы говорим о любви бойз-бэнда. Для связей, в которых участвуют атом, который сильно увлечен электронами, и атом, который просто не чувствует любви электронов, связь имеет тенденцию быть действительно полярной. Электроны отвечают взаимностью на столкновение и идут к атому, который нравится им больше всего. Разве это не мило?
Электроны отвечают взаимностью на столкновение и идут к атому, который нравится им больше всего. Разве это не мило?
Связь фтористоводородной кислоты (HF) полярна, потому что F действительно любит электроны. Давайте сравним это с CH 4 . Углерод находится в том же ряду, что и фтор (см. рисунок выше), но HF является гораздо более сильной кислотой, чем CH 4 . Связи C-H неполярны по сравнению со связью H-F. CH 4 — очень слабая кислота.
Вот еще один класс кислот, сила которых также предсказуема на основании периодической таблицы: оксокислоты. Они имеют общую формулу H n YO m .
Некоторые реальные примеры: H 2 CO 3 , H 2 PO 4 и HNO 3 . Эти кислоты содержат связь O-H, которая диссоциирует с образованием иона гидроксония и сопряженного основания:
( Примечание: В этом разделе, когда мы говорим «атом Y», мы не имеем в виду иттрий.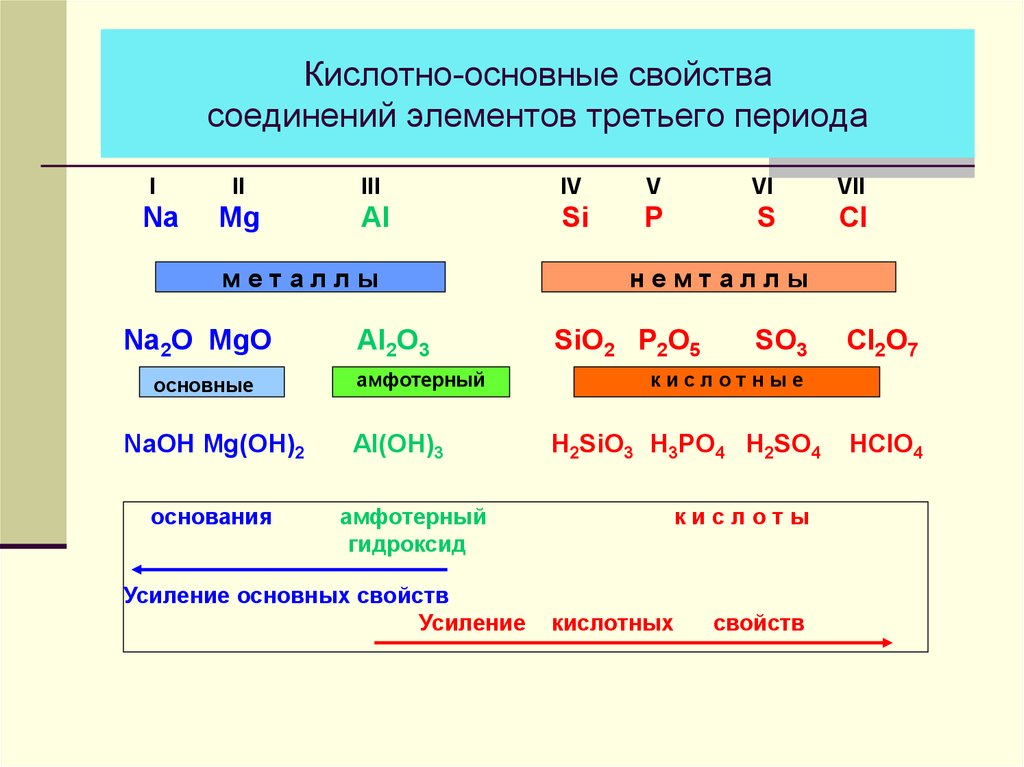 Мы используем Y вместо элемента.)
Мы используем Y вместо элемента.)
Чем сильнее кислота, тем более благоприятна правая сторона равновесия. Чем больше атом Y способен стабилизировать Y-O — отрицательно заряженный продукт в правой части равновесия, тем сильнее будет кислота.
Если Y имеет сильное столкновение с электронами (сильно электроотрицательный), он будет счастлив оказаться на правильной стороне равновесия. Это потому, что в молекуле с правой стороны равновесия больше электронов. Несмотря на то, что Y не получает все электроны себе, он все же получает некоторое удовлетворение от того, что знает, что соседний атом кислорода наслаждается ими. Разве это не мило?
В целом, чем более электроотрицательным является атом Y, тем лучше он может стабилизировать продукт Y-O — и тем сильнее будет кислота. Ряд гипогалоидной кислоты хорошо справляется со своей задачей, показывая увеличение силы кислоты с увеличением электроотрицательности атома Y (в данном случае атома галогена).
Всякий раз, когда связь O-H ослабевает, кислота становится сильнее. В приведенном выше примере связь O-H ослабляется за счет увеличения электроотрицательности атома Y. Думайте об атоме Y как об электронном пылесосе, который высасывает электроны из связи O-H, чтобы они больше не делились с протоном и не оказывались на молекуле сопряженного основания. Чем сильнее вакуум вытягивает электроны из связи, тем сильнее будет кислота.
Тот же принцип справедлив для кислот, содержащих один и тот же атом Y, но разное количество атомов кислорода. Атомы кислорода также подобны электронным пылесосам. Они ослабляют связь ОН через центральный атом Y и стабилизируют отрицательно заряженный продукт. В результате, чем больше атомов кислорода присоединено к центральному атому Y, тем сильнее кислота H n YO m .
Ряд оксокислот хлора иллюстрирует то, что мы имеем в виду:
Увеличение числа атомов кислорода, присоединенных к центральному атому, также увеличивает степень окисления центрального атома.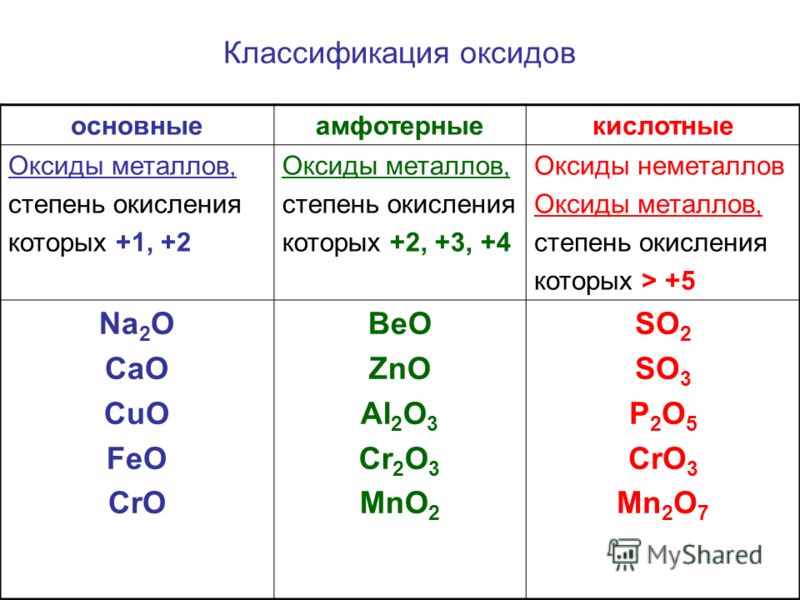 Высокие степени окисления центрального атома представляют собой положительный заряд этого атома.
Высокие степени окисления центрального атома представляют собой положительный заряд этого атома.
Поскольку противоположные заряды притягиваются, очень положительный центральный атом будет сильнее притягиваться к отрицательному заряду неподеленной пары электронов на соседнем атоме кислорода. Чтобы соседний кислород получил заветную неподеленную пару электронов, он переносит протон и действует как кислота.
Хотя приведенные выше тенденции и примеры будут полезны, вы неизбежно столкнетесь с инопланетными молекулами. Напоминает старый фильм Спилберга. Когда нам нужно сравнить кислотность молекул, которых мы раньше не видели, попытайтесь определить, сколько электронных пылесосов (если они есть) на молекуле. Эти «пылесосные» атомы обычно имеют высокую электроотрицательность, например кислород. Эти атомы стабилизируют неподеленную пару электронов, которая обычно возникает, когда кислота переносит протон. Чем лучше молекула может стабилизировать дополнительные электроны, тем сильнее она будет как кислота.

 6+}&\text{кислая}\\\hline
\конец{массив}
$$ 9{-}})$.
6+}&\text{кислая}\\\hline
\конец{массив}
$$ 9{-}})$.
Leave A Comment