1.3.3. Водородные связи
Присутствие в молекулах атомов сильно электроотрицательных элементов (таких, как фтор, кислород, азот), связанных с атомом водорода, приводит к значительному возрастанию дефицита электронной плотности на этом атоме водорода и увеличению положительного заряда на нём. Такой атом водорода способен принимать неподелённую пару электронов на частично вакантную орбиталь. В результате возникает слабая связь особого типа, называемая водородной связью. Например, для фтороводорода и воды:
Аналогично воде для спиртов характерно образование межмолекулярных водородных связей. В результате такого взаимодействия из молекул спирта, как и из молекул воды, образуются димеры, тримеры и, в конечном итоге, полимеры:
Водородная связь менее прочна, чем обычные ковалентные связи. Энергия образования водородной связи обычно не превышает 20—30 кДж/моль.
Образование
водородных связей, например, ответственно
за аномально высокие температуры кипения
спиртов по сравнению с соответствующими
алканами и галогеналканами.
Для карбоновых кислот характерно образование прочных межмолекулярных водородных связей:
Поэтому температуры кипения и плавления у них более высоки по сравнению с соответствующими альдегидами и спиртами. За счёт таких связей димеры карбоновых кислот существуют даже в парáх.
В молекулах таких соединений, как альдегиды, кетоны, простые эфиры, отсутствуют сильно полярные связи С–Н, но за счёт наличия атомов с неподелёнными парами электронов возможно образование водородных связей, например, между молекулами эфира и воды:
Это
влияет на их растворимость в воде —
простые эфиры значительно лучше
растворимы, чем незамещённые углеводороды.
Водородная связь может возникать между атомами одной и той же молекулы. Например, для салицилового альдегида или этиленгликоля:
салициловый альдегид этиленгликоль
Это влияет не только на свойства соединений (физические и химические), но и на конформацию молекулы (гл.1.7.3) и должно благоприятствовать одной из нескольких возможных различных конформаций.
Реакционная способность веществ, механизм и направление реакции в значительной степени зависят от распределения электронной плотности в реагирующих молекулах. Химическая реакция по существу сводится к перераспределению электронной плотности.
По полярности ковалентной связи все вещества можно разделить на две группы: с неполярными связями типа А
 На одном из атомов
возникает частичный положительный (+)
заряд, а на другом — частичный отрицательный
(—).
Такое распределение зарядов в молекуле
обычно обозначают А+:B—.
На одном из атомов
возникает частичный положительный (+)
заряд, а на другом — частичный отрицательный
(—).
Такое распределение зарядов в молекуле
обычно обозначают А+:B—.Индуктивный (индукционный) эффект — смещение поделенной пары электронов —связи. Вызван различием в электроотрицательности атомов. Смещение происходит в сторону более электроотрицательного атома или от более электроположительного (отсюда название от латинского
По
отношению к атому углерода более
электроотрицательные, чем углерод,
атомы и атомные группировки вызывают
электроноакцепторный (или просто
акцепторный, или отрицательный)
индуктивный эффект. Он обозначается
буквой I со знаком «–» (минус), то есть «–I-эффект».
И наоборот, менее электроотрицательные,
чем углерод, атомы и атомные группировки
вызывают электронодонорный (положительный)
индуктивный эффект; обозначается
«+I-эффект».
–I-эффект +I-эффект
Индуктивный эффект, вызываемый атомом водорода, принят равным нулю. Индуктивный эффект насыщенных углеводородных заместителей считается поэтому положительным по отношению к рассматриваемому атому углерода.
I = 0 +I-эффект
Чем больше электроотрицательность заместителя, тем сильнее выражен его акцепторный эффект, тем больше величина отрицательного индуктивного эффекта этого заместителя (по модулю). По силе акцепторного индуктивного эффекта заместители можно расположить в следующий ряд:
—NО2 > -CN > -F > -Cl > -Br > -I > -COOH > —ОН > —NH2
И,
наоборот, чем меньше электроотрицательность
заместителя, тем сильнее выражен его
электронодонорный эффект, тем больше
величина положительного индуктивного
эффекта заместителя.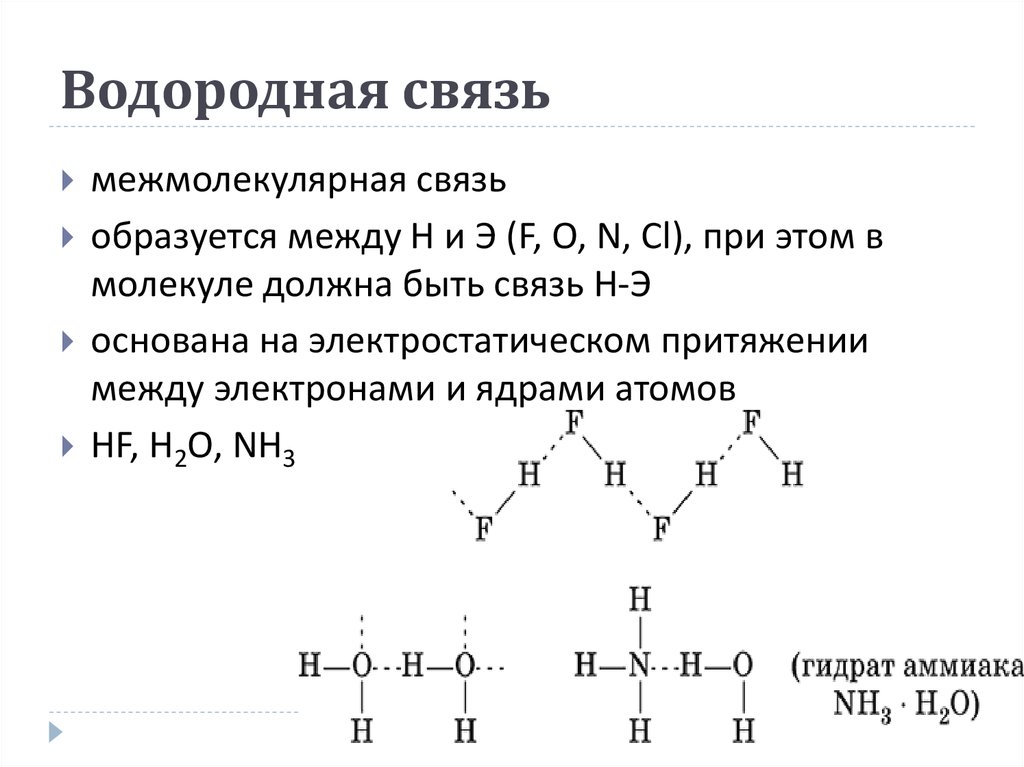 По силе донорного
индуктивного эффекта заместители можно
расположить в следующий ряд:
По силе донорного
индуктивного эффекта заместители можно
расположить в следующий ряд:
—CH3 < —C2H5
Положительный индуктивный эффект вызывает увеличение на атоме углерода электронной плотности и, соответственно, возникновение частичного отрицательного (—) заряда, а отрицательный индуктивный эффект вызывает уменьшение электронной плотности и возникновение частичного положительного (+) заряда.
Индуктивный эффект обладает двумя важными свойствами.
1).
Он распространяется по всем —связям
молекулы, и его величина быстро ослабевает
вдоль цепи (примерно в 3 раза при передаче
через один атом углерода), так что на
четвертом—пятом атоме углерода он
почти не чувствуется.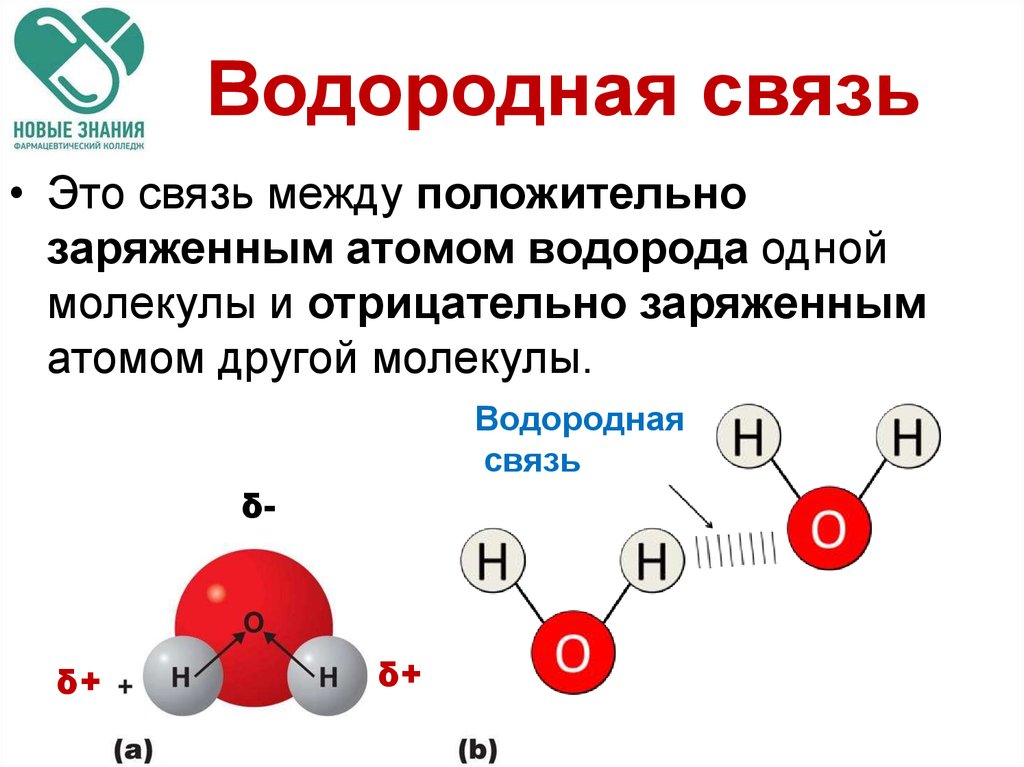
2). Индуктивный эффект обладает способностью к суммированию (аддитивности). Например, суммарный индуктивный эффект заместителя —C(CH3)3 равен
Iобщ
то есть общий индуктивный эффект равен сумме индуктивных эффектов концевых метильных групп (3I(CH3)), умноженной на коэффициент затухания (K), и эффекту самой метильной группы, через которую происходит передача.
Другой
пример. В хлорметане атом хлора оказывает
индуктивное воздействие на углерод в
силу большей электроотрицательности: CH3Cl. В дихлорметане ClCH2Cl суммарный индуктивный эффект, оказываемый
двумя атомами хлора, будет значительно
больше, чем в хлорметане (но не в два
раза).
Мезомерный эффект связан со смещением электронов р-орбиталей, в том числе и электронов —связей. Сказанное можно проиллюстрировать следующим примером. Известно, что полярность двойной связи углерод—кислород (2.4D) больше, чем полярность связи углерод—фтор (1.39D), несмотря на то, что фтор электроотрицательнее кислорода.
>
Это вызвано смещением электронов не только -связи, но и
и
образование системы сопряжённых —связей
за счёт взаимодействия (связывания,
сопряжения) р-орбиталей,
образующих эти —связи. При этом мезомерный эффект передаётся
по цепи углеродных атомов практически
без изменений, то есть он не ослабевает.
Обозначают мезомерный эффект буквой
«М» («+М-эффект»
или «–М-эффект»,
в зависимости от направления — донорный
или акцепторный).
При этом мезомерный эффект передаётся
по цепи углеродных атомов практически
без изменений, то есть он не ослабевает.
Обозначают мезомерный эффект буквой
«М» («+М-эффект»
или «–М-эффект»,
в зависимости от направления — донорный
или акцепторный).
В зависимости от структурной и электронной природы различают несколько типов сопряжённых систем. Перераспределение —электронной плотности в этих системах и есть проявление мезомерного эффекта. Рассмотрим некоторые из них.
1. Полярная —-сопряжённая система.
Происходит
сопряжение двух —связей,
одна из которых поляризована наличием
гетероатома (например, кислорода), и
смещение —электронов
в сторону более электроотрицательного
атома. При крайнем (полном) смещении
пары электронов к атому кислорода на
нём локализуется отрицательный заряд
и, соответственно, на другом конце
сопряжённой системы — положительный
заряд (р-орбиталь
остаётся пустой, вакантной).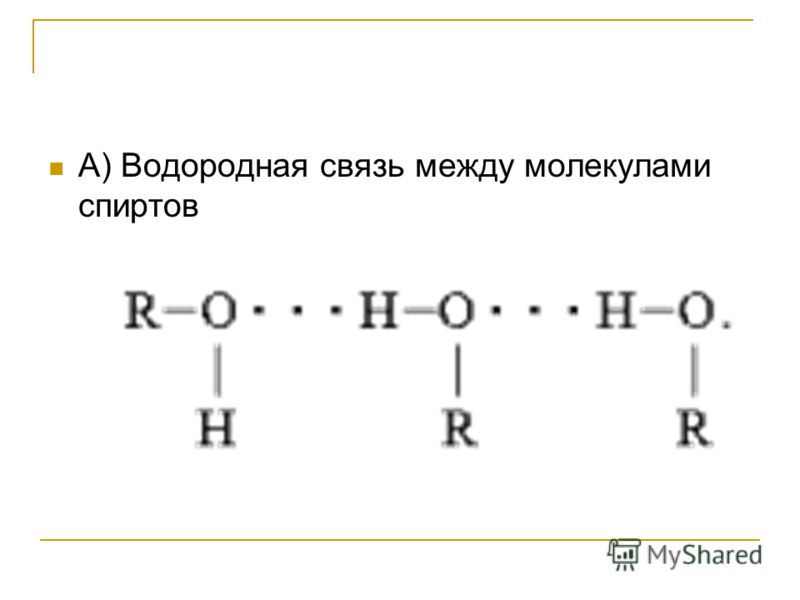 Такая
структура (с разделенными целочисленными
зарядами) является граничной:
Такая
структура (с разделенными целочисленными
зарядами) является граничной:
В этом примере атом кислорода (и вся С=О группа) обладает акцепторным (а значит, отрицательным) мезомерным эффектом (–М-эффект).
Обратите внимание, что для обозначения взаимосвязи между каноническими формами используется обоюдонаправленная стрелка, которую не следует путать с совокупностью двух противоположно направленных стрелок. Последние используются для обозначения взаимосвязи между двумя структурами, находящимися в равновесии, а резонансные формы не существуют по отдельности и не находятся в равновесии одна с другой.
2. Неполярная --сопряжённая система.
Здесь
также происходит сопряжение двух
—связей.
Они могут быть неполярными либо могут
обладать незначительной полярностью,
но быть легко поляризуемы. При этом под
воздействием растворителя или другого
внешнего фактора электронная плотность
смещается либо на один конец сопряжённой
системы, либо на другой.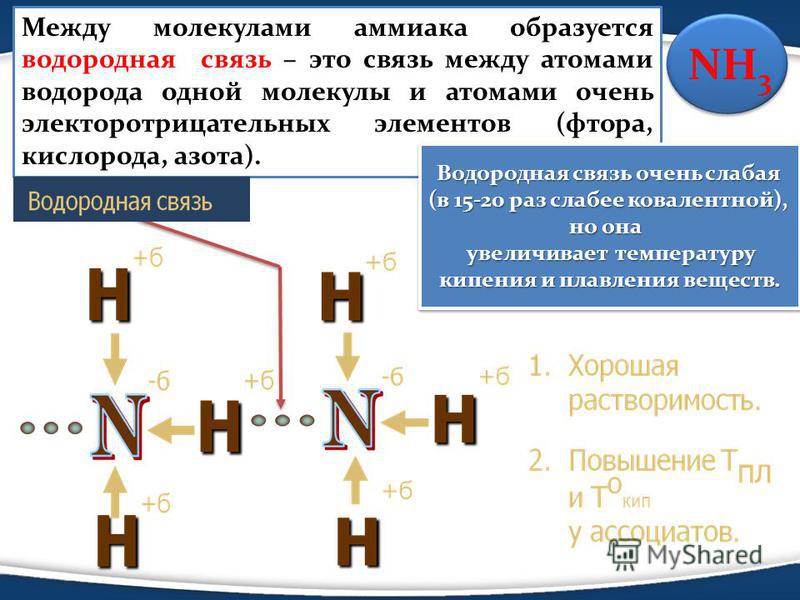 Это можно описать
при помощи граничных структур:
Это можно описать
при помощи граничных структур:
3. р--Сопряжённая система.
В образовании такой сопряжённой системы принимают участие электроны —связи и неподелённая пара электронов на р-орбитали соседнего атома. При перекрывании этой р-орбитали с р-орбиталями —связи происходит перераспределение электронной плотности (более равномерное её распределение между р-орбиталями). При полном смещении неподелённой пары электронов от гетероатома и образовании за её счёт новой —связи (граничная структура) на гетероатоме возникает положительный заряд, а на другом конце сопряжённой системы — отрицательный заряд:
Это пример проявления атомом хлора донорного (а значит, положительного) мезомерного эффекта (+М-эффект).
4. --Сопряжённая система.
Здесь
происходит сопряжение р-орбиталей
—связи
с орбиталями —связи С–Н соседнего
атома углерода (тетраэдрического). Под
влиянием трёх —связей С–Н -связь
подвергается поляризации, становится
более полярной. В свою очередь, атомы
водорода в метильной группе приобретают
большую подвижность, то есть связи С–Н также
поляризуются. Этот процесс в предельном
случае завершается полным переносом
электронной пары как —связи,
так и -связи:
Под
влиянием трёх —связей С–Н -связь
подвергается поляризации, становится
более полярной. В свою очередь, атомы
водорода в метильной группе приобретают
большую подвижность, то есть связи С–Н также
поляризуются. Этот процесс в предельном
случае завершается полным переносом
электронной пары как —связи,
так и -связи:
Но так как в образовании таких связей принимают участие sp3—гибридные орбитали углерода, то оси этих орбиталей не могут быть параллельны осям р-орбиталей —связи, и поэтому перекрывание орбиталей не может быть полным. Такое сопряжение значительно менее эффективно, чем другие виды сопряжения (рассмотренные ранее).
-р-Сопряжённая система.
В
этом случае в сопряжении участвуют
-связь С–Н и р-орбиталь
соседнего атома углерода, не принимающая
участие в образовании —связи. Например, для свободного радикала:
Например, для свободного радикала:
В общем случае в -- и -р-сопряжении принимает участие —связь С–Н по причине малого размера атома водорода и высокой поляризуемости этой связи. Такие виды сопряжения называются сверхсопряжением (или гиперконъюгацией).
Однако известны случаи -- и -р-сопряжения, в которых принимают участие не С–Н-связи, а связи С–F. В этих случаях под влиянием сильно электроотрицательного фтора наблюдается эффект обратного сверхсопряжения (обратной гиперконъюгации). Например, для -р-сопряжения:
Водородная связь | CHEMEGE.RU
Рассмотрим взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не образуются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
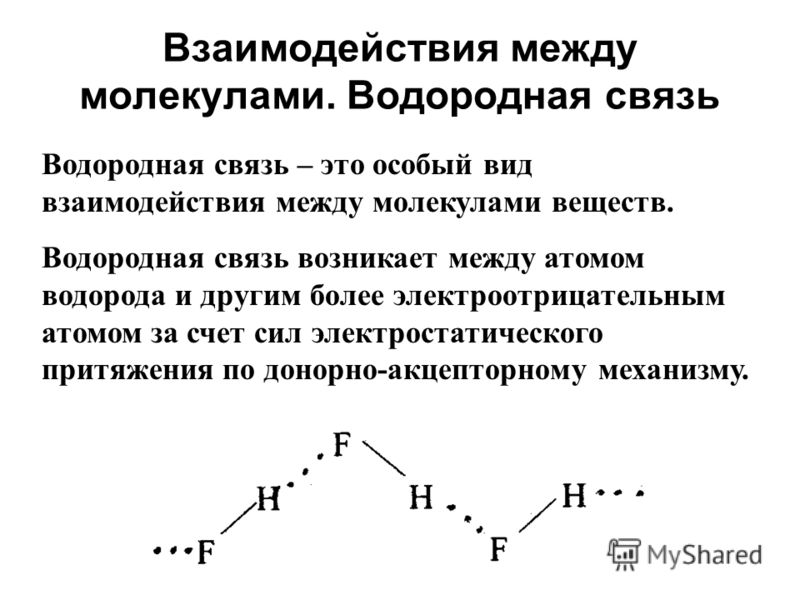
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
- фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота),
- вода H2O (пар, лед, жидкая вода):
- раствор аммиака и органических аминов — между молекулами аммиака и воды;
- органические соединения, в которых есть связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.

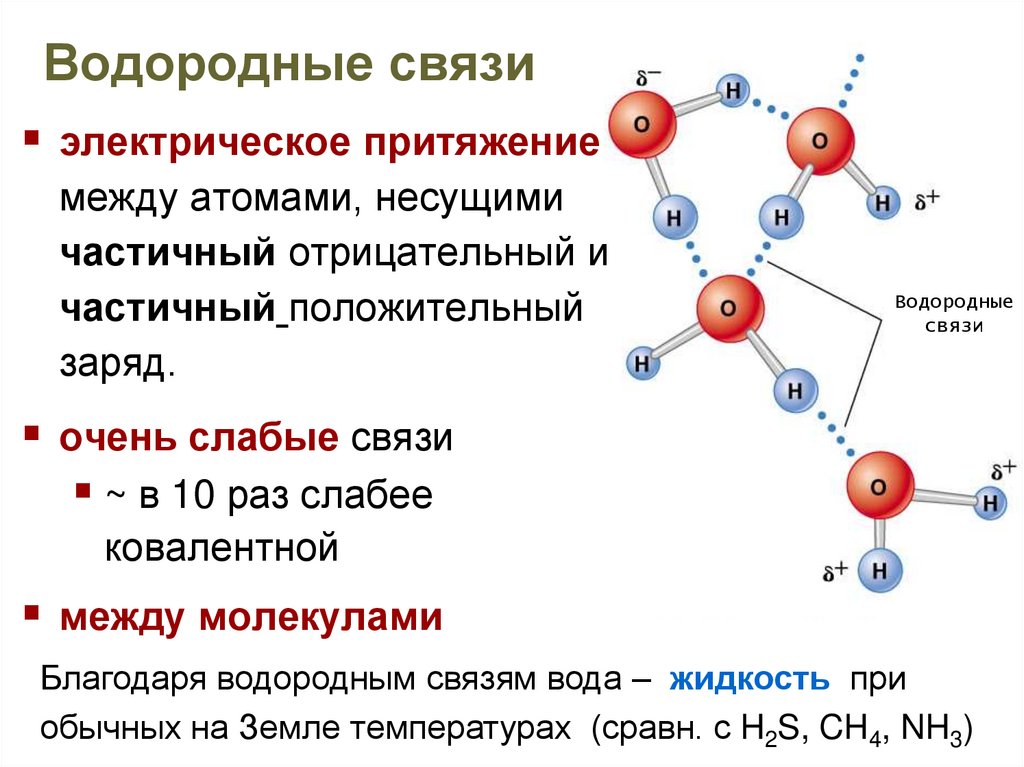
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью.
Понравилось это:
Нравится Загрузка…
Связывание и межмолекулярные силы – Ответы на практические вопросы – Химия
Простые молекулы
1: Нарисуйте диаграммы точка-кросс для i) PH 3 , ii) CS 2 ), , 6 iii) 0 BF 90 005 2
2: Нарисуйте диаграмму для иона H 3 O +
3: Озон и трехокись серы также имеют дательные связи. Нарисуйте диаграмму точка-кросс для
Нарисуйте диаграмму точка-кросс для
i) O 3 , ii) SO 3 . (Обратите внимание, что сера в SO 3 имеет расширенный октет)
4: Предскажите формы и валентные углы в:
i) дихлорид серы (SCl2) нелинейный 104,5° ii) силан (Sih5) тетраэдрический 109,5° iii) сероуглерод (CS2) линейный 180° iv) трехокись серы (SO3) тригональная плоскость 120° v) озон (O3) нелинейный 117,5° 9Межмолекулярные силы ) Ar, Ne, He , поскольку лондонские силы увеличиваются с увеличением числа электронов в атомах
ii) фторметан, хлорметан, бромметан, поскольку лондонские силы увеличиваются с увеличением числа электронов в атоме галогена, учитывая, что остальная часть молекулы остается одинаковым в каждом случае
7: Рассмотрим ряд молекул CH 4 , CH 3 Cl, CH 2 Cl 2 , CHCl 3 и CCl 4
90 из которых полярные связи? Ответ: все, кроме CH 4
ii) Какая из этих молекул полярна? Ответ: CH 3 Cl, CH 2 Cl 2 и CHCl 3
N.
B. CCl 4 имеет полярные связи, но симметрично расположенные вокруг центрального атома углерода, поэтому диполи компенсируют друг друга, не оставляя общего диполя.
8: Объясните, почему ион аммония содержит полярные связи, но не имеет полного диполя
N и H имеют разную электроотрицательность, поэтому связи полярны. Тетраэдрическая форма иона аммония означает, что диполи уравновешены симметрично вокруг ионов, поэтому общего диполя нет.
9: Расположите следующие группы веществ по порядку, начиная с самой высокой температуры кипения.
i) бутан ii) метилпропан iii) 1-хлорбутан iv) 2-хлорметилпропан
Ответ: iii) Постоянный диполь-диполь, более сильные лондонские силы (линейная форма)
iv) Постоянный диполь-диполь, более слабые лондонские силы (меньше площадь контакта с поверхностью)
900 i 41 диполь, более сильные лондонские силы (линейная форма)
ii) Нет постоянного диполь-диполя, более слабые лондонские силы (меньшая площадь поверхностного контакта)
10: Какой основной тип взаимодействия между молекулами в:
I) Бутанон Анс: Постоянный диполь-диполь (C = O-полярная связь)
II) Пентен Ответ: Лондонские силы (без полярных облигаций)
11: Объясните, почему у Пентана Б.
П. 36°C, в то время как 2-метилбутан имеет т.кип. 28°C
Ответ: Это изоэлектронные молекулы. Молекулы пентана неразветвленные, менее сферические - площадь контакта с поверхностью больше и, следовательно, силы Лондона сильнее, чем у разветвленного 2-метилбутана.
12: Нарисуйте диаграмму, иллюстрирующую водородные связи в аммиаке
На вашей диаграмме должны быть показаны как минимум ДВЕ молекулы аммиака, где:
- δ+ на каждом атоме H и δ- на каждом атоме N
- неподеленная пара на каждый атом N
- водородная связь (заштрихованные линии) между H одной молекулы и неподеленной парой атома N другой молекулы.
13: Расположите следующие молекулы в порядке возрастания температуры кипения:
Самый низкий: CH 4 Только лондонские силы
CH 2 o Лондонские силы и постоянные диполь-диполи
Высшие: CH 3 Ох лондонский сил, постоянные диполи и 415 3
OH London Force, постоянные диполь и 41419 3 OH London, постоянные диполь и 4141919 связывание14: Сравните межмолекулярные силы в аммиаке, NH 3 , и гидразине, N 2 H 4 , и предположите, что будет иметь самую высокую температуру кипения.
Ответ: Гидразин имеет более высокую температуру кипения, чем аммиак. Оба имеют водородную связь (и постоянные диполь-дипольные силы, и силы Лондона), но гидразин может образовывать больше водородных связей, потому что у него есть два атома N, каждый с неподеленной парой, в то время как у аммиака есть только одна.
Нравится:
Нравится Загрузка...
Домашнее задание по химии 1
Домашнее задание по химии 1Страница домашнего задания по химии II, экзамен 1, материал
Страница домашнего задания без видимых ответов
На этой странице есть все необходимые домашние задания по материалу первого экзамена второго семестра по общей химии. Учебником, связанным с этим домашним заданием, является ХИМИЯ Центральная наука Брауна, ЛеМэя и др. Последним изданием, которое я потребовал от студентов, было издание 12 th («ХИМИЯ. Центральная наука», 12-е изд. Брауна, Лемея, Берстена, Мерфи и Вудворда), но для этого курса подойдет любое издание этого учебника.
Примечание. Вы ожидаете, что дойдет до конца задач в главах вашего учебника, найдет похожие вопросы и решит эти задачи. Это всего лишь необходимый список задач для целей викторины. Вы также должны изучить упражнения в главах. Упражнения представляют собой отработанные примеры вопросов в конце главы. В учебном пособии также проработаны примеры.
Это голые вопросы. Вопросы из учебника будут содержать дополнительную информацию, которая может оказаться полезной и свяжет задачи с приложениями в реальной жизни, многие из которых относятся к биологии.
Межмолекулярные взаимодействия, жидкости и твердые тела (главы одиннадцатая и двенадцатая)
- Что понимают под молекулой, имеющей диполь?
Ответ
- Электроны сместились на одну сторону молекулы.
- У кого будет самый сильный диполь (а) F 2 или HF, (б) CH 3 Cl или CH 3 Br?
Ответ
(а) ХФ
(б) СН 3 Класс
- Что более поляризуемо? (a) Cl 2 или I 2 , (b) C 2 H 6 или C 10 H 22 ?
Ответ
- (а) I 2 (б) С 10 Н 22
- Этанол, C 2 H 5 OH, имеет температуру кипения 78 °C, тогда как пропанол, C 3 H 7 OH, имеет температуру кипения 97°С.
Полностью объяснить.
Ответ
- Пропанол больше и будет иметь больше лондонских дисперсионных сил, что дает ему более сильные межмолекулярные силы и требует больше энергии для разделения молекул. Пропанол также имеет большую массу, и это также требует больше энергии для их перемещения и разделения. Оба они будут способствовать более высокой температуре кипения пропанола.
- Пропанол, CH 3 CH 2 CH 2 OH, имеет температуру кипения 97°С. Замена конца CH 3 на OH дает этиленгликоль HOCH 2 CH 2 OH с температурой кипения 197 °C. Массы одинаковые, так почему же температура кипения этиленгликоля намного выше, чем температура кипения пропанола?
Ответ
- Этиленгликоль может образовывать водородные связи на обоих концах молекулы, что приводит к гораздо более сильным межмолекулярным силам и более высокой температуре кипения.
- Какой из следующих материалов, вероятно, имеет (а) не диполь-дипольные силы, но самые большие лондоновские дисперсионные силы, (б) самые большие диполь-дипольные межмолекулярные силы: I 2 , He, H 2 S, H 2 Te.
Ответ
- (а) I 2 , это самая большая неполярная молекула. (б) H 2 S, S является более электроотрицательным и сделает молекулу более полярной.
- Какие силы притяжения необходимо преодолеть, чтобы (а) возвысить At 2 ; (b) испарить C 2 H 5 F; (c) кипятить фтористый водород, HF; (d) расплавить LiBr? Объяснять.
Ответ
- (а) Неполярные - Лондонские дисперсионные силы. (b) Полярное - диполь-дипольное притяжение (и дисперсионные силы). (c) Очень полярный – водородные связи между молекулами. Водородные связи образуются, когда водород ковалентно связан с N, O или F. (г) Молекул нет, значит, нет межмолекулярных сил – ионных связей.
- Объясните разницу температур кипения членов следующих пар веществ (обязательно включите все соображения):
- NH 3 (-33,35 °C) и PH 3 (-87,7 °C)
Ответ
- В зависимости от полярности более полярный аммиак, NH 3 , должен труднее кипеть (что и есть).
Согласно массе аммиака, NH 3 , должно легче кипеть (но это не так). В этом случае эффект полярности больше, чем эффект массы.
- PH 3 (-87,7 °C) и AsH 3 (-55 °C)
Ответ
- PH 3 более полярен (P ближе к F), а AsH 3 имеет большую массу. По полярности АШ 3 должен кипеть при более низкой температуре, а по массе РН 3 должен кипеть при более низкой температуре. В этом случае эффект массы больше, чем эффект полярности.
- HCl (-85 °C) и HBr (-66 °C)
Ответ
- HCl более полярен, но увеличенная масса HBr дает ему более высокую температуру кипения.
- Br 2 (58,78 °С) и I 2 (184,35 °С)
Ответ
- Оба неполярны, но I 2 имеет большую массу и более поляризуем (более сильные межмолекулярные силы), поэтому у него будет более высокая температура кипения.
- HF (19,54 °C) и Ne (-245,92 °C)
Ответ
- Оба имеют примерно одинаковую молекулярную массу, но HF очень полярна, поэтому HF имеет более высокую температуру кипения.
- Какой из следующих материалов, вероятно, имеет (а) не диполь-дипольные силы, но самые большие лондоновские дисперсионные силы, (б) самые большие диполь-дипольные межмолекулярные силы: I 2 , He, H 2 S, H 2 Те.
Ответ
- (а) I 2 , это самая большая неполярная молекула. (б) H 2 S, S является более электроотрицательным и сделает молекулу более полярной.
- Предположим, что жидкий аммиак NH 3 имеет удельную теплоемкость 4,75 Дж/г-C, а газообразный аммиак имеет удельную теплоемкость 2,17 Дж/г-C. Теплота испарения аммиака составляет 23,35 кДж/моль при его температуре кипения 33,4°С. (а) Нарисуйте кривую нагревания для превращения 34 г аммиака из жидкости при -40°С в газ при 0°С. (b) Рассчитайте теплоту, необходимую для превращения, описанного в части (a).
Ответ
- Нормальные температуры плавления и кипения бензола, С 6 H 6 , составляют 5,55 °С и 78,25 °С соответственно (при нормальных температурах плавления и кипения давление равно 1 атм).
Его тройная точка находится при 5,51 ° C и 0,047 атм. Критическая точка находится при 288,95 ° C и 47,9 атм. а) Нарисуйте фазовую диаграмму бензола (не обязательно в масштабе), отметив четыре указанные выше точки и указав область, в которой каждая фаза стабильна. б) Будет ли твердый бензол при нагревании возгоняться или плавиться при давлении 2,5 атм? в) Нарисуйте кривую нагревания твердого бензола до состояния газа при давлении 1,0 атм.
Ответ
- Определите следующие кристаллы (A-E) как ионные, полярно-молекулярные, неполярно-молекулярные, ковалентные (сетчатые) или металлические. Объяснять. В таблице может быть более одного или ни одного из типов кристаллов.


 B. CCl 4 имеет полярные связи, но симметрично расположенные вокруг центрального атома углерода, поэтому диполи компенсируют друг друга, не оставляя общего диполя.
B. CCl 4 имеет полярные связи, но симметрично расположенные вокруг центрального атома углерода, поэтому диполи компенсируют друг друга, не оставляя общего диполя.  П. 36°C, в то время как 2-метилбутан имеет т.кип. 28°C
П. 36°C, в то время как 2-метилбутан имеет т.кип. 28°C
 Полностью объяснить.
Полностью объяснить.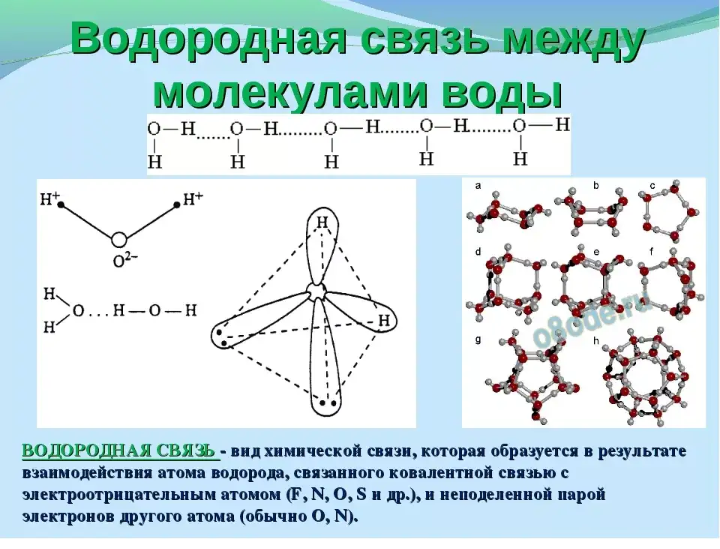
 Согласно массе аммиака, NH 3 , должно легче кипеть (но это не так). В этом случае эффект полярности больше, чем эффект массы.
Согласно массе аммиака, NH 3 , должно легче кипеть (но это не так). В этом случае эффект полярности больше, чем эффект массы.
 Его тройная точка находится при 5,51 ° C и 0,047 атм. Критическая точка находится при 288,95 ° C и 47,9 атм. а) Нарисуйте фазовую диаграмму бензола (не обязательно в масштабе), отметив четыре указанные выше точки и указав область, в которой каждая фаза стабильна. б) Будет ли твердый бензол при нагревании возгоняться или плавиться при давлении 2,5 атм? в) Нарисуйте кривую нагревания твердого бензола до состояния газа при давлении 1,0 атм.
Его тройная точка находится при 5,51 ° C и 0,047 атм. Критическая точка находится при 288,95 ° C и 47,9 атм. а) Нарисуйте фазовую диаграмму бензола (не обязательно в масштабе), отметив четыре указанные выше точки и указав область, в которой каждая фаза стабильна. б) Будет ли твердый бензол при нагревании возгоняться или плавиться при давлении 2,5 атм? в) Нарисуйте кривую нагревания твердого бензола до состояния газа при давлении 1,0 атм.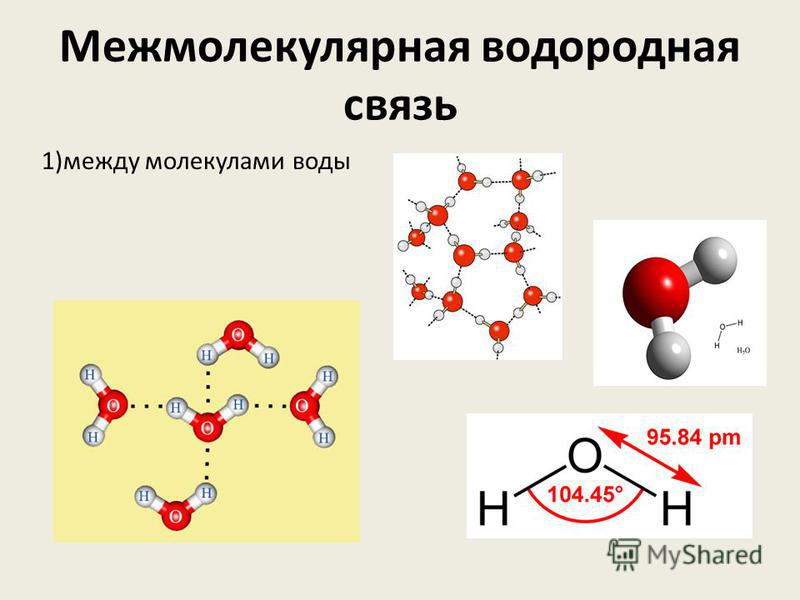 14
14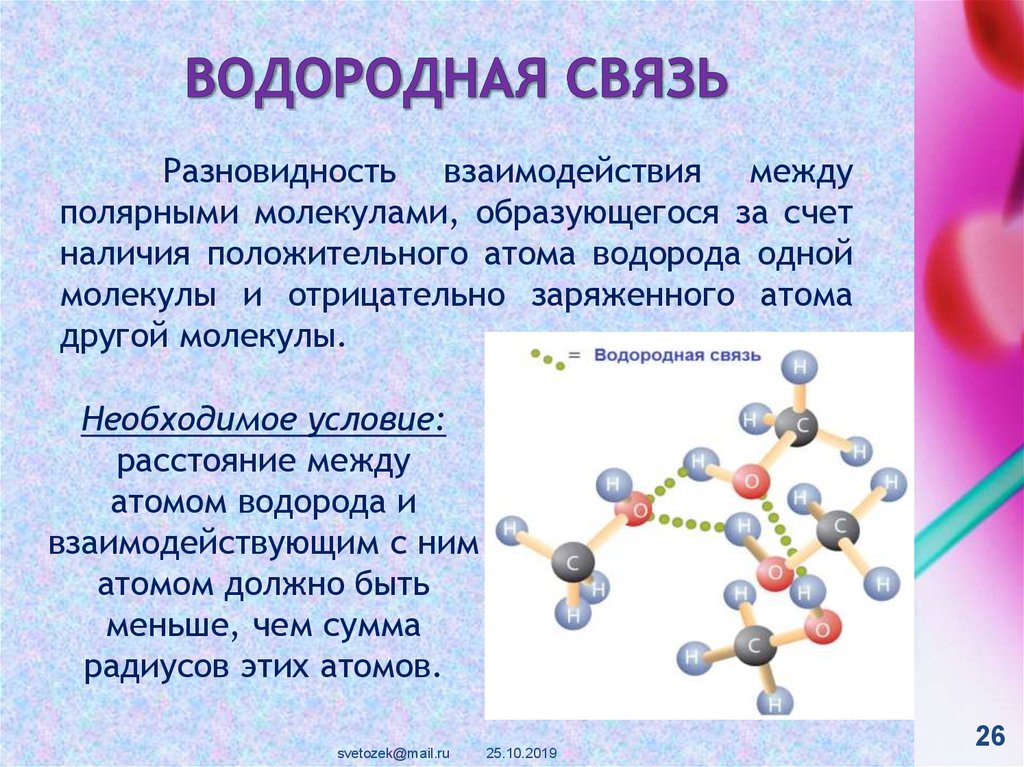 п. и т.п., непроводящие - неполярно-молекулярные. (СО 2 - неполярная молекула)
п. и т.п., непроводящие - неполярно-молекулярные. (СО 2 - неполярная молекула)

Leave A Comment