koh, CuO, Ba(oh)2, Fe2o3, Al2o3, co2, SiO2, h4po4, o2, h3o? Составьте уравнения возможных реакций.
Решение:
Серная кислота не взаимодействует с веществами, имеющими кислотные свойства (H3PO4, CO2, и SiO2), и с кислородом, т.к. она не способна окисляться.
Уравнения возможных реакций:
H2SO4 + 2KOH = K2SO4 + 2H2O
основание
H2SO4 + СuO = CuSO4 + H2O
основной
оксид
H2SO4 + Ba(OH)2, = Ba SO4 + 2H2O
основание
3H2SO4 + Fe2O3 = Fe2(SO4)3+ 3H2O
амфотерный
оксид
3H2SO4 + Al2O3 =
Al
амфотерный
оксид
H2SO4 + KOH = KНSO4 + H2O
2H2SO4 + СuO = Cu(HSO4)2 + H2O
H2SO4
(конц. ) +
nH2O=
H2SO4 ∙
nH2O
) +
nH2O=
H2SO4 ∙
nH2O
олеум
Пример 6. Назовите приведенные здесь кислую, основную соли: Al(OH)2Cl, Ba(HSO3)2. Напишите реакции, с помощью которых их можно превратить в средние соли.
Решение:
Al(OH)2Cl – основная соль, хлорид дигидроксоалюминия
Ba(HSO3)2 – кислая соль, гидросульфит бария
1) Основная соль – та соль, в формуле молекулы которой имеется гидроксид — ион.
2) Кислая соль – та соль, в молекуле которой содержится ион водорода.
3)Средняя соль – молекула такой соли содержит катион металла и кислотный остаток, не содержащий ион водорода.
Основную соль в среднюю превращают добавлением кислоты
Al(OH)2Cl
+ 2HCl
= AlCl3 +
2H2O.
Кислую соль превращают в среднюю действием на нее основания
Ba(HSO3) + Ba(OH)2 = 2BaSO3 + 2H2O.
Пример 7. Написать реакции, с помощью которых можно осуществить следующие превращения:
Al2O3 → KAlO2 → Al(OH)3 → AlOHSO4 → Al2(SO4)3 → Al → Al(NO3)3
Решение:
а) Al2O3+ 2KOH = 2KAlO2
метаалюминат
калия
б) 2KAlO2 + H2SO4 + 2H2O → 2Al(OH)3 + K2SO4
в) Al(OH)3 + H2SO4 = AlOHSO4 + 2H2O
недост. сульфат
гидроксоалюминия
г) 2AlOHSO4 + H2SO4 = Al2(SO4)3 + 2H2O
сульфат
алюминия
д)
Al2(SO4)3 + 3Mg = 2Al + 3MgSO
φºAl3+ | Al = -1,68 B
φºMg2+ | Mg = -2,37 B
Следовательно, магний активнее алюминия и может вытеснить алюминий из его соли:
е) Al + 4HNO3 = Al(NO3)3 + NO + 2H2O
Al – 3e = Al3+ | 1
NO3— + 4H+ + 3e = NO + 2H2O | 1
Пример 8. Напишите
уравнения реакций в молекулярных и
ионо-молекулярных формах гидроксида
натрия со следующими веществами: P
Напишите
уравнения реакций в молекулярных и
ионо-молекулярных формах гидроксида
натрия со следующими веществами: P
Решение:
1) P2O5 + 6NaOH = 2Na3PO4 + 3H2O
P2O5 + 6OH— = 2PO43-+ 3H2O
2) Al(OH)3 + NaOH = Na[Al(OH)4]
амфотер. изб. тетрагидроксоалюминат
натрия
Al(OH)3+ OH— = [Al(OH)4]—
3) CuSO4 + 2NaOH = ↓Cu(OH)2 + Na2
эквивалентные гидроксид
количества меди (II)
Cu2+ + 2OH— = Cu(OH)2
4) PbSO4 + 2NaOH = Na2PbO2 + H2SO4
изб. плюмбит
плюмбит
натрия
PbSO4 +2OH—= PbO22- + SO42-
5) ZnO + 2NaOH = Na2ZnO2 + H2O
гидроксид натрия
ZnO + 2OH— = ZnO22- + H2O
Пример 9. Напишите реакции следующих превращений
Решение:
1) FeSO4 + 2NaOH = ↓Fe(OH)2 + Na2SO4
2) FeSO4 + BaCl2 = FeCl2 + BaSO4↓
3) FeSO4 + Ba(NO3)2 = Fe(NO3)2 + BaSO4↓
Пример 10.
Решение:
Запишем уравнение реакции нейтрализации:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Определяем массу H2SO4, необходимую для нейтрализации:
2ּ 40 г NaOH – 98 г H2SO4
16000 г NaOH – х
Находим массу 10% раствора H2SO4 по формуле ,
Следовательно,
Находим объем раствора H2SO4, необходимый для нейтрализации NaOH:
Классы неорганических соединений | Задачи 149
Задача 149.
Можно ли получить раствор, содержащий одновременно: а) Ва(ОН)2 и HCl; б) СаСI2 и Na2СО3; в) NaCl и AgNO3 ; г) КСI и NaNO3. Указать, какие комбинации невозможны и почему.
Решение:
а) Ba(OH)2 и HCl – сильные электролиты, поэтому в водных растворах диссоциируют полностью:
Находящиеся в растворе ионы Ba
б) Растворимые соли CaCl2 и Na2CO3 как сильные электролиты в водных растворах диссоциируют полностью по схемам:
Ионы Ca2+ и CO3– связываются друг с другом, образуя осадок — не растворимая соль. В растворе останутся ионы Cl– и OH–, которые не связываются друг с другом, молекулами CaCO3 и ионами воды H+ и OH—.
в) NaCl и AgNO3, как сильные электролиты в водных растворах диссоциируют полностью по схемам:
NaCl ⇔ Na+ + Cl-;
AgNO3 ⇔ Ag+ + NO3—.
Ионы Ag+ и Cl— связываются друг с другом, образуя осадок AgCl. В растворе остаются ионы Na+ и NO3—, которые не связываются друг с другом с молекулами AgCl, ионами воды H+ и OH- и не образуют осадок, газ или слабый электролит. Поэтому невозможно получить раствор, содержащий одновременно NaCl и AgNO3, так как выпадает осадок AgCl.
г) КСI и NaNO3 – растворимые соли, которые в водных растворах полностью распадаются на ионы:
KCl ⇔ K+ + Cl—;
NaNO3 ⇔ Na+ + NO3—.
Образовавшиеся ионы K+, Na+, Cl— и NO3— не связываются друг с другом и ионами воды H+ и OH— и не образуют осадок, газ или слабодиссоциируемое вещество. Таким образом, можно получить раствор одновременно содержащий КСI и NaNO3.
Таким образом, можно получить раствор одновременно содержащий КСI и NaNO3.
Задача 150.
Какие из перечисленных кислот образуют кислые соли: HJ, H2Se, H2SeO3, H2C2O4, CH3COOH.
Решение:
Кислые соли образуют многоосновные кислоты, в которых атомы водорода не все замещены на катионы кислоты. Так как кислоты HJ и CH3COOH содержат по одному катиону водорода в составе молекул, то они не могут образовать кислых солей. Кислоты H2Se, H2SeO3, H2C2O4 являются двухосновными кислотами, то они могут образовать кислые соли при замещении одного атома водорода на катион металла. При взаимодействии этих кислот с основаниями, в случае, если кислота взята в избытке, образуется кислая соль, например:
Названия кислых солей образуются, так же как и средних, но при этом добавляют приставку «гидро» и указывают наличие незамещённых атомов водорода, число которых обозначают греческими числительными («ди», «три» и т. д.). Например: NaH2HO4 — дигидроортофосфат натрия; KH2AsO4 – дигидроортоарсенат калия; Mg(HCO3)2 – гидрокарбонат магния.
д.). Например: NaH2HO4 — дигидроортофосфат натрия; KH2AsO4 – дигидроортоарсенат калия; Mg(HCO3)2 – гидрокарбонат магния.
Задача 151.
Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: Р2О5, СО2, N2O5, NO2, SO2?
Решение:
а) При взаимодействии P2O5 с водой могут образоваться различные кислоты, например метафосфорная HPO3 и ортофосфорная H3PO4:
Р2О5 + h3O → 2HPO3;
Р2О5 + 3H2O → 2H3PO4.
б) При пропускании углекислого газа через воду образуется раствор слабой угольной кислоты H2CO3:
CO2 + H2O → H2CO3
в) При растворении N2O5 в воде образуется азотная кислота HNO3 – сильный электролит.
г) при взаимодействии NO2 с водой может быть получена смесь двух кислот азотистой HNO2 и азотной HNO3:
2NO2 + H2O → HNO2 + HNO3
В присутствии избытка кислорода в воде образуется только азотная кислота:
4NO2 + O2 + 2H2O → 4HNO3
д) SO2 хорошо растворим в воде (36 об. ч. SO2 на 1 об. ч. Н2О при 20 0С), при этом образуется сернистая кислота H2SO3 – кислота средней силы:
SO2 + H2O → H2SO3.
Задача 152.
С какими из перечисленных ниже веществ будет реагировать соляная кислота: N2O5, Zn(ОН)2, СаО, AgNO3, Н3РO3, Н2SO4? Составить уравнения реакций.
Решение:
а) Оксид азота (V) N2O5 является кислотным оксидом, поэтому не реагирует с соляной кислотой HCl.
б) гидроксид цинка Zn(ОН)2 является амфотерным основанием, поэтому реагирует как с основаниями, так и с кислотами. Реакция между Zn(ОН)2 и HCl протекает:
Zn(ОН)2 + 2HCl →ZnCl2 + 2H2O
в) Оксид кальция СаО является основным оксидом, поэтому реагирует с соляной кислотой:
CaO + 2HCl → CaCl2 + H2O
г) Нитрат серебра AgNO3 – сильный электролит, который в водных растворах диссоциирует на ионы Ag+ и NO3—, а соляная кислота как электролит распадается на ионы H+ и Cl—. Ионы Ag+ и Cl—, соединяясь, образуют нерастворимую соль AgCl, которая выпадает в осадок. Реакция между нитратом серебра и соляной кислотой протекает по схеме:
AgNO3 + HCl →AgC↓ + HNO3
д) Ортофосфорная кислота Н3РO4, серная кислота H2SO4 и соляная кислота HCl – электролиты, которые в водных растворах распадаются на ионы:
Н3Р04 ⇔ 3H+ + PO43-;
H2SO4⇔ 2H+ + SO42-;
HCl ⇔ H+ + Cl—.
Ионы PO43-, SO42-, H+ и Cl— не связываются друг с другом, не образуют осадок, газ или малодиссоциируемое вещество. Поэтому Н3РO3 и Н2SO4 не реагируют с HCl.
Задача 153.
Какие из указанных веществ реагируют с гидроксидом натрия: HNO3, CaO, CO2, CuSO4, Cd(OH)2, P2O5. Составить уравнения реакций.
Решение:
а) Азотная кислота как кислота вступает в реакцию нейтрализации с основанием NaOH, при этом образуется соль и вода:
HNO3 + NaOH → NaNO3 + H2O
б) Оксид кальция СаО – основной оксид, поэтому не будет реагировать с NaOH – сильным основанием.
в) Оксид углерода (II) СО2 – кислотный оксид, поэтому будет реагировать с гидроксидом NaOH с образованием соли и воды:
CO2 + 2NaOH → NaO3 + H2O
г) CuSO4 и NaOH – сильные электролиты, поэтому в водных растворах распадаются на ионы:
CuSO4 ⇔ Cu2+ + SO42-;
NaOH ⇔ Na+ + OH—
Ионы Cu2+ и OH— связываются друг с другом, образуя осадок из нерастворимого Cu(OH)2. Значит, между CuSO4 и NaOH реакция протекает по уравнению:
Значит, между CuSO4 и NaOH реакция протекает по уравнению:
д) Гидроксид кадмия Сd(OH)2 имеет слабо выраженные кислотные свойства, поэтому в растворе гидроксида натрия высокой концентрации при длительном кипячении образует неустойчивые гексагидроксокадмиат(I) – ионы [Cd(OH)6]4-:
Сd(OH)2 + 4NaOH → Na4[Cd(OH)6]
Оксид фосфора(V) Р2О5 – кислотный оксид, поэтому будет реагировать с раствором гидроксида натрия с образованием соли и воды:
Р2О5 + 6NaOH → 2Na3PO4
Задача 154.
Написать уравнения реакций, свидетельствующих об основных свойствах FeO, Cs2O, HgO, Bi2O3.
Решение:
Оксиды FeO, Cs2O, HgO, Bi2O3 имеют основной характер, поэтому все они растворяются в кислотах с образованием соли и воды:
Задача 155.
Написать уравнения реакций, доказывающих кислотный характер SеО2, SО3, Мn2O7, Р2O5, СrО3.
Решение:
Кислотные оксиды SеО2, SО3, Мn2O7, Р2O5 и СrО3 при взаимодействии с водой образуют соответствующие кислоты. Все они проявляют кислотные свойства, взаимодействуют как с основаниями, так и с основными оксидами:
Задача 156.
Составить уравнения реакций получения хлорида магния: а) действием кислоты на металл; б) действием кислоты на основание; в) действием кислоты на соль.
Решение:
Уравнения реакций получения хлорида магния:
а) Действием кислоты на металл:
Ma + 2HCl → MaCl2 + H2↑
б) Действием кислоты на основание:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
в) Действием кислоты на соль:
MgSO4 + 2HCl → MgCl2 + H2SO4
Задача 157.
Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3, NaHSO4, Na2HPO4, K2S, Fe2(SO4)3.
Решение:
Уравнения реакций образования солей:
Задача 158.
Какие вещества могут быть получены при взаимодействии кислоты с солью? Кислоты с основанием? Соли с солью? Привести примеры реакций.
Решение:
а) При взаимодействии кислоты с солью могут быть получены кислота и соль, а также и другие вещества, например оксиды и вода:
CuS + 10HNO3 → Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
CaF2 + H2SO4 → CaSO4 + 2HF
б) При взаимодействии кислоты с основанием (реакция нейтрализации) образуются соль и вода:
NaOH + HCl → NaCl + H2O;
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O
в) Реакция между солями идёт, если при этом образуется малорастворимое соединение (реакция обмена).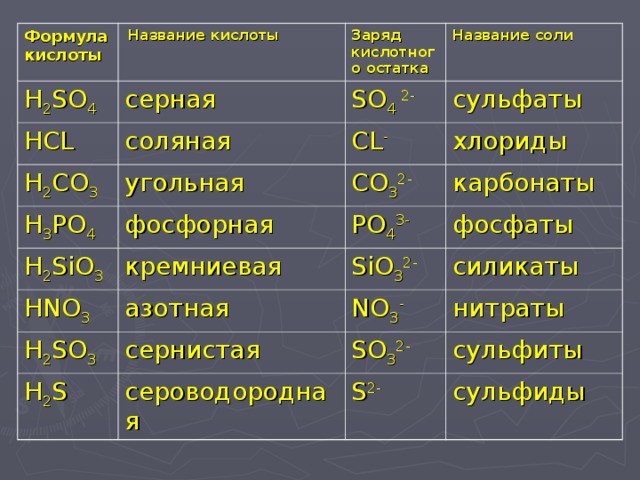 При взаимодействии соли с солью образуются новые соли, одна из них нерастворима:
При взаимодействии соли с солью образуются новые соли, одна из них нерастворима:
AgNO3 + HCl → AgCl↓ + HNO3;
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
7.8: Кислотно-основные реакции и реакции выделения газа
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47510
Цели обучения
- Определить, когда в результате реакции будет выделяться газ.
Реакции нейтрализации
Кислоты и основания химически реагируют друг с другом с образованием солей . Соль — это общий химический термин для любого ионного соединения, образованного кислотой и основанием. В реакциях, где кислота представляет собой соединение, содержащее ион водорода, а основание представляет собой соединение, содержащее ион гидроксида, вода также является продуктом. Общая реакция выглядит следующим образом:
В реакциях, где кислота представляет собой соединение, содержащее ион водорода, а основание представляет собой соединение, содержащее ион гидроксида, вода также является продуктом. Общая реакция выглядит следующим образом:
\[\text{кислота + основание} → \text{вода + соль} \nonumber \]
Реакция кислоты и основания с образованием воды и соли называется нейтрализация . Как и любое химическое уравнение, химическое уравнение нейтрализации должно быть правильно сбалансировано. Например, реакция нейтрализации между гидроксидом натрия и соляной кислотой выглядит следующим образом:
\[\ce{NaOH (водн.) + HCl (водн.) \rightarrow NaCl (водн.) + H_2O (л)} \label{Eq2} \ ]
с коэффициентами, которые все считаются равными единице. Реакция нейтрализации между гидроксидом натрия и серной кислотой выглядит следующим образом:
\[\ce{2NaOH (водн.) + H_2SO_4 (водн.) \rightarrow Na_2SO_4 (водн.) + 2H_2O (л)} \label{Eq3} \]
Пример \(\PageIndex{1}\): Нейтрализация азотной кислоты
Азотную кислоту (HNO 3 (водн. )) можно нейтрализовать гидроксидом кальция (Ca(OH) 2 (водн.)). Напишите сбалансированное химическое уравнение реакции между этими двумя соединениями и определите соль, которую она образует.
)) можно нейтрализовать гидроксидом кальция (Ca(OH) 2 (водн.)). Напишите сбалансированное химическое уравнение реакции между этими двумя соединениями и определите соль, которую она образует.
Решение
| Ступени | Пояснение | Уравнение |
|---|---|---|
| Напишите уравнение несбалансированности. | Это реакция двойного замещения, поэтому катионы и анионы меняются местами, образуя новые продукты. | Ca(OH) 2 (водн.) + HNO 3 (водн.) → Ca(NO 3 ) 2 (водн.) + H 2 O(ℓ) |
| Сбалансируйте уравнение. | Поскольку в формуле Ca(OH) 9 присутствуют два иона OH − 0050 2 , нам нужно два моля HNO 3 для получения ионов H + | Ca(OH) 2 (aq) + 2 HNO 3 (aq) → Ca(NO 3 ) 2 (aq) + 2 H 2 O( ℓ) |
Дополнительный шаг: определение соли. | Образующаяся соль представляет собой нитрат кальция. |
Упражнение \(\PageIndex{1}\)
Синильная кислота (\(\ce{HCN(aq)}\)) может быть нейтрализована гидроксидом калия (\(\ce{KOH(aq)}\)). Напишите сбалансированное химическое уравнение реакции между этими двумя соединениями и определите соль, которую она образует.
Ответ
\[\ce{KOH (водн.) + HCN (водн.) → KCN (водн.) + h3O(ℓ)} \номер \]
Реакции выделения газа
Реакция выделения газа является химической процесс, который производит газ, такой как кислород или углекислый газ. В следующих примерах кислота реагирует с карбонатом с образованием соли, углекислого газа и воды соответственно. Например, азотная кислота реагирует с карбонатом натрия с образованием нитрата натрия, двуокиси углерода и воды (таблица \(\PageIndex{1}\)):
\[\ce{2HNO3(aq)+Na2CO3(aq)→2NaNO3(aq)+CO2(g)+h3O(l)} \nonumber \]
Серная кислота реагирует с карбонатом кальция с образованием сульфата кальция , диоксид углерода и вода:
\[\ce{h3SO4(aq) + CaCO3(aq) → CaSO4(aq) + CO2(g)+h3O(l)} \nonumber \]
Соляная кислота реагирует с карбонат кальция с образованием хлорида кальция, диоксида углерода и воды:
\[\ce{2HCl(водн. ) + CaCO3(водн.) → CaCl2(водн.) + CO2(г) + h3O(л)} \номер \]
) + CaCO3(водн.) → CaCl2(водн.) + CO2(г) + h3O(л)} \номер \]
Рисунок \(\PageIndex{1}\) демонстрирует этот тип реакции:
Рисунок \(\PageIndex{1}\): Взаимодействие кислот с карбонатами. В этой реакционной установке известковую воду (вода + гидроксид кальция) наливают в одну из пробирок и закрывают пробкой. В оставшуюся пробирку осторожно приливают небольшое количество соляной кислоты. К кислоте добавляют небольшое количество карбоната натрия и закрывают пробирку резиновой пробкой. Две трубки соединены. В результате кислотно-карбонатной реакции образуется углекислый газ и известковая вода мутнеет. В этой реакционной установке известковую воду, разбавленный раствор гидроксида кальция ( \(Ca(OH)_2\) ), наливают в одну из пробирок и закрывают пробкой. В оставшуюся пробирку осторожно приливают небольшое количество соляной кислоты. К кислоте добавляют небольшое количество карбоната натрия и закрывают пробирку резиновой пробкой. Две трубки соединены. В результате кислотно-карбонатной реакции образуется углекислый газ и известковая вода мутнеет.
| Тип реагента | Промежуточный продукт | Выделившийся газ | Пример |
|---|---|---|---|
| сульфид | нет | \(\ce{h3S}\) | \(\ce{2HCl(водн.) + K2S \rightarrow h3S (г) + 2KCl (водн.)}\) |
| карбонаты и бикарбонаты | \(\ce{h3CO3}\) | \(\ce{CO2}\) | \(\ce{2HCl(водн.) + K2CO2 \rightarrow h3O (л) + CO2(г) + 2KCl (водн. )}\) )}\) |
| сульфиты и бисульфиты | \(\ce{h3SO3}\) | \(\ce{SO2}\) | \(\ce{2HCl(водн.) + K2SO2 \rightarrow h3O (л) + SO2(г) + 2KCl (водн.)}\) |
| аммиак | \(\ce{Nh5OH}\) | \(\ce{Nh4}\) | \(\ce{Nh5Cl(водн.) + KOH \rightarrow h3O (ж) + Nh4(г) + 2KCl (водн.)}\) |
Эксперимент по газовыделению известковой воды показан в следующем видео:
Видео \(\PageIndex{1}\): Двуокись углерода (\(CO_2\)) и известковая вода (химическая реакция) ). По мере протекания реакции известковая вода превращается из прозрачной в молочную; это происходит из-за того, что \(CO_2(g)\) реагирует с водным гидроксидом кальция с образованием карбоната кальция, который лишь немного растворим в воде. +\) восстанавливается до \(H_2(g)\). Окисление металлов сильными кислотами — еще один распространенный пример реакции газовыделения.
+\) восстанавливается до \(H_2(g)\). Окисление металлов сильными кислотами — еще один распространенный пример реакции газовыделения.
Авторы и партнеры
Boundless (www.boundless.com)
Википедия (CC-BY-SA-3.0)
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф. Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…[email protected]).
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- автор@Генри Эгнью
- автор@Мариса Альвиар-Агнью
- источник@https://www.ck12.org/c/chemistry/
Химическая реакция | Определение, уравнения, примеры и типы
сжигание
Посмотреть все СМИ
- Ключевые люди:
- Антуан Лавуазье Клод-Луи Бертолле Вильгельм Оствальд Анри-Луи Ле Шателье Сэр Дерек Х. Р. Бартон
- Похожие темы:
- кислотно-основная реакция механизм реакции катализ окислительно-восстановительная реакция ионообменная реакция
Просмотреть весь связанный контент →
Последние новости
23 февраля 2023 г., 11:10 по восточноевропейскому времени (AP)
Сдвиг Израиля вправо обостряет его связи с американскими евреями
Многие еврейские лидеры США бьют тревогу по поводу того, что они считают угрозой к израильской демократии со стороны нового правительства
Основные вопросы
Каковы основы химических реакций?
- Химическая реакция – это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты.
 Вещества – это либо химические элементы, либо соединения.
Вещества – это либо химические элементы, либо соединения. - Химическая реакция перестраивает составляющие атомы реагентов для создания различных веществ в качестве продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если произойдет физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Подробнее ниже: Основные понятия о химических реакциях
химический элемент
Узнайте об этом типе вещества, которое не может быть разложено на более простые вещества обычными химическими процессами.химическое соединение
Узнайте об этом типе вещества, которое можно разложить на более простые вещества с помощью обычных химических процессов.Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современному взгляду на химические реакции, связи между атомами в реагентах должны быть разрушены, а атомы или фрагменты молекул снова собираются в продукты путем образования новых связей. Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше энергии, выделяемой при образовании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться различные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, веществом, которое поставляет электронную пару, и кислотой Льюиса, веществом, которое может принимать электронную пару. Аммиак является примером основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше энергии, выделяемой при образовании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться различные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, веществом, которое поставляет электронную пару, и кислотой Льюиса, веществом, которое может принимать электронную пару. Аммиак является примером основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
химическая связь
Узнайте о различных типах химической связи.кислотно-основная реакция: реакции кислот Льюиса
Узнайте о кислотно-основных реакциях Льюиса.Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типу реагентов, по результату реакции и по механизму реакции. Часто данную реакцию можно отнести к двум или даже трем категориям, включая реакции газообразования и реакции осаждения. Многие реакции производят газ, такой как двуокись углерода, сероводород, аммиак или двуокись серы. Подъем теста для торта вызван газообразующей реакцией между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и окислительно-восстановительные реакции, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результату реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перетасовываются и повторно собираются при образовании продуктов.
Часто данную реакцию можно отнести к двум или даже трем категориям, включая реакции газообразования и реакции осаждения. Многие реакции производят газ, такой как двуокись углерода, сероводород, аммиак или двуокись серы. Подъем теста для торта вызван газообразующей реакцией между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и окислительно-восстановительные реакции, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результату реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перетасовываются и повторно собираются при образовании продуктов.
Подробнее читайте ниже: Классификация химических реакций
кислотно-щелочная реакция
Узнайте о кислотно-щелочных реакциях.
окислительно-восстановительная реакция
Узнайте об окислительно-восстановительных или окислительно-восстановительных реакциях.цепная реакция
Узнайте о цепных или самоподдерживающихся реакциях.Резюме
Прочтите краткий обзор этой темы
химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов. Вещества – это либо химические элементы, либо соединения. Химическая реакция перестраивает составляющие атомы реагентов для создания различных веществ в качестве продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и самой жизни. Сжигание топлива, плавка железа, изготовление стекла и гончарных изделий, пивоварение, производство вина и сыра — вот лишь некоторые примеры деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысячелетий. Химические реакции изобилуют в геологии Земли, в атмосфере и океанах, а также в огромном количестве сложных процессов, происходящих во всех живых системах.
Химические реакции изобилуют в геологии Земли, в атмосфере и океанах, а также в огромном количестве сложных процессов, происходящих во всех живых системах.
Химические реакции следует отличать от физических изменений. Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если произойдет физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. В любом физическом состоянии вода (H 2 O) — одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода. Однако если вода в виде льда, жидкости или пара встречается с металлическим натрием (Na), атомы перераспределяются с образованием новых веществ: молекулярного водорода (H 2 ) и гидроксида натрия (NaOH). Таким образом, мы знаем, что произошло химическое изменение или реакция.
Исторический обзор
Концепция химической реакции возникла примерно 250 лет назад. Он берет свое начало в ранних экспериментах, которые классифицировали вещества как элементы и соединения, а также в теориях, объясняющих эти процессы. Развитие концепции химической реакции сыграло главную роль в определении науки химии, какой она известна сегодня.
Он берет свое начало в ранних экспериментах, которые классифицировали вещества как элементы и соединения, а также в теориях, объясняющих эти процессы. Развитие концепции химической реакции сыграло главную роль в определении науки химии, какой она известна сегодня.
Britannica Quiz
13 правильных или неверных вопросов из самых простых научных викторин Britannica
Первые серьезные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в 18 веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли. Влияние французского химика Антуана-Лорана Лавуазье было особенно заметным, поскольку его идеи подтвердили важность количественных измерений химических процессов. В своей книге Traité élémentaire de chimie (1789; Elementary Treatise on Chemistry ), Лавуазье определил 33 «элемента» — вещества, не разделенные на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, прибавляемый при окислении элементов, и приписал результат соединению элемента с кислородом. Концепция химических реакций с участием комбинации элементов ясно возникла из его работ, и его подход побудил других заняться экспериментальной химией как количественной наукой.
Концепция химических реакций с участием комбинации элементов ясно возникла из его работ, и его подход побудил других заняться экспериментальной химией как количественной наукой.
Другим событием исторического значения, касающимся химических реакций, было развитие атомной теории. Большая заслуга в этом принадлежит английскому химику Джону Дальтону, постулировавшему свою атомную теорию в начале XIX века. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции связаны с перестройкой атомов с образованием новых веществ. Этот взгляд на химические реакции точно определяет текущий предмет. Теория Дальтона послужила основой для понимания результатов более ранних экспериментаторов, в том числе закона сохранения материи (материя не создается и не разрушается) и закона постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.


 Вещества – это либо химические элементы, либо соединения.
Вещества – это либо химические элементы, либо соединения.
Leave A Comment