Этиламин, C2H5Nh3, химические свойства, получение, применение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Азотсодержащие производные углеводородов и биологически важные вещества
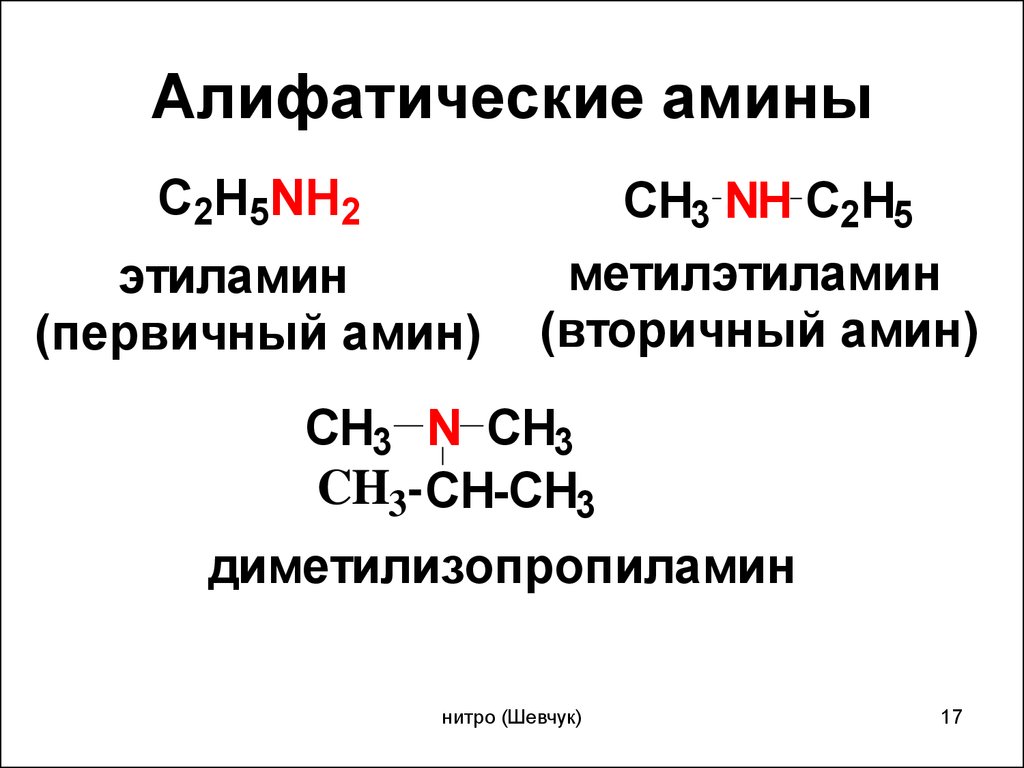
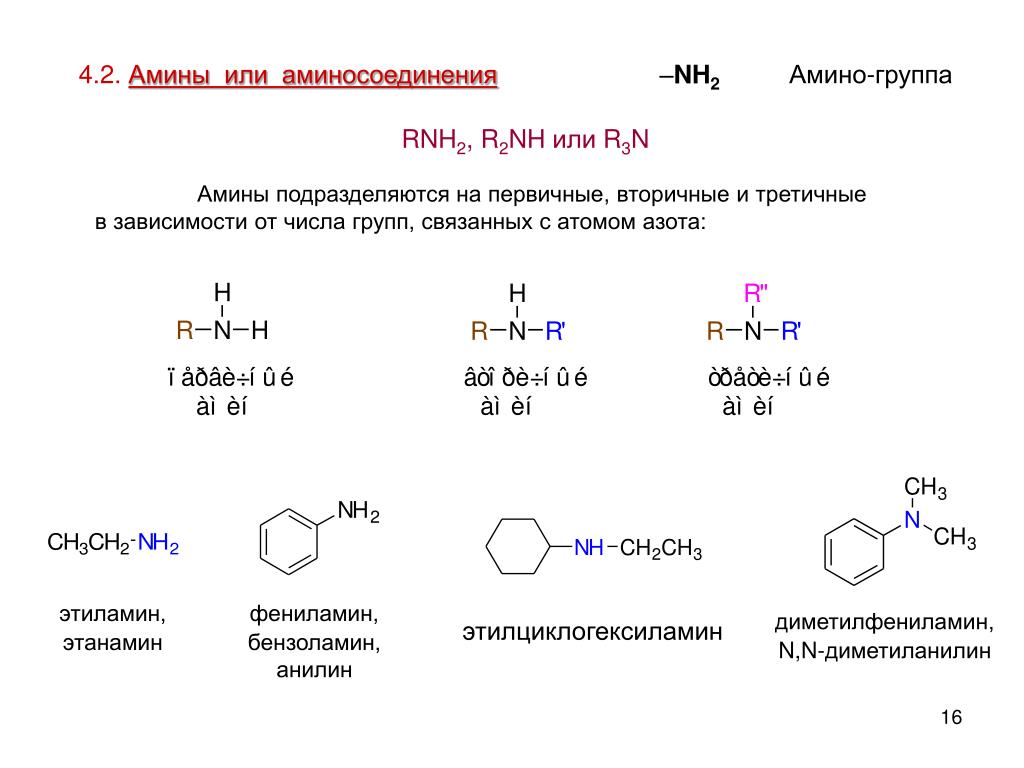
Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот; Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки.
1. И анилин, и диметиламин реагируют с
1) водой
2) бромэтаном
3) серной кислотой
4) бромоводородом
5) гидроксидом натрия
6) раствором перманганата калия
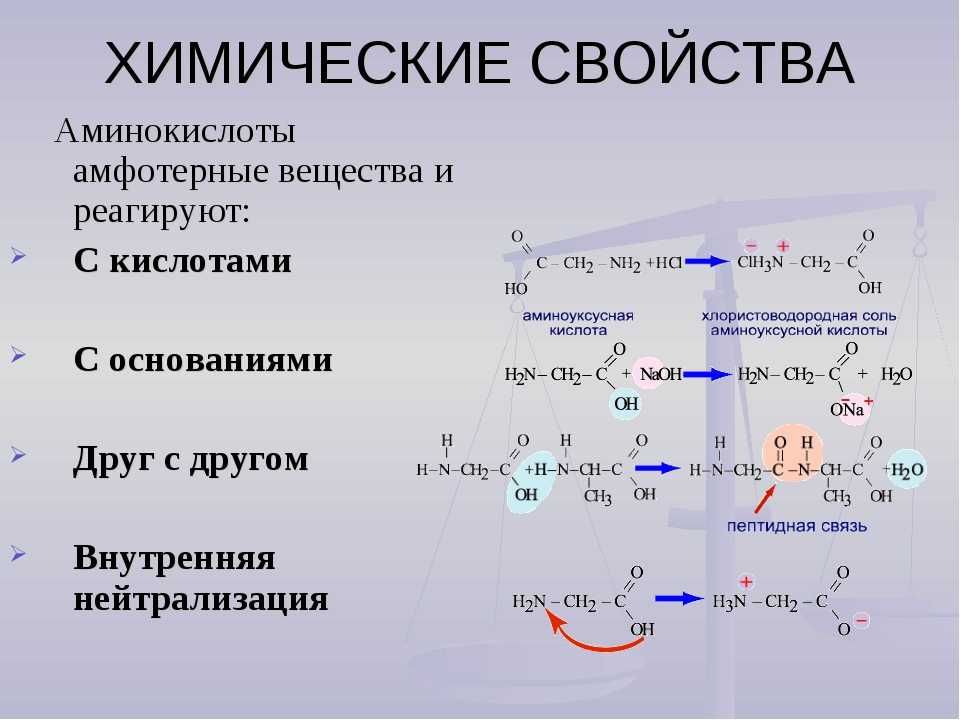
2. С аминоуксусной кислотой реагирует
1) вода
2) этанол
3) хлороводород
4) сульфат натрия
5) гидроксид натрия
6) гидроксид меди(II)
3. О глицине можно сказать, что это вещество
1) жидкое при обычных условиях
2) обладает амфотерными свойствами
3) имеет резкий запах
4) хорошо растворимо в воде
5) образует сложные эфиры
6) не реагирует с кислотами
4. Об анилине можно сказать, что это вещество
Об анилине можно сказать, что это вещество
1) более сильное основание, чем аммиак
2) хорошо растворяется в воде
3) образует соли в реакции с кислотами
4) окисляется на воздухе
5) реагирует со щелочами
6) обесцвечивает бромную воду
5. С метиламином взаимодействует
1) аммиачный раствор оксида серебра
2) фосфорная кислота
3) гидроксид калия
4) хлороводород
5) хлорэтан
6) вода
6. О хлориде фениламмония можно сказать, что это вещество
1) имеет молекулярное строение
2) обесцвечивает бромную воду
3) реагирует с соляной кислотой
4) взаимодействует со щелочами
5) хорошо растворимо в воде
6) сильное основание
7. С раствором гидроксида натрия взаимодействует
1) глицин
2) этанол
3) анилин
4) метиламин
5) метилацетат
6) хлорид метил аммония
8. Про метиламин можно сказать, что это вещество
1) газообразное при обычных условиях
2) вступает в реакцию «серебряного зеркала»
3) не горит на воздухе
4) более сильное основание, чем аммиак
5) с хлороводородом образует соль
6) не растворяется в воде
9. И анилин, и метиламин реагируют с
И анилин, и метиламин реагируют с
1) водой
2) хлорметаном
3) хлороводородом
4) азотной кислотой
5) гидроксидом калия
6) аммиачным раствором оксида серебра
10. Про диметиламин можно сказать, что это вещество
1) сгорает на воздухе
2) хорошо растворяется в воде
3) имеет немолекулярное строение
4) более сильное основание, чем анилин
5) вступает в реакцию «серебряного зеркала»
6) реагирует со щелочами с образованием солей
11. Этиламин взаимодействует с
1) пропаном
2) водой
3) азотной кислотой
4) толуолом
5) кислородом
6) этаном
12. Метилэтиламин взаимодействует с
1) этаном
2) бромоводородной кислотой
3) кислородом
4) гидроксидом калия
5) пропаном
6) водой
13. Этиламин взаимодействует с
1) метаном
2) водой
3) бромоводородом
4) бензолом
5) кислородом
6) пропаном
14. Анилин взаимодействует с
Анилин взаимодействует с
1) гидроксидом натрия
2) бромной водой
3) хлором
4) толуолом
5) хлороводородом
6) метаном
15. Диметиламин
1) имеет специфический запах
2) относится к третичным аминам
3) является жидкостью при комнатной температуре
4) содержит атом азота с неподеленной электронной парой
5) реагирует с кислотами
6) является более слабым основанием, чем аммиак
16. Диметиламин взаимодействует с
1) гидроксидом бария
2) кислородом
3) оксидом меди(П)
4) пропаном
5) уксусной кислотой
6) водой
17. Пропиламин взаимодействует с
1) водой
2) муравьиной кислотой
3) бензолом
4) бутаном
5) хлороводородом
6) метаном
18. Метиламин взаимодействует с
1) этапом
2) бромоводородной кислотой
3) кислородом
4) гидроксилом калия
5) пропаном
6) водой
19. Метиламин может быть получен при взаимодействии
Метиламин может быть получен при взаимодействии
1) СН4 и HONО2
2) CH3NO2 и Н2
3) СНзОН и N2
4) СН3ОН и NH3
5) [CH3NH3]C1 и КОН
6) СН3-СН3 и NH3
20. Этиламин получают при взаимодействии веществ:
1) С2Н6 и HONО2
2) С2Н5NO2 и Н2
3) С2Н5ОН и N2
4) С2Н5ОН и NH3
5) [C2H5NH3]C1 и NaOH
6) СН3-СH3 и NH3
21. Аминоуксусная кислота взаимодействует с
1) оксидом кальция
2) бензолом
3) бромоводородом
4) хлороформом
5) магнием
6) толуолом
22. И метиламин, и фениламин
1) хорошо растворяются в воде
2) имеют сильно щелочную среду водного раствора
3) реагируют с азотной кислотой
4) взаимодействуют с Са(ОН)2
5) горят в атмосфере кислорода
6) относятся к первичным аминам
23. Практически нейтральную среду имеют водные растворы:
Практически нейтральную среду имеют водные растворы:
24. Фенолфталеин изменяет окраску в растворе
25. С аминоуксусной кислотой реагируют:
1) водород
2) гидроксид натрия
3) перманганат калия
4) метанол
5) иодоводород
6) бензол
26. Диметиламин
1) является твердым веществом
2) растворим в воде
3) относится к первичным аминам
4) взаимодействует с серной кислотой
5) взаимодействует с хлоридом натрия
6) взаимодействует с хлорметаном
27. Аланин взаимодействует с
1) KOH
2) H2SO4
3) Na2SO4
4) NH2CH3COOH
5) Ag
6) Si
28. С аминоуксусной кислотой реагируют
1) водород
2) гидроксид натрия
3) перманганат калия
4) метанол
5) иодоводород
6) бензол
29. Водный раствор аминоуксусной кислоты взаимодействует с
1) | гидроксидом кальция |
2) | бензолом |
3) | бромоводородом |
4) | хлорбензолом |
5) | магнием |
6) | толуолом |
30. И с анилином, и с аланином способны реагировать
И с анилином, и с аланином способны реагировать
1) | кислород |
2) | бромоводород |
3) | этан |
4) | пропен |
5) | серная кислота |
6) | гидроксид калия |
31. Целлюлоза реагирует с
1) HNO3
2) I2
3) O2
4) H2O (H+)
5) CO2
6) C2H6
32. Для глюкозы возможны реакции с
Для глюкозы возможны реакции с
1) бензолом
2) водой
3) кислородом
4) азотной кислотой
5) простым эфиром
6) гидроксидом меди (II)
33. Сахароза реагирует с
1) Cu(OH)2
2) O2
3) C2H6
4) H2O (H+)
5) Ag2O (аммиачный раствор)
6) СО2
34. В промышленности реакцию гидролиза жиров используют для получения
1) маргарина
2) глицерина
3) этандиола
4) масляной кислоты
5) мыла
6) стеариновой кислоты
35. Аланин взаимодействует с
1) NaOH
2) HCl
3) KNO3
4) CH2(NH2)COOH
5) Cu
6) S
Ответы: 1-234, 2-235, 3-245, 4-346, 5-245, 6-245, 7-156, 8-145, 9-234, 10-124, 11-356, 12-236, 13-235, 14-235, 15-145, 16-256, 17-125, 18-236, 19-245, 20-245, 21-135, 22-356, 23-15, 24-346, 25-245, 26-246, 27-124, 28-245, 29-135, 30-135, 31-134, 32-346, 33-124, 34-256, 35-124.
Этиламин — Sciencemadness Wiki
Этиламин представляет собой органическое соединение с формулой CH 3 CH 2 NH 2 или просто EtNH 904 2.
Содержание
- 1 Свойства
- 1.1 Химическая промышленность
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Как и другие простые алифатические амины, этиламин является слабым основанием с pKa 10,8.
Этиламин реагирует с кислотами с образованием соответствующих солей.
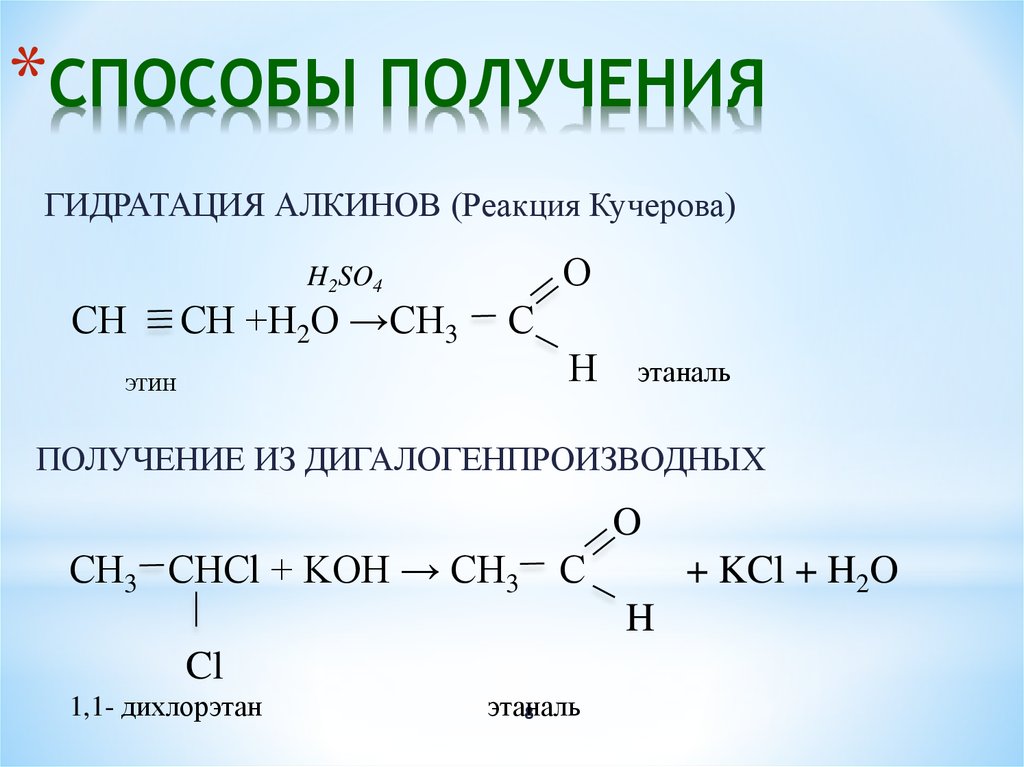
Реакция с сульфурилхлоридом с последующим окислением сульфонамида дает диэтилдиазен или азоэтан (EtN=NEt). [1]
Этиламин может быть окислен сильным окислителем, таким как перманганат калия, с образованием ацетальдегида.
Физический
Этиламин представляет собой бесцветный газ, который конденсируется при температуре чуть ниже комнатной в жидкость. Имеет сильный рыбный запах. Этиламин смешивается с различными растворителями, но реагирует с кислотами. Сол. 70% водн. Этиламин имеет плотность 0,81 г/мл при 20 °С.
Наличие
Этиламин продается поставщиками химикатов. Поскольку в большинстве стран он классифицируется как прекурсор наркотиков Списка I, химик-любитель практически не может приобрести его без разрешения. В Соединенных Штатах он классифицируется как химическое вещество DEA List I.
Препарат
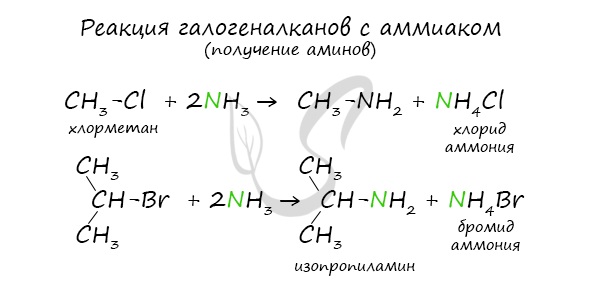
Этиламин получают в промышленных масштабах путем реакции этанола и аммиака в присутствии оксидного катализатора:
- CH 3 CH 2 OH + NH 3 → CH 3 CH 2 NH 2 + H 2 O
В этой реакции этиламин используется вместе с DIETHYLAMIN триэтиламин. Фракционная перегонка часто используется для очистки компонентов.
Более простой способ включает восстановительное аминирование ацетальдегида:
- CH 3 CHO + NH 3 + H 2 → CH 3 CH 2 NH 2 + H 2 O
. Другие границы включают в себя reacting Ethylene и Amonia в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии в присутствии. катализатора, такого как амид натрия или другие родственные основные катализаторы. [2]
- H 2 C = CH 2 + NH 3 → CH 3 CH 2 NH 2
Гидрадиация ацетонитрия, ацетамиид и эфиламновая доходность и эфиламная гидратация. . Эти реакции можно проводить стехиометрически с использованием алюмогидрида лития.
Другим способом этиламин можно синтезировать путем нуклеофильного замещения галогенэтана (такого как хлорэтан или бромэтан) аммиаком с использованием сильного основания, такого как гидроксид калия. Также производятся побочные продукты, такие как диэтиламин и триэтиламин. [3]
- CH 3 CH 2 Cl + NH 3 + KOH → CH 3 CH 2 NH 2 + KCl + H 2 O
Projects
- Получение солей этиламмония
- Приготовить симазин
Обращение
Безопасность
Этиламин токсичен в высоких концентрациях. Он также легко воспламеняется, а смеси с воздухом в замкнутом пространстве могут быть взрывоопасными.
Хранение
Этиламин можно хранить в сжатых баллонах при стандартных условиях. Альтернативно, он может храниться в виде соли или растворяться в выбранном растворителе. Не рекомендуется хранить его в холодильнике или морозильной камере в виде жидкости в бутылке.
Утилизация
Этиламин и его соли не вредны для окружающей среды и обычно не требуют специальной утилизации. Если у вас небольшие количества, можно развести соль и высыпать в канализацию или в землю, где она распадется на менее вредные продукты.
Ссылки
- ↑ https://web.archive.org/web/20070930230511/http://www.orgsyn.org/orgsyn/pdfs/CV6P0078.pdf
- ↑ https://www.freepatentsonline.com/7161039.pdf
- ↑ http://www.docbrown.info/page06/OrgMechs2b.htm
Соответствующие нити Sciencemadness
- Синтез этиламина
- Приготовление 70% раствора этиламина
- Этиламин из бромэтана и аммиака
- этиламин
- Помощь в выделении этиламина
- разделение этиламинов
Ацетон — Sciencemadness Wiki0006 2
CO ) — популярный растворитель и полезное химическое вещество для многих процессов органической химии, являющееся простейшим кетоном.Содержание
- 1 Свойства
- 1.
 1 Химическая промышленность
1 Химическая промышленность - 1.2 Физический
- 1.
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 См. также
- 7 Каталожные номера
- 7.1 Соответствующие темы Sciencemadness
Свойства
Химический
Ацетон легко воспламеняется и горит на воздухе с выделением углекислого газа и паров воды.
Реагирует с галогенами с образованием галогенированных органических соединений, т.е. хлорацетона, бромацетона, йодацетона. Ацетон очень экзотермически реагирует с галогенами, растворенными в основных растворах, с образованием галоформа указанного галогена, процесс, известный как галоформная реакция. Одним из примеров является использование бытового отбеливателя и других гипохлоритов с образованием хлороформа.
Ацетон образует непредсказуемую и опасную взрывоопасную перекись ацетона при окислении перекисью водорода при определенных условиях, например, с кислотным катализатором.
Ацетон реагирует с холодной концентрированной азотной кислотой с образованием уксусной и муравьиной кислот. В результате реакции выделяется много тепла, из-за чего продукты испаряются из реакционной колбы.
Физический
Ацетон — прозрачная жидкость с очень низкой вязкостью, смешивающаяся с водой, закипающая при 56 °C и замерзающая при -9от 5 до −93 °C. Он имеет резкий, несколько сладкий и цветочный аромат, похожий на другие кетоны. Он также смешивается с большинством органических растворителей, таких как ледяная уксусная кислота, бензол, хлороформ, диэтиловый эфир, этанол, гептан, гексан и метанол. Однако ацетон не смешивается с глицерином.
Наличие
Ацетон можно найти в хозяйственных магазинах в качестве разбавителя краски или жидкости для снятия лака, в чистом виде или в смеси с другими органическими веществами (обычно сложными эфирами). Для очистки ацетона может потребоваться перегонка.
Большинство технических сортов ацетона, как правило, довольно чистые и содержат очень мало воды, если вообще содержат ее.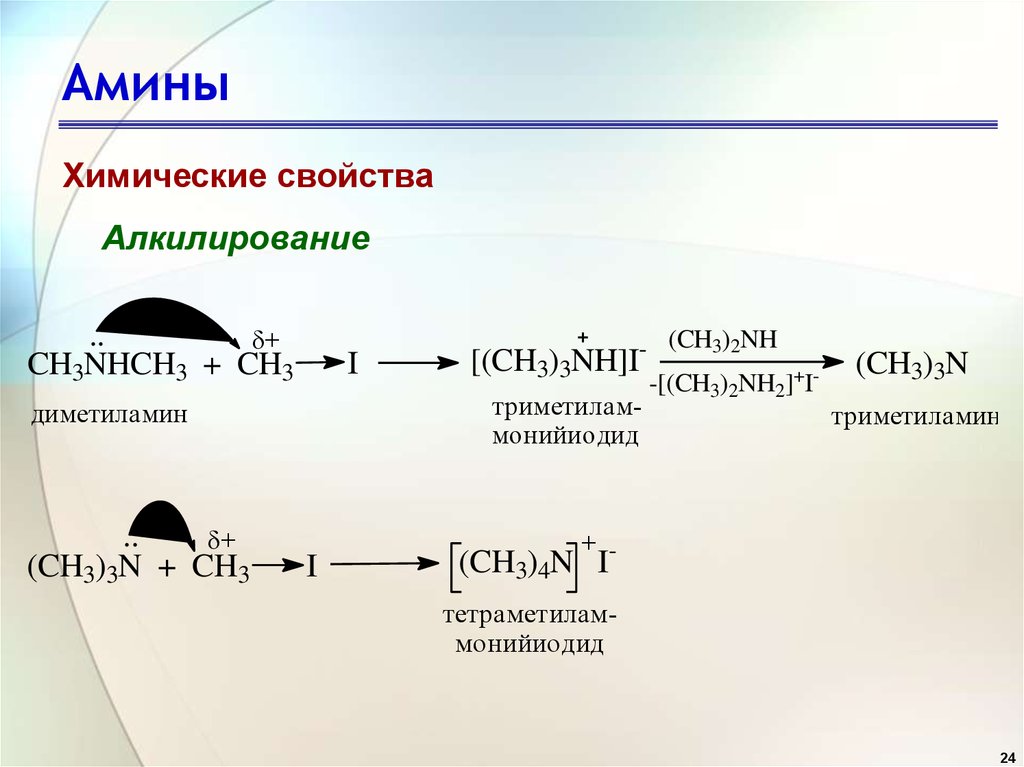 Если вы хотите, чтобы он был более чистым, вы можете перегнать его снова.
Если вы хотите, чтобы он был более чистым, вы можете перегнать его снова.
Приготовление
В промышленности ацетон производится кумольным процессом, при котором бензол алкилируется пропиленом с получением кумола, который окисляется воздухом с образованием фенола и ацетона.
До этого метода ацетон производился путем сухой перегонки ацетатной соли, обычно ацетата кальция или ацетата натрия.
- 2 Na(CH 3 COO) → Na 2 CO 3 + (CH 3 ) 2 CO
- Ca(CH 3 COO) 2 → CaCO 3 + (CH 3 ) 2 CO
Поскольку эта реакция происходит при температуре около 400-500°C и температуре самовоспламенения, ацетона, это должно быть выполнено в бескислородной камере (достаточно углекислого газа или только атмосферы), и, поскольку ацетон образуется в виде паров, его необходимо конденсировать.
Ацетон можно извлечь из водного раствора высаливанием безводным ацетатом натрия, который обычно получают из уксуса и пищевой соды.
Проекты
- Синтез метилметакрилата
- Синтез перекиси ацетона
- Синтез хлороформа
- Органические экстракты
- Сделать этенон
Обращение
Безопасность
Контакт с кожей с ацетоном не рекомендуется, так как длительное воздействие может привести к обезжириванию кожи. Низкая температура кипения ацетона требует работы в проветриваемом помещении. Хотя ацетон летуч и его пары не особенно токсичны, в больших количествах они могут вызывать раздражение. Однако ацетон является одним из наименее токсичных растворителей, и, как показали многие исследования, в случае многократного воздействия не возникает долгосрочного риска.
Основная опасность ацетона связана с его воспламеняемостью. Его пары имеют температуру воспламенения намного ниже комнатной температуры, поэтому смеси воздух/ацетон могут легко взорваться или загореться даже при ударах статическим электричеством.
При температуре выше 486 °C ацетон самовоспламеняется.

 1 Химическая промышленность
1 Химическая промышленность
Leave A Comment