Максимальное число электронов, которые могут находиться на энергетическом уровне,
Вариант 3 1. Распределение электронов по энергетическим уровням в атоме серы: 1) 2, 6 2) 2, 8, 8
…
3) 2, 8, 6 4) 2, 8, 8, 6 2. Сера — более сильный окислитель, чем: 1) фтор 2)хлор 3)фосфор 4) кислород 3. Степени окисления серы изменяются с +6 до 0 в группе веществ: 1)S, SO3 2) h3SO4, h3S 3) Na2SO4, S 4) SO2, S 4. Схеме превращения S+6 → S+4 соответствует уравнению реакции: 1) SO3 + h3O = h3SO4 3) h3SO4 + Zn = ZnSO4 + h3 2) 2SO2 + O2 = 2SO3 4) Cu +2h3SO4 = CuSO4 + SO2 + 2h3O 5. И сернистый газ, и оксид серы(VI) будут реагировать со следующей парой веществ: 1) h3O , CO2 2) NaOH, CaO 3) h3O, Cl2 4) h3S, O2 6.
Вариант 2 1.Для серы нехарактерна степень окисления: 1. -2 2. -4 3. +4 4. +6 2.Сера является восстановителем в реакции с: 1. Фтором 2. Железом 3. Натр
…
ием 4.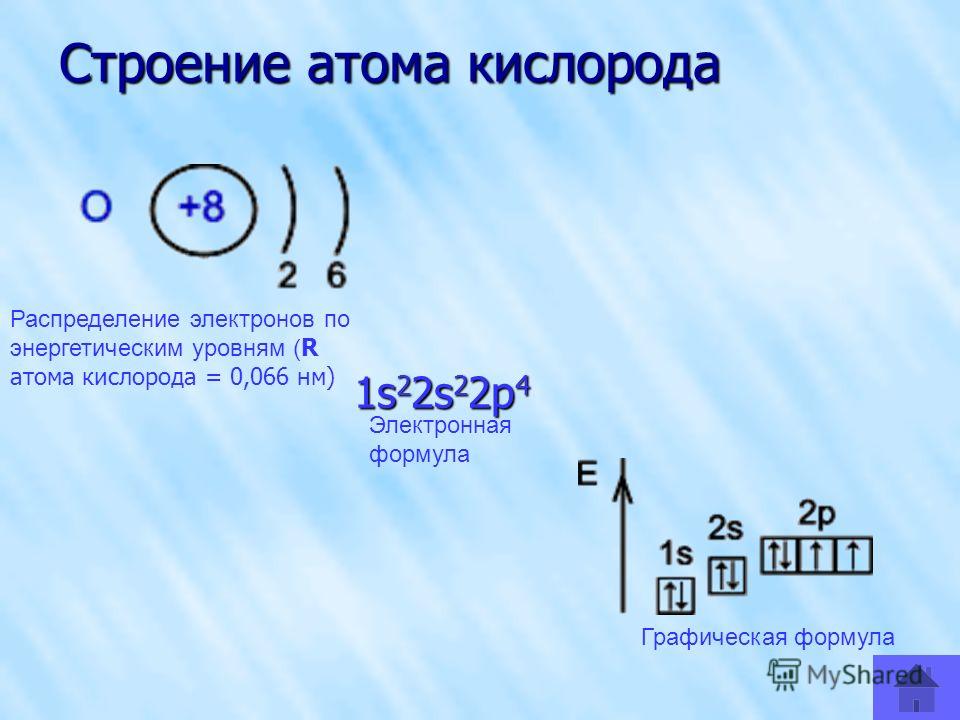 Водородом 3.Степени окисления серы изменяются в последовательности +6, +4, -2 в группе веществ 1. S, SO2, SO3 2. h3SO4, SO2, h3S 3. Na2SO4, K2S, S 4. SO3, K2SO3, S 4.Схема превращения S+6 → S-2 соответствует уравнению реакции 1. SO3 + h3O → h3SO4 3. h3SO4 + Zn → ZnSO4 + h3S + h3O 2. 2SO2 + O2 → 2SO3 4. Cu + 2h3SO4 → CuSO4 + SO2 + 2h3O 5.И сернистый газ, и серная кислота будут реагировать со следующей парой веществ 1. Н2О и СО2 2. КOH и MgO 3. h3O и SO3 4. Na2S и О2 6.Для осуществления превращения S→SO2→SO3→ BaSO4 нужно последовательно использовать 1. Воду, кислород, оксид бария 3. Кислород, кислород, гидроксид бария 2. Кислород, кислород, нитрат бария 4. Воду, кислород, нитрат бария 7.Качественную реакцию на сульфит-анион можно представить сокращённым ионным уравнением 1. Pb2+ + S2-→PbS 2. Cu2+ + SO42- → CuSO4 3. Ba2+ + SO42- → BaSO4 4. 2H+ + SO32- → SO2 + h3O 8.Газ с запахом горящих спичек, образующий при растворении в воде слабую кислоту, называется 1. Сернистый 2. Угарный 3. Сероводород 4.
Водородом 3.Степени окисления серы изменяются в последовательности +6, +4, -2 в группе веществ 1. S, SO2, SO3 2. h3SO4, SO2, h3S 3. Na2SO4, K2S, S 4. SO3, K2SO3, S 4.Схема превращения S+6 → S-2 соответствует уравнению реакции 1. SO3 + h3O → h3SO4 3. h3SO4 + Zn → ZnSO4 + h3S + h3O 2. 2SO2 + O2 → 2SO3 4. Cu + 2h3SO4 → CuSO4 + SO2 + 2h3O 5.И сернистый газ, и серная кислота будут реагировать со следующей парой веществ 1. Н2О и СО2 2. КOH и MgO 3. h3O и SO3 4. Na2S и О2 6.Для осуществления превращения S→SO2→SO3→ BaSO4 нужно последовательно использовать 1. Воду, кислород, оксид бария 3. Кислород, кислород, гидроксид бария 2. Кислород, кислород, нитрат бария 4. Воду, кислород, нитрат бария 7.Качественную реакцию на сульфит-анион можно представить сокращённым ионным уравнением 1. Pb2+ + S2-→PbS 2. Cu2+ + SO42- → CuSO4 3. Ba2+ + SO42- → BaSO4 4. 2H+ + SO32- → SO2 + h3O 8.Газ с запахом горящих спичек, образующий при растворении в воде слабую кислоту, называется 1. Сернистый 2. Угарный 3. Сероводород 4.
(b) Назовите три элемента 1группы.
выберите электронные формулы атомов химических элементов относящихся к одной группе 2b дам 100 баллов
8. 128 gramm oltingugurt kislorod bilan reaksiyaga kirishganda necha gra oltingugurt (IV) oksidi hosil bo’ladi. (2,7ball) A)64gr B) 128gr C)192 gr D) … 256gr 9. Ozonni aniqlash uchun qaysi reaksiyadan foydalaniladi. (2,7ball) A) ZKJ+Os+ H₂O=Jz+ 2KOH +0₂ B) INH+ 40 = Nh5NO3 +402+H₂O C) 350₂ + 3H₂0+0=3H₂SO4 D) S+H₂O +0₂= H₂SO4
Строение атома и электронные конфигурации 2.0
На этой странице вы узнаете- Какой паспорт у атомов?
- Что общего у электронов и студентов?
Всё, что окружает нас в повседневной жизни имеет сложное строение: от чайника на плите до улиц города. Не менее сложным строением обладает и крохотный атом. В этой статье поговорим о его электронных конфигурациях.
Вспомним самую важную информацию об атоме.
Долгое время ученые не могли выяснить, из чего состоит атом. Впоследствии было установлено, что атом состоит из элементарных частиц: протонов, нейтронов и электронов.
Чтобы объяснить расположение элементарных частиц была предложена планетарная модель атома. Она гласит следующее: вокруг каждого ядра находятся электроны, которые располагаются вокруг него определенным образом, как и планеты вокруг Солнца. Подробнее о строении атома можно почитать в статье «Строение атома и электронные конфигурации 1.0».
В это статье мы сфокусируемся на электронах в атоме.
Валентные и неспаренные электроныПоследний энергетический уровень называют внешним. На нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
Неспаренными называют электроны, которые находятся по одиночке в квантовых ячейках. При этом они тоже являются валентными электронами, то есть могут участвовать в образовании химических связей с другими элементами. При этом они тоже являются валентными электронами, то есть могут участвовать в образовании химических связей с другими элементами.Таким образом, можно сказать, что неспаренные и валентные электроны — близкие родственники: похожи, но не одинаковы. |
Сравним, какая же связь существует между валентными и неспаренными электронами. При образовании химической связи возможны два механизма: обменный и донорно-акцепторный. Более распространен обменный механизм, благодаря которому атомы выделяют по одному электрону на внешнем электронном уровне и образуют “коннекшн” (общую электронную пару).
Из этого следует правило:
| Все неспаренные электроны являются валентными, но не все валентные электроны должны быть неспаренными. |
У каждого атома или иона есть “паспорт” расположения электронов по энергетическим уровням. Такой паспорт называется электронной конфигурацией.
Такой паспорт называется электронной конфигурацией.
Электронная конфигурация — это формула, отражающая распределение электронов по электронным оболочкам атома.
| Что общего у электронов и студентов? Пусть электрон — это студент. А где обычно живут студенты? В общаге! Давайте нарисуем общежитие для электронов: — В нём есть отдельные комнаты — максимум 2 электрона. |
Более подробно про расположение электронов можно почитать в статье «Особенности строения электронных оболочек атомов элементов». .
Электронную конфигурацию ионов можно написать по тем же правилам, что и электронную конфигурацию атомов, только при этом нужно учитывать, какой заряд (положительный или отрицательный) у частицы.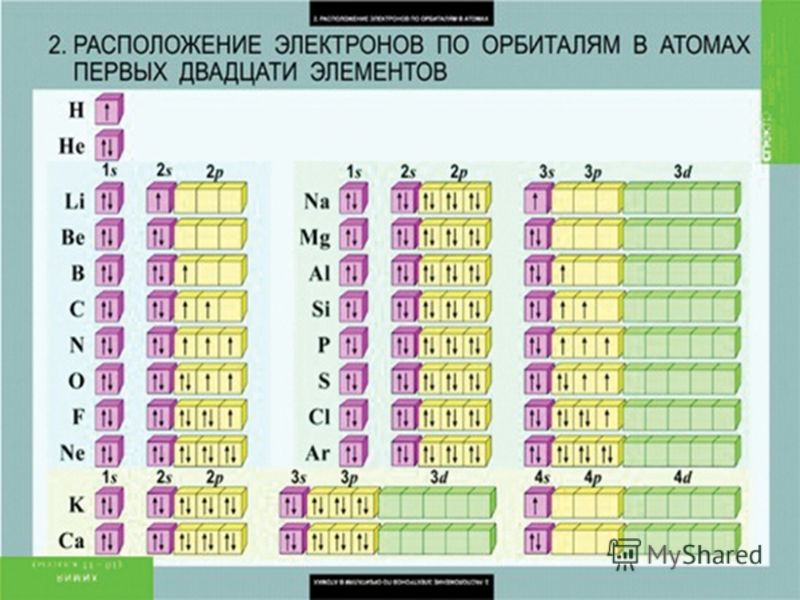
Если атом принимает электроны, то он становится анионом, если отдаёт электроны – то катионом.
Атом может отдать или принять электроны таким образом, чтобы внешний энергетический уровень был максимально заполнен, так как это энергетически выгодно. Полностью заполненный подуровень является очень устойчивым — такую конфигурацию имеют все благородные газы, и к ней стремятся ионы.
Рассмотрим пример с образованием сульфид-аниона S2-.
- 3 энергетический уровень является внешним для атома серы, на нем располагается 6 электронов, 2 из которых являются неспаренными.
- К этим электронам могут добавиться два “соседа”, благодаря которым p-подуровень заполняется полностью и обретает стабильную конфигурацию.
- Так как каждый из электронов имеет заряд (-1), то суммарно после их присоединения к сере образуется сульфид-анион S2-
- Электроны заполняются определенным образом на энергетических уровнях вокруг атома.

- Электронная конфигурация помогает нам узнать, на каком уровне и подуровне располагается определенное число электронов.
- Если к нейтральному атому добавить электроны, то он превращается в анион, если же отобрать электроны — образуется катион.
- Атом стремится обладать наиболее устойчивой электронной конфигурацией, при которой энергетический уровень/подуровень является заполненным.
Задание 1.
Внешним энергетическим уровнем называется :
- Первый энергетический уровень
- Последний энергетический уровень
- Энергетический уровень с наименьшей энергией
Задание 2.
Максимальное число электронов на внешнем энергетическом уровне равно:
- 5
- 6
- 7
- 8
Задание 3.
Количество валентных электронов, в большинстве случаев, равно:
- Номеру группы
- Номеру периода
- Порядковому номеру элемента
- Массовому числу элемента
Задание 4.
Сколько электронов необходимо для заполнения энергетического уровня атома углерода?
- 2
- 3
- 4
- 5
Задание 5.
Электронной конфигурации какого благородного газа будет соответствовать электронная конфигурация хлорид-иона?
- Аргона
- Неона
- Криптона
- Ксенона
Ответы: 1. — 2; 2. — 4; 3. — 1; 4. — 3; 5. — 1.
3.2 — Электронные конфигурации атомов
Квантово-механическая модель атома представляет собой более точную модель атома. Это более сложная модель, основанная на сложных математических расчетах и интерпретациях. Мы рассмотрим эту модель и подведем итоги на основе этих математических расчетов, не проводя их самостоятельно.
Мы рассмотрим эту модель и подведем итоги на основе этих математических расчетов, не проводя их самостоятельно.
Квант Механическая модель представляет концепцию:
- подоболочки или подуровни ( s, p, d, f )
и атомных орбиталей.
В следующей таблице указано количество орбиталей на каждом подуровне.
| Тип атомной орбиты | Количество орбиталей |
 | |
3E — Электроны в Подуровни
Каждая орбиталь может содержать максимум два электрона. Вольфганг Паули утверждает, что если два электрона занимают одинаковые орбитали, они должны иметь противоположный спин. Это известно как Паули принцип исключения.
Напомним, что из модели Бора (максимальное число электронов, которые могут занимать главную энергию уровень n это
Подробный обзор главного энергетического уровня 3, n = 3
- Модель Бора предсказывает, что максимум 2(3) 2 = 18 электронов может находиться на 3-м основном энергетическом уровне.
- Квантово-механическая модель атома предсказывает, что основная энергия
уровень 3, есть 3 s , 3 p и 3 d .

- В любой p-подоболочке есть 3 атомные орбитали. Поэтому, на подуровне 3 p находятся 3 атомные орбитали.
- В любой d-подоболочке имеется и 5 атомных орбиталей. Следовательно, 5 атомных орбиталей в 3 d подуровень.
- С следует, что:
- 1 атомная орбиталь в 3 с подуровень х 2 электрона/орбиталь = 2 электрона могут находиться на подуровне 3 s
- 3 атомные орбитали в 3 p подуровне
x 2 электрона/орбиталь =
6 электронов могут находиться на подуровне 3
- 5 атомных орбиталей на 5 d подуровне x 2 электрона/орбиталь = 10 электронов могут находиться в 3 d подуровень
 Квантово-механическая модель
позволяет нам увидеть, как 18 электронов распределены на каждом подуровне внутри
3-й главный энергетический уровень.
Квантово-механическая модель
позволяет нам увидеть, как 18 электронов распределены на каждом подуровне внутри
3-й главный энергетический уровень. - Вот пример орбитальной конфигурации для водорода, гелия и углерода.
Простейший атом водорода имеет 1 электрон. Он выйдет на орбиту 1s со спином либо в направление. Мы можем представить это либо с помощью орбитальной диаграммы заполнения или электронной конфигурации.
Следующий атом — гелий. У него 2 электрона. В результате согласно правилу исключения Паули Принцип : никакие два электрона не могут иметь один и тот же набор из четырех квантовых чисел. Таким образом, два электрона, занимающие 1s-орбиталь, должны иметь разные спины. Это видно на диаграмме заполнения орбит, но не на электронной конфигурация, которая предоставляет меньше информации.
Следующий важный атом для инструкции C. Он имеет шесть электронов. Но как те электроны расположены?
Получается, что два электрона, заполняющих 2р-орбитали, разделятся на разные орбитали с параллельными спинами.
 Это результат правила Хунда . Наиболее устойчиво расположение электронов на подуровне с наибольшим числом параллельных спинов. В результате на каждой орбитали будет один электрон, вращающийся в общем направлении, прежде чем два электрона заполнят одну и ту же орбиталь. Обратите внимание еще раз, что электронная конфигурация не делает этого различия.
Это результат правила Хунда . Наиболее устойчиво расположение электронов на подуровне с наибольшим числом параллельных спинов. В результате на каждой орбитали будет один электрон, вращающийся в общем направлении, прежде чем два электрона заполнят одну и ту же орбиталь. Обратите внимание еще раз, что электронная конфигурация не делает этого различия.Когда электроны заполняют энергетические уровни, они заполняют главную энергию уровни, подуровни, атомные орбитали от самой низкой энергии в первую очередь. чтобы просмотреть порядок, в котором подуровни упорядочены в соответствии с энергией. Смотреть внимательно и вы увидите:
- некоторый подуровень 4 имеет меньшую энергию, чем подуровень 3 (т.е. 4 s равно ниже по энергии, чем 3 d; )
- некоторый подуровень 5 или 6 имеет меньшую энергию, чем подуровень 4 (т.е. 5 р и 6 с имеют меньшую энергию, чем 4 ф; )
На первый взгляд кажется, что последовательность для электронов
заполнить атомные орбитали имеют случайный порядок. Читайте дальше, чтобы найти более простой способ запомнить порядок атомных орбиталей в зависимости от энергии.
Читайте дальше, чтобы найти более простой способ запомнить порядок атомных орбиталей в зависимости от энергии.
3F — Порядок заполнения подуровней
Как нам запомнить последовательность, в которой электроны заполняют подуровни?
| Порядок, в котором электроны заполняют подуровни, легко запомнить, если выполнить следующие шаги: | |
| |
| |
3G — Обозначения электронной конфигурации
Существует способ точно представить расположение электронов в атомах. Давайте взглянем на простейший атом, водород.
Атом водорода имеет 1 электрон. Этот электрон будет занимать самый низкий главный энергетический уровень, n = 1, и единственный подуровень, s . Обозначим электронную конфигурацию водорода как
Аналогично,
- Гелий имеет 2 электрона; 2 электрона
оба занимают подуровень s на основном энергетическом уровне 1.
- Электронная конфигурация гелия 1 с 2
- Литий имеет 3 электрона; 2 из 3 электронов
занимают подуровень s на главном энергетическом уровне 1. 3-й электрон
должен перейти на следующий доступный подуровень, 2 с.

- Электронная конфигурация лития 1 с 2 2 с 1
- Бериллий имеет 4 электрона; 2 из 3 электронов
занять s подуровень основного энергетического уровня 1. 3-й и 4-й
электроны должны перейти на следующий доступный подуровень, 2 с.
- Электронная конфигурация бериллия 1 с 2 2 с 2
В таблице ниже показана электронная конфигурация первых 20 элементов периодической таблицы.
NB: верхние индексы в сумме составляют атомный номер
атома.
| Имя | Атомный номер | Электронная конфигурация |
| ПЕРИОД 1 | ||
| Водород | 1 | 1 с 1 |
| Гелий | 2 | 1 с 2 |
| ПЕРИОД 2 | ||
| Литий | 3 | 1 с 2 2 с 1 |
| Бериллий | 4 | 1 с 2 2 с 2 |
| Бор | 5 | 1 с 2 2 с 2 2 р 1 |
| Углерод | 6 | 1 с 2 2 с 2 2 р 2 |
| Азот | 7 | 1 с 2 2 с 2 2 р 3 |
| Кислород | 8 | 1 с 2 2 с 2 2 р 4 |
| Фтор | 9 | 1 с 2 2 с 2 2 р 5 |
| Неон | 10 | 1 с 2 2 с 2 2 с 6 |
| ПЕРИОД 3 | ||
| Натрий | 11 | 1 с 2 2 с 2 2 р 6 3 с 1 |
| Магний | 12 | 1 с 2 2 с 2 2 р 6 3 с 2 |
| Алюминий | 13 | 1 с 2 2 с 2 2 р 6 3 с 2 3 р 1 |
| Кремний | 14 | 1 с 2 2 с 2 2 р 6 3 с 2 3 р 2 |
| Фосфор | 15 | 1 с 2 2 с 2 2 р 6 3 с 2 3 р 3 |
| Сера | 16 | 1 с 2 2 с 2 2 р 6 3 с 2 3 р 4 |
| Хлор | 17 | 1 с 2 2 с 2 2 р 6 3 с 2 3 р 5 |
| Аргон | 18 | 1 с 2 2 с 2 2 р 6 3 с 2 3 р 6 |
| ПЕРИОД 4 | ||
| Калий | 19 | 1 с 2 2 S 2 2 P 6 3 S 2 3 P 6 4 S 1 |
| Кальций | 20 | 1 с 2 2 S 2 2 P 6 3 S 2 3 P 6 4 S 2 |
3H — Электронная конфигурация и периодическая таблица
Существует закономерность между электронной конфигурацией для
элементы и их положение в периодической таблице. Вы должны взглянуть на
и внимательно посмотрите на первые 20 элементов. Сравните электронную конфигурацию элемента и
его положение в периодической таблице.
Вы должны взглянуть на
и внимательно посмотрите на первые 20 элементов. Сравните электронную конфигурацию элемента и
его положение в периодической таблице.
- Элементы, принадлежащие к группе IA (например, H, Li,
Na, K) все имеют электронную конфигурацию, оканчивающуюся на нс 1
(верхний индекс «1» указывает на наличие 1 валентного электрона для элементов, принадлежащих к группе IA). - Элементы, принадлежащие к группе IIA (например, Be,
Mg, Ca) все имеют электронную конфигурацию, оканчивающуюся на нс 2
(верхний индекс «2» указывает на наличие 2 валентные электроны для элементов, принадлежащих к группе IIA). - Элементы, принадлежащие к группе IIIA (например, — B,
Al) все имеют электронную конфигурацию, оканчивающуюся на нс 2 np 1
(сумма надстрочных индексов до «3» указывает на то, что есть 3 валентные электроны для элементов, принадлежащих к группе IIIA).
- Элементы, принадлежащие к группе IVA (например, C, Si)
все имеют электронную конфигурацию, оканчивающуюся на нс 2 np 2
(сумма надстрочных индексов до «4» указывает на то, что есть 4 валентные электроны для элементов, принадлежащих к группе IVA). - Элементы, принадлежащие к группе VA (например, N, P)
все имеют электронную конфигурацию, оканчивающуюся на нс 2 np 3
(сумма надстрочных индексов до «5» указывает на то, что есть 5 валентные электроны для элементов, принадлежащих к группе VA). - Элементы, принадлежащие к группе VIA (например, — O, S)
все имеют электронную конфигурацию, оканчивающуюся на нс 2 нп 4
(сумма надстрочных индексов до «6» указывает на то, что есть 6 валентные электроны для элементов, принадлежащих к группе VIA). - Элементы, принадлежащие к группе VIIA (например, — F,
Cl) все имеют электронную конфигурацию, оканчивающуюся на нс 2 np 5
(сумма надстрочных индексов до «7» указывает на то, что их 7 валентные электроны для элементов, принадлежащих к группе VIIA).
- Элементы, принадлежащие к группе VIIIA (например, He,
Ne, Ar) все имеют электронную конфигурацию, оканчивающуюся на нс 2 np 6
(сумма надстрочных индексов до «8» указывает на то, что есть 8 валентные электроны для элементов, принадлежащих к группе VIIIA).
Каково максимальное количество электронов на энергетическом уровне 3? – Gzipwtf.com
Содействие
Диана Монтгомери
Каково максимальное количество электронов на энергетическом уровне 3?
18 электронов
В: Энергетический уровень III может содержать максимум 18 электронов. Сколько орбиталей имеет этот энергетический уровень? A: При двух электронах на орбиталь этот энергетический уровень должен иметь девять орбиталей.
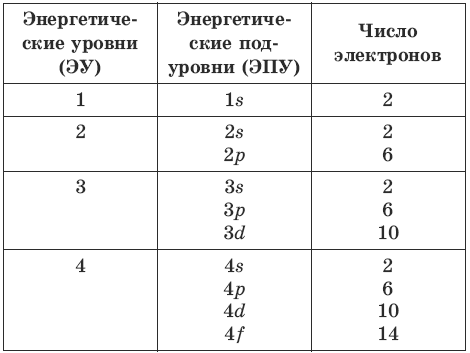
Каково максимальное количество электронов на каждом из следующих энергетических уровней?
Вопросы и ответы
| Энергетический уровень (главное квантовое число) | Шелковая буква | Электронная емкость |
|---|---|---|
| 1 | К | 2 |
| 2 | л | 8 |
| 3 | М | 18 |
| 4 | Н | 32 |
Каково максимальное число электронов на каждом из следующих энергетических уровней в боровской модели атома?
Максимальное количество электронов, которое может заселить определенный энергетический уровень, определяется следующей формулой. Например: максимальное количество электронов на первом энергетическом уровне (n = 1) равно 2 (1)2 = 2 электрона. Максимальное количество электронов на втором энергетическом уровне (n = 2) равно 2 (2)2 = 8 электронов.
Например: максимальное количество электронов на первом энергетическом уровне (n = 1) равно 2 (1)2 = 2 электрона. Максимальное количество электронов на втором энергетическом уровне (n = 2) равно 2 (2)2 = 8 электронов.
Каково максимальное количество электронов в n 3 L 2?
10 электронов
– Означает, что соответствующая орбиталь, где n = 3, l = 2, будет «3d», поскольку 3d-орбитали содержат пять подоболочек, а главное квантовое число равно 3. – Мы знаем, что 3d-орбиталь может вмещать 10 электронов (каждая подоболочка может вместить два электрона). – Следовательно, число электронов в n = 3, l = 2 равно 10,9.0004
Каково максимальное количество электронов в n 3 L 1?
Таким образом, n=3 и l=1 указывают на присутствие электронов в подоболочке 3p. Подоболочка p имеет максимум 3 орбитали, и каждая орбиталь содержит максимум 2 электрона. Следовательно, правильный вариант (D) 6.
Каково максимальное число электронов на 5-м энергетическом уровне?
32 электрона
Пятый энергетический уровень содержит: 5s (содержит 2 электрона), 5p (содержит 6), 5d (содержит 10) и 5f (содержит 14), всего 32 электрона.
Какое максимальное количество электронов в викторине о втором энергетическом уровне?
Максимальное количество электронов на втором энергетическом уровне атома равно 4.
Каково максимальное количество электронов на 4-м энергетическом уровне?
Четвертый и более высокие уровни также имеют f-подуровень, содержащий семь f-орбиталей, которые могут содержать максимум 14 электронов. Таким образом, четвертый уровень может содержать до 32 электронов: 2 на s-орбитали, 6 на трех p-орбиталях, 10 на пяти d-орбиталях и 14 на семи f-орбиталях.
Каково максимальное количество электронов в n 4?
Здесь n — главное квантовое число, описывающее энергетическую оболочку. Это означает, что четвертая энергетическая оболочка может содержать максимум 32 электрона.
Каково максимальное количество электронов на следующем энергетическом уровне N 2?
восемь
Максимальное количество электронов на энергетическом уровне n=2 равно восьми.



 сравните порядок заполнения последовательности подуровней с энергетической диаграммой подуровней.
сравните порядок заполнения последовательности подуровней с энергетической диаграммой подуровней.

Leave A Comment