2. Присоедините бромоводород к следующим алкенам:
Назовите исходные соединения и полученные продукты по международной номенклатуре.
Решение
а)
бутен-1 2-бромбутан
(реакция протекает по правилу Марковникова ).
б)
гексен — 3 3-бромгексан
Исходное соединение симметрично и совершенно безразлично, к какому атому углерода (к третьему или четвертому) присоединяется протон.
в)
3-метилпентен-2 3 – бром-3-метилпентан.
реакция протекает в соответствии с правилом Марковникова.
г)
фенилэтен
(винилбензол) 1–бром-1-фенилэтан.
Реакция протекает в соответствии с правилом Марковникова
3. Присоедините бром, бромоводород и воду к акролеину и к акриловой кислоте. Назовите исходные вещества и продукты реакций по международной номенклатуре.
пропеналь 2,3-дибромпропаналь
пропеновая кислота 2,3-дибромпропановая кислота
Бромоводород и вода присоединяются к α,β-ненасыщенным альдегидам и кислотам по двойной углерод-углеродной связи против правила Марковникова
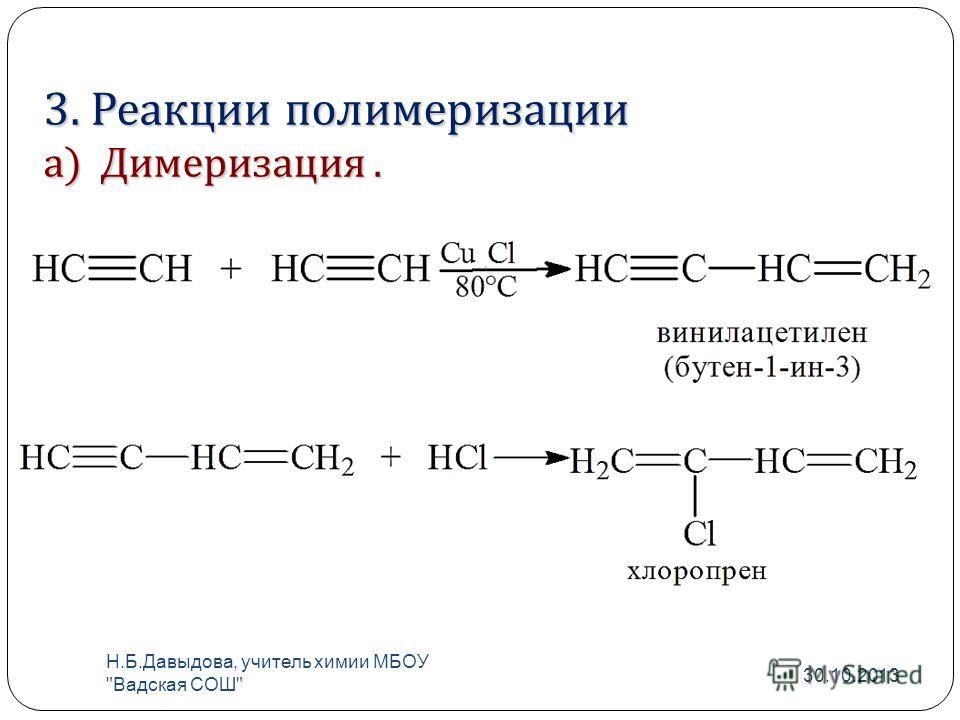
4. Присоедините 1 моль брома к октадиену-3,5 . Назовите продукты реакции по международной номенклатуре.
Решение
В молекуле октадиена
выделим сопряжённый фрагмент и присоединим
атомы бромы по концам этого фрагмента
(1,4-присоединение).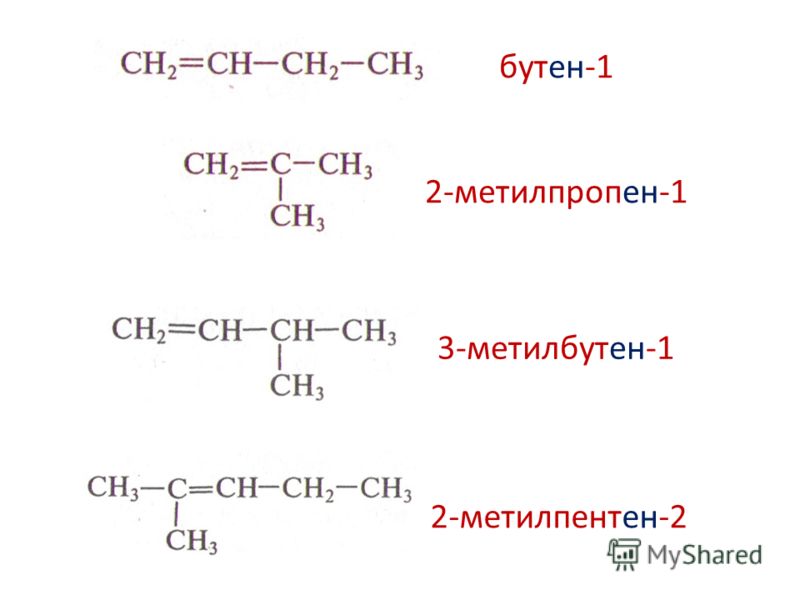
3,6-дибромоктен-4 (продукт 1,4-присоединения.)
Чтобы получить продукт 1,2-присоединения, атомы брома надо присоединить по связи С3 — С4 или С5 — С6, что совершенно безразлично, так как исходная молекула симметрична.
5,6-дибромоктен-3
5. Напишите ступенчатую реакцию полного хлорирования пентадиена — 1,3. Назовите продукты по международной номенклатуре.
Решение
1,4- дихлорпентен –2 1,2,3,4-тетрахлорпентан
Эталонное решение задач третьего типа
1. Получите реакцией алкилирования этилбензол и напишите реакцию его нитрования избытком азотной кислоты.
Решение
этилбензол
Так как этильный
радикал является ориентантом первого
рода, он облегчает S
этилбензол 2,4,6-тринитроэтилбензол
Получите реакцией ацилирования ацетофенон (метилфенилкетон) и бензофенон (дифенилкетон).
Решение
а)
хлористый ацетил ацетофенон
(SE реакция)
б)
хлористый бензофенон
бензоил
(SE реакция)
Получите изопропилбензол реакцией алкилирования бензола пропеном в кислой среде и напишите реакцию взаимодействия хлора с изопропилбензолом:
а) на свету ;
б) в присутствии
катализатора.
Тест по теме «Правило Марковникова» | Тест по химии по теме:
ПРАВИЛО МАРКОВНИКОВА
- При взаимодействии пропена с бромом при обычных условиях преимущественно образуется:
- 1-бромпропан
- 2-бромпропан
- 1,1-дибромпропан
- 1,2-дибромпропан
2.При взаимодействии пропена с хлором при 500℃ преимущественно образуется:
1) 1,2-дихлорпропан
2) 3-хлорпропан
3) 3-хлорпропен
4) 1,1-дихлорпропан
3. При взаимодействии пропена с бромоводородом преимущественно образуется:
1) 1-бромпропан
2) 2-бромпропан
3) 1,1-дибромпропан
4)1,2-дибромпропан
4. При гидратации бутена-1 преимущественно образуется:
1) бутанол-1
2) бутанол-2
3) бутаналь
4) бутанон
5. При гидратации бутена-2 преимущественно образуется:
1) бутанол-1
2) бутанол-2
3) бутаналь
4) бутановая кислота
6. При взаимодействии бромоводорода с 2-бромпропеном преимущественно образуется:
1) 1,1-дибромпропан
2) 1,2-дибромпропан
3) 2,2-дибромпропан
4)1,3 -дибромпропан
7. При взаимодействии 1 моль пропина с 1 моль хлороводорода преимущественно образуется:
При взаимодействии 1 моль пропина с 1 моль хлороводорода преимущественно образуется:
1) 2-хлорпропан
2) 2-хлорпропен
3) 1-хлорпропан
4) 1-хлорпропен
8. Один и тот же продукт образуется при гидратации каждого из двух веществ:
1) бутена-1 и бутена-2
2) бутена-1 и бутина-1
3) бутина-1 и бутена-2
4) бутена-1 и пропина
9. При взаимодействии акриловой кислоты с бромоводородом преимущественно образуется:
1)1-бромпропановая кислота
2) 2-бромпропановая кислота
3) 3-бромпропановая кислота
4) α-бромпропионовая кислота
10. Взаимодействие бутена-1 с бромоводородом в присутствии пероксида водорода приводит к преимущественному образованию:
1) 1-бромбутана
2) 2-бромбутана
3) 1-бромбутена-1
4) 2-бромбутена-2
11. По правилу Марковникова происходит взаимодействие:
1) пропена и бромоводорода:
2) бутена-1 и воды
3) бутена-1 и брома
4) бутена-2 и водорода
5) бутена-1 и хлороводорода
6) этилена и кислорода
12. Для взаимодействия пропена и бромоводорода справедливы утверждения:
Для взаимодействия пропена и бромоводорода справедливы утверждения:
1) в ходе реакции образуется 1,2-дибромпропан
2) реакция протекает по правилу Зайцева
3) реакция протекает по правилу Марковникова
4) в ходе реакции образуется 2-бромпропан
5) реакция относится к реакциям замещения
6) реакция идет по иному механизму
13. Для взаимодействия бутена-1 и хлороводорода справедливы утверждения:
1) в ходе реакции образуется 1,2-дихлорбутан
2) реакция протекает по правилу Марковникова
3) реакция является эндотермической
4) в ходе реакции образуется 2-хлорбутан
5) реакция относится к реакциям замещения
6) реакция идет по ионному механизму
14. Правило Марковникова не используют для объяснения хода реакции между:
1) бутеном-1 и бромоводородом
2) пропеном и водородом
3) пропеном и водой
4) бутеном-2 и бромоводородом
5) бутеном-1 и бромом
6) бутеном-1 и водой
15.Бромирование метана:
1) осуществляется по правилу Марковникова
2) относится к радикальным реакциям
3) начинается с процесса разрыва связи в молекуле брома
4) протекает по схеме: Ch5 + Br2 →Ch3Br2+h3
5) протекает не так энергично, как реакция хлорирования
6) относится к реакциям присоединения
16. Радикал этил C2H5- :
Радикал этил C2H5- :
1) образует заряд -1
2) образуется при присоединении HCl к этилену
3) имеет нечетное число электронов
4) содержит атомы углерода в состоянии sp3-гибридизации
5) образуется при присоединении Cl2 к этену
6) электронейтрален
17. Карбокатион Ch4-CH+-Ch4:
1) образуется при хлорировании пропана
2) образуется при присоединении НВr к молекуле прпена
3) более устойчив, чем кабокатион Ch4-Ch3-Ch3+
4) содержит атомы углерода только в sp3-гибридном состоянии
5) содержит центральный атом углерода в состоянии sp2-гибридизации
6) имеет линейное строение
18. Карбокатион Ch4-Ch3-Ch3+:
1) образуется при бромировании пропана
2) образуется как основной промежуточный продукт при присоединении HBr к молекуле пропена
3) менее устойчив, чем карбокатион Ch4-CH+-Ch4
4) содержит атомы углерода только в sp3-гибридном состоянии
5) содержит атомы углерода в состоянии sp3- и sp2-гибридизации
6) содержит четное число электронов
19.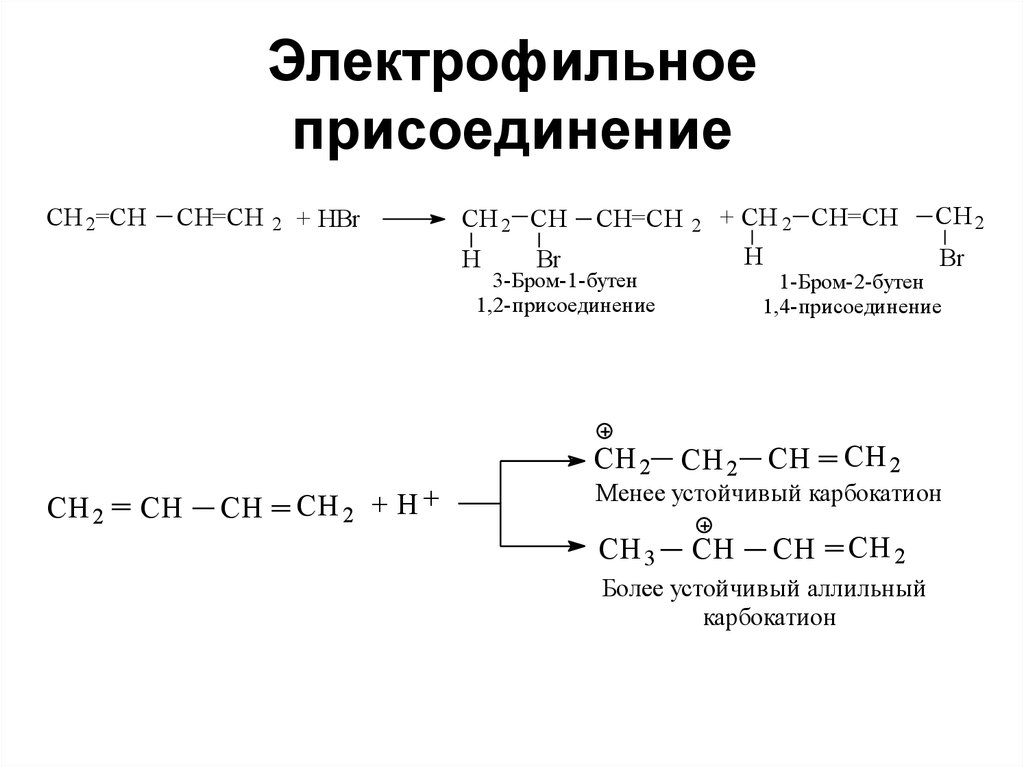 При присоединении бромоводорода к пропену :
При присоединении бромоводорода к пропену :
1) преимущественно образуется 2-бромпропавн
2) образуется 1-бромпропан и 2-бромпропан в равных соотношениях
3) происходит промежуточное образование катиона Ch4-CH+-Ch4
4) происходит промежуточное образование радикала Ch4-Ch3-Ch3-
5) правило Марковникова не соблюдается
6) разрывается π-связь в молекуле пропена
20. При присоединении воды к пропену :
1) преимущественно образуется пропанол-1
2) образуется пропанол-1 и пропанол-2 в равных соотношениях
3) разрывается π-связь в молекуле пропена
4) происходит промежуточное образование катиона Ch4-CH+-Ch4
5) правило Марковникова соблюдается
6) происходит промежуточное образование радикала Ch4-Ch3-Ch3-
ОТВЕТЫ:
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
4 | 3 | 2 | 2 | 2 | 3 | 2 | 1 | 3 | 1 |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
125 | 346 | 246 | 245 | 235 | 346 | 235 | 356 | 136 | 345 |
Добавление HBr к алкенам – Master Organic Chemistry
dasdas Описание: Обработка алкенов бромистоводородной кислотой приводит к образованию алкилбромидов.
Примечания: Это реакция присоединения. Обратите внимание, что бром всегда заканчивается на более замещенном углероде алкена (селективность по Марковникову). В третьем примере правило Марковникова не дает явного предпочтения, поэтому получается смесь. Пятый пример дает смесь диастереомеров, поскольку добавление HBr к алкену не повлияет на начальную (R) стереохимию. Последний (шестой) пример будет давать доминирующий продукт, несмотря на идентичную замену, потому что будет благоприятствовать образованию резонансно-стабилизированного карбокатиона!
Когда вторичный карбокатион образуется рядом с третичным или четвертичным углеродом, возможны перегруппировки. Дополнительные примеры см. на этих страницах:
- Присоединение с 1,2-гидридным сдвигом
- Присоединение с 1,2-алкильным сдвигом
Механизм: Электроны от связи C1-C2 π атакуют водород HBr, вытесняя бромид-анион и приводит к образованию карбокатиона (этап 1, стрелки A и B).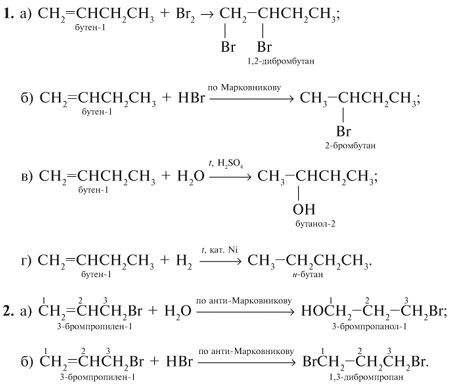 Обратите внимание, что карбокатион преимущественно образуется на C2 (вторичный), а не на C1 (первичный), поскольку вторичные карбокатионы более стабильны. Затем бромид-анион атакует карбокатион, что приводит к образованию алкилбромида (Стадия 2, стрелка C)
Обратите внимание, что карбокатион преимущественно образуется на C2 (вторичный), а не на C1 (первичный), поскольку вторичные карбокатионы более стабильны. Затем бромид-анион атакует карбокатион, что приводит к образованию алкилбромида (Стадия 2, стрелка C)
Примечания: Поскольку карбокатион плоский (плоский), нет предпочтительного направления атаки бромид-иона. Если удастся образовать стереоцентр, получится смесь стереоизомеров.
Перегруппировки: Когда вторичные (или первичные) карбокатионы образуются рядом с более замещенным углеродом , соседние атомы водорода или алкильные группы могут сдвигаться, что приводит к образованию более стабильного карбокатиона .
Первой стадией описанной ниже реакции является образование карбокатиона. Здесь показано образование карбокатиона посредством атаки алкена на H-Br. (Шаг 1, стрелки А и В). Поскольку у нас есть вторичный карбокатион, соседствующий с третичным углеродом, сдвиг водорода во вторичный карбокатион приведет к (более стабильному) третичному карбокатиону (этап 2, стрелка C). Затем третичный карбокатион захватывается, в данном случае, Br(-) (этап 3, стрелки D). Этап перегруппировки проходит через переходное состояние, такое как изображенное на рисунке.
Затем третичный карбокатион захватывается, в данном случае, Br(-) (этап 3, стрелки D). Этап перегруппировки проходит через переходное состояние, такое как изображенное на рисунке.
Дополнительный пример (расширенный): Если молекула содержит соседние стереоцентры, два направления атаки на карбокатион больше не будут иметь одинаковую энергию, и будет получена смесь диастереомеров. В этом примере предпочтительна атака бромид-иона на менее затрудненную «верхнюю поверхность» карбокатиона, и будет получена смесь продуктов (диастереомеров).
Возможны также перестановки. См. Присоединения к алкенам, сопровождаемые 1,2-гидридными сдвигами
Проверьте себя!
(продвинутые) Ссылки и дальнейшее чтение:
- Ранний пример
Стереохимия добавления водородного бромида и 1,2-диметилциклохсена
George S. Hammond и Thomas D. Nevitt
Nevitt
9007
George S. Hammond и Thomas D. D.0072
9007
George S. Hammond и Thomas D. D.0072
. Американского химического общества, 1954, 76 (16), 4121-4123,
, . Он предпочитает согласованный путь, хотя это может быть связано с условиями, которые он использует — в пентане, очень неполярном растворителе, полярные промежуточные соединения нежелательны. - Механистические исследования
Гидрохлорирование циклогексена в уксусной кислоте. Кинетические исследования и исследования продуктов
Robert C. Fahey, Michael W. Monahan, and C. Allen McPherson
Journal of the American Chemical Society 1970 92 (9), 2810-2815
DOI: 10.1021/ja00712a034
Подробные кинетические исследования добавление HCl к циклогексену в уксусной кислоте, обсуждая возможный механизм третьего порядка (скорость = к [циклогексен][HX] 2 ). - Методика эксперимента
СПИРОАННЕЛИРОВАНИЕ ЭНОЛ-СИЛАНОВ: 2-ОКСО-5-МЕТОКСИПРО[5.
 4]ДЕКАН
4]ДЕКАН Lee, T. V.; Портер, Дж. Р. Org. Синт. 1995 , 72 , 189
DOI: 10.15227/orgsyn.072.0189
Первая реакция в описанной выше процедуре включает две стадии – присоединение HBr по двойной связи и превращение альдегида в диметилацеталь.
Примеры из жизни:
Орг. Синтез. 1938, 18, 47
DOI Link: 10.15227/orgsyn.018.0047
Орг. Синтез. 1940, 20, 64
DOI Link: 10.15227/orgsyn.020.0064
Реакции алкенов с галогеноводородами
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3763
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице представлены факты и простой, лаконичный механизм реакций электрофильного присоединения между галогеноводородами и алкенами, такими как этен и циклогексен.
Реакции электрофильного присоединения с участием бромистого водорода
Алкены реагируют с бромистым водородом на холоду. Двойная связь разрывается, и к одному атому углерода присоединяется атом водорода, а к другому – атом брома. В случае этилена образуется бромэтан.
\[ \ce{CH_2=CH_2 + HBr \rightarrow CH_3CH_2Br}\]
Из циклогексена получается бромциклогексан.
Структуры циклогексена и бромциклогексана часто упрощают:
Убедитесь, что вы понимаете взаимосвязь между этими упрощенными диаграммами и полной структурой.
Механизмы
Реакции являются примерами электрофильного присоединения. С этеном и HBr:
и с циклогексеном:
Реакции электрофильного присоединения с участием других галогеноводородов
Хлороводород и другие галогеноводороды присоединяются точно таким же образом.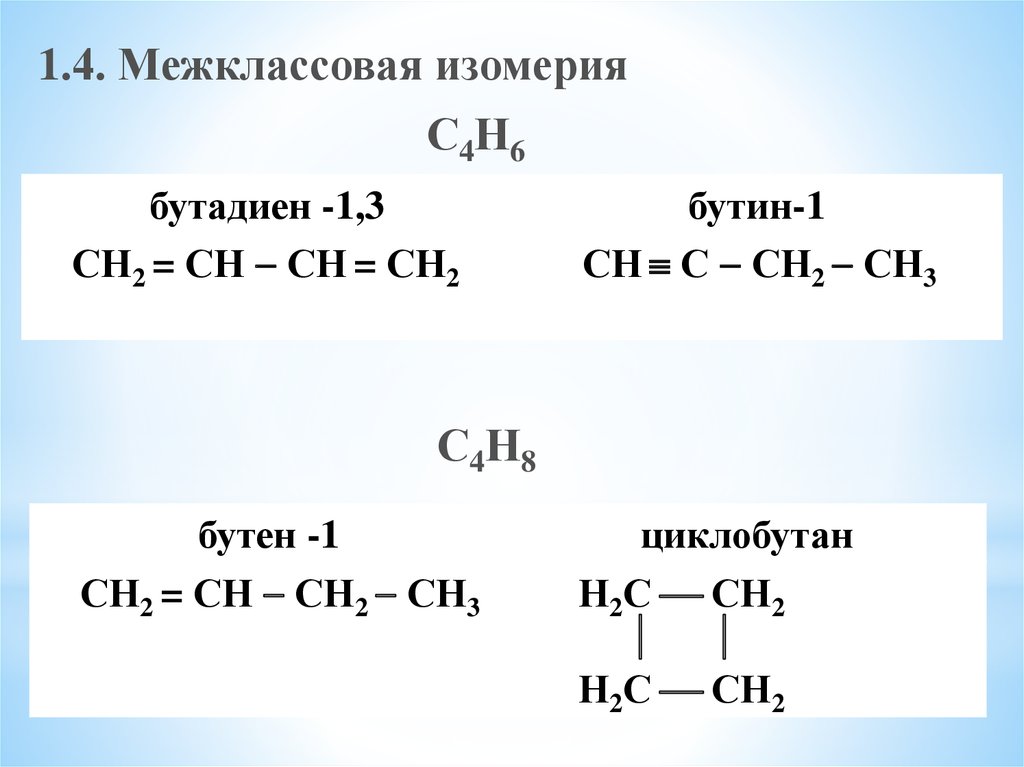 Например, хлористый водород присоединяется к этилену с образованием хлорэтана:
Например, хлористый водород присоединяется к этилену с образованием хлорэтана:
\[ \ce{CH_2=CH_2 + HCl \rightarrow CH_3CH_2Cl}\]
Единственная разница заключается в том, как быстро протекают реакции с различными галогеноводородами. Скорость реакции увеличивается по мере перехода от HF к HCl, затем к HBr и HI.
HF > HCl > HBr > HI
Причина этого в том, что по мере увеличения атомов галогена прочность связи водород-галоген падает. Прочность связи (измеряется в кДж на моль):
H-F (569 кДж) > HCl (432 кДж) > HBr (366 кДж) > HI (298 кДж)
Как вы видели в случае с HBr, на первом этапе механизма разрывается водородно-галогенная связь. Чем слабее связь, тем легче она разорвется, и поэтому реакция произойдет с большей вероятностью.
Механизмы
Реакции до сих пор являются примерами электрофильного присоединения. Например, для этилена и HCl:
Это точно такой же механизм реакции между этиленом и HBr, за исключением того, что мы заменили Br на Cl.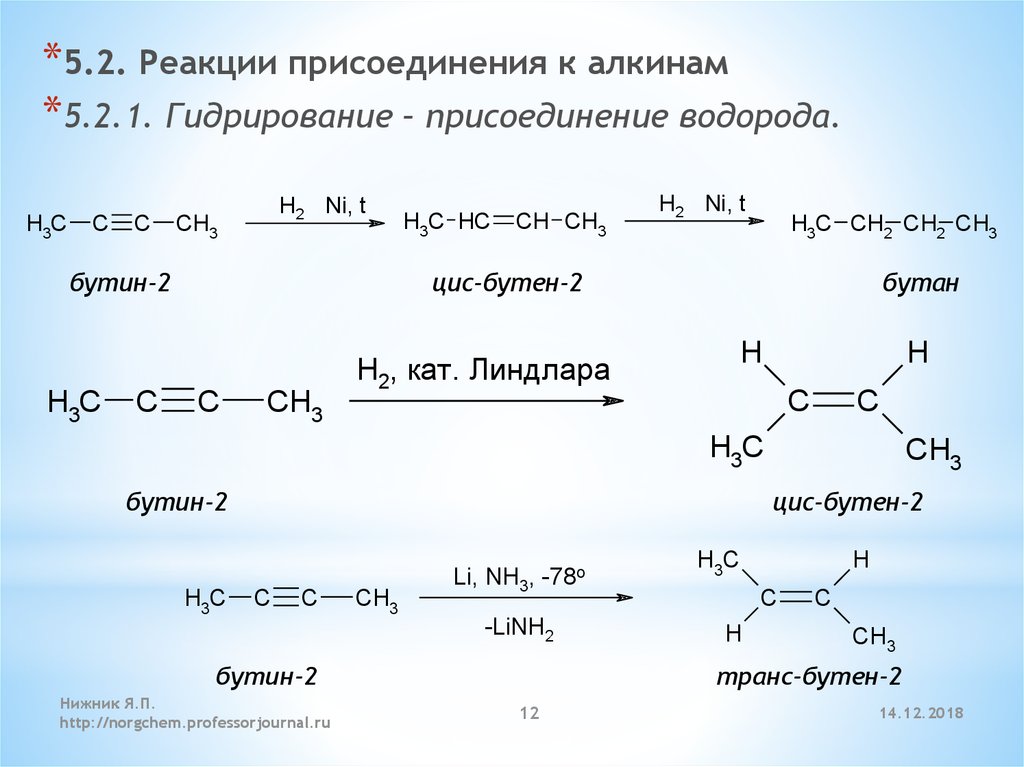

 Nevitt
Nevitt 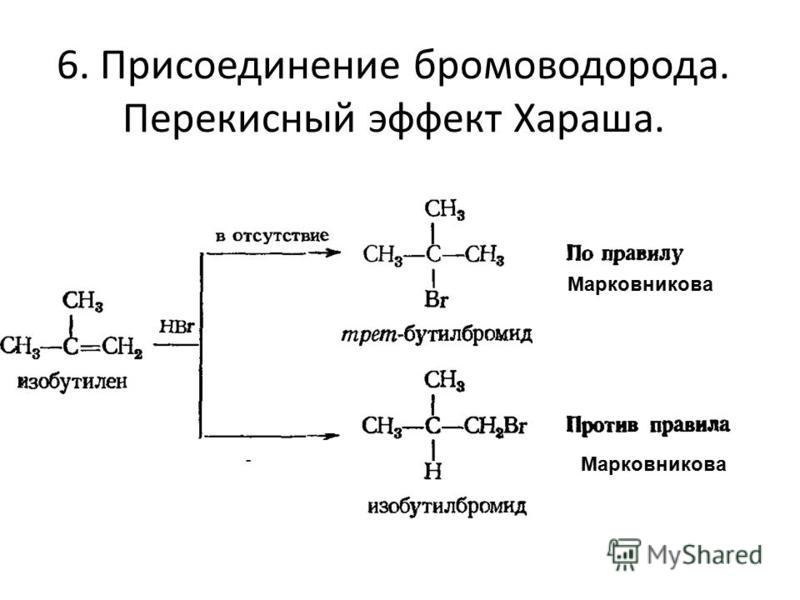 4]ДЕКАН
4]ДЕКАН
Leave A Comment