1.1. Основные виды химической связи — ЗФТШ, МФТИ
Взаимодействие валентных (наименее прочно связанных с ядром) электронов атомов приводит к образованию химических связей, т. е. к объединению атомов в молекулу. Образование молекулы из атомов возможно лишь тогда, когда оно приводит к выигрышу энергии; молекулярное состояние должно обладать меньшей энергией, чем атомное состояние, и, следовательно, быть устойчивее. Таким наиболее устойчивым является состояние атома, когда число электронов на внешнем электронном уровне максимальное, которое он может вместить; такой уровень называется завершённым и характеризуется наибольшей прочностью. Таковы электронные конфигурации атомов благородных газов. Значит, образование химической связи должно приводить к завершению внешнего электронного уровня атомов.
Это взаимодействие валентных электронов, приводящее к образованию химической связи, может осуществляться по-разному. Различают три основных вида химических связей: ковалентную, ионную и металлическую.
Рассмотрим механизм возникновения ковалентной связи на примере образования молекулы водорода:
`»H»+»H»=»H»_2`; `Delta»H»=-436` кДж/моль
Реакция сопровождается высвобождением большого количества тепла, значит, она энергетически выгодна.
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным `1s`-электроном. При сближении атомов до определённого расстояния происходит частичное перекрывание их электронных облаков (орбиталей).
Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов.
Химическую связь можно изобразить:
1) в виде точек, обозначающих электроны и поставленных у химического знака элемента:
`»H»* + *»H»=»H»:»H»` где `:` означает `sigma`-связь
2) с помощью квантовых ячеек (орбиталей), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке:
3) часто, особенно в органической химии, ковалентную связь изображают чёрточкой, которая символизирует пару электронов: `»H» — «H»`.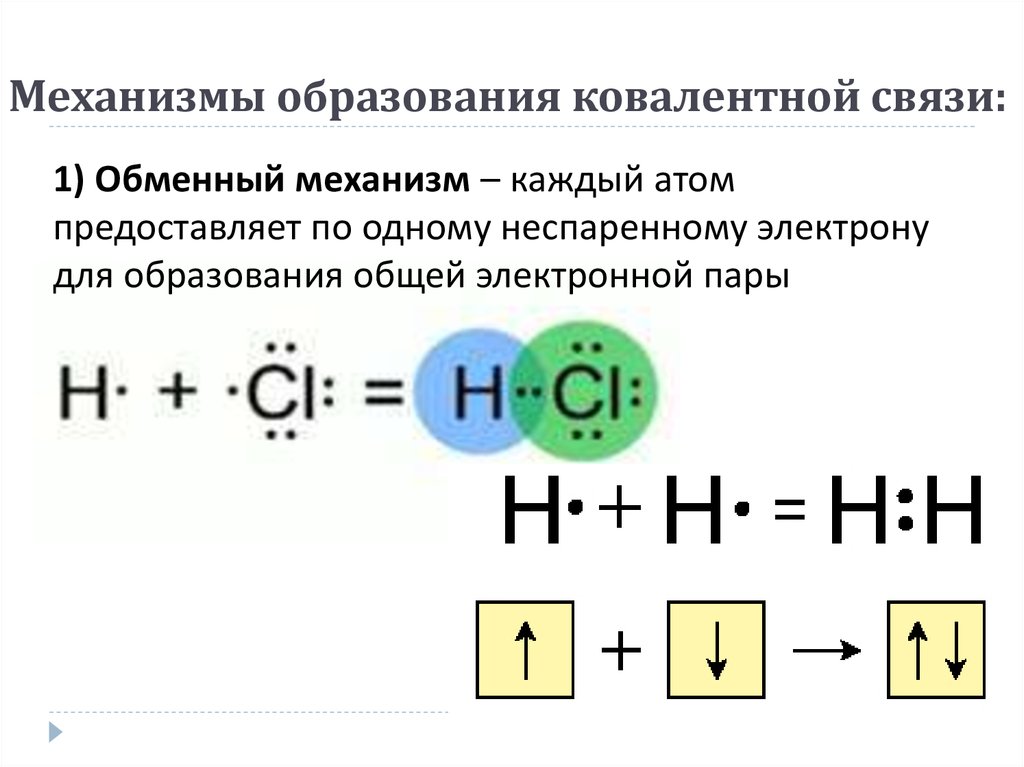
Ковалентная связь в молекуле хлора также осуществляется с помощью двух общих электронов или электронной пары:
:Cl·····+·Cl····: → :Cl····:Cl····::\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}\cdot+\cdot\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:\;\rightarrow\;:\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:
В каждом атоме хлора `7` валентных электронов, из них `6` в виде неподелённых пар, а `1` — неспаренный электрон. Образование химической связи происходит именно за счёт неспаренных электронов каждого атома хлора. Они связываются в общую пару (или неподелённую пару) электронов. Если считать, что общая пара принадлежит обоим атомам, то каждый из них становится обладателем `8` электронов, т. е. приобретает устойчивую конфигурацию благородного газа. Поэтому ясно, что молекула хлора энергетически выгоднее, чем отдельные атомы.
Это также `sigma`-связь, но она образована перекрыванием `p`-электронных орбиталей по оси `x`.
Если в реагирующих атомах имеется `2` или `3` неспаренных электрона, то могут образоваться не `1`, а `2` или `3` связи, т. е. общих электронных пары. Если между атомами возникла одна ковалентная связь, то она называется одинарной, если две — двойной, если три — тройной. Они обозначаются соответственно = или `-=` штрихами.
Но хотя обозначение их одинаково, они отличаются по своим свойствам от одинарной `sigma`-связи. Чтобы пояснить разницу, рассмотрим образование тройной связи в молекуле азота `»N»_2`. В ней атомы имеют три общие пары электронов:
:N···+·N··: → :N⋮⋮N::\overset\cdot{\underset\cdot{\mathrm N}}\cdot+\cdot\overset\cdot{\underset\cdot{\mathrm N}}:\;\rightarrow\;:\mathrm N\vdots\vdots\mathrm N:
Они образованы неспаренными `p`-электронами двух атомов азота:
Орбитали `2p`-электронов расположены взаимно перпендикулярно, т. е. по осям `x`, `y` и `z`. Если перекрывание по оси `x` ведёт к образованию `sigma`-связи (перекрывание вдоль линии, связывающей центры атомов), то перекрывание по осям `y` и `z` происходит по обе стороны линии, связывающей центры соединяющихся атомов. Такая
Такая
Очевидно, что взаимное перекрывание орбиталей в случае `pi`-связи меньше, чем в случае `sigma`-связи, поэтому `pi`-связь всегда менее прочная, чем `sigma`-связь. Но в сумме три связи `(sigma_x+pi_y+pi_z)` придают молекуле `»N»_2` большую прочность, поэтому молекула азота при нормальных условиях нереакционноспособна.
Таким образом, если имеется одинарная связь, то это обязательно `sigma`-связь; если имеется двойная или тройная связь, то одна из составляющих её связей обязательно `sigma`-связь (как более прочная она формируется первая и разрушается последняя), а остальные — `pi`-связи. И `sigma`-, и `pi`-связи — это разновидности ковалентной связи.
В общем случае
Например, полярная ковалентная связь образуется при взаимодействии атомов водорода и хлора.
H·+·Cl····: → H:Cl····:\mathrm H\cdot+\cdot\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:\;\rightarrow\;\mathrm H:\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:
Электронная пара смещена к атому хлора, так как относительная электроотрицательность хлора `(x=3)` больше, чем у водорода `(x=2,1)`.
У молекул, содержащих неполярную связь, связующее облако распределяется симметрично между ядрами обоих атомов, и ядра в равной степени тянут его к себе. Электрический момент диполя таких молекул (`»H»_2`, `»F»_2`, `»Cl»_2` и др.) равен нулю. Молекулы, содержащие полярную связь, образованы связующим электронным облаком, смещённым в сторону атома с большей относительной электроотрицательностью.
Описанные выше примеры образования ковалентной связи относятся к обменному механизму, когда каждый из соединяющихся в молекулу атомов предоставляет по электрону. Однако образование ковалентной связи может происходить и по донорно-акцепторному механизму. В этом случае химическая связь возникает за счёт двухэлектронного облака одного атома (спаренных электронов) и свободной орбитали другого атома. Атом, предоставляющий неподелённую пару, называется донором, а атом, принимающий её (т. е. предоставляющий свободную орбиталь) —акцептором.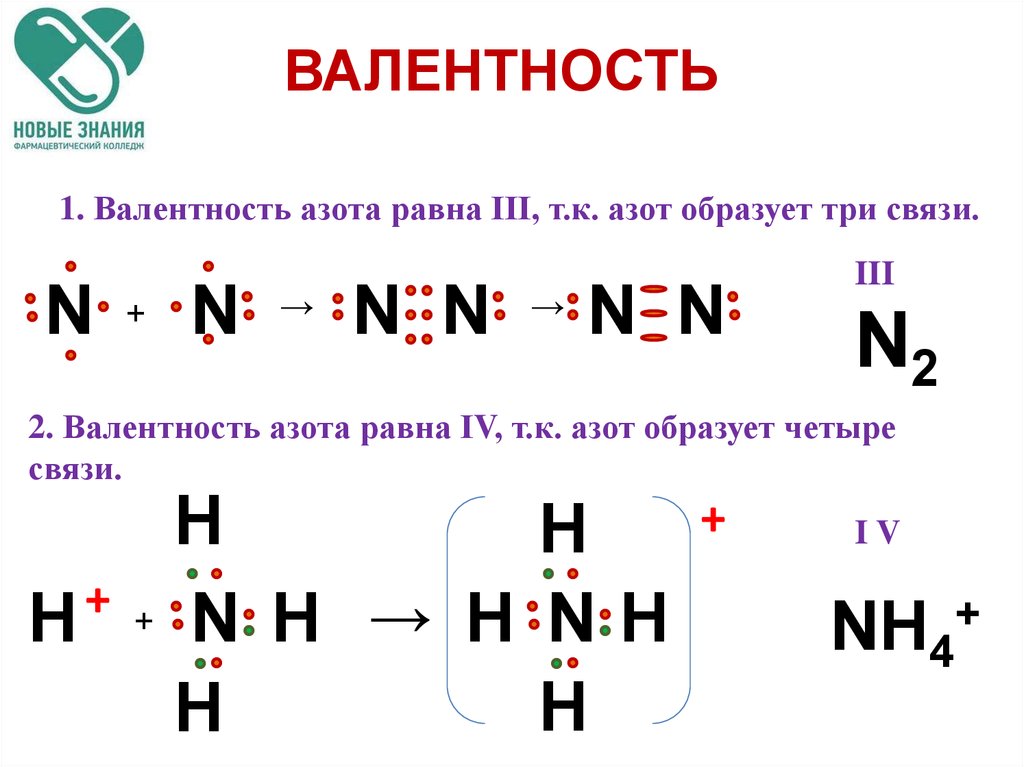 -`, несущими разноимённые заряды, возникают силы электростатического притяжения, в результате чего образуется соединение `»NaCl»`.
-`, несущими разноимённые заряды, возникают силы электростатического притяжения, в результате чего образуется соединение `»NaCl»`.
Ионные соединения образуют атомы элементов, резко отличающихся по электроотрицательности, например, атомы элементов главных подгрупп I и II групп с элементами главных подгрупп VI и VII групп.
Таким образом, между механизмами возникновения ковалентной и ионной связей нет принципиального различия. Они различаются лишь степенью поляризации (смещения) общих электронных пар. Поэтому можно рассматривать ионную связь как предельный случай полярной ковалентной связи.
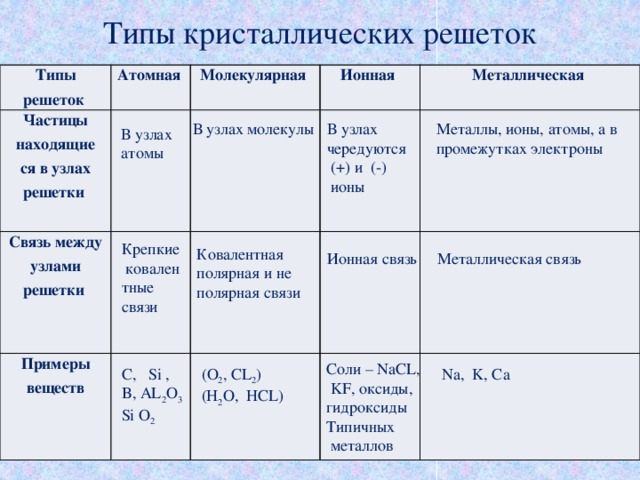
Вместе с тем надо помнить о важных отличиях ионной связи от ковалентной. Ионная связь характеризуется ненаправленностью в пространстве (каждый ион может притягивать ион противоположного знака по любому направлению) и ненасыщаемостью (взаимодействие ионов не устраняет способность притягивать или отталкивать другие ионы). Вследствие ненаправленности и ненасыщаемости ионные соединения в твёрдом состоянии представляют собой ионную кристаллическую решётку, в которой каждый ион взаимодействует не с одним, а со многими ионами противоположного знака; например, в решётке хлорида натрия катион натрия окружён шестью хлорид-анионами и наоборот. Связи между ионами многочисленны и прочны, поэтому вещества с ионной решёткой тугоплавки, малолетучи и обладают сравнительно высокой твёрдостью. При плавлении ионных кристаллов прочность связи между ионами уменьшается, и расплавы их проводят электрический ток. Ионные соединения, как правило, хорошо растворяются в воде и других полярных растворителях.
Связи между ионами многочисленны и прочны, поэтому вещества с ионной решёткой тугоплавки, малолетучи и обладают сравнительно высокой твёрдостью. При плавлении ионных кристаллов прочность связи между ионами уменьшается, и расплавы их проводят электрический ток. Ионные соединения, как правило, хорошо растворяются в воде и других полярных растворителях.
В то же время ковалентная связь отличается насыщаемостью (т. е. способностью атомов образовывать ограниченное количество ковалентных связей, определяемое числом неспаренных электронов) и направленностью (определённой пространственной структурой молекул, которой мы коснёмся ниже).
Твёрдые вещества, состоящие из молекул (полярных и неполярных), образуют молекулярные кристаллические решётки. Молекулы в таких решётках соединены сравнительно слабыми межмолекулярными силами, поэтому вещества с молекулярной решёткой имеют малую твёрдость, низкие температуры плавления, они плохо растворимы в воде, а их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной кристаллической решёткой невелико: лёд, твёрдый оксид углерода (IV) («сухой лёд»), твёрдые галогеноводороды и простые вещества, но зато большинство кристаллических органических соединений имеют молекулярную решётку.
Число неорганических веществ с молекулярной кристаллической решёткой невелико: лёд, твёрдый оксид углерода (IV) («сухой лёд»), твёрдые галогеноводороды и простые вещества, но зато большинство кристаллических органических соединений имеют молекулярную решётку.
Если же в узлах решётки располагаются атомы, соединённые прочными ковалентными связями, то такие вещества имеют высокие температуры плавления, прочность и твёрдость, они практически нерастворимы в жидкостях.
Характерный пример вещества с атомной кристаллической решёткой — алмаз; она характерна также для твёрдого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Особый тип решётки в твёрдом состоянии образуют металлы. В узлах такой металлической кристаллической решётки находятся катионы металлов, а между ними — отрицательно заряженный «электронный газ». Атомы металлов в решётке упакованы так тесно, что валентные орбитали соседних атомов перекрываются, и электроны получают возможность свободно перемещаться из орбиталей одного атома в орбитали других атомов, осуществляя связь между всеми атомами данного кристалла металла. Лишённые валентных электронов, атомы превращаются в катионы, а электроны, осуществляющие связь, перемещаются по всему кристаллу металла и становятся общими.
Лишённые валентных электронов, атомы превращаются в катионы, а электроны, осуществляющие связь, перемещаются по всему кристаллу металла и становятся общими.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку и в её основе лежит обобществление валентных электронов. Однако при ковалентной связи эти электроны находятся вблизи соединённых атомов и прочно с ними связаны, тогда как при металлической связи электроны свободно перемещаются по всему кристаллу и принадлежат всем его атомам. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической — пластичны, т. е. без разрушения изменяют форму, прокатываются в листы, вытягиваются в проволоку. Наличие свободных электронов придаёт кристаллам металлов непрозрачность, высокую электрическую проводимость, теплопроводность.
Водородная связь весьма распространена и играет важную роль при ассоциации молекул, в процессах кристаллизации, растворения, образования кристаллогидратов, электролитической диссоциации и других важных физико-химических процессах.
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары:
Эта способность обусловливает строение и свойства воды и льда.
Вода является жидкостью, хотя более тяжелый сероводород – полный электронный аналог воды – газ. Молекулы воды образуют между собой водородные связи, что увеличивает плотность вещества в жидком состоянии и его температуру кипения. Между молекулами сероводорода подобных связей не возникает из-за большого радиуса и сравнительно малой электроотрицательности атома серы.
При замерзании количество водородных связей между молекулами воды становится максимальным. Строго ориентируясь относительно друг друга, они образуют правильные шестиугольники. Образованные ими канальцы заполнены воздухом, поэтому плотность льда меньше плотности воды.
Водородная связь приводит к образованию димеров муравьиной и уксусной кислот, устойчивых в газообразном и жидком состоянии:
Благодаря водородной связи фтороводород `»HF»` в обычных условиях существует в жидком состоянии (`»t»_»кип»=19,5^@»C»`), а плавиковая кислота диссоциирует с образованием как фторид-аниона `»F»^-`, так и гидродифторид-аниона `»HF»_2^-`.
Важную роль играют водородные связи в химии процессов жизнедеятельности, поскольку они распространены в молекулах белков, нуклеиновых кислот и других биологически важных соединений.
Тема 2 «Строение молекул. Химическая свя
Тема 2 «Строение молекул. Химическая связь. Валентность. Степень окисления»
Вопрос А3. Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Вопрос А4. Валентность химических элементов. Степень окисления химических элементов.
Тест 1.
1. Какое из веществ имеет ковалентную полярную связь?
1) Р4 2) СаS 3) HI 4) BaBr2
2. Какое из указанных веществ имеет ковалентную неполярную связь?
1) h3O 2) S8 3) Cah3 4) C2H6
3. Какое из веществ имеет ионную связь?
1) LiCl 2) HBr 3) O2 4) CO
4. Одинаковый вид химической связи имеют углекислый газ и…
1) белый фосфор 2) ацетилен 3) кремний 4) кислород
5. Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно:
1) фтор и хлорид калия 2) водород и хлор 3) сера и водород 4) вода и кислород
6. Ионная связь характерна для каждого из двух веществ:
Ионная связь характерна для каждого из двух веществ:
1) негашеная известь, каменная соль
2) озон, железняк
3) сероводород, аммиак
4) метан, бронза
7. В молекуле оксида азота (I) химические связи:
1) ионные 2) металлические 3) ковалентные неполярные 4) ковалентные полярные
8. Какое из указанных веществ имеет металлическую связь:
1) Zn 2) S 3) C 4) KH
9. Наименьшее значение степени окисления фосфор имеет в соединении
1) Р2О3 2) Р2О5 3) Н3Р 4) Са(Н2РО4)2
10. Высшую степень окисления хлор проявляет в соединении
1) Cl2О 2) ClО3 3) AlCl3 4) НClО4
11. В соединениях SiO2 и K2SiO3 степени окисления кремния соответственно равны:
1) +4,+4 2) +4,-4 3) -4,+4 4) -4,+2
12. Значения высшей и низшей степеней окисления кремния соответственно равны:
1) +4,-4 2) +2,-4 3) +4,-2 4) -2,-3
13. Только валентность II проявляет в соединениях:
1) бериллий 2) фтор 3) алюминия 4) кремний
14. Постоянную валентность в соединениях имеет:
Постоянную валентность в соединениях имеет:
1) сера 2) кислород 3) фосфор 4) азот
15. Бром в веществах, формулы которых Br2O7, CaBr2, Br2 имеет соответственно степени окисления:
1) +7, 0, -1 2) +7, -1, 0 3) -1, +7, 0 4) 0, -1, +7
Вопрос А3. Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Вопрос А4. Валентность химических элементов. Степень окисления химических элементов.
Тест 2.
1. Какое из веществ имеет ковалентную полярную связь?
1) Ch5 2) S8 3) CuO 4) Zn
2. Какое из указанных веществ имеет ковалентную неполярную связь?
1) h3 2) Cl2O 3) PCl3 4) MgO
3. Какое из веществ имеет ионную связь?
1) Mg 2) NO 3) Cu3Zn2 4) CaS
4. Одинаковый вид химической связи имеют бромид кальция и…
1) бром 2) оксид калия 3) оксид азота (I) 4) оксида кремния (VI)
5. Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно:
1) хлор и бромид натрия 2) водород и хлор 3) алмаз и водород 4) вода и кислород
6. Веществами с ионной и ковалентной неполярной связью являются соответсвенно:
Веществами с ионной и ковалентной неполярной связью являются соответсвенно:
1) азот, озон
2) оксида азота (I), озон
3) хлорид натрия, азот
4) азот, сульфат кальция
7. В молекуле метана химическая связь:
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
8. Тип химической связи в соединении фтора с кальцием:
1) ионная 2) металлическая 3) ковалентная неполярная 4) ковалентная полярная
9. Наибольшее значение степени окисления фосфор имеет в соединении
1) КН2РО3 2) h4РО4 3) Na3Р 4) Р4
10. Низшую степень окисления фосфор проявляет в соединении
1) h4РО3 2) P2О3 3) h4P 4) AlPО4
11. В соединениях Nh4 и HNO2 степени окисления азота соответственно равны:
1) -3,+4 2) +3,+4 3) +4,+1 4) -3,+3
12. Значения высшей степеней окисления азота и алюминия соответственно равны:
1) +5,+3 2) +5,0 3) -5,+3 4) +2,+5
13. Валентность IV характерна для:
1) кальция 2) фосфора 3) кислорода 4) кремния
14. Постоянную валентность в соединениях имеет:
Постоянную валентность в соединениях имеет:
1) фтор 2) хлор 3) бром 4) иод
15. Азот в веществах, формулы которых Nh4, HNO2, NO имеет соответственно степени окисления:
1) +3, +2, -3 2) -3, +3, +2 3) -3, +5, +2 4) +3, -3, +2
ГИА-2016, вопрос 3.
1. Какой вид химической связи в оксиде бария?
1) ковалентная неполярная
2) металлическая
3) ковалентная полярная
4) ионная
2. Какой вид химической связи в оксиде хлора(VII)?
1) ковалентная полярная
2) ионная
3) ковалентная неполярная
4) металлическая
3. Какой вид химической связи характерен для меди?
1) ковалентная неполярная
2) металлическая
3) ионная
4) ковалентная полярная
4. Ковалентную полярную связь имеет каждое из двух веществ
1) оксид натрия и оксид хлора(VII)
2) оксид кремния и аммиак
3) хлорида лития и кислород
4) сероводород и хлор
5. Ковалентная неполярная связь образуется между атомом хлора и атомом
Ковалентная неполярная связь образуется между атомом хлора и атомом
1) углерода
2) калия
3) водорода
4) хлора
6. В соединении натрия с кислородом химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
7. Веществами с ионной и ковалентной неполярной связью являются соответственно
1) хлорид натрия и хлор
2) водород и хлор
3) хлорид меди(II) и хлороводород
4) вода и магний
8. Ионная связь характерна для каждого из двух веществ:
1) хлорид калия и хлороводород
2) хлорид бария и оксид натрия
3) хлорид натрия и оксид углерода(IV)
4) оксид лития и хлор
9. Химическая связь в хлориде кальция
1) ковалентная полярная
2) ионная
3) ковалентная неполярная
4) металлическая
10. Какой вид химической связи в молекуле фтора?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
11. Химическая связь в кристалле оксида кальция
Химическая связь в кристалле оксида кальция
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
12. Химическая связь в кристалле хлорида натрия
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
13. Ионная химическая связь реализуется в
1) хлороводороде
2) гидроксиде натрия
3) оксиде углерода(II)
4) оксиде углерода(IV)
14. Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) оксид фосфора и оксид натрия
2) хлорид натрия и хлор
3) азот и сульфид натрия
4) хлорид кальция и хлороводород
15. Только ковалентная неполярная связь имеется в
1) молекуле воды
2) кристалле
3) кристалле кремния
4) молекуле пероксида водорода
16. Ионная химическая связь реализуется в
1) кристаллической сере
2) твёрдом иоде
3) иодиде кальция
4) оксиде фосфора(V)
17. Ковалентная неполярная связь реализуется в
Ковалентная неполярная связь реализуется в
1) молекуле оксида углерода(IV)
2) молекуле
3) кристаллическом льде
4) молекуле
18. Химическая связь в молекуле углекислого газа
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
19. Ковалентная полярная связь имеется в молекуле
1) серной кислоты
2) пластической серы
3) хлора
4) сульфида рубидия
20. Вещество, образованное посредством ионных связей:
1) оксид серы(IV)
2) оксид бария
3) сероводород
4) аммиак
21. Вещество, образованное посредством ковалентных неполярных связей:
1) метан
2) алмаз
3) оксид углерода(IV)
4) сероводород
22. Химическая связь в молекуле
1) водородная
2) ковалентная неполярная
3) ковалентная полярная
4) ионная
23. Химическая связь в молекуле
Химическая связь в молекуле
1) ковалентная неполярная
2) ковалентная полярная
3) ионная
4) водородная
24. Какой вид химической связи в молекуле фтора?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
25. В молекуле фтора химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
26. Химическая связь в молекулах серы
1) ковалентная неполярная
2) ковалентная полярная
3) ионная
4) металлическая
27. Химическая связь в молекулах белого фосфора
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
28. Соединение, в котором реализуется ионная связь,
1) оксид фосфора(V)
2) хлорид фосфора(V)
3) фосфорная кислота
4) фосфат натрия
29. Вещество, в котором реализуется ковалентная неполярная связь, —
Вещество, в котором реализуется ковалентная неполярная связь, —
1) хлорид натрия
2) оксид хлора(I)
3) хлороводород
4) хлор
30. В молекуле фтора химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
10.3: Соединения хлора — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 212674
- Эндрю Р. Бэррон
- Университет Райса через CNX
Сравнение с фтором
Чтобы оценить химию хлора по сравнению с фтором, необходимо оценить различия и тенденции между элементами. Как видно из таблицы \(\PageIndex{1}\), хлорида значительно больше, чем фтора. Кроме того, хотя хлор является электроотрицательным элементом, его электроотрицательность значительно меньше, чем у фтора, что приводит к менее полярной связи.
Как видно из таблицы \(\PageIndex{1}\), хлорида значительно больше, чем фтора. Кроме того, хотя хлор является электроотрицательным элементом, его электроотрицательность значительно меньше, чем у фтора, что приводит к менее полярной связи.
| Элемент | Ионный радиус (Å) | Ковалентный радиус (Å) | Радиус Ван-дер-Ваала (Å) | Электроотрицательность |
|---|---|---|---|---|
| Фтор | 1,33 | 0,64 | 1,47 | 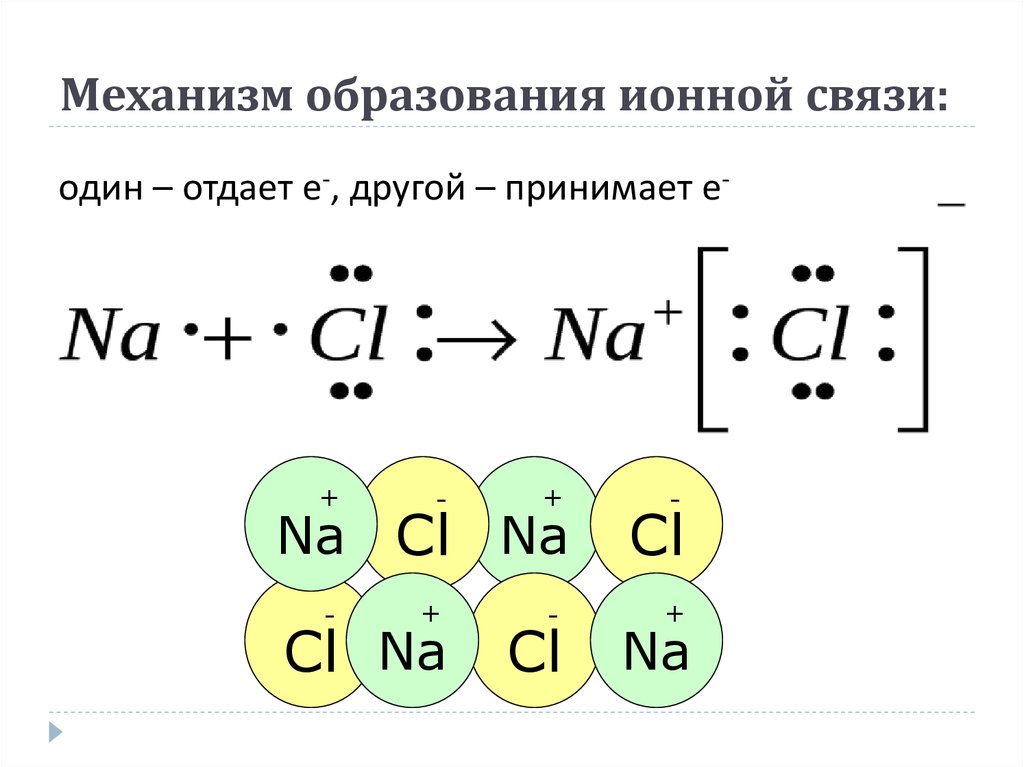 1 1 |
| Хлор | 1,81 | 0,99 | 1,75 | -2,9 |
Связь X-Cl представляет собой ковалентную связь электронной пары с высокой полярностью. В этом отношении хлор подобен фтору. Однако есть две ключевые особенности в отношении связывания хлора, которые отличают его от фтора.
- В отличие от фтора хлор может образовывать множественные ковалентные связи, например, ClO 4 — и ClF 3 .
- В отличие от фтора хлор может образовывать π-связи с кислородом, т. е. Cl=O.
Ион хлорида (Cl — ) образует соли с ионными решетками (например, NaCl), но также образует широкий спектр комплексов, например, [Fe(H 2 O) 5 Cl] 2+ и [RhCl 6 ] 3- . Хлорид также действует как мостиковый лиганд, в котором один, два или три хлорида могут соединять два металлических центра (рис. \(\PageIndex{1}\)).
Хлорид также действует как мостиковый лиганд, в котором один, два или три хлорида могут соединять два металлических центра (рис. \(\PageIndex{1}\)).
Хлоридные (и бромидные) мостики обычно изогнуты, тогда как фторидные мостики могут быть как линейными, так и изогнутыми. Например, BeF 2 и BeCl 2 изоструктурны, состоят из бесконечных цепочек с изогнутыми перемычками (рис. \(\PageIndex{2}\)). Напротив, пентагалогениды переходных металлов имеют различную структуру в зависимости от типа галогенида. При этом TaCl 5 димеризуется с изогнутыми мостиками (рис. \(\PageIndex{3}\)a), а TaF 5 образует циклический тетрамер с линейными фторидными мостиками (рис. \(\PageIndex{3}\)b). .
Галогенный мостик
Мостиковые галогенидные связи могут быть описаны как теорией Льюиса, так и теорией молекулярных орбиталей (МО). В простой картине можно представить, что неподеленная пара концевого галогенида действует как лиганд-донор основания Льюиса для второго кислотного металлического центра Льюиса. Действительно, некоторые мостиковые галогениды асимметричны, что согласуется с этой точкой зрения; однако симметричные могут быть описаны резонансной формой. С точки зрения молекулярных орбиталей мостиковый галогенид представлен комбинацией двух центрированных металлических орбиталей с двумя галогенными орбиталями.
В простой картине можно представить, что неподеленная пара концевого галогенида действует как лиганд-донор основания Льюиса для второго кислотного металлического центра Льюиса. Действительно, некоторые мостиковые галогениды асимметричны, что согласуется с этой точкой зрения; однако симметричные могут быть описаны резонансной формой. С точки зрения молекулярных орбиталей мостиковый галогенид представлен комбинацией двух центрированных металлических орбиталей с двумя галогенными орбиталями.
Хлористый водород
Хлористый водород (HCl) получают реакцией концентрированной серной кислоты (H 2 SO 4 ) либо с NaCl, либо с концентрированным раствором HCl.
Хлористый водород представляет собой полярную молекулу с диполем 1,08 Д. Однако более низкая полярность по сравнению с полярностью фтористого водорода (1,91 Д) согласуется с физическими и химическими свойствами. Хлористый водород представляет собой газ при комнатной температуре (т.пл. = -114,25°С, т.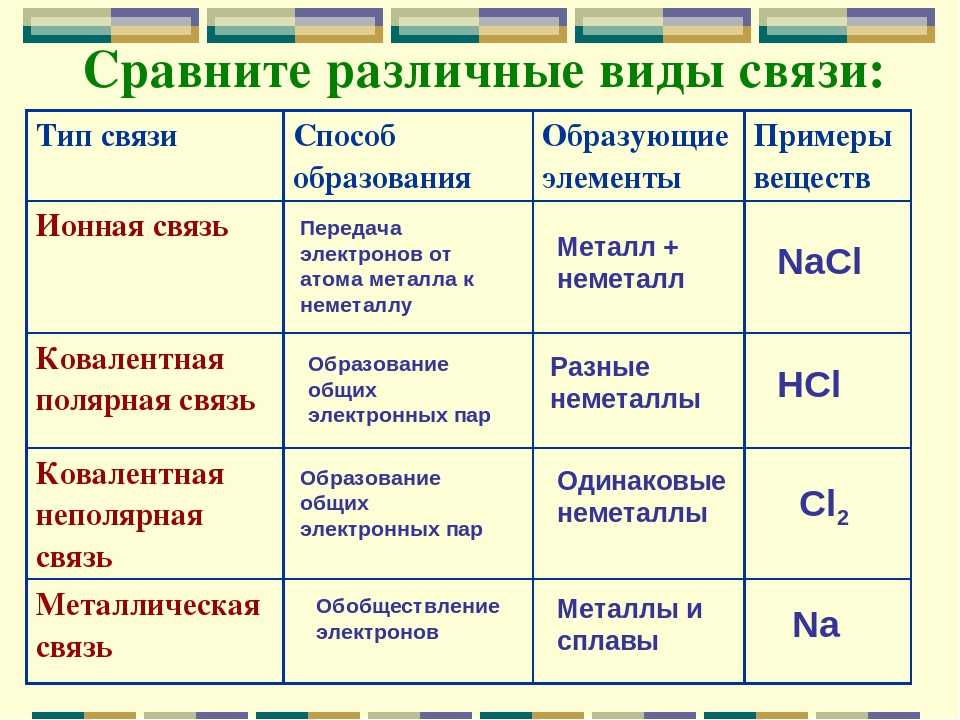 пл. = -85,09°С), и его низкая температура кипения соответствует слабой водородной связи в жидком состоянии. Хотя самоионизация (10.3.1) очень мала, жидкая HCl растворяет некоторые неорганические соединения с образованием проводящих растворов (10.3.2). 9- \]
пл. = -85,09°С), и его низкая температура кипения соответствует слабой водородной связи в жидком состоянии. Хотя самоионизация (10.3.1) очень мала, жидкая HCl растворяет некоторые неорганические соединения с образованием проводящих растворов (10.3.2). 9- \]
Оксиды хлора
Хлор образует ряд оксидов (Таблица \(\PageIndex{2}\)), в которых хлор имеет формальные степени окисления +1, +4, +6 и +7. Физические свойства оксидов приведены в таблице \(\PageIndex{2}\). В то время как оксиды хлора не очень стабильны (на самом деле некоторые из них чувствительны к ударам и склонны к взрыву), сопряженные оксикислоты стабильны.
| Соединение | Мп (°С) | Бп (°С) |
|---|---|---|
| Класс 2 О | -116 | 4 |
| ClO 2 | -5,9 | 10 |
| Класс 2 О 4 | -117 | 44,5 |
| 3,5 | нестабильный | |
| Класс 2 О 7 | -91,5 | 82 |
Монооксид дихлора (Cl 2 O, рисунок \(\PageIndex{4}\)a) представляет собой желтовато-красный газ, который получают реакцией хлора с оксидом ртути (10.
\[ \rm 2 Cl_2 + 2 HgO \rightarrow HgCl_2 \cdot HgO + Cl_2O\]
Рисунок \(\PageIndex{4}\): Структура (а) Cl 2 O, (б) ClO 2 , (c) Cl 2 O 4 и (d) Cl 2 O 7 .При нагревании или воздействии искры Cl 2 O взрывается до Cl 2 и O 2 . Монооксид дихлора реагирует с водой с образованием оранжево-желтого раствора хлорноватистой кислоты (10.3.5).
\[ \rm H_2O_{(г)} + Cl_2O_{(г)} \rightleftharpoons 2 HOCl_{(г)} \]
Диоксид хлора (ClO 2 ) представляет собой желтоватый газ при комнатной температуре и обычно используется в промышленности в качестве окислителя. Лучший синтез ClO  3.6). Фотолиз ClO 2 дает темно-коричневое твердое вещество с формулой Cl 2 O 3 ; однако его легкое взрывное разложение препятствует изучению.
3.6). Фотолиз ClO 2 дает темно-коричневое твердое вещество с формулой Cl 2 O 3 ; однако его легкое взрывное разложение препятствует изучению.
\[ \rm 2 NaClO_3 + SO_2 + H_2SO_4 \rightarrow 2 ClO_2 + 2 NaHSO_4\]
Структура ClO 2 (Рисунок \(\PageIndex{4}\)b) эквивалентна SO 2 с одним дополнительным электроном, что приводит к образованию парамагнитных неспаренных электронов. Необычно то, что, несмотря на неспаренную электронную конфигурацию, ClO 2 не проявляет тенденции к димеризации. В отличие от аналогичного NO 2 молекула.
Тетраоксид дихлора (Cl 2 O 4 ) обычно называют перхлоратом хлора из-за его структуры (рис. \(\PageIndex{4}\)c). Гексаоксид дихлора (Cl 2 O 6 ) представляет собой нестабильное красное масло, имеющее в твердом состоянии ионную структуру: [ClO 
Гептоксид дихлора (Cl 2 O 7 ) представляет собой относительно стабильное масло, которое получают дегидратацией хлорной кислоты при температуре -10 °C (10.3.7) с последующей вакуумной перегонкой. Структура Cl 2 O 7 (рис. \(\PageIndex{4}\)d) был определен методом электронной дифракции в газовой фазе.
\[ \rm HClO_4 \xrightarrow[-H_2O]{+ P_4O_5} Cl_2O_7\]
Реакция Cl 2 O 7 со спиртами и аминами дает алкилперхлораты (ROClO
Фториды хлора
Учитывая изолобальное соотношение между галогенами, неудивительно, что могут быть получены смешанные дигалогены, например, ClF, ICl и BrCl. Фторид хлора представляет собой высокореакционный газ (Bp = -100,1 °C), который является сильным фторирующим агентом и получается путем окисления хлора трифторидом хлора (10.3.8).
\[ \rm Cl_2 + ClF_3 \rightarrow 3 ClF\]
Более высокая электроотрицательность фтора по сравнению с хлором (таблица \(\PageIndex{1}\)), и способность хлора образовывать более одной связи , означает, что известны также высшие фториды хлора, т.
\[ \rm Cl_2 + 3 F_2 \xrightarrow{200 °C} 2 ClF_3\]
\[ \rm KCl + 3 F_2 \xrightarrow{200 °C} ClF_5 + KF\]
Структура ClF 3 имеет Т-образную форму с двумя неподеленными парами на хлоре (рис. \(\PageIndex{5}\)a), а ClF 5 имеет квадратно-пирамидальную форму с одной неподеленной парой на хлоре (рис. \(\PageIndex{ 5}\)б).
Рисунок \(\PageIndex{5}\): Структуры (а) ClF 3 и (b) CLF 5 .Обычно фториды галогенов очень реакционноспособны; взрывные реакции происходят с органическими соединениями. Все они являются сильными фторирующими агентами при разбавлении азотом, и порядок реакционной способности следующий:
\[ \rm ClF_3 > BrF_3 > BrF_5 > IF_7 > ClF > IF_5 > BrF\]
Как и большинство фторидов галогенов, ClF, ClF 3 и ClF 5 реагируют с сильными основаниями (например, фторидами щелочных металлов) с образованием анионов (10.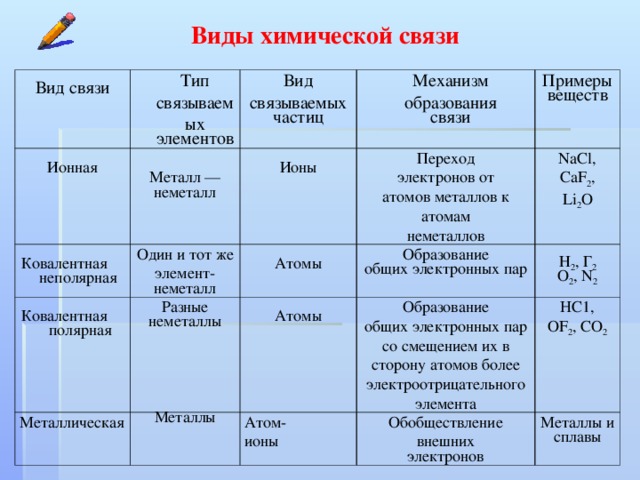 3.12) и (10.3.13) и сильных кислот (например, AsF 9-\]
3.12) и (10.3.13) и сильных кислот (например, AsF 9-\]
Эта страница под названием 10.3: Соединения хлора распространяется под лицензией CC BY 3.0 и была создана, изменена и/или курирована Эндрю Р. Бэрроном (CNX) через исходный контент, отредактированный в соответствии со стилем и стандартами LibreTexts. Платформа; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Эндрю Р. Бэррон
- Лицензия
- СС BY
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- галогенный мостик
- source@https://cnx.org/contents/[email protected]:HUxicYBD@1/Preface-to-the-Chemistry-of-the-Main-Group-Elements
6.4 Ионная связь | Химическая связь
Предыдущий 6.3 Ковалентная связь | Следующий 6.5 Металлическое соединение |
6.4 Ионная связь (ESABW)
Природа ионной связи (ESABX)
Когда электроны переносятся от одного атома к другому, это называется ионный
склеивание .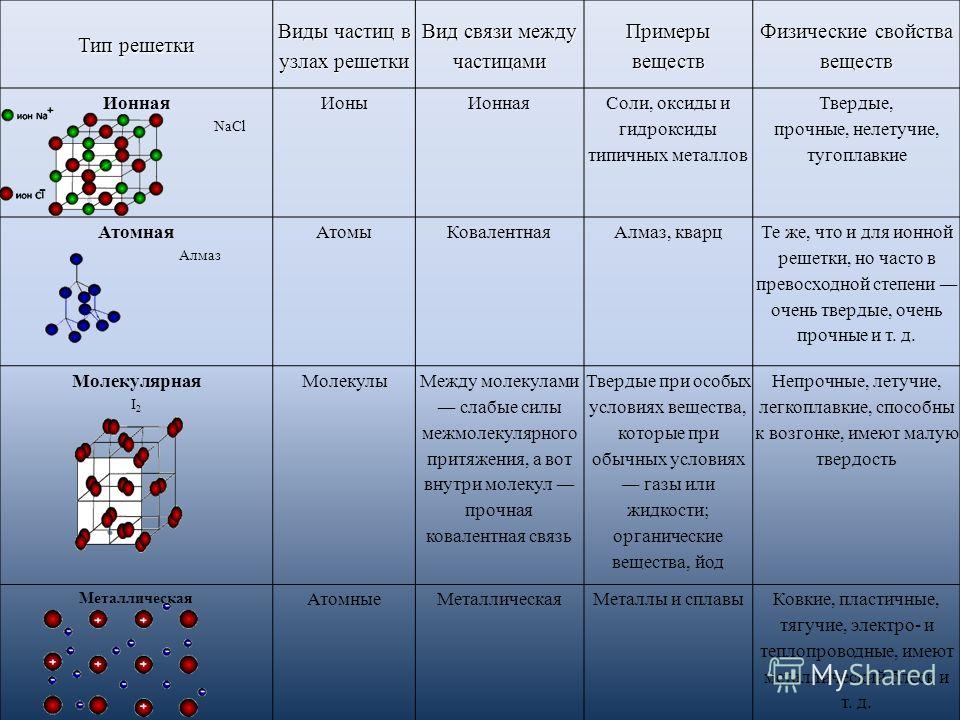
Электроотрицательность — это свойство атома, описывающее, насколько сильно он притягивает или удерживает
электроны. Ионная связь возникает, когда разница в электроотрицательности между
два атома больше, чем \(\text{1,7}\). Обычно это происходит, когда атом металла связывается
с атомом неметалла. Когда разница в электроотрицательности велика, один атом
притягивают общую электронную пару намного сильнее, чем другую, заставляя электроны
переносится на атом с большей электроотрицательностью. При образовании ионных связей металл
отдает один или несколько электронов из-за низкой электроотрицательности для образования положительного
ион или катион. Атом неметалла обладает высокой электроотрицательностью, поэтому легко
получает электроны, образуя отрицательный ион или анион. Затем два иона притягиваются друг к другу.
другие электростатическими силами.
Затем два иона притягиваются друг к другу.
другие электростатическими силами.
- Ионная связь
Ионная связь – это тип химической связи, при котором один или несколько электронов переходят от одного атома к другому.
Пример 1:
В случае \(\text{NaCl}\) разница в электроотрицательности между \(\text{Na}\)
(\(\текст{0,93}\)) и \(\text{Cl}\) (\(\text{3,16}\)) равно \(\text{2,1}\). Натрий имеет только
один валентный электрон, а у хлора семь. Поскольку электроотрицательность
хлор выше, чем электроотрицательность натрия, хлор будет притягивать
валентный электрон атома натрия очень сильно. {+}\).
9{-}\) ион.
{+}\).
9{-}\) ион.
Хлор представляет собой двухатомную молекулу, поэтому для того, чтобы он мог участвовать в образовании ионной связи, он должен сначала распадаются на два атома хлора. Натрий является частью металлической решетки и отдельные атомы должны сначала оторваться от решетки.
Таким образом, электрон переходит от натрия к хлору:
Рисунок 6.1: Ионная связь в хлориде натрия
Сбалансированное уравнение реакции:
\[2\text{Na} + \text{Cl}_{2} \rightarrow 2\text{NaCl}\]Пример 2:
Другой пример ионной связи имеет место между магнием \((\text{Mg})\) и кислородом.
\((\text{O}_{2})\) с образованием оксида магния \((\text{MgO})\). {2-}\). Сила притяжения между противоположно заряженными ионами
удерживает соединение вместе.
{2-}\). Сила притяжения между противоположно заряженными ионами
удерживает соединение вместе.
Сбалансированное уравнение реакции:
\[2\text{Mg} + \text{O}_{2} \rightarrow 2\text{MgO}\]Поскольку кислород представляет собой двухатомную молекулу, для соединения с одним потребуется два атома магния. молекула кислорода (которая имеет два атома кислорода) для производства двух единиц оксида магния \((\текст{MgO})\).
временный текстСтруктура кристаллической решетки ионных соединений (ESABY)
Ионные вещества на самом деле представляют собой комбинацию множества ионов, связанных вместе в гигантский
молекула. Расположение ионов в правильной геометрической структуре называется кристаллическая решетка . Так что на самом деле \(\text{NaCl}\) не содержит ни одного
\(\text{Na}\) и один ион \(\text{Cl}\), а скорее много этих двух ионов, расположенных в
кристаллическая решетка, в которой соотношение ионов \(\text{Na}\) к ионам \(\text{Cl}\) составляет 1:1.
структура кристаллической решетки показана ниже.
Так что на самом деле \(\text{NaCl}\) не содержит ни одного
\(\text{Na}\) и один ион \(\text{Cl}\), а скорее много этих двух ионов, расположенных в
кристаллическая решетка, в которой соотношение ионов \(\text{Na}\) к ионам \(\text{Cl}\) составляет 1:1.
структура кристаллической решетки показана ниже.
Рисунок 6.2: Расположение кристаллической решетки в \(\text{NaCl}\)
Рисунок 6.3: Модель заполнения пространства решетки хлорида натрия
Свойства ионных соединений (ЭСАБЗ)
Ионные соединения обладают рядом свойств:
Ионы расположены в решетчатой структуре
Ионные твердые вещества являются кристаллическими при комнатной температуре
Ионная связь представляет собой сильное электростатическое притяжение.
 Это означает, что ионный
соединения часто твердые и имеют высокие температуры плавления и кипения
Это означает, что ионный
соединения часто твердые и имеют высокие температуры плавления и кипенияИонные соединения хрупки, и связи разрываются вдоль плоскостей, когда компаунд находится под давлением (напряженный)
Твердые кристаллы не проводят электричество, а ионные растворы проводят
Ионные соединения
Учебник Упражнение 6.3
Объясните разницу между ковалентным и ионная связь .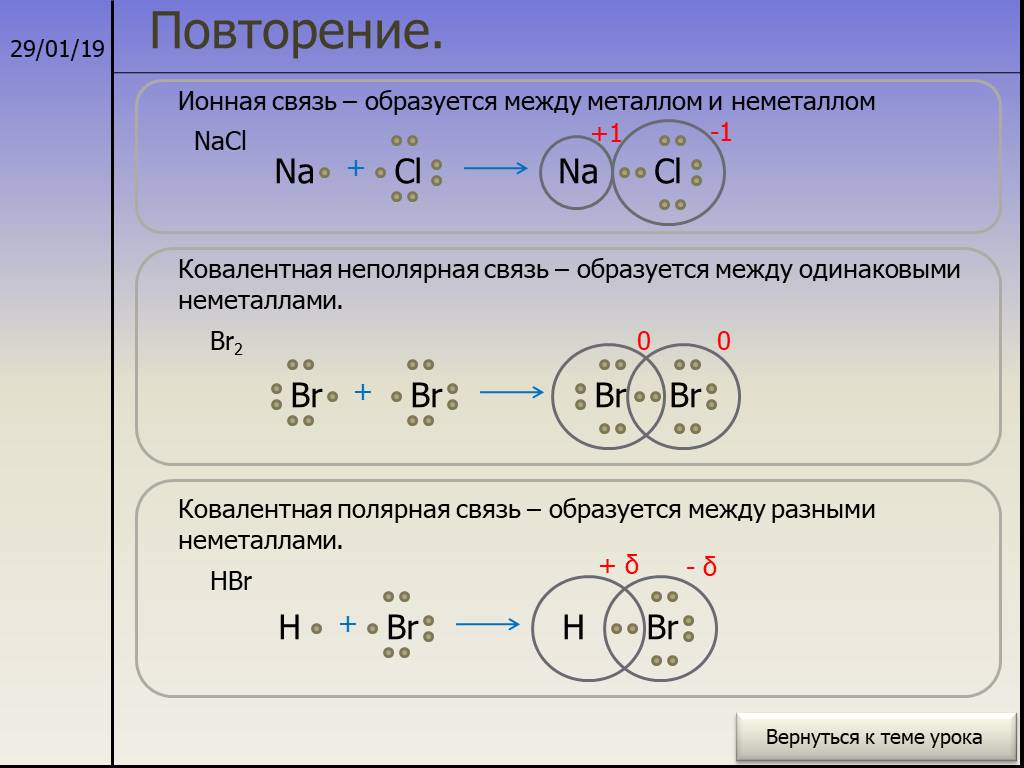
Решение пока недоступно.
Магний и хлор реагируют с образованием хлорида магния.
Какая разница в электроотрицательности между этими двумя элементами?
Назовите химическую формулу:
ион магния
ион хлорида
ионное соединение, которое производится в течение этого реакция
Напишите сбалансированное химическое уравнение для реакция, которая имеет место.

Решение пока недоступно.
Нарисуйте диаграммы Льюиса для представления следующих ионных соединения:
йодид натрия \((\text{NaI})\)
бромид кальция \((\text{CaBr}_{2})\)
хлорид калия \((\text{KCl})\)
Решение пока недоступно.


 Это означает, что ионный
соединения часто твердые и имеют высокие температуры плавления и кипения
Это означает, что ионный
соединения часто твердые и имеют высокие температуры плавления и кипения
Leave A Comment