фенол, физические, химические свойства и применение фенола
Фенол (гидроксибензол, устар. карболовая кислота) C6H5OH — простейший представитель класса фенолов. Мировое производство фенола на 2006 год составляет 8,3 млн тонн/год. По объёму производства фенол занимает 33-е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ.
Получение, производство фенола
В настоящее время производство фенола в промышленном масштабе осуществляется следующими способами способами:
Кумольный метод получение фенола
Кумольный метод. Этим способом получают более 95 % всего производимого в мире фенола. В каскаде барботажных колонн кумол подвергают некаталитическому окислению воздухом с образованием гидропероксида кумола (ГПК). Полученный ГПК, при катализе серной кислотой, разлагают с образованием фенола и ацетона. Кроме того, ценным побочным продуктом этого процесса является α-метилстирол.
Окисление толуола, с промежуточным образованием бензойной кислоты
Около 3 % всего фенола получают окислением толуола, с промежуточным образованием бензойной кислоты.
Весь остальной фенол выделяют из каменноугольной смолы.
Ведутся пилотные испытания установок получения фенола прямым окислением бензола закисью азота и кислотным разложением гидропероксида втор-бутилбензола.
Фенол также можно получить восстановлением хинона.
Физические свойства
Представляет собой бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ (это связано с промежуточным образованием хинонов). Обладает специфическим запахом (таким, как запах гуаши, так как в состав гуаши входит фенол). Умеренно растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Химические свойства
Из-за наличия ароматического кольца и гидроксильной группы фенол проявляет химические свойства, характерные как для спиртов, так и для ароматических углеводородов.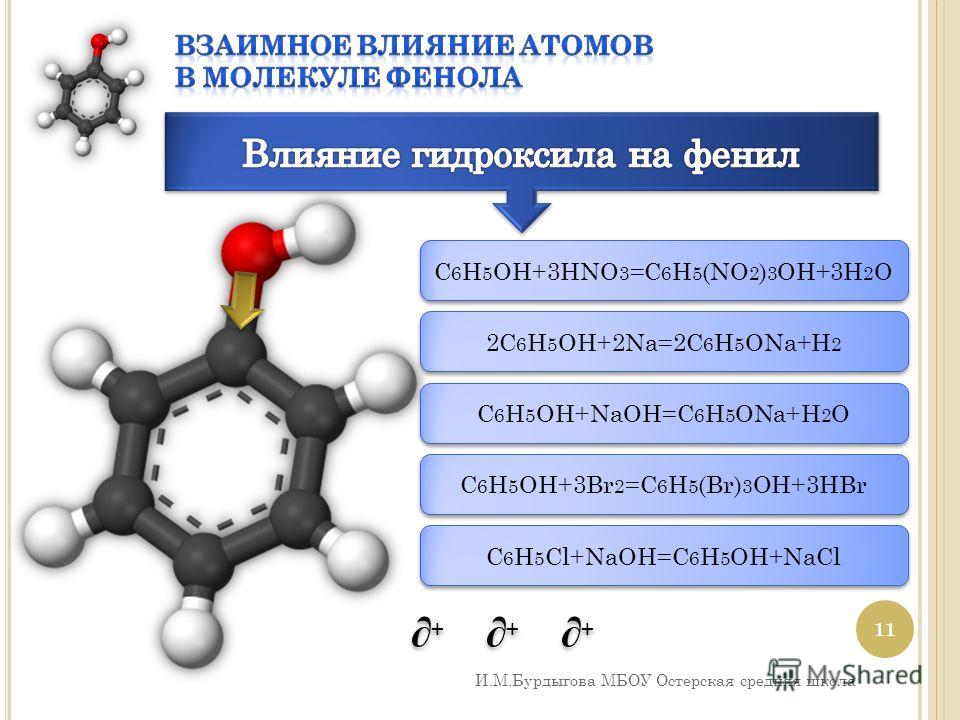
По гидроксильной группе:
Обладает слабыми кислотными свойствами (более сильными, чем у спиртов), при действии щелочей образует соли — феноляты (например, фенолят натрия — C6H5ONa):
\mathsf{C_6H_5OH + NaOH \rightarrow C_6H_5ONa + H_2O}
Фенол — очень слабая кислота; даже угольная кислота вытесняет его из фенолятов:
{\displaystyle {\mathsf {C_{6}H_{5}ONa+H_{2}CO_{3}\rightarrow C_{6}H_{5}OH+NaHCO_{3))))
Более интенсивно феноляты разлагаются под действием сильных кислот, например, серной:
{\displaystyle {\mathsf {C_{6}H_{5}ONa+H_{2}SO_{4}\rightarrow C_{6}H_{5}OH+NaHSO_{4))))
Взаимодействие с металлическим натрием:
\mathsf{2C_6H_5OH + 2Na \rightarrow 2C_6H_5ONa + H_2\uparrow}
Фенол непосредственно не этерифицируется карбоновыми кислотами, эфиры можно получить при взаимодействии фенолятов с ангидридами или галогенангидридами кислот:
{\displaystyle {\mathsf {C_{6}H_{5}ONa+CH_{3}COCl\rightarrow C_{6}H_{5}OCOCH_{3}+NaCl))}
{\displaystyle {\mathsf {C_{6}H_{5}ONa+(CH_{3}CO)_{2}O\rightarrow C_{6}H_{5}OCOCH_{3}+CH_{3}COONa))}
Образование простых эфиров.

Для получения простых эфиров фенола действуют галогеналканами или галогенпроизводными аренов на феноляты. В первом случае получают смешанные жирно-ароматические простые эфиры:
{\displaystyle {\mathsf {C_{6}H_{5}ONa+CH_{3}I\rightarrow C_{6}H_{5}OCH_{3}+NaI))}
Во втором случае получают чисто-ароматические простые эфиры:
{\displaystyle {\mathsf {C_{6}H_{5}ONa+C_{6}H_{5}Cl{\xrightarrow[{}]{Cu))C_{6}H_{5}OC_{6}H_{5}+NaCl))}
Реакция проводится в присутствии порошкообразной меди, которая служит катализатором.
При перегонке фенола с цинковой пылью происходит замещение гидроксильной группы водородом:
{\displaystyle {\mathsf {C_{6}H_{5}OH+Zn\rightarrow C_{6}H_{6}+ZnO))}
По ароматическому кольцу:
Вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп (вследствие уменьшении электронной плотности на функциональной группе), увеличивает реакционную способность кольца к этим реакциям и направляет замещение в орто- и пара-положения.
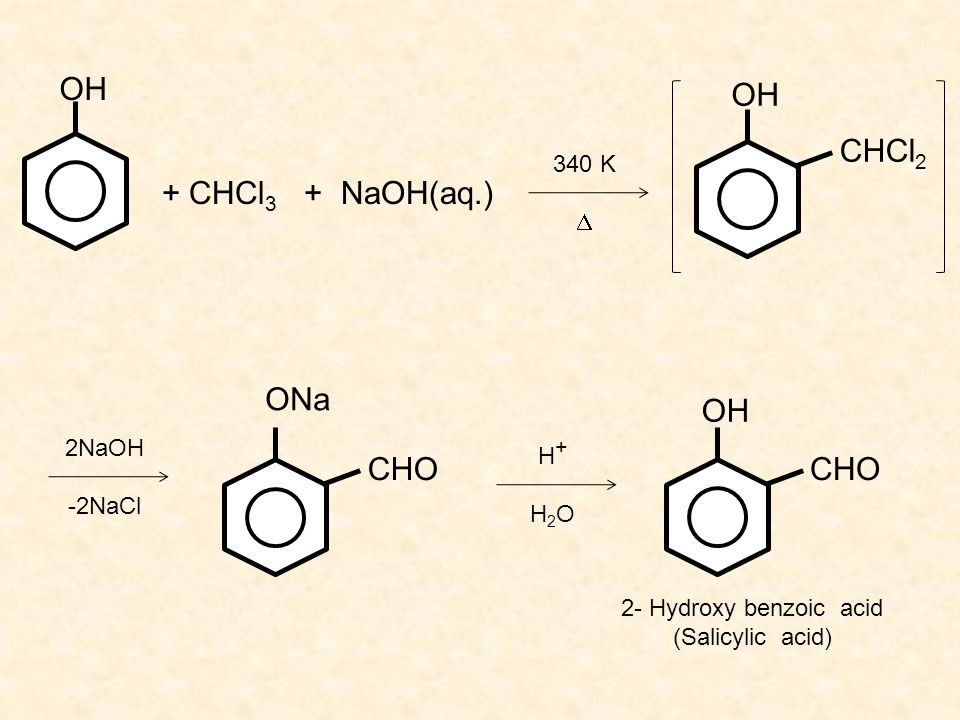
Реакция Кольбе — Шмитта служит для синтеза салициловой кислоты и её производных (ацетилсалициловой кислоты и других).
{\displaystyle {\mathsf {C_{6}H_{5}OH+CO_{2}{\xrightarrow[{}]{NaOH))C_{6}H_{4}OH(COONa)))}
{\displaystyle {\mathsf {C_{6}H_{4}OH(COONa)+H_{2}SO_{4}\rightarrow C_{6}H_{4}OH(COOH)+NaHSO_{4))))
Взаимодействие с бромной водой (качественная реакция на фенол):
\mathsf{C_6H_5OH + 3Br_2 \rightarrow C_6H_2Br_3OH + 3HBr}
образуется 2,4,6-трибромфенол — твёрдое вещество белого цвета.
Взаимодействие с концентрированной азотной кислотой:
\mathsf{C_6H_5OH + 3HNO_3 \rightarrow C_6H_2(NO_2)_3OH + 3H_2O}
Взаимодействие с хлоридом железа(III) (качественная реакция на фенол):
\mathsf{6C_6H_5OH + FeCl_3 \rightarrow [Fe(C_6H_5OH)_6]Cl_3}
Реакция присоединения
Гидрированием фенола в присутствии металлических катализаторов получают циклогексанол и циклогексанон:
{\displaystyle {\mathsf {2C_{6}H_{5}OH+5H_{2}{\xrightarrow {t,p,kat:Pt/Pd,Pd/Ni,Pd/Al_{2}O_{3},Ni/Cr/Al_{2}O_{3))}C_{6}H_{11}OH+C_{6}H_{10}O))}
Окисление фенола
Вследствие наличия гидроксильной группы в молекуле фенола устойчивость к окислению намного ниже, чем у бензола. В зависимости от природы окислителя и условия проведения реакции получаются различные продукты.
В зависимости от природы окислителя и условия проведения реакции получаются различные продукты.
Так, под действием пероксида водорода в присутствии железного катализатора образуется небольшое количество двухатомного фенола — пирокатехина:
{\displaystyle {\mathsf {C_{6}H_{5}OH+2H_{2}O_{2}{\xrightarrow[{-H_{2}O}]{kat:Fe))C_{6}H_{4}(OH)_{2))))
При взаимодействии более сильных окислителей (хромовая смесь, диоксид марганца в кислой среде) образуется пара-хинон.
Биологическая роль и значение
Протеиногенная аминокислота тирозин является структурным производным фенола и может быть рассмотрена как пара-замещённый фенол или α-замещённый пара-крезол. В природе распространены и другие фенольные соединения, в том числе полифенолы. В свободном виде фенол встречается у некоторых микроорганизмов и находится в равновесии с тирозином. Равновесие поддерживает фермент тирозин-фенол-лиаза (КФ 4.1.99.2).
Биологическое значение фенола обычно рассматривается в рамках его воздействия на окружающую среду.
Применение
Ммировое потребление фенола имеет следующую структуру (данные 2006 г.):
44 % фенола расходуется на производство бисфенола А, который, в свою очередь, используется для производства поликарбонатов и эпоксидных смол;
30 % фенола расходуется на производство фенолформальдегидных смол;
12 % фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон — нейлона и капрона;
в России большое количество фенола используется в нефтепереработке, в частности для селективной очистки масел на технологических установках типа 37/1 и А-37/1. Фенол проявляет высокую селективность и эффективность при удалении из масел смолистых веществ, различных полициклических ароматических углеводородов с короткими боковыми цепями, а также соединений, содержащих серу;
остальной фенол расходуется на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов.
Фенол и его производные обусловливают консервирующие свойства коптильного дыма. Также фенол используют в качестве консерванта в вакцинах. Пример использования, в качестве антисептика — препарат «Орасепт» и «Фукорцин». В косметологии как химический пилинг (токсично).
в скотоводстве: дезинфекция животных растворами фенола и его производных.
в косметологии для проведения глубокого пилинга.
Токсические свойства
Фенол ядовит. Относится к высокоопасным веществам (Класс опасности II). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуют.
Предельно допустимые концентрации (ПДК) фенола:
- ПДКр.з. = 1 мг/м³
-
ПДКр.
 с. = 0,3 мг/м³
с. = 0,3 мг/м³ - ПДКм.р. = 0,01 мг/м³
- ПДКс.с. = 0,003 мг/м³
- ПДКв. = 0,001 мг/л.
Попадая на кожу, фенол очень быстро всасывается даже через неповреждённые участки и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Смертельная доза для человека при попадании внутрь 1—10 г, для детей 0,05—0,5 г[9].
Фенольная катастрофа в Уфе
Наглядный пример воздействия фенола на окружающую среду был продемонстрирован весной 1990 года в Уфе. В результате техногенной аварии на предприятии ПО «Уфахимпром» произошла утечка большого количества фенола в речку Шугуровка, впадающую в более крупную реку Уфу, являющуюся источником хозяйственно-питьевого водоснабжения города Уфы. Загрязнение воды в районе Южного водозабора превышало ПДК более чем в 100 раз.
Загрязнение воды в районе Южного водозабора превышало ПДК более чем в 100 раз.
Опасность загрязнения питьевой воды фенолом проявляется в том, что при очистке вод использовался хлор, который, взаимодействуя с фенолом, образовывал хлорпроизводные (смесь хлорфенолов) — более токсичные вещества (некоторые в 100—250 раз превышают токсичность самого фенола). Было оповещено население Уфы об опасности употребления водопроводной воды для питья. Общая численность населения, потреблявшего питьевую воду, загрязненную фенолом из Южного водозабора Уфы, составила 672 876 человек
ФГБОУ ВО ПГФА Минздрава России
Пермская государственная
фармацевтическая академия
Для слабовидящих
Осторожно, грипп!!!
…
Правила здоровья
…
еще .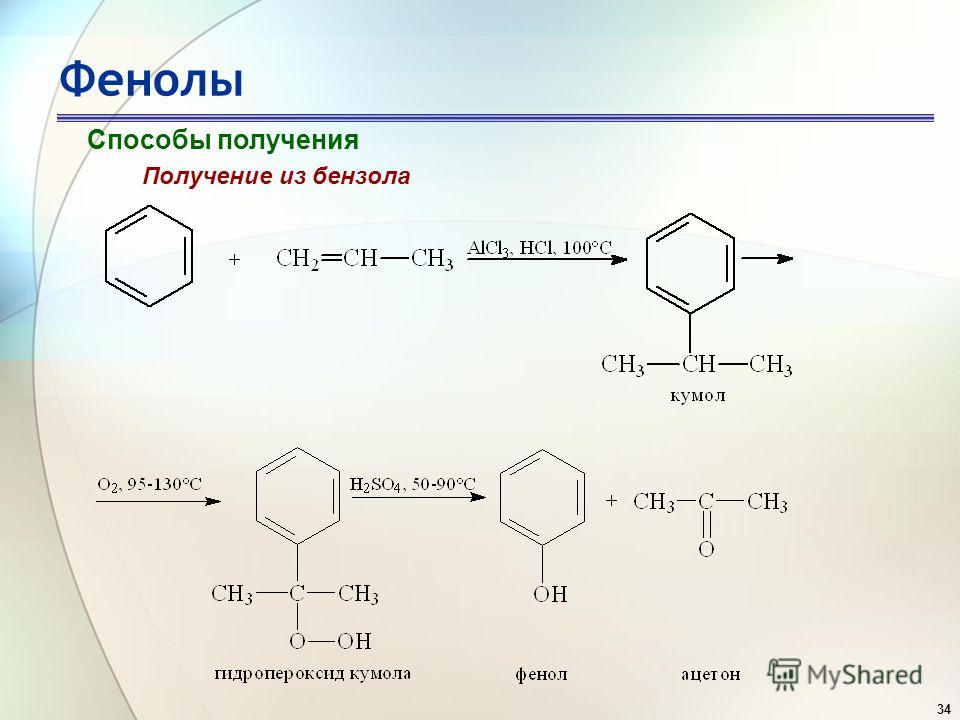 ..
..
Наши новости
Поздравление Министра здравоохранения Российской Федерации М.А. Мурашко с праздником 8 Марта
07 марта 2023
ПГФА открывает прием на обучение в Королевстве Марокко
03 февраля 2023
еще …
Наши события
85 лет Молоховой Лилии Георгиевне (1938-2007)
03 марта 2023
Концерт «Сквозь мечты» 3 марта 2023 года в 18:00
02 марта 2023
еще …
Конференции, олимпиады, форумы…
Исследования учёных ПГФА получили высокую оценку на конференции по цифровизации фармации в Тюмени
22 февраля 2023
Приглашение к участию в Международном литературном конкурсе «Живая латынь»
09 января 2023
I международная научно-практическая Олимпиада по философии для студентов медвузов
15 декабря 2022
еще . ..
..
Новости спорта
II этап I Спартакиады «Физическая культура и спорт — вторая профессия врача» по мини-футболу
07 марта 2023
Игры по волейболу, посвященные Международному женскому дню 8-е марта
06 марта 2023
Соревнования по мини-футболу между сборными женских команд
22 февраля 2023
еще …
Button
Коммерческое предложение ПК 2023
Ученый совет
Научный полк
Обращение советов ректоров вызов Пермского края
Мисс Фармация-2019
День открытых дверей
Информация об аккредитации специалистов
Галерея новостей
Видеообзор — введение в профессию
Ректор ПГФА Алексей Юрьевич Турышев рассказывает о перспективах специальности и приёме в 2019 году
В ПГФА имеется 200 бюджетных мест для абитуриентов. Трудоустройство выпускников ПГФА почти 100 %. ПГФА обеспечивает половину кадровой потребности отрасли. Провизоры — аналитики, технологи, организаторы. Обеспечивается полный цикл обучения от создания молекулы до разработки лекарственной формы. Эфир 26 февраля 2019 года
Трудоустройство выпускников ПГФА почти 100 %. ПГФА обеспечивает половину кадровой потребности отрасли. Провизоры — аналитики, технологи, организаторы. Обеспечивается полный цикл обучения от создания молекулы до разработки лекарственной формы. Эфир 26 февраля 2019 года
Смотреть все видеообзоры о професии
Условия проживания студентов в общежитии № 2 (более новое первое общежитие не показано). Съёмка 2016 года.
Имеющиеся у ПГФА два общежития неизменно входят в десятку лучших общежитий образовательных учреждений города Перми. В общежитиях имеются столовая, кухни на каждом этаже, библиотека, спортзал, бытовая, душевая и постирочная комнаты (общежитие № 1 новее).
Первокурсники на лабораторных занятиях по физике в ПГФА. Съёмка 25 февраля 2019 года
На первом курсе студенты изучают биологию, физиологию, математику, физику, неорганическую химию, физическую химию, латинский язык, информатику, экономическую теорию, историю. Основной предмет — химия. За годы учёбы её будет 9 видов.
Впечатления первокурсника
после двух месяцев учёбы в 2018 году.
Ректор
Проректоры
Помощник ректора по воспитательной работе
Ученый совет
Административно — управленческие подразделения
Ведущий юрисконсульт
Учебные подразделения
Кафедры
Научные подразделения
Корпуса и общежития
Отдел качества
Региональный испытательный центр «Фарматест»
Полиграфический отдел
Стоматологическая клиника
Столовая
Здравпункт
Музей
Профком сотрудников
Профком студентов
Социально-психологическая служба
Фенол | Определение, структура, использование и факты
фенолформальдегидная смола
См. все материалы
- Связанные темы:
- бисфенол А хлорфенол салициловая кислота бисфенол F бисфенол С
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
фенол , любое из семейства органических соединений, характеризующееся гидроксильной (—ОН) группой, присоединенной к атому углерода, являющемуся частью ароматического кольца. Помимо использования в качестве общего названия для всей семьи, термин фенол также является конкретным названием его простейшего члена, моногидроксибензола (C 6 H 5 OH), также известного как бензол или карболовая кислота.
Помимо использования в качестве общего названия для всей семьи, термин фенол также является конкретным названием его простейшего члена, моногидроксибензола (C 6 H 5 OH), также известного как бензол или карболовая кислота.
Фенолы похожи на спирты, но образуют более прочные водородные связи. Таким образом, они лучше растворимы в воде, чем спирты, и имеют более высокие температуры кипения. Фенолы встречаются либо в виде бесцветных жидкостей, либо в виде белых твердых веществ при комнатной температуре и могут быть очень токсичными и едкими.
Британская викторина
Наука: правда или вымысел?
Фенолы широко используются в бытовых продуктах и в качестве промежуточных продуктов для промышленного синтеза. Например, сам фенол используется (в низких концентрациях) в качестве дезинфицирующего средства в бытовых чистящих средствах и средствах для полоскания рта. Фенол, возможно, был первым хирургическим антисептиком.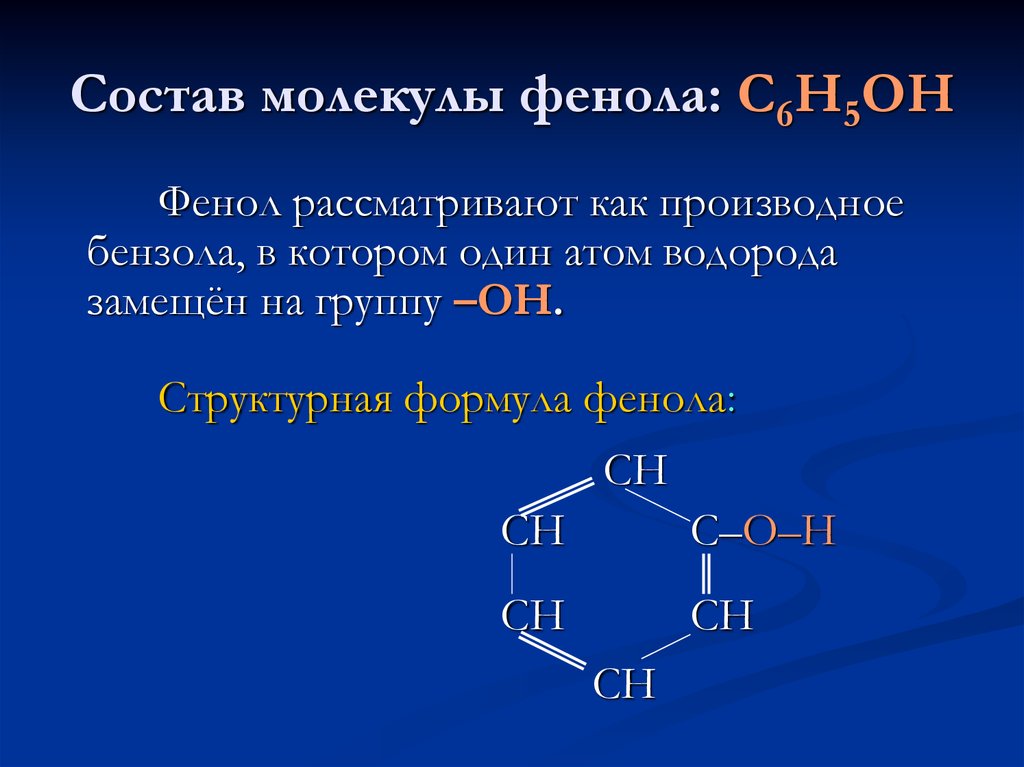 В 1865 году британский хирург Джозеф Листер использовал фенол в качестве антисептика для стерилизации своего операционного поля. При таком использовании фенола смертность от хирургических ампутаций в отделении Листера снизилась с 45 до 15 процентов. Однако фенол довольно токсичен, и его концентрированные растворы вызывают тяжелые, но безболезненные ожоги кожи и слизистых оболочек. Менее токсичные фенолы, такие как n -гексилрезорцин, вытеснили сам фенол в леденцах от кашля и других антисептических средствах. Бутилированный гидрокситолуол (БГТ) обладает гораздо меньшей токсичностью и является распространенным антиоксидантом в пищевых продуктах.
В 1865 году британский хирург Джозеф Листер использовал фенол в качестве антисептика для стерилизации своего операционного поля. При таком использовании фенола смертность от хирургических ампутаций в отделении Листера снизилась с 45 до 15 процентов. Однако фенол довольно токсичен, и его концентрированные растворы вызывают тяжелые, но безболезненные ожоги кожи и слизистых оболочек. Менее токсичные фенолы, такие как n -гексилрезорцин, вытеснили сам фенол в леденцах от кашля и других антисептических средствах. Бутилированный гидрокситолуол (БГТ) обладает гораздо меньшей токсичностью и является распространенным антиоксидантом в пищевых продуктах.
В промышленности фенол используется в качестве исходного материала для производства пластмасс, взрывчатых веществ, таких как пикриновая кислота, и лекарств, таких как аспирин. Обычный фенолгидрохинон является компонентом фотографического проявителя, который превращает открытые кристаллы бромида серебра в черное металлическое серебро.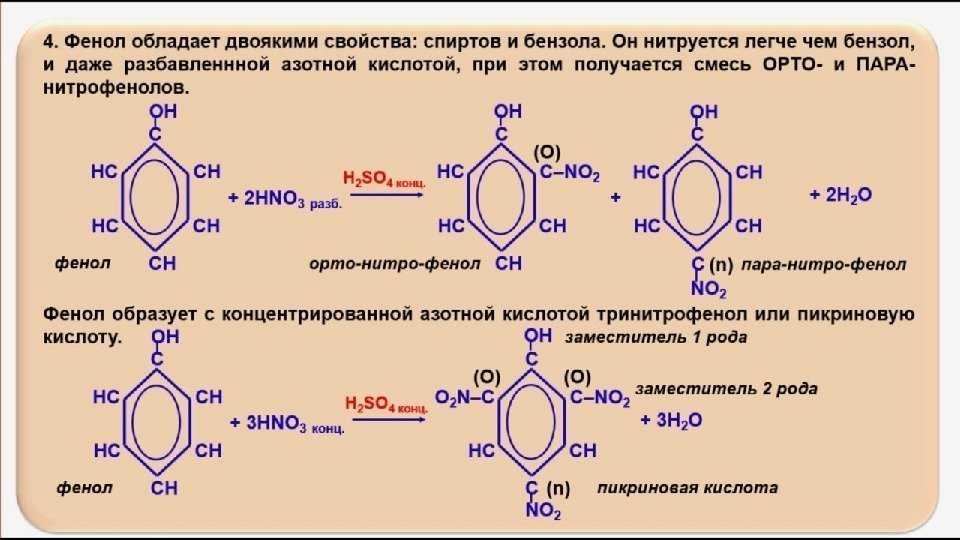 Другие замещенные фенолы используются в красильной промышленности для получения интенсивно окрашенных азокрасителей. Смеси фенолов (особенно крезолов) используются в качестве компонентов консервантов для древесины, таких как креозот.
Другие замещенные фенолы используются в красильной промышленности для получения интенсивно окрашенных азокрасителей. Смеси фенолов (особенно крезолов) используются в качестве компонентов консервантов для древесины, таких как креозот.
Природные источники фенолов
Фенолы широко распространены в природе; примеры включают тирозин, одну из стандартных аминокислот, содержащихся в большинстве белков; эпинефрин (адреналин), стимулирующий гормон, вырабатываемый мозговым веществом надпочечников; серотонин, нейромедиатор в головном мозге; и урушиол, раздражающее вещество, выделяемое ядовитым плющом, чтобы животные не могли есть его листья. Многие из более сложных фенолов, используемых в качестве ароматизаторов и ароматизаторов, получают из эфирных масел растений. Например, ванилин, основной ароматизатор ванили, выделяют из ванильных бобов, а метилсалицилат, имеющий характерный мятный вкус и запах, выделяют из грушанки. Другие фенолы, полученные из растений, включают тимол, выделенный из тимьяна, и эвгенол, выделенный из гвоздики.
Фенол, крезолы (метилфенолы) и другие простые алкилированные фенолы могут быть получены путем перегонки каменноугольной смолы или сырой нефти.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Номенклатура фенолов
Многие фенольные соединения были открыты и использованы задолго до того, как химики смогли определить их структуру. Поэтому для наиболее распространенных фенольных соединений часто используются тривиальные названия (например, ванилин, салициловая кислота, пирокатехин, резорцин, крезол, гидрохинон и эвгенол).
Однако систематические названия более полезны, потому что систематическое название определяет фактическую структуру соединения. Если гидроксильная группа является основной функциональной группой фенола, соединение можно назвать замещенным фенолом с атомом углерода 1, несущим гидроксильную группу. Например, систематическое название тимола — 5-метил-2-изопропилфенол. Фенолы только с одним другим заместителем могут быть названы с использованием соответствующих номеров или орто (1,2), мета (1,3) и пункт (1,4).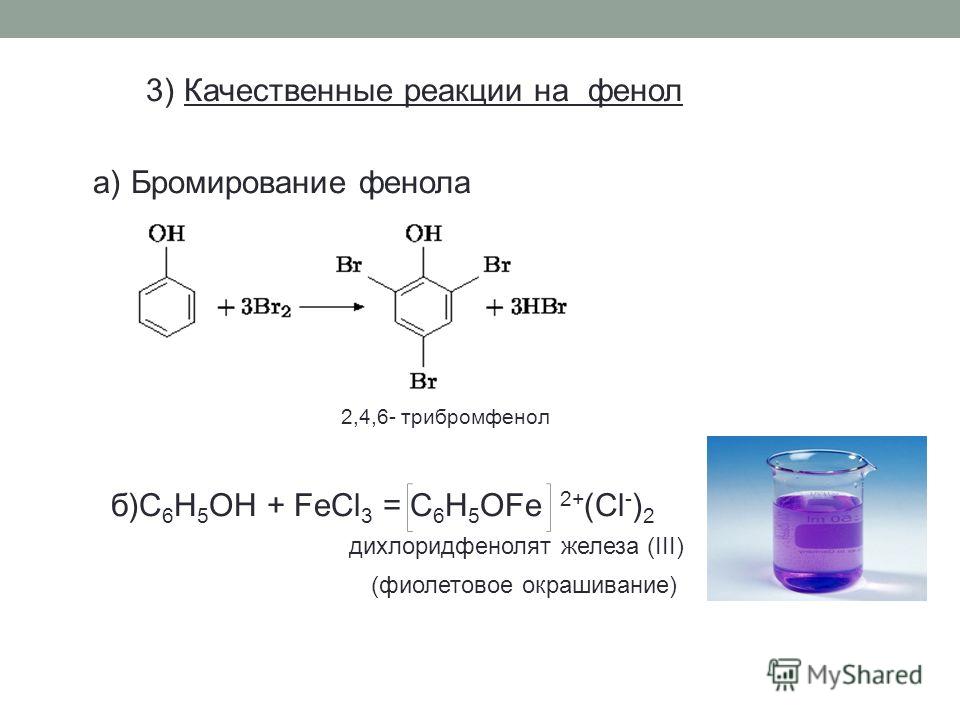 Соединения с другими основными функциональными группами могут быть названы с гидроксильной группой в качестве гидроксизаместителя. Например, систематическое название ванилина — 4-гидрокси-3-метоксибензальдегид.
Соединения с другими основными функциональными группами могут быть названы с гидроксильной группой в качестве гидроксизаместителя. Например, систематическое название ванилина — 4-гидрокси-3-метоксибензальдегид.
Физические свойства фенолов
Подобно спиртам, фенолы имеют гидроксильные группы, которые могут участвовать в межмолекулярных водородных связях; на самом деле фенолы имеют тенденцию образовывать более прочные водородные связи, чем спирты. ( См. химическая связь: межмолекулярные силы для получения дополнительной информации о водородной связи.) Водородная связь приводит к более высоким температурам плавления и намного более высоким температурам кипения для фенолов, чем для углеводородов с аналогичным молекулярным весом. Например, фенол (молекулярная масса [MW] 94, точка кипения [кип.] 182 °C [359,6 °F]) имеет температуру кипения более чем на 70 градусов выше, чем у толуола (C 6 H 5 CH 3 ; MW 92, точка кипения 111 °C [231,8 °F]).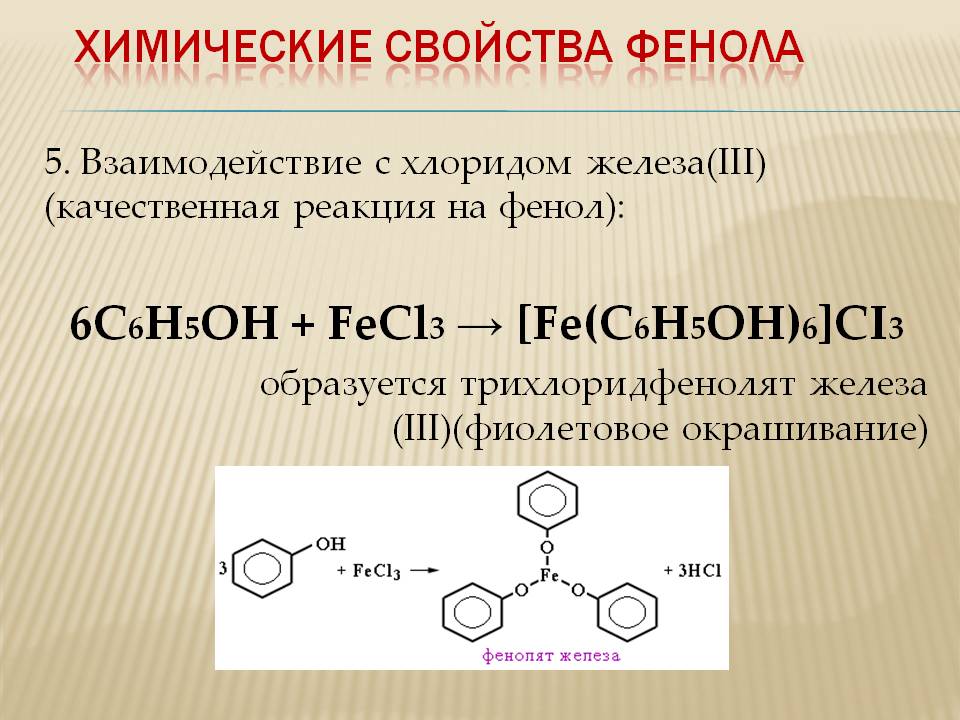
Способность фенолов образовывать прочные водородные связи также повышает их растворимость в воде. Фенол растворяется с образованием 9,3-процентного раствора в воде по сравнению с 3,6-процентным раствором циклогексанола в воде. Связь между водой и фенолом необычайно сильна; когда кристаллический фенол остается во влажной среде, он поглощает из воздуха достаточно воды, чтобы образовать жидкие капли.
Синтез фенолов
Большая часть используемого в настоящее время фенола производится из бензола путем гидролиза хлорбензола или окисления изопропилбензола (кумола).
Гидролиз хлорбензола (процесс Доу)
Бензол легко превращается в хлорбензол различными методами, одним из которых является процесс Доу. Хлорбензол гидролизуется сильным основанием при высоких температурах с образованием соли феноксида, которая подкисляется до фенола.
Окисление изопропилбензола
Бензол превращается в изопропилбензол (кумол) путем обработки пропиленом и кислотным катализатором.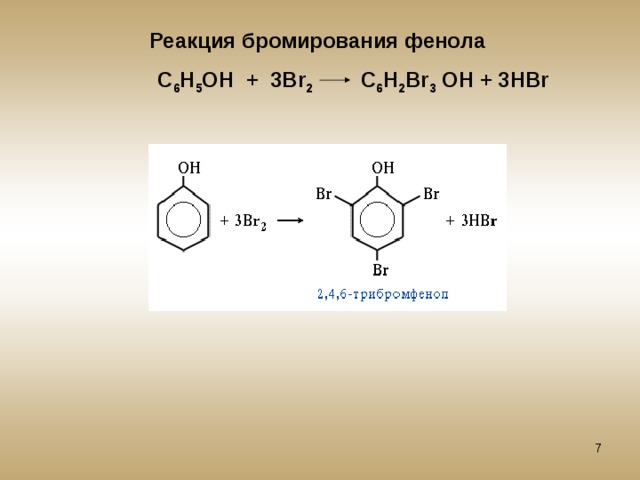 Окисление дает гидропероксид (гидропероксид кумола), который подвергается катализируемой кислотой перегруппировке в фенол и ацетон. Хотя этот процесс кажется более сложным, чем процесс Доу, он выгоден тем, что производит два ценных промышленных продукта: фенол и ацетон.
Окисление дает гидропероксид (гидропероксид кумола), который подвергается катализируемой кислотой перегруппировке в фенол и ацетон. Хотя этот процесс кажется более сложным, чем процесс Доу, он выгоден тем, что производит два ценных промышленных продукта: фенол и ацетон.
Общий синтез фенолов
Для получения более сложных фенольных соединений необходим более общий синтез. Реакция гидропероксида кумола довольно специфична для самого фенола. Процесс Доу является несколько более общим, но требуемые строгие условия часто приводят к низким выходам и могут разрушать любые другие функциональные группы в молекуле. Более мягкой и общей реакцией является диазотирование ариламина (производное анилина, C 6 H 5 NH 2 ) с получением соли диазония, которая гидролизуется до фенола. Большинство функциональных групп могут выдержать этот метод, если они стабильны в присутствии разбавленной кислоты.
Реакции фенолов
Большая часть химии фенолов аналогична химии спиртов. Например, фенолы реагируют с кислотами с образованием сложных эфиров, а феноксид-ионы (ArO — ) могут быть хорошими нуклеофилами в синтезе эфира Вильямсона.
Например, фенолы реагируют с кислотами с образованием сложных эфиров, а феноксид-ионы (ArO — ) могут быть хорошими нуклеофилами в синтезе эфира Вильямсона.
Хотя фенолы часто рассматриваются просто как ароматические спирты, они обладают несколько иными свойствами. Наиболее очевидным отличием является повышенная кислотность фенолов. Фенолы не такие кислые, как карбоновые кислоты, но они гораздо более кислые, чем алифатические спирты, и они более кислые, чем вода. В отличие от простых спиртов, большинство фенолов полностью депротонируются гидроксидом натрия (NaOH).
Как и другие спирты, фенолы подвергаются окислению, но они дают продукты, отличные от тех, что наблюдаются с алифатическими спиртами. Например, хромовая кислота окисляет большинство фенолов до сопряженных 1,4-дикетонов, называемых хинонами. В присутствии кислорода воздуха многие фенолы медленно окисляются с образованием темных смесей, содержащих хиноны.
Гидрохинон (1,4-бензолдиол) является особенно легко окисляемым соединением, потому что он имеет две гидроксильные группы в правильном соотношении для отщепления атомов водорода с образованием хинона.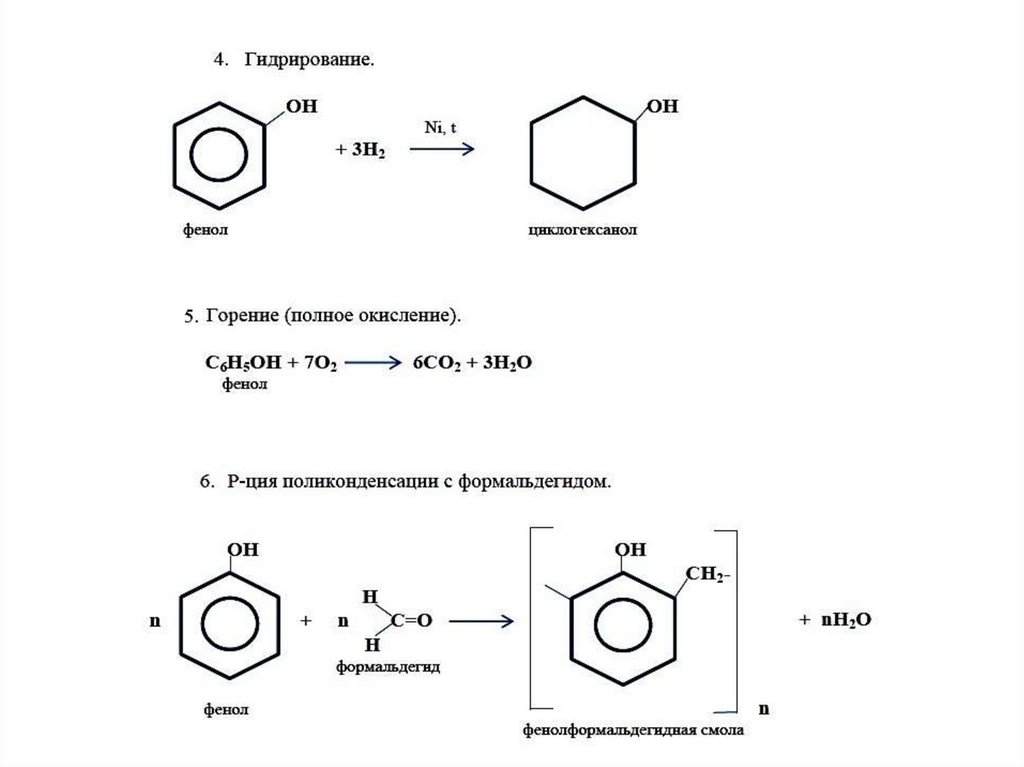 Гидрохинон используется в проявлении фотопленки путем восстановления активированного (воздействующего на свет) бромида серебра (AgBr) до черного металлического серебра (Ag↓). Неэкспонированные зерна бромида серебра реагируют медленнее, чем экспонированные зерна.
Гидрохинон используется в проявлении фотопленки путем восстановления активированного (воздействующего на свет) бромида серебра (AgBr) до черного металлического серебра (Ag↓). Неэкспонированные зерна бромида серебра реагируют медленнее, чем экспонированные зерна.
Фенолы обладают высокой реакционной способностью по отношению к электрофильному ароматическому замещению, поскольку несвязывающие электроны на кислороде стабилизируют промежуточный катион. Эта стабилизация наиболее эффективна для атаки в положении кольца орто или пара ; поэтому гидроксильная группа фенола считается активирующей (т.е. ее присутствие делает ароматическое кольцо более реакционноспособным, чем бензольное) и орто- или пара -направляющей.
Пикриновая кислота (2,4,6-тринитрофенол) является важным взрывчатым веществом, которое использовалось в Первой мировой войне. Эффективное взрывчатое вещество требует высокой доли окисляющих групп, таких как нитрогруппы. Однако нитрогруппы сильно дезактивируют (т.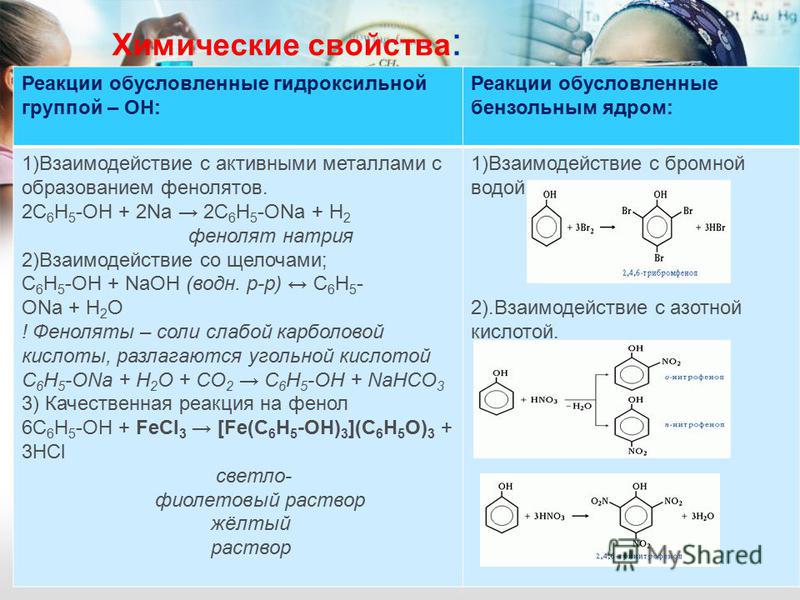 Е. Делают ароматическое кольцо менее реакционноспособным), и часто трудно добавить вторую или третью нитрогруппу к ароматическому соединению. Три нитрогруппы легче замещаются на фенол, поскольку сильная активация гидроксильной группы помогает противодействовать дезактивации первой и второй нитрогрупп.
Е. Делают ароматическое кольцо менее реакционноспособным), и часто трудно добавить вторую или третью нитрогруппу к ароматическому соединению. Три нитрогруппы легче замещаются на фенол, поскольку сильная активация гидроксильной группы помогает противодействовать дезактивации первой и второй нитрогрупп.
Ионы феноксида, образующиеся при обработке фенола гидроксидом натрия, настолько сильно активируются, что подвергаются электрофильному ароматическому замещению даже с очень слабыми электрофилами, такими как диоксид углерода (CO 2 ). Эта реакция используется в коммерческих целях для получения салициловой кислоты для преобразования в аспирин и метилсалицилат.
Образование фенолформальдегидных смол
Фенольные смолы составляют большую часть производства фенола. Фенолформальдегидная смола под торговым названием бакелит была одним из первых пластиков, изобретенных американским химиком-промышленником Лео Бакеландом и запатентованных в 1909. Фенолформальдегидные смолы недорогие, термостойкие и водонепроницаемые, хотя и несколько хрупкие. Полимеризация фенола с формальдегидом включает электрофильное ароматическое замещение в положениях орто и пара фенола (вероятно, несколько случайным образом) с последующим сшиванием полимерных цепей.
Полимеризация фенола с формальдегидом включает электрофильное ароматическое замещение в положениях орто и пара фенола (вероятно, несколько случайным образом) с последующим сшиванием полимерных цепей.
Информационная карточка для въезда 7203220
7203219 << 7203220 >> 7203221
| Химическое название | Сокристаллизат фуллерена [70] фенола |
|---|---|
| Формула | С170 h40 О5 |
| Расчетная формула | С170 h35 О5 |
| Название публикации | Кристаллическая структура надмолекулярного аддукта 2 C70·5 C6H5OH, содержащего водородные связи фенола |
| Авторы публикации | Шульц-Добрик, Мартин; Пантефер, Мартин; Янсен, Мартин |
| Журнал публикации | КристИнжКомм |
| Год издания | 2006 |
| Том журнала | 8 |
| Выпуск журнала | 2 |
| Страниц публикации | 163 |
| и | 21,348 ± 0,003 Å |
| б | 19,231 ± 0,003 Å |
| с | 22,047 ± 0,003 Å |
| α | 90° |
| β | 105,139 ± 0,003° |
| γ | 90° |
| Объем ячейки | 8737 ± 2 Å 3 |
| Температура ячейки | 100 ± 2 К |
| Температура дифракции окружающей среды | 100 ± 2 К |
| Количество отдельных элементов | 3 |
| Номер космической группы | 14 |
| Символ космической группы Германа-Могена | Р 1 21/н 1 |
| Символ группы пространства зала | -P 2yn |
| Коэффициент невязки для всех отражений | 0,1996 |
| Коэффициент невязки для значительно интенсивных отражений | 0,1243 |
| Взвешенные остаточные коэффициенты для очень интенсивных отражений | 0,1067 |
| Взвешенные остаточные коэффициенты для всех отражений, включенных в уточнение | 0,1241 |
| Параметр согласия для значительно интенсивных отражений | 2,99 |
| Параметр согласия для всех отражений, включенных в уточнение | 2,47 |
| Датчик дифракционного излучения | рентген |
| Длина волны дифракционного излучения | 0,71073 Å |
| Тип дифракционного излучения | МоКа |
| Имеет координаты | Да |
| Имеет расстройство | № |
| Имеет F наблюдателя | № |
| Ревизия | Дата | Сообщение | Файлы |
|---|---|---|---|
| 180363 (текущий) | 26.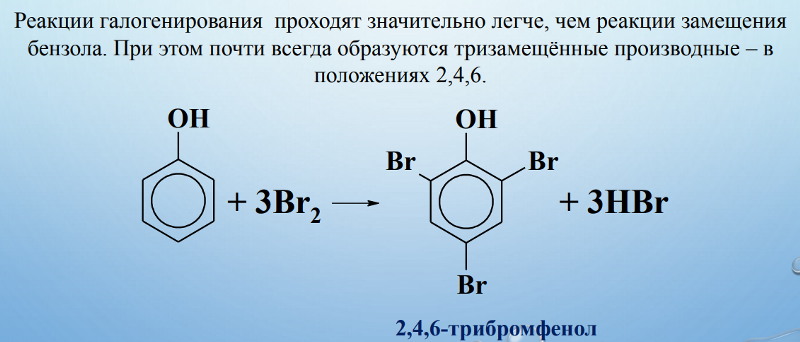
|

 с. = 0,3 мг/м³
с. = 0,3 мг/м³
Leave A Comment