Тест Строение электронных оболочек атомов по химии онлайн
Последний раз тест пройден более 24 часов назад.
Для учителя
Вопрос 1 из 10
Атом состоит:
ПодсказкаПравильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 2 из 10
В состав ядра атома входят:
электроны
протоны
нейтроны
нуклоны
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 3 из 10
Какой заряд имеет атом?
положительный
отрицательный
атом электронейтрален
атом может менять заряд с положительного на отрицательный
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 4 из 10
Масса электрона:
больше массы протона
меньше массы протона
равна массе протона
в зависимости от химической реакции может быть больше или меньше массы протона
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 5 из 10
Сколько электронов содержится в атоме?
столько же, сколько и протонов
столько же, сколько и нейтронов
столько же, сколько и нуклонов
в каждом атом содержится 1 электрон
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 6 из 10
Каково максимальное количество электронов на первом уровне?
1
2
3
4
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 7 из 10
Каково максимальное количество электронов на четвертом уровне?
8
16
32
64
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 8 из 10
Сколько электронных слоев имеет атом хлора?
1
2
3
4
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 9 из 10
Электрон обладает свойствами:
ПодсказкаПравильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 10 из 10
Вокруг чего движутся электроны?
вокруг протонов
вокруг ядра
вокруг нейтронов
вокруг изотопов
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Доска почёта
Чтобы попасть сюда — пройдите тест.
Никита Губский
7/10
Антон Неврамов
10/10
Александр Алишевич
7/10
Паша Кривов
10/10
Александр Котков
10/10
Саша Штрейкер
8/10
Тимур Насыров
10/10
Фыафыафыа Фыафыа
10/10
Ангелина Шумовская
8/10
Al Unicorn
9/10
Рейтинг теста
3.8
Средняя оценка: 3.8
Всего получено оценок: 2101.
А какую оценку получите вы? Чтобы узнать — пройдите тест.
Тест на строение атома. строение электронных оболочек атомов по химии для ОГЭ
Зарегистрируйся и получи 7 дней бесплатного доступа к тренажерам и персональный план прокачки знаний до 100%!
Вопросов в тесте: 30
Среднее время прохождения: ~10:00
Зарегистрируйся и получи персональный план прокачки знаний до 100%!
Как работает платформа Skills4u
Тестирование по предмету за класс
Платформа определит, какие темы сформированы слабо и составит индивидуальный план обучения
Персональный план обучения
План обучения и повторений поможет ученику в закреплении всех необходимых тем по предмету
Закрепление темы на 100%
Платформа напомнит и проконтролирует все повторения для закрепления каждой темы на 100%
Проработка слабых тем с предыдущих классов
Чтобы идеально овладеть предметом, рекомендуем закрепить пробелы, начиная с самых простых тем
Почему нужно пройти общее тестирование по химии за класс, а не по отдельной теме «Строение атома. Строение электронных оболочек атомов»
Строение электронных оболочек атомов»
Пройдя тестирование за класс вы получите ПОЛНУЮ КАРТИНУ ЗНАНИЙ ПО ВСЕМ ТЕМАМ.
Такой подход позволит глубинно проанализировать знания, вывести успеваемость и понимание предмета на качественно новый уровень.
Пройдя тестирование по одной теме вы получите РЕЗУЛЬТАТ ЗНАНИЙ ТОЛЬКО ЭТОЙ ТЕМЫ, которая, возможно, плохо изучена. Такой метод не является комплексным и дает лишь точечное понимание знаний по предмету.
Зарегистрироваться и пройти тестирование
Как растут результаты учеников
после занятий на тренажерах Skills4u
Занятия
на Skills4u
Занятия
с учебником
Успеваемость
Мотивация
Внимательность
Скорость
Самостоятельность
Запоминание
Первичный Тест «Строение атома. Строение электронных оболочек атомов» по химии для ОГЭ онлайн и бесплатно предоставляется всем желающим.
Советуем пройти тестирование за весь класс по химии, чтобы узнать пробелы в знаниях по всем темам и получить индивидуальный план обучения.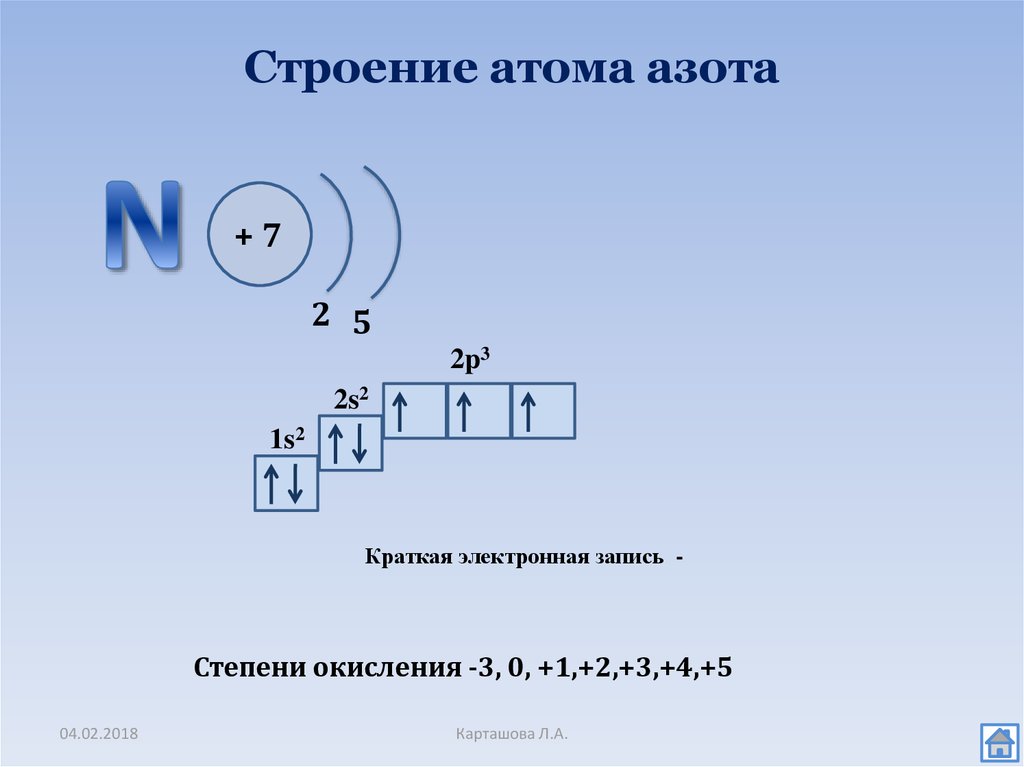
После регистрации вы получите 7 дней бесплатного доступа, чтобы увидеть первые результаты занятий и оценить эффективность тренажеров.
Зарегистрироваться и пройти тестирование
А для комплексного результата пройдите общее тестирование за
класс! Узнайте пробелы в знаниях по всем темам
Ученик
Занимайся 20 минут в день и прокачай знания по школьной программе за месяц!
Родитель
Наслаждайтесь прогрессом вашего ребенка в школе и на платформе
Учитель/
репетитор
Задавайте и проверяйте домашние задания прямо на платформе
Зарегистрироваться и пройти тестирование
68084
учеников уже занимаются с нами
Электронные оболочки: конфигурация, подоболочка, схема
Представьте себе атом. Конечно, вы, вероятно, никогда раньше не видели их должным образом — это крошечные, крошечные вещи. Возьмем, к примеру, толщину стандартного листа бумаги для принтера. Как вы думаете, сколько атомов в толщине? Одна тысяча? Пятьдесят тысяч? Двести тысяч? Ответ один миллион. Да, действительно, один миллион атомов по толщине не больше листа бумаги. Фактически, потребовалось бы сто миллионов атомов, чтобы сформировать линию длиной всего в один сантиметр.
Конечно, вы, вероятно, никогда раньше не видели их должным образом — это крошечные, крошечные вещи. Возьмем, к примеру, толщину стандартного листа бумаги для принтера. Как вы думаете, сколько атомов в толщине? Одна тысяча? Пятьдесят тысяч? Двести тысяч? Ответ один миллион. Да, действительно, один миллион атомов по толщине не больше листа бумаги. Фактически, потребовалось бы сто миллионов атомов, чтобы сформировать линию длиной всего в один сантиметр.
Атом , как вы помните из Фундаментальные частицы , содержит ядро , полное протонов и нейтронов . Это ядро очень маленькое и чрезвычайно тяжелое. Если бы наш атом был размером с футбольный стадион, ядро было бы размером с мраморный шарик. Большая часть того, что осталось в атоме, — это пустое пространство, но наш атом также содержит электронов , вращающихся вокруг ядра в вещах, известных как оболочек . Эти электронные оболочки являются важной частью электронная конфигурация и атомная структура и играют роль в определении реакционной способности атома или иона.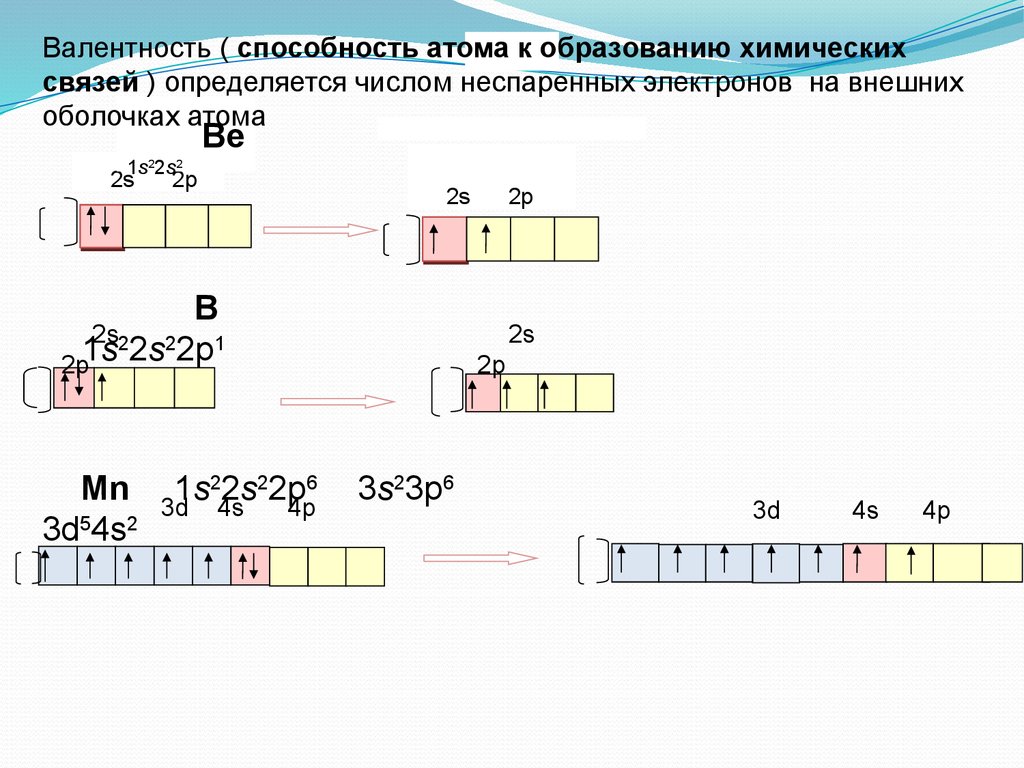 Но что именно они собой представляют?
Но что именно они собой представляют?
Электронные оболочки — это орбитальные траектории, по которым следуют электроны вокруг ядра атома. Они также известны как уровней энергии .
Каждой электронной оболочке присваивается номер, соответствующий ее расстоянию от ядра, называемый главным квантовым числом, n. Главные квантовые числа начинаются с 1 и каждый раз увеличиваются на 1, поэтому первые четыре энергетических уровня имеют главные квантовые числа 1, 2, 3 и 4 соответственно. Чем больше главное квантовое число, тем выше энергетический уровень оболочки и тем дальше она от ядра.
Оболочки с более высокой энергией также могут содержать больше электронов. Первая оболочка может содержать только два электрона, а вот вторая восемь, а третья восемнадцать. Общее правило для числа электронов, которые может удерживать оболочка, таково: , где n — главное квантовое число оболочки. Например, вторая оболочка может удерживать электроны.
Рис. 1. Диаграмма, показывающая, как квантовые числа связаны с расстоянием от ядра. По мере увеличения их квантового числа электронные оболочки удаляются от ядра и могут удерживать больше электронов
Что такое электронные подоболочки?
Электронные оболочки разделены на более мелкие подоболочек , которые сами содержат орбиталей . Прежде чем перейти к орбиталям, мы вместе изучим подоболочки.
Типы подоболочек
Каждый уровень энергии , который, как вы помните, является еще одним термином для электронной оболочки, содержит определенное количество подуровней . Они также известны как субоболочки . Вы можете думать о подоболочках как о мини-разделениях внутри каждой оболочки или энергетического уровня. Первые четыре типа подоболочек — 9.0005 с, р, д, и ф .
Однако не каждая оболочка содержит все типы субоболочек. Например, ближайшая к ядру оболочка с n = 1 содержит только s-подоболочку. Мы называем эту подоболочку 1s . Вторая оболочка содержит вложенные оболочки 2s и 2p , а третья оболочка содержит 3s, 3p, , а также 3d .
Мы называем эту подоболочку 1s . Вторая оболочка содержит вложенные оболочки 2s и 2p , а третья оболочка содержит 3s, 3p, , а также 3d .
Энергетические уровни подоболочек
Мы знаем, что каждая электронная оболочка имеет свой собственный энергетический уровень . По мере того, как увеличивается главное квантовое число , оболочка увеличивается на энергетическом уровне . Точно так же каждая из подоболочек внутри оболочки также имеет различный энергетический уровень. Подоболочки S имеют самый низкий энергетический уровень, затем p, затем d, затем f. Но вы должны помнить, что все подоболочки в одной электронной оболочке имеют более низкий энергетический уровень, чем подоболочки в электронной оболочке с более высоким главным квантовым числом. Это может показаться немного запутанным, но это просто означает, что все подоболочки в энергетической оболочке 2, например, имеют более низкий уровень энергии, чем в оболочке 3.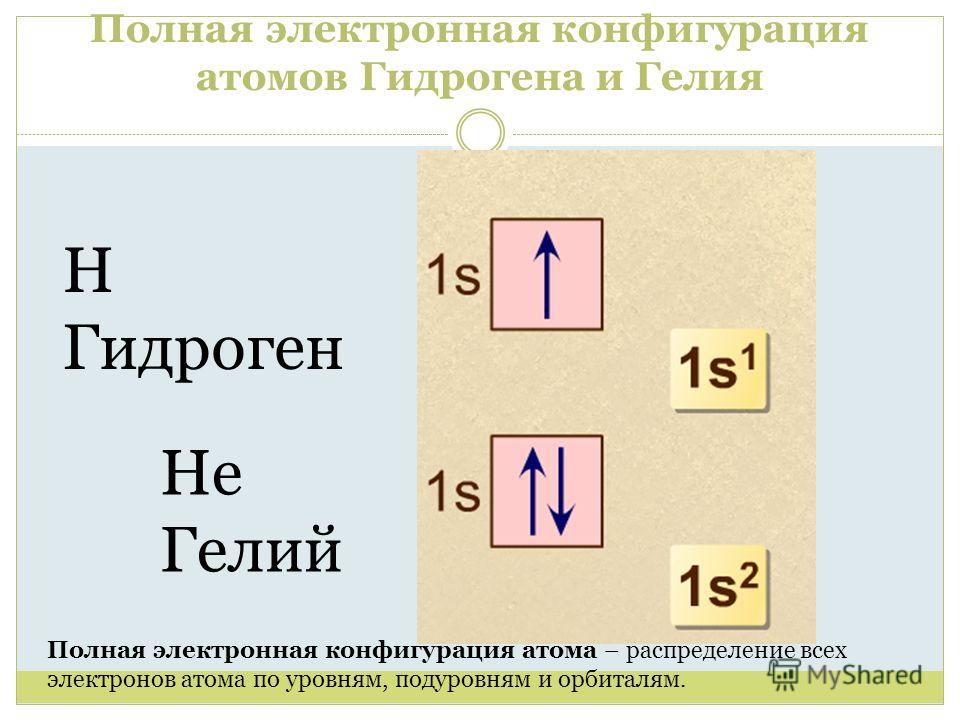 Однако есть только одно исключение. Подоболочка 3d имеет более высокий энергетический уровень, чем 4s , несмотря на то, что она находится в оболочке с более низким главным квантовым числом.
Однако есть только одно исключение. Подоболочка 3d имеет более высокий энергетический уровень, чем 4s , несмотря на то, что она находится в оболочке с более низким главным квантовым числом.
Рис. 2 – Электронные оболочки квантовое число энергетические оболочки StudySmarter
Что такое электронные орбитали?
Каждая подоболочка содержит орбиталей . Итак, что такое орбиталь? Что ж, в соответствии с принципом неопределенности Гейзенберга , невозможно точно знать, где в пространстве находится электрон и куда он направляется в любой данный момент. Это кажется немного запутанным и не очень полезным для ученых, но мы можем, по крайней мере, делать прогнозы о том, где электрон с наибольшей вероятностью может быть найден в любой точке, наблюдая и изображая его местоположение снова и снова, чтобы составить приблизительную диаграмму. . Хотя мы не знаем, куда он идет, дает нам приблизительное представление о том, где, вероятно, будет находиться электрон большую часть времени. Эти области называются орбиталями .
Эти области называются орбиталями .
Орбитали правильно определяются как области пространства, где электроны могут находиться в 95% случаев.
Электроны на самом деле не частицы. Иногда они действуют как частицы, а иногда как волны, например, как световые волны. Все зависит от того, соблюдаются они или нет. Это часть области, называемой квантовой механикой. В 1925 января Эрвин Шредингер вывел уравнение, которое помогло нам предсказать местоположение и энергию электрона, основываясь на его волновом поведении. Это уравнение помогло ему получить Нобелевскую премию по физике в 1933 году.
Давайте посмотрим на водород. Вы помните, что водород имеет один электрон (см. Атомная структура ), и если вы снова и снова наносите на карту расположение этого электрона, вы в конечном итоге получите примерно такой набросок:
Рис. 3. Электрон водорода электрон в основном занимает сферическую область
Мы знаем эту область как орбиталь из подоболочки 1s. Как видите, эта орбиталь имеет примерно сферическую форму. Давайте подробнее рассмотрим формы и свойства всех остальных орбиталей.
Как видите, эта орбиталь имеет примерно сферическую форму. Давайте подробнее рассмотрим формы и свойства всех остальных орбиталей.
Формы орбит
Орбиты имеют различную форму в зависимости от их подоболочки . S-орбитали имеют сферическую форму, p-орбитали представляют собой восьмерку, а d-орбитали могут иметь различную форму.
Рис. 4. Диаграмма, показывающая формы s-орбитали слева и p-орбитали справа
Количество электронов
Все орбитали могут содержать максимум 2 электрона. Их может быть меньше 2, но определенно не может быть больше. Различные подоболочки также имеют разное количество орбиталей, что влияет на то, сколько электронов они могут удерживать. Подоболочки S имеют только одну орбиталь, в то время как подоболочки p имеют три, а подоболочка d — пять. Это означает, что подоболочки s могут иметь не более двух электронов, подоболочки p могут иметь шесть, а подоболочки d могут иметь десять. Это показано ниже:
Рис.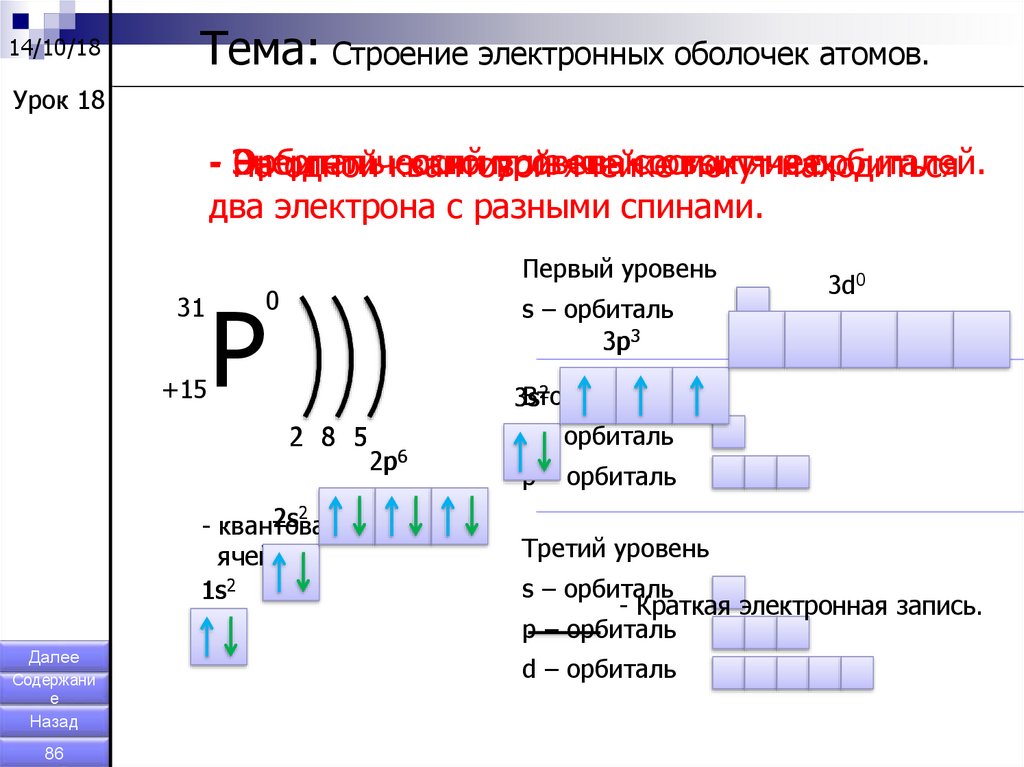 5. Таблица, показывающая количество электронов в каждой подоболочке
5. Таблица, показывающая количество электронов в каждой подоболочке
Вам не нужно выходить за рамки этого на уровне А, но вам может быть интересно узнать, что у f подоболочек семь орбиталей, и поэтому может содержать до 14 электронов.
Спин электрона
Электроны на орбите должны иметь противоположные спинов . Спин — это свойство электронов, которое может двигать его вверх или вниз. I На орбитали может быть не более одного электрона со спином вверх и одного со спином вниз. (Узнайте больше о вращении в Понимание ЯМР .)
Орбитальная энергия
Все орбиты в одной подоболочке имеют одинаковую энергию . Это означает, например, что все 10 электронов в подоболочке 3d имеют одинаковую энергию друг с другом; оба электрона в 2s имеют одинаковую энергию друг с другом.
Следующая диаграмма объединяет все, что мы знаем об оболочках, подоболочках, орбиталях и энергетических уровнях, чтобы показать количества и энергии орбиталей до 4p.
Рис. 6. Диаграмма, показывающая энергии различных электронных оболочек, подоболочек и орбиталей. Помните, что каждая орбиталь может содержать до двух электронов
Электронная конфигурация
Электроны заполняют оболочки, подоболочки и орбитали в определенном порядке . Они довольно суетливы, им нравится следовать определенным правилам. Взгляните на Электронная конфигурация , чтобы узнать больше о том, как именно электроны расположены в атоме, но пока вы должны знать, что Электронная конфигурация атома определяет его реакционную способность и свойства.
Электронные оболочки — основные выводы
Электроны расположены в оболочках , также известных как энергетических уровней . Каждая оболочка имеет главных квантовых чисел . Оболочки с более высоким главным квантовым числом находятся дальше от ядра и имеют более высокий энергетический уровень.

Электронные оболочки разбиты на подуровни, называемые подуровнями . Они также различаются по уровню энергии.
Подоболочки содержат разное количество орбиталей , которые являются областями пространства, где электрон находится в 95 процентах случаев. Орбитали могут удерживать только максимум два электрона и имеют разную форму.
Электроны заполняют оболочки, подоболочки и орбитали в определенном порядке, известном как электронная конфигурация элемента . Это определяет свойства и реакционную способность атома.
Структура атома и электронная конфигурация
Все ресурсы AP Chemistry
6 Диагностические тесты 225 практических тестов Вопрос дня Карточки Learn by Concept
← Предыдущая 1 2 3 Следующая →
AP Chemistry Help » Атомная структура и свойства » Атомная структура и электронная конфигурация
Если электрон падает с энергетического уровня n = 5 на основное состояние n = 1, что наиболее вероятно произойдет?
Возможные ответы:
Электрон меняет направление вращения
Фотон поглощается
Нейтрон превращается в протон
Электрон приобретает скорость
Фотон испускается 9000 3
Правильный ответ: А испускается фотон
В основе вопроса недостаточно информации, чтобы определить, изменилась ли скорость электрона. Однако мы можем окончательно определить, что электрон потеряет энергию и будет испущен фотон.
Однако мы можем окончательно определить, что электрон потеряет энергию и будет испущен фотон.
Сообщить об ошибке
Какая электронная конфигурация иона Fe(II) является наиболее стабильной?
Возможные ответы:
1s2 2s2 2p6 3s2 3p6 4s2 3d4
1s2 2s2 2p6 3s2 3p4 4s2
1s2 2 s2 2p6 3s2 3p6
1s2 2s2 2p6 3s2 3p6 3d6
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Правильный ответ:
Пояснение:
Полностью заполненная орбиталь обычно более стабильна, чем полузаполненная. Расщепление энергетических уровней также зависит от геометрии анализируемого соединения. 4s-электроны имеют более высокую энергию, чем 3d-электроны, поэтому теряются первыми, оставляя наполовину заполненные d-орбитали, что является наиболее стабильной конфигурацией.
Сообщить об ошибке
Какая подоболочка атома заполнится электронами первой: 3d или 4s?
Возможные ответы:
4s
Недостаточно информации для ответа
3d
Оба будут заполнены одновременно 003
Объяснение:
Для подоболочки 3d n (главное квантовое число) = 3 и l (азимутальное квантовое число) = 2, поэтому n + l = 5. Для подоболочки 4s n = 4 и l = 0, поэтому n+ l = 4. Из этой информации мы видим, что подоболочка 4s имеет более низкую энергию и сначала заполнится электронами.
Для подоболочки 4s n = 4 и l = 0, поэтому n+ l = 4. Из этой информации мы видим, что подоболочка 4s имеет более низкую энергию и сначала заполнится электронами.
Сообщить об ошибке
Какое правильное обозначение орбиты меди?
Возможные ответы:
1s2 2s2 2p6 3s2 3p6 4s1 3d10
1s2 2s2 2p6 3s2 3p6 4s2 3d10
1s2 2s2 2p6 3s2 3p6 4s2 3d9
1s2 2s2 2p6 3s2 3p6 3d10
Правильный ответ:
1s2 2s2 2p6 3s2 3p6 4s1 3d10
Пояснение:
Элементы группы меди заполняют d-орбиталь за счет полузаполненной s-орбитали. Это связано с тем, что эта конфигурация более стабильна, чем полная s-орбиталь и d-орбиталь с 9/10 мест заполнено.
Сообщить об ошибке
Какова электронная конфигурация хрома?
Возможные ответы:
[Ar] 3d4 4s2
[Ar] 3p6
[Ar] 3d5 4s1
[Ar] 3d6
900 88 Правильный ответ:[Ар] 3d5 4s1
Пояснение:
В хроме на 6 электронов больше, чем в аргоне. Для d-орбиталей более стабильно быть заполненными наполовину. Таким образом, один электрон заполнит каждую из 5 d-орбиталей.
Для d-орбиталей более стабильно быть заполненными наполовину. Таким образом, один электрон заполнит каждую из 5 d-орбиталей.
Сообщить об ошибке
Что такое элемент с основной электронной конфигурацией ?
Возможные ответы:
Алюминий
Кремний
Калий
Фосфор
Сера
Правильный ответ :
Фосфор
Пояснение:
Конфигурации электронов можно легко вычислить с помощью периодической таблицы. Важно запомнить порядок заполнения орбиталей; затем вы можете просто следовать таблице Менделеева, добавляя один электрон по мере перехода от одного элемента к другому. Чтобы упростить задачу, вы также можете помнить, что первый период заканчивается на 1s, второй — на 2p, а третий — на 3p. После этого становится немного сложнее, но знание этих первых нескольких периодов позволит вам работать быстрее.
При наличии электронной конфигурации вы также можете добавить количество электронов, чтобы определить атомный номер элемента.
показывает общее количество электронов. Фосфор соответствует атомному номеру 15.
Сообщить об ошибке
Какой элемент имеет валентную оболочку с пятью электронами?
Возможные ответы:
Arsenic
Carbon
Алюминий
СЕРНАЯ
Бром
Правильный ответ:
Мышьяк
Объяснение:
Чтобы найти ответ, мы выпишем электронную конфигурацию для каждого заданного варианта.
Мышьяк имеет электронную конфигурацию с четвертой оболочкой, представляющей валентные электроны. Валентность включает в себя как 4s, так и 4p, так что всего 5 (). Мы также могли бы взглянуть на периодическую таблицу и увидеть, что мышьяк находится в том же периоде, что и азот и фосфор, а это означает, что у него будет пять валентных электронов.
Сообщить об ошибке
Сколько валентных орбиталей содержит один электрон в атоме азота?
Возможные ответы:
Правильный ответ:
Пояснение:
Азот — это атом, p которого начинают заполняться электронами. Согласно правилу Хунда, электроны предпочтут свободную орбиталь, если она находится на том же энергетическом уровне, что и другие доступные орбитали. В азоте 2 s орбиталь полностью заполнена. Поскольку доступны три 90 205 p 90 206 орбиталей, три оставшихся электрона предпочтут иметь свои незанятые орбитали. В результате каждая из трех p орбиталей будет иметь по одному электрону.
1s ee
2s ee
2p e_ e_ e_
Сообщить об ошибке
Какой элемент не содержит электронов на орбите d ?
Возможные ответы:
Кальций
Скандий
Стронций
Галлий
Криптон
Правильный ответ:
Кальций 9000 3
Пояснение:
Периодическая таблица предназначена для организации элементов по их орбиталям. Электроны входят только в орбиталь d в четвертом периоде (строке) в начале переходных металлов. Скандий — первый элемент, электрон которого выходит на орбиталь d . Кальций — последний элемент в таблице, имеющий до p орбитальных электронов и пустых d орбиталей.
Электроны входят только в орбиталь d в четвертом периоде (строке) в начале переходных металлов. Скандий — первый элемент, электрон которого выходит на орбиталь d . Кальций — последний элемент в таблице, имеющий до p орбитальных электронов и пустых d орбиталей.
Кальций:
Скандий:
Сообщить об ошибке
Одновалентный катион в основном состоянии имеет следующую электронную конфигурацию:
Что такое катион?
Возможные ответы:
Ни один из доступных ответов
Правильный ответ: 9 0003
Объяснение:
Поскольку это одновалентный катион, неионная электронная конфигурация будет (обратите внимание, что электрон был удален из s-оболочки, а не из d-оболочки, так как это переходный металл). Эта электронная конфигурация соответствует железу, поэтому катион должен быть .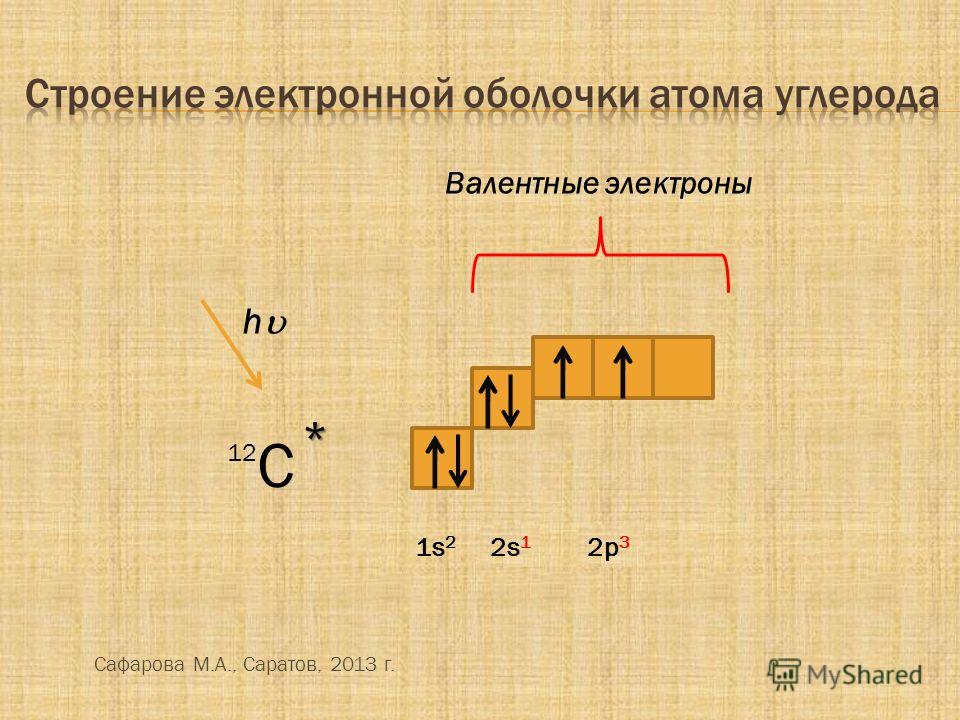


Leave A Comment