Медь двухлористая — незаменимый в промышленности реактив
Медь двухлористая — неорганическое соединение, которое можно отнести как к бинарным соединениям, так и к солям, и к галогенидам. Это хлорид меди (II), соль соляной кислоты. Может образовывать кристаллогидраты с одной, двумя, тремя и четырьмя молекулами кристаллизационной воды. То, какой именно кристаллогидрат образуется, зависит от температуры исходного раствора. Чаще всего, на практике имеют дело с хлоридом меди CuCl2•2h3O, содержащим две молекулы воды.
Двухводный хлорид встречается в природе в виде минерала эрнохальцита с красивыми кристаллами синего цвета. Для нужд экономики безводный хлорид получают химически синтезом в результате обжига сульфидов меди и хлорида натрия. Двухводный хлорид выкристаллизовывают из раствора.
Свойства
Безводный реактив — твердое вещество с кристаллами, цвет которых может варьироваться от желтого до темно-коричневого. Хорошо растворяется в воде, этиловом и метиловом спиртах, ацетоне, аммиаке. С повышением температуры, растворимость в воде увеличивается. Ядовит, как все медные соли.
С повышением температуры, растворимость в воде увеличивается. Ядовит, как все медные соли.
Двухводный кристаллогидрат — твердое вещество с зелеными очень гигроскопичными кристаллами.
Хлорид меди (II) вступает в реакции со щелочами; металлами, менее активными, чем медь; с другими солями, с которыми может обменяться кислотными остатками; с окисью азота; органическими сульфокислотами.
| Медь двухлористая импортная | Вытяжной шкаф ВА-102 | Медь двухлористая |
Меры предосторожности
Вещество токсично. При проглатывании вызывает отравление. Контакт с кожей и слизистыми оболочками приводит к раздражению. Регулярный контакт может вызвать заболевание кожи и глаз, поэтому на производствах, имеющих дело с хлоридом меди или его кристаллогидратами, следует использовать средства индивидуальной защиты: респираторы, очки, резиновые перчатки. Само помещение должно быть снабжено вентиляцией.
Хранят реактив на крытых сухих складах в герметичной упаковке. Транспортировка допускается любым видом транспорта.
Применение
• Для покрытия поверхности металлических изделий слоем меди для защиты от коррозии; для улучшения токопроводящих свойств; для придания изделию привлекательного вида; как промежуточный процесс для последующего никелирования, хромирования, серебрения.
• В химпроме — сырье для получения производных меди; для получения углеводородов на основе литийорганических соединений.
• В качестве катализатора для различных органических синтезов, а также для процессов крекинга нефти.
• Для декарбоксилирования органических кислот.
• В аналитической химии — для титрования, проведения качественных реакций.
• Для изготовления органических и неорганических красителей.
• В текстильной индустрии используется для протравы перед окрашиванием тканей и волокон, а также как составной ингредиент красителей.
• В радиоэлектронике — для травления печатных плат.
• В металлургии — для проверки качества некоторых марок стали.
• В цветной металлургии двухлористая медь применяется для травления меди и тонкой обработки шлифованных поверхностей.
• Для очистки поверхностей из меди, ее сплавов, нихрома от жира, краски и ржавчины перед пайкой.
• В дефектоскопии и определении ударной вязкости образцов — образец после контролируемого удара погружают в раствор реактива, в котором любые дефекты и трещины покрываются хорошо заметным слоем меди.
• Входит в состав пиротехнических смесей (окрашивает пламя в красивый сине-зеленый цвет).
• Раствор двухлористой меди в аммиаке применяется для определения концентрации углекислого газа в дымовых газах.
• В фармацевтике — для производства лекарственных препаратов.
Способы травления меди — audioGO
Травление с помощью CuCl2
Суть травления заключается в обратимой реакции
CuCl2 + Cu ==> CuCl
Hа холоде процесс идет крайне медленно, т.к. CuCl достаточно устойчив.
Hо при повышении температуры выше 75-80°С процесс резко ускоряется из-за того, что CuCl гидролизуется горячей водой:
CuCl ==> CuCl2 + Cu.
При травлении медной фольги процесс идет активно до некоторого насыщения раствора медной взвесью, после чего наступает равновесие
между выделенной медной взвесью и ее растворением. Причем медная взвесь растворяется гораздо эффективнее фольги, и присутствуя во
всем объеме тормозит процесс. Это связано с большей поверхностной энергией, по сравнению с компактной медью. Можно сместить
равновесие, удаляя медь – в простейшем случае отстаиванием, но можно и с применением фильтрации и т.д.
Разложению CuCl (а следовательно и обогащению CuCl2) способствует присутствие окислителей, которым может быть даже кислород воздуха
и в меньшей степени свет. Сильные окислители, например h3O2, ускоряют процесс многократно (в его присутствии заготовки ПП травятся
за считанные минуты). При этом образуется CuCl2 и нерастворимая основная соль меди – CuCl(OH), выпадающая в виде зеленого осадка.
Ксати, при стоянии на воздухе поверхность насыщенных растворов покрывается пленкой состоящей из CuCl(OH) и CuCO3·Cu(OH)2 – результатом
взаимодействия с кислородом и углекислым газом воздуха.
Hа практике это выглядит следующим образом. Если травление меди происходит не часто, то вполне можно обойтись одним раствором, который
после травления “отдыхает”, выделяя медь в виде ровного осадка (в осадке также присутсвует CuCl, CuCl(OH) и CuCO3·Cu(OH)2). В зависимости
от скорости охлаждения соотношение выпадающей в осадок меди и солей изменяется. Hапример, если резко разбавить упаренный раствор холодной
водой, то обнаружим помутнение раствора, который после отстаивания становится светло-зеленым, в случае медленного остывания в осадок
бурый – выпадает медь. В данном случае необходимо одно условие – процесс не должен дойти до насыщения. Этого можно достигнуть двумя
способами: увеличением объема раствора и удалением меди.
С первым способом все понятно, а под удалением меди понимается либо перевод одновалентновй меди в двухвалентную, либо отфильтровывание
металлической взвеси. Если окислять медь кислородом или кислород содержащими окислителями, то мы неизбежно теряем некоторую часть хлорида
Если окислять медь кислородом или кислород содержащими окислителями, то мы неизбежно теряем некоторую часть хлорида
в виде основных солей. Можно также просто добавить “свежих” хлорид ионов (например добавлением соляной кислоты), таким образом мы смещаем
равновесие в сторону CuCl2.
4CuCl + 4HCl + O2 ==> CuCl2 + h3O
CuCl(OH) + HCl ==> CuCl2 + h3O
CuCO3·Cu(OH)2 + 4HCl ==> 2CuCl2 + h3O + CO2
К счастью соляная кислота не дефицит (а в промышленности часто просто крайне нежелательный отход) и это пожалуй самый дешевый способ
регенерации раствора CuCl2. Hо есть большой недостаток: при температуре 75-80°С соляная кислота начинает интенсивно испаряться из раствора.
При этом и неприятный запах, и сильная коррозия металлических предметов, находящихся рядом, уже через несколько дней.
Выход из этой ситуации – добавлять кислоту только при необходимости маленькими порциями, а еще лучше использовать герметичную емкость.
Кстати, о дешивизне: летом 2003 5л упаковка дымящей соляной кислоты стоила 200р (а на Украине уже давненько совсем не продают), что
относительно не дорого. И пару слов об устойчивости маски (защитного слоя): маска должна быть кислотостойка и механически устойчива
И пару слов об устойчивости маски (защитного слоя): маска должна быть кислотостойка и механически устойчива
при температурах 80-100 °C.
Пожалуй это самое экономичное и экологичное травление (если используется регенерация и герметичная аппаратура).
Травление с помощью смеси NaCl и CuSO4
Старинный “советский” способ эпохи дефицита. Hо если ничего под рукой нет, то и он сойдет. Суть травления сводится к тому, что идет
обратимая реакция:
2NaCl + CuSO4 ==> Na2SO4 + CuCl2
в результате которой появляется CuCl2. Теоритически все аналогично предыдущему. Суммарный процесс можно записать в виде:
CuSO4 + Cu + 2NaCl ==> CuCl + Na2SO4
Травление идет медленнее, чем у CuCl2. Объясняется это тем, что в растворе присутсвуют ионы натрия, и сульфат ионы, которые приводят
к образованию плотных и трудноудаляемых пленок на поверхности меди. В принципе, процесс идет нормально только при кипячении.
Травление с помощью FeCl3
По-моему, хлорид железа никогда не был дефицитным, так как огромное его количество получается при стравливании окалины с металлических
деталей после проката и др. операций термообработки. Основные процессы растворения:
операций термообработки. Основные процессы растворения:
FeCl3 + Cu ==> FeCl2 + CuCl2 (суммарный процесс)
FeCl3 + Cu ==> FeCl2 + CuCl (на поверхности меди)
FeCl3 + CuCl ==> FeCl2 + CuCl2 (в объеме раствора)
Хлорид железа III очень хорошо растворим в воде, причем при подъеме температуры до 70°С растворимость увеличивается в 5 раз (с 96 до
~500 г/100г воды). Подогретые насыщенные растворы богаты хлорид ионами, и растворение меди в свежем растворе проходит достаточно быстро.
Hо в любом случае необходимо хорошее перемешивание для удаления продуктов реакций от поверхности металла.
Особо следует остановиться на подогреве. При нагреве раствора FeCl3 выше 70°С он быстро мутнеет, а процесс травления практически
останавливается. Дело в том, что хлорид железа III сильно гидролизуется горячей водой, с образованием целого спектра основных солей и
соляной кислоты, которая в свою очередь быстро испаряется раствора:
FeCl3 + h3O ==> FeCl2(OH) + HCl
FeCl3 + 2h3O ==> FeCl(OH)2 + 2HCl
Hе исключен и полный гидролиз FeCl3:
FeCl3 + 3h3O ==> Fe(OH)3 + 3HCl
Причем гидролиз хлорида идет не только горячей водой, но и парами воды из воздуха (правда процесс идет гораздо медленнее).
FeCl3·6h3O ==> Fe(Cl)x(OH)y + nHCl
Учитывая все эти факторы, хранить хлорид железа III необходимо в герметичной таре, с плотно закрывающейся крышкой, иначе через некоторое
время верхний слой (а возможно и весь объем) превратится в обычную ржавчину. При покупке следует обратить внимание на цвет. Сухой хлорид
железа (не кристаллогидрат) почти черный мелкий порошок, тогда как кристаллогидрат крупная соль, имеющая темно-красный цвет, иногда с
жидкостью на поверхности.
Часто пытаются “регенерировать” раствор FeCl3, кидая в него железный лом, стружку и т.п., якобы для вытеснения растворенной меди.
Делать это я крайне не рекомендую. После травления в растворе остается FeCl3, FeCl2 и CuCl2. Хоть FeCl2 и малоустойчив на воздухе, все же
устанавливается некоторое равновесие с CuCl2 (но через некоторое время он все равно окислится кислородом воздуха). Добавляя железо мы
вытесняем мель из раствора, в котором остается только хлориды железа II и III. В свою очередь FeCl2 очень быстро окисляется кислородом
воздуха, но не до FeCl3, а до основных солей железа, выпадающих в осадок. А далее железный лом начинает взаимодействовать с хлоридом
А далее железный лом начинает взаимодействовать с хлоридом
железа III, также приводя его в негодность.
FeCl3 + Fe ==> FeCl2
FeCl2 + h3O + O2 ==> Fe(Cl)x(OH)y
Регененрирование может проводиться добавлением соляной кислоты, или продувкой хлора (что делается крайне редко). Hо чаще всего вообще
отказываются от какой-либо регенерации раствора – это усложняет аппаратуру, к тому же недостатка в FeCl3 нет. В промышленности отработанный
раствор утилизируют, с предварительной обработкой содой.
Hа мой взгляд это самое мягкое и безопасное травление.
Травление с помощью HCl и h3O2
Процессы несколько отличаются от предыдущих способов. Суммарный процесс можно записатть в виде:
Cu + 4HCl + O2 ==> 2CuCl2 + 2h3O
Образовавшийся CuCl2 сразу же вступает в реакцию комплексообразования:
CuCl2 + 2HCl ==> h3[CuCl4]
CuCl2 + 2HCl + 2h3O ==> h3[Cu(h3O)2Cl4]
Данный способ требует соблюдения всех мер предосторожности при работе с килотами т. к. раствор все время выделяет газы, используются
к. раствор все время выделяет газы, используются
концентрированные растворы HCl и h3O2. Hагревать раствор крайне не рекомендуется – испарение соляной кислоты резко увеличивается, и
максимальная температура не более 40-50С. Хранить необходимо в темной таре, с неплотно закрывающеся крышкой, в орошо проветриваемом
помещении или под вытяжкой.
Процесс травления проходит очень быстро, но на плате в любом случае остается некоторое количество HCl, которое будет приводит в дальнейшем
к появлению микротрещен на дорожках.
(c) www.anytech.narod.ru
Химическая реакция алюминиевой фольги в растворе CuCl2
Я согласен с коллегами в том, что это, скорее всего, металлическая медь. Однако, учитывая, что мы начинаем с кислого раствора хлорида меди и, вероятно, происходит некоторое воздействие кислорода либо из исходной воды, либо из-за контакта с воздухом, может иметь место немного больше химии, точнее, электрохимическая (или отображение поверхностного анода). /катодный механизм). Известно, что, например, с медью, железом и, вероятно, другими переходными металлами (Mn, Co, Ce, Cr,…) в кислых растворах в присутствии кислорода протекает следующая реакция:
Известно, что, например, с медью, железом и, вероятно, другими переходными металлами (Mn, Co, Ce, Cr,…) в кислых растворах в присутствии кислорода протекает следующая реакция:
Cu(l)/Fe(ll) + 1/4 O2 + H+ —> Cu(ll)/Fe(llll) + ½ h3O файл на https://wwwbrr.cr.usgs.gov/projects/GWC_coupled/phreeqc/html/final-78.html и, соответственно, комментарии на https://pubs.acs.org/doi/10.1021/es0501058) и для меди см., например, уравнение (7) на странице https://en.wikipedia.org/wiki/Dicopper_chloride_trihydroxid.
Я бы переписал приведенную выше реакцию, учитывая склонность некоторых переходных металлов (например, меди) к образованию основных солей, следующим образом:
4 Cu(l) + O2 + 2 H+ —> 4 Cu(ll) + 2 OH-
Для студентов колледжей и исследователей я интересно вывел лежащий в основе радикальной химии путь этой реакции, используя дополнение «Воздействие аэрозолей на химию атмосферных газовых примесей: тематическое исследование пероксидных радикалов», Х. Лян1, З.М. Чен1, Д. Хуан1, Ю. Чжао1 и З.Ю. Ли, ссылка: https://www.google.com/ URL?sa=t&source=web&rct=j&url=http://www.atmos-chem-phys.net/13/11259/2013/acp-13-11259-2013-supplement.pdf&ved=0ahUKEwj64JTh5ejMAhVCHR4KHegXCu8QFggcMAE&usg=AFQjCNGZWxTNxFPmgaT1bARYjO08w2_wIg&sig2=Gbhj5orSHmeDIV9uy-moYg :
Чен1, Д. Хуан1, Ю. Чжао1 и З.Ю. Ли, ссылка: https://www.google.com/ URL?sa=t&source=web&rct=j&url=http://www.atmos-chem-phys.net/13/11259/2013/acp-13-11259-2013-supplement.pdf&ved=0ahUKEwj64JTh5ejMAhVCHR4KHegXCu8QFggcMAE&usg=AFQjCNGZWxTNxFPmgaT1bARYjO08w2_wIg&sig2=Gbhj5orSHmeDIV9uy-moYg :
3 R Cu+
3
3 Cuq 2+ + O2- ( k = 4,6xE05 )
R27 O2- + Cu+ + 2 H+ → Cu2+ + h3O2 ( k = 9,4xE09 )
R25 h3O2 + Cu+ → Cu2+ + OH + OH- ( k = 7,0 xE03 )
R23 OH + Cu+ → Cu2+ + OH- ( k = 3,0×E09 )
Снова чистая реакция: 4 Cu+ + O2 + 2 H+ → 4 Cu2+ + 2 OH-
Теперь, для эксперимента, обсуждаемого с Al/CuCl2, я подозреваю, что элементарная металлическая медь, особенно свежеосажденная, будет реагировать аналогичным образом, образуя покрытие из оксида меди в соответствии с обычно медленным наблюдаемым окислением железа и металлической меди в кислой смеси воздуха/CO2 в соответствии с так называемой реакцией самоокисления металлов (реакция R24 выше):
O2(водн.) + 4 Cu/Fe = Cu(l)/Fe(ll) + •O2−
, которая также является обратимой реакцией. При подкислении анион-радикал супероксида (записывается как O2-, •O2- или O2•- , но, хотя последняя форма является общепринятой, она может создавать значительные проблемы с читаемостью и возможной неправильной интерпретацией природы активного вещества) может привести к h3O2 (реакция R27) и запустить реакцию Фентона (или типа Фентона с медью) (см. R25 выше), в результате чего образуется соль трехвалентного или двухвалентного железа. Как следствие, наблюдаемая более темная окраска может на самом деле быть связана с присутствием Cu2O, а при низком pH и повышенном уровне кислорода могут появиться более темные пятна CuO.
При подкислении анион-радикал супероксида (записывается как O2-, •O2- или O2•- , но, хотя последняя форма является общепринятой, она может создавать значительные проблемы с читаемостью и возможной неправильной интерпретацией природы активного вещества) может привести к h3O2 (реакция R27) и запустить реакцию Фентона (или типа Фентона с медью) (см. R25 выше), в результате чего образуется соль трехвалентного или двухвалентного железа. Как следствие, наблюдаемая более темная окраска может на самом деле быть связана с присутствием Cu2O, а при низком pH и повышенном уровне кислорода могут появиться более темные пятна CuO.
При температурах выше 65 C в одном исследовании (см. полностью доступную статью в формате pdf на https://www.sciencedirect.com/science/article/pii/0001616069
7) говорится о «прибытии электронов на оксидно-газовую интерфейс с помощью термоэлектронной эмиссии в качестве шага, регулирующего скорость», где я ожидал бы, что это приведет к анион-радикалу супероксида через:
e- (водн. ) + O2 (водн.) = • O2−
) + O2 (водн.) = • O2−
И, согласно другому исследованию, также реакция:
e- (aq) + H+ = •H
, где протон водорода (полученный из водяного пара), по-видимому, занимает поверхностные вакансии Cu, образованные из основных дефектов, связанных с Cu2O (см. обсуждение Вана и Чо на https://www. .jstage.jst.go.jp/article/isijinternational/49/12/49_12_1926/_pdf).
Я также хотел бы отметить, что атмосферный супероксид плюс водяной пар из-за изменения диэлектрической проницаемости среды •O2− становится в значительной степени присутствующим в виде •HO2 (протон, по-видимому, легко отдается водой). Кроме того, последний гидропероксидный радикал является не только медленным предшественником h3O2 (и возможной реакцией типа Фентона, отмеченной выше согласно R25) посредством реакции: кислотный радикал сам по себе (см. «Радикально-повышенная кислотность: почему бикарбонат, карбоксил, гидропероксил и родственные радикалы такие кислотные» на https://pubs.acs.org/doi/abs/10.1021/acs. jpca.7b08081? src=recsys&journalCode=jpcafh ).
jpca.7b08081? src=recsys&journalCode=jpcafh ).
Дигидрат хлорида меди(II) | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Название продукта: Дигидрат хлорида меди(II)
Номер продукта: Все применимые коды продуктов American Elements, например. CU2-CL-02-C.2HYD , CU2-CL-03-C.2HYD , CU2-CL-04-C.2HYD , CU2-CL-05-C.2HYD
Номер CAS: 10125-13-0
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи 502
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси в соответствии с 29 CFR 1910 (OSHA HCS)
GHS05 Коррозия
Skin Corr. 1B h414 Вызывает серьезные ожоги кожи и повреждения глаз.
1B h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Глазная травма. 1 ч418 Вызывает серьезное повреждение глаз.
GHS07
Острый токсикоз. 4 h402 Вреден при проглатывании.
Опасности, не классифицированные иначе
Данные отсутствуют
Элементы маркировки СГС
Элементы маркировки СГС, включая меры предосторожности
Пиктограммы опасности
GHS05 GHS07
Сигнальное слово: Опасно
Краткая характеристика опасности
h402 Вреден при проглатывании.
h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Меры предосторожности
P260 Не вдыхать пыль/дым/газ/туман/пары/аэрозоль.
P303+P361+P353 При попадании на кожу (или волосы): Немедленно снять всю загрязненную одежду. Промойте кожу водой/душем.
P305+P351+P338 ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промывать глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскать.
P301+P330+P331 ПРИ ПРОГЛАТЫВАНИИ: прополоскать рот. Не вызывает рвоту.
Не вызывает рвоту.
P405 Магазин заперт.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
Классификация WHMIS
D2B — Токсичный материал, вызывающий другие токсические эффекты
E — Коррозионный материал
Система классификации
Рейтинги HMIS (шкала 0-4)
(Система идентификации опасных материалов)
ЗДОРОВЬЕ
ПОЖАР
РЕАКТИВНОСТЬ
3 ) = 3
Воспламеняемость = 0
Физическая опасность = 1
Прочие опасности
Результаты оценки PBT и vPvB
PBT: N/A
vPvB: N/A
РАЗДЕЛ 3. СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
Вещества
Номер CAS / Название вещества:
10125-13-0 Дигидрат хлорида меди(II)
Идентификационный номер(а):
Номер ЕС: 231-210-2
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
0 Описание мер первой помощиОбщая информация
Немедленно снять одежду, испачканную продуктом.
При вдыхании:
Обеспечить пациента свежим воздухом.
 Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле. Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратиться за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как острые, так и замедленные
Вызывает сильные ожоги кожи.
Вызывает серьезное повреждение глаз.
Указание на необходимость немедленной медицинской помощи и специального лечения
Нет данных
РАЗДЕЛ 5. ПРОТИВОПОЖАРНЫЕ МЕРЫ
Средства пожаротушения
Подходящие средства пожаротушения
Продукт не воспламеняется. Используйте меры пожаротушения, подходящие для окружающего пожара.
Особые опасности, исходящие от вещества или смеси
Если этот продукт участвует в пожаре
, могут выделяться следующие вещества:
Хлористый водород (HCl)
Оксиды меди
Рекомендации для пожарных
Защитное снаряжение:
Носить автономный респиратор.
Наденьте полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и чрезвычайные меры
Использовать средства индивидуальной защиты. Держите незащищенных людей подальше.
Обеспечьте достаточную вентиляцию.
Меры предосторожности по охране окружающей среды:
Не допускайте попадания продукта в канализацию, канализационные системы или другие водоемы.
Методы и материалы для локализации и очистки:
Использовать нейтрализующий агент.
Утилизируйте загрязненный материал как отходы в соответствии с разделом 13.
Обеспечьте достаточную вентиляцию.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7.
 ОБРАЩЕНИЕ И ХРАНЕНИЕ
ОБРАЩЕНИЕ И ХРАНЕНИЕ Обращение
Меры предосторожности для безопасного обращения
Работать под сухим защитным газом.
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Обеспечить хорошую вентиляцию на рабочем месте.
Информация о защите от взрывов и пожаров:
Продукт не воспламеняется
Условия безопасного хранения, включая любые несовместимости
Требования, предъявляемые к складским помещениям и емкостям:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Хранить в защищенном от воздуха месте.
Хранить вдали от воды/влаги.
Хранить вдали от прочных оснований.
Хранить вдали от щелочных металлов.
Дополнительная информация об условиях хранения:
Хранить в сухом инертном газе.
Этот продукт гигроскопичен.
Этот продукт чувствителен к воздействию воздуха.
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в хорошо закрытых контейнерах.
Беречь от влаги и воды.
Конкретное конечное применение
Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем:
Правильно работающий химический вытяжной шкаф, предназначенный для опасных химических веществ и имеющий среднюю скорость потока при не менее 100 футов в минуту.
Параметры управления
Компоненты с предельными значениями, требующими контроля на рабочем месте:
Нет.
Дополнительная информация: Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и загрязненную одежду.
Мыть руки перед перерывами и по окончании работы.
Избегать попадания в глаза и на кожу.
Поддерживать эргономически подходящую рабочую среду.
Дыхательное оборудование:
При наличии высоких концентраций используйте подходящий респиратор.
Рекомендуемое фильтрующее устройство для краткосрочного использования:
Используйте респиратор с картриджами типа P100 (США) или P3 (EN 143) в качестве резерва средств технического контроля. Необходимо провести оценку риска, чтобы определить, подходят ли респираторы для очистки воздуха. Используйте только оборудование, проверенное и одобренное в соответствии с соответствующими государственными стандартами.
Защита рук: Непроницаемые перчатки
Осмотрите перчатки перед использованием. №
Выбор подходящих перчаток зависит не только от материала, но и от качества. Качество зависит от производителя.
Материал перчаток
Нитриловый каучук, NBR
Время проникновения материала перчаток (в минутах)
480
Толщина перчаток
0,11 мм
Защита глаз:
Плотно прилегающие очки
Полная защита лица
Защита тела:
Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физических и химических свойствах
Внешний вид:
Форма: Различные формы (порошок/чешуйки/кристаллы/гранулы и т.д.)
Цвет: Сине-зеленый
Запах: Без запаха
Порог восприятия запаха: Нет данных.
pH: нет данных
Точка плавления/диапазон плавления: 100 °C (212 °F) (разл.)
Точка/диапазон кипения: данные отсутствуют
Температура сублимации/начало: данные отсутствуют
Воспламеняемость (твердое вещество, газ) ): Данные недоступны.
Температура воспламенения: данные отсутствуют
Температура разложения: Данные отсутствуют.
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление пара: неприменимо
Плотность при 20 °C (68 °F): 2,51 г/см 3 (20,946 фунта/гал)
Относительный Плотность: Данные отсутствуют.
Плотность пара: н/д
Скорость испарения: н/д
Растворимость в воде / Смешиваемость с водой при 20 °C (68 °F): 1150 г/л
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация
Нет данных
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Нет данных
Химическая стабильность
Стабилен при рекомендуемых условиях хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
Опасные реакции неизвестны
Условия, которых следует избегать
Нет данных
Несовместимые материалы:
Воздух
Вода/влага
Основания
Щелочные металлы
Опасные продукты разложения:
Хлористый водород (HCl)
Оксиды меди
Сведения о токсикологических эффекты
Острая токсичность:
Вреден при проглатывании.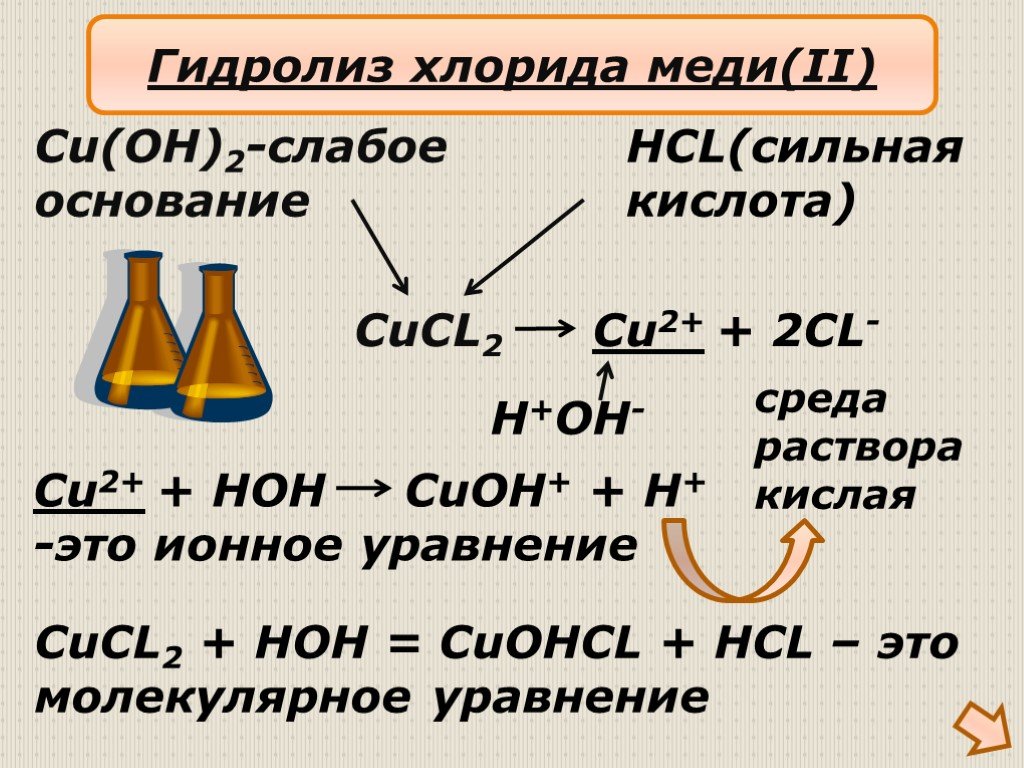
Проглатывание вызывает сильное разъедающее действие на рот и горло и опасность перфорации пищевода и желудка.
Реестр токсических эффектов химических веществ (RTECS) содержит данные об острой токсичности этого вещества.
Значения LD/LC50, важные для классификации: Нет данных
Раздражение или коррозия кожи: Вызывает сильные ожоги кожи.
Раздражение или коррозия глаз: Вызывает серьезное повреждение глаз.
Сенсибилизация: Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток: Эффекты неизвестны.
Канцерогенность:
EPA-D: Не классифицируется в отношении канцерогенности для человека: недостаточные доказательства канцерогенности для людей и животных или данные отсутствуют.
Репродуктивная токсичность: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — многократное воздействие: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — однократное воздействие: Эффекты неизвестны.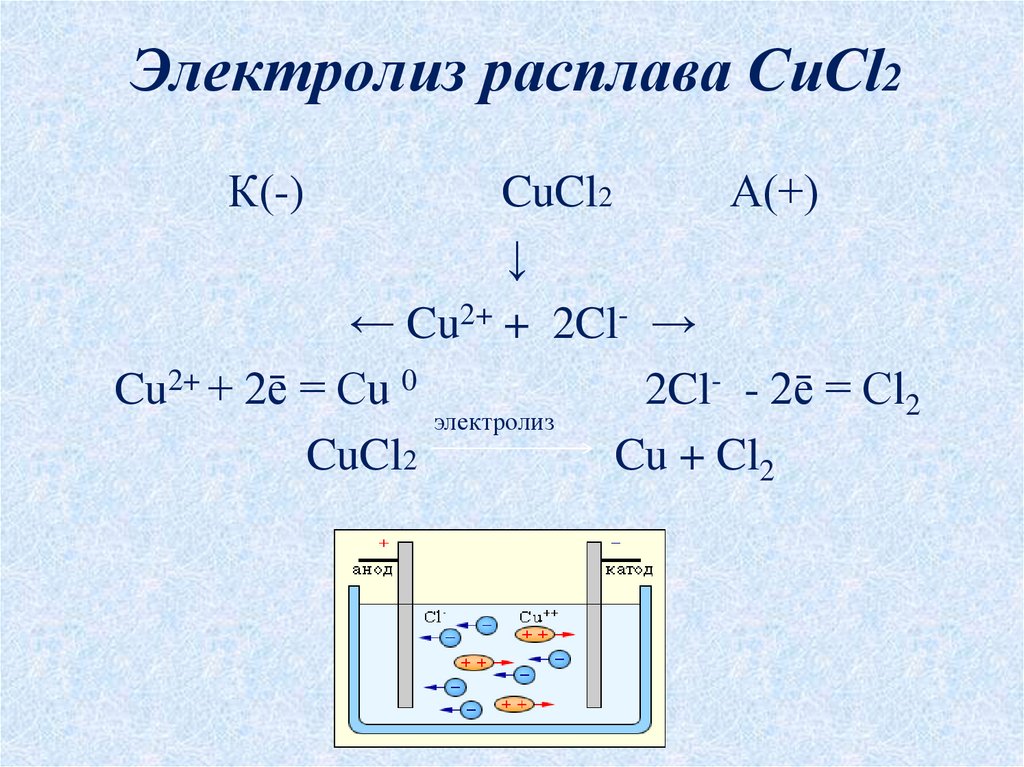
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности: Эффекты неизвестны.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Акватоксичность:
Нет данных
Стойкость и способность к разложению
Нет данных
Биоаккумулятивный потенциал
Нет данных
Мобильность в почве
Нет данных
Экотоксическое воздействие:
Примечание:
Очень токсично для водных организмов информация:
Не допускать попадания продукта в грунтовые воды, водоемы или канализационные системы.
Опасность для питьевой воды при попадании в землю даже небольшого количества.
Также ядовито для рыб и планктона в водоемах.
Может оказывать долговременное вредное воздействие на водные организмы.
Избегайте попадания в окружающую среду.
Очень токсичен для водных организмов
Результаты оценки PBT и vPvB
PBT: неприменимо
vPvB: неприменимо
Другие неблагоприятные воздействия
Данные отсутствуют официальные правила для обеспечения надлежащей утилизации.
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, IMDG, IATA
UN2802
Надлежащее отгрузочное наименование ООН
DOT
RQ Медь хлорид
IMDG
COPPER PHLOLIDE, MARINE90907 070 ХЛОРИД МЕДИ
Класс опасности при транспортировке( е)
DOT
Класс
8 Коррозионные вещества.
Этикетка
8
Класс
8 (C2) Коррозионные вещества
Этикетка
8
IMDG
Класс
8 Коррозионные вещества.
Этикетка
8
IATA
Класс
8 Коррозионные вещества.
Этикетка
8
Группа упаковки
DOT, IMDG, IATA
III
Опасность для окружающей среды:
Вещество твердое, опасное для окружающей среды; Загрязнитель моря
Загрязнитель моря (IMDG):
Да (PP)
Символ (рыба и дерево)
Особые меры предосторожности для пользователя
Предупреждение: Коррозионные вещества
Номер EMS:
F-A,S-B
Группы разделения
Кислоты
Транспортировка наливом в соответствии с Приложением II MARPOL73/78 и Кодексом IBC
N/A
Транспортировка/Дополнительная информация:
DOT
Опасное вещество:
10 фунтов, 4,54 кг
Загрязнитель морской среды (DOT):
Да ( PP)
Примечания:
Специальная маркировка символом (рыба и дерево).
ООН «Модельный регламент»:
UN2802, Хлорид меди, 8, III
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Правила/законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к данному веществу или смеси
СГС Элементы маркировки СГС, включая меры предосторожности
Пиктограммы опасности
GHS05
GHS07
Сигнальное слово: Опасно
Краткая характеристика опасности
h402 Вреден при проглатывании.
h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Меры предосторожности
P260 Не вдыхать пыль/дым/газ/туман/пары/аэрозоль.
P303+P361+P353 При попадании на кожу (или волосы): Немедленно снять всю загрязненную одежду. Промойте кожу водой/душем.
P305+P351+P338 ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промывать глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскать.
P301+P330+P331 ПРИ ПРОГЛАТЫВАНИИ: прополоскать рот. Не вызывает рвоту.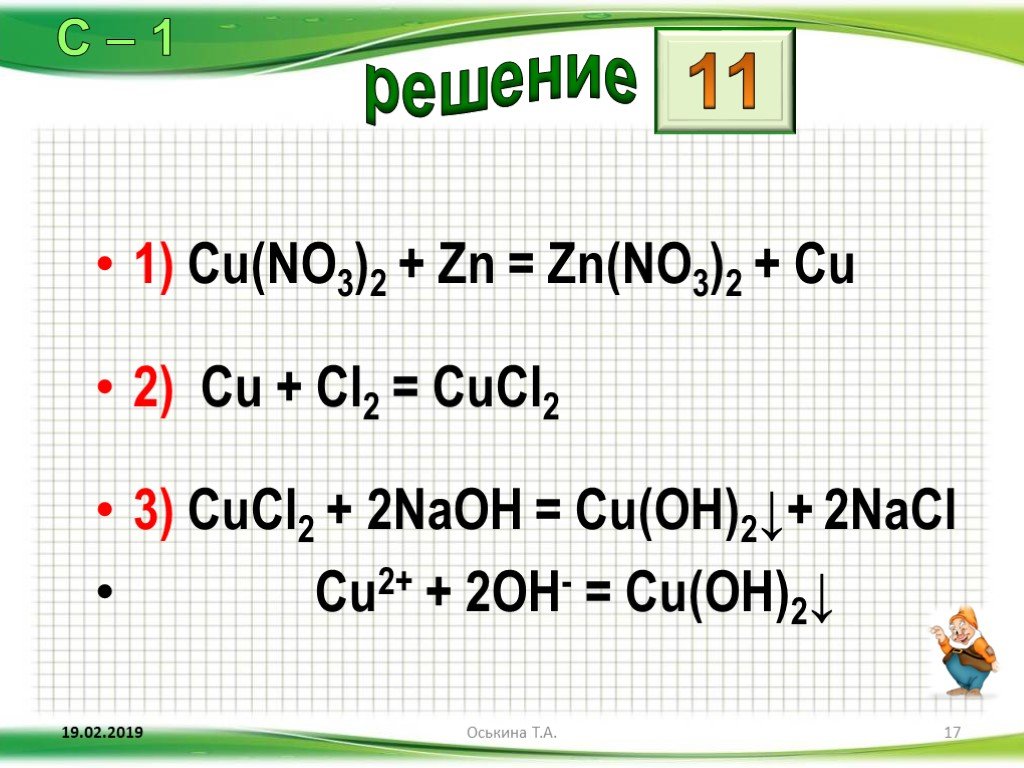
P405 Магазин заперт.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
Национальное законодательство
Все компоненты этого продукта перечислены в Перечне химических веществ
Закона о контроле за токсичными веществами Агентства по охране окружающей среды США. Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
SARA Раздел 313 (списки конкретных токсичных химических веществ)
10125-13-0 Дигидрат хлорида меди(II)
Предложение 65 штата Калифорния
Предложение 65 – Химические вещества, вызывающие рак
Вещество не указано.
Prop 65 — Токсичность для развития
Вещество не указано.
Prop 65 — Токсичность для развития, женщины
Вещество не указано.
Prop 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Прочие нормы, ограничения и запретительные нормы
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта.

Leave A Comment